СУЛЬФАТ АММОНИЯ
Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Физико-химические свойства
Сульфат аммония (Nh5)2S04 — бесцветные кристаллы ромбической формы с плотностью 1,769 г/см3. Технический сульфат аммония имеет серовато-желтоватый оттенок. При нагревании сульфат аммония разлагается с потерей аммиака, превращаясь в кислые соли. Давление Nh4 над сульфатом аммония равно при 205°
1 1 | — j | ||||||||||
—ia. os- | |||||||||||
К | |||||||||||
— — | |
О -20 -10 0 10 20 30 40 50 60 70 80 90 100 110 Температура ,°С |
Рис. 361. Растворимость (NH4)2S04 В воде. |
0,5 мм рт. ст., при 300° 50,8 мм рт. ст. К При 513° он полностью разлагается на Nh4 и h3S04. При растворении 1 г-экв соли в 1 л воды поглощается при 19,6° около 1 ккал тепла. При кристаллизации сУльфата аммония из раствора выделяется 2,6 кал/г-мол. Растворимость (Nh5)2S04 в воде показана на рис. 3612>3. В присутствии аммиака растворимость сульфата аммония значительно снижается. Температура кипения насыщенного водного раствора (Nh5)2SOi пРи 760 ммрт. ст. равна 108,9°.
Применение
Промышленное использование сульфата аммония весьма ограничено, — небольшие его количества потребляют в производств аккумуляторов и в медицине. Очень большие количества сульфат аммония применяют в сельском хозяйстве в качестве азотного удобрения. Оно содержит 20,5—21% азота (химически чисты* (Nh5)2S04 содержит 21,2% N).
Объем производства сульфата аммония в капиталистических странах составлял в 1960 г. приблизительно 30% от общего объема производства азотных удобрений (в пересчете’на азот). Мировое производство сульфата аммония в 1960 г. равнялось 15 млн. т. Особенно велика доля сульфата аммония в производстве азотных удобрений в Японии, Италии, Великобритании, США и Индии 4~15. В СССР доля сульфата аммония в общем балансе азотных удобрений (N) составляла в 1967 г. — 8,5%.
Сульфат аммония физиологически кислое удобрение. Для устранения его подкисляющего действия требуется вносить в почву в 1,7 раза больше СаС03, чем при пользовании аммиачной селитрой.
Высший | 1-й |
Сорт | Сорт |
(в %) | (В %) |
21,0 | 20,8 |
0,025 | 0,05 |
0,2 | 0,3 |
85 | 70 |
2-й сорт <в %) 20,8 0,05 0,3 Не нормируется |
Азот (иа сухое вещество), не менее. Свободная серная кислота, не более Влага, не более……………………………… Фракция более 0,25 мм, не менее. |
Сульфат аммония упаковывают в мешки и отгружают в крытых железнодорожных вагонах; допускается (по согласованию с потребителем) отгрузка навалом в крытых железнодорожных вагонах. Сульфат аммония аккумуляторный получают из синтетического аммиака и аккумуляторной серной кислоты. Его выпускают двух сортов и используют в производстве свинцовых аккумуляторов. Согласно ГОСТ 894—41, в обоих сортах должно содержаться (в пересчете на сухое вещество) не менее 99,05% (Nh5)2S04 и не |
По своим физическим свойствам сульфат аммония лучше аммиачной селитры, он не огнеопасен, меньше слеживается и обладает значительно меньшей гигроскопичностью. Равновесная относительная влажность воздуха над насыщенным раствором сульфата аммония при 30° равна 79,2% (для аммиачной селитры 59,4%) 1б_18- Сульфат аммония должен иметь крупнокристаллическую структуру и содержать наименьшее количество влаги и смолистых приме
19-32
Сульфат аммония (для удобрения), выпускаемый на коксохимических предприятиях, должен удовлетворять следующим требованиям (ГОСТ 9097—65):
более 0,3% кислоты (в пересчете на h3SO4). В продукте допускаются незначительные примеси хлоридов, железа, мышьяка и марганца. Продукт упаковывают в деревянные бочки.
Сульфат аммония очищенный, изготовленный из синтетического аммиака и серной кислоты, согласно ГОСТ 10873—64, должен содержать не менее 21% азота (в сухом веществе) и не более: 1% влаги, 0,15% свободной серной кислоты, 0,002% хлоридов, 0,015% Fe, 0,00005% As, 0,00005% Мп, 0,015% не растворимого в воде остатка, 0,001 % азотной и азотистой кислот, 0,005% роданидов (SCN), 0,0005% тяжелых металлов сероводородной группы (РЬ) и 0,02% фосфатов (Р04).
Производство сульфата аммония
Для производства сульфата аммония используют аммиак, получающийся как побочный продукт при сухой перегонке каменного угля в коксохимической и газовой промышленности, а также синтетический аммиак 33~48.
В СССР сульфат аммония-—удобрение производят только из аммиака, содержащегося в коксовом газе. Синтетический аммиак предпочитают перерабатывать в аммиачную селитру, являющуюся более концентрированным азотным удобрением, стоимость единицы азота в котором ниже, чем в сульфате аммония.
Основными промышленными способами производства сульфата аммония являются следующие 49~50:
поглощение серной кислотой аммиака, содержащегося в газе коксовых печей 51_61;
нейтрализация серной кислоты газообразным синтетическим аммиаком 62>63;
обработка гипса растворами карбоната аммония 64-74;
переработка растворов, являющихся отходом производства капролактама75~77.
Кроме этих основных широко применяемых способов, сульфат аммония может быть получен окислением сульфита аммония, образующегося из Nh4 и SO2 (стр. 534). Сульфит аммония окисляется под давлением 2—3 ат 82—98%-ным кислородом в сульфат аммония. Получаемый 40% раствор (Nh5)2S04 выпаривают и криСталлизуют.
Для производства 1 т сульфата аммония требуется 100—106 ж3 кислорода (100%) и 80—90 квт-ч электроэнергии78″82.
Разработан способ производства сульфата аммония из дымовых газов электростанций (и выхлопных газов сернокислотных заводов). Газообразный аммиак вводят в горячие дымовые газы между экономайзером и подогревателем воздуха. Аммиак связывает содержащиеся в газе окислы серы в сульфит, бисульфит, сульфат, тиосульфат аммония. Эти соли улавливают нз газоврго потока.
‘5 .4. Г. Г»! ин вместе с золой в электрофильтрах и после отделения золы перерабатывают в сульфат аммония 83~88.
В СССР в НИУИФ разработан способ, дающий возможность одновременно получать из природного сульфата натрия два ценных продукта — соду и сульфат аммония. Он основан на реакции: Na2S04 + 2С02 + 2NH3 + 2Н20 = 2NaHC03 + (NH4)2S04
Процесс аналогичен аммиачному способу получения соды из поваренной соли, с той лишь разницей, что здесь вместо хлорида аммония образуется сульфат аммония, который, после отделения ют кристаллов бикарбоната, извлекается из раствора путем его выпаривания и охлаждения. Использование сырья здесь значительно выше: натрий используется не на 60—70%, а на 95—97%; кроме того, отсутствуют отходы загрязненных растворов хлорида Кальция, получаемые при регенерации аммиака из хлорида аммония и сливаемые в «белые моря» 89-91.
— Разработаны способы получения сульфата аммония из отходов производства метилметакрилата 92, из кислого гудрона 93>94, из промывных вод от травления металлов94, из сточных вод96 и др.97.
Физико-химические основы получения сульфата аммония нейтрализацигй серной кислоты
Аммиаком
Сульфат аммшия получается по реакции
2Nh4(r.) + h3S04 = (Nh5)2S04 + 66,9 Ккал
Путем нейтрализации газообразного аммиака серной кислотой. При мокром способе производства продукт кристаллизуется из пересыщенных растворов, при сухом — осуществляется нейтрализация мелких брызг серной кислоты в газообразном аммиаке.
При насыщении аммиаком 75—78%-ной серной кислоты в реакционном аппарате выделяется значительное количество тепла, достаточное для нагрева реакционной смеси до температуры кипения и для испарения из нее значительного количества воды. Башенная серная кислота, часто применяемая в этом производстве, содержит сотые доли процента окислов азота в виде нитрозилсерной кислоты. В непрерывном производственном процессе башенную кислоту смешивают с реакционным раствором; при этом она разбавляется и нагревается за счет тепла гидратации и нейтрализации аммиаком. Вследствие этого происходит денитрация с выделением окислов азота в газовую фазу по реакции:
2SOsNH + Н20 = 2h3S04 + NO + N02
При больших масштабах производства сульфата аммония количество выделяющихся окислов азота велико, несмотря на незначительное содержание их в серной кислоте. Поэтому должны приниматься меры к тому, чтобы эти газы, вредно действующие на человеческий организм, не проникали в атмосферу цеха.
Наиболее целесообразно производить денитрацию серной кислоты до нейтрализации ее аммиаком, так как в противном случае некоторое количество аммиака теряется вследствие следующей реакции:
NO + N02 + 2Nh4 = 2N2 + 3h30
Обычно и осуществляют Цредварительную денитрацию башенной кислоты, разбавляя ее водой или маточным раствором сульфата аммония, причем концентрация кислоты, направляемой на нейтрализацию, снижается на 8—10%.
HjS04
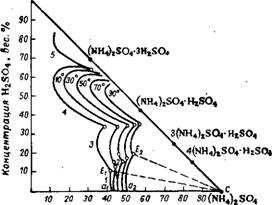
Концентрация (Nh5)j SO.,, вес. % Рис. 362. Изотермы растворимости в системе (Nh5)2S04—h3S04— Н20 при 10, 30, 50, 70 и 90°- |
Из примесей, находящихся в башенной серной кислоте (около 0,2%), наиболее вредное влияние в процессе получения сульфата аммония оказывают сульфаты железа и алюминия 98. При нейтрализации кислоты из этих солей образуются коллоидные гидроокиси железа и алюминия
(Fe, Al)2 (S04)3 + 6Nh4 + 6Н20 = 2 (Fe, Al) (ОН)3+ 3 (Nh5)2 S04
Обволакивающие кристаллы сульфата аммония и тормозящие их Рост. Устранение этого явления достигается путем неполной нейтрализации кислоты — в непрерывно действующих реакторах поддерживают кислую реакцию среды.
На рис. 362 изображены изотермы растворимости в системе (Nh5)2S04— h3SO4— Н20 99-10°. В этой системе в твердой фазе могут существовать различные кислые соли. Отдельные участки кривых соответствуют насыщению раствора: 1—(Nh5)2S04; 2 — 4(Nh5)2S04-h3S04; 3 — 3(Nh5)2S04-h3S04; 4 — (Nh5)2S04-h3S04; •5—(Nh5)2S04-3h3S04. Поле кристаллизации (Nh5)2S04 лежит в области систем, содержащих небольшие количества серной кислоты — A^Ic при 10° и а2Е2с при 90°. Во избежание выпадения кислых солей содержание h3S04 в жидкой фазе системы должно быть меньше, чем в точках Е, т. е. меньше 11,08% при 10° или 19,77% при 90°. Хотя в процессе нейтрализации реакционная масса имеет высокую температуру, но при последующем отделении кристаллов она охлаждается, поэтому при выборе состава реакционного раствора необходимо исходить из положения поля кристаллизации сульфата аммония при невысоких температурах. Практически кислотность раствора поддерживают на уровне 6—7% свободной h3S04, что исключает возможность кристаллизации кислых солей.
Кристаллы сульфата аммония, выделяющиеся из такого кислого раствора, сравнительно мелки, что несколько затрудняет их отфиль — тровывание и отмывку от маточного раствора. Для получения более крупных кристаллов содержание свободной кислоты в растворе должно было бы быть в пределах 9—15 г h3S04 в 1 л. При еще меньшей кислотности раствора опять получаются мелкие кристаллы21’101. Как при высокой, так и при очень незначительной кислотности раствора сульфат аммония образует пересыщенные растворы, что ведет к появлению мелких кристаллов. Указанная же кислотность соответствует условиям, при которых кристаллизация идет медленнее, а кристаллы получаются крупнее 102. Однако работа с такой кислотностью допустима лишь при незначительном содержании в растворе веществ, образующих коллоидные осадки 103.
Вредное влияние коллоидных осадков при кристаллизации из слабокислых растворов может быть устранено путем осаждения соединений железа и алюминия добавкой небольших количеств суперфосфата, фосфорной кислоты и других реагентов 26>28′ 29> 104>1®5.
Величина кристаллоз увеличивается также с возрастанием продолжительности их роста. В непрерывно действующих аппаратах интенсивное перемешивание кристаллической суспензии инертным тазами — воздухом или водяным паром — препятствует осаждени» кристаллов плотным слоем на дно аппарата, где их рост прекра щается. Замедление процесса кристаллизации достигается такж при двухступенчатой нейтрализации—в первой ступени получается кислый насыщенный раствор сульфата аммония, который после охлаждения донасыщается аммиаком во второй ступени. Равномернее распределение аммиака по всему объему нейтрализуемой массы обеспечивает равномерное распределение тепла и зарождающихся центров кристаллизации 10®> 107.
При отжиме образовавшихся кристаллов сульфата аммония на центрифугах в нем остается часть маточного раствора (до 1,5% влаги). При охлаждении соли продолжается ее кристаллизация из Оставшегося маточного раствора, что приводит к срастанию поверхностей отдельных кристаллов, и вся масса цементируется в сплошную глыбу. Во избежание этого после отжима от маточного раствора соль следует промывать на центрифуге водой. При промывке вода растворяет мелкие кристаллы, и масса становится более рыхлой. Иногда для уменьшения кислотности продукта его промывают аммиачной водой. Когда центрифугированию подвергается соль, имеющая щелочную реакцию, т. е. содержащая свободный аммиак, промывку лучше производить горячей водой, так как выделившиеся в этом случае гидроокиси железа и алюминия, забивающие поры между кристаллами, коагулируют в более крупный осадок и Промывка облегчается.
С целью улучшения физических свойств готового продукта и уменьшения слеживаемости его подвергают сушке 108′ 109. Сушку сульфата аммония проводят различными способами — на вибротранспортере и в барабанных сушилках. В последнее время в связи с повышенными требованиями к влажности продукта (влажность должна быть ^1%) сушку стали осуществлять в псевдоожи — женном слое110-116. Кроме того, испытана высокоэффективная сушка в вихревой камере, дающая продукт с влажностью 0,1— 0,6% «7, и в вертикальной трубе, в которой удается высушить продукт до содержания влаги 0,02—0,08% 118. Сушится сульфат аммония воздухом, предварительно нагретым паром до 110—130°.
Производство сульфата аммония из аммиака. коксового газа
Содержащийся в коксовом газе аммиак (7—10 г/ж3) можно перерабатывать в сульфат аммония тремя способами: косвенным, прямым и полупрямым 119-134.
Косвенный способ состоит в следующем: коксовый газ подвергают охлаждению в газовых холодильниках для выделения из него смолы и водяных паров. Оставшийся в газе аммиак поглощают водой в аммиачных скрубберах. Затем из аммиачной и надсмольной воды, образовавшейся вследствие расслоения смолы и сконденсировавшихся водяных паров, в дистилляционных колоннах отгоняют аммиак, который связывают серной кислотой с образованием сульфата аммония. Этот метод требует больших капиталовложений на сооружение аммиачных скрубберов, а также большого расхода электроэнергии воды и пара. Кроме того, он связан с большими потерями аммиака. Вследствие своей нерентабельности этот способ в СССР не применяется.
В прямом способе поглощение аммиака серной кислотой с образованием сульфата аммония производится непосредственно из горячего коксового газа, температура которого превышает температуру конденсации содержащихся в газе водяных паров.
Обычно температуру поддерживают на уровне 110°. Этот способ также не применяется в нашей промышленности из-за сложной технологии, а также потому, что не позволяет улавливать ценные пиридиновые основания.
Полупрямой способ как наиболее экономичный получил самое широкое применение в коксохимической промышленности. Сущность этого способа состоит в том, что вначале из коксового газа выделяют смолу и водяные пары путем его охлаждения. Образовавшаяся жидкая фаза расслаивается на два слоя: нижний — смолу и верхний — надсмольную воду, в которой частично растворен аммиак.
Надсмольную воду подвергают обработке для выделения из нее аммиака, который затем направляют на поглощение серной кислотой вместе с очищенным от смолы коксовым газом, содержащим оставшееся количество аммиака 16> 135-‘3?.
Для выделения из надсмольной воды аммиака ее подвергают дистилляции. При нагревании до 100° острым паром из нее выделяется растворенный аммиак и происходит разложение части аммонийных солей, образовавшихся при взаимодействии аммиака коксового газа с содержащимися в нем примесями — двуокисью углерода, сероводородом, серным и сернистым ангидридом, хлористым водородом, цианистыми соединениями и др. Такие аммонийные соли, как (Nh5)2C03, Nh5HC03, (Nh5)2S, легко разлагаются при нагревании с выделением аммиака. Для разложения остальных аммонийных солей надсмольную воду обрабатывают в дистилля — ционной колонне известковым молоком, например:
(NH4)2 S04 + Са (ОН)2 = 2NH3 + 2Н20 + CaS04 2NH4NCS + Са (ОН)2 = 2NH3 + 2Н20 + Са (NCS)2
Поглощение аммиака из коксового газа можно производить в сатураторах (сатураторный метод) или в скрубберах (бессатураторный метод) 138. До последнего времени переработку аммиака коксового газа в сульфат аммония производили в сатураторах, в которых совмещ
msd.com.ua
Сульфат аммония
Упаковка и применение
Применение:
Особенности применения сульфата аммония
- В сельском хозяйстве в качестве азотного удобрения. Также содержит сульфатную серу, необходимую всем видам растений.
- В производстве вискозного волокна.
- В биохимии для переосаждения белка
- в пищевой промышленности в качестве пищевой добавки E517 — улучшитель муки и хлеба, стабилизатор. Используется для питания дрожжей. Добавки сульфата аммония в количестве 0,01-0,02% от массы муки вызывают увеличение объёма хлеба, улучшение структурно-ме-ханических свойств мякиша и повышение формоудерживающей способности подовых изделий
- Используется в технологии хлорирования воды с аммонизацией, вводится в обрабатываемую воду за несколько секунд до хлора, с хлором образует хлораммины — связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водовод. Так же используется в получении марганца электролизом.
- а также в кожевенно-обувной, текстильной, электротехнической, химической промышленности.
Преимущества сульфата аммония перед аммиачной селитрой и карбамидом
1. Сульфат аммония — всегда дешевле!
Экономика неумолима, поэтому экономичность удобрений в занчительной мере определяется стоимостью единицы действующего вещества. По расчетам стоимость 1 тонны азота в сульфате аммония примерно в 2 раза ниже, чем в аммиачной селитре и карбамиде. При оценке экономической эффективности можно учесть наличие серы в сульфате аммония.
2.Сера оказывает влияние на качество урожая.
Сера занимает одно из ведущих мест среди биогенных элементов после азота, фосфора и калия. Положительное влияние на урожай часто остается не замеченным, поскольку она воздействует не на величину, а на качество продукции. Кроме того, внешнее проявление серного голодания растений почти полностью совпадает с признаками недостаточного азотного питания.
В условиях недостатка в почве серы снижается синтез белков, жиров, витаминов, а азот, что очень опасно, накапливается в виде нитратов. Помимо всего ухудшается хранение продектов.
В последние годы наблюдается тенденция снижения содержания серы в почвах во многих регионах России, около 80% пашни бедны серой.
Таким образом, сульфат аммония можно считать удобрением с содержанием питательных веществ 45%.
3.Сульфат аммония по эффективности не уступает другим азотным удобрениям.
По многочисленным данным Географической сети опытов с удобрениями сульфат аммония по эффективности не уступает распространенным азотным удобрениям, таким как аммиачная селитра и карбамид. При сравненительных испытаниях эффективности воздействия различных видов азотных удобрений на величину и качество урожая зерновых, картофеля, масличных отмечено следующее: все удобрения эффективны — при внесении в равных дозах по азоту (60кг в д.в.) особенно хорошие результаты обеспечивает внесение сульфата аммония под зерновые, рапс, рис, картофель, подсолнечник, свеклу, овощные культуры, арбузы, подкормку многолетних трав и в поджнивные остатки.
4.Меньше потери азота и лучше экология.
Известно, что при использовании азотных удобрений в сельсклм хозяйстве, особенно при несбалансированном соотношении питательных элементов, возникают экологические проблемы. К основным из них следует отнести занитрачивание продукции, загрязнение поземных и поверхностных вод, а самое главное — потери азота до 20-30% из нитратных удобрений и карбамида вследствие денитрификации и вымывании. Потери азота из нитратных удобрений больше, чем из аммиачных. Если при поверхностном внесении сульфата аммония потери аммиака составляют, как правило, не более 1-3%, то у карбамида и аммиачной селитры 25-30% от внесенного количества азота.
Важно также то, что этот элемент питания в сульфате аммония находится в наиболее доступной форме для растений и участвует в формировании урожая на протяжении всего вегетационного периода.
5.Утилизация соломы.
Один из эффективных методов применения сульфата аммония — это внесение его с пожнивными остатками (измельченной соломой). При этом доза азота составляет 10 кг.д.в. на 1 тонну соломы, что обеспечивает ускореное разложение клетчатки. Таким образом, одновреммено решаются проблемы утилизации соломы, улучшения ее удобрительных свойств и охраны окружающей среды.
При урожае зерновых 20-30ц/га внесение сульфата аммония совместно с пожнивными остатками в почву будет обспечивать возвращение 30-40кг.азота, 50-80 кг. фосфора, 18-24.калия, а также 35-45кг. серыв, способствующей повышению белка в продукции.
Упаковка и хранение: мешки 25 кг с полиэтиленовым вкладышем
Сульфат аммония хранят в крытых складских помещениях вдали от прямых солнечных лучей и влаги.
veleshem.ru
Сульфат аммония (сернокислый аммоний) | справочник Пестициды.ru
Физические и химические свойства
Сульфат аммония (NH4)2SO4 – бесцветные кристаллы, плотность – 1,766 г/см3. При температуре выше +100°C разлагается с выделением аммиака NH3и образованием сначала NH4HSO4, а впоследствии (NH4)2S2O7 и сульфаниловой кислоты.
Растворимость в воде: при 0°C – 70,5 г/100 г, при +25°C – 76,4 г/100 г, при +100°C – 101,7 г/100 г. Окисляется до N2 под действием сильных окислителей, например, марганцевокислого калия KMnO4.[8]
Сульфат аммония содержит:
- азота по массовой доле в пересчете на сухое вещество – не менее 21 %;
- воды – 0,2 %;
- серной кислоты – не более 0,03 %.
Фракционный состав удобрения:
- массовая доля фракции размером более 0,5 мм – не менее 80 %;
- менее 6 мм – 100 %.
Рассыпчатость – 100 %.
Массовая доля остатка, не растворимого в воде, не превышает 0,02 %.[3]
Применение
Сельское хозяйство
Сульфат аммония в сельском хозяйстве используют как основное удобрение под различные культуры.[8]
Промышленность
Сульфат аммония в химической промышленности используют как компонент осадительной ванны при формировании вискозного волокна. В стекольной промышленности – в качестве добавки к стекольной шихте для улучшения ее плавкости.[8]
Схема реакцииСхема реакции
Схема реакции обменных процессов между сульфатами аммония и катионами почвенного поглощающего комплекса (ППК), согласно:[9]
Поведение в почве
При внесении в почву сульфат аммония быстро растворяется, и значительная часть катионов NH4+ входит в почвенно-поглощающий комплекс. Одновременно в почвенный раствор переходит эквивалентное количество вытесненных катионов. При этом ион аммония теряет подвижность. Это устраняет опасность его вымывания при промывном режиме почв.
Находясь в обменно-поглощенном состоянии, ионы аммония хорошо усваиваются растениями. (Изображение)
Вследствие нитрификации аммонийный азот переходит в нитратную форму. Скорость перехода аммонийного азота в нитратный зависит от необходимых для нитрификации условий: температуры, аэрации, влажности, биологической активности и реакции почвы. Одним из основных факторов, влияющим на скорость нитрификации, является степень окультуренности почв.
Переувлажнение и повышенная кислотность почв тормозят нитрификацию. Известкование кислых почв значительно ускоряет этот процесс. После превращения аммонийного азота в нитратный он приобретает все свойства нитратных удобрений. В результате процесса нитрификации в почве образуется азотная кислота и освобождается серная кислота.
(NH4)2SO4 + 4O2 → 2HNO3 + H2SO4 + 2H2O
В почве эти кислоты нейтрализуются, вступая во взаимодействие с бикарбонатами почвенного раствора и катионами почвенного поглощающего комплекса.
Нейтрализация минеральных кислот сопровождается использованием бикарбонатов почвенного раствора и вытеснением оснований из ППК водородом. Это ослабляет буферную способность почв и повышает их кислотность.
Однократное внесение сульфата аммония может и не повлиять на реакцию почвы. При систематическом использовании данного удобрения почвенная среда может значительно подкислиться. Степень подкисления увеличивается при меньшей буферной способности почв.[9]
Применение на различных типах почв
Сульфат аммония при длительном использовании оказывает на почву окисляющее действие.
окисляющее действие этого удобрения проявляется уже через несколько лет. Для регулирования реакции почвы и усиления действия удобрения рекомендуется проводить известкование либо нейтрализовать сульфат аммония до внесения в почву. Для этого на 1 ц удобрения добавляют 1,3 ц извести.[5] кислотность почв повышается спустя 10–15 лет. Однако на урожайности подкисливание черноземов практически не сказывается, поскольку эти типы почв обладают высоким содержанием гумуса, большой буферностью и емкостью поглощения.[5] и сероземах оснований опасаться подкисления карбонатных почв нет.[5]в районах достаточного увлажнениясульфат аммония наиболее эффективен вследствие слабой миграции аммония.[5]Способы внесения
Сульфат аммония более всего подходит для основного внесения. Но допустимо и применение для поверхностных подкормок озимых зерновых культур, сенокосов и пастбищ,[1] а также фертигации.[7]
Сроки внесения и способы заделки основного удобрения определяются свойствами почвы и климатическими условиями зоны.[6]
Влияние на сельскохозяйственные культуры
Сульфат аммония обеспечивает сельскохозяйственные растения азотом на весь вегетационный период и положительно влияет на их рост, развитие и урожайность.
на подкисляющее действие сульфата аммония реагируют слабо.[5] на подкисляющее действие удобрения реагируют сильно.[5]. Применение сульфата аммония особенно эффективно, поскольку они положительно отзываются на серу.[5] – лучшая форма азотных удобрений, посколькупри использовании сульфата аммония в клубнях накапливается гораздо меньше нитратов по сравнению с другими формами азотных удобрений.[1]Получение
Сульфат аммония получают двумя способами:
- путем нейтрализации серной кислоты аммиаком;[6]
H2SO4 + 2NH3 → (NH4)2SO4
- из природных минералов (гипса, мирабилита, фосфогипсом) путем их измельчения и взаимодействия с аммиаком и углекислотой.[5]
При написании статьи, также использовались следующие источники:[4]
www.pesticidy.ru
Аммоний сульфат
Аммоний сульфат ГОСТ 3769-78
(NH4)2SO4
Сульфат аммония (аммоний сернокислый, лат. ammonium sulphate), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Физические свойства
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в мелко измельченном виде — белый порошок[1]. Запаха не имеет. Гигроскопичность невысокая.
Сингония орторомбическая, а = 0,7782 нм, b = 5993 нм, с = 1,0636 нм.
Плотность (при 20 °C) — 1,766 г/см3[1].
Растворимость в воде (г/100 мл)[2]:
- 70,1 (0 °C)
- 72,7 (10 °C)
- 75,4 (20 °C)
- 76,9 (25 °C)
- 78,1 (30 °C)
- 81,2 (40 °C)
- 84,3 (50 °C)
- 87,4 (60 °C)
- 94,1 (80 °C)
- 102 (100 °C).
Растворимость в других растворителях (г/100 г):
- муравьиная кислота 95 %: 25,4 (16,5 °C)
- ацетон: нерастворим
- этанол: нерастворим
- диэтиловый эфир: нерастворим.
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора[1].
Химические свойства
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
-
- {\displaystyle {\mathsf {(NH_{4})_{2}SO_{4}\rightarrow NH_{4}HSO_{4}+NH_{3}\uparrow }}}.
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
-
- {\displaystyle {\mathsf {NH_{4}HSO_{4}\ {\xrightarrow {>500^{o}C}}\ NH_{3}+SO_{3}+H_{2}O}}}.
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.
Очистка
Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину[3], для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа(II) в железо(III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата(III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO3--групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
Также используется в производстве вискозного волокна.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того находит применение при получении марганца электролизом.
Воздействие на человека
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки Е517. В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.
himmax.ru
Сульфат аммония (аммоний сернокислый)
Новосибирск: +7(383) 3-34-34-34,
8 (800) 200-11-66,
Иркутск: +7 (3952) 475732
Описание:
Сульфат аммония — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха.
Сульфат аммония (аммоний сернокислый) ГОСТ 9097-82
Применение:
Сульфат аммония (аммоний сернокислый) предназначается для различных отраслей промышленности, а также для сельского хозяйства (азотно-фосфорная группа удобрений, таких как аммофос и суперфосфат) и розничной торговли.
Технические характеристики:
| 1. Внешний вид | Белые или прозрачные кристаллы |
| 2. Массовая доля азота в пересчете на сухое вещество, %, не менее |
21 |
| 3. Массовая доля воды, %, не более | 0,2 |
| 4. Массовая доля свободной серной кислоты, %, не более | 0,03 |
| 5. Фракционный состав: массовая доля фракции размером более 0,5 мм, %, не менее менее 6 мм, % |
80 |
| 5. Рассыпчатость, % | 100 |
| 6. Массовая доля нерастворимого в воде остатка, %, не более | 0,02 |
Упаковка:
Сульфат аммония (аммоний сернокислый) упаковывают в четырех — шестислойные бумажные мешки или полиэтиленовые мешки.
Хранение:
Сульфат аммония хранят в закрытых складских помещениях, защищающих продукт от попадания влаги. Гарантийный срок хранения продукта — 12 месяцев.
Сульфат аммония (аммоний сернокислый) ГОСТ 9097-82 реализует компания «Логосиб».
Сульфат аммония по ТУ 113-03-625-90
Применение:
Сульфат аммония — побочный продукт предназначается для различных отраслей промышленности, а также для сельского хозяйства и розничной торговли.
Технические характеристики:
Сульфат аммония ТУ 113-03-625-90 |
Сульфат аммония марки А | Сульфат аммония марки Б | Сульфат аммония марки В |
| 1.Внешний вид | Кристаллы прозрачные или слабоокрашенные | ||
| 2.Массовая доля азота в пересчете на сухое вещество, %, не менее | 21 | 21 | 21 |
| 3.Массовая доля воды, %, не более | 0.3 | 0.3 | 0.3 |
| 4.Массовая доля свободной серной кислоты, %, не более | 0.05 | 0.05 | 0.05 |
| 5.Массовая доля нерастворимых примесей, %, не более | 0.02 | 0.04 | 0.05 |
| 6.Рассыпчатость, % | 100 | 100 | 100 |
Упаковка:
Сульфат аммония упаковывают в четырех-, пяти-, шестислойные бумажные мешки или полиэтиленовые мешки.
Хранение:
Сульфат аммония хранят в закрытых складских помещениях, защищающих продукт от попадания влаги. Гарантийный срок хранения продукта — 12 месяцев.
Транспортировка:
Сульфат аммония (аммоний сернокислый) перевозят насыпью и в упакованном виде.
Техника безопасности:
Сульфат аммония является негорючим веществом.
Сульфат аммония ТУ 113-03-625-90 реализует компания «Логосиб».
Цены:
Несмотря на изначально низкие цены, мы делаем скидки в зависимости от объема закупаемого товара.
Качество:
Мы работаем непосредственно с производителями, поэтому обеспечиваем наших клиентов товарами высокого качества.
Оформление и отгрузка:
Благодаря отлаженной работе офиса и складов, мы предоставляем быстрое оформление и отгрузку товаров.
Доставка:
Мы предлагаем доставку товаров по России:
•автотранспортом;
•железнодорожными контейнерами, вагонами;
•через транспортные компании.
Для получения подробной информации о ценах на сульфат аммония и условиях поставки звоните нашим специалистам по телефонам:
+7 (383) 3-34-34-34 и 8-800-200-11-66 (бесплатный звонок по России).
www.logosib.ru
Сульфат аммония | Baltic-Terra
ТУ 113-03-625-90
Сульфат аммония ((Nh5)2SO4) — средняя соль серной кислоты, содержит до 21 % азота и до 24 % серы, представляет собой белые прозрачные кристаллы, молекулярная масса равна 132,15. В зависимости от типа производства выпускается трех марок:
- Марка А — побочный продукт производства капролактама.
- Марка Б — побочный продукт акрилатных производств.
- Марка В — побочный продукт коксохимических производств.
Получение сульфата аммония марки В основано на реакции нейтрализации аммиаком серной кислоты. Аммиак содержится в коксовом газе, выделяющемся при коксовании каменных углей. Кристаллический слабоокрашенный продукт. Содержащееся небольшое количество серной кислоты придаëт удобрению слабокислую реакцию. Запаха не имеет.
Основные технические характеристики
| № п/п | Наименование показателей | |
1 | Внешний вид | Белые или прозрачные кристаллы |
2 | Массовая доля азота в пересчете на сухое вещество, % не менее | 21 |
3 | Массовая доля воды, % не более | 0,2 |
4 | Массовая доля свободной серной кислоты, % не более | 0,03 |
5 | Фракционный состав: Массовая доля фракции размером более 0,5 мм, %, не менее | 80 |
| менее 6 мм, % | 100 | |
6 | Рассыпчатость, % | 100 |
7 | Массовая доля нерастворимого в воде остатка, %, не более | 0,02 |
Сульфат аммония вносится в почву в качестве удобрения. Внесение осуществляется в различных почвенно-климатических зонах. Степень опасности продукта в целом — умеренно опасное вещество по степени воздействия на организм — 3 класс опасности.
| Компонент | Массовая доля, | ПДКрз мг/м3 | Класс опасности |
| сернокислый аммоний | 99% [18] | 10 | 3 |
| свободная серная кислота | 0,03 — 0,05% [23, 24] | 1 | 2 |
| бисульфат аммония | менее 1% [15] | не установлены | |
| сульфат пиридина | менее 1% [15] | не установлены | |
В сернокислом аммонии могут присутствовать: [25] | |||
| ртуть | не более 2,0 мг/кг | 0,01/0,005 | 1 |
| кадмий | не более 0,5 мг/кг | 0,05/0,01 | 1 |
| кобальт | не более 5,0 мг/кг | 0,05/0,01 | 1 |
| мышьяк | не более 2,0 мг/кг | 0,04/0,01 | 1 |
| никель | не более 4,0 мг/кг | 0,05 | 1 |
| свинец | нет более 32 мг/кг | 0,01/0,005 | 1 |
| медь | не более 33 мг/кг | 1/0,5 | 2 |
| цинк | не более 55 мг/кг | не установлены | |
| хром | не более 2 мг/кг | не установлены | |
| марганец | не более 1500 мг/кг | не установлены | |
Рекомендации по применению
Сульфат аммония является одним из наиболее распространенных азотных удобрений. Он быстро растворяется в почвенной влаге, причем большая часть ионов NH4 + связывается почвой. Это обуславливает малую подвижность ионов аммония в почве и затрудняет вымывание их водой.
Растения усваивают катион NH4 + сульфата аммония гораздо интенсивнее, чем анион SO4 — так как азот требуется растениям для образования белков в значительно большем количестве, чем сера. Этот процесс сопровождается разрушением содержащихся в почве соединений основного характера, что приводит к повышению еë кислотности, особенно заметному при длительном применении сульфата аммония на одних и тех же участках. Таким образом, сульфат аммония является типичным представителем физиологически кислых удобрений.
Физиологическая кислотность сульфата аммония практически не снижает его эффективности при внесении в некислые почвы (черноземы, сероземы, каштановые, известковые каштановые почвы), содержащие достаточное количество кальция. Продолжительное же внесение сульфата аммония в почвы, бедные кальцием (кислые подзолистые почвы), может привести к понижению урожайности сельскохозяйственных культур вследствие закисления почвы. Поэтому при длительном применении сульфата аммония периодически проводится известкование почвы, т.е. внесение в нее тонко измельченных материалов, содержащих карбонаты Ca и Mg (известняк, мел, мергель, доломит), или же — негашеной и гашеной извести и др.
Сульфат аммония является весьма эффективным азотным удобрением под озимую рожь, овес, картофель и особенно под чай и рис. Ценным свойством сульфата аммония является его малая слеживаемость; даже после длительного хранения он легко рассыпается и рассеивается туковой сеялкой. Кроме того, сульфат аммония мало гигроскопичен, что также облегчает условия его хранения, перевозки и применения.
Оптимальная доза внесения составляет 330 кг сульфата аммония на гектар. Сульфат аммония вносится весной.
baltic-terra.ru
| Продукция | Синонимы | CAS № | ГОСТ | Марка/сорт | Упаковка/вес |
| Аммоний хлористый технический | хлорид аммония, нашатырь | 12125-02-9 | 2210-73, импорт | Мешок 25 кг, 35 кг | |
| Бифторид фторид аммония | аммоний фтористый, кислый гидрофторид аммония, фторид аммония кислый, кислая соль аммония, фтористоводородная кислота | 1341-49-7 | импорт | Мешок 25 кг | |
| Бихромат натрия | натрия двухромовокислый, хромпик натриевый | 10588-01-9 | 2651-78 | Мешок 25 кг | |
| Диаммонийфосфат пищевой | гидрофосфат аммония, диаммофос, аммоний фосфорнокислый двузамещенный, ДАФ | 7783-28-0 | 2148-673-00209438-02 | Мешок 25 кг | |
| Калий азотнокислый технический | селитра калиевая, нитрат калия, калиевая соль азотной кислоты | 7757-79-1 | P 53949-2010 | Б | Мешок 50 кг |
| Калий сернокислый | сульфат калия, дикалий сульфат, агрохимикат калий сернокислый очищенный, арканит | 7778-80-5 | 48-0114-66-91, 2184-093-43399406-2001 | Мешок 40 кг | |
| Калий хлористый | хлорид калия, калийная соль, калий хлорид | 7778-54-3 | 4568-95, РБ 600122610.010-2002 | первый | МКР 850 кг, Мешок 50 кг |
| Кальций азотнокислый 4-водный | селитра кальциевая, нитрат кальция | 13477-34-4 | 2181-039-32496445-2004 | Мешок 20 кг | |
| Карбамид | мочевина, диамид угольной кислоты | 57-13-6 | 2081 — 2010 | марка А, первый, Б сорт высший | Мешок 50 кг |
| Кислота лимонная моногидрат пищевая (E330) | гидрат лимонной кислоты, антиоксидант E330, 2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая кислота, добавка Е330 | 5949-29-1 | 908-2004 | пищевая | Мешок 25 кг |
| Медный купорос | сульфат меди, меди (II) сульфат 5-ти водный, медь сульфат пентагидрат | 7758-99-8 | 19347-99 | Мешок 25 кг | |
| Натрий азотнокислый технический | селитра натриевая, нитрат натрия, чилийская селитра, натриевая соль азотной кислоты | 7631-99-4 | 828-77 | Б | Мешок 50 кг |
| Натрий фтористый технический | натрия фторид | 7681-49-4 | импорт | Мешок 25 — 40кг | |
| Натрия сульфат природный | натрий сернокислый, натриевая соль серной кислоты | 7757-82-6 | 2141-084-56238216-2010 | Мешок 50 кг | |
| Натрия сульфат технический | натрий сернокислый, натриевая соль серной кислоты | 7757-82-6 | 6318-77 | А, высший | МКР, мешки |
| Сода кальцинированная техническая | натрий углекислый, карбонат натрия, динатрий карбонат | 497-19-8 | 5100-85 | А, Б | Мешок 25 кг, 50 кг, МКР 600 кг, 800 кг, 1250 кг |
| Сульфаминовая кислота | амидосульфоновая кислота, моноамид серной кислоты, амидосерная кислота | 5329-14-6 | импорт | Мешок 25 кг | |
| Триполифосфат натрия технический | натрия триполифосфат | 7758-29-4 | 13493-86 | технический | Мешок 45 кг |
| Цинк сернокислый технический 7-водный | сульфат цинка семиводный, цинковый купорос | 7446-20-0 | импорт | Мешок 25 кг | |
| Цинк сернокислый технический моногидрат | сульфат цинка моногидрат, цинковый купорос | 7446-19-7 | импорт | Мешок 25 кг | |
| Щавелевая кислота | этандиовая кислота дигидрат, кислота щавелевая дигидрат | 6153-56-6, 144-62-7 | импорт | Мешок 25 кг |
www.chempack.ru