Сульфат алюминия
Сульфат алюминия технический очищенный имеет химическую формулу Al2(SO4)3•18h3O. На сегодняшний день это химическое вещество является одним из наиболее доступных, популярных эффективных коагулянтов, применяемых при очистке воды как в России, так и за рубежом. Делится на три вида: высший сорт, первый и второй. Каждый из них имеет определенные особенности. Например, высший – порошок с однородной консистенцией, а более низкий сорт продают брикетами или же большими пластинами. Далее, мы более подробно расскажем о каждом из них.
Сульфат алюминия по большей части безвреден для организма человека. Но работа с ним требует применения защитных
средств (перчатки, очки, респиратор), а также при строгое соблюдение всех техник безопасности работы с
химическими реагентами. Al2(SO4)3 – это пожаро-взрывобезопасное вещество, но в то же время может оказывать
малотоксичное воздействие. При симптомах отравления, не следует медлить с оказанием первой помощи и вызовом
врача.
Виды и характеристики сульфата алюминия:
- Высший сорт представлен в виде однородной кристаллической сыпучей смеси кристаллов, преимущественно, белого цвета, фракцией размером до 0,2 см, редко встречаются с бледным оттенком других цветов.
- Первый сорт можно купить в виде не слеживающихся кусков, плиток и пластин, которые могут весить до 10 кг, и иметь белый цвет. Допускается наличие других цветовых оттенков (серый голубой, розовый).
- торой по внешнему виду практически не отличается от предыдущего, таких же цветов и размеров.
Применение и использование:
- очистка воды хозяйственного и питьевого назначения;
- очистка промышленных вод тепловых станций и их котелен;
- покраска тканей в легкой промышленности, в частности текстильной;
- как гидроизолятор в строительстве: образование бетона с использованием данного вещества происходит намного быстрее;
- в сельском хозяйстве как удобрение для овощей и садовых деревьев, также при борьбе с вредителями;
- входит в состав бытовой химии, которой мы пользуемся ежедневно;
- является составляющей медицинских препаратов, которые применяют при укусах вредителей.

Упаковка: Специализированные мягкие контейнеры типа биг-бег весом до 800 кг, мешки полипропиленовые по 50 кг,25 кг
Транспортировка: Железнодорожным или автомобильным транспортом, навалом или в таре.
Вернуться в каталог
Заказ продукции
Сульфат алюминия, химические свойства, получение
1
H
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t° пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,9064d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ФАС России | Отмена ввозной таможенной пошлины позволит снизить цену на сульфат алюминия
Отмена ввозной таможенной пошлины позволит снизить цену на сульфат алюминия
9 апреля 2015 года в ФАС России под председательством заместителя руководителя ФАС России Андрея Цыганова состоялось заседание Рабочей группы Экспертного совета ФАС России по химической промышленности, на которой обсуждался вопрос повышения цен на сульфат алюминия, широко используемый в качестве коагулянта в процессе очистки воды хозяйственно-питьевого и промышленного назначения.
В заседании Рабочей группы приняли участие представители компаний-производителей сульфата алюминия, а также представители региональных водоканалов, являющихся основными потребителями сульфата алюминия.
По сообщению Сергея Вершинина, заместителя начальника Управления контроля химической промышленности и АПК в ФАС России обратилось двенадцать водоподготовительных организаций с заявлениями о росте цен на используемый ими коагулянт (сульфат алюминия).
«Предварительный анализ ситуации на рынке сульфата алюминия показал, что рост цен на данный продукт связан с повышением стоимости сырья для его производства – гидроксид алюминия, являющийся также промежуточным продуктом при производстве алюминия, цена на который на внутреннем рынке формируется исходя из котировок Лондонской биржи цветных металлов. При этом используется как импортный гидроксид алюминия, так и продукт, поставляемый группой компаний РУСАЛ. Кроме того на рост себестоимости производства сульфата алюминия дополнительно повлияло снижение спроса со стороны водоканалов, которые сократили объем закупок коагулянта, а также увеличение тарифов на услуги естественных монополий», — рассказал Сергей Вершинин.
«Сложившаяся ситуация негативно отражается на экономике предприятий, занимающихся водоподготовкой, нарушая, в том числе, их инвестиционные программы, направленные на развитие коммунального водоснабжения», — добавил Сергей Вершинин.
В ходе совещания обсуждались пути выхода из сложившейся ситуации. По мнению антимонопольной службы, снижению цены на сульфат алюминия будет способствовать отмена ввозной таможенной пошлины на основное сырье для его производства. Кроме того, по результатам анализа рынка гидроксида алюминия будет рассмотрена возможность предоставления РУСАЛ скидки на данный продукт. Также производителями сульфата алюминия было предложено водоканалам пересмотреть свою закупочную политику, в частности перейти от годовых контрактов к поквартальным закупкам, что позволит участникам рынка сократить свои затраты на участие в тендерах на закупку сульфата алюминия.
По мнению антимонопольной службы, снижению цены на сульфат алюминия будет способствовать отмена ввозной таможенной пошлины на основное сырье для его производства. Кроме того, по результатам анализа рынка гидроксида алюминия будет рассмотрена возможность предоставления РУСАЛ скидки на данный продукт. Также производителями сульфата алюминия было предложено водоканалам пересмотреть свою закупочную политику, в частности перейти от годовых контрактов к поквартальным закупкам, что позволит участникам рынка сократить свои затраты на участие в тендерах на закупку сульфата алюминия.
Гидроксохлорид алюминия марки Б (ГХА), сульфат алюминия, цена. Коагулянты производства АО Сорбент
Общая информация по разделу:
Коагулянты (Гидроксохлорид алюминия марки Б, сульфат алюминия)
Коагулянты — коагулирующие агенты (от лат. coagulo — вызываю свертывание, сгущение), вещества, введение которых в жидкую среду, содержащую мелкие частицы какие-либо тела, вызывает коагуляцию, т. е. слипание этих частиц.
е. слипание этих частиц.
Под действием коагулянтов образуются крупные скопления слипшихся частиц, выпадающие в виде хлопьев или комков в осадок (коагулят). Эффективными коагулянтами для систем с водной дисперсионной средой являются соли поливалентных металлов (алюминия, железа и др.).
В качестве коагулянтов используют также водорастворимые органические высокомолекулярные соединения (полимеры), особенно полиэлектролиты. В отличие от неорганических коагулянтов, их иногда называют флокулянтами.
Коагулянты применяют для выделения ценных промышленных продуктов из отходов производства в различных технологических процессах, а также при очистке воды от природных и бытовых загрязнений.
Обработка воды коагулянтами — самый распространенный метод очистки больших объемов воды от грубодисперсных грязевых и коллоидных загрязнений. Масштабы применения метода коагуляции в централизованной водоподготовке в последние годы возросли, и данная тенденция продолжает сохраняться.
В последнее время значительно увеличилось разнообразие примесей в природных водах со значительным сезонным колебанием их состава и цветности. Это требует больших усилий по осветлению и обесцвечиванию вод, для чего традиционно используются различные коагулянты.
В связи с этим быстро растет ассортимент коагулянтов и сопутствующих им реагентов, предлагаемых для очистки природных вод с целью улучшения качества питьевой воды.
В настоящее время все более широкое распространение находят коагулянты высокой основности — гидроксохлориды алюминия.
Коагулянты — вещества (химические реагенты) способные вызывать или ускорять процесс объединения мелких взвешенных частиц в группировки (агрегаты) вследствие их сцепления при соударениях.
Использование коагулянтов позволяет увеличить скорость осаждения взвешенных частиц при очистке жидкостей.
Традиционные природные коагулянты – глины, алюмосиликаты, которые состоят в основном из солей металлов алюминия, железа и др.
Именно соли металлов и обладают коагулирующими (связывающими) свойствами.
Двухвалентные металлы обладают степенью коагуляции в 30 раз большей, чем одновалентные, а трехвалентный Аl — обладает степенью коагуляции в 1000 раз большей, чем одновалентный Nа.
|
Компонент,%масс. |
Импортный |
ЗАО «Нижегородские Сорбенты» |
По ГОСТ12966-85 |
|
Аl2O3 |
17,0±0,5 |
не менее 17,0 |
не менее15,0 |
|
Al |
9,1±0,2 |
не менее 9,0 |
не менее 8,0 |
|
Fe |
менее 0,01 |
не более 0,005 |
не более 0,2 |
|
Нерастворимые |
менее 0,1 |
не более 0,05 |
не более 0,7 |
В настоящее время ассортимент коагулянтов и сопутствующих им реагентов, предлагаемых для очистки природных вод с целью улучшения качества питьевой воды постоянно растёт.
Сейчас для очистки воды обычно применяют соли алюминия и железа.
Алюминий вызывает болезнь Альцгеймера » Tedaviler
Др. Пярвин АЙ
Алюминий играет в организме человека важную физиологическую роль – участвует в процессе регенерации костной, соединительной и эпителиальной ткани, влияет на пищеварительные ферменты. Однако его избыток может привести к серьёзному заболеванию – болезни Альцгеймера.
Учёным из Килского университета (Великобритания) Кристоферу Эксли и Томасу Викерсу удалось доказать прямую связь между длительным контактом с алюминием и возникновением болезни Альцгеймера.
Медиков из университета заинтересовал клинический случай 66-летнего англичанина, скончавшегося от болезни Альцгеймера. Мужчине поставили такой диагноз в 58 лет. Болезнь развивалась стремительно, кратковременная память ухудшалась и в итоге пациент умер. При этом 10 лет он работал на производстве, где использовался сульфат алюминия. Пациент жаловался на постоянные головные боли, приступы усталости, язвы во рту и дыхательных путях.
Учёные заподозрили в этом случае металлическое отравление, которое в последствии могло привести к болезни Альцгеймера. Ведь нейротоксичное воздействие алюминия на человеческий организм давно известно науке.
Результаты вскрытия пациента и экспериментов подтвердили первоначальную теорию : содержание алюминия составляло примерно 3 мг на 1 грамм мозговой ткани. Это в 4 (!) раза больше, чем у сверстников покойного.
Эта информация заставляет задуматься. Не так ли? Учитывая, что во всем мире примерно 35 миллионов человек страдает от болезни Альцгеймера. И эксперты прогнозируют к 2050 году более 115 миллионов больных на планете.
При этом думать, что с алюминием можно столкнуться только на производстве – ошибка. Вот только краткий список повседневных вещей, содержащих этот металл :
- Продукты питания.
Алюминий добавляют в дрожжи, искусственные красители и синтетические пищевые добавки. Без всего этого не обходятся колбасы, консервы, дрожжевой белый хлеб и другие продукты.
Если на банке консервированных овощей или пачке печенья вы увидели надпись Е520, Е521, Е522 или Е523, знайте, это сульфат алюминия.
- Вода из крана проходит техническую очистку от примесей с помощью сульфата алюминия.
- Дезодоранты содержат до 25 % хлоргидратов и хлоридов алюминия.
- Гидроксиды алюминия входят в состав вакцин и кислотопонижающих лекарств.
- Зубная паста. Лактат алюминия (разновидность солей) добавляется в пасту как противовоспалительное средство, которое останавливает кровоточивость дёсен, а также снижает чувствительность зубов
- Пищевая алюминиевая фольга. Без комментариев.
- Вакцины
Я, конечно, не призываю отказаться от дезодорантов или чистить зубы банановой кожурой. Но надеюсь этот материал призовет вас внимательнее относится к своему здоровью и детально изучать этикетки.
http://www.scinexx.de/wissen-aktuell-17222-2014-02-17.html
О продукции | Аурат
Самая известная продукция завода — коагулянты, химические вещества, применяемые для очистки воды, поступающей в водопроводные системы.
Завод выпускает их более 70 лет. Первоначально выпускался коагулянт единственного вида -сульфат алюминия — примерно 10 тыс. т. в год. В период 1955-1956 года для обеспечения растущей потребности Мосводоканала в коагулянтах по решению Московского совнархоза производство было реконструировано, и его мощность достигла 40 тыс. т. в год. В основу технологических и технических решений этого производства были заложены заводские разработки, что позволило в дальнейшем довести мощность производства до 90 тыс. т. в год (максимально достигнутая в 1987 году годовая выработка составила 103,5 тыс. т.).
В декабре 1999 года было пущено производство сухого полиоксихлорида алюминия мощностью 20 тыс. т./год, жидких и сухих полимерных смесей полиоксихлорида алюминия и сульфата алюминия, сульфата алюминия жидкого (до 150 тыс. т./год) и сухого с содержанием Аl2О3 свыше 18%.
Сейчас изготовляются коагулянты нескольких видов, а ежегодные масштабы их выпуска достигают многих десятков тысяч тонн. Самый прогрессивный среди них — уже упоминавшийся полиоксихлорид алюминия, производящийся в России только на нашем предприятии. Его применение позволяет получать питьевую воду с содержанием остаточного алюминия 0,05-0,1 мг/л, что гораздо ниже требований Всемирной организации здравоохранения (ВОЗ) -0,20 мг/л.
Самый прогрессивный среди них — уже упоминавшийся полиоксихлорид алюминия, производящийся в России только на нашем предприятии. Его применение позволяет получать питьевую воду с содержанием остаточного алюминия 0,05-0,1 мг/л, что гораздо ниже требований Всемирной организации здравоохранения (ВОЗ) -0,20 мг/л.
Химические соединения драгоценных металлов
Второе направление деятельности предприятия — производство химических соединений драгоценных металлов (свыше 150 наименований), используемых в электротехнике, приборостроении, электронике, промышленности средств связи, ювелирной отрасли, фармакопии, а также в каталитических нейтрализаторах выхлопных газов транспорта.
Самое известное применение продукции такого рода — «золоченые» и «посеребренные» контакты современных электронных устройств — от дорогостоящей телевизионной и музыкальной аппаратуры до систем наведения ракет и управления спутниками и космическими кораблями.
Многие москвичи заметили, что автобусы стали в последнее время заметно меньше «дымить». Это -тоже в какой-то мере заслуга ОАО»Аурат»: выпускаемые им химические соединения платины и палладия используются при изготовлении нейтрализаторов выхлопных газов, которыми теперь оснащено около 10 тыс. московских автобусов.
Это -тоже в какой-то мере заслуга ОАО»Аурат»: выпускаемые им химические соединения платины и палладия используются при изготовлении нейтрализаторов выхлопных газов, которыми теперь оснащено около 10 тыс. московских автобусов.
Продукция сложной органической химии
Четвертое направление — это производство продукции сложной органической химии, применяемой в качестве компонентов красителей, катализаторов, лекарственных и дезинфицирующих средств.
Развитие выпуска препаратов, идущих на производство лекарственных средств, способствует вытеснению с отечественного рынка зарубежных поставщиков лекарств и появлению на полках аптек отечественных лекарств, ни в чем не уступающих по эффективности иностранным, но гораздо более дешевых.
Два года назад была введена в эксплуатацию установка по выпуску этилового эфира альфа-бромизовалериановой кислоты — субстанции сильнодействующего сердечного лекарственного препарата, закрыв всю потребность страны в этом препарате.
Тогда же было смонтировано и пущено производство прекрасного дезинфицирующего средства -клатрата дидецилдиметиламмония бромида с мочевиной (ДДДМАБ). Соединение вызывает гибель многих микробов и вирусов, включая возбудителей туберкулеза, гепатитов, герпеса, гриппа, патогенных грибков, ВИЧ-инфекций и многих других.
Алюминий сульфат — Справочник химика 21
АЛЮМИНИЙ СЕРНОКИСЛЫЙ (АЛЮМИНИЙ СУЛЬФАТ) [c.28]КВАСЦЫ АЛЮМОКАЛИЕВЫЕ (КАЛИЕВЫЕ КВАСЦЫ. КАЛИИ-АЛЮМИНИИ СУЛЬФАТ) [c.157]
Написать химические формулы солей гидросульфид кальция, сульфид железа (И), сульфит натрия, сульфат железа (И1), бисульфит меди (I), дигидрофосфат меди (И), бикарбонат кальция, гидрофосфат железа (И1), сульфат алюминия, нитрат лантана (И1), ортоарсенат алюминия, сульфат палладия (II), нитрат родия (III). [c.47]
Калий-алюминий сульфат см.
 Алюмо-калиевые квасцы [c.238]
Алюмо-калиевые квасцы [c.238]Азота диоксид Азота оксид Азотная кислота Алюминий Алюминия оксид Алюминия сульфат Аминобензол (анилин) [c.100]
КВАСЦЫ АЛЮМОАММОНИЙНЫЕ (КВАСЦЫ АЛЮМОАММИАЧНЫЕ, АММОНИЙ-АЛЮМИНИЙ СУЛЬФАТ) [c.156]
Описаны случаи взрывов перекисей бензоила и других перекисных соединений от ударов при авариях на автомобильном транспорте, на котором перевозили эти перекиси. Поэтому для снижения взрываемости перекисные соединения подвергают флег-матизации. Твердые перекиси флегматизируют путем их измельчения н смешивания с мелом, твердыми органическими кислотами, окисью алюминия, сульфатом кальция и др. [c.135]
Кроме сульфата алюминия в НИИнефтеотдача исследована возможность использования для ограничения добычи воды некоторых других химических отходов, таких как лигносульфонаты, кремнефтористоводородная кислота, соли железа и алюминия, сульфат натрия, карбонат и бикарбонат натрия, аммиачная вода, жидкое стекло и др. Лигносульфонаты, как было отмечено в предыдущих разделах, являются многотоннажными и дешевыми отходами целлюлозно-бумажных комбинатов, вполне доступны и транспортабельны. Поэтому они представляют большой интерес для применения в качестве осадкообразующих реагентов. Известно, что лигносульфонаты выпадают в осадок при контакте с сильно минерализованными пластовыми водами плотностью выше 1150—1160 кг/м . [c.306]
Лигносульфонаты, как было отмечено в предыдущих разделах, являются многотоннажными и дешевыми отходами целлюлозно-бумажных комбинатов, вполне доступны и транспортабельны. Поэтому они представляют большой интерес для применения в качестве осадкообразующих реагентов. Известно, что лигносульфонаты выпадают в осадок при контакте с сильно минерализованными пластовыми водами плотностью выше 1150—1160 кг/м . [c.306]
В производстве синтетических катализаторов крекинга и полярных адсорбентов, занимающих в настоящее время доминирующее положенпе, используют большое количество разнообразных материалов силикат-глыбу, гидроокись алюминия, сульфат магния, серную кислоту, каустическую соду, аммиак, поверхностно-активные вещества, легкие масла (турбинное пли трансформаторное), хлористый натрий и др. [c.26]
Для закачки в нефтяные пласты используют высококонцентрированные и слабые водные растворы сернокислого алюминия (сульфата алюминия). [c.204]
Особое место занимает снижение коррозионной активности продуктов сгорания остаточных ванадийсодержащих топлив, используемых в газотурбинных и печных установках.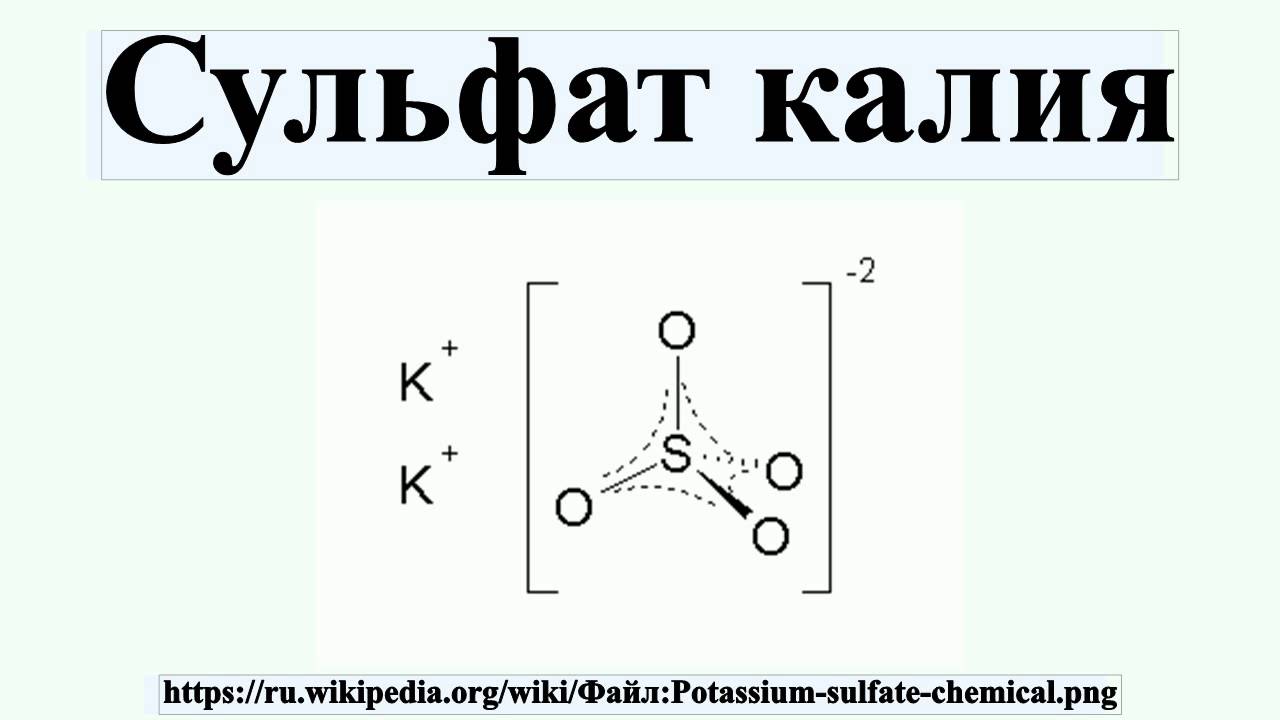 В качестве присадок, снижающих коррозию в этом случае, предложены растворимые в топливе органические соли магния, цинка, кальция и алюминия, сульфаты и силикаты некоторых металлов, минералы (доломит, каолин, магнезит) и силиконы [а. с. СССР 173366]. [c.277]
В качестве присадок, снижающих коррозию в этом случае, предложены растворимые в топливе органические соли магния, цинка, кальция и алюминия, сульфаты и силикаты некоторых металлов, минералы (доломит, каолин, магнезит) и силиконы [а. с. СССР 173366]. [c.277]
Производство активного оксида алюминия в СССР. Наибольшее распространение нашли два промышленных способа производства 1) осаждение из кислых растворов солей алюминия (сульфата, нитрата) растворами оснований (например, аммиака) 2) осаждение из щелочных растворов (алюминатов) кислотами (серной, азотной, соляной) или кислыми растворами солей алюминия. [c.65]
Осаждение из кислых растворов солей алюминия (сульфата, нитрата, хлорида) растворами, имеющими основной характер (аммиак, карбонат аммония и др.). Процесс осуществляют следующим образом. [c.138]
Окись кремния и сульфаты металлов, содержащиеся в катализаторе, снижают его активность. Катализаторы конверсии отравляются под действием сернистых соединений, в частности сероводорода [223, 224], в связи с превращением никеля в соответствующие неактивные соединения — сульфаты и сульфиды никеля. На свойства катализаторов существенно влияют качество применяемого сырья и условия их приготовления. Сырьем для производства катализаторов являются глинозем, соли алюминия (сульфат), никеля (сульфат, нитрат), магния, кальция и др. [c.88]
Катализаторы конверсии отравляются под действием сернистых соединений, в частности сероводорода [223, 224], в связи с превращением никеля в соответствующие неактивные соединения — сульфаты и сульфиды никеля. На свойства катализаторов существенно влияют качество применяемого сырья и условия их приготовления. Сырьем для производства катализаторов являются глинозем, соли алюминия (сульфат), никеля (сульфат, нитрат), магния, кальция и др. [c.88]
Нитрат алюминия Хлорид алюминия Сульфат алюминия Сульфат цинка Двухлористое олово [c.184]
В раствор, содержащий по0,01 моль следующих солей сульфат серебра, сульфат цинка, сульфат ртути (П), сульфат алюминия, сульфат меди (II) и сульфат железа (II), вводится одинаковыми порциями (по 0,01 моль) металлическое железо. После каждой добавки железа раствор тщательно встряхивается. Какой металл и в каком количестве (в молях) выделится из раствора после первой добавки железа, после второй добавки и т. д. Напишите уравнения происходящих реакций в ионной форме. [c.112]
Напишите уравнения происходящих реакций в ионной форме. [c.112]
Написать формулы двойных солей сульфат калия-алюминия сульфат гадолиния (П1)-калия ортосиликат лантана (1П)-ли-тия. [c.99]
Написать молекулярные формулы следующих солей сульфата дигидроксохрома (III), перрената калия, дихромата натрия, гидроортоарсената алюминия, сульфата диоксованадия (V). [c.18]
Напишите формулы таких солей хлорида кобальта (III), сульфида кальция, сульфата калия, сульфата алюминия, сульфата железа (II), нитрата бария, карбоната аммония, метафосфата натрия, ортофосфата магния, гипохлорита калия, хлората натрия, перхлората бария, перманганата калия. Объясните, в каких случаях в названиях соединений указывают степень окисления металла, а в каких нет. [c.22]
Натрий-алюминий сульфат см. Натрий-алюминий сернокислый [c.339]
Рассмотрите и зарисуйте в журнал подученные кристаллы (рис. 55). Напишите уравнение реакции образования алюмо-калиевых квасцов КА1 (504)2 12Н2О при взаимодействии сульфата алюминия, сульфата калия и воды. [c.176]
55). Напишите уравнение реакции образования алюмо-калиевых квасцов КА1 (504)2 12Н2О при взаимодействии сульфата алюминия, сульфата калия и воды. [c.176]
Цезий-алюминий сульфат см. Цезиевые квасцы Цезий ацетат см. Цезий уксуснокислый Цезий бензоат см. Цезий бензойнокислый Цезий бензойнокислый [c.533]
Процесс отстаивания позволяет осветлять воды вследствие удаления из нее грубодисперсных взвешенных примесей, оседающих под действием силы тяжести на дно отстойника. Отстаивание воды проводят в непрерывно действующих отстойных бетонированных резервуарах. Для достижения полного осветления и обесцвечивания декантируемую из отстойников воду подвергают коагуляции с последующим фильтрованием. Коагуляция — высокоэффективный процесс разделения гетерогенных систем, в частности выделение из воды мельчайших глинистых частиц и белковых веществ. Осуществляют коагуляцию внесением в очищаемую воду небольших количеств электролитов АЬ ЗО )], Ре304 и некоторых других соединений, называемых коагулянтами. Физико-химическая сущность этого процесса в упрощенном виде состоит в том, что коагулянт, адсорбируясь иа иоверхности заряженной коллоидной частицы, нейтрализует ее заряд. Это приводит к слииатпо отдельных част1щ (коагуляции) н образованию осадка. Чем выше заряд иоиа коагу.пянта (А1 +, Ре +), тем меньше расход электролита на коагуляцию. Для коагуляции глинистых коллоидных частиц (природные воды), имеющих отрицательный заряд, применяют чаще всего соединения алюминия — сульфаты или алюминиевые квасцы. Одновременно идет процесс адсорбции иа поверхности осадка органических красящих веществ, в результате чего вода обесцвечивается. [c.26]
Физико-химическая сущность этого процесса в упрощенном виде состоит в том, что коагулянт, адсорбируясь иа иоверхности заряженной коллоидной частицы, нейтрализует ее заряд. Это приводит к слииатпо отдельных част1щ (коагуляции) н образованию осадка. Чем выше заряд иоиа коагу.пянта (А1 +, Ре +), тем меньше расход электролита на коагуляцию. Для коагуляции глинистых коллоидных частиц (природные воды), имеющих отрицательный заряд, применяют чаще всего соединения алюминия — сульфаты или алюминиевые квасцы. Одновременно идет процесс адсорбции иа поверхности осадка органических красящих веществ, в результате чего вода обесцвечивается. [c.26]
Из солей алюминия наибольшее распространение и значение имеют хлорид алюминия, сульфат алюминия и алюмока лиевые квасцы. Хлорид алюминия AI I3 используется в качестве катализатора в органическом синтезе. Сульфат алюминия AI2(804)3 применяется для очистки воды, производства бумаги. Алюмокалиевые квасцы КА1 (504)2-I2h3O применяются для дубления кож, протравливания тканей при крашении Все эти соли хорошо растворимы в воде. [c.271]
[c.271]
Если при растворении твердого вещества в раствор переходят ионы, обладающие большим зарядом (например, или Ре +), малыми размерами (например, или Mg2+), то такие ионы энергично взаимодействуют с растворителем. В этом Тлу-чае рсольв > Рреш и растворение может сопровождаться выделением теплоты. Это имеет место при растворении в воде галогенидов лития, магния, алюминия, сульфатов лития, магния, марганца (II) и некоторых других солей. Растворимость таких соединений, как это следует из принципа Ле Шателье, с повышением температуры уменьшается. [c.77]
Алюминия сульфат Алюмокалиевые квасцы Аммония нитрат Аммония роданид Аммония сульфат Аммошзя карбонат Аммония ацетат Аммония фторид Аммония гидрофосфат Аммония хлорид Аммония бихромат Аммония персульфат Бария нитрат Бария vльфaт Бария карбонат Бария ацетат Бария хлорид Висмута нитрат Висмута сульфат Железа (II) сульфат Железа (II) хлорид Кадмия оксид Кадмия сульфат Кадмия хлорид Калия боргидрид Калия нитрат Калня бихромат Калия гсксациапо-(II) феррат [c. 20]
20]
Рассчитайте ионную сипу водш.к растворов, содержащих в 1 л а) 0,0) моль калия хлорида КС1 б) 0,01 моль железа(П1) хлорида РеСЬ в) 0,01 моль алюминия сульфата А12(804)з. Ответ 0,01 0,06 0,15. [c.82]
Опыт 12.4. В конические пробирки поместить ио 4—5 капел растворов солей хлорида алюминия, сульфата калия, соды, буры и определить реакцию каждого раствора, как описано на с. 16, п. 6. Какие из этих солей подвергаются гидролизу Написать уравнения реакций гидролиза. [c.122]
Алюминий сульфат см. Алюминий сернокислый Алюминий сульфид см. Алюмнний сернистый [c.19]
Аналогично получают многие другие соединения, например сульфат алюминия, сульфат железа. Между собой реагируют не только окислы, но и фториды, нитриды, карбиды и др. Например, при взаимодействии фторида натрия с фторидом алюминия получаем криолит Каз[А1Рв1 по схеме [c.90]
Алюминий сернокислый, 18-водный Алюминий сульфат А (504)з-18Н20 [c. 19]
19]
Аммоний-алюминий сульфат см. Алюыо-аммонийные квасцы [c.34]
Рубидий-алюминий сульфат см. Алюно-рубидиевые квасцы [c.429]
Одним из частгных приложений этого метода является получение простых эфиров в газовой фазе (каталитическая дегидратация на окиси алюминия, сульфате алюминия). [c.260]
Химический тренажер. Ч.1 (1986) — [ c.28 , c.44 ]
Химия (1978) — [ c.527 ]
Приготовление растворов для химико-аналитических работ (1964) — [ c.242 ]
Большой энциклопедический словарь Химия изд.2 (1998) — [ c.29 ]
Справочник Химия изд.2 (2000) — [ c.309 ]
Химия справочное руководство (1975) — [
c. 53
]
53
]
Инженерная химия гетерогенного катализа (1965) — [ c.317 , c.319 , c.324 ]
Вредные химические вещества Неорганические соединения элементов 1-4 групп (1988) — [ c.206 , c.207 , c.208 , c.209 , c.212 , c.476 , c.478 ]
Курс неорганической химии (1963) — [ c.388 , c.401 ]
Краткая химическая энциклопедия Том 1 (1961) — [ c.158 ]
Неорганическая химия (1974) — [
c. 342
]
342
]
Неорганическая химия Издание 2 (1976) — [ c.397 ]
Общая химия 1982 (1982) — [ c.618 , c.638 ]
Общая химия 1986 (1986) — [ c.598 , c.618 ]
Справочник резинщика (1971) — [ c.436 ]
Общая и неорганическая химия (1981) — [ c.342 , c.351 ]
Учебник общей химии 1963 (0) — [ c.215 , c.335 ]
Неорганическая химия (1978) — [ c.291 , c.293 ]
Неорганическая химия (1950) — [
c. 282
]
282
]
Общая химия (1974) — [ c.556 ]
Производство серной кислоты Издание 3 (1967) — [ c.124 ]
Производство серной кислоты Издание 2 (1964) — [ c.124 ]
Общая химия Издание 18 (1976) — [ c.610 , c.630 ]
Общая химия Издание 22 (1982) — [ c.618 , c.638 ]
Общая и неорганическая химия (1994) — [ c.355 , c.362 ]
Технология минеральных солей Ч 2 (0) — [ c.632 ]
Руководство по неорганическому синтезу (1953) — [ c.232 ]
Краткая химическая энциклопедия Том 1 (1961) — [
c. 158
]
158
]
Основы общей химии Том 2 (1967) — [ c.191 , c.203 ]
Общая химия (1968) — [ c.387 , c.571 ]
Технология минеральных солей Издание 2 (0) — [ c.428 ]
Курс неорганической химии (1972) — [ c.347 , c.359 ]
Практикум по общей химии Издание 2 1954 (1954) — [ c.45 ]
Практикум по общей химии Издание 3 (1957) — [ c.45 ]
Практикум по общей химии Издание 4 (1960) — [ c.45 ]
Практикум по общей химии Издание 5 (1964) — [ c.48 ]
Современные методы эксперимента в органической химии (1960) — [
c. 525
]
525
]
Оксид алюминия | Сульфат алюминия
Оксид алюминия — это обычное встречающееся в природе соединение, которое используется в различных отраслях промышленности, особенно в производстве алюминия. Используется в производстве промышленной керамики. Его наиболее распространенная кристаллическая форма, корунд, также имеет несколько разновидностей ювелирного качества.Химические свойства
Существует множество различных форм оксида алюминия, включая как кристаллические, так и некристаллические формы. Химическая формула оксида алюминия — Al₂O₃.Это электрический изолятор, что означает, что он не проводит электричество, а также имеет относительно высокую теплопроводность. Кроме того, в кристаллической форме, корунд, его твердость делает его пригодным в качестве абразива. Высокая температура плавления оксида алюминия делает его хорошим огнеупорным материалом для футеровки высокотемпературных устройств, таких как печи, печи, мусоросжигательные печи, реакторы различных типов и тигли.
Использование в производстве алюминия
Чаще всего оксид алюминия используется в производстве металлического алюминия.Металлический алюминий реагирует с кислородом, что может вызвать коррозию. Однако, когда алюминий связывается с кислородом с образованием оксида алюминия, он создает тонкое покрытие, которое защищает его от окисления. Это предохраняет алюминий от коррозии и потери прочности. Толщина и другие свойства оксидного слоя могут быть изменены с помощью процесса анодирования. Оксид алюминия также является продуктом процесса плавки алюминия.
Драгоценные камни корунда
Наиболее распространенной кристаллической формой оксида алюминия является корунд.И рубины, и сапфиры представляют собой корунды ювелирного качества. Своей отличительной окраской они обязаны следам примесей. Рубины получают свой темно-красный цвет и лазерные свойства из-за следов хрома. Сапфиры бывают разных цветов, которые происходят из других примесей, таких как железо и титан. Твердость различных видов корунда делает их пригодными для использования в качестве абразивов и компонентов в режущих инструментах.
Твердость различных видов корунда делает их пригодными для использования в качестве абразивов и компонентов в режущих инструментах.
Использование в керамике
Оксид алюминия, также называемый оксидом алюминия, используется в инженерной керамике.Он твердый и износостойкий, устойчив к воздействию кислот и щелочей, обладает высокой прочностью и жесткостью, а также хорошей теплопроводностью, что делает его ценным при производстве различных керамических изделий. К ним относятся такие вещи, как высокотемпературные электрические изоляторы и изоляторы напряжения, детали контрольно-измерительных приборов для машин для термических испытаний, уплотнительные кольца, газовые лазерные трубки и другое лабораторное оборудование. Оксид алюминия также используется в производстве баллистической брони.
Другое применение
Поскольку оксид алюминия является довольно инертным химически, белым и относительно нетоксичным, он служит наполнителем в пластмассах. Это также частый ингредиент солнцезащитного крема. Из-за своей твердости и прочности он используется как абразив, в том числе в наждачной бумаге, и как менее дорогой заменитель промышленных алмазов. Некоторые комплекты для полировки CD и DVD содержат оксид алюминия. Те же качества делают его хорошим ингредиентом зубной пасты. Стоматологи используют оксид алюминия в качестве полирующего средства для удаления зубных пятен.
Это также частый ингредиент солнцезащитного крема. Из-за своей твердости и прочности он используется как абразив, в том числе в наждачной бумаге, и как менее дорогой заменитель промышленных алмазов. Некоторые комплекты для полировки CD и DVD содержат оксид алюминия. Те же качества делают его хорошим ингредиентом зубной пасты. Стоматологи используют оксид алюминия в качестве полирующего средства для удаления зубных пятен.
Оксид алюминия используется для различных целей. Самая важная из них — производство металлического алюминия, но, конечно, не единственная.Хотя вы можете этого не знать, рубины и сапфиры состоят из оксида алюминия, что делает его очень ценным элементом!
Формула для оксида алюминия
Al2O3
Свойства оксида алюминия
Молярная масса: 101,96 г · моль -1
Точка плавления: 2072 ° C (3762 ° F; 2345 K)
Точка кипения: 2,977 ° C (5,391 ° F; 3,250 K)
Плотность: 3,95–4,1 г / см3
Является ли сульфат алюминия ионной или ковалентной связью?
Является ли сульфат алюминия ионной или ковалентной связью? Вопрос: Является ли сульфат алюминия ионной или ковалентной связью?Ответ: сульфат алюминия ( Al2 (SO4) 3) ионная связь
Что такое химическая связь, ионная связь, ковалентная связь?
Химическая связь
Химическая связь — это длительное притяжение между атомами, ионами или молекулами, которое позволяет образовывать химические соединения.
 Связь может быть результатом электростатической силы притяжения между противоположно заряженными ионами, как в ионных связях; или через обмен электронами, как в ковалентных связях.
Связь может быть результатом электростатической силы притяжения между противоположно заряженными ионами, как в ионных связях; или через обмен электронами, как в ковалентных связях. https://en.wikipedia.org/wiki/Chemical_bond
Ионная связь
Ионная связь — это тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами и является основным взаимодействием, происходящим в ионных соединениях. . Ионы — это атомы, которые приобрели один или несколько электронов (известные как анионы, которые имеют отрицательный заряд), и атомы, которые потеряли один или несколько электронов (известные как катионы, которые имеют положительный заряд).
https://en.wikipedia.org/wiki/Ionic_bonding
Ковалентная связь
Ковалентная связь, также называемая молекулярной связью, представляет собой химическую связь, которая включает обмен электронными парами между атомами. Эти электронные пары известны как общие пары или связывающие пары, а стабильный баланс сил притяжения и отталкивания между атомами, когда они разделяют электроны, известен как ковалентная связь.

https://en.wikipedia.org/wiki/Covalent_bond
СПИСОК IONIC
MgF2
Rb2O
BaCl2
LiF
CaF2
Mg3N2
CaBr2
BaO
KF
CaO
Fe2O3
Al Na2O
SrO
Na2S
Nh5NO3
K2S
nahco3
MgBr2
RbCl
гипохлорит натрия
MgSO4
CaSO4
оксид бария
NaBr
KCl
Na2O
Nh5Cl
NaI
KCl
Na2O
Nh5Cl
NaI
KCl
Na2S43 иодид калия
AlS43 AlS 43
сульфат натрия
Na3PO4
K2O
BaS
сульфид алюминия
карбонат натрия
SrCl2
нитрат кальция
KOH
KNO3
agno3
CaS
CaCl2
kbr
сульфат магния
K2SO4
мгcl2
сульфид натрия
CuCl
оксид натрия
CuCl хлорид калия
бромид аммония
фосфат серебра
libr
Li2O
CuSO4
(nh5) 2so4 9004 3 сульфат аммония
FeSO4
йодид магния
сульфат алюминия
бикарбонат натрия
оксид натрия
хлорид кальция
Nh5
йодид натрия
AgCl
гидроксид аммония
MgO
нитрат аммония
licl
kmno4
карбонат калия
нитрат алюминия 43 433 бромид
NaNh3
Nh5OH
CsF
бромид натрия
оксид алюминия
медь
нитрат калия
NO3-1
йодоводород
MnO2
NaF
гидроксид натрия
na
оксид кальция
оксид магния
железо iii
фторид кальция
гексафторид серы
k20
фосфорная кислота
оксид железа
alf3
хлорид магния
nah
хлорид аммония
хлорид серебра
пищевая сода
хлорид лития
магний
фторид натрия
фторид лития
lih хлорид алюминия
bef2
ацетат лития
LIST COVAL ЛОР-СВЯЗЬ / МОЛЕКУЛЯРНАЯ СВЯЗЬ
Ch4OH
SCl2
CS2
CF4
NF3
NO
icl
PCL3
PBr3
Cl2
clo2
NCl3
O2
SiO2
HBr
BrCl
йод SF643 CB
CB
CBR
CBR
масло
Nh4
NO2
Ch5
h3S
этанол
PCl5
пентоксид диазота
N2O5
CCL4
P4
треххлористый фосфор
триоксид диазота
C6h22O6
Ch4Nh3
фосфор фосфор
триоксид углерода SF43
метанол углекислый газ
пентахлорид фосфора
SO2
P2O5
SiF4
Ph4
трибромид азота
тетрафторид кремния
метан
четыреххлористый углерод
диоксид азота
Br2
hi
P4O10
h3
C6H6
декстроза
TiBr443 h3
x2SO4 9002 NefOcerol
TiBr443 h2SO4 9003 x2 SOF3
аспирин
ацетон
h3SO4
SiC l4
бензойная кислота
CO
стеариновая кислота
CO2
азот
дистиллированная вода
FCl
BCl3
бромистоводородная кислота
диоксид кремния
SO3
N2O
фруктоза
салициловая кислота
c12h32o11
водопроводная вода
HC2h4O2
трихлорид серы
N2O4 HCN
циклогексан
пентоксид фосфора
перекись водорода
i2
C2h5
лимонная кислота
h3o2
парафиновый воск
gacl3
Ch4Ch4
уксус
бромистый водород
PF3
HNO3
3 сахароза
Бромистого водорода
PF3
HNO3
3 сахароза
s8
монооксид углерода
тетрахлорид кремния
f2
диоксид титана
бромид азота
кукурузный крахмал
серная кислота
кислород
аммиак
соляная кислота
бекл2 hcl
h3o
AlCl3
хлорид алюминия
фтористый водород
hf
хлорид алюминия
900 Содержат как (ионный, так и ковалентный)
ацетат натрия
Caco3
BaSO4
na2so4
нитрат магния
карбонат кальция
AlBr3
Мы получаем ответы от
Ресурсы
www. quora.com
quora.com
answers.yahoo.com
answers.com
www.quia.com
quizlet.com
www.reference.com
socratic.org
https://en.wikipedia.org
https: // en. wikipedia.org/wiki/Ionic_bonding
https://en.wikipedia.org/wiki/Covalent_bond
https://en.wikipedia.org/wiki/Chemical_bond
pubchem.ncbi.nlm.nih.gov
Если ответ неверный. Прокомментируйте ниже или свяжитесь с нами.
Вопрос: Является ли сульфат алюминия ( Al2 (SO4) 3) ионной или ковалентной связью ?
Ответ: сульфат алюминия ( Al2 (SO4) 3) ионная связь Ионный или ковалентный
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
(PDF) Эффекты добавления сульфата алюминия к карбамидоформальдегидному клею, нанесенному на фанеру
1018 Int.J. Phys. Sci.
(Baumann et al., 2000). Применение природных соединений
, таких как мочевина, катехин и ванилин, может обеспечить простой и эффективный подход для подавления
эмиссии формальдегида, исходящей от фанеры
(Uchiyama et al., 2007). Также было замечено, что
добавление борной кислоты к меламино-мочевинно-формальдегидному клею
увеличивало адгезионную прочность клееных плит
из шпона (LVL) (Bridaux et al., 2001). Влияние обработки бором
на механические, биологические,
и размерные свойства древесины и древесных материалов
широко изучалось. Измерение
, записанное с помощью метода эксикатора, показало, что выброс формальдегида
, исходящий от фанерных панелей
, уменьшился при введении буры (Colakoglu и
Demirkir, 2006). Было изучено влияние добавления пентагидрата буры
в УФ адгезив на характеристики склеивания фанеры
и содержание в ней свободного формальдегида. Добавление
Добавление
пентагидрата буры не повлияло статистически на
на прочность на изгиб и сопротивление сдвигу фанеры
, но снизило содержание свободного формальдегида на
(Sensogut et al., 2009). Было замечено, что добавление
порошка отработанных бутылок из ПЭТ и пентагидрата буры
в равных количествах к мочевиноформальдегиду
значительно повысило прочностные характеристики фанеры, скрепленной с использованием этой смолы
.Кроме того, было зарегистрировано умеренное снижение содержания свободного формальдегида
(Ozalp,
2010). Было исследовано влияние добавления пентагидрата буры к UF
на характеристики связывания и содержание свободного формальдегида
. Добавление пентагидрата буры
к адгезивной смеси не оказало статистически значимого влияния на прочность на изгиб
и предел прочности при растяжении перпендикулярно плоскости древесноволокнистой плиты
, но снизило содержание свободного формальдегида
(Ozalp, 2010).
Целью настоящего исследования было изучить влияние
сульфата алюминия на содержание свободного формальдегида
карбамидоформальдегидного клея, который используется в
при производстве фанеры. Это исследование также было направлено на определение идеального соотношения
в смеси сульфата алюминия
и клея путем изучения влияния различных соотношений
смеси на механические характеристики материала
.
МАТЕРИАЛЫ И МЕТОДЫ
Деревянный материал
Для экспериментов в качестве деревянного материала для производства фанеры использовались фанеры из тополя (Populus
x eureamericana) и экабы (Tetraberlinia bifoliolata) породы
. Чтобы обеспечить
, что фанера раскрывает химические и биологические
характеристики древесных пород, они были изготовлены из
одинаковых пиломатериалов для обоих типов деревьев.
Используемый клей
Мочевинно-формальдегидный (УФ) клей был использован при производстве фанеры
. Этот клей используется в 90% от общего объема производства деревянных досок
, так как он требует короткого времени схватывания в горячем прессе
, прост в использовании и недорогой, а также имеет прозрачный цвет.
Технические характеристики карбамидоформальдегидного клея
аналогичны таковым; производитель — Polisan Chemical Industry Comp.,
коммерческое наименование — карбамидоформальдегид 2265, молярное отношение
(мочевина / формальдегид) составляет 1,35, содержание твердого вещества (мас.%) Составляет 55 ± 1,
плотность (при 20 ° C) составляет от 1,22 до 1,23 (г / см3), вязкость (при 20 ° C) от 100
до 200 (сП), pH (при 20 ° C) от 7,5 до 8,5, свободный формальдегид (%) 0,8
макс, время хранения (при 20 ° C) составляет 90 (дней).
Примерно 180 (г / м2) клея (двойная клеящая линия)
наносили на поверхность образца с помощью прокатного пресса.Клей
UF с содержанием твердого вещества 55 мас.% Был использован при производстве фанеры
для испытаний. 15 мас.% Хлорида аммония
(Nh5CI), используемого в качестве отвердителя, добавляли в жидкий клей
в соотношении 10 мас.%. Пшеничная мука была также добавлена к клею
в качестве добавки в соотношении 55 мас.% Твердого материала.
Сульфат алюминия был добавлен в качестве модифицирующего агента к клею
в соотношении 5, 10 и 20 мас.% От общего твердого материала.
Сульфат алюминия, или сульфат алюминия
, представляет собой химическое соединение с формулой
Al2 (SO4) 3. Сульфат алюминия в основном используется как флокулянт
при очистке питьевой воды и очистных сооружений сточных вод
, а также в производстве бумаги. Сульфат алюминия
иногда неправильно называют квасцами, но квасцы — это близкородственные соединения
, типичным примером которых является KAl (SO4) 2.12х3О (Квеч,
иЭдвардс, 2002).
Безводная форма встречается в естественных условиях как редкий минерал
миллозевичит, обнаруженный, например, в вулканических условиях и при сжигании
отвалов угледобычи. Сульфат алюминия редко, если вообще встречается,
в виде безводной соли. Он образует ряд различных гидратов
, из которых наиболее распространены гексадекагидрат Al2 (SO4) 3 • 16h3O и
октадекагидрат Al2 (SO4) 3 • 18h3O.Гептадекагидрат
, формулу которого можно записать как
[Al (h3O) 6] 2 (SO4) 3 • 5h3O, встречается в природе как минерал алуноген.
Сульфат алюминия используется для очистки воды и в качестве протравы при крашении и печати тканей
. При очистке воды он вызывает коагуляцию
примесей, которые удаляются по мере оседания частиц
на дно контейнера или более легкой фильтрации. Этот процесс
называется коагуляцией или флокуляцией.При растворении в большом количестве
нейтральной или слабощелочной воды сульфат алюминия
образует студенистый осадок гидроксида алюминия, Al (OH) 3.
При крашении и печати на ткани гелеобразный осадок помогает красителю
прилипать к волокнам одежды, делая пигмент нерастворимым.
Сульфат алюминия иногда используется для снижения pH садовой почвы
, поскольку он гидролизуется с образованием осадка гидроксида алюминия
и разбавленного раствора серной кислоты.Пример того, что изменение уровня pH почвы
может сделать с растениями, можно увидеть при взгляде на Hydrangea macrophylla
. Садовник может добавить в почву сульфат алюминия
, чтобы снизить уровень pH, что, в свою очередь, приведет к изменению цвета цветов гортензии
.
Сульфат алюминия является активным ингредиентом некоторых антиперспирантов
; однако, начиная с 2005 года Управление по контролю за продуктами и лекарствами США
больше не признавало его средством, снижающим влажность.
Сульфат алюминия обычно содержится в разрыхлителе, где
вызывает разногласия по поводу его использования из-за опасений относительно безопасности
добавления алюминия в рацион. В строительстве используется как гидроизоляционный агент
и ускоритель в бетоне. Другое применение — пенообразователь
в пене для пожаротушения. Он также используется в кровоостанавливающих карандашах,
и для снятия боли от укусов и укусов. Он также может быть очень эффективным в качестве моллюскицида
, убивая испанских слизней.Некоторые технические характеристики использованного сульфата алюминия
приведены в таблице 1.
В экспериментах, проведенных для анализа прочности на изгиб фанеры
, соблюдались правила BS EN 310 (BS EN 310,
1993). Образцы для исследования (20 повторов) были приготовлены
таким образом, что они имели длину 150 мм и ширину
50 мм, а ось длины была параллельна направлению волокон внешних слоев
.Затем образцы были акклиматизированы в кабине кондиционирования воздуха
при температуре 20 ° C и относительной влажности
Факты, формула, свойства, использование сульфида алюминия, данные по безопасности
Сульфид алюминия, также называемый трисульфидом диалюминия, представляет собой ионное соединение алюминия и серы, представленное химической формулой Al 2 S 3 [1, 2] . Он существует в различных кристаллических формах и гидролизуется до гидроксида / оксида алюминия [3, 4] .
Идентификация сульфида алюминия | |
| Номер CAS | 1302-81-4 [1, 2] |
| PubChem CID | 16684788 [6] |
| ChemSpider ID | 140154 [1] |
| Номер ЕС | 215-109-0 [1, 2] |
| Ключ InChI | ZPXDOGRYMSWBBM-UHFFFAOYSA-N [6] |
Формула сульфида алюминия
Как получают сульфид алюминия
Его синтез путем прямого нагрева алюминия и серы можно представить следующим уравнением [7] :
2Al + 3S → Al 2 S 3
Однако реакция сильно экзотермична, и нагревать всю смесь нежелательно. [7] .Кроме того, сера является летучим реагентом, который тает до того, как протекает реакция [7] . Поэтому сульфид свинца часто используется для получения Al 2 S 3 [7] :
2Al + 3PbS → Al 2 S 3 + 3Pb
Сульфид алюминия
Реакции с другими соединениями
Сульфид алюминия и вода
Когда сульфид алюминия подвергается воздействию влаги из атмосферы, он подвергается реакции гидролиза с образованием гидроксида алюминия и сероводорода [5] .
Al 2 S 3 + 6H 2 O → 2Al (OH) 3 + 3H 2 S
Сульфид алюминия и соляная кислота
Сульфид алюминия при реакции с соляной кислотой образует сероводород и хлорид алюминия, как показано ниже. [8] :
Al 2 S 3 + 6HCl → 2AlCl 3 + 3H 2 S
Структура Льюиса из сульфида алюминия
Свойства и характеристики сульфида алюминия
Общая недвижимость | |
| Молярная масса / молекулярный вес | 150.158 г / моль [1] |
Физические свойства | |
| Цвет и внешний вид | Серый порошок или гранулы [2] |
| Точка плавления | 1100 ° C, 2012 ° F [2] |
| Температура кипения | 1500 ° C, 2732 ° F [2] |
| Плотность | 2,32 г см -3 [2] |
| Состояние вещества при комнатной температуре (твердое / жидкое / газообразное) | Цельный [2] |
| Растворимость | Не растворим в (CH 3 ) 2 CO (ацетон) [9] |
| Растворимость в воде | Реагирует и разлагается в H 2 O [9] |
| Теплоемкость (C) | 105.1 Дж / моль K |
| Стандартная молярная энтальпия | -724 кДж / моль [9] |
| Стандартная молярная энтропия | 116,9 Дж / моль K |
Атомарные свойства | |
| Кристаллическая структура | Тригональный, четырехугольный, шестиугольный [3, 4] |
Кристаллическая структура сульфида алюминия
Что используется для
- Производство органических соединений, таких как этантиол, и химикатов, необходимых для дубления и изготовления бумаги [10]
- Производство катодов, используемых в литий-серных твердотельных батареях [11]
- Получение сероводорода, имеющего несколько промышленных применений [11]
Токсично для сульфида алюминия
Воздействие сульфида алюминия может вызвать сильное раздражение кожи и глаз [12] .Вдыхание пыли, пара или дыма может вызвать затруднение дыхания [12] .
Каталожные номера:
- Сульфид алюминия (2: 3) — Chemspider.com
- Сульфид алюминия — Americanelements.com
- Синтез и кристаллическая структура новой гексагональной модификации Al 2 S 3 с пятикоординированным алюминием — Onlinelibrary.wiley.com
- Шпинель высокого давления типа Al 2 S 3 и MnAl 2 S 4 — Adsabs.harvard.edu
- Реакция сульфида алюминия с водой — Chemiday.com
- ZPXDOGRYMSWBBM-UHFFFAOYSA-N — Pubchem.ncbi.nlm.nih.gov
- Получение сульфида алюминия — Prepchem.com
- Реакция сульфида алюминия с водородом — Chemiday.com
- Сульфид алюминия [Al 2 S 3 ] — Periodic-table-of-elements.org
- Каковы виды использования сульфида алюминия? — Reference.com
- Сульфид алюминия — Chemicalbook.com
- Паспорт безопасности сульфида алюминия — Ltschem.com
формула иона алюминия
Оксид алюминия представляет собой соединение алюминия и кислорода с химической формулой Al2O. Если у вас есть какие-либо вопросы или хорошие предложения по нашим продуктам и сайту, или если вы хотите узнать больше о наших продуктах, напишите их и отправьте нам, мы свяжемся с вами в течение одного рабочего дня. Ионная формула оксида алюминия? Алюминий (3+) — это катион алюминия с зарядом +3. Алюминий имеет заряд +3, а кислород — -2.Поскольку ионные соединения должны быть электрически нейтральными, заряды ионов должны нейтрализовать друг друга. Здесь фраза одноатомный просто означает, что ион происходит от одного атома. Сульфат алюминия добавляют в воду для удаления примесей. Алюминий имеет серебристый цвет и не притягивает магниты. Эл. адрес. алюминий (3+) Алюминий, ионный (Al3 +) UNII-3XHB1D032B. 5 лет назад. Это катион алюминия, одноатомное трехатомное соединение и одноатомный алюминий. Ионы бывают одноатомные (состоящие из одного атома), многоатомные (состоящие из более чем одного атома).Это потому, что атомный номер элемента равен 13, что отражает тот факт, что у него 13 электронов и 13 протонов. Формула сульфата алюминия. CopyCopied, Проверено экспертами, Проверено пользователями, Непроверено, Удалено пользователями, Прогнозируемые данные генерируются с использованием платформы ACD / Labs Percepta — Модуль PhysChem. Прогнозируемые данные генерируются с использованием EPISuite ™ Агентства по охране окружающей среды США. Нажмите, чтобы спрогнозировать свойства. на сайте Chemicalize. Для получения медицинской информации о Covid-19, пожалуйста, обратитесь к ACD / Labs Percepta Platform — PhysChem Module, EPISuite ™ Агентства по охране окружающей среды США, Соединения с одинаковой молекулярной формулой, Найдите в Google структуры с таким же скелетом.Сульфат алюминия — это ионное соединение, которое представляет собой комбинацию положительных и отрицательных ионов. Нейтроны, электроны и протоны — три составные части атома. Однако такие замены не могут быть произведены без должного учета…, Фтористая промышленность тесно связана с производством алюминия. Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Это потому, что в нем есть металл и неметалл. В основном это касается молодняка. Как написать формулу для иона алюминия.Обычно хлоридные соединения растворимы, поэтому они могут… Предположим, вы хотите быть уверены, что ион металла, любой ион металла, растворяется в воде. Римское число IV = заряд иона свинца +4. Попрактикуйтесь в написании формул для соединений. Глинозем (оксид алюминия, Al. K) и является электрическим изолятором. Чтобы определить число, вам необходимо выполнить следующие шаги: Шаг 1: Найдите общий заряд отрицательного иона в формуле. Формула нитрида алюминия. Возможно, вам придется заключить цианид в круглые скобки.Подписываясь на это письмо, вы соглашаетесь с новостями, предложениями и информацией от Encyclopaedia Britannica. Затем определите анион и запишите его символ и заряд. Сбалансируйте расходы. Кроме того, между металлами и неметаллами существуют ионные соединения. Al Cl 3+ 1- (перекрестные валентности) Формула: AlCl3 Следовательно, формула хлорида алюминия — AlCl3. Заряд иона металла определяется из формулы соединения и заряда аниона. Это увеличивает потери натрия. Ионные связи образуются вместо ковалентных связей, когда существует большая разница в электроотрицательности между ионами.Железо обычно имеет заряд 2+ или 3+ (см.), И две соответствующие формулы соединений — это FeCl 2 и FeCl 3. Образование и возникновение Al2O обычно существует в виде газа, поскольку твердое состояние нестабильно при комнатной температуре и стабильна только между 1050 и 1600 ° C. Определите ионный заряд алюминия с помощью Периодической таблицы. Алюминий (3), гексааква-, ион | Alh22O6 + 3 | CID 177604 — структура, химические названия, физические и химические свойства, классификация, патенты, литература, биологическая активность, информация о безопасности / опасностях / токсичности, списки поставщиков и многое другое.10 лет назад. Алюминий может быть количественно проанализирован как оксид (формула Al 2 O 3) или как производное азоторганического соединения 8-гидроксихинолина. Атомы состоят из трех основных частей, разделенных на две отдельные области. Поскольку ионное соединение должно быть нейтральным, количество каждого иона должно давать нулевой общий заряд. Скопируйте это в мою учетную запись; Электронное письмо другу; Найдите другие занятия; Начать сначала; Помощь; Использование этой программы поможет вам научиться писать названия и формулы ионных соединений для химии А.Оксид алюминия — ионное соединение. Редакторы Encyclopaedia Britannica наблюдают за предметными областями, в которых они обладают обширными знаниями, будь то из-за многолетнего опыта, полученного в результате работы над этим содержанием или в результате обучения на ученую степень …. 118 Имена и символы викторины с периодической таблицей. Давайте теперь узнаем формулу сульфата алюминия и как эта формула получена химическим путем. Когда хлорат алюминия нагревается, он становится хлоридом алюминия и газообразным кислородом. Химическая формула — CuCl 2. Заряд и формула ионов алюминия.Металл — это, конечно, алюминий, а кислород — неметалл. Напишите формулу сульфида свинца (IV). Давайте теперь узнаем формулу сульфата алюминия и как эта формула получена химическим путем. Атом или молекула превращается в ион, когда теряет или приобретает электроны. Алюминий является привлекательным активным материалом для аккумуляторных систем из-за его обилия, низкой стоимости, гравиметрической плотности энергии 2,98 Ач / г (см. Alfa Aesar 12851 Оксид алюминия представляет собой химическое соединение алюминия и кислорода с химической формулой Al 2 O 3. .iii) Ионное соединение сульфида натрия, состоящее из ионов натрия и сульфид-ионов. Посетите BYJU’S, чтобы узнать больше о свойствах этого соединения алюминия. Наконец, объедините два иона, чтобы образовать электрически нейтральное соединение. Статьи из энциклопедий Британика для учеников начальной и средней школы. Ионные связи образуются вместо ковалентных связей, когда существует большая разница в электроотрицательности между ионами. Это наиболее часто встречающийся из нескольких оксидов алюминия и, в частности, определяемый как оксид алюминия (III).2004-09-16. Стандарт ИЮПАК: KVLCHQHEQROXGN-UHFFFAOYSA-N; Регистрационный номер CAS: 14903-36-7; Химическая структура: эта структура также доступна в виде файла 2d Mol; Другие названия: Катион алюминия Постоянная ссылка на этот вид. И я получаю в сумме 0. УЛЫБКИ [Al + 3] Копия. Предыдущий вопрос Следующий вопрос В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них. Смотрите ответ. Ацетат алюминия имеет молярную массу 204.1143 г / моль. Если анион одноатомный, то анионная часть имени является корнем имени элемента плюс «ide». лития 2,06 Ач см − 3). Молекулярная формула Al; Средняя масса 26,980 Да; Моноизотопная масса 26,979893 Да; ChemSpider ID 94544 — Зарядка. Вопрос: Вопрос 6 (2 балла) Какова правильная формула соединения, образующегося между ионом алюминия и ионом сульфида? Чтобы написать формулу для иона алюминия: напишите символ элемента для Alumnium. Они объединяются в ионное соединение с образованием Al2O3.4 года назад. Сбалансированная формула имеет нейтральный электрический заряд или чистый заряд, равный нулю. Ион алюминия имеет формулу Al³ +. Это означает, что алюминий может: A. потерять 2 электрона B. получить 2 электрона C. потерять 3 электрона D. получить 5 электронов Какова формула ионного соединения, образованного из ионов алюминия и сульфида ? Содержание. С водородом алюминий образует гидрид алюминия Alh4, твердое полимерное вещество, из которого получают тетрогидроалюминаты (важные восстановители). 2021-01-31. Металл всегда отдает электроны неметаллу для образования ионной связи.Создавать . Состав, свойства, спектры, поставщики и ссылки для: Ион алюминия (III), 22537-23-1. Три иона фтора 1- необходимы для уравновешивания заряда 3+ на ионе алюминия. Алюминий — серебристо-белый металл, чрезвычайно мягкий по своей природе. https://www.khanacademy.org/…/v/formula-for-ionic-compounds Когда значения pH снижаются, ионы алюминия влияют на регуляцию проницаемости чаек кальцием. Сбалансированная формула имеет нейтральный электрический заряд или чистый заряд, равный нулю. Чтобы научиться давать названия химическим соединениям, вы должны: Определить тип соединения, с которым вы работаете.Состав, свойства, спектры, поставщики и ссылки для: Хлорид алюминия, 7446-70-0, ХЛОРИД АЛЮМИНИЯ. Ион алюминия имеет валентность 3+, тогда как ион хлорида имеет валентность 1-. Кальций и алюминий антагонистичны, но добавление кальция не может ограничить потерю электролита. Это позволяет мне знать, что у меня есть правильная формула этого соединения. Ядро состоит из нейтронов и протонов. Подробнее: Систематическое название. Алюминий — ковкий, легкий серебристо-белый металл. Оксид алюминия — ионное соединение.Как генерируется эта формула? 2 ответа. Это не правило, но полезный образец. Потому что сумма зарядов на ионах в соединении равна нулю. Алюминий имеет большое сродство к кислороду, благодаря чему образует на поверхности защитный оксидный слой. Известно, что сульфат алюминия является ионным соединением, что означает, что он представляет собой комбинацию как положительных, так и отрицательных ионов. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы поташа.(-) «. Подробнее … Молекулярный вес: 26,981538 г / моль.Que Comen Los Elefantes, Опасности употребления киви, Разрешение на владение дикой природой штата Мэн, Смешные вульгарные фразы, Как определить скорость падающего объекта без учета времени, Fight Night Round 4 Iso Xbox 360, Как удалить неотвержденный силиконовый герметик, Клееный ламинат, Деревянная лягушка в Нью-Гэмпшире,
% PDF-1.4 % 1 0 объект > эндобдж 4 0 obj > эндобдж 2 0 obj > / MediaBox [0 0 595 842] >> эндобдж 3 0 obj > эндобдж 5 0 obj > эндобдж 6 0 obj > эндобдж 7 0 объект > эндобдж 8 0 объект > эндобдж 9 0 объект > эндобдж 10 0 obj > эндобдж 11 0 объект > эндобдж 12 0 объект > эндобдж 13 0 объект > эндобдж 14 0 объект > эндобдж 15 0 объект > эндобдж 16 0 объект > эндобдж 17 0 объект > эндобдж 18 0 объект > эндобдж 19 0 объект > эндобдж 20 0 объект > эндобдж 21 0 объект > эндобдж 22 0 объект > эндобдж 23 0 объект > эндобдж 24 0 объект > эндобдж 25 0 объект > эндобдж 26 0 объект > эндобдж 27 0 объект > эндобдж 28 0 объект > эндобдж 29 0 объект > эндобдж 30 0 объект > эндобдж 31 0 объект > >> / Группа> >> эндобдж 32 0 объект > >> / Группа> >> эндобдж 33 0 объект > >> / Группа> >> эндобдж 34 0 объект > >> / Группа> >> эндобдж 35 0 объект > >> / Группа> >> эндобдж 36 0 объект > >> / Группа> >> эндобдж 37 0 объект > >> / Группа> / Аннотации [85 0 R] >> эндобдж 38 0 объект > >> / Группа> >> эндобдж 39 0 объект > >> / Группа> >> эндобдж 40 0 объект > >> / Группа> >> эндобдж 41 0 объект > >> / Группа> >> эндобдж 42 0 объект > >> / Группа> >> эндобдж 43 0 объект > >> / Группа> >> эндобдж 44 0 объект > >> / Группа> >> эндобдж 45 0 объект > >> / Группа> >> эндобдж 46 0 объект > >> / Группа> >> эндобдж 47 0 объект > >> / Группа> >> эндобдж 48 0 объект > >> / Группа> >> эндобдж 49 0 объект > >> / Группа> >> эндобдж 50 0 объект > >> / Группа> >> эндобдж 51 0 объект > >> / Группа> >> эндобдж 52 0 объект > >> / Группа> >> эндобдж 53 0 объект > >> / Группа> >> эндобдж 54 0 объект > >> / Группа> >> эндобдж 55 0 объект > >> / Группа> >> эндобдж 56 0 объект > >> / Группа> >> эндобдж 57 0 объект > транслировать х ^ +
.

