Алюминий сульфат и другие соединения алюминия в природе и жизни человека :: SYL.ru
В повседневной жизни каждый из нас ежеминутно сталкивается с умопомрачительным количеством химических веществ, как природных, так и созданных самим человеком. Остановимся на двух химических соединениях: сульфат алюминия, гидроксид алюминия. Что это такое и почему стоит обратить на них внимание?
Чтобы познакомиться, нужно заземлиться
Алюминий сульфат (глинозём) наряду с алюмосиликатами и различными видами глины составляет основную массу земной коры. Это позволяет алюминию занимать первое место среди металлов по распространенности на Земле. В природе сульфат алюминия, формула которого Al2(SO4)*18H2O, является кристаллогидратом и представляет собой растворимые в воде кристаллы белого цвета с серым, голубым или розовым оттенком.
В отличие от алюминия сульфата, гидроксид его представляет собой белое твердое вещество, нерастворимое в воде. Алюминий сульфат, гидроксид алюминия, каолинит широко распространены. Их добывают в Сибири, Крыму, Китае, Японии, а также в странах Центральной и Южной Америки.
Их добывают в Сибири, Крыму, Китае, Японии, а также в странах Центральной и Южной Америки.
Зри в пробирку
Чтобы познать истину, определим, какими же химическими свойствами обладают сульфат и гидроксид Al. Перефразируем крылатое выражение Козьмы Пруткова «Зри в корень!» на более прагматичное: «Зри в пробирку!»
Начнем с гидроксида Al, представив это вещество в образе двуликого Януса. Совсем немного химических соединений способны одновременно реагировать и с кислотами, и со щелочами. Такая «двуликость» в химии называется амфотерностью. Так, в реакциях гидроксида алюминия с кислотой получаем средние соли.
Рассматривая взаимодействие гидроксида алюминия Al(OH)3 со щелочами, будем внимательны и учтем условия, при которых происходит реакция. Именно от них будут зависеть конечные продукты:
Сам же гидроксид Al(OH)3 получают в лаборатории непрямым путем, то есть не из оксида и воды, что в этом случае невозможно, а из соли алюминия. Для этого берут раствор сульфата алюминия и действуют на него щелочью, например едким натром, осторожно вливая его по каплям.
Для этого берут раствор сульфата алюминия и действуют на него щелочью, например едким натром, осторожно вливая его по каплям.
В результате в пробирке образуется студенистый осадок белого цвета – гидроксид Al(OH)3 .
Суммируя все выше приведенные реакции, доказывающие амфотерность гидроксида алюминия, сделаем вывод: в кислой среде химическое равновесие смещается в сторону образования солей Al, а в щелочной – в сторону образования метаалюминатов или гидроксоалюминатов.
Поддерживающий традиции
Отдохнем от сложностей «двуликости» амфотерного гидроксида алюминия и обратимся к традиционной средней соли – сульфату алюминия. Никаких отступлений от правил. Растворы средних солей реагируют со щелочами, с кислотами, с другими солями, с металлами, стоящими в ряду Бекетова (ряд напряжений металлов) до метала, ион которого содержится в молекуле соли. Например, алюминий сульфат в растворе будет реагировать с литием, калием, кальцием, натрием и магнием. Подтвердим это уравнениями реакций.
Сульфат алюминия, формула которого Al2(SO4)3, является продуктом взаимодействия слабого основания гидроксида алюминия Al(OH)3 и сильной сульфатной кислоты H2SO4. Поэтому в водном растворе он легко гидролизирует. Избыток ионов водорода H+ обнаруживается с помощью индикатора лакмуса, меняющего свой синий цвет в растворе сульфата алюминия на красный. Таким образом, мы устанавливаем, что раствор сульфата алюминия имеет кислую реакцию.
Можно было бы продолжить углубляться в приятные и волнующие для химика-эстета подробности данной темы, если бы вдали не замаячило подозрительно-скептическое лицо с вопросом: «Ну и что я с этого буду иметь?»
Они придут на помощь
Чтобы развеять все сомнения, скажем, что вы уже имеете массу полезных и даже жизненно необходимых вещей, благодаря таким соединениям, как алюминий сульфат, гидроксид алюминия и другим алюминийсодержащим реагентам. В первую очередь Al(OH)3 используют для очистки жесткой воды. После данного процесса вода становится прозрачнее и светлее и освобождается от солей, делающих ее жесткой.
После данного процесса вода становится прозрачнее и светлее и освобождается от солей, делающих ее жесткой.
В стремлении быть всегда красивыми и ухоженными нам помогают лосьоны, гели, тоники. А ведь они тоже содержат алюминий сульфат. Широко рекламируемая инновация в индустрии дезодорантов-антиперспирантов под названием «кристаллы свежести» – не что иное, как алюмокалиевые квасцы, компонентом которых является алюминий сульфат. Соединения алюминия имеют обволакивающую способность и поэтому используются также в производстве разноцветных хлопчатобумажных тканей и в фармакологии.
Структура сульфата алюминия (Al2 (SO4) 3), применение, виды, токсичность / химия | Thpanorama
сульфат алюминия неорганическая соль алюминия формулы Al2(SO4)3, это обычно выглядит как белое твердое вещество с блестящими кристаллами. Цвет соединения будет зависеть от его концентрации железа и любых других примесей. Существует два основных типа сульфата алюминия: A и B.
На нижнем изображении показаны белые кристаллы гидратированного сульфата алюминия. Можно отметить отсутствие коричневых окрасок, указывающих на ионы железа в кристаллической решетке..
Сульфат алюминия — это соль, которая очень хорошо растворяется в воде, и в природе редко можно найти ее в безводной форме. Обычно гидратируется в форме октадекагидрата сульфата алюминия [Al2(SO4)3.18H2O] или гексадекагидрат [Al2(SO4)3.16H2O].
Кроме того, он может образовывать двойные соли с калием и аммонием, соединения, известные как квасцы. Частично это может быть связано со сродством воды в гидратах удерживать другие ионы, кроме алюминия.
Сульфат алюминия может разлагаться под действием воды в гидроксиде алюминия и серной кислоте. Это свойство позволило использовать его в качестве подкислителя почв.
Это также токсичное соединение, особенно при контакте с его порошком. Тем не менее, он имеет бесконечное число применений и применений, которые идут от очистки воды с помощью метода коагуляции, происходящего через его использование в нескольких отраслях промышленности, до его использования в терапевтических целях. .
.
индекс
- 1 структура
- 2 Для чего это (использует)
- 2.1 Коагуляция или флокуляция воды
- 2.2 Использование в качестве протравы чернил и при разработке бумаги
- 2.3 Промышленное использование
- 2.4 Лекарственное и терапевтическое использование
- 2.5 Другое использование
- 3 Производство сульфата алюминия
- 4 Типа
- 5 Токсичность
- 6 Ссылки
Сульфат алюминия имеет соотношение двух катионов Al3+ на каждые три аниона ТАК42- (верхнее изображение), что можно наблюдать непосредственно в его химической формуле Al2(SO4)3.
Обратите внимание, что Аль3+ они сероватые, а ТАК42- они желтые (для атома серы) и красные (для атомов кислорода).
Проиллюстрированная структура соответствует безводной форме Al2(SO4)3, так как ни одна молекула воды не взаимодействует с ионами. В ваших гидратах, однако, вода может быть привлечена к положительным центрам Al3+, или отрицательным SO тетраэдров42- через водородные связи (HOH-O-SO32-).
В ваших гидратах, однако, вода может быть привлечена к положительным центрам Al3+, или отрицательным SO тетраэдров42- через водородные связи (HOH-O-SO32-).
Аль2(SO4)3H 18H2Или, например, он содержит 18 молекул воды в своей твердой структуре. Некоторые из них могут находиться в прямом контакте с Алом3+ или с SO42-. Другими словами: сульфат алюминия может иметь внутреннюю или внешнюю координационную воду.
Кроме того, его структура может вместить другие катионы, такие как Fe3+, не доступно+, К+, и т.д. Но для этого необходимо присутствие большего количества анионов ТАК42-. Для чего? Для нейтрализации увеличения положительных зарядов за счет металлических примесей.
Сульфат алюминия может иметь много структур, хотя его гидраты имеют тенденцию принимать моноклинную кристаллическую систему.
Физико-химические свойствавнешний видОн выглядит как твердое вещество с блестящими белыми кристаллами, гранулами или порошком.
342,31 г / моль (безводный).
запахБез запаха
ароматСладкий вкус умеренно вяжущий.
Точка плавления770ºС безводная форма (86,5ºС октадекагидратада)
Растворимость в воде31,2 г / 100 мл при 0 ° С; 36,4 г / 100 мл при 20 ° С и 89 г / 100 мл при 100 ° С.
плотностьОт 2,67 до 2,71 г / см3.
растворимостьСлабо растворим в этиловом спирте.
Давление параПо сути ноль.
стабильностьСтабильный в воздухе.
разложениеПри нагревании примерно до точки плавления он может разлагаться, выделяя, в частности, оксид серы, токсичный газ..
коррозионная активностьРастворы сульфата алюминия вызывают коррозию алюминия. Также соединение может разъедать металлы в присутствии влаги.
3,3 до 3,6. И его pH составляет 2,9 или более в 5% водном растворе.
Для чего это (использует)Коагуляция или флокуляция воды-При смешивании с водой (пригодной для питья, подачи или отходов) сульфат алюминия вызывает образование гидроксида алюминия, который образует комплексы с соединениями и частицами в растворе, ускоряя их осаждение, что в отсутствие обработки сульфатом алюминия может привести к долгое время.
-Сульфат алюминия также используется при очистке воды в бассейне, что делает его более привлекательным для использования.
-Благодаря использованию сульфата алюминия вода получается без мутности и цвета, что повышает ее способность к обработке за счет облегчения очистки воды. К сожалению, этот метод очистки может привести к незначительному увеличению концентрации алюминия в воде..
-Алюминий является очень токсичным металлом, который накапливается в коже, мозге и легких, вызывая серьезные нарушения. Кроме того, неизвестно, какую функцию он выполняет в живых существах..
Кроме того, неизвестно, какую функцию он выполняет в живых существах..
-Европейский Союз требует, чтобы максимально допустимый предел содержания алюминия в воде не превышал 0,2 мг / л. Между тем, Агентство по охране окружающей среды США требует, чтобы максимальный предел загрязнения воды алюминием не превышал 0,05-0,2 мг / л..
-Очистка сточных вод или использование сульфата алюминия позволяет экономно удалять или уменьшать содержание фосфора в них..
Использование в качестве протравы чернил и при разработке бумаги-Сульфат алюминия использовался в качестве протравы для красителей или чернил, помогая закрепиться на красящем материале. Его фиксирующее действие обусловлено Al (OH)3, чья желатиновая консистенция способствует адсорбции красителей на текстиле.
-Хотя он использовался примерно с 2000 г. до н.э. для описанной цели, только органические красители требуют морилки. Синтетические красители, с другой стороны, не требуют протравы для выполнения своей функции.
-Это было вытеснено из производства бумаги, но это все еще используется в производстве бумажной массы. Удаляет примеси, а также используется для связывания материалов, нейтрализации зарядов и калибровки канифоли.
Промышленное использование-Он используется в строительной промышленности для ускорения схватывания бетона. Кроме того, он используется в гидроизоляции зданий.
-В производстве мыла и жиров он используется в производстве глицерина.
-Он используется в нефтяной промышленности при производстве синтетических катализаторов, которые используются во время эксплуатации.
-Он используется в фармацевтической промышленности в качестве вяжущего при приготовлении лекарств и косметики.
-Вмешивается в производство красителей, таких как кармин. Он также используется в качестве красителя при производстве синтетических каучуков бутадиен-стирола..
-В сахарной промышленности его используют в качестве очистителя мелассы для сахарного тростника. .
.
-Используется при изготовлении дезодорантов. Почему? Потому что это вызывает сужение протоков потовых желез, ограничивая тем самым накопление пота, необходимой среды для роста бактерий, вызывающих запах.
-Используется при дублении кожи, необходим процесс его использования. Кроме того, он используется в производстве удобрений.
-Используется в качестве добавки при приготовлении красок, адгезивов и герметиков, а также в средствах для чистки и ухода за мебелью..
Лечебное и терапевтическое использование-Сульфат алюминия является иммунологическим адъювантом. Следовательно, он выполняет функцию обработки антигенов таким образом, что при высвобождении в месте их действия они производят большую продукцию антител к антигенам, которые были инокулированы..
-Адъювант Фрейнда и БЦЖ, а также другие адъюванты, в том числе эндогенные, такие как интерлейкины, неспецифичны для антигенов, что позволяет увеличить радиус действия иммунитета. Это позволило разработать вакцины против многочисленных заболеваний.
-Коагулирующее действие сульфата алюминия позволило устранить многочисленные вирусы в очищенной воде, среди прочего: Q бета, MS2, T4 и P1. Результаты показывают, что обработка воды сульфатом алюминия приводит к инактивации таких вирусов..
-Сульфат алюминия используется в форме карандаша или в виде порошка при лечении мелких поверхностных ран или ссадин, возникающих при бритье.
-Он используется в производстве ацетата алюминия, соединения, используемого при лечении некоторых заболеваний уха. Он также использовался без особого успеха для смягчения последствий укусов муравьев..
-Растворы сульфата алюминия используются в концентрации от 5 до 10% при местном лечении язв, что позволяет контролировать их секрецию.
-Вяжущее действие сульфата алюминия сокращает поверхностные слои кожи, коагулируя белки и заживляя раны.
Другое использование-Сульфат алюминия помогает контролировать чрезмерный рост водорослей в прудах, озерах и в потоках воды. Он также используется для удаления моллюсков, в том числе испанского слизняка.
Он также используется для удаления моллюсков, в том числе испанского слизняка.
-Садовники применяют это соединение для подкисления щелочных почв. При контакте с его водой сульфат алюминия разлагается на гидроксид алюминия и разбавленную серную кислоту. Затем гидроксид алюминия выпадает в осадок, оставляя серную кислоту в растворе.
-Подкисление почв из-за серной кислоты визуализируется очень творчески, благодаря наличию растения под названием гортензия, чьи цветы становятся синими в присутствии кислой почвы; то есть они чувствительны и реагируют на изменения pH.
-Сульфат алюминия участвует в производстве пены для борьбы с огнем и борьбы с ним. Как? Реагирует с бикарбонатом натрия с выделением СО2. Этот газ блокирует доступ O2 до места сгорания материала; и, следовательно, прекращение огня, которое развивалось.
Производство сульфата алюминияСульфат алюминия синтезируется путем взаимодействия обогащенного алюминием соединения, такого как бокситовая руда, с серной кислотой при повышенных температурах. Следующее химическое уравнение представляет реакцию:
Следующее химическое уравнение представляет реакцию:
в2О3 + H2SW4 -> Ал2(SO4)3 + 3 ч2О
Сульфат алюминия также может образовываться в результате реакции нейтрализации между гидроксидом алюминия и серной кислотой в соответствии со следующей реакцией:
2 Al (OH)3 + 3 ч2SW4 + 12 ч2O -> Al2(SO4)3.18H2О
Серная кислота вступает в реакцию с алюминием, образуя сульфат аммония и выделяя молекулы водорода в виде газа. Реакция схематизируется следующим образом:
2 Al + 3 H2SW4 -> Ал2(SO4)3 + 3 ч2
типСульфат алюминия подразделяется на два типа: тип A и тип B. В сульфате алюминия типа A твердые вещества имеют белый цвет и имеют концентрацию железа менее 0,5%. .
.
В сульфате алюминия типа B твердые вещества коричневые и имеют концентрацию железа менее 1,5%..
Есть отрасли, производящие сульфат алюминия, которые имеют различные критерии для их классификации. Так, промышленность сообщает, что для его приготовления сульфата алюминия типа А максимальная концентрация железа составляет 0,1% в виде оксида железа. В то время как для типа B они указывают максимальную концентрацию железа 0,35%.
токсичность-Сульфат алюминия — это соединение, которое оказывает токсическое действие при контакте с пылью, вызывая раздражение кожи, а в случаях частого контакта — дерматит..
-В глазах это вызывает сильное раздражение, даже вызывает постоянные травмы..
-Вдыхание вызывает раздражение носа и горла, что может вызвать кашель и сыпь.
-Его прием вызывает раздражение желудка, тошноту и рвоту.
-Существуют токсические эффекты, которые, хотя они не связаны непосредственно с сульфатом алюминия, косвенно связаны с их использованием. Это случай определенных токсических эффектов алюминия, вызванных использованием сульфата алюминия при очистке воды..
Это случай определенных токсических эффектов алюминия, вызванных использованием сульфата алюминия при очистке воды..
-Пациенты, которые подвергаются хроническому диализу с использованием солей, приготовленных в очищенной воде, с использованием сульфата алюминия, испытывают очень серьезные нарушения здоровья. Среди этих нарушений у нас есть анемия, деменция при диализе и рост заболеваний костей..
ссылки- Wikipedia. (2018). Сульфат алюминия Взято из: en.wikipedia.org
- Арис Индастриал Раствор сульфата алюминия типа А и В. Взято с сайта: aris.com.pe
- Кристофер Бойд (9 июня 2014 г.) Лучшие промышленные применения для сульфата алюминия. Взято из: chemservice.com
- PubChem. (2018). Сульфат алюминия безводный. Взято из: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals (20 августа 2009 г.) Лист безопасности из сульфата алюминия. [PDF]. Взято из: andesia.com
- Химическая Книга. (2017). Сульфат алюминия. Взято из: chemicalbook.com
Сульфат алюминия — Al2(SO4)3 — Kemicalinfo
Сульфат алюминия представляет собой неорганическую соль, обычно используемую в качестве коагулянта в процессах очистки воды и флокулянта при очистке жидкостей.
| IUPAC Name | Алюминиевый сульфат |
| Молекулярная формула | AL2 (SO4) 3 |
| CAS № | 10043-01-3 |
| 9000. Synonymin7. квасцы для торта, квасцы для изготовления бумаги, квасцы для фильтра | |
| ИнЧИ | ИнЧИ=1S/2Al.3h3O.14h3SO4/c;;31-5(2,3)4/h;;(h3,1,2,3,4)/q2+3;/ p-3 |
Формула сульфата алюминия
Химическая формула сульфата алюминия: Al2(SO4)3. Эта формула представляет собой соотношение атомов в сульфате алюминия и используется для обозначения состава соединения. Формулу также можно использовать в химических расчетах, таких как определение молярной массы или количества молей сульфата алюминия в данном образце. Химическая формула сульфата алюминия является удобным способом представления состава материала и широко известна в научном сообществе. Кроме того, формулу можно использовать для прогнозирования химических и физических свойств сульфата алюминия, таких как его растворимость в воде, реакционная способность с другими соединениями и стабильность в различных условиях.
Молярная масса сульфата алюминия
Молярная масса сульфата алюминия составляет 342,15 г/моль. Это значение важно в различных химических и физических расчетах, включая определение молярных концентраций, стехиометрии реакции и закона идеального газа. Молярная масса рассчитывается путем сложения атомных масс всех атомов в химической формуле сульфата алюминия, которая представляет собой Al2(SO4)3. Молярную массу также можно использовать для преобразования массы в количество молей для данного образца сульфата алюминия.
Температура кипения сульфата алюминия
Температура кипения сульфата алюминия точно не определена, поскольку он разлагается до кипения. Сульфат алюминия представляет собой гидратированную соль и при нагревании теряет воду гидратации и разлагается на оксид алюминия и серную кислоту. Температура разложения может составлять от 120°С до 140°С в зависимости от степени гидратации. Наличие примесей в образце также может влиять на температуру разложения.
Точка плавления сульфата алюминия
Температура плавления сульфата алюминия составляет приблизительно 1200°C. Такая высокая температура обусловлена сильными ионными связями между ионами алюминия и серы. Сульфат алюминия представляет собой кристаллическое твердое вещество при комнатной температуре и имеет четко определенную кристаллическую структуру, что способствует его высокой температуре плавления. Температура плавления сульфата алюминия важна для определения условий обработки, необходимых для синтеза и очистки материала.
Сульфат алюминия Плотность г/мл
Плотность сульфата алюминия составляет от 1,8 до 2,0 г/мл. Это значение может варьироваться в зависимости от степени гидратации и наличия примесей в образце. Плотность сульфата алюминия является важным физическим свойством, которое можно использовать для расчета объема данной массы материала. Плотность сульфата алюминия также полезна при определении концентрации раствора, поскольку позволяет рассчитать массу растворенного вещества на единицу объема растворителя. 2-). Катионы алюминия координируются с шестью сульфатными анионами в гексагональной плотноупакованной структуре, удерживаемой вместе сильными ионными связями. Кристаллическая структура сульфата алюминия влияет на его физические свойства, такие как температура плавления и растворимость.
2-). Катионы алюминия координируются с шестью сульфатными анионами в гексагональной плотноупакованной структуре, удерживаемой вместе сильными ионными связями. Кристаллическая структура сульфата алюминия влияет на его физические свойства, такие как температура плавления и растворимость.
| Appearance | Crystalline Solid |
| Specific Gravity | 1.8 to 2.0 g/mL |
| Color | White |
| Odor | Odorless |
| Molar Mass | 342.15 g /моль |
| Плотность | от 1,8 до 2,0 г/мл |
| Температура плавления | 770°C |
| Температура кипения0008 | |
| Flash Point | Not applicable |
| Water Solubility | Soluble in water |
| Solubility | Soluble in water |
| Vapour Pressure | Not well defined |
| Vapour Density | Не точно определено |
| pKa | Неточно определено |
| pH | Нейтральный |
Сульфат алюминия является опасным веществом, с которым следует обращаться осторожно. Вдыхание его пыли может вызвать раздражение дыхательных путей и кашель. Контакт с кожей или глазами может вызвать покраснение, зуд и жжение. Проглатывание сульфата алюминия может вызвать раздражение желудочно-кишечного тракта, включая тошноту, рвоту и диарею. При попадании внутрь в больших количествах это может привести к более серьезным проблемам со здоровьем, таким как депрессия центральной нервной системы и повреждение почек. Поэтому важно носить средства индивидуальной защиты, такие как перчатки и очки, при работе с сульфатом алюминия. Кроме того, рабочая зона должна хорошо проветриваться, чтобы снизить риск вдыхания пыли. В случае попадания на кожу или в глаза пораженный участок следует промыть большим количеством воды в течение не менее 15 минут и немедленно обратиться за медицинской помощью.
Вдыхание его пыли может вызвать раздражение дыхательных путей и кашель. Контакт с кожей или глазами может вызвать покраснение, зуд и жжение. Проглатывание сульфата алюминия может вызвать раздражение желудочно-кишечного тракта, включая тошноту, рвоту и диарею. При попадании внутрь в больших количествах это может привести к более серьезным проблемам со здоровьем, таким как депрессия центральной нервной системы и повреждение почек. Поэтому важно носить средства индивидуальной защиты, такие как перчатки и очки, при работе с сульфатом алюминия. Кроме того, рабочая зона должна хорошо проветриваться, чтобы снизить риск вдыхания пыли. В случае попадания на кожу или в глаза пораженный участок следует промыть большим количеством воды в течение не менее 15 минут и немедленно обратиться за медицинской помощью.
| Hazard Symbols | Xi – Irritant | |
| Safety Description | S24/25 – Avoid contact with skin and eyes | |
| UN Ids | UN3077 – Environmental Hazard | |
| HS Code | 2833. 30.00 30.00 | |
| Класс опасности | 8 — Коррозийное вещество | |
| Группа упаковки | III | |
| Токсичность | Низкий или умеренный токсичность, если внедрены, или в контакте с кожей или глаз | 0008 |
Сульфат алюминия можно синтезировать различными методами, включая осаждение и реакцию с серной кислотой.
Одним из методов синтеза является метод осаждения, который включает смешивание раствора солей алюминия с серной кислотой. Эта реакция приводит к образованию сульфата алюминия, который осаждается из раствора в виде твердого вещества. Затем твердое вещество можно отфильтровать, промыть и высушить с получением чистого сульфата алюминия.
Другим методом синтеза является метод реакции, который включает смешивание гидроксида алюминия или оксида алюминия с серной кислотой. В результате этой реакции образуются сульфат алюминия и вода. Затем продукт можно очистить путем промывки и сушки.
Затем продукт можно очистить путем промывки и сушки.
В обоих методах чистота конечного продукта может быть улучшена за счет использования исходных материалов высокой чистоты и тщательного контроля условий реакции. Чистоту сульфата алюминия можно проверить, проанализировав его физические и химические свойства, такие как молярная масса, температура плавления и растворимость в воде.
В целом синтез сульфата алюминия представляет собой относительно простой процесс, который можно проводить в лабораторных или промышленных условиях, в зависимости от желаемого масштаба производства. Выбор метода синтеза будет зависеть от наличия исходных материалов, желаемой чистоты продукта и желаемого масштаба производства.
Сульфат алюминия Использование Промышленность использует сульфат алюминия из-за его универсальности в различных областях, таких как очистка воды, производство бумаги и сельское хозяйство. При очистке воды это вещество действует как коагулянт и очищает питьевую воду, вызывая агрегацию примесей и образование более крупных частиц, которые можно легко отфильтровать. В бумажной промышленности сульфат алюминия используется в качестве наполнителя и связующего для повышения прочности и белизны бумаги, а также для регулирования уровня pH в целлюлозе. В сельском хозяйстве сульфат алюминия снижает рН почвы и повышает кислотность, обеспечивая растения необходимыми питательными веществами, такими как сера и алюминий. Сульфат алюминия также имеет дополнительные применения, в том числе для дубления кожи, огнеупорного текстиля и в качестве флокулянта при очистке сточных вод. Таким образом, сульфат алюминия играет важную роль в современной жизни, выполняя множество функций в различных отраслях промышленности.
В бумажной промышленности сульфат алюминия используется в качестве наполнителя и связующего для повышения прочности и белизны бумаги, а также для регулирования уровня pH в целлюлозе. В сельском хозяйстве сульфат алюминия снижает рН почвы и повышает кислотность, обеспечивая растения необходимыми питательными веществами, такими как сера и алюминий. Сульфат алюминия также имеет дополнительные применения, в том числе для дубления кожи, огнеупорного текстиля и в качестве флокулянта при очистке сточных вод. Таким образом, сульфат алюминия играет важную роль в современной жизни, выполняя множество функций в различных отраслях промышленности.
Вопросы:
Какова формула сульфата алюминия?
Химическая формула сульфата алюминия: Al2(SO4)3.
Растворим ли сульфат алюминия?
Да, сульфат алюминия растворим в воде. Он растворяется в воде с образованием раствора ионов алюминия, сульфата и гидроксида. Растворимость сульфата алюминия в воде зависит от температуры, а это означает, что он более растворим при более высоких температурах и менее растворим при более низких температурах. При комнатной температуре сульфат алюминия хорошо растворяется в воде с растворимостью около 20 г на 100 мл воды.
При комнатной температуре сульфат алюминия хорошо растворяется в воде с растворимостью около 20 г на 100 мл воды.
Сульфат алюминия – формула, приготовление, N-фактор, применение, часто задаваемые вопросы
Сульфат алюминия – это химическое соединение, растворимое в воде. Он преимущественно используется в качестве коагулянта при очистке питьевой воды и очистных сооружений. Он также используется в процессе производства бумаги. Безводная структура сульфата алюминия получается из вулканической среды и при добыче угля. Его получают в виде редкого минерала миллосевичита.
Сульфат алюминия также известен как квасцы или квасцы для производства бумаги в определенных отраслях промышленности. Раствор сульфата алюминия выглядит как бесцветная жидкость, а его безводная структура выглядит как кристаллическое твердое вещество. Упомянутые выше формы сульфата алюминия нетоксичны и невзрывоопасны соответственно.
Сульфат алюминия не имеет запаха и имеет сладкий вкус.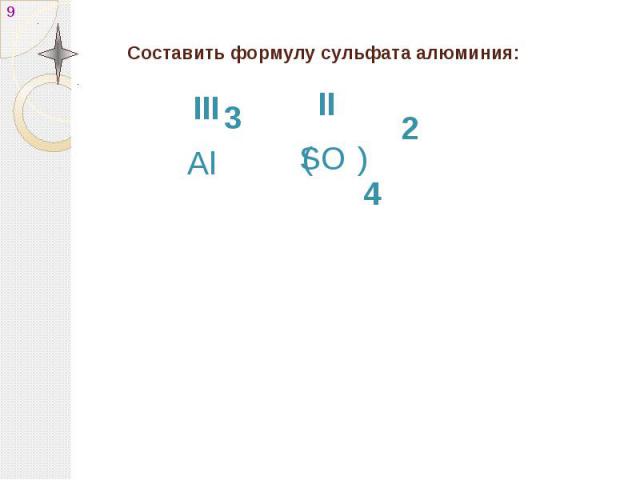 Это водорастворимое химическое соединение, но нерастворимое в этаноле. Сульфат алюминия выделяет смертельные пары оксида серы в процессе разложения.
Это водорастворимое химическое соединение, но нерастворимое в этаноле. Сульфат алюминия выделяет смертельные пары оксида серы в процессе разложения.
также прочитал —
- . представленный как — Al 2 (SO 4 ) 3
Трисульфат диалюминия или фильтрующие квасцы — некоторые из других терминов, используемых для обозначения сульфата алюминия.
Молярная масса сульфата алюминия составляет 342,15 г/см 3 .
Это формула сульфата алюминия.
Приготовление:-
Сульфат алюминия можно получить в лаборатории следующим методом-
Его также можно получить нагреванием алюминия в растворе серной кислоты.
Квасцовые сланцы содержат пирит железа, силикат алюминия и несколько битуминозных элементов и подвергаются процессу обжига, при котором образуется серная кислота, которая воздействует на глину с образованием сульфата алюминия.
 Аналогичное требование к условиям предъявляется при выветривании. процесс; это еще один процесс, используемый для производства сульфата алюминия.
Аналогичное требование к условиям предъявляется при выветривании. процесс; это еще один процесс, используемый для производства сульфата алюминия.Извлеченная масса теперь систематически удаляется водой и готовится раствор сульфата алюминия с требуемой плотностью. Этот раствор выдерживают в течение некоторого времени для разделения образовавшихся кальция и основного сульфата железа (III). Затем его выпаривают до кристаллизации сульфата железа (II) при охлаждении. Затем его сливают и выпаривают до тех пор, пока он не приобретет требуемый удельный вес, и дают отстояться в течение некоторого времени с последующей декантацией.
Материал слегка прокаливают, затем смешивают с серной кислотой и водой и постепенно нагревают до кипения. Если используется концентрированная кислота, то внешнее тепло или тепло не требуется, поскольку образование сульфата алюминия является экзотермической реакцией. Прозрачный раствор экстрагируют после того, как ему дают постоять в течение определенного периода времени.
 Таким способом из глины или боксита извлекают сернокислый алюминий.
Таким способом из глины или боксита извлекают сернокислый алюминий.Карбонат кальция смешивают с криолитовой рудой и нагревают, что приводит к образованию алюмината натрия. Затем его снова нагревают и осаждают, используя бикарбонат натрия или пропуская через раствор ток двуокиси углерода. Затем осадок растворяют в растворе серной кислоты. Таким образом, сульфат алюминия производится из криолитовой руды.
Сульфат алюминия — Al 2 (SO 4 ) 3 представляет собой соль, состоящую из алюминия, кислорода и серы. Он состоит из положительных и отрицательных ионов, называемых соответственно катионами и анионами. Таким образом, приведенное выше утверждение подтверждает, что сульфат алюминия является ионным соединением. Образование ионов происходит, когда атом или молекула получает или теряет электрон или электроны из оболочки. В большинстве случаев ионные соединения состоят из положительного иона или катиона, являющегося атомом металла, и отрицательного иона или аниона, являющегося радикалом или отрицательным ионом.

Катион и анион в молекуле сульфата алюминия (Al3 + ) и (SO 3- 4 ) соответственно.
Химическая формула сульфата алюминия может быть получена, как описано ниже: он образует дианион
: (SO 3- 4 )
Ионы объединяются таким образом, чтобы образовать электрически нейтральную соль.
Перемножая их валентности крестом, получаем –
Al 2 (SO 4 ) 3
Соединение ионов происходит таким образом, что они образуют электрически нейтральную соль.
Читайте также:
- Решения NCERT для класса 12 по химии Глава 7 Элементы P-блока блочные элементы
N-фактор и эквивалентный вес-
N-фактор — это способность принимать или отдавать электроны. Эта способность отражается изменением степени окисления видов.

Следовательно, n-фактор для солей можно просто определить как произведение зарядов ионов, присутствующих в соли.
Эквивалентная масса определяется как отношение молекулярной массы заряженных ионов к заряду ионных частиц (n-фактор), т.е. отношение молекулярной массы соли к n-фактору.
Теперь найдем n-фактор Al 2 (SO 4 ) 3
Al 2 (SO 4 ) 3 содержащих заряды соединений алюминия и 3 и -2 соответственно.
Эти ионы обозначены как – Al3 + и SO 3- 4 .
Перемножая заряды, имеющиеся в ионах, получаем:0269 4 ) 3 равно 6.
Эквивалентная масса может быть указана как = коэффициент M/n
= M/6
Сульфат алюминия используется:
Сульфат алюминия действует как протрава.
 Это помогает красителю в печати на бумаге или куске ткани.
Это помогает красителю в печати на бумаге или куске ткани.Сульфат алюминия в основном используется в промышленности в качестве коагулянта на водоочистных сооружениях. Сульфат алюминия при смешивании с водой приводит к образованию нескольких форм с различными уровнями ионизации, способных притягивать загрязняющие вещества, присутствующие в воде, и осаждать их.
Сульфат алюминия также находит применение в бумажной промышленности. Он используется для устранения нежелательных посторонних частиц вместе с водой. Он также помогает прилипать к материалам и нейтрализовать заряды при использовании в самой целлюлозе.
Сульфат алюминия помогает регулировать рост водорослей в водоемах. Сульфат алюминия, являющийся кислотным соединением, часто используется садоводами для регулирования pH почвы.
Он также используется в качестве ускорителя и гидроизоляционного агента в производстве бетона.


 Аналогичное требование к условиям предъявляется при выветривании. процесс; это еще один процесс, используемый для производства сульфата алюминия.
Аналогичное требование к условиям предъявляется при выветривании. процесс; это еще один процесс, используемый для производства сульфата алюминия.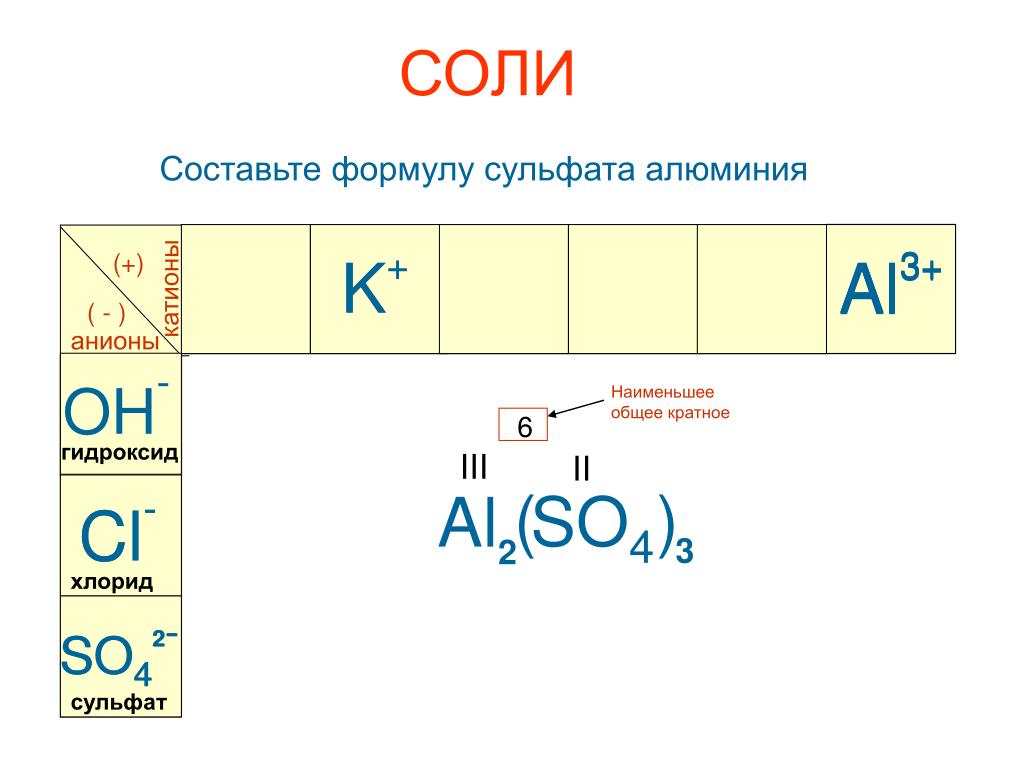 Таким способом из глины или боксита извлекают сернокислый алюминий.
Таким способом из глины или боксита извлекают сернокислый алюминий.

 Это помогает красителю в печати на бумаге или куске ткани.
Это помогает красителю в печати на бумаге или куске ткани.