Объем углекислого газа, его концентрация в воздухе, масса, молекула и физические свойства
Главная » Диоксид углерода
Рубрика: Диоксид углеродаАвтор: admin
Молекула углекислого газа
Углекислый газ представляет собой бесцветный газ, без запаха,который относится к неорганическим веществам. Другие названия вещества — диоксид углерода, двуокись углерода, углекислота, диоксид карбона, угольный ангидрид. Молекула углекислого газа состоит из атома углерода, соединенного двойной ковалентной связью с двумя атомами кислорода.
Электронная формула диоксида углеродаХимическая формула — CO2. Молярная масса углекислоты равна 44,01 г/моль. Расстояние от центра центрального атома углерода до каждого центра атома кислорода равно 116,3 пикометров (10 в -12 степени).
Структурная формула молекулыCO2 при низких температурах и нормальном давлении замерзает и кристаллизуется в белую массу, похожую на снег — «Сухой лед».
В жидкостное состояние газ преобразуется при высоком давлении (73.8 атм.) и средних температурах (+31.1 °C). Это критическая точка углекислоты. Подъем температуры или давления после нее приводит к образованию сверхкритической жидкости (Отсутствует различие между жидкостной и газовой фазой). При снижении температуры до -56.6 °C и давления до 5.2 атм. он остается в жидкостной фазе. Это предельные значения, при изменении которых углекислота переходит в газообразную или твердую фазу (тройная точка состояний).
CO2 не ядовит, но при превышении концентрации в десятки раз, он оказывает удушающее воздействие на живые организмы и вызывает кисловатый вкус и запах (реакция CO 2 со слюной и слизистыми образует угольную кислоту).
Читайте также: Углекислый газ в помещении.
Двуокись углерода превышает по плотности кислород на 37 процентов и равна 1,96 кг/м3 при нормальных условиях среды (температура — 273 К, давление — 101 кПа). Этим физическим свойством объясняется потеря сознания у животных в «Собачьей пещере», расположенной рядом с городом Поццуоли, Италия. Диоксид углерода скапливался из трещин кратеров в нижних слоях пещеры, тем самым достигая больших концентраций. Туристов приводили туда обычно с собакой, которая в пещере с течением времени теряла сознание. Человек обычно не подвергался воздействию CO2, так как дышал воздухом с более высокого уровня.
Плотность углекислоты, воздуха и кислорода.Объем углекислого газа в окружающем нас воздухе, составляет 0,04% (406 ppm – 406 частиц на миллион).
Понравилась статья? Поделиться с друзьями:
Формула Углекислого газа структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: CO2
Химический состав Углекислого газа
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12. 011 011 |
7 | 27,3% |
| O | Кислород | 15.999 | 1 | 72,7% |
Молекулярная масса: 44.009
Диокси́д углеро́да (углеки́слый газ, двуо́кись углеро́да, окси́д углеро́да (IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), без запаха, с химической формулой CO2. Плотность при нормальных условиях 1,98 кг/м³ (тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения. Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %. Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Оксид углерода(IV) — углекислый газ, газ без запаха и цвета, тяжелее воздуха, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации −78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (1 объём углекислого газа в одном объёме воды при 15 °С).
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует с щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Организм человека выделяет приблизительно 1 кг (2,3 фунта) углекислого газа в сутки. Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, и уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он. Углекислый газ (

- Большая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната.
- Около 5 % — 10 % углекислого газа растворено в плазме крови.
- Около 5 % — 10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин).
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа.


 При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению).
При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать CO2, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ. Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона. В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты. Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты. Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290. Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими. Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений. Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде. Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании. Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа.
Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений. Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде. Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании. Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,— таким образом, работа с подобными баллонами может считаться вполне безопасной. Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,— таким образом, работа с подобными баллонами может считаться вполне безопасной. Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе.
Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария. Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан). Поэтому с марта по сентябрь вследствие фотосинтеза содержание CO2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон. Большое количество углекислоты растворено в океане. Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Поэтому с марта по сентябрь вследствие фотосинтеза содержание CO2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон. Большое количество углекислоты растворено в океане. Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Углекислый газ нетоксичен, но по воздействию его повышенных концентраций в воздухе на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. Незначительные повышения концентрации до 2—4 % в помещениях приводят к развитию у людей сонливости и слабости. Опасными концентрациями считаются уровни около 7—10 %, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), в зависимости от концентрации, в течение времени от нескольких минут до одного часа.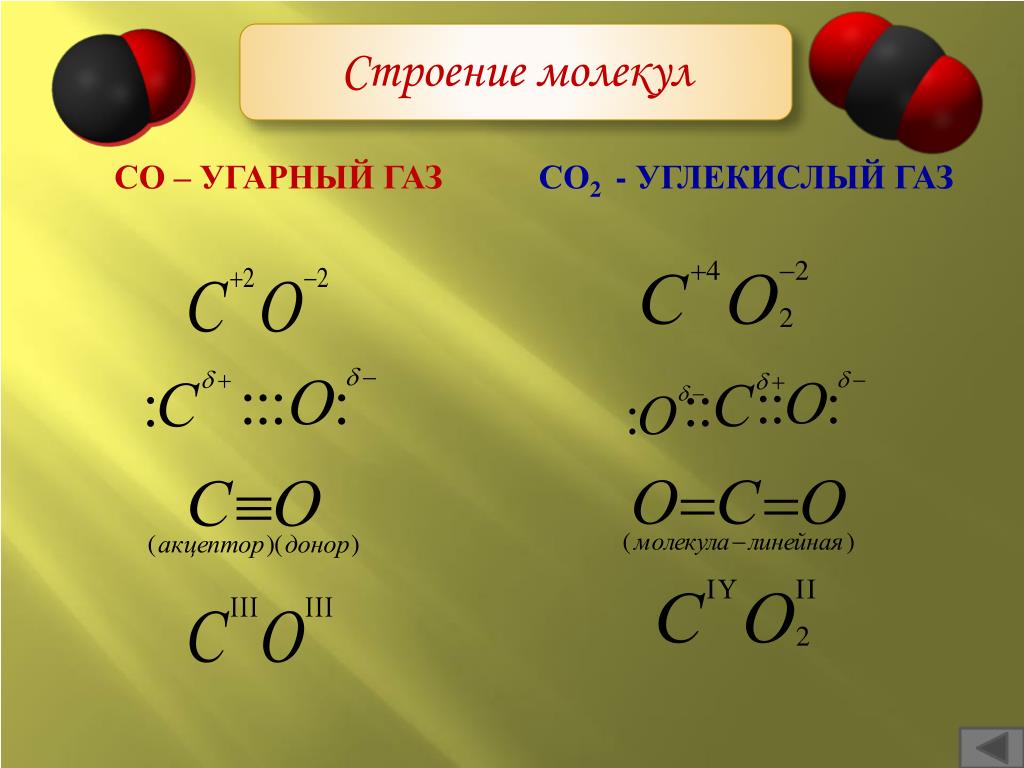 При вдыхании воздуха с высокими концентрациями газа смерть наступает очень быстро от удушья. Хотя, фактически, даже концентрация 5—7 % CO2 не смертельна, уже при концентрации 0,1 % (такое содержание углекислого газа наблюдается в воздухе мегаполисов) люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоких содержаниях кислорода большая концентрация CO2 сильно влияет на самочувствие. Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья и после удаления пострадавшего из загазованной атмосферы быстро наступает полное восстановление здоровья.
При вдыхании воздуха с высокими концентрациями газа смерть наступает очень быстро от удушья. Хотя, фактически, даже концентрация 5—7 % CO2 не смертельна, уже при концентрации 0,1 % (такое содержание углекислого газа наблюдается в воздухе мегаполисов) люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоких содержаниях кислорода большая концентрация CO2 сильно влияет на самочувствие. Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья и после удаления пострадавшего из загазованной атмосферы быстро наступает полное восстановление здоровья.
Углекислый газ – определение и примеры
Углекислый газ
н.
[daɪˈɒksaɪd]
Определение: неорганическое соединение, состоящее из двух атомов кислорода и углерода соединение с химической формулой CO 2 , состоящее из двух атомов кислорода, связанных с одним атомом углерода ковалентной связью, и необходимое для многих биохимических и биологических процессов. Синонимы: оксид углерода, оксид углерода(iv) ангидрид углерода, оксид углерода, углекислый газ, сухой лед (твердая фаза).
Синонимы: оксид углерода, оксид углерода(iv) ангидрид углерода, оксид углерода, углекислый газ, сухой лед (твердая фаза).
Подробнее о углекислом газе
Углекислый газ (CO 2 ) стал первым газом, который отличался от обычного воздуха. Примерно в 1630 году Ян Баптист ван Гельмонт , фламандский химик, обнаружил пар, отличный от воздуха, когда сжигал древесный уголь в закрытом сосуде. Он, они, назвал пар «древесным газом» ( дух сильвестрис ). Он думал, что это элемент или отдельное вещество. 1 В 1756, Джозеф Блэк , шотландский врач, заметил этот газ при нагревании карбоната кальция (CaCO 3 ). Он назвал это «неподвижным воздухом». Он также определил его по выдыхаемому воздуху и описал его как более плотный, чем воздух, слегка кислый. В 1803 году Джон Дальтон (английский химик) предположил, что это вещество состоит из одного атома углерода и двух атомов кислорода. Теперь он называется «двуокись углерода» .
Теперь он называется «двуокись углерода» .
Углекислый газ представляет собой химическое соединение, состоящее из атома углерода и двух атомов кислорода. Каждый из атомов кислорода связан с центральным атомом углерода двойной ковалентной связью. Связь CO имеет длину 116,3 пм. Конфигурация соединения линейная и центросимметричная. Его химическая формула CO 2 .
Углекислый газ представляет собой бесцветный негорючий газ без запаха. Помимо газа, углекислый газ также может находиться в жидком и твердом состояниях. Сухой лед представляет собой замороженный углекислый газ. Возгоняется при -78,5°С при нормальном атмосферном давлении.
Общее описание неорганического соединения — это соединение, в котором отсутствует атомов углерода, атомов и архаично, что оно не производится живым существом ( Витализм ). Тем не менее углекислый газ является исключением из этого общего правила. Углекислый газ имеет атом углерода и может вырабатываться живыми существами посредством дыхания. Однако он не имеет ковалентных связей С-С и С-Н, присутствующих в органических соединениях.
Однако он не имеет ковалентных связей С-С и С-Н, присутствующих в органических соединениях.
Из-за линейности и центросимметричности двуокиси углерода это соединение имеет неполярный . Неравномерное распределение валентных электронов отсутствует. Два атома кислорода имеют равную силу или электроотрицательность, поскольку они оттягивают электронную плотность от углерода на 180°. Таким образом, никакого чистого смещения электронов не происходит ни в каком направлении, и поэтому ни на одном из атомов не возникает суммарного заряда. 2
Двуокись углерода растворима в воде, но только при сохранении давления. Когда он реагирует с водой, он образует угольную кислоту , которая является слабой кислотой. Химическая реакция выглядит следующим образом: CO 2 + H 2 O ⇌ H 2 CO 3 . Таким образом, углекислый газ присутствует не только в атмосфере Земли, но и в океанах, морях, реках, озерах, подземных водах, ледниках и ледяных шапках. Жидкий углекислый газ возвращается в газообразное состояние при падении давления, т.е. при давлениях ниже 5,1 атм.
Жидкий углекислый газ возвращается в газообразное состояние при падении давления, т.е. при давлениях ниже 5,1 атм.
Углекислый газ имеет молярную массу 44,01 г·моль −1 . Его температура плавления составляет -56,6 ° C. При стандартной температуре и давлении его плотность составляет 1,98 кг/м 9 .0038 3 . Его удельный вес составляет 1,53 при 21 ° C. Это негорючий газ.
Углекислый газ в углеродном цикле
Углерод является четвертым по распространенности элементом во Вселенной. Углеродный цикл — это биогеохимический цикл, отражающий углеродный обмен на Земле. Круговорот углерода в литосфере, гидросфере и атмосфере Земли.
В атмосфере углерод существует в основном в виде двуокиси углерода и метана. Эти два фактора являются основными факторами, ответственными за парниковый эффект . Хотя углекислый газ находится рядом с метаном с точки зрения создания парникового эффекта на единицу объема, он дольше живет, чем метан, и встречается в гораздо более высокой концентрации. Таким образом, углекислый газ считается более важным парниковым газом, чем метан. Концентрация углекислого газа в атмосфере с годами росла. Одним из основных факторов, приведших к этому росту, является человеческая деятельность . В начале г. эпохи индустриализации г. концентрация углекислого газа в атмосфере увеличилась примерно до 43%. Во многом это связано со сжиганием ископаемого топлива. Кроме того, к этому добавилась вырубка лесов. Деревья и другие фотосинтезирующие организмы служат основным поглотителем углекислого газа. Без них углекислый газ не утилизировался бы максимально и тем самым накапливался бы в атмосфере. Другими видами деятельности человека являются сжигание биомассы и производство цемента. Деятельность человека является основным источником углекислого газа на Земле.
Хотя углекислый газ находится рядом с метаном с точки зрения создания парникового эффекта на единицу объема, он дольше живет, чем метан, и встречается в гораздо более высокой концентрации. Таким образом, углекислый газ считается более важным парниковым газом, чем метан. Концентрация углекислого газа в атмосфере с годами росла. Одним из основных факторов, приведших к этому росту, является человеческая деятельность . В начале г. эпохи индустриализации г. концентрация углекислого газа в атмосфере увеличилась примерно до 43%. Во многом это связано со сжиганием ископаемого топлива. Кроме того, к этому добавилась вырубка лесов. Деревья и другие фотосинтезирующие организмы служат основным поглотителем углекислого газа. Без них углекислый газ не утилизировался бы максимально и тем самым накапливался бы в атмосфере. Другими видами деятельности человека являются сжигание биомассы и производство цемента. Деятельность человека является основным источником углекислого газа на Земле. На их долю приходится около 29миллиардов тонн углекислого газа в год.
На их долю приходится около 29миллиардов тонн углекислого газа в год.
Другими естественными биогенными источниками диоксида углерода являются биологические процессы, такие как дыхание и разложение органических веществ . При клеточном дыхании кислород поглощается для метаболизма, так что может производиться химическая энергия (например, АТФ). Одним из побочных продуктов клеточного дыхания является углекислый газ. У людей и других животных углекислый газ собирается из клеток и тканей, чтобы в конечном итоге высвобождаться за пределы тела при его выдыхании. Углекислый газ также может образовываться в процессе разложения или разложения органического вещества.
Помимо этих биогенных источников, углекислый газ образуется из других природных источников, таких как вулканы, горячие источники и гейзеры. Вулканы, в частности, выбрасывают от 0,2 до 0,3 миллиарда тонн углекислого газа в год. Карбонатные породы, растворенные в воде и кислотах, также являются источником углекислого газа. Углекислый газ растворяется в различных водоемах при давлении выше 5,1 атм. Он возвращается в атмосферу в виде газа, когда давление падает.
Углекислый газ растворяется в различных водоемах при давлении выше 5,1 атм. Он возвращается в атмосферу в виде газа, когда давление падает.
Биологическое значение
Углекислый газ является одним из основных неорганических соединений, необходимых для жизни. У животных углекислый газ представляет собой химическое соединение, которое накапливается в тканях и удаляется из организма при выдохе животного. Таким образом, это метаболический побочный продукт метаболизма углеводов, особенно клеточного дыхания, при котором углеводы или липиды метаболизируются для синтеза метаболической энергии, такой как АТФ.
Фотоавтотрофные организмы, такие как растения и цианобактерии, используют углекислый газ в качестве важного реагента для производства сахаров путем фотосинтеза. Химическая реакция фотосинтеза выглядит следующим образом:
N CO 2 + N H 2 O → (CH 2 O) N + N O 2 9 0006 9002 Photosyntes. атмосфера.
атмосфера.
Использование диоксида углерода
Диоксид углерода используется в пищевой промышленности, особенно при производстве газированных напитков. Он также используется в качестве охлаждающей жидкости и хладагента. Это также эффективный огнетушитель, поскольку он плотнее воздуха и негорюч.
Читать:
- Углерод – элемент
- Кислород – свойства и биологическое значение
- Фотосинтез – фотолиз и фиксация углерода
- Дыхание — онлайн-руководство по биологии
- Влияние CO2 на рост и развитие организмов
Ссылка
- Углекислый газ Encyclopedia.com. (2000, 1 января). Получено с https://www.encyclopedia.com/science-and-technology/chemistry/compounds-and-elements/carbon-dioxide
- Ашиш. (2017, 26 октября). Углекислый газ (CO2) полярный или неполярный? Получено с https://www.scienceabc.com/pure-sciences/is-carbon-dioxide-co2-polar-or-nonpolar.html .
© Биология онлайн. Контент предоставлен и модерируется редакторами Biology Online Editors
Контент предоставлен и модерируется редакторами Biology Online Editors
Quiz
Выберите лучший ответ.
1. Химический состав углекислого газа
Два углерода и один кислород
Один углерод и один кислород
Один углерод и два кислорода
2. Углекислый газ представляет собой …
элемент
органическое соединение
неорганическое соединение
3. Свойство диоксида углерода
полярный
неполярный
органический
4. Помимо углекислого газа, еще одним фактором, ответственным за парниковый эффект, является . ..
..
азот
метан
кислород
5. В клеточном дыхании углекислый газ является …
реагентом
побочным продуктом
катализатором
Отправьте результаты (необязательно)
Ваше имя
Электронная почта
Следующий
Объясните строение углекислого газа?
Последняя обновленная дата: 13 февраля 2023 г.
•
Общее представление: 184,5K
•
Просмотры сегодня: 3,72K
Ответ
Проверено
184.5K+ виды
Hint: 184.5K+ OF
Hint: . углекислый газ $ C{O_2} $. В природе это бесцветный газ без запаха. Он состоит из атомов углерода, ковалентно связанных с атомами кислорода. 92} $ гибридизирован. Углекислый газ представляет собой ковалентное соединение
углекислый газ $ C{O_2} $. В природе это бесцветный газ без запаха. Он состоит из атомов углерода, ковалентно связанных с атомами кислорода. 92} $ гибридизирован. Углекислый газ представляет собой ковалентное соединение
. Две образующиеся связи полярны, так как кислород более электроотрицательный, чем углерод. Но из-за компенсации дипольного момента молекула в целом неполярна.
Структура Льюиса двуокиси углерода выглядит следующим образом:
Связи выглядят как параллельные линии между атомами углерода и кислорода.
Свойства двуокиси углерода:
— Углекислый газ представляет собой бесцветный газ без запаха.
— Плотность углекислого газа на $53\%$ выше, чем у воздуха.
Примечание:
Углекислый газ составляет менее $ 1\% $ в атмосфере, тем не менее, он является важным парниковым газом. Сгорание бензина и дизельного топлива в автомобилях, дыхание живых существ увеличивает количество углекислого газа в воздухе.
