Формула Пероксида водорода структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: H2O2
Химический состав Пероксида водорода
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1,008 | 2 | 5,9% |
| О | Кислород | 15,999 | 2 | 94,1% |
Молекулярная масса: 34,014
Пероксид водорода (перекись водорода) H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем.
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обусловливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства. При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до атомарного кислорода. Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганец при реакции с водным раствором перманганата калия в кислой среде. Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс.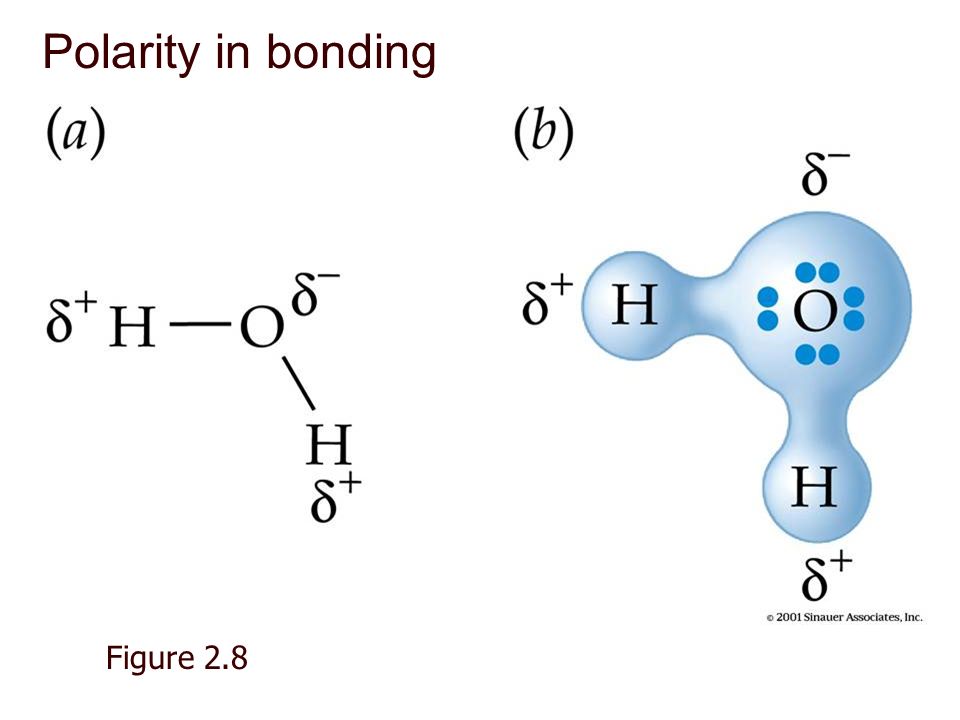 Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Получение
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется надсерная кислота, с последующим гидролизом последней до пероксида и серной кислоты. С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона.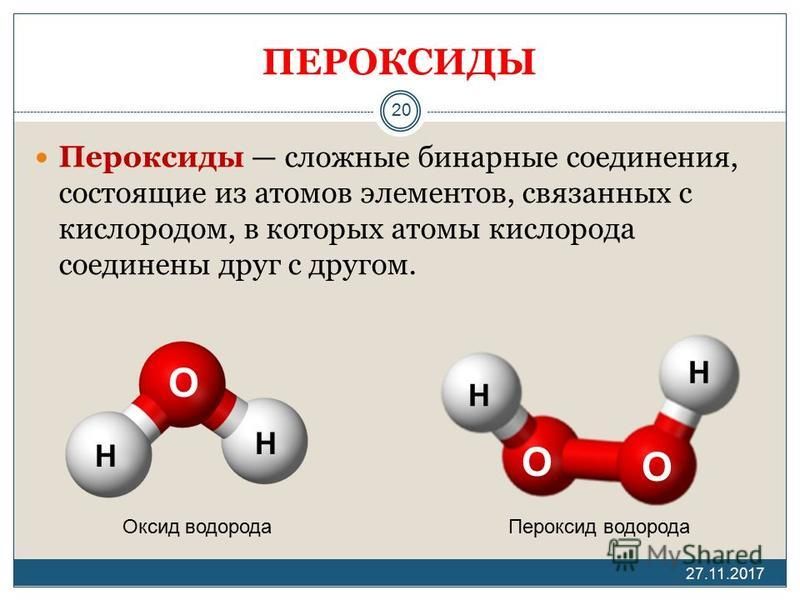 Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия. Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта, при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется. Концентрирование и очистку пероксида водорода проводят осторожной перегонкой. В последнее время (кон. XX в.) удалось синтезировать H 2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия. Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта, при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется. Концентрирование и очистку пероксида водорода проводят осторожной перегонкой. В последнее время (кон. XX в.) удалось синтезировать H 2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.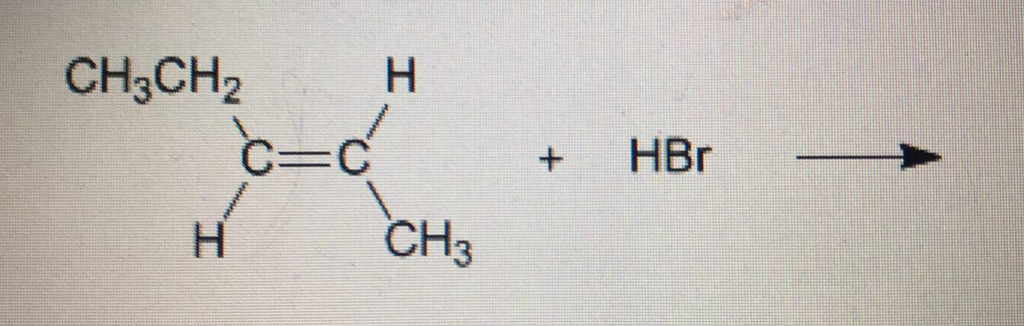 у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H.
у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.

 3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме.
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме.Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
Опасность применения
Несмотря на то, что пероксид водорода нетоксичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей.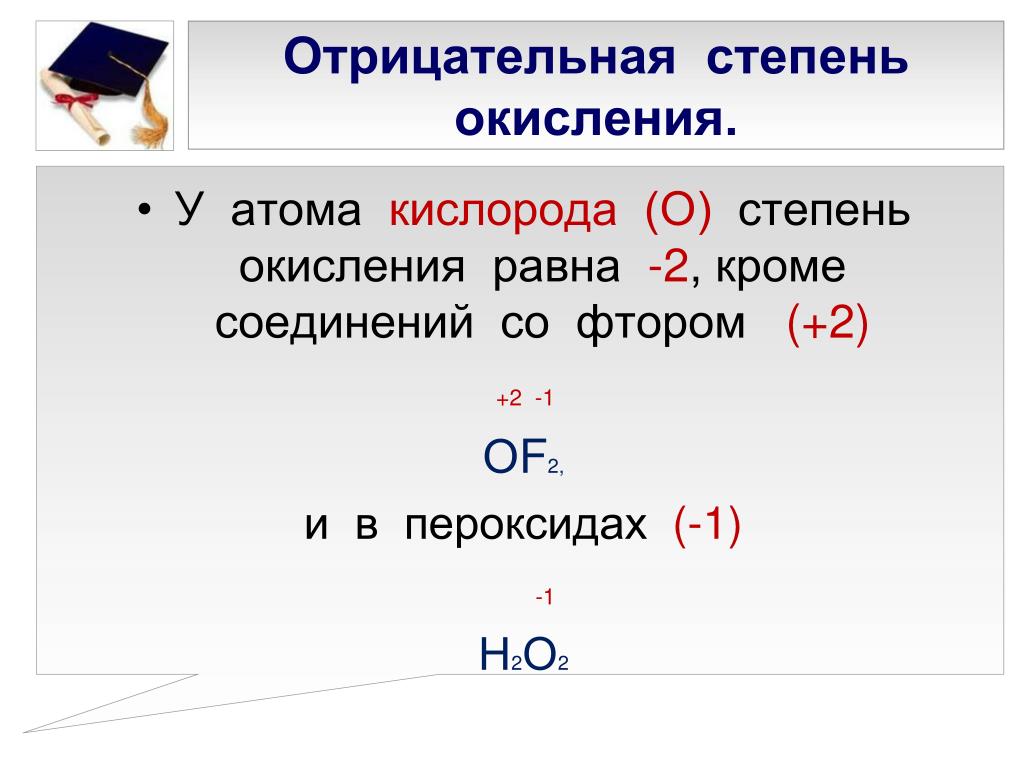 Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл.
Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл.
4. Пероксид водорода. Окислительно — восстановительная двойственность н2о2
1. Строение молекулы. Структурная формула Н — О – О — Н. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль). Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150С. Температура плавления 0,41С. Почти в 1.5 раза тяжелее воды,поверхностное натяжение (σ) больше, чем у Н2О.
В молекуле Н2О2 связи между атомами кислорода и водорода полярны (вследствие смещения общих электронных пар к кислороду). В водных растворах – это слабая кислота, хоть и в незначительной степени распадается на ионы:
I
ст. К1 =
2,610-12.
К1 =
2,610-12.
II ст. практически не протекает,
т.к. подавляется диссоциацией Н2О, которая протекает в большей степени, чем Н2О2. Сместить диссоциацию по 2-й ступени можно введением щелочи.
2. С некоторыми основаниями Н2О2 взаимодействует непосредственно образуя соли, что подтверждает его кислотные свойства.
Ba(OH)2 + H2O2 = BaO2 + 2H2O
соль
пероксида водорода
3. В отличие от воды пероксид водорода – непрочное соединение, разлагается даже при комнатной температуре (диспропорционирует на свету)
Н2О2-1 + Н2О2-1 = О20 + 2Н2О-2
Н2О2 = Н2О+ О
Неустойчивость
Н2О2 обусловлена непрочностью связи О — О.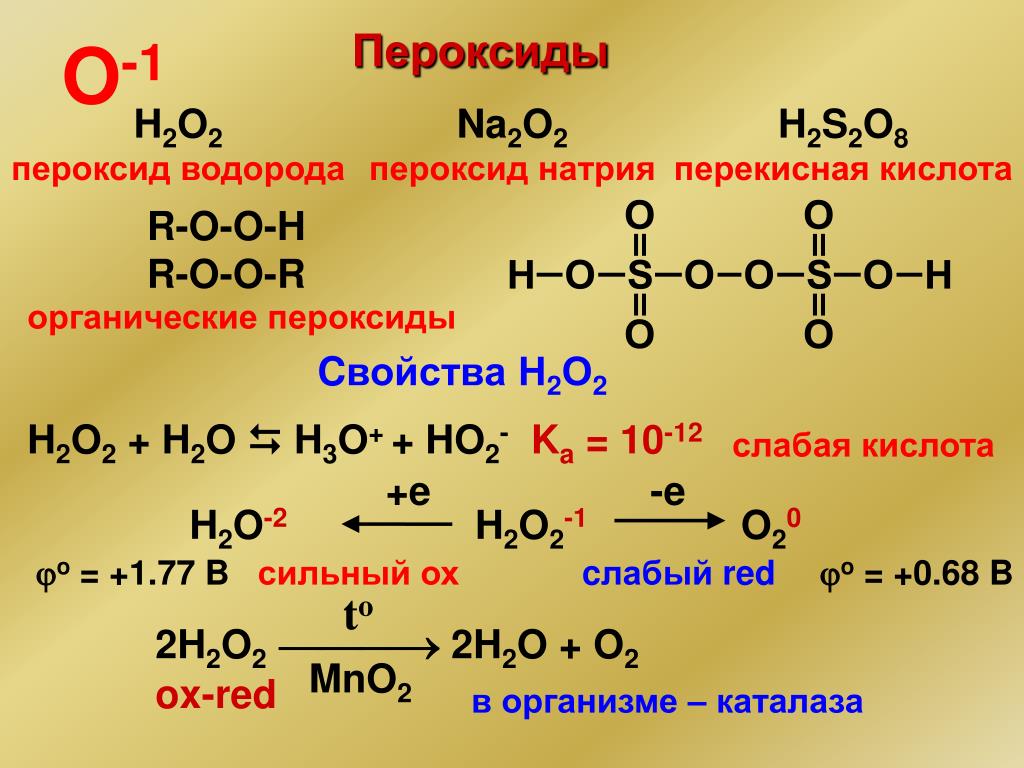
Атомы кислорода в молекуле Н2О2 связаны непосредственно друг с другом неполярной ковалентной связью. Связи О — Н полярны. Поэтому молекула Н2О2 также полярна.
Пероксиды относят к классу солей. Как соли они могут вступать в реакцию обмена с кислотами:
ВаО2 + Н2SO4 = BaSO4 + H2O2
в отличие от оксидов
SnO2 + 2H2SO4 = Sn(SO4)2 + 2H2O
Этой реакцией пользуются для различия оксидов и пероксидов.
Н
0.![]() 95 А0 = 0,095нм
95 А0 = 0,095нм
1,48 А0 = 0,148нм
120°
О О
95°
Н
ЕО-О = 210 кДж/моль ЕО-Н = 468 Дж/моль
Молекула нелинейна, две связи О — Н расположены не симметрично, а в 2-х плоскостях под углом 120. Поэтому полярность Н2О2 > Н2О.
4. Окислительно-восстановительная двойственность Н2О2
Н2О2 + 2КI = I2 + 2KOH
окислитель восстановитель
Н2О2 + Ag+2O = 2Ag0 + O2 + H2O
восстановитель окислитель
H2O2 + KMnO4 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
H2O2 + KI + H2SO4 → H2O + I2 + K2SO4
Na2O2 и K2O2 – используют для регенерации кислорода
в подводных лодках и в изолирующих
противогазах.
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Наличие атомарного кислорода сообщает Н2О2 и Na2O2 сильные окислительные свойства. Na2O2 способен гидролизоваться с образованием H2O2 по реакции
Na2O2 + 2H2O = 2NaOH + H2O2
В связи с этим они находят применение для отбеливания шерсти, шелка, мехов.
Аптечная перекись водорода – 3% водный раствор Н2О2, применяется как дезинфицирующее средство, (30% раствор называется пергидроль).
N2O2 Структура и характеристики Льюиса (15 полезных фактов) —
Диоксид азота или N 2 O 2 представляет собой бинарный оксид азота с молекулярной массой 60,012 г/моль. Теперь мы подробно узнаем о N 2 O 2 .
Теперь мы подробно узнаем о N 2 O 2 .
Диоксид азота можно получить реакцией 1 моля азота на 1 моль кислорода. Это молекула 1:1, в которой фиксировано стехиометрическое соотношение. Это нейтральный оксид азота, имеющий тригональную планарную геометрию. Их связи NN присутствуют, но природа связи является сигма-связью.
Таким образом, связь может быть легко расщеплена термическим разложением с образованием двух молекул оксида азота или NO. он также известен как диоксогидразин, потому что его можно рассматривать как молекулу гидразина, в которой атомы H заменены на O. Теперь мы должны обсудить основные свойства молекулы с надлежащим объяснением.
1. Как нарисовать структуру Льюиса N
2 O 2 ? Структура Льюиса N 2 O 2 может дать правильную информацию о ковалентном характере молекулы. Теперь попробуем нарисовать структуру Льюиса числа N 9.0003 2 O 2 в несколько шагов.
Подсчет валентных электронов
Подсчет общего количества валентных электронов для N 2 O 2 является первым шагом в построении его структуры Льюиса. Общее количество валентных электронов для молекулы равно 22, включая также электроны двух атомов N и O. Поэтому валентные электроны молекулы являются вкладом отдельных атомов.
Выбор центрального атома
2-й и еще один важный шаг для рисования структуры Льюиса — определение центрального атома среди всех атомов молекулы. Центральный атом выбран на основе большего размера и меньшей электроотрицательности. Для N 2 O 2 N подходит на роль центрального атома, удовлетворяющего всем критериям.
Удовлетворение октета
Теперь, во время образования связи между центральным атомом и другими атомами, они должны знать о правиле октета, завершая свою валентную орбиталь, разделяя электроны. Чтобы завершить октет, каждый N образует три связи и имеет шесть общих электронов. Опять же, каждый O имеет две общие связи и четыре общих электрона.
Опять же, каждый O имеет две общие связи и четыре общих электрона.
Удовлетворение валентности
При формировании октета каждый атом должен удовлетворяться своей стабильной валентностью. Стабильная валентность для N и O равна 3 и 2 соответственно. Итак, они образовали соответственно три и две связи, после чего содержат необходимое количество неподеленных пар, чтобы выполнить октет, завершив валентную орбиталь.
Назначить неподеленные пары
После удовлетворения октета и валентности, если необходимо большее число связей, мы должны добавить или назначить неподеленные пары тем атомам, которые имеют больше валентных электронов, чем связь, образованная ими. Каждый N содержит одну неподеленную пару, а каждый O содержит две пары неподеленных пар. N 2 O 2 Структура Льюиса
2. N
2 O 2 валентные электроны Число валентностей электронов, присутствующих в N 2 O 2 , такое же количество электронов, присутствующих в составных атомах. Подсчитаем валентные электроны для N 2 O 2 .
Подсчитаем валентные электроны для N 2 O 2 .
Общее количество валентных электронов, подсчитанных для N 2 O 2 , равно 22, где 12 электронов вносятся с двух O-позиций, а остальные 10 электронов вносятся с N-позиции. Итак, видно, что полные валентные электроны для молекулы представляют собой сумму валентных электронов составляющих атомов.
- Валентных электронов для каждого атома N 5, так как его электронная конфигурация [He}2s 2 2p 3
- Валентных электронов для каждого атома O 6, так как его электронная конфигурация [He]2s 2 2p 4
- Итак, общее количество валентных электронов для N 2 O 2 равно 5*2 + 6*2 =22.
3. N
2 O 2 неподеленные пары структуры Льюиса Неподеленные пары – это один из видов валентных электронов, которые присутствуют на валентной орбитали, но не участвуют в образовании связи.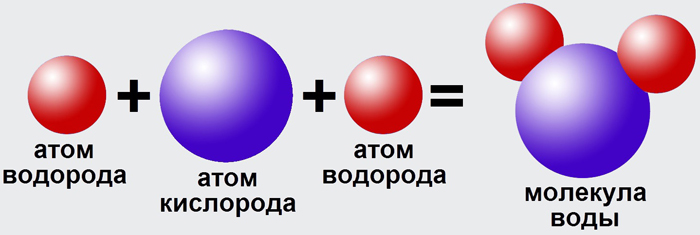 Подсчитаем неподеленные пары для N 2 О 2 .
Подсчитаем неподеленные пары для N 2 О 2 .
В молекуле N 2 O 2 присутствует 6 пар неподеленных пар. Где четыре пары происходят от двух атомов O, а остальные — от N-сайта. Итак, как и валентные электроны, неподеленные пары молекулы представляют собой суммирование неподеленных пар отдельных атомов. Эти электроны не участвуют в образовании связи.
- Неподеленные пары рассчитываются по формуле: неподеленные пары = электроны, находящиеся на валентной орбитали – электроны, участвующие в образовании связи.
- Неподелённые пары, присутствующие над атомом N: 5-3 = 2
- Неподелённые пары, присутствующие над атомом O: 6-2 = 4 каждый N содержит 2 неподеленные пары электронов, что означает одну неподеленную пару.
- ТАК. Общее количество неподеленных пар, присутствующих в молекуле N 2 O 2 , составляет 1*2 + 2*2 = 6 пар.
4. N
2 O 2 Правило октетов структуры Льюиса И N, и O следуют правилу октетов в N 2 O 2 молекула путем обмена электронами в подходящем количестве связей.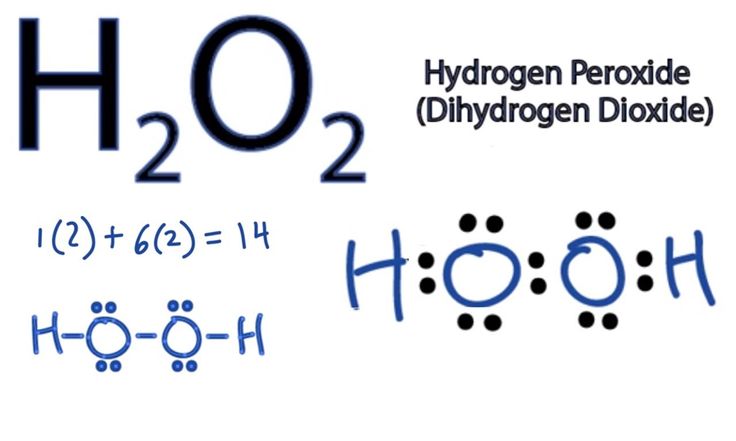 Давайте подробно рассмотрим правило октетов N 2 O 2 .
Давайте подробно рассмотрим правило октетов N 2 O 2 .
N и O следуют за октетом, и им нужно восемь электронов в их валентной оболочке. N и O делят электроны на своих валентных орбиталях. Электронов, необходимых для октета 4 * 8 = 32, и валентных электронов доступно 22, поэтому оставшиеся электроны должны быть удовлетворены связями 10/2 = 5.
Итак, в молекуле присутствует пять связей, но для завершения октета, а также валентности атома требуется двойная связь между N и O. Итак, в молекуле присутствуют две двойные связи для завершения октет. Одиночные пары также учитываются в октете.
5. N
2 O 2 форма структуры lewisФорма молекулы принимается центральным атомом и окружающими атомами для правильной ориентации расположения. Предскажем форму N 2 О 2 .
Молекулярная форма или форма Льюиса молекулы N 2 O 2 является тригональной плоской вокруг обоих атомов N, что может быть подтверждено следующей таблицей:
| 90 013 Молекулярный Формула | № пар связей | № одиночных пар | Форма 900 14 | Геометрия |
| AX | 1 | 0 | Линейная | Линейная |
| AX 2 | 2 | 0 | Линейная | Линейная |
| AXE | 1 | 1 | Линейный | Линейный |
| AX 3 | 3 | 0 | Треугольный Плоский 9021 1 | Треугольный Плоский |
| AX 2 E | 2 | 1 | Изогнутый | Треугольный Плоский |
| AX 2 | 1 | 2 | Линейная | Треугольная Плоская |
| 4 | 0 | Тетраэдрический | Тетраэдрический | |
| AX 3 E | 3 | 1 | Треугольная Пирамидальная | Тетраэдрический |
| AX 2 E 2 | 2 | 2 | Изогнутый | Четырехгранный |
| AX 3 | 1 | 9 0205 3Линейный | Тетраэдрический | |
| AX 5 | 5 | 0 | треугольный бипирамидальный | треугольный бипирамидальный | 902 34
| AX 4 E | 4 | 1 | seesaw | trigonal bipyramidal |
| AX 3 E 2 | 3 | 2 | t-shaped | trigonal bipyramidal |
| AX 2 E 3 | 2 | 3 | линейный | тригональный b 9 0013 i пирамидальная |
| AX 6 | 6 | 0 | октаэдрический | октаэдрический |
| AX 5 E | 9020 5 51 | квадратный пирамидальный | восьмигранный | |
| AX 4 Е 2 | 4 | 2 | квадратный пирамидальный | восьмигранный |
Из таблицы VSEPR (отталкивание пар электронов валентной оболочки) мы можем заключить, что если молекула не имеет неподеленных пар и имеет структуру, подобную AX 2 , она принимает изогнутую форму, хотя ее фактическая геометрия является тригональной. плоский. Так, молекула N 2 O 5 приняла изогнутую форму вокруг обоих центральных атомов N.
плоский. Так, молекула N 2 O 5 приняла изогнутую форму вокруг обоих центральных атомов N.
6. N
2 O 2 структурный угол ЛьюисаВалентный угол – это угол, образуемый атомами с центральным атомом для правильной ориентации в принятой геометрии. Рассчитаем N 2 O 2 угол связи.
Валентный угол O-N-N равен 117 0 , что соответствует тригональной плоской геометрии. Хотя наилучший валентный угол для тригональной плоскости составляет 120 90 104 0 90 105 , между атомами O с двойной связью и неподеленными парами над атомами N возникает стерическое отталкивание. Таким образом, чтобы избежать стерического отталкивания, он уменьшил валентный угол до 117 0 . N 2 O 2 Валентный угол
- Валентный угол теперь рассчитывается по величине гибридизации центрального атома
- Формула валентного угла согласно правилу Бента: COSθ = s/(s-1).

- Центральный атом N гибридизован sp 2 , поэтому символ s здесь равен 1/3 rd
- Итак, валентный угол COSθ = {(1/3)} / {(1/3) -1} =-( ½)
- Θ = COS -1 (-1/2) = 120 0
7. N
2 O 2 Структура Льюиса формальный сборФормальный заряд используется для определения заряда, присутствующего на атоме в молекуле при условии равной электроотрицательности. Рассчитаем формальную плату за N 2 O 2 .
Формальный заряд молекулы N 2 O 2 равен нулю, потому что это нейтральная молекула. Заряд, накопленный каждым атомом, полностью аннулируется другим атомом, поэтому он кажется нейтральным. Хотя N обладает слегка электроположительным характером, а O здесь демонстрирует слегка электроотрицательный характер.
- Формальный заряд молекулы N 2 O 2 рассчитывается по формуле F.
 C. = N v – N л.п. -1/2 N п.н.
C. = N v – N л.п. -1/2 N п.н. - Формальный заряд каждого атома N равен 5-2-(6/2) = 0
- Формальный заряд каждого атома O равен 6-4-(4 /2) = 0
- Таким образом, общий формальный заряд молекулы N 2 O 2 равен нулю, так как оба атома по отдельности содержат нулевые формальные заряды.
Смешивание атомных орбиталей с разной энергией для получения равного количества гибридных орбиталей с эквивалентной энергией называется гибридизацией. Предскажем гибридизацию N 2 O 5 .
Центральным атомом каждого N является гибридизация sp 2 в молекуле N 2 O 2 , которую можно обсудить в следующей таблице.
| Структура | Гибридизация значение | Состояние гибридизация центрального атома | Угол связи |
1. Линейный Линейный | 2 | sp /sd / pd | 180 0 |
| 2.Планировщик треугольный | 3 | sp 2 | 120 0 |
| 3.Тетраэдрический | 4 | sd 3 / sp 3 | 109,5 0 |
| 4.Тригональный бипирамидальная | 5 | сп 3 д/дсп 3 | 90 0 (аксиальный), 120 0 (экваториальный) |
| 3 д 2 / д 2 сп 3 | 90 0 | ||
| 6.Пятиугольная бипирамидальная | 7 | sp 3 d 3 /d 3 sp 3 | 90 0 ,72 0 |
- Мы можем рассчитать гибридизацию по общепринятой формуле, H = 0,5(V+M-C+A),
- Таким образом, гибридизация центрального N равна ½(5+ 1+0+0) = 3 (sp 2 )
- В гибридизации участвуют одна s-орбиталь и две p-орбитали N.

- Двойная связь между N и O не участвует в гибридизации.
9. N
2 O 2 растворимостьРастворимость N 2 O 2 зависит от характера диссоциации и применяемой температуры. Посмотрим, растворим ли N 2 O 2 в воде или нет.
N 2 O 2 нерастворим в воде, потому что это газообразная молекула, а газообразная молекула очень трудно растворяется в жидкости без внешнего давления или температуры. Он скорее адсорбируется в молекуле воды и может также образовывать Н-связь, что может способствовать его растворимости в воде в очень небольшой степени.
Может быть частично растворим в
- Тетрахлорид углерода
- Органический полярный растворитель
- CCl 4
10. Is N
2 O 2 твердое или газообразное? Физическое состояние молекулы зависит от природы составляющих ее атомов и температуры окружающей среды.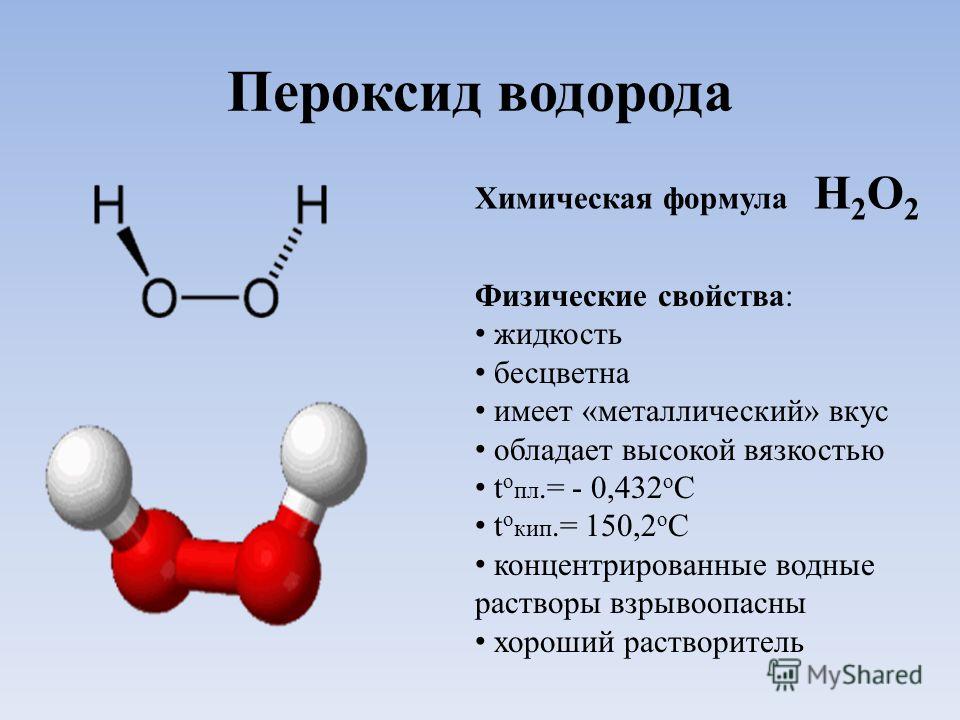 Давайте посмотрим, является ли N 2 O 2 твердым или газообразным.
Давайте посмотрим, является ли N 2 O 2 твердым или газообразным.
N 2 O 2 представляет собой газообразную молекулу, так как она состоит из двух газообразных элементов азота и кислорода. Это гомогенная молекула, поэтому природа молекулы зависит исключительно от физического состояния реагентов. Кислород и азот находятся в газообразной форме при нормальной температуре, он также существует в газообразной форме .
Кроме того, внутри молекулы присутствует слабая ван-дер-ваальсова сила притяжения, поэтому все атомы расположены далеко друг от друга, и диффузность увеличивается – в результате существует газ.
11. Является ли N
2 O 2 полярным или неполярным?Если имеется разность электроотрицательностей, а также существует постоянный дипольный момент, то говорят, что молекула полярна. Проверим, полярен он или нет.
№ 2 O 2 является полярной молекулой, и основная причина этого заключается в наличии постоянного дипольного момента.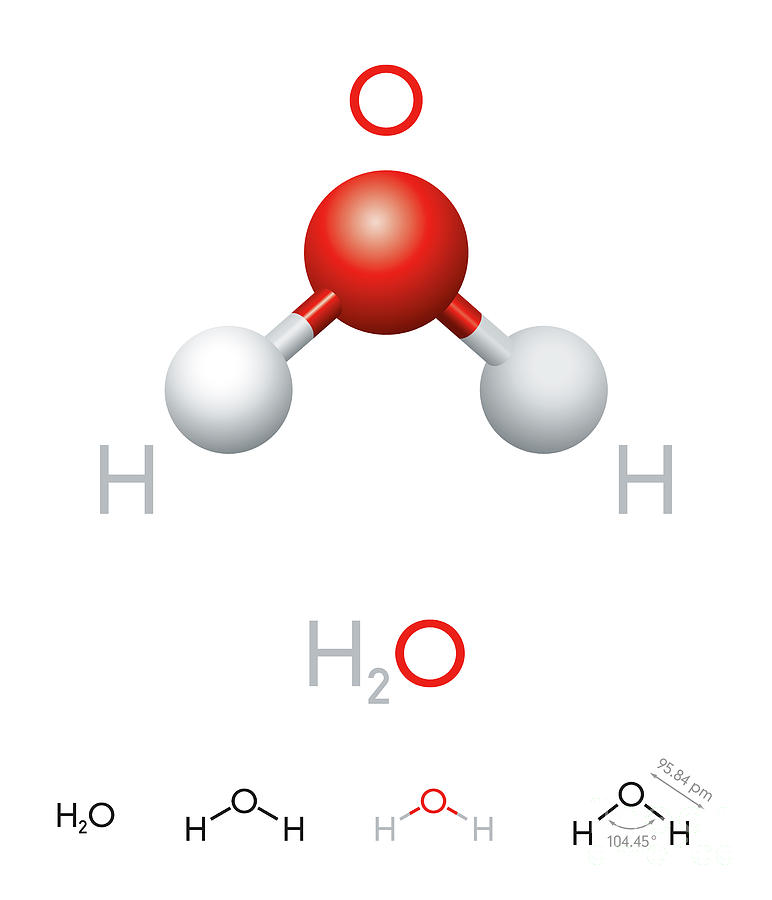 Между O и N существует разница в электроотрицательности, поэтому поток дипольного момента будет наблюдаться от электроположительного N к электроотрицательным атомам O. молекула имеет асимметричную форму.
Между O и N существует разница в электроотрицательности, поэтому поток дипольного момента будет наблюдаться от электроположительного N к электроотрицательным атомам O. молекула имеет асимметричную форму.
Из-за асимметричной формы направление дипольного момента отличается и не компенсируется другим дипольным моментом. Угол связи также играет важную роль в полярности молекулы.
12. Является ли N
2 O 2 кислотным или основным?Кислотность молекулы зависит от присутствия кислого протона или основного ОН – и от способности высвобождения в растворе. Посмотрим, кислота это или основание.
N 2 O 2 не является ни кислотным, ни основным, поскольку не имеет кислотного протона или основного радикала. Скорее это нейтральный бинарный оксид азота, когда он реагирует с водой, образуя нейтральный продукт. Итак, согласно теории Аррениуса, он не является ни кислотным, ни основным по своей природе.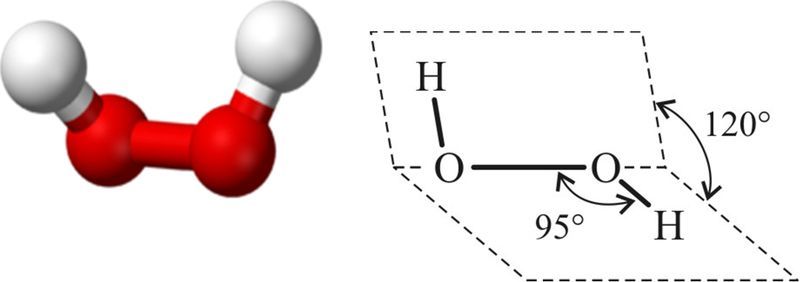
Он не может принимать электронную плотность от других, но может отдавать неподеленные пары, поэтому он может действовать как основание Льюиса.
13. Является ли N
2 O 2 электролитом?Электролиты – это вещества, которые могут ионизироваться в водном растворе и проводить через него электричество. Проверим, электролит это или нет.
N 2 O 2 не является электролитом, поскольку представляет собой нейтральную молекулу с двойной связью, поэтому он не может быть ионизирован путем разрыва связи. Хотя он нерастворим в воде, поэтому он не может диссоциировать на ионы и нести электричество. Даже из формального обвинения мы видим, что и N, и O нейтральны.
14. Является ли N
2 O 2 ионным или ковалентным? Ни одна молекула не имеет на 100% чистую ковалентную или ионную природу, это как раз наоборот, основанное на поляризуемости – правиле Фаяна. Посмотрим, является ли N 2 O 2 ионным или ковалентным.
Посмотрим, является ли N 2 O 2 ионным или ковалентным.
N 2 O 2 является ковалентной молекулой, поскольку молекула образована за счет совместного использования электронов N и O поровну. Нет такой отдачи и приема электронов. Кроме того, центральный N подвергается гибридизации, чтобы образовать правильную ковалентную связь.
Опять же, ионный потенциал катиона очень низкий, а поляризуемость аниона также плохая, поэтому молекула не может быть поляризована и проявляет более ковалентный характер.
15. Является ли N
2 O 2 четырехгранным?Тетракоординированная молекула может иметь тетраэдрическую геометрию, чтобы избежать стерического отталкивания. Посмотрим, является ли N 2 O 2 тетраэдрическим или нет.
N 2 O 2 не является тетраэдрической молекулой, потому что форма молекулы тригональная, плоская вокруг центрального N. но из-за неподеленных пар она приняла изогнутую форму, как молекула воды, и это не тетраэдрическая молекула. -координирован, поэтому он не может принять тетраэдрическую геометрию.
но из-за неподеленных пар она приняла изогнутую форму, как молекула воды, и это не тетраэдрическая молекула. -координирован, поэтому он не может принять тетраэдрическую геометрию.
Заключение
N 2 O 2 является хорошим источником азота или оксида азота, поэтому его можно использовать там, где требуются эти молекулы. Связь между двумя N может быть легко разорвана, потому что присутствуют два электроотрицательных атома O, и они притягивают к себе электронную плотность, поэтому связь становится слабее.
ковалентные соединения. Структура N2O2
спросил
Изменено 3 года, 11 месяцев назад
Просмотрено 11 тысяч раз
$\begingroup$
Я нарисовал структуру $\ce{N2O2}$ следующим образом:
$$\ce{:\overset{\large.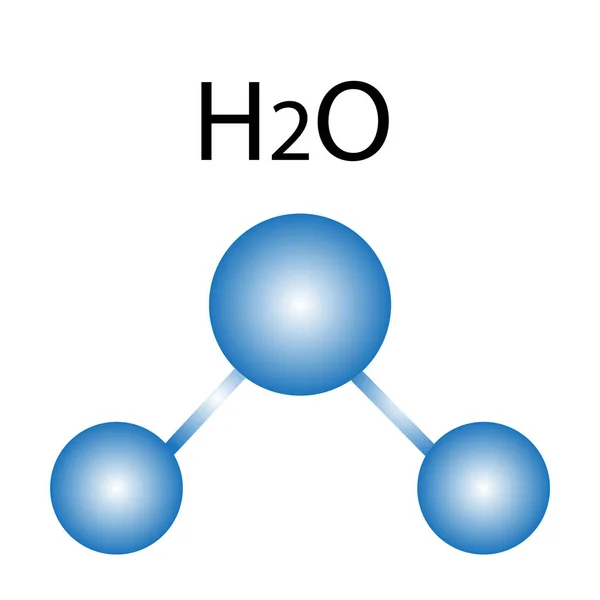 \!\!.}{\underset{\large.\!\! .}{O}}-N#N-\overset{\large.\!\!.}{\underset{\large.\!\!.}{O}}:}$$
\!\!.}{\underset{\large.\!\! .}{O}}-N#N-\overset{\large.\!\!.}{\underset{\large.\!\!.}{O}}:}$$
Не знаю знать, если это возможно. Пожалуйста, поправьте меня, если я ошибаюсь. Кроме того, какова будет его природа?
- ковалентные соединения
- структуры Льюиса
- нитросоединения
$\endgroup$
6
$\begingroup$
Если вы просто смотрите на структуру Льюиса с точки зрения правила октетов, кажется , что структура верна. Динитроген всегда имеет неподеленную пару электронов, которую можно было бы использовать для дательного падежа, как вы предполагаете. Так что с этой точки зрения кажется, что в этом нет ничего плохого, кроме того, что в природе такого не существует.
Если вам интересно узнать о димере, ряд предложений был сделан в этой статье JACS 1994 года. Если вас интересует анион гипонитрита, вы можете прочитать об этом в Википедии (всегда хорошее место для начала), и для справки структура натриевой соли приведена ниже:
$\endgroup$
1
$\begingroup$
Это неправильно в том смысле, что это не согласуется с тем, что обнаружено экспериментально, согласно Структуре димера NO J.


 C. = N v – N л.п. -1/2 N п.н.
C. = N v – N л.п. -1/2 N п.н. 