Метиловый эфир муравьиной кислоты, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Метилантранилат Антраниловая кислота Метилбензоат Метильная группа Метилформиат, диметиламфетамин, угол, белый, текст png
Метилантранилат Антраниловая кислота Метилбензоат Метильная группа Метилформиат, диметиламфетамин, угол, белый, текст pngтеги
- угол,
- белый,
- текст,
- треугольник,
- другие,
- симметрия,
- монохромный,
- кислота,
- черный,
- аминокислота,
- сложный эфир,
- химическое соединение,
- фенетиламин,
- замещенный фенетиламин,
- символ,
- площадь,
- антраниловая кислота,
- триптофан,
- черный и белый,
- метильная группа,
- метилформиат,
- крезол,
- диаграмма,
- диметиламфетамин,
- индол,
- линия,
- марка,
- метилантранилат,
- метилбензоат,
- линия Art,
- png,
- прозрачный,
- бесплатная загрузка
Об этом PNG
- Размер изображения
- 1200x761px
- Размер файла
- 22.
 76KB
76KB - MIME тип
- Image/png
изменить размер PNG
ширина(px)
высота(px)
Лицензия
Некоммерческое использование, DMCA Contact Us
- Серотонин молекула химия химическая структура мелатонин, другие, угол, белый, текст png 800x587px 16.54KB
- Химическое соединение Химический синтез Химия Органическое соединение Молекула, химическая формула, угол, белый, текст png 1917x1466px 134.17KB
- Допамин молекула химия нейротрансмиттер серотонин, информация об элементе, угол, белый, текст png 800x328px 12.14KB
- org/ImageObject»> Химическая формула Алкоголь Химическое вещество Химия Структурная формула, другие, угол, белый, текст png 800x558px 18.2KB
- Стрелка Северный Компас роза, стрелка знак, угол, треугольник, симметрия png 2400x2400px 77.69KB
- четыре черные стрелки, стрела, эскиз стрелы, угол, белый, лицо png 800x615px 9.56KB
- Адреналин Химическая структура Норадреналин Дофамин, дофамин, угол, белый, текст png 1024x647px 17.56KB
- Эстер Органическое соединение Карбоновая кислота Éster carbónico, Эфир жирных кислот, угол, текст, логотип png 1024x756px 26.09KB
- org/ImageObject»> Молекула Химическое соединение Химическая формула Аминокислота Леводопа, дофамин, угол, белый, текст png 1280x546px 25.57KB
- Мелатонин Химическая структура Гормон Химическое соединение, формула 1, разное, угол, белый png 1200x998px 30.19KB
- Глюкоза Органическое соединение Химия Химическое соединение Сахароза, сахар, угол, белый, текст png 1920x1280px 58.33KB
- Салициловая кислота Растительный гормон Фенолы Салицилат натрия, другие, угол, белый, текст png 1208x1024px 19.68KB
- Бумажный самолетик Самолет Рисование, самолетик бумажный, угол, белый, текст png 1280x879px 59.29KB
- org/ImageObject»> Глутатион антиоксидант молекула алами, другие, угол, белый, текст png 1024x559px 22.02KB
- Шаблон комиксов с речевым шаром, BICBLE, разное, угол, текст png 1920x1372px 103.86KB
- Биологически активная добавка Creatine Methyl group Химическая формула Добавка для бодибилдинга, эфир, угол, белый, текст png 900x436px 9.27KB
- Ароматичность Фенолы Ароматические углеводороды Миндальная кислота Бензол, др., угол, прямоугольник, треугольник png 670x767px 17.25KB
- Эфир Функциональная группа Амин Нитросоединение Органическое соединение, колибри, разное, угол, белый png 849x971px 9.06KB
- org/ImageObject»> Норадреналин Химическое соединение Катехоламин Дофамин Нейротрансмиттер, дофамин, угол, белый, текст png 2000x853px 43.79KB
- Этилацетат Метильная группа Этилпропионат, другие, угол, текст, другие png 1200x630px 20.03KB
- иллюстрация формы белого сердца, наброски сердца, свадебные сердца, любовь, угол, белый png 600x556px 26.03KB
- Норадреналин Катехоламин Адреналин Химическая структура Нейротрансмиттер, другие, угол, белый, текст png 1024x692px 18.85KB
- Ацетон Химическое соединение Структурная формула Химическая формула Метильная группа, другие, угол, текст, другие png 1920x1141px 40.17KB
- org/ImageObject»> Шаблонные рамки, арабески, Разное, угол, белый png 5000x3750px 276.5KB
- Число Десятичная Математика Прямоугольник Квадрат, черно-белая сетка, разное, угол, белый png 1024x1024px 8.29KB
- Классический элемент Огонь Вода Воздух Земля, режим четырех сезонов, химический элемент, угол, белый png 640x640px 47.31KB
- Молочная кислота Карбоновая кислота Пропионовая кислота Метакриловая кислота, другие, разное, угол, текст png 2000x1500px 54.89KB
- иллюстрация солнечных лучей, Starburst, абстрактные линии, разное, угол, белый png 512x512px 10.09KB
- org/ImageObject»> ассорти с, геометрическая форма, геометрия, геометрический рисунок, угол, белый, текст png 3433x3239px 333.84KB
- Мелатонин Химическое строение Химическое вещество Химия Химическое соединение, другие, угол, белый, текст png 1232x1024px 30.73KB
- Химическая формула Молекулярная формула Структурная формула Молекула Химическое вещество, Формула Один флаг, угол, белый, текст png 1024x508px 22.3KB
- Иконки настольного компьютера, стрелка вправо, четыре белые стрелки графика, разное, угол, белый png 894x894px 67.54KB
- римские цифры иллюстрация, циферблат римские цифры время, время, угол, белый, текст png
1150x1150px
51.
 91KB
91KB - Речи шар мультфильм, другие, разные, комиксы, угол png 600x434px 28.4KB
- Ацетон Химическое соединение Химическая формула Структурная формула Диметилсульфоксид, другие, угол, текст, другие png 1200x713px 22.38KB
- Метилбутират Метильная группа Метиловый эфир жирной кислоты Химия, другие, угол, текст, другие png 1024x367px 15.5KB
- справочный материал химическая структура, черно-синие соты, текстура, материал, угол png 1213x931px 187.12KB
- Триптофан Химическая структура Химия Серотонин, Альфаметилтриптамин, разное, угол, белый png
1200x679px
43.
 46KB
46KB - Этанол Спирт Химическое соединение Структурная формула Химия, Растворение, разное, угол, белый png 1208x747px 1.64KB
- Серотонин Химическая структура Структурная формула Дофамин, дмт, угол, белый, текст png 928x768px 23.05KB
- Витамин В-6, витамины группы В, пиридоксин, химия, др., угол, белый, текст png 2000x1839px 58.77KB
- Таурин Молекула Химическое вещество Химическая формула Химия, Мочевой Кальций, угол, текст, треугольник png 1200x640px 22.31KB
- Ромб ромб, ромб, разное, угол, текст png 1024x1024px 22.12KB
- org/ImageObject»> Свободное основание Химическое соединение Химия Кокаин, соль, угол, белый, текст png 994x768px 30.44KB
- Химия Химическая структура Химический синтез Соединение диазония, никотин, угол, белый, текст png 1280x875px 34.45KB
- Куркумин Куркума Структура Химия Кето-енольная таутомерия, другие, угол, белый, текст png 1200x427px 20.09KB
- Триглицерид жирной кислоты липид, другие, угол, белый, текст png 969x429px 32.31KB
- 2,5-диметоксибензальдегид аспирин ацетаминофен примесь, аспирин, угол, белый, текст png 992x744px 22.96KB
- Замещенный амфетамин Adderall Стимулятор метамфетамина, молекула adderall, угол, белый, текст png
1280x584px
24.
 62KB
62KB - Замещенный фенетиламин, 1-фенилэтиламин, моноаминный нейротрансмиттер допамин, другие, угол, белый, текст png 1280x532px 20.76KB
Готовимся к углубленному изучению химии : 10.5 Сложные эфиры. Жиры
10.5. Сложные эфиры. Жиры
Сложные эфиры –
функциональные производные карбоновых кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR)
Сложные эфиры карбоновых кислот – соединения с общей формулой.
R–COOR’, где R и R’ – углеводородные радикалы.
Сложные эфиры предельных одноосновных карбоновых кислот имеют общую формулу:
Физические свойства:
· Летучие, бесцветные жидкости
· Плохо растворимы в воде
· Чаще с приятным запахом
· Легче воды
Сложные
эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический
запах.
Они определяют их специфический
запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. –
апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Аромат. Структурная формула. | Название сложного эфира |
Яблоко | Этиловый эфир 2-метилбутановой кислоты |
Амиловый эфир муравьиной кислоты | |
Изоамиловый эфир уксусной кислоты | |
Ананас | Этиловый эфир масляной кислоты (этилбутират) |
Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) | |
Жасмин | Бензиловый эфир уксусной (бензилацетат) |
Краткие названия сложных эфиров строятся по названию радикала (R’) в остатке
спирта и названию группы RCOO— в остатке кислоты. Например,
этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Например,
этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Применение
· В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
· В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX
— начале ХХ века, когда органический синтез делал свои первые шаги, было
синтезировано и испытано фармакологами множество сложных эфиров. Они стали
основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее
и обезболивающее средство широко использовался метилсалицилат, в настоящее
время практически вытесненный более эффективными средствами.
Как местнораздражающее
и обезболивающее средство широко использовался метилсалицилат, в настоящее
время практически вытесненный более эффективными средствами.
Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR’ + H2O (H+)↔ RCOOH + R’OH
Гидролиз в
присутствии щелочи протекает необратимо (т.к. образующийся отрицательно
заряженный карбоксилат-анион RCOO– не вступает в реакцию с
нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
Жиры, их строение, свойства и применение
«Химия везде, химия во всем:
Во всем, чем мы дышим,
Во всем, что мы пьем,
Во всем, что едим».
Во всем, что мы носим,
Люди давно научились выделять жир из
натуральных объектов и использовать его в повседневной жизни. Жир сгорал в
примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали
полозья, по которым спускали на воду суда. Жиры – основной источник нашего
питания. Но неправильное питание, малоподвижный образ жизни приводит к
избыточному весу. Животные пустынь запасают жир как источник энергии и воды.
Толстый жировой слой тюленей и китов помогает им плавать в холодных водах
Северного Ледовитого океана.
Животные пустынь запасают жир как источник энергии и воды.
Толстый жировой слой тюленей и китов помогает им плавать в холодных водах
Северного Ледовитого океана.
Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.
Жиры выполняют различные функции: строительную, энергетическую (1 г
жира дает 9 ккал энергии), защитную, запасающую. Жиры обеспечивают 50% энергии,
требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в
день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются
незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е,
К, гормоны.
Жиры обеспечивают 50% энергии,
требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в
день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются
незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е,
К, гормоны.
Многие животные и человек используют жир в качестве теплоизолирующей оболочки, например, у некоторых морских животных толщина жирового слоя достигает метра. Кроме того, в организме жиры являются растворителями вкусовых веществ и красителей. Многие витамины, например витамин А, растворяются только в жирах.
Некоторые животные (чаще водоплавающие птицы) используют жиры для смазки своих собственных мышечных волокон.
Жиры повышают эффект насыщения пищевыми продуктами, т. к. они перевариваются очень медленно и задерживают наступление чувства голода.
История открытия жиров
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699)
впервые высказал предположение, что жиры содержат «скрытую кислоту».
немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699)
впервые высказал предположение, что жиры содержат «скрытую кислоту».
В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса.
То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле.
Впервые химический состав жиров определил в начале прошлого века французский химикМишель Эжен Шеврёль, основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии «Химические исследования тел животного происхождения».
1813 г Э. Шеврёль установил строение
жиров, благодаря реакции гидролиза жиров в щелочной среде. Он показал, что жиры
состоят из глицерина и жирных кислот, причем это не просто их смесь, а
соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
Он показал, что жиры
состоят из глицерина и жирных кислот, причем это не просто их смесь, а
соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
Синтез жиров
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.
Общая формула жиров (триглицеридов)
Жиры –
сложные эфиры глицерина и высших карбоновых кислот. Общее название таких
соединений – триглицериды.
Классификация жиров
Животные жиры содержат главным образом глицериды предельных кислот и
являются твердыми веществами. Растительные жиры, часто называемые маслами,
содержат глицериды непредельных карбоновых кислот. Это, например, жидкие
подсолнечное, конопляное и льняное масла.
Растительные жиры, часто называемые маслами,
содержат глицериды непредельных карбоновых кислот. Это, например, жидкие
подсолнечное, конопляное и льняное масла.
Природные жиры содержат следующие жирные кислоты
Насыщенные: стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) Масляная (C3H7COOH) | В СОСТАВЕ ЖИВОТНЫХ ЖИРОВ |
Ненасыщенные: олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) | В СОСТАВЕ РАСТИТЕЛЬНЫХ |
Жиры
содержатся во всех растениях и животных. Они представляют собой смеси полных
сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Они представляют собой смеси полных
сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства жиров
·
Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
·
Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Химические свойства жиров
1. Гидролиз, или омыление, жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт — глицерин и смесь карбоновых кислот:
или щелочей (необратимо). При щелочном гидролизе образуются соли
высших жирных кислот, называемые мылами. Мыла получаются при
гидролизе жиров в присутствии щелочей:
При щелочном гидролизе образуются соли
высших жирных кислот, называемые мылами. Мыла получаются при
гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:
В
условиях процесса гидрогенизации масел (высокая температура, металлический
катализатор) происходит изомеризация части кислотных остатков, содержащих
цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в
маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот
увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
Повышенное содержание в
маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот
увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
Реакция получения жиров (этерификация)
Применение жиров
Жиры — продукт питания. Биологическая роль жиров
Животные
жиры и растительные масла, наряду с белками и углеводами – одна из главных
составляющих нормального питания человека. Они являются основным источником
энергии: 1 г жира при полном окислении (оно идет в клетках с участием
кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем
можно получить из белков или углеводов. Кроме того, жировые запасы в
организме практически не содержат воду, тогда как молекулы белков и углеводов
всегда окружены молекулами воды. В результате один грамм жира дает почти в 6
раз больше энергии, чем один грамм животного крахмала – гликогена. Таким
образом, жир по праву следует считать высококалорийным «топливом». В основном
оно расходуется для поддержания нормальной температуры человеческого тела, а
также на работу различных мышц, поэтому даже когда человек ничего не делает
(например, спит), ему каждый час требуется на покрытие энергетических
расходов около 350 кДж энергии, примерно такую мощность имеет электрическая
100-ваттная лампочка.
Таким
образом, жир по праву следует считать высококалорийным «топливом». В основном
оно расходуется для поддержания нормальной температуры человеческого тела, а
также на работу различных мышц, поэтому даже когда человек ничего не делает
(например, спит), ему каждый час требуется на покрытие энергетических
расходов около 350 кДж энергии, примерно такую мощность имеет электрическая
100-ваттная лампочка.
Для
обеспечения организма энергией в неблагоприятных условиях в нем создаются
жировые запасы, которые откладываются в подкожной клетчатке, в жировой складке
брюшины – так называемом сальнике. Подкожный жир предохраняет организм от
переохлаждения (особенно эта функция жиров важна для морских животных). В
течение тысячелетий люди выполняли тяжелую физическую работу, которая требовала
больших затрат энергии и соответственно усиленного питания. Для
покрытия минимальной суточной потребности человека в энергии достаточно всего
50 г жира. Однако при умеренной физической нагрузке взрослый человек должен
получать с продуктами питания несколько больше жиров, но их количество не
должно превышать 100 г (это дает треть калорийности при диете, составляющей
около 3000 ккал). Следует отметить, что половина из этих 100 г
содержится в продуктах питания в виде так называемого скрытого жира. Жиры
содержатся почти во всех пищевых продуктах: в небольшом количестве они есть
даже в картофеле (там их 0,4%), в хлебе (1–2%), в овсяной крупе (6%). В молоке
обычно содержится 2–3% жира (но есть и специальные сорта обезжиренного молока).
Довольно много скрытого жира в постном мясе – от 2 до 33%. Скрытый жир
присутствует в продукте в виде отдельных мельчайших частиц. Жиры почти в чистом
виде – это сало и растительное масло; в сливочном масле около 80% жира, в
топленом – 98%. Конечно, все приведенные рекомендации по потреблению жиров –
усредненные, они зависят от пола и возраста, физической нагрузки и
климатических условий. При неумеренном потреблении жиров человек быстро
набирает вес, однако не следует забывать, что жиры в организме могут
синтезироваться и из других продуктов. «Отрабатывать» лишние калории путем
физической нагрузки не так-то просто. Например, пробежав трусцой 7 км,
человек тратит примерно столько же энергии, сколько он получает, съев всего
лишь одну стограммовую плитку шоколада (35% жира, 55% углеводов).
Следует отметить, что половина из этих 100 г
содержится в продуктах питания в виде так называемого скрытого жира. Жиры
содержатся почти во всех пищевых продуктах: в небольшом количестве они есть
даже в картофеле (там их 0,4%), в хлебе (1–2%), в овсяной крупе (6%). В молоке
обычно содержится 2–3% жира (но есть и специальные сорта обезжиренного молока).
Довольно много скрытого жира в постном мясе – от 2 до 33%. Скрытый жир
присутствует в продукте в виде отдельных мельчайших частиц. Жиры почти в чистом
виде – это сало и растительное масло; в сливочном масле около 80% жира, в
топленом – 98%. Конечно, все приведенные рекомендации по потреблению жиров –
усредненные, они зависят от пола и возраста, физической нагрузки и
климатических условий. При неумеренном потреблении жиров человек быстро
набирает вес, однако не следует забывать, что жиры в организме могут
синтезироваться и из других продуктов. «Отрабатывать» лишние калории путем
физической нагрузки не так-то просто. Например, пробежав трусцой 7 км,
человек тратит примерно столько же энергии, сколько он получает, съев всего
лишь одну стограммовую плитку шоколада (35% жира, 55% углеводов). Физиологи
установили, что при физической нагрузке, которая в 10 раз превышала привычную,
человек, получавший жировую диету, полностью выдыхался через 1,5 часа. При
углеводной же диете человек выдерживал такую же нагрузку в течение 4 часов.
Объясняется этот на первый взгляд парадоксальный результат особенностями
биохимических процессов. Несмотря на высокую «энергоемкость» жиров, получение
из них энергии в организме – процесс медленный. Это связано с малой реакционной
способностью жиров, особенно их углеводородных цепей. Углеводы, хотя и дают
меньше энергии, чем жиры, «выделяют» ее намного быстрее. Поэтому перед
физической нагрузкой предпочтительнее съесть сладкое, а не жирное.Избыток в
пище жиров, особенно животных, увеличивает и риск развития таких заболеваний
как атеросклероз, сердечная недостаточность и др. В животных жирах много
холестерина (но не следует забывать, что две трети холестерина синтезируется в
организме из нежировых продуктов – углеводов и белков).
Физиологи
установили, что при физической нагрузке, которая в 10 раз превышала привычную,
человек, получавший жировую диету, полностью выдыхался через 1,5 часа. При
углеводной же диете человек выдерживал такую же нагрузку в течение 4 часов.
Объясняется этот на первый взгляд парадоксальный результат особенностями
биохимических процессов. Несмотря на высокую «энергоемкость» жиров, получение
из них энергии в организме – процесс медленный. Это связано с малой реакционной
способностью жиров, особенно их углеводородных цепей. Углеводы, хотя и дают
меньше энергии, чем жиры, «выделяют» ее намного быстрее. Поэтому перед
физической нагрузкой предпочтительнее съесть сладкое, а не жирное.Избыток в
пище жиров, особенно животных, увеличивает и риск развития таких заболеваний
как атеросклероз, сердечная недостаточность и др. В животных жирах много
холестерина (но не следует забывать, что две трети холестерина синтезируется в
организме из нежировых продуктов – углеводов и белков).
Известно, что значительную долю потребляемого
жира должны составлять растительные масла, которые содержат очень важные для
организма соединения – полиненасыщенные жирные кислоты с несколькими двойными
связями. Эти кислоты получили название «незаменимых». Как и витамины, они
должны поступать в организм в готовом виде. Из них наибольшей активностью
обладает арахидоновая кислота (она синтезируется в организме из линолевой),
наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная
потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего
линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора –
однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в
подсолнечном и ореховом масле.
Эти кислоты получили название «незаменимых». Как и витамины, они
должны поступать в организм в готовом виде. Из них наибольшей активностью
обладает арахидоновая кислота (она синтезируется в организме из линолевой),
наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная
потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего
линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора –
однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в
подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе
должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это
олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается,
если треть жиров человек получает в виде жидких растительных масел – в
количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который
содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от
30 до 54% полиненасыщенных. Для сравнения: в сливочном масле содержится 45–50%
насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В
этом отношении высококачественный маргарин полезнее сливочного масла.
Для сравнения: в сливочном масле содержится 45–50%
насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В
этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить!!!
Насыщенные жирные кислоты отрицательно
влияют на жировой обмен, работу печени и способствуют развитию атеросклероза.
Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой
обмен и участвуют в выведении холестерина из организма. Чем выше содержание
ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность
твердых животных и жидких растительных жиров примерно одинакова, однако
физиологическая ценность растительных жиров намного выше. Более ценными
качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных
кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на
эти положительные качества, нельзя употреблять только молочный жир, так как
никакой жир не содержит идеального состава жирных кислот. Лучше всего
употреблять жиры как животного, так и растительного происхождения. Соотношение
их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и
лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные
жиры.
Лучше всего
употреблять жиры как животного, так и растительного происхождения. Соотношение
их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и
лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные
жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей
жира вредно для здоровья: он в большом количестве откладывается про запас, что
увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается
его концентрация в крови, что, как фактор риска, способствует развитию
атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
УПРАЖНЕНИЯ
1. Имеется 148 г смеси двух органических соединений одинакового состава С3Н6О2. Определите строение этих соединений и их массовые доли в смеси, если известно, что одно из них при взаимодействии с избытком гидрокарбоната натрия выделяет 22,4 л (н.у.) оксида углерода (IV), а другое не реагирует с карбонатом натрия и аммиачным раствором оксида серебра, но при нагревании с водным раствором гидроксида натрия образует спирт и соль кислоты.
Решение:
Известно, что оксид углерода (IV) выделяется при взаимодействии карбоната натрия с кислотой. Кислота состава С3Н6О2может быть только одна — пропионовая, СН3СН2СООН.
С2Н5СООН
+ NаНСО3
→ C2H5COONa + CO2↑ + Н2О.
По условию, выделилось 22,4 л СО2, что составляет 1 моль, значит кислоты в смеси также было 1 моль. Молярная масса исходных органических соединений равна: M(С3Н6О2) = 74 г/моль, следовательно 148 г составляют 2 моль.
Второе соединение при гидролизе образует спирт и соль кислоты, значит это — сложный эфир:
RCOOR‘ + NaOH → RCOONa + R‘OH.
Составу С3Н6О2 отвечают два сложных эфира: этилформиат НСООС2Н5 и метилацетат СН3СООСН3. Эфиры муравьиной кислоты реагируют с аммиачным раствором оксида серебра, поэтому первый эфир не удовлетворяет условию задачи. Следовательно, второе вещество в смеси — метилацетат.
Поскольку в смеси было по одному
молю соединений с одинаковой молярной массой, то их массовые доли равны и
составляют 50%.
Ответ. 50% СН3СН2СООН, 50% СН3СООСН3.
________________________________________________________________
2. Относительная плотность паров сложного эфира по водороду равна 44. При гидролизе этого эфира образуются двасоединения, при сгорании равных количеств которых образуются одинаковые объемы углекислого газа (при одинаковых условиях).Приведите структурную формулу этого эфира.
Решение:
Общая формула сложных эфиров, образованных предельными спиртами и кислотами, — СnН2nО2. Значение n можно определить из плотности по водороду:
M(СnН2nО2) = 14n + 32 = 44.2 = 88 г/моль,
откуда n = 4, то есть эфир содержит 4
атома углерода. Поскольку при сгорании спирта и кислоты, образующихся при
гидролизе эфира, выделяются равные объемы углекислого газа, то кислота и
спирт содержат одинаковое число атомов углерода, по два. Таким образом,
искомый эфир образован уксусной кислотой и этанолом и называется
этилацетат:
Поскольку при сгорании спирта и кислоты, образующихся при
гидролизе эфира, выделяются равные объемы углекислого газа, то кислота и
спирт содержат одинаковое число атомов углерода, по два. Таким образом,
искомый эфир образован уксусной кислотой и этанолом и называется
этилацетат:
-О-С2Н5 |
Ответ. Этилацетат, СН3СООС2Н5.
________________________________________________________________
3. При гидролизе сложного эфира, молярная масса которого равна 130
г/моль, образуются кислота А и спирт Б. Определите строение эфира, если
известно, что серебряная соль кислоты содержит 59,66% серебра по массе. Спирт Б
не окисляется дихроматом натрия и легко реагирует с хлороводородной кислотой
с образованием алкилхлорида.
Решение:
Сложный эфир имеет общую формулу RCOOR‘. Известно, что серебряная соль кислоты, RCOOAg, содержит 59,66%серебра, следовательно молярная масса соли равна: M(RCOOAg) = M(Аg)/0,5966 = 181 г/моль, откуда M(R) = 181-(12+2.16+108) = 29 г/моль. Этот радикал — этил, С2Н5, а сложный эфир был образован пропионовой кислотой: C2H5COOR‘.
Молярная масса второго радикала равна: M(R‘) = M(C2H5COOR‘) — М(С2Н5СОО) = 130-73 = 57 г/моль. Этот радикал имеет молекулярную формулу С4Н9. По условию, спирт С4Н9ОН не окисляется Na2Сr2О7 и легко реагирует с HCl следовательно, этот спирт — третичный, (СН3)3СОН.
Таким образом, искомый эфир образован пропионовой кислотой и трет-бутанолом и называется трет-бутилпропионат:
C2H5 — | C — O — | C — CH3 |
Ответ. Трет-бутилпропионат.
Трет-бутилпропионат.
________________________________________________________________
4. Напишите две возможные формулы жира, имеющего в молекуле 57 атомов углерода и вступающего в реакцию с иодом в соотношении 1:2. В составе жира имеются остатки кислот с четным числом углеродных атомов.
Решение:
Общая формула жиров:
CH2-O-CO-R |
CH-O-CO-R’ |
CH2-O-CO-R» |
где R, R’, R» —
углеводородные радикалы, содержащие нечетное число атомов углерода (еще
один атом из кислотного остатка входит в состав группы -СО-). На долю трех
углеводородных радикалов приходится 57- 6 = 51 атом углерода.
Можно предположить, что каждый из радикалов содержит по 17 атомов углерода.
На долю трех
углеводородных радикалов приходится 57- 6 = 51 атом углерода.
Можно предположить, что каждый из радикалов содержит по 17 атомов углерода.
Поскольку одна молекула жира может присоединить две молекулы иода, то на три радикала приходится две двойные связи или одна тройная. Если две двойные связи находятся в одном радикале, то в состав жира входят остаток линолевой кислоты (R = С17Н31) и два остатка стеариновой кислоты (R‘ = R» = С17Н35). Если две двойные связи находятся в разных радикалах, то в состав жира входят два остатка олеиновой кислоты (R = R‘ = С17H33) и остаток стеариновой кислоты (R» = С17Н35). Возможные формулы жира:
|
|
________________________________________________________________
5.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Что такое реакция этерификации.
2.
Какое различие существует в строении твердых и жидких жиров.
3.
Каковы химические свойства жиров.
4.
Приведите уравнение реакции получения метилформиата.
5.
Напишите структурные формулы двух сложных эфиров и
кислоты, имеющих состав С3Н6О2. Назовите эти
вещества по международной номенклатуре.
6.
Напишите уравнения реакций этерификации между: а) уксусной кислотой и 3-метилбутанолом-1; б) масляной кислотой и пропанолом-1. Назовите эфиры.
7.
Сколько граммов жира было взято, если для гидрирования образовавшейся в результате его гидролиза кислоты потребовалось 13,44 л водорода (н.у.).
8.
Рассчитайте массовую долю выхода сложного эфира, образующегося при нагревании в присутствии концентрированной серной кислоты 32 г уксусной кислоты и 50 г пропанола-2, если при этом образовалось 24 г эфира.
9.
Для гидролиза образца жира массой 221 г понадобилось
150 г раствора гидроксида натрия с массовой долей щелочи 0,2. Предложите
структурную формулу исходного жира.
10.
Вычислите объем раствора гидроксида калия с массовой долей щелочи 0,25 и плотностью 1,23 г/см3, который нужно затратить для проведения гидролза 15 г смеси, состоящей из этилового эфира этановой кислоты, пропилового эфира метановой кислоты и метилового эфира пропановой кислоты.
ВИДЕО ОПЫТ
1. Какая реакция лежит в основе получения сложных эфиров: | |
а) нейтрализации | б) полимеризации |
в) этерификации | г) гидрирования |
2. Сколько изомерных сложных эфиров отвечает формуле С4Н8О2: | |
а) 2 | б) 4 |
в) 3 | г) 5 |
3. Валериановой кислоте изомерен: | |
а) пропилформиат | б) этилацетат |
в) бутилформиат | г) бутилацетат |
4. Для получения сложного эфира используют реакцию карбоновой кислоты с: | |
а) спиртом | б) алкеном |
в) альдегидом | г) карбоновой кислотой |
5. Укажите число всех изомеров с молекулярной формулой С2Н4О2: | |
а) 2 | б) 3 |
в) 4 | г) 5 |
6. Качественной реакцией на жиры является взаимодействие с: | |
а) КОН | б) раствором перманганата калия |
в) серебром | г) Н2SO4 |
7. Один из способов химической переработки жиров называется: | |
а) кристаллизация | б) перегонка |
в) гидрирование | г) перетапливание |
8. С каким из реагентов реагирует этилацетат: | |
а) Сu | б) ZnO |
в) ZnSO4 | г) NaOH |
9. Качественной реакцией на метилформиат является взаимодействие с: | |
а)водородом | б) оксидом меди |
в) оксидом серебра | г) медью |
10. Установите молекулярную массу жира, если на омыление 89 г этого жира понадобилось 12 г натрий гидроксида: | |
а) 900 | б) 890 |
в) 89 | г) 356 |
Ответы:
1 | в |
2 | б |
3 | в |
4 | а |
5 | г |
6 | б |
7 | в |
8 | г |
9 | в |
10 | б |
Метанол — Sciencemadness Wiki
Метанол или метиловый спирт — простейший спирт с формулой CH 3 OH , также сокращенно MeOH . Это легкая, бесцветная, летучая, легковоспламеняющаяся жидкость. Это важное химическое соединение в качестве растворителя и органического соединения исходного сырья. [1]
Это легкая, бесцветная, летучая, легковоспламеняющаяся жидкость. Это важное химическое соединение в качестве растворителя и органического соединения исходного сырья. [1]
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.1.1 Идентификация метанола
- 5.2 Хранение
- 5.3 Утилизация
- 5.1 Безопасность
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Метанол является исходным продуктом для многих органических соединений, таких как формальдегид, который получают путем окисления метанола.
- CH 3 OH + [O] → CH 2 O + H 2 O
Метанол сгорает при воспламенении на воздухе с образованием углекислого газа и паров воды. В качестве побочного продукта образуются мельчайшие следы формальдегида, если при горении не происходит избытка кислорода.
В качестве побочного продукта образуются мельчайшие следы формальдегида, если при горении не происходит избытка кислорода.
- 2 CH 3 OH + 3 O 2 → 2 CO 2 + 4 H 2 O
Реакция метанола с йодистоводородной кислотой дает йодистоводородную кислоту.
- CH 3 OH + HI → CH 3 I + H 2 O
В отличие от этанола, добавление аниона гипохлорита к метанолу дает не хлороформ, а метилгипохлорит, очень опасный и нестабильный соединение, которое быстро разлагается и может даже взорваться при высоких концентрациях.
- CH 3 OH + 2 NaClO → CH 3 ClO + NaCl + NaOH
Пары метанола в воздухе разлагаются в течение нескольких дней с образованием углекислого газа и водяного пара. [2]
Метанол также используется в производстве биодизеля.
Физический
Метанол представляет собой бесцветную летучую легковоспламеняющуюся жидкость со спиртовым запахом. Он имеет молекулярную массу 32,04, температуру кипения 65 °C и плотность 0,7914 г/см 3 . [3] Метанол смешивается с различными органическими и неорганическими растворителями, хотя и не так часто, как этанол. Смеси метанол/вода можно разделить на два слоя высаливанием карбонатом калия.
Он имеет молекулярную массу 32,04, температуру кипения 65 °C и плотность 0,7914 г/см 3 . [3] Метанол смешивается с различными органическими и неорганическими растворителями, хотя и не так часто, как этанол. Смеси метанол/вода можно разделить на два слоя высаливанием карбонатом калия.
Доступность
Метанол доступен по низкой цене у большинства поставщиков химикатов.
Тип антифриза и автомобильного очистителя, известный как Heet, можно найти на большинстве заправочных станций в Соединенных Штатах, и он содержит метанол на 99% или выше. Некоторые альтернативные виды топлива полностью или в основном состоят из метанола, и из-за обычно продаваемых больших количеств это может быть очень эффективным способом его покупки.
Метанол иногда продается в магазинах красок в виде древесного спирта или метилового спирта. [4] Его также можно купить у научных поставщиков в более высоких классах. Поставки оборудования иногда продают метанол как «метилгидрат». Наконец, некоторые домашние камины используют в качестве топлива метанол, поэтому его также можно найти таким образом. Некоторые растворы для мытья окон содержат 50-90% метанола, а также следы воды и красителя или других спиртов, хотя это встречается реже, поскольку метанол дешевле других спиртов. Некоторые технические спирты представляют собой не что иное, как почти чистый метанол, смешанный с красителем.
Наконец, некоторые домашние камины используют в качестве топлива метанол, поэтому его также можно найти таким образом. Некоторые растворы для мытья окон содержат 50-90% метанола, а также следы воды и красителя или других спиртов, хотя это встречается реже, поскольку метанол дешевле других спиртов. Некоторые технические спирты представляют собой не что иное, как почти чистый метанол, смешанный с красителем.
В некоторых странах продажа «чистого» (высокочистого) метанола может регулироваться из-за того, что он классифицируется как яд или из-за его использования в поддельном спирте. С мая 2018 года продажа средств для мытья окон, содержащих более 0,6% метанола, ограничена в странах ЕС, хотя во многих странах этот запрет, по-видимому, в значительной степени игнорируется, или средства для мытья окон на основе метанола были перемаркированы как технический спирт для общего использования и целей. . [5]
Подготовка
В промышленности метанол получают реакцией монооксида углерода и водорода на катализаторе (обычно это смесь оксидов меди и цинка) при высоких температурах и давлениях. Этот маршрут не практичен в лабораторных масштабах.
Этот маршрут не практичен в лабораторных масштабах.
Неочищенный метанол можно получить деструктивной перегонкой древесины. Этот процесс экономически нецелесообразен в небольших масштабах и дает много побочных продуктов / загрязняющих веществ, в том числе уксусную кислоту, ацетон и смолы. Тем не менее, это все еще интересный процесс, и его можно было бы попробовать исключительно в образовательных целях. [6]
Другой возможный способ получения включает гидролиз метиловых эфиров, таких как метилбензоат. [7] Этот способ позволяет получить гораздо более чистый метанол.
Проекты
- Производство формальдегида
- Сделать триметилборат
- Получение метилсалицилата и других метиловых эфиров
- Синтез йодистого метила
- Синтез диметилового эфира
- Топливный элемент прямого действия на метаноле
- Отделение мочевины от солей аммония (мочевина хорошо растворима в метаноле, но сульфат аммония, например, нет)
Обращение
Безопасность
Метанол значительно более токсичен, чем другие распространенные спирты, такие как этанол или изопропанол, поскольку он метаболизируется к муравьиной кислоте в организме, вызывая слепоту и смерть при высоких дозах. По возможности следует избегать вдыхания паров и контакта с кожей.
По возможности следует избегать вдыхания паров и контакта с кожей.
Случайное проглатывание большого количества метанола приведет к слепоте, а дозы выше 10 мл могут оказаться смертельными. При случайном употреблении метанола первая помощь заключается в том, чтобы дать больному этанол, перорально, водку или другой пищевой спиртосодержащий напиток, а затем немедленно вызвать скорую помощь. Этанол не нейтрализует действие метанола, а конкурирует с ним и препятствует его немедленному метаболизму, что дает врачам больше времени для спасения пациента.
Пламя метанола, как правило, имеет чрезвычайно низкую видимость, особенно в дневное время или в хорошо освещенных помещениях, что затрудняет обнаружение горящего метанола и создает большой риск. Если он используется в случаях, когда возможно возгорание, добавление небольшого количества борной кислоты окрашивает пламя в зеленый цвет и позволяет его увидеть.
Идентификация метанола
Учитывая, что метанол очень похож на этанол по свойствам (запах практически идентичен, их плотность также очень похожа), важно иметь хороший метод различения метанола и этанола.
Поскольку даже минимальное количество примесей в метаноле окрашивает пламя, сжигание спирта — не лучший способ определить, метанол ли у вас там.
Грубый способ обнаружения метанола заключается в том, чтобы поместить в спирт раскаленный кусок медной проволоки. Если пары имеют резкий запах типа «морга» (запах формальдегида), то спирт может содержать метанол. Однако этот метод не очень надежен, так как многие другие соединения могут давать похожий запах, и не каждый человек воспринимает запах формальдегида одинаково, обычно из-за генетики или других биологических факторов.
Лучший способ проверить, содержит ли ваш спирт метанол или это метанол, это добавить небольшое количество вашего спирта к легкому алкану, такому как пентан, гексан или гептан к спирту, так как алканы смешиваются с этанолом, а метанол не смешивается. . Если ваш спирт образует отдельный слой, это не вода, то это метанол. Это лучше всего работает с почти безводным спиртом, но не подходит для пищевого спирта, который обычно содержит воду или некоторые другие органические соединения, которые мешают тесту.
Хранение
Метанол лучше всего хранить в стеклянных или пластиковых бутылках вдали от открытого огня, так как он очень летуч и легко воспламеняется. Убедитесь, что вы четко обозначили бутылку, чтобы отличить ее от менее токсичного и аналогичного этанола.
Утилизация
Сжигание метанола — хороший способ его уничтожения. Делайте это на улице или в вытяжном шкафу. Поскольку метанол горит почти невидимым пламенем, что может представлять серьезную опасность, рекомендуется сделать пламя видимым, смешав метанол с другим растворителем, таким как этанол или ацетон. Старайтесь не сжигать слишком много сразу, чтобы предотвратить его испарение в воздухе или вдыхание продуктов парциального окисления, таких как формальдегид, муравьиная кислота или окись углерода.
Ссылки
- ↑ http://en.wikipedia.org/wiki/Метанол
- ↑ http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=887&loc=ec_rcs#itabs-2d
- ↑ CRC Справочник по химии и физике, 66-е издание, 1985 г.

- ↑ http://en.wikipedia.org/wiki/List_of_commonly_available_chemicals#L.E2.80.93N
- ↑ https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=CELEX:32018R0589
- ↑ http://www.sciencemadness.org/talk/viewthread.php?tid=2652
- ↑ https://www.youtube.com/watch?v=GJMGzIQE4RM
Соответствующие темы Sciencemadness
- Метанол -> метаналь (формальдегид)
- Деструктивная перегонка древесины
- Синтез метанола (Новая тема)
2.5: Химические формулы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 370696
- OpenStax
- OpenStax
Цели обучения
- Обозначение состава молекул с использованием молекулярных формул и эмпирических формул
- Представьте расположение связей атомов внутри молекул, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, в котором используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, показывающие количество атомов каждого типа в молекуле. (Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
Структурная формула соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома C и четырех атомов H, указывающие на количество атомов в молекуле (рисунок \(\PageIndex{1}\)). Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, удерживающее их вместе в молекуле или кристалле.) Мы обсудим химические связи и увидим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Шарико-стержневая модель показывает геометрическое расположение атомов с размерами атомов не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Хотя многие элементы состоят из дискретных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных друг с другом. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 соответственно. Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента серы состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис. \(\PageIndex{2}\)).
\(\PageIndex{2}\)).
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют совершенно разные виды. H 2 представляет собой молекулярную формулу; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в одно целое. Выражение 2H 2 представляет собой две молекулы двухатомного водорода (рисунок \(\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): символы H, 2H, H 2 и 2H 2 представляют очень разные объекты.
Соединения образуются при химическом соединении двух или более элементов, что приводит к образованию связей. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Иногда мы описываем состав этих соединений с помощью эмпирической формулы, которая указывает типы присутствующих атомов и простейшее целочисленное отношение числа атомов (или ионов) в соединении . Например, диоксид титана (используемый в качестве пигмента в белой краске и в густых белых блокирующих солнцезащитных средствах) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титан (Ti) и кислород (O) как составляющие диоксида титана и указывает на присутствие вдвое большего количества атомов элемента кислорода, чем атомов элемента титана (рис. \(\PageIndex{4}\) ).
Рисунок \(\PageIndex{4}\): (a) Белая составная двуокись титана обеспечивает эффективную защиту от солнца. (б) Кристалл диоксида титана, TiO 2 , содержит титан и кислород в соотношении 1 к 2. Атомы титана окрашены в серый цвет, а атомы кислорода — в красный. (кредит: модификация работы «ossous»/Flickr).
Атомы титана окрашены в серый цвет, а атомы кислорода — в красный. (кредит: модификация работы «ossous»/Flickr).Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают фактическое количество атомов каждого элемента в молекуле соединения. Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу). Например, экспериментально можно определить, что бензол содержит два элемента, углерод (С) и водород (Н), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (Рисунок \(\PageIndex{5}\)).
Рисунок \(\PageIndex{5}\): Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений. Молекулу бензола можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. г) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы).
Молекулу бензола можно представить в виде (а) структурной формулы, (б) шаростержневой модели и (в) модели заполнения пространства. г) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы).Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это своего рода академическое упражнение; на практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, C 2 Н 4 О 2 . Эта формула показывает, что молекула уксусной кислоты (рис. \(\PageIndex{6}\)) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2:4:2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов, 1:2:1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Рисунок \(\PageIndex{6}\): (a) уксус содержит уксусную кислоту, C 2 H 4 O 2 , который имеет эмпирическую формулу CH 2 O. Он может быть представлен как (b) структурная формула и (c) как шаростержневая модель. (кредит a: модификация работы «HomeSpot HQ»/Flickr)
Он может быть представлен как (b) структурная формула и (c) как шаростержневая модель. (кредит a: модификация работы «HomeSpot HQ»/Flickr)Пример \(\PageIndex{1}\): эмпирические и молекулярные формулы
Молекулы глюкозы (кровяной сахар) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярная и эмпирическая формулы глюкозы?
Решение
Молекулярная формула C 6 H 12 O 6 , поскольку одна молекула фактически содержит 6 атомов C, 12 H и 6 атомов O. Простейшее целочисленное отношение атомов C к H к O в глюкозе составляет 1:2:1, поэтому эмпирическая формула CH 2 O.
Упражнение \(\PageIndex{1}\)
Молекула метальдегида (пестицид, используемый для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярная и эмпирическая формулы метальдегида?
- Ответить
Молекулярная формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Изомеры
Важно знать, что одни и те же атомы могут располагаться по-разному: Соединения с одинаковой молекулярной формулой могут иметь разную связь между атомами и, следовательно, разную структуру. Например, может ли быть другое соединение с той же формулой, что и уксусная кислота, C 2 Н 4 О 2 ? И если да, то какова будет структура его молекул?
Например, может ли быть другое соединение с той же формулой, что и уксусная кислота, C 2 Н 4 О 2 ? И если да, то какова будет структура его молекул?
Если вы предполагаете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы. Два атома C, четыре атома H и два атома O также могут образовывать метилформиат, который используется в производстве в качестве инсектицида и для быстросохнущих покрытий. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Примерами изомеров являются уксусная кислота и метилформиат — соединения с одинаковой химической формулой, но разной молекулярной структурой (рис. \(\PageIndex{7}\)). Обратите внимание, что это небольшое различие в расположении атомов оказывает большое влияние на их соответствующие химические свойства. Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса), когда делаете заправку для салата.
Существует множество типов изомеров (рис. \(\PageIndex{8}\)). Уксусная кислота и метилформиат являются структурными изомерами, соединениями, в которых молекулы различаются тем, как атомы связаны друг с другом. Существуют также различные типы пространственных изомеров, в которых относительная ориентация атомов в пространстве может быть различной. Например, сложный карвон (содержащийся в семенах тмина, мяте колосовой и кожуре мандарина) состоит из двух изомеров, которые являются зеркальным отражением друг друга. S -(+)-карвон пахнет тмином, а R -(-)-карвон пахнет мятой.
Молекулярные формулы: https://youtu.be/yBffLt2Y6Ck
Резюме
A Молекулярная формула использует химические символы и нижние индексы для указания точного количества различных атомов в молекуле или соединении. Эмпирическая формула дает простейшее целочисленное соотношение атомов в соединении. Структурная формула указывает на расположение связей атомов в молекуле. Шаростержневые модели и модели с заполнением пространства показывают геометрическое расположение атомов в молекуле. Изомеры – это соединения с одинаковой молекулярной формулой, но разным расположением атомов.
Глоссарий
- эмпирическая формула
- формула, показывающая состав соединения в виде простейшего целочисленного соотношения атомов
- изомеры
- соединения с одинаковой химической формулой, но разной структурой
- молекулярная формула Формула
- , указывающая состав молекулы соединения и дающая фактическое число атомов каждого элемента в молекуле соединения.

- пространственные изомеры
- соединения, в которых относительная ориентация атомов в пространстве различна
- структурный изомер
- одно из двух веществ, имеющих одинаковую молекулярную формулу, но разные физические и химические свойства, поскольку их атомы связаны по-разному
- структурная формула
- показывает атомы в молекуле и то, как они связаны
Эта страница под названием 2.5: Химические формулы распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Метки
- Тег автора:OpenStax
- эмпирическая формула
- изомеры
- молекулярная формула
- источник@https://openstax.
 org/details/books/chemistry-2e
org/details/books/chemistry-2e - источник[1]-chem-38141
- источник[2]-chem-38141
- пространственные изомеры
- структурная формула
- структурные изомеры
МЕТИЛФОРМИАТ | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
|
|
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| Метилформиат |
| ||
NFPA 704
| Алмаз | Опасность | Значение | Описание |
|---|---|---|---|
| Здоровье | 2 | Может привести к временной потере трудоспособности или остаточной травме. | |
| Воспламеняемость | 4 | Легко горит. Быстро или полностью испаряется при атмосферном давлении и нормальной температуре окружающей среды. | |
| нестабильность | 0 | Обычно стабилен даже в условиях пожара. | |
| Специальный |
(NFPA, 2010)
Общее описание
Прозрачная бесцветная жидкость с приятным запахом. Температура вспышки -27°F. Менее плотный, чем вода. Пары тяжелее воздуха.
Опасности
Что это за информация?
Опасные поля
включают
специальные предупреждения об опасности
воздух и вода
реакции, пожароопасность, опасность для здоровья, профиль реактивности и
подробности о
задания реактивных групп
а также
потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
Предупреждения о реактивности
- Легковоспламеняющийся
Реакции с воздухом и водой
Легко воспламеняется. Вода. Медленно реагирует с водой, образуя муравьиную кислоту, вызывающую коррозию, и метанол, легковоспламеняющуюся жидкость. Оба продукта растворяются в воде.
Опасность возгорания
Поведение при пожаре: Пары тяжелее воздуха и могут перемещаться на значительное расстояние до источника воспламенения и вспыхивать обратно. (USCG, 1999)
Опасность для здоровья
Вдыхание вызывает раздражение слизистых оболочек. Продолжительное вдыхание может вызвать наркоз и симптомы со стороны центральной нервной системы, включая некоторое временное нарушение зрения. Контакт с жидкостью раздражает глаза и может вызвать раздражение кожи, если оставить ее. Проглатывание вызывает раздражение полости рта и желудка и угнетение центральной нервной системы, включая нарушения зрения. (USCG, 1999)
(USCG, 1999)
Профиль реакционной способности
МЕТИЛФОРМИАТ реагирует с кислотами с выделением тепла вместе со спиртами и кислотами. Сильные окисляющие кислоты могут вызвать бурную реакцию, достаточно экзотермическую, чтобы воспламенить продукты реакции. Тепло также выделяется с щелочными растворами. Горючий водород образуется при смешивании с щелочными металлами и гидридами.
Принадлежит к следующей реакционноспособной группе (группам):
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа
включают в себя расстояния изоляции и эвакуации, а также рекомендации по
пожаротушение, пожарное реагирование, защитная одежда и первая помощь.
информация в CAMEO Chemicals поступает из различных
источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 129 [Горючие жидкости (смешивающиеся с водой / вредные)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки на расстоянии не менее 50 метров (150 футов) во всех направлениях.
КРУПНЫЙ РАЗЛИВ: Рассмотрите начальную эвакуацию по ветру на расстояние не менее 300 метров (1000 футов).
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 129 [Горючие жидкости (смешивающиеся с водой / вредные)]:
ВНИМАНИЕ: Большинство этих продуктов имеют очень низкую температуру воспламенения. Использование распыления воды при тушении пожара может быть неэффективным.
НЕБОЛЬШОЙ ПОЖАР: Сухой химикат, CO2, распыление воды или спиртоустойчивая пена. Не используйте сухие химические огнетушители для тушения возгораний, связанных с нитрометаном (UN1261) или нитроэтаном (UN2842).
БОЛЬШОЙ ПОЖАР: Распыление воды, туман или спиртоустойчивая пена. Избегайте направления прямых или сплошных струй непосредственно на продукт. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. При массовом возгорании используйте беспилотные устройства управления потоком или стволы-мониторы; если это невозможно, отойдите от зоны и дайте огню гореть. (ЭРГ, 2020)
(ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 129 [Горючие жидкости (смешивающиеся с водой / вредные)]:
УСТРАНИТЕ все источники воспламенения (не курить, факелы, искры или пламя) в непосредственной близости. Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к рассыпанному материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Не допускать попадания в водные пути, канализацию, подвалы или замкнутые пространства. Для уменьшения паров можно использовать пароподавляющую пену. Впитать или засыпать сухой землей, песком или другим негорючим материалом и переложить в контейнеры. Используйте чистые, искробезопасные инструменты для сбора абсорбированного материала.
БОЛЬШОЙ РАЗЛИВ: Оборудуйте дамбу далеко перед местом разлива жидкости для последующего удаления. Распыление воды может уменьшить испарение, но не может предотвратить возгорание в закрытых помещениях. (ЭРГ, 2020)
(ЭРГ, 2020)
Защитная одежда
Выдержка из Карманного справочника NIOSH по метилформиату:
Кожа: ПРЕДОТВРАТИТЬ КОНТАКТ С КОЖЕЙ — Носите соответствующую защитную одежду для предотвращения контакта с кожей.
Глаза: ПРЕДОТВРАЩАЙТЕ ПОПАДАНИЕ В ГЛАЗА — Носите соответствующую защиту для глаз, чтобы предотвратить попадание в глаза.
Мытье кожи: ПРИ ЗАГРЯЗНЕНИИ — Рабочий должен немедленно вымыть кожу, когда она становится загрязненной.
Снять: ПРИ ВЛАЖНОСТИ (ЛЕГКОВОСПЛАМЕНЯЮЩЕЙСЯ) — Рабочую одежду, которая намокла, следует немедленно снять из-за ее опасности воспламенения (например, для жидкостей с температурой вспышки <100°F).
Смена: Нет рекомендаций, указывающих на необходимость смены работником одежды после рабочей смены. (НИОСХ, 2022 г.)
Ткани DuPont Tychem® Suit Fabrics
Обозначение ткани, подробности тестирования и предостережение от DuPont
Tychem® Fabric Legend
«> швейцарских франков| QS = Tychem 2000 |
| Контроль качества = Tychem 2000 |
| SL = Tychem 4000 |
| C3 = Тайхем 5000 |
| TF = Tychem 6000 |
| TP = Tychem 6000 FR |
| RC = Tychem RESPONDER® CSM |
| ТК = Тайхем 10000 |
| RF = Tychem 10000 FR |
Детали тестирования
Данные о проницаемости ткани были получены для DuPont третьей стороной
лаборатория. Данные о проникновении промышленных химикатов получены в
ASTM F739. Нормализованное время прорыва (время, в которое
скорость проникновения превышает 0,1 мкг/см2/мин) сообщается в минутах. Все
химические вещества были испытаны при температуре приблизительно от 20°C до 27°C, если
в противном случае указано. Все химические вещества были протестированы в концентрации
больше 95%, если не указано иное.
Боевые отравляющие вещества (люизит, зарин, зоман, сернистый иприт, табун
и VX Nerve Agent) были протестированы при температуре 22°C и относительной влажности 50%.
в соответствии с военным стандартом MIL-STD-282. «Время прорыва» для химической
боевых отравляющих веществ определяется как время, когда кумулятивная масса,
проникновение через ткань превышает предел MIL-STD-282 [либо
1,25 или 4,0 мкг/см2].
Все химические вещества были протестированы в концентрации
больше 95%, если не указано иное.
Боевые отравляющие вещества (люизит, зарин, зоман, сернистый иприт, табун
и VX Nerve Agent) были протестированы при температуре 22°C и относительной влажности 50%.
в соответствии с военным стандартом MIL-STD-282. «Время прорыва» для химической
боевых отравляющих веществ определяется как время, когда кумулятивная масса,
проникновение через ткань превышает предел MIL-STD-282 [либо
1,25 или 4,0 мкг/см2].
Предупреждение DuPont
Эта информация основана на технических данных, которые, по мнению DuPont,
быть достоверным на дату выпуска. подлежит доработке как доп.
приобретаются знания и опыт. Информация отражает
лабораторное исследование тканей, некомплектных швейных изделий, под
контролируемые условия. Предназначен для информационного использования лицами
наличие технических навыков для оценки в соответствии с их конкретным конечным использованием
условиях, на свое усмотрение и риск. это пользователь
ответственность за определение уровня токсичности и надлежащее
необходимы средства индивидуальной защиты. Любой, кто собирается использовать это
Информация должна сначала подтвердить, что выбранная одежда подходит
для предполагаемого использования. Во многих случаях швы и застежки имеют более короткую длину.
время прорыва и более высокие скорости проникновения, чем у ткани. Если
ткань разорвана, потерта или проколота, или если швы или застежки выходят из строя,
или если прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен
прекратите использование одежды, чтобы избежать потенциального воздействия химических веществ.
Поскольку условия использования находятся вне нашего контроля, DuPont не делает никаких
гарантии, явные или подразумеваемые, включая, помимо прочего,
гарантии товарной пригодности или пригодности для конкретного использования и
не несет никакой ответственности в связи с любым использованием этой информации.
это пользователь
ответственность за определение уровня токсичности и надлежащее
необходимы средства индивидуальной защиты. Любой, кто собирается использовать это
Информация должна сначала подтвердить, что выбранная одежда подходит
для предполагаемого использования. Во многих случаях швы и застежки имеют более короткую длину.
время прорыва и более высокие скорости проникновения, чем у ткани. Если
ткань разорвана, потерта или проколота, или если швы или застежки выходят из строя,
или если прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен
прекратите использование одежды, чтобы избежать потенциального воздействия химических веществ.
Поскольку условия использования находятся вне нашего контроля, DuPont не делает никаких
гарантии, явные или подразумеваемые, включая, помимо прочего,
гарантии товарной пригодности или пригодности для конкретного использования и
не несет никакой ответственности в связи с любым использованием этой информации. Эта информация не предназначена для использования в качестве лицензии на работу или
рекомендацию о нарушении любого патента, товарного знака или технического
информацию DuPont или других лиц, касающуюся любого материала или его использования.
Эта информация не предназначена для использования в качестве лицензии на работу или
рекомендацию о нарушении любого патента, товарного знака или технического
информацию DuPont или других лиц, касающуюся любого материала или его использования.
| Химическая | Номер CAS | Состояние | КС | КК | СЛ | С3 | ТФ | ТП | РЦ | ТК | РФ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Метилформиат | 107-31-3 | Жидкость | >480 |
> указывает больше чем.
Специальное предупреждение от DuPont: ткани Tychem® и Tyvek® не должны используется вблизи тепла, пламени, искр или в потенциально легковоспламеняющихся или взрывоопасные среды. Только…
Подробнее…
…Tychem® ThermoPro, Tychem® Reflector® и Tychem® TK моделей 600T/601T (с алюминированным верхним костюмом) одежда разработана и испытана, чтобы помочь уменьшить ожоги при спасении от внезапного пожара. Пользователи Tychem® Модели ThermoPro, Tychem® Reflector® и Tychem® TK 600T/601T (с алюминизированный верхний костюм) предметы одежды не должны заведомо попадать во взрывчатое вещество Окружающая среда. Одежда Tychem® с прикрепленными носками должна носиться внутри. защитную верхнюю обувь и не подходят в качестве верхней обуви. Эти прикрепленные носки не обладают достаточной прочностью или сопротивлением скольжению, чтобы быть носится как наружное покрытие стопы.
(Дюпон, 2022)
Первая помощь
ГЛАЗА: Сначала проверьте наличие у пострадавшего контактных линз и снимите их, если они есть. Промывать глаза пострадавшего водой или физиологическим раствором в течение 20–30 минут, одновременно звоня в больницу или токсикологический центр. Не закапывайте в глаза пострадавшему какие-либо мази, масла или лекарства без специальных указаний врача. НЕМЕДЛЕННО доставьте пострадавшего после промывания глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.
Промывать глаза пострадавшего водой или физиологическим раствором в течение 20–30 минут, одновременно звоня в больницу или токсикологический центр. Не закапывайте в глаза пострадавшему какие-либо мази, масла или лекарства без специальных указаний врача. НЕМЕДЛЕННО доставьте пострадавшего после промывания глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.
КОЖА: НЕМЕДЛЕННО промойте пораженные участки кожи водой, сняв и изолировав всю загрязненную одежду. Тщательно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы доставить пострадавшего в больницу для лечения.
ПРИ ВДЫХАНИИ: НЕМЕДЛЕННО покинуть зараженную зону; сделать глубокий вдох свежего воздуха. При появлении симптомов (таких как свистящее дыхание, кашель, одышка или жжение во рту, горле или груди) вызовите врача и будьте готовы доставить пострадавшего в больницу. Обеспечьте надлежащую защиту органов дыхания спасателям, входящим в неизвестную атмосферу. По возможности следует использовать автономный дыхательный аппарат (SCBA); если это невозможно, используйте уровень защиты выше или равный рекомендованному в разделе «Защитная одежда».
По возможности следует использовать автономный дыхательный аппарат (SCBA); если это невозможно, используйте уровень защиты выше или равный рекомендованному в разделе «Защитная одежда».
ПРОГЛАТЫВАНИЕ: НЕ ВЫЗЫВАТЬ РВОТУ. Летучие химические вещества имеют высокий риск попадания в легкие жертвы во время рвоты, что усугубляет проблемы со здоровьем. Если пострадавший в сознании и у него нет конвульсий, дайте 1-2 стакана воды для разбавления химиката и НЕМЕДЛЕННО позвоните в больницу или токсикологический центр. НЕМЕДЛЕННО доставьте пострадавшего в больницу. Если пострадавший находится в судорогах или без сознания, ничего не давать ртом, убедиться, что дыхательные пути пострадавшего открыты, и уложить пострадавшего на бок так, чтобы голова была ниже туловища. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992)
Физические свойства
Что это за информация?
Поля физических свойств
включают в себя такие свойства, как давление пара и
температура кипения, а также пределы взрываемости и
пороги токсического воздействия
Информация в CAMEO Chemicals поступает из различных источников. источники данных.
источники данных.
| Химическая формула: |
|
Температура вспышки: -26°F (НТП, 1992)
Нижний предел взрываемости (НПВ): 5 % (NTP, 1992)
Верхний предел взрываемости (ВПВ): 23 % (НТП, 1992)
Температура самовоспламенения: 853°F (USCG, 1999)
Точка плавления: -147,6°F (НТП, 1992)
Давление паров: 400 мм рт.ст. при 61°F ; 476 мм рт.ст. при 68°F (NTP, 1992)
Плотность пара (относительно воздуха): 2.07 (НТП, 1992)
Удельный вес: 0,977 при 68°F (USCG, 1999)
Точка кипения: 88,7°F при 760 мм рт.ст. (NTP, 1992)
Молекулярный вес: 60.05 (НТП, 1992)
Растворимость в воде: больше или равно 100 мг/мл при 72°F (NTP, 1992)
Энергия/потенциал ионизации: 10,82 эВ (NIOSH, 2022)
IDLH: 4500 частей на миллион (NIOSH, 2022)
AEGL (Рекомендуемые уровни острого воздействия)
Информация об AEGL отсутствует.
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитного действия)
| Химические вещества | ПАК-1 | ПАК-2 | ПАК-3 | |
|---|---|---|---|---|
| Метилформиат; (муравьиная кислота, метиловый эфир) (107-31-3) | 100 частей на миллион | 830 частей на миллион | 5000 частей на миллион | НПВ = 45000 частей на миллион |
указывает, что значение составляет 10–49 % НПВ.
(DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | ЭПКРА 313 ТРИ | RCRA Код | CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Муравьиная кислота, метиловый эфир | 107-31-3 | 10000 фунтов | |||||
| Метилформиат | 107-31-3 | 10000 фунтов |
(Список списков EPA, 2022 г. )
)
Антитеррористические стандарты CISA Chemical Facility (CFATS)
| ВЫПУСК | КРАЖА | САБОТАЖ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Исследуемое химическое вещество | Номер CAS | Минимальная концентрация | STQ | Безопасность Выпуск | Минимальная концентрация | СТК | Безопасность Выпуск | Минимальная концентрация | STQ | Безопасность Выпуск |
| Метилформиат; [Метиловый эфир муравьиной кислоты] | 107-31-3 | 1,00 % | 10000 фунтов | легковоспламеняющийся | ||||||
(CISA, 2007)
Перечень стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.

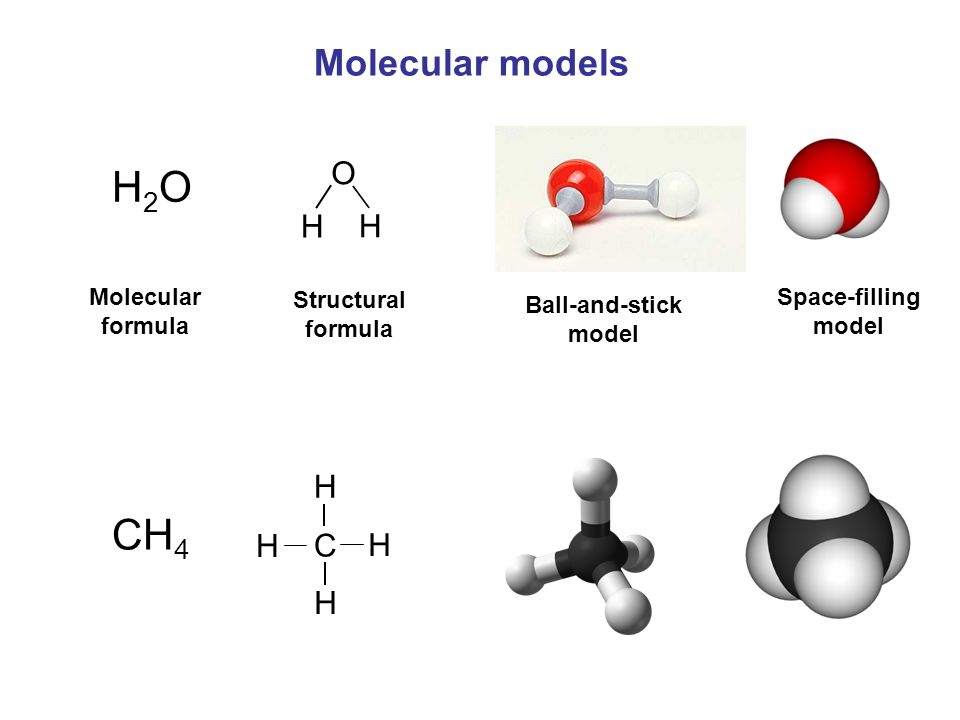 76KB
76KB 91KB
91KB 46KB
46KB