Формула углекислого газа
0
Опубликовано: 27.09.2019
Для обозначения химических элементов используются символы, образованные от их латинских названий. Формула углекислого газа CO2 указывает на простое соединение, содержащее углерод и кислород. Вещество, характеризующееся универсальными свойствами, используется в разных отраслях, производится в промышленных и кустарных условиях,
Оглавление:
- Что такое собой представляет
- Как выглядит формула
- Свойства углекислого газа
- Получение
- Применение
Что такое собой представляет
Двуокись углерода имеет другие определения такие как, угольный ангидрид, сухой лед — бесцветный газ. Соединение характеризуется кисловатым вкусом, который наблюдается при наличии большой концентрации. В естественных условиях при атмосферном давлении углекислота находится в газообразном состоянии.
Соединение характеризуется кисловатым вкусом, который наблюдается при наличии большой концентрации. В естественных условиях при атмосферном давлении углекислота находится в газообразном состоянии.
Источники образования двуокиси углерода включают в себя:
- дыхание животных и растений;
- деятельность вулканов;
- разложение органических веществ.
В виде соединений вещество находится в полезных ископаемых — угле, нефти, известняке, торфе. При критической температуре -31,3 ºC вещество легко сжижается, а при охлаждении превращается в массу, по внешнему виду напоминающую снег. Соединение плавится при давлении в 5 атмосфер. Жидкая углекислота не проводит электрический ток.
Сухой лед и жидкий угольный ангидрид характеризуются широким спектром применения, но эти формы легко распадаются, имеют низкую устойчивость. Газообразное соединение является важной частью состава атмосферы и Мирового океана.
Как выглядит формула
Химическая формула углеродистого соединения CO2, структурная O=C=O.
Молекула соединения характеризуется ковалентной полярной химической связью. Полярность обеспечивается большим значением электроотрицательности. Молярная масса вещества составляет 44.
Свойства углекислого газа
Углекислый газ не имеет запаха, цвета, вкуса, легко растворяется в воде. Это свойство используется при изготовлении газированных напитков. Физические свойства соединения:
- тяжелее воздуха в 1,5 раза;
- не поддерживает горение;
- плотность — 1,977 г/л;
- кристаллизуется при температуре -78,3ºC;
- сублимируется при -78 ºC;
- сухой лед испаряется при атмосферном давлении;
- в его атмосфере может поддерживаться горение щелочных и щелочноземельных металлов;
- в электрическом разряде светится бело-зеленым цветом;
- образуется при горении и гниении органических веществ.

При растворении в воде образуется смесь угольной кислоты и двуокиси углерода. Качественная реакция на углекислый газ характеризуется помутнением известковой воды. В результате взаимодействия гидроксида кальция образуется осадок — карбонат кальция.
Получение
Технология производства углекислоты отличается разнообразностью. Газ выделяется вместе с дымовыми отходами ТЭЦ и электростанций, при брожении спиртового состава. Абсорбирование газа предусматривает очистку, которая выполняется поэтапно в соответствии с установленными требованиями Государственного стандарта.
Газ на нефтеперерабатывающих предприятиях — путем адсорбции моноэтаноламином и карбонатом калия. Технология сбора углерода предусматривает подачу по трубопроводу веществ, которые насыщаются углекислотой.
При повышенной температуре или низком давлении происходит высвобождение чистого соединения и других продуктов распада. В лабораторных условиях извлечение CO2 возможно в результате реакции кислот и гидрокарбонатов.
Реакция происходит при низком давлении. После очистки газ попадает в компрессор, сжимается и восстанавливается в 2 адсорбера, очищается от второстепенных запахов и переводится в конденсат. Этот метод применяют при спиртовом брожении на пивоварнях.
Угольный ангидрит в твердом агрегатном состоянии (сухой лед) образуется путем обработки жидкости низкой температурой -56ºC. В промышленном производстве только 20% объема исходного вещества переходит в лед, а остальное количество превращается в газ.
Технология изготовления твердой углекислоты предусматривает промывку, сжатие, охлаждение газообразного углерода. После очистки активированным углем жидкость поступает в холодильник, затем направляется на испарение и под пресс.
Применение
Использование материала в различных отраслях связано с химическими и физическими свойствами вещества. Двуокись углерода безопасна для человека в низких концентрациях, является основным компонентом, поддерживающим жизнедеятельность человека. Газ не поддерживает горения, поэтому используется в системах пожаротушения.
Двуокись углерода безопасна для человека в низких концентрациях, является основным компонентом, поддерживающим жизнедеятельность человека. Газ не поддерживает горения, поэтому используется в системах пожаротушения.
При сварке металла предотвращает окисление и защищает от нагрева. Распыление газа в парнике стимулирует развитие растений, повышает урожайность. В медицине газ применяется для создания атмосферы при проведении операций, введении пациента в наркоз. В приборах и оборудовании вещество используется в качестве абразивного материала для прочистки.
В пищевой промышленности углекислота применяют в качестве консерванта при изготовлении напитков. Сухой лед используется в морозильных камерах, предназначенных для транспортировки. В производстве бумаги вещество регулирует водородный показатель целлюлозы или древесной массы.
Химическая промышленность использует угольный ангидрит для нейтрализации щелочей, регулирования температуры в реакциях, синтеза искусственных соединений. В металлургии двуокись углерода применяется для осаждения дыма, регулировки направления потока воды при отводе из шахт.
В металлургии двуокись углерода применяется для осаждения дыма, регулировки направления потока воды при отводе из шахт.
Компании по производству технических газов предлагают купить углекислоту, произведенную по всем требованиям и хранящуюся согласно ГОСТу. Заказ можно оформить на сайте организации, по телефону. Доставка осуществляется по предусмотренным условиям сотрудничества.
Сергей Одинцов
tweet
Углекислый газ, CO2, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Molecule CO2 — Иллюстрациян и Vektorgrafiken
Grafiken
- Bilder
- FOTOS
- GRAFIKEN
- VEKTOREN
- VIDEOS
DUCHSTERN SIZE 1.6663
. Oder starten Sie eine neuesuche, um noch mehr faszinierende Stock-Bilder und Vektorarbeiten zu entdecken.
Сортировать по номеру:
Am beliebtesten
Fitness, Gesundheit, Fitness-Studio Trendige Iconen Auf Kreisen — Молекула СО2, графика, клипарты, мультфильмы и символыFitness, Gesundheit, Fitness-Studio Trendige Ikonen auf Kreisen
CO2-Molekül-Vektor-Symbol
molekülliniensymbole. вектор-иллюстрация энтальтен значок-аминозавр, пептид, гормон, белок, коллаген, озон, o2 химическая форма пиктограмма для химии. grüne farbe bearbeitbarer strich — молекула СО2, графика, клипарт, мультфильмы и символы
вектор-иллюстрация энтальтен значок-аминозавр, пептид, гормон, белок, коллаген, озон, o2 химическая форма пиктограмма для химии. grüne farbe bearbeitbarer strich — молекула СО2, графика, клипарт, мультфильмы и символыMolekülliniensymbole. Увлекательная векторная иллюстрация Icon-Aminosäur
Molekülliniensymbole. Die Vectorillustration umfasste das Symbol Aminosäure, Peptid, Hormon, Protein, Kollagen, Ozon, O2 chemische Formel Umriss Piktogramm für die Chemie. Bearbeitbarer Strich mit grüner Farbe.
gemeinsame moleküle set — co2 molecule stock-grafiken, -clipart, -cartoons und -symbole. . co2-molekül химический элемент линейный стиль. quadratisches formsymbol der атомарная структура kohlendioxidgasmoleküls. treibhausgasdämpfe. schwarze lineare vektorillustration isoliert auf weiß. — Молекула СО2 сток-графика, -клипарт, -мультфильмы и -символCO2-Molekül chemisches Element linearer Stil. Quadratisches…
CO2-Molekül chemisches Element lineares Stilsymbol. Квадратичный символ формы атомной молекулы газа Kohlendioxid Struktur. Treibhausgasdämpfe. Schwarze lineare Vektorillustration isoliert auf weiß.
Квадратичный символ формы атомной молекулы газа Kohlendioxid Struktur. Treibhausgasdämpfe. Schwarze lineare Vektorillustration isoliert auf weiß.
Синий Молекулярный символ. Linearer Stil flacher Vektor blaues Symbol…
Blaues Molekülsymbol. Linearer Stil flacher Вектор синий символ химических элементов. Atommodell von flyßendem Gas с CO2-Kohlendioxid. Symbolsymbol für Wissenschaft, Bildung, Technologie, Unternehmen.
kohlendioxid-symbol — молекула СО2, графика, клипарт, мультфильмы и символыKohlendioxid-symbol
molekülliniensymbole. вектор-иллюстрация энтальтен значок-аминозавр, пептид, гормон, белок, коллаген, озон, o2 химическая форма пиктограмма для химии. 64 x 64 пикселя идеальное редактирование хаб — молекула СО2 сток-графики, -клипарт, -мультфильмы и -символ
64 x 64 пикселя идеальное редактирование хаб — молекула СО2 сток-графики, -клипарт, -мультфильмы и -символMolekülliniensymbole. Увлекательная векторная иллюстрация Icon-Aminosäur
Molekülliniensymbole. Die Vectorillustration umfasste das Symbol Aminosäure, Peptid, Hormon, Protein, Kollagen, Ozon, O2 chemische Formel Umriss Piktogramm für die Chemie. 64×64 пикселей идеальное изображение.
sammlung molekularchemischer model kombinationen aus wasserstoff-sauerstoff-natriumkohlenstoffstickstoff und chlor. vektormoleküle illustration isoliert auf weißemhintergrund — молекула СО2, графика, клипарт, мультфильмы и символМолекулярно-химическая комбинация моделей, аус…
Комбинация молекулярно-химических моделей, объединенная с Wasserstoff-Sauerstoff-Natriumkohlenstoff-Stickstoff und Chlor. Vektormolekül-Set-Illustration isoliert auf weißem Hintergrund
kohlenstoffkreislauf. Баум поглощает CO2 и устанавливает O2 бесплатно.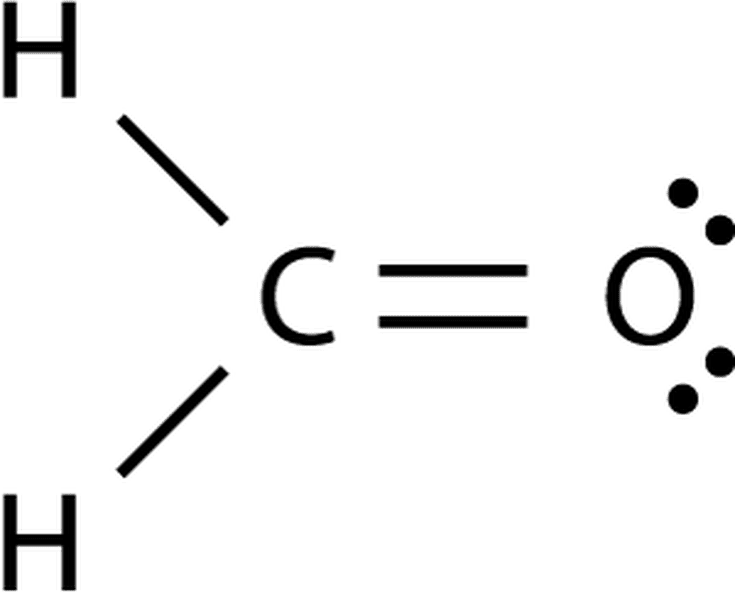 схема фотосинтеза-процесса. — Молекула СО2 сток-графика, -клипарт, -мультфильмы и -символ
схема фотосинтеза-процесса. — Молекула СО2 сток-графика, -клипарт, -мультфильмы и -символKohlenstoffkreislauf. Баум абсорбирует CO2 и освобождает O2….
Reduzierung von Kohlendioxid. Зауэрстоффпродукция. Aufforstungskonzept. Умвельтфрендлих. Векторные иллюстрации, флеш, клипарт.
Nationale Emissionshöchstgrenzen für bestimmte luftschadstoffe — молекула СО2 графика, -клипарт, -мультфильмы и -symbole черный квадратный вкус. вектор — молекула СО2 сток-графики, -клипарт, -мультфильмы и -символНабор полипропиленов, химических форм с лучшими бензолрингенами,…
Набор полипропиленов, химических форм с лучшими бензолрингенами, химическими реагентами и выбросами CO2 в общем. Schaltfläche für das schwarze Quadrat. Вектор
Kohlendioxid-symbol — Cohlendioxidmolekül-Konzeptillustration nahtloses must must des co2-moleküls. linearer stil weiße chemische elementmoleküle auf blauerhintergrundtextur. medizin wissenschaft technologie biochemie druckdesign. — Молекула СО2 сток-графики, -клипарт, -мультфильмы и -символ
medizin wissenschaft technologie biochemie druckdesign. — Молекула СО2 сток-графики, -клипарт, -мультфильмы и -символNahtloses Muster des CO2-Moleküls. Linearer Stil weiße chemische…
CO2-Molekül nahtloses Muster. Lineare weiße chemische Elementmoleküle auf blauer Hintergrundtextur. Medizin Wissenschaft Technologie Biochemie Druckdesign.
Fitness, Gesundheit, Fitness Trendige Iconen Auf Kreisen — Co2 Molecule Stock-Grafiken, -Clipart, -Cartoons und -Symbole клипарт, -cartoons und -symboleMolecule Icons — Classic Line Serie
Bearbeitbare Strich- Molekül- Liniensymbole
kohlenmonoxid und kohlendioxid-moleküle und chemische formeln — молекула СО2 фондовая графика, -клипарт, -мультфильмы и -символKohlenmonoxid und Kohlendioxid-Moleküle und chemische Formeln
Kohlenmonoxid CO и Kohlendioxid CO2 Molekül Modelle und chemische Formeln. Газ. Ball-and-Stick-Modelle, Geometrische Strukturen und Strukturformeln. Иллюстрация на заднем плане. Вектор.
Газ. Ball-and-Stick-Modelle, Geometrische Strukturen und Strukturformeln. Иллюстрация на заднем плане. Вектор.
3D изометрический флачер вектор концепт иллюстрации дес…
3D Isometrischer flacher Vektor Konzeptionelle Darstellung des Kohlendioxidmoleküls, der Chemischen Struktur von CO2
Wasser, Kohlendioxid, метан, лахгаз, озонмолекюль. трейбхаусгазе. Химическая форма и молекулярная модель — молекула СО2, графика, клипарт, мультфильмы и символыWasser, Kohlendioxid, Methan, Lachgas, Ozonmolekül. Трейбхаусгазе.
treibhausgasen: метан и колендиоксид — молекула СО2, графика, -клипарт, -мультфильмы и -символTreibhausgasen: метан и колендиоксид
Baum абсорбирует CO2 и устанавливает O2 бесплатно. Коленстофф Крайслауф. схема фотосинтеза-процесса. — молекула СО2 сток-графики, -клипарт, -мультфильмы и -символ Баум поглощает CO2 и устанавливает O2 бесплатно. Kohlenstoffkreislauf….
Kohlenstoffkreislauf….
Reduzierung von Kohlendioxid. Зауэрстоффпродукция. Aufforstungskonzept. Умвельтфрендлих. Векторные иллюстрации, флеш, клипарт.
co2-kohlendioxid-3d-molekül — молекула co2 сток-графика, -клипарт, -мультфильмы и -символCO2-kohlendioxid-3D-Molekül
Анализ горения
Получение эмпирических и молекулярных формул из Данные о сжигании
Эмпирические и молекулярные формулы соединений, содержащих только углерод и водород (C a H b ) или углерод, водород и кислород (C a H b O c ) можно определить с помощью процесса, называемого анализом горения. Шаги для этой процедуры
Взвесьте образец анализируемое соединение и поместите его в прибор, показанный на рис. изображение ниже.
Сжечь компаунд
полностью. Единственные продукты сгорания соединения,
содержит только углерод и водород (C a H b ) или
углерод, водород и кислород (C a H b O c )
являются углекислый газ и вода.
Н 2 О и CO 2 проходят через две трубки. Одна трубка содержит вещество, поглощающее воду, а другое содержит вещество который поглощает углекислый газ. Взвесьте каждую из этих пробирок до и после сгорания. Увеличение массы в первой пробирке масса H 2 O, образующийся при горении, и увеличение массы второй трубки равно массе СО 2 сформировался.
Предположим, что все углерод в соединении был преобразован в CO 2 и попал во вторую трубку. Вычислите массу углерода в соединения от массы углерода в измеренной массе CO 2 сформировался.
Предположим, что все водород в соединении превратился в H 2 О и попал в первую трубку. Вычислите массу водорода в соединения от массы водорода в измеренной массе воды.
Если соединение
содержит кислород, а также углерод и водород, рассчитайте массу
кислорода путем вычитания массы углерода и водорода из
общая масса исходного образца соединения.
Используйте эти данные для определить эмпирическую и молекулярную формулы обычным способом.
Прибор для анализа горения A соединение, содержащее углерод и водород (C a H b ) или углерод, водород и кислород (C a H b O c ) полностью сгорел с образованием H 2 O и CO 2 . Продукты протягивается через две трубки. Первая трубка поглощает воду, а вторая трубка поглощает углекислый газ.
Чтобы проиллюстрировать, как эмпирические и молекулярные формулы могут быть
определяется по данным, полученным в результате анализа горения, давайте рассмотрим
вещество под названием триоксан. Формальдегид, СН 2 O, неустойчив в чистом виде
газ, легко образующий смесь вещества, называемого триоксаном, и полимера
называется параформальдегидом. Вот почему формальдегид растворяют в растворителе, таких как вода, прежде чем она будет продана и использована. Молекулярная формула триоксана, который
содержит углерод, водород и кислород, можно определить по данным двух
разные эксперименты. В первом опыте сжигается 17,471 г триоксана.
в аппарате, показанном выше, и 10,477 г H 2 O и 25,612 г
СО 2 формируются. Во втором эксперименте молекулярная масса
триоксан равен 90,079.
Молекулярная формула триоксана, который
содержит углерод, водород и кислород, можно определить по данным двух
разные эксперименты. В первом опыте сжигается 17,471 г триоксана.
в аппарате, показанном выше, и 10,477 г H 2 O и 25,612 г
СО 2 формируются. Во втором эксперименте молекулярная масса
триоксан равен 90,079.
Мы можем получить молекулярная формула соединения из его эмпирической формулы и его молекулярной масса. (См. в тексте напоминание о том, как это делается.) Чтобы получить эмпирическую формулу, нам нужно определить массу в граммах углерод, водород и кислород в 17,471 г триоксана. Таким образом, нам нужно выполните эти общие шаги.
Во-первых, преобразовать из данные приведены в граммах углерода, водорода и кислорода.
Во-вторых, определите эмпирическая формула из граммов углерода, водорода и кислорода.
В-третьих, определите
молекулярная формула из эмпирической формулы и заданной молекулярной массы.
Поскольку мы предполагаем, что весь углерод в триоксане прореагировал в CO 2 можно найти массу углерода в 17,471 г триоксана путем расчета массы углерода в 25,612 г CO 2 .
Поскольку мы предполагаем, что весь водород в триоксане прореагировал с образованием H 2 О, мы можем найти массу водорода в 17,471 г триоксана, вычислив массу водорода в 10,477 г H 2 O.
Поскольку триоксан содержит только углерод, водорода и кислорода, мы можем вычислить массу кислорода, вычитая масс углерода и водорода от общей массы триоксана.
? г О = 17,471 г триоксана — 6,9899 г С — 1,1724 г H = 9,309 г О
Теперь вычислим эмпирическую формулу, эмпирическая формула массы и молекулярная формула.
Образец Учебный лист : Расчет молекулярных формул на основе данных о горении
Предупреждение — Вы хотите рассчитать молекулярную формулу соединения. содержащие только углерод и водород (C a H b ) или углерод,
водород и кислород (C a H b O c ), и вы
учитывая его молекулярную массу и массы CO 2 и H 2 О
образуется при сгорании данной массы соединения.
содержащие только углерод и водород (C a H b ) или углерод,
водород и кислород (C a H b O c ), и вы
учитывая его молекулярную массу и массы CO 2 и H 2 О
образуется при сгорании данной массы соединения.
Общие Процедура
Расчет количества граммов углерода в соединении путем расчета количества граммов углерода в данном количестве CO 2 .
Рассчитать количество граммов водорода в соединении, рассчитав количество граммов водород в данном количестве H 2 O.
Если соединение содержит кислород, рассчитайте количество граммов кислорода в нем путем вычитания масс углерода и водорода из заданной общей массы соединения.
? г О = (данные) г всего — (расчетное) г C — (расчетное) г Н
Расчет эмпирического
Формула соединения из граммов углерода, водорода и кислорода.

