Амфотерные металлы: взаимодействие, свойства, характеристики
Главная » Металлы » Получение и сферы применения амфотерных металлов
На чтение 4 мин
Содержание
- Какие элементы относятся к амфотерным?
- Получение
- Свойства
- Где используются амфотерные металлы?
Амфотерные металлы — группа простых элементов, которые похожи с материалами из металлической группы. Сходства проявляются в свойствах, характеристиках. Сами по себе компоненты из металлической группы не проявляют подобных свойств, но их соединения часто становятся амфотерными.
Какие элементы относятся к амфотерным?
Амфотерными называют — соединения, которые проявляют химическую двойственность. Они делятся на 3 группы:
- Оксиды — Cu2O, Cr2O, PbO2, PbO, SnO
- Гидроксиды — Al(OH)3, Fe(OH)3, Zn(OH)2.
К третьей группе относятся металлы — алюминий, медь, железо, цинк, бериллий, свинец и т. д. Они занимают значительную часть в периодической таблице Менделеева и находятся под порядковыми номерами — 22–32, 40–51. Другие идут по отдельности.
Другие идут по отдельности.
Представители металлов:
- Железо. Относится к группе амфотерных. Представляет собой простое вещество. Характерные свойства — серебристо-белый цвет, ковкость, универсальность. Если поместить железо в чистый кислород, оно полностью перегорит, а если сделать его мелкодисперсным, может произойти самовозгорание на открытом воздухе. Оксид железа образуется при его горении в среде, насыщенной чистым кислородом. Он представляет собой окалину.
- Алюминий. На открытом воздухе покрывается прочной оксидной пленкой, которая защищает его от образования ржавчины. Если раздробить его до мелких частиц, начинает взаимодействовать с кислородом. При контакте с кислородом выделяется большое количество тепла. Если нагреть алюминий до 200°C, он начинает взаимодействовать серой. В результате такой реакции образуется сульфид алюминия.
Амфотерные металлы — простые элементы, которые являются аналогами группы веществ металлического типа. Сходства можно увидеть в химических, физических свойствах.
Получение
Для получения амфотерных металлов, ученые применяют тот же процесс, что при выделении нерастворимых в воде оснований. Перед проведением работ нужно получить больше информации о взаимодействии амфотерных соединений с щелочами, поскольку с помощью щелочного раствора будет выделяться металл.
Примеры:
- Для получения гидроксида цинка нужно смешать раствор сульфата цинка с гидроксидом натрия.
- Для получения гидроксида алюминия нужно смешать раствор сульфата алюминия с раствором гидроксида калия.
- Для получения трехвалентных гидроксидов хрома, алюминия нужно смешать раствор карбоната с раствором на основе солей этих металлов.
Свойства
Свойства:
- При сильном нагревании соединения распадаются на составляющие. Одновременно с этим выделяется амфотерный оксид.
- При взаимодействии с щелочами образуются растворимые соли, с кислотами —растворимые соли с амфотерным катионом.

- Они могут проявлять восстановительные, окислительные свойства.
- Существуют определенные амфотерные металлы, которые имеют отрицательную степень окисления.
Чтобы понять химические свойства этих веществ, их нужно сравнить с обычными металлами. Они имеют множество похожих характеристик. Металлы могут образовывать оксиды, гидроксиды.
Амфотерные свойства могут проявлять металлы и неметаллы. Металлы могут отдавать электроны, которые располагаются на внешнем электронном облаке. Неметаллы притягивают их к себе.
Неметаллы не могут проводить тепло или электричество. Некоторые из них обладают такими способностями, но они незначительны. Металлы хорошо проводят электрический ток, тепло. Их используют для изготовления проводников, радиаторов.
В нормальных условия амфотерные соединения не растворяются в воде. Это твердые материалы с высокой прочностью. Выделить их основание можно после проведения химической реакции, в которой будут задействованы металлические соли, щелочь. Реакция опасна. Проводить ее нужно в специальном защитном снаряжении, медленно и аккуратно.
Реакция опасна. Проводить ее нужно в специальном защитном снаряжении, медленно и аккуратно.
Получение амфотерных оксидовБольшинство металлов этой группы взаимодействуют с щелочами, кислотами, легко поддаются обработке разными способами. Проявляют высокое электросопротивление, магнитные свойства.
Где используются амфотерные металлы?
Сферы применения:
- Изготовление деталей для сейсмических и скоростных датчиков, часовых механизмов, крутящего момента.
- Производство деталей для оборудования, которые будут взаимодействовать с агрессивными факторами.
- Армирование труб высокого давления.
- Кораблестроение, самолетостроение.
- Производство бытовых приборов, инструментов. К ним относятся столовые приборы, рулетки, бритвенные лезвия, посуда для кухни.
- Сборка видеозаписывающего оборудования.
С каждым годом появляется все больше химических соединений. Благодаря этому открываются новые амфотерные металлы. Их называют материалами будущего, но популярность их растет медленно. Связано это с высокой стоимостью, небольшими размерами готовых изделий.
Их называют материалами будущего, но популярность их растет медленно. Связано это с высокой стоимостью, небольшими размерами готовых изделий.
( Пока оценок нет )
Поделиться
Амфотерные соединения | Дистанционные уроки
05-Дек-2014 | комментария 4 | Лолита Окольнова
и их свойства
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + h3O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
h3SO4 + 2KOH → K2SO4 + 2h3O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3,
Fe2O3, Fe(OH)3)И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)
Наиболее часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды): ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, Al2O3, Al(OH)3, Fe 2O3, Fe(OH)3, Cr2O3, Cr(OH)3.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами.
- с взаимодействием с кислотами все просто, в этих реакциях амфотерные соединения ведут себя как основные:
Оксиды:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
ZnO + H2SO4 → ZnSO4 + H2O
BeO + HNO3 → Be(NO3)2 + H2O
Точно так же реагируют гидроксиды:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Pb(OH)2 + 2HCl → PbCl2 + 2H2O
- С взаимодействием со щелочами немного сложнее.

Или реакция происходит в растворе, или реагирующие вещества берутся твердые и сплавляются.
Разберем на примере гидроксида цинка. Как уже говорилось ранее, амфотерные соединения взаимодействуя с основными, ведут себя как кислоты. Вот и запишем гидроксид цинка Zn(OH)2 как кислоту. У кислоты водород спереди, вынесем его: H2ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он – кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + H2ZnO2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
Полученное вещество K 2ZnO2 называется метацинкат калия (или просто цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H2ZnO2 (солями такие соединения называть не совсем правильно, но для собственного удобства мы про это забудем). Только гидроксид цинка записывать вот так: H2ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
Только гидроксид цинка записывать вот так: H2ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
2KOH(тв.) + Zn(OH)2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
С гидроксидами, в которых 2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2
Pb(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2PbO2 (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя группами OH (Al(OH)3, Cr(OH)3, Fe(OH)3) немного иначе.
Разберем на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH → H2
O + KAlO2 (метаалюминат калия, или просто алюминат)Но гидроксид алюминия вот так HAlO2 записывать нельзя, записываем как обычно, но подразумеваем там «кислоту»:
Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KAlO2(метаалюминат калия)
То же самое и с гидроксидом хрома:
Cr(OH)3 → H3CrO3 → HCrO2
Cr(OH)3(тв. ) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия,
) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли хромовой кислоты).
С гидроксидами содержащими четыре группы ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3
Pb(OH)4 → H4PbO4 → H2PbO3
Следует помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4, Pb(OH)4).
И эти гидроксиды будут образовывать разные «соли»:
Степень окисления | +2 | +4 | ||
Формула гидроксида | Sn(OH)2 |
|
|
|
Формула гидроксида в виде кислоты | H2SnO2 | H2PbO2 | H2SnO3 | H2PbO3 |
Соль (калиевая) | K2SnO2 | K2PbO2 | K2SnO3 | K2PbO3 |
Название соли | станнИТ | блюмбИТ | метастаннАТ | метаблюмбАТ |
Те же принципы, что и в названиях обычных «солей», элемент в высшей степени окисления – суффикс АТ, в промежуточной – ИТ.
Такие «соли» (метахроматы, метаалюминаты, метабериллаты, метацинкаты и т.д.) получаются не только в результате взаимодействия щелочей и амфотерных гидроксидов. Эти соединения всегда образуются, когда соприкасаются сильноосновный «мир» и амфотерный (при сплавлении). То есть точно так же как и амфотерные гидроксиды со щелочами будут реагировать и амфотерные оксиды, и соли металлов, образующих амфотерные оксиды (соли слабых кислот). И вместо щелочи можно взять сильноосновный оксид, и соль металла, образующего щелочь (соль слабой кислоты).
Взаимодействия:
Запомните, реакции, приведенные ниже, протекают при сплавлении.
Амфотерного оксида с сильноосновным оксидом:
ZnO(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия, или просто цинкат калия)
Амфотерного оксида со щелочью:
ZnO(тв. ) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
ZnO(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
Амфотерного гидроксида с сильноосновным оксидом:
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
Амфотерного гидроксида со щелочью:
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2H2O↑
Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
Zn(OH)2(тв.
 ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
Соли слабой кислоты и металла, образующего амфотерные соединение с сильноосновным оксидом:
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой кислоты и металла, образующего щелочь:
ZnCO3(тв.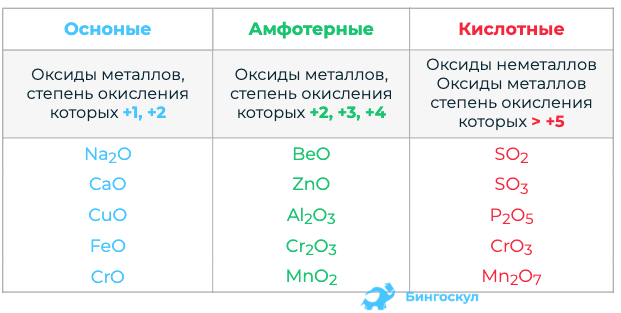 ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
Ниже представлена информация по солям амфотерных гидроксидов, красным помечены наиболее встречающиеся в ЕГЭ.
Оксид | Гидроксид | Гидроксид в виде кислоты | Кислотный остаток | Соль | Название соли |
BeO | Be(OH)2 | H2BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
ZnO | Zn(OH)2 | H2ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
SnO | Sn(OH)2 | H2SnO2 | SnO22- | K2SnO2 | СтаннИТ |
PbO | Pb(OH)2 | H2PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
SnO2 | Sn(OH)4 | H2SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
PbO2 | Pb(OH)4 | H2PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ) |
В ЕГЭ это называют «растворением гидроксида алюминия (цинка, бериллия и т. д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
Мы будем рассматривать два случая: когда металл окружен четырьмя гидроксид-ионами, и когда он окружен шестью гидроксид-ионами.
Запишем сокращенное ионное уравнение этих процессов:
Al(OH)3 + OH— → Al(OH)4—
Образовавшийся ион называется Тетрагидроксоалюминат-ион. Приставка «тетра-» прибавляется, потому что гидроксид-иона четыре. Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Al(OH)3 + 3OH— → Al(OH)63-
Образовавшийся в этой реакции ион называется гексагидроксоалюминат ион. Приставка «гексо-» прибавляется, потому что гидроксид-иона шесть.
Прибавлять приставку, указывающую на количество гидроксид-ионов обязательно. Потому что если вы напишете просто «гидроксоалюминат», не понятно, какой ион вы имеете в виду: Al(OH)4— или Al(OH)63-.
При взаимодействии щелочи с амфотерным гидроксидом в растворе образуется соль. Катион которой – это катион щелочи, а анион – это сложный ион, образование которого мы рассмотрели ранее. Анион заключается в квадратные скобки.
Al(OH)3 + KOH → K[Al(OH)4] (тетрагидроксоалюминат калия)
Al(OH)3 + 3KOH → K3[Al(OH)6] (гексагидроксоалюминат калия)
Какую именно (гекса- или тетра-) соль вы напишете как продукт – не имеет никакого значения. Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Кроме амфотерных гидроксидов, со щелочами реагируют амфотерные оксиды. Продукт будет тот же. Только вот если вы запишете реакцию вот так:
Al2O3 + NaOH → Na[Al(OH)4]
Al2O3 + NaOH → Na3[Al(OH)6]
Но эти реакции у вас не уравняются. Надо добавить воду в левую часть, взаимодейтсиве ведь происходит в растворе, воды там дотаточно, и все уравняется:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]
Помимо амфотерных оксидов и гидроксидов, с растворами щелочей взаимодействуют некоторые особо активные металлы, которые образуют амфотерные соединения. А именно это: алюминий, цинк и бериллий. Чтобы уравнялось, слева тоже нужна вода. И, кроме того, главное отличие этих процессов – это выделение водорода:
А именно это: алюминий, цинк и бериллий. Чтобы уравнялось, слева тоже нужна вода. И, кроме того, главное отличие этих процессов – это выделение водорода:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
В таблице ниже приведены наиболее распространенные в ЕГЭ примеры свойства амфотерных соединений:
Амфотерное вещество | Соль | Название соли | Реакции |
Al Al2O3 Al(OH)3 | Na[Al(OH)4] | Тетрагидроксоалюминат натрия | Al(OH)3 + NaOH → Na[Al(OH)4] Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
Na3[Al(OH)6] | Гексагидроксоалюминат натрия | Al(OH)3 + 3NaOH → Na3[Al(OH)6] Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6] 2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑ | |
Zn ZnO Zn(OH)2 | K2[Zn(OH)4] | Тетрагидроксоцинкат натрия | Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] ZnO + 2NaOH + H2O → Na2[Zn(OH)4] Zn + 2NaOH + 2H2O → Na2[Zn(OH)4]+ H2↑ |
K4[Zn(OH)6] | Гексагидроксоцинкат натрия | Zn(OH)2 + 4NaOH → Na4[Zn(OH)6] ZnO + 4NaOH + H2O → Na4[Zn(OH)6] Zn + 4NaOH + 2H2O → Na4[Zn(OH)6]+ H2↑ | |
Be BeO Be(OH)2 | Li2[Be(OH)4] | Тетрагидроксобериллат лития | Be(OH)2 + 2LiOH → Li2[Be(OH)4] BeO + 2LiOH + H2O → Li2[Be(OH)4] Be + 2LiOH + 2H2O → Li2[Be(OH)4]+ H2↑ |
Li4[Be(OH)6] | Гексагидроксобериллат лития | Be(OH)2 + 4LiOH → Li4[Be(OH)6] BeO + 4LiOH + H2O → Li4[Be(OH)6] Be + 4LiOH + 2H2O → Li4[Be(OH)6]+ H2↑ | |
Cr2O3 Cr(OH)3 | Na[Cr(OH)4] | Тетрагидроксохромат натрия | Cr(OH)3 + NaOH → Na[Cr(OH)4] Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4] |
Na3[Cr(OH)6] | Гексагидроксохромат натрия | Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] Cr2O3 + 6NaOH + 3H2O → 2Na3[Cr(OH)6] | |
Fe2O3 Fe(OH)3 | Na[Fe(OH)4] | Тетрагидроксоферрат натрия | Fe(OH)3 + NaOH → Na[Fe(OH)4] Fe2O3 + 2NaOH + 3H2O → 2Na[Fe(OH)4] |
Na3[Fe(OH)6] | Гексагидроксоферрат натрия | Fe(OH)3 + 3NaOH → Na3[Fe(OH)6] Fe2O3 + 6NaOH + 3H2O → 2Na3[Fe(OH)6] |
Полученные в этих взаимодействиях соли реагируют с кислотами, образуя две другие соли (соли данной кислоты и двух металлов):
2Na3[Al(OH)6] + 6H2SO4 → 3Na2SO4 + Al2(SO4)3 + 12H2O
Вот и все! Ничего сложного. Главное не путайте, помните что образуется при сплавлении, что в растворе. Очень часто задания по этому вопросу попадаются в B части.
Главное не путайте, помните что образуется при сплавлении, что в растворе. Очень часто задания по этому вопросу попадаются в B части.
- Подписка на рассылку
(Правила комментирования)
Амфотеризм — амфотерное определение и примеры
В химии амфотерное вещество представляет собой химический вид, который может действовать как кислота и как основание, в зависимости от условий реакции. Явление называется амфотеризмом .
Амфотерность относится к кислотам и основаниям Бренстеда-Лоури и Льюиса. Слово происходит от греческого слова amphoteros или amphoteroi , что означает «каждый или оба из двух» и означает, что вещество является «либо кислотным, либо щелочным».
Амфотерные вещества
Амфотерное вещество имеет переносимый водород (протон) и атом с неподеленными электронными парами. Примеры амфотерных веществ включают воду, аминокислоты, белки и многие оксиды и гидроксиды металлов.
Оксиды и гидроксиды алюминия, сурьмы, мышьяка, сурьмы, висмута, бериллия, хрома, кобальта, меди, галлия, германия, золота, железа, свинца, серебра, теллура, олова и цинка являются амфотерными. Однако оксиды щелочных металлов и щелочноземельных металлов образуют только основные оксиды и не являются амфотерными. Наиболее амфотерные оксиды и гидроксиды металлов происходят из металлов, находящихся вблизи центра таблицы Менделеева.
Некоторые вещества, обычно считающиеся либо кислотами, либо основаниями, на самом деле являются амфотерными. Например, серная кислота (H 2 SO 4 ) действует как кислота в воде, но действует как основание или является амфотерной в суперкислотах. В общем, кислоты, способные отдавать несколько ионов водорода, являются амфотерными. Точно так же основания с высокозаряженными катионами металлов являются амфотерными.
Примеры амфотеризма
Например, рассмотрим амфотеризм воды (H 2 O):
Вода принимает протон при взаимодействии с кислотой, такой как соляная кислота (HCl).
H 2 O + HCl ⇌ H 3 O + + Cl –
Вода отдает протон, когда реагирует с основанием, таким как аммиак (NH 9 3 9000).
H 2 O + NH 3 ⇌ NH 4 + + OH —
Аналогично, оксиды амфотерных металлов, такие как оксид алюминия (AL 2 O 3 900). основание при реакции с кислотой и как кислота при реакции с основанием.
AL 2 O 3 (S) + 6H 3 0 + (AQ) + 3H 2 O (L) → 2 [AL (OH 2 ) 6 ] 3 3 + (водн.)
Al 2 O 3 (т) + 2OH – (водн.) + 3H 2 O(ж) → 2[Al(OH) 4 4 6 ( 4 ] aq) Чтобы идентифицировать амфотерное вещество, обратите внимание на способность как добавлять, так и удалять ионы водорода из других молекул. Амфотерное вещество может содержать несколько ионов водорода, как кислотных, так и основных компонентов в одной и той же молекуле, или несколько зарядов на своем катионе или анионе. Может оказаться полезным увидеть виды, которые не амфотерны. Например, азотистая кислота (HNO 2 ) — это кислота, а не амфотерная, потому что она не может служить основанием. Он диссоциирует с выделением катиона водорода и аниона NO 2 – . Азотистая кислота отдает только один ион водорода или протон. Он больше не может принимать протоны, а анион NO 2 – (сопряженное основание) не может их отдавать. HNO 2 → H + + NO 2 − Амфипротный : Амфипротный вид представляет собой тип амфотерного вещества, которое либо принимает, либо отдает протон (H + ) в зависимости от условий. Согласно теории кислот и оснований Льюиса амфипротные соединения являются амфотерными, но не все амфотерные вещества являются амфипротонными. Согласно теории кислот и оснований Бренстеда-Лоури амфотерные и амфипротонные означают одно и то же. Амфолиты : Амфолиты представляют собой амфотерные соединения, содержащие как кислотную, так и основную группу. Например, аминокислота имеет аминогруппу, способную отдавать водород, и карбоксильную группу, способную принимать водород. В нашем обсуждении кислот и оснований до сих пор гидроксиды всегда были синонимами оснований. Теперь мы рассмотрим амфотерные гидроксиды, т. е. гидроксидные соли, которые могут действовать как кислота или основание в зависимости от условий реакции. Мы начнем со знакомого случая, когда гидроксид действует как основание. Одним из наиболее распространенных и известных примеров амфотерного гидроксида является гидроксид алюминия Al(OH) 3 . HCl(водн.)+Al(OH)3(водн.)→AlCl3(водн.)+3h3O(ж)HCl(водн.)+Al(OH)_3 (водн.)\rightarrow AlCl_3(водн.)+3H_2O(л)HCl(водн.)+Al(OH)3(водн.)→AlCl3(водн.)+3h3O(л) Это классическая реакция кислотно-щелочной нейтрализации: HCl полностью протонирует все три гидроксида на моль Al(OH) 3 с получением чистой воды и соли AlCl 3 . Из того, что мы знаем об основных свойствах гидроксидов на данный момент, это именно то, что мы и ожидали — так как же гидроксид может действовать как кислота? Рассмотрим теперь реакцию гидроксида алюминия в сильноосновном растворе: 9-(водн.)Al(OH)3(водн.)+OH-(водн.)→Al(OH)4-(водн.) Здесь гидроксид алюминия захватывает ион гидроксида из раствора, тем самым действуя как кислота Льюиса. Гидроксид алюминия Гидроксид алюминия может действовать либо как основание Бренстеда-Лоури, принимая протоны из кислого раствора, либо как кислота Льюиса, принимая электронную пару из гидроксид-ионов в щелочном растворе. Центральный атом алюминия является электронодефицитным — он образует только три связи, и правило октета не выполняется; таким образом, Al 3+ вполне счастлив принять пару электронов и образовать другую связь при правильных условиях. В щелочном растворе он образует связь с ионом ОН — , вытягивая его из раствора и снижая рН раствора. Гидроксиды металлов с высокозаряженным центральным атомом металла могут быть амфотерными. В дополнение к алюминию такие металлы, как цинк, олово, свинец и бериллий, также могут образовывать амфотерные оксиды или гидроксиды. Будут ли такие гидроксиды вести себя как кислоты или основания, зависит от рН окружающего раствора. Show Sources Безграничный поиск и отбор высококачественного контента с открытой лицензией со всего Интернета. Данный конкретный ресурс использовал следующие источники: «Безграничный». http://www.boundless.com/
Безграничное обучение CC BY-SA 3.0. «Безграничный». http://www.boundless.com//chemistry/definition/base Boundless Learning CC BY-SA 3.0. «кислота». http://en.wiktionary.org/wiki/acid
Викисловарь CC BY-SA 3.0. «Амфотеризм». http://en.wikipedia.org/wiki/Амфотеризм Википедия CC BY-SA 3.0. «Гидроксид». http://en.wikipedia.org/wiki/Hydroxid Википедия CC BY-SA 3.0. Как идентифицировать амфотерные вещества

Родственные термины

Ссылки
Основные и амфотерные гидроксиды | Введение в химию |
Цель обучения

Ключевые моменты
Термины
Реакция амфотерных гидроксидов в кислом растворе
 Из наших правил растворимости мы знаем, что Al(OH) 3 практически нерастворим в нейтральной воде; однако в сильнокислом растворе ситуация меняется. Например, рассмотрим реакцию Al(OH)3 с HCl:
Из наших правил растворимости мы знаем, что Al(OH) 3 практически нерастворим в нейтральной воде; однако в сильнокислом растворе ситуация меняется. Например, рассмотрим реакцию Al(OH)3 с HCl: Реакция амфотерных гидроксидов в основном растворе
 Как это возможно? Рассмотрим структуру Льюиса для Al(OH) 3.
Как это возможно? Рассмотрим структуру Льюиса для Al(OH) 3. Заключение







 ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑