Сода кальцинированная
Главная / Химическое сырье / Сода кальцинированная марка Б сорт высший ГОСТ 5100-85 (карбонат натрия Na2CO3)
%D
%d.%M.%y
%h~:~%m
Источниками получения соды кальцинированной (карбоната натрия) с древних времен до начала XIX в. были содовые озера Египта и некоторых других стран, а также щелочесодержащие растения, произрастающие по берегам Средиземного моря и Атлантического океан. Однако к концу XVIII в. эти источники уже не могли удовлетворить потреность в соде кальцинированной. Возникло фабричное производство соды кальцинированной, которое может по праву считаться родоначальником современной химической промышленности, так как в нем было осуществлено в крупном масштабе получение синтетическим путем продукта, ранее добывающегося из естественных источников или из растений.
Проблема получения искусственной соды кальцинированной (карбоната натрия)
 Лебланом, предложившим получать соду кальцинированную прокаливанием смеси сульфата натрия, измельченного мела или известняка и угля. Из полученного плава соду кальцинированную выщелачивали водой, раствор упаривали, выделяя карбонат натрия, в твердом виде. В шламе оставался сульфит кальция, являвшийся отходом производства, так называемый содовой остаток, который составляет до 1,5 т на каждую тонну соды кальцинированной. Отходом производства соды кальцинированной был также хлористый водород, получаемый в процессе разложения хлорида натрия серной кислотой.
Лебланом, предложившим получать соду кальцинированную прокаливанием смеси сульфата натрия, измельченного мела или известняка и угля. Из полученного плава соду кальцинированную выщелачивали водой, раствор упаривали, выделяя карбонат натрия, в твердом виде. В шламе оставался сульфит кальция, являвшийся отходом производства, так называемый содовой остаток, который составляет до 1,5 т на каждую тонну соды кальцинированной. Отходом производства соды кальцинированной был также хлористый водород, получаемый в процессе разложения хлорида натрия серной кислотой. Способ Леблана сыграл большую роль в развитии химической промышленности и разработке сырьевых баз. В то же время существенные недостатки этого способа, и в первую очередь обильные отходы, выявившиееся как только производство достигло значительных масштабов, привели к созданию более рациональных способов производства кальцинированной соды (карбоната натрия).
В 1838 г. англичане Гаррисон и Хемминг взяли патент на производство соды кальцинированной по аммиачному методу. Несмотря на кажущуюся в лабораторных условиях простоту этого метода, осуществление его в промышленном масштабе было сопряжено с огромными трудностями.
В 1861 г. к практическому осуществлению аммиачно-содового процесса приступил бельгийский инженер Э. Сольвье. К 1872 г. Ему удалось создать удачное аппаратурное оформление аммиачно-содового способа, что позволило обеспечить непрерывность производственного процесса. При этом в первой четверти XX столетия производство соды кальцинированной явилось центром, вокруг которого возникли, развивались и от которого отделялись другие химические производства минеральных продуктов.
В те же годы предпринимались многочисленные попытки повышения удельной производительности аппаратуры, разработанной Э. Сольве, модернизации технологии и сокращения отходов, однако до 70-х годов XX столетия эти попытки практически не делали положительных результатов.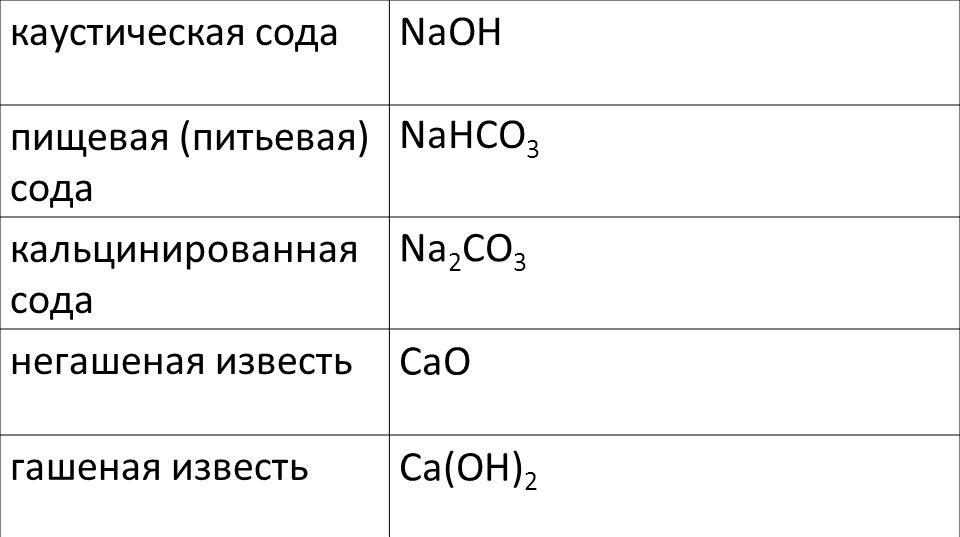 Традиционное аппаратурное оформление стало сдерживать развитие содовой промышленности, а все увеличивающиеся размеры «белых морей» (накопителей шлама-отходов) оказывали отрицательное влияние на развитие аммиачного способа производства соды кальцинированной (карбоната натрия).
Традиционное аппаратурное оформление стало сдерживать развитие содовой промышленности, а все увеличивающиеся размеры «белых морей» (накопителей шлама-отходов) оказывали отрицательное влияние на развитие аммиачного способа производства соды кальцинированной (карбоната натрия).
В настоящее время в мире производство соды кальцинированной (карбонат натрия) базируется на четырех способах ее получения: аммиачный (из хлорида натрия), из природной соды, из нефелинов, карбонизацией гидрооксида натрия.
Аммиачный способ получения соды кальцинированной (карбонат натрия)
продолжает оставаться основным, хотя его удельный вес, еще недавно составлявший 100%, снижается и по состоянию на 2001г. может быть оценен в 65-70%.
Этот способ обладает рядом крупных достоинств:
— недорогое и легко добываемое сырье
— не высокая температура (до 100 С) и атмосферное давление необходимое для производства
— хорошая изученность и устойчивость технологического процесса
— высокое качество получаемого продукта
— сравнительно низкая себестоимость кальцинированной соды
Однако у аммиачного способа производства соды кальцинированной есть существенные недостатки:
— низкая степень использования исходного сырья
— большие количества жидких и твердых отходов
— значительный расход энергетических ресурсов
Одновременно большое внимание было уделено созданию производства кальцинированной соды на базе комплексной переработки нефелинового сырья.
В настоящее время в мире насчитывается более 75 содовых предприятий, расположенны 34 странах. Мировое производство кальцинированной соды в 2003г. можно оценить в 38,5 -39,0 млн. т при имеющихся мощьностях в 45 млн. т.
Распределение поизводства соды по континентам весьма неравномерное: в Европе вырабатывается примерно 55% производимой соды кальцинированной, в Северной Америке — 29%, в Азии -13%, в Африке, Австралии, Южной Америке — примерно по 1%, причем существующие в Западной Европе мощности полностью обеспечивают потребности региона.
Ведующими содопроизводящими фирмами мира являются: «Сольвей» (Бельгия), «Ай-Си-Ай» (Англия), ФМК и «Эллайд» (США). Отечественные производители ОАО СОДА г. Стерлитамак, Республика Башкортостан, ОАО «Березниковский содовый завод» г. Березники, Пермский край.
Отечественные производители ОАО СОДА г. Стерлитамак, Республика Башкортостан, ОАО «Березниковский содовый завод» г. Березники, Пермский край.
Различные названия соды кальцинированной
Сода кальцинированная — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3
Название «сода» происходит от растения солянка содоносная (лат. Salsola soda), из золы которого её добывали. Кальцинированной соду называли потому, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).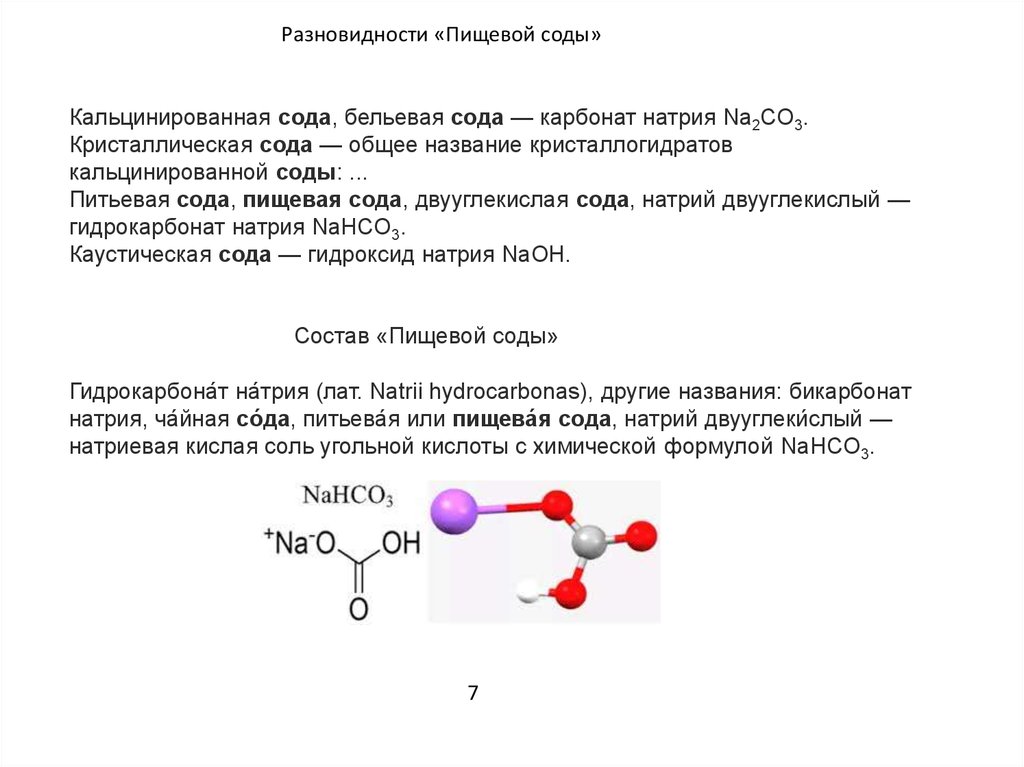
Кальцинированная сода — традиционный продукт, имеющий многолетнюю история производства и использования. Трудно назвать какую-либо отрасль современной промышленности, где не применялся этот продукт. Важнейшие области применения кальцинированной соды представлены на рис. 1. Крупнейшими потребителями соды кальцинированной являются химическая, металлургическая, и другие отрасли промышленности.
В химической промышленности сода кальцинированная
применяется для получения каустической соды химическими методами, гидрокарбоната натрия, моющих средств (мыло хозяйственное, мыло туалетное) соединений хрома, сульфитов и фторидов, фосфатов, нитрита натрия, натриевой селитры, для очистки рассола и др., а также расходуется для производства листовых, прокатных, светотехнических стекол, силикатной глыбы, бутылок, хрусталя, сортовой посуды и др. В состав всех этих продуктов и изделий сода кальцинированная входит в виде Na2O. В стекольной промышленности кальцинированная сода является основным компонентом шихты для варки стекла.
РИС. 1. Схема применения кальцинированной соды в промышленности
Большое количество соды кальцинированной (карбоната натрия) используется в цветной металлургии в основном при производстве глинозема из бокситов методом спекания криолита, при переработке свинцово-цинковых, ккобальт-никелевых, а также вольфрамомолибденовых руд. При получении алюминия, никеля, вольфрама и других цветных металлов
Значительное количество соды кальцинированной использует целлюлозно-бумажная промышленность (при проклейке бумаги, картона, в производстве пергамента, дрожжей, дубителей и главным образом при сульфитной варке. целлюлозы).
Большое применение соды кальцинированной находит также в нефтехимической и нефтеперерабатывающей промышленности при производстве синтетических жирных кислот, синтетических моющих средств, а также при переработке нефти и в других процессах. Применение кальцинированной соды
Применение кальцинированной соды
В черной металлургии сода кальцинированная (карбонат натрия) используется для удаления серы и фосфора из чугуна и извлечения ряда химических продуктов из смол, образующихся в коксохимическом производстве. Обессеривание чугуна позволяет интесифицировать доменный процесс путем сокращения расхода сырого известняка и введения плавки чугуна на кислых шлаках. Последнее способствует повышению производительности доменных печей на 2%-3%, улучшения качества и снижению себестоимости чугуна.
В машиностроении сода кальцинированная необходима для пасивирования и обезвреживания деталей машин и инструмента. Большое значение имеет использование кальцинированной соды для совершенствования технологии литейного производства в машиностроении.
В медецинской промышленности сода кальцинированная применяется в производстве медикаментов. В электронной промышленности кальцинированная сода используется для изготовления электровакумного стекла.
В легкой промышленности кальцинированная сода используется для мытья, беления и крашения ткани, мерсеризации хлопка, получения искусственного шелка, нитроцелюлозы и пр. В кожевенной и обувной промышленности, при выработке мехов сода кальцинированная применяется для щелочной обработки материалов.
Применение карбоната натрия (соды кальцинированной) для отчистки воды, питающей паровые котлы, способствуют удлинению срока службы котлов и значительной экономии топлива.
Одним из источников экономии пищевых жирова, расходуемых в производстве мыла хозяйственного, мыла туалетного и мыла жидкого является выпуск стиральных порошков и синтетических моющих средств. Известно, что на изготовление 1т мыла расходуется от 400 до 700 кг. жирных кислот, в то время как на 1тн. стиральных порошков расход жирных кислот не превышает 100-250кг, а для изготовления синтетических моющих средств пищевые жиры совершенно не требуются.
жирных кислот, в то время как на 1тн. стиральных порошков расход жирных кислот не превышает 100-250кг, а для изготовления синтетических моющих средств пищевые жиры совершенно не требуются.
Сода кальцинированная
Сода кальцинированная
Сода кальцинированная
есть в наличии
|
CAS № |
497-19-8 |
ГОСТ |
ГОСТ 5100-85 |
|
Формула |
Na2CO3 |
Сорт |
Марка Б |
|
Синонимы |
натрий углекислый, карбонат натрия |
Фасовка |
26 кг |
|
Цена |
|
Применение
Техническая кальцинированная сода (натрий углекислый, карбонат натрия) предназначается для химической, стекольной, электронной,целлюлозно-бумажнойи других отраслей промышленности и поставки на экспорт.
В зависимости от назначения техническая кальцинированная сода должна изготовляться марок А и Б. Продукт марки А используется для производства электровакуумного стекла и других целей, марки Б — в химической, стекольной и других отраслях промышленности.
Требования безопасности
Техническая кальцинированная сода пожаро- и взрывобезопасна, по степени воздействия на организм относится к веществам3-гокласса опасности.
Упаковка
Техническую кальцинированную соду марки А упаковывают в мягкие специализированные контейнеры разового использования, в четырех-, пятислойные бумажные мешки.
Транспортировка, хранение
Техническую кальцинированную соду, упакованную в мешки, транспортируют всеми видами транспорта в крытых транспортных средствах. Транспортирование упакованного продукта по железной дороге осуществляется повагонными отправками. По согласованию с потребителем продукт марки А транспортируют в специальных вагонах (содовозах, сажевозах, цементовозах). Продукт марки Б насыпью транспортируют в специальных вагонах и автомобилях (содовозах, сажевозах, цементовозах), а также в крытых вагонах. Мягкие специализированные контейнеры по железной дороге транспортируют в полувагонах и крытых вагонах.
Продукт марки Б насыпью транспортируют в специальных вагонах и автомобилях (содовозах, сажевозах, цементовозах), а также в крытых вагонах. Мягкие специализированные контейнеры по железной дороге транспортируют в полувагонах и крытых вагонах.
Техническую кальцинированную соду хранят в закрытых складских помещениях, силосах, бункерах, предохраняя продукт от попадания влаги.
Гарантийный срок хранения продукта
Продукт марки А — 3 месяца, марки Б — 6 месяцев со дня изготовления, продукт, упакованный в мягкие специализированные контейнеры, — 5 лет со дня изготовления.
|
Наименование показателя |
Норма для марки и сорта |
|||||
|
А |
Б |
|||||
|
Высший |
Первый |
Второй |
Высший |
Первый |
Второй |
|
|
Внешний вид |
Гранулы белого цвета |
Порошок белого цвета |
||||
|
Массовая доля углекислого натрия, %, не менее |
99,4 |
99,0 |
98,5 |
99,4 |
99,0 |
99,0 |
|
Массовая доля углекислого натрия в пересчете на непрокаленный продукт, %, не менее |
98,7 |
98,2 |
97,0 |
98,9 |
98,2 |
97,5 |
|
Массовая доля потери при прокаливании при 270–300°С, %, не более |
0,7 |
0,8 |
1,5 |
0,5 |
0,8 |
1,5 |
|
Массовая доля хлоридов в пересчете на NaCl, %, не более |
0,2 |
0,5 |
0,8 |
0,4 |
0,5 |
0,8 |
|
Массовая доля железа в пересчете на Fe2O2, %, не более |
0,003 |
0,005 |
0,008 |
0,003 |
0,003 |
0,008 |
|
Массовая доля не растворимых в воде веществ, %, не более |
0,04 |
0,04 |
0,08 |
0,03 |
0,04 |
0,08 |
|
Массовая доля сульфатов в пересчете на Na2SO4, %, не более |
0,04 |
0,05 |
— |
0,04 |
0,05 |
— |
|
Насыпная плотность, г/см3, не менее |
1,1 |
0,9 |
0,9 |
— |
— |
— |
|
Гранулометрический состав: остаток на сите с сеткой № 2К по ГОСТ 6613–86,%, не более прохождение через сито с сеткой № 1, 25К по ГОСТ 6613–86, %, не более остаток на сите с сеткой № 1К по ГОСТ 6613–86,%, не более прохождение через сито с сеткой № 01К, 25К по ГОСТ 6613–86,%, не более |
— 100 3 7 |
5 — — 15 |
5 — — 25 |
— — — — |
— — — — |
— — — — |
|
Магнитные включения размером более 0,25 мм |
Отсутствие |
— |
— |
— |
— |
— |
По вопросам приобретения обращаться по тел.
 (831)259-89-00
(831)259-89-00(831)259-89-04
Определение содержания карбонатов в образце кальцинированной соды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 75254
- Oliver Seely
- Калифорнийский государственный университет Dominguez Hills
Неочищенный карбонат натрия Na 2 CO 3 обычно называют кальцинированной содой. Он часто используется в качестве коммерческого нейтрализующего агента. Помимо карбоната также могут присутствовать небольшие количества гидроксида натрия, NaOH, и гидрокарбоната натрия, NaHCO 3 . Титрование стандартной кислотой, обычно HCl, позволяет определить общую щелочность кальцинированной соды. {-8}\). Участвуют следующие реакции: 9+ \rightleftharpoons H_2CO_3 + H_2O \label{2}\]
{-8}\). Участвуют следующие реакции: 9+ \rightleftharpoons H_2CO_3 + H_2O \label{2}\]
Точка эквивалентности pH для реакции \(\ref{1}\) достигается при pH около 8,3, поэтому подходящим и широко используемым индикатором является фенолфталеин. Точка эквивалентности для реакции \(\ref{2}\) происходит при pH примерно 4,0. В качестве индикаторов использовались метиловый красный, метиловый оранжевый, метиловый пурпурный и бромкрезоловый зеленый. В анализе, который вы будете выполнять, будет использоваться бромкрезоловый зеленый. В начале титрования CO 3 2- существует практически за исключением других видов карбонатов. Когда был добавлен один эквивалент кислоты, почти весь CO 3 2- превратился в HCO 3 — . Добавление следующего эквивалента кислоты превращает практически весь гидрокарбонат в угольную кислоту, H 2 CO 3 . Последний находится в равновесии с водой и CO 2 . Крутые участки кривой титрования около двух точек эквивалентности не такие крутые и не распространяются на столь широкий диапазон рН, как это требуется для точности титрования 0,1 относительных процента.
Рядом с HCO 3 — точка эквивалентности рН 8,3 изменение рН, вызванное добавлением 1,0 мл кислоты, составляет всего около 0,3 единицы, а для изменения рН на 1 единицу требуется 10 мл. Ситуация вблизи второй точки эквивалентности при рН 4,0 несколько более благоприятна. Для изменения рН на 1 единицу требуется около 4 мл кислоты. Точность титрования можно значительно повысить, удаляя CO 2 непосредственно перед достижением второй точки эквивалентности. Точность лучше 0,1 относительного процента может быть получена с помощью описанной ниже экспериментальной процедуры.
Индикатор фенолфталеин добавляют к раствору карбоната, который затем титруют HCl до тех пор, пока не исчезнет розовая окраска, что произойдет при приблизительном рН 8. Поскольку точка эквивалентности находится при рН 8,4, количество кислоты несколько превышает используется один эквивалент, а титрование дает лишь приблизительную оценку содержания карбонатов в исходном растворе. Затем добавляют индикатор бромкрезоловый зеленый, который окрашивает раствор в синий цвет. При продолжении титрования раствор постепенно меняет цвет с синего на зеленый, а затем приближается к желтому. Непосредственно перед тем, как раствор станет полностью желтым, раствор кипятят для удаления растворенного CO 9 .0032 2 . Это изменит pH обратно где-то между 8 и 9, а цвет индикатора снова станет синим. Затем раствор охлаждают на бане со льдом и продолжают титрование до тех пор, пока раствор не станет желто-зеленым. Удаление CO 2 изменяет аспекты этой последней части титрования на сильное основание, титруемое сильной кислотой, что объясняет точность выше 0,1%, которую можно получить этим методом.
Затем добавляют индикатор бромкрезоловый зеленый, который окрашивает раствор в синий цвет. При продолжении титрования раствор постепенно меняет цвет с синего на зеленый, а затем приближается к желтому. Непосредственно перед тем, как раствор станет полностью желтым, раствор кипятят для удаления растворенного CO 9 .0032 2 . Это изменит pH обратно где-то между 8 и 9, а цвет индикатора снова станет синим. Затем раствор охлаждают на бане со льдом и продолжают титрование до тех пор, пока раствор не станет желто-зеленым. Удаление CO 2 изменяет аспекты этой последней части титрования на сильное основание, титруемое сильной кислотой, что объясняет точность выше 0,1%, которую можно получить этим методом.
Полное уравнение для этой реакции и то, на котором вы будете основывать свои расчеты, как для стандартизации HCl, так и для определения массового % Na 2 CO 3 в кальцинированной соде
\[ Na_2CO_3(водн.) + 2HCl \rightarrow CO_2(г) + H_2O(ж) + 2NaCl(водн. ) \label{3}\]
) \label{3}\]
Поскольку безводный карбонат натрия легко получить высокую чистоту, его часто используют в качестве первичного стандарта для стандартизации сильных кислот. Вы будете использовать этот реагент для стандартизации, однако убедитесь, что вы используете безводный реагент, а не декагидрат.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление и стандартизация 0,10 М HCl
Высушить около 2,0 г первичного стандарта безводного Na 2 CO 3 в бюксе в течение 2 часов при 105-110°С, затем охладить и хранить в эксикаторе.
Промойте литровую стеклянную бутылку дистиллированной водой. Добавьте дистиллированную воду до начала плавной кривой вверху, оставив немного воздуха между поверхностью воды и горлышком. Используя соответствующий мерный цилиндр, отмерьте и добавьте 17 мл 6M HCl. Затем добавьте немного воды в градуированный цилиндр, осторожно взболтайте и перелейте смесь в бутылку. Закройте бутыль пробкой и несколько раз переверните, чтобы смесь стала однородной. Одна кварта равна 946 мл, почти литр. Семнадцать мл 6М кислоты при разбавлении 946 мл воды дают раствор, близкий к концентрации 0,1М: = 0,11\,M\]
Одна кварта равна 946 мл, почти литр. Семнадцать мл 6М кислоты при разбавлении 946 мл воды дают раствор, близкий к концентрации 0,1М: = 0,11\,M\]
Этот раствор должен быть стандартизирован с использованием безводного Na 2 CO 3 , поэтому в этой процедуре нет необходимости следить за аналитической точностью. Концентрация коммерческой HCl не измеряется с точностью выше ±0,2 М (обычно она определяется при 36,5–38,0%, близкой к 12 М), поэтому даже если 17 мл измеряются с точностью ±0,001 мл, молярность все равно не может быть определена. t быть определена с точностью, достаточной для данного эксперимента. Для достижения необходимой точности раствор необходимо стандартизировать с помощью измеренных образцов безводного карбоната натрия.
Точно взвесьте три образца высушенного безводного Na 2 CO 3 весом от 0,20 до 0,25 г непосредственно в отдельные, чистые и сухие колбы Эрленмейера на 250 мл. Добавьте 50 мл дистиллированной воды, чтобы растворить карбонат, затем накройте колбы парафильмом. Промойте чистую бюретку на 50 мл небольшими порциями раствора HCl, а затем заполните ее раствором кислоты. Запишите начальное показание (которое , а не должно быть ровно 0,00 мл) с точностью до сотой доли мл. Безводный карбонат натрия поглощает как воду, так и углекислый газ из атмосферы, поэтому вес ваших образцов, скорее всего, будет медленным. Нередко можно наблюдать увеличение на 0,0001 г каждые 5–10 секунд. Вы не должны медлить, пытаясь сделать массу равной 0,2000 г, или 0,2500 г, или какому-либо другому конкретному числу, иначе постепенное увеличение массы приведет к значительной систематической ошибке в ваших результатах. Перемещайте реагент до тех пор, пока наблюдаемая масса не будет находиться в пределах от 0,2 до 0,25 г, закройте дверцы весов, снимите показания, когда масса стабилизируется до ±0,0001 г, и покончите с этим. Еще одно предупреждение: кристаллы безводного карбоната натрия не слипаются на плоском шпателе. Они имеют тенденцию отваливаться, поэтому во время переноса не пытайтесь делать большие насыпи реагента на кончике шпателя, иначе вы его потеряете.
Промойте чистую бюретку на 50 мл небольшими порциями раствора HCl, а затем заполните ее раствором кислоты. Запишите начальное показание (которое , а не должно быть ровно 0,00 мл) с точностью до сотой доли мл. Безводный карбонат натрия поглощает как воду, так и углекислый газ из атмосферы, поэтому вес ваших образцов, скорее всего, будет медленным. Нередко можно наблюдать увеличение на 0,0001 г каждые 5–10 секунд. Вы не должны медлить, пытаясь сделать массу равной 0,2000 г, или 0,2500 г, или какому-либо другому конкретному числу, иначе постепенное увеличение массы приведет к значительной систематической ошибке в ваших результатах. Перемещайте реагент до тех пор, пока наблюдаемая масса не будет находиться в пределах от 0,2 до 0,25 г, закройте дверцы весов, снимите показания, когда масса стабилизируется до ±0,0001 г, и покончите с этим. Еще одно предупреждение: кристаллы безводного карбоната натрия не слипаются на плоском шпателе. Они имеют тенденцию отваливаться, поэтому во время переноса не пытайтесь делать большие насыпи реагента на кончике шпателя, иначе вы его потеряете. Места, где вы не хотите ничего потерять, находятся на стенке фляги, на крае фляги или на поддоне снаружи фляги. Вы хотите, чтобы все это попало в горлышко фляги.
Места, где вы не хотите ничего потерять, находятся на стенке фляги, на крае фляги или на поддоне снаружи фляги. Вы хотите, чтобы все это попало в горлышко фляги.
Титрование, описанное ниже, включает переход цвета от синего к зеленому. Некоторым людям нелегко увидеть тонкость изменения. Среди нашего населения распространена сине-зеленая цветовая слепота, и многие люди не подозревают о том, что они страдают легким нарушением зрения. Чтобы убедиться, что вы можете определить воспроизводимую конечную точку, приготовьте 100 мл 0,05 М NaCl в колбе Эрленмейера на 250 мл, разбавив 5 мл 1,00 М NaCl до 100 мл дистиллированной водой. Добавьте 3 капли индикатора бромкрезолового зеленого и 3 капли индикатора фенолфталеина, кипятите в течение короткого времени, охлаждайте и титруйте до конечной точки, при которой зеленый цвет меняется на желто-зеленый. Будьте осторожны, так как требуемый объем будет довольно мал, возможно, всего одна капля. Этот объем называется «коррекцией индикатора», «коррекцией бланка» или «ошибкой титрования»; его следует вычесть из других объемов титрования (поскольку объем — это объем, необходимый для достижения конечной точки пробы, содержащей нет Na 2 CO 3 ).
Сохраните это титрование в качестве руководства по воспроизводимости для всех будущих титрований. Это дает вам эталонный цвет для вашей конечной точки. Приведение всех будущих титрований к этому окончательному цвету, а затем вычитание коррекции индикатора из ваших конечных объемов должно улучшить ваши результаты. В конце каждого лабораторного периода выбрасывайте титрование с поправкой на индикатор и делайте новый в начале следующего лабораторного периода.
Добавьте 3 капли индикатора фенолфталеина к одному образцу карбоната и оттитруйте его кислотой, как описано выше в разделе обсуждения. Поместите лист белой бумаги под колбу для титрования, чтобы вы могли легко видеть любые незначительные изменения цвета. В первой точке эквивалентности цвет будет исчезать довольно медленно, поэтому не ждите резкого перехода от розового к бесцветному. Используйте свое лучшее суждение. Фенолфталеин бесцветен в кислых растворах и имеет ярко-розовый цвет в щелочных растворах. Первая точка эквивалентности СО 3 2- достигается, когда раствор почти полностью изменил цвет с розового на бесцветный, но в нем все еще остается призрачный оттенок розового. После первой точки эквивалентности добавьте 3 капли индикатора бромкрезолового зеленого; раствор станет синим. Титруйте HCl до тех пор, пока цвет раствора не начнет меняться с синего на зеленый. Если он стал желтым, вы зашли слишком далеко. Ваше решение должно быть отброшено, и вы должны начать заново со второго образца. Новый «первый» образец можно взвесить повторно после успешного взвешивания двух последних. Добавляйте кислоту, постоянно вращая колбу. Когда синий цвет начнет переходить в зеленый, нагрейте раствор до кипения на плитке, чтобы удалить CO 9 .0032 2 образуется при титровании. Охладить до комнатной температуры с помощью ледяной бани. Раствор снова должен быть зеленым, возможно, даже синим. Завершите титрование, добавляя по каплям кислоту, пока раствор не изменит цвет на ранее приготовленный контрольный образец.
Первая точка эквивалентности СО 3 2- достигается, когда раствор почти полностью изменил цвет с розового на бесцветный, но в нем все еще остается призрачный оттенок розового. После первой точки эквивалентности добавьте 3 капли индикатора бромкрезолового зеленого; раствор станет синим. Титруйте HCl до тех пор, пока цвет раствора не начнет меняться с синего на зеленый. Если он стал желтым, вы зашли слишком далеко. Ваше решение должно быть отброшено, и вы должны начать заново со второго образца. Новый «первый» образец можно взвесить повторно после успешного взвешивания двух последних. Добавляйте кислоту, постоянно вращая колбу. Когда синий цвет начнет переходить в зеленый, нагрейте раствор до кипения на плитке, чтобы удалить CO 9 .0032 2 образуется при титровании. Охладить до комнатной температуры с помощью ледяной бани. Раствор снова должен быть зеленым, возможно, даже синим. Завершите титрование, добавляя по каплям кислоту, пока раствор не изменит цвет на ранее приготовленный контрольный образец. Запишите показания бюретки и рассчитайте общее количество кислоты, израсходованной с начала титрования до конечной точки бромкрезолового зеленого после кипячения. Скорректируйте объем используемой кислоты с помощью графика калибровки бюретки, подготовленного ранее, и вычтите ошибку конечной точки или поправку на холостой результат. Теперь повторите ту же процедуру с двумя другими образцами по одному. От объема кислоты и массы Na 2 CO 3 используется для расчета молярности раствора HCl. Среднее отклонение от средней молярности не должно превышать 0,2% от среднего.
Запишите показания бюретки и рассчитайте общее количество кислоты, израсходованной с начала титрования до конечной точки бромкрезолового зеленого после кипячения. Скорректируйте объем используемой кислоты с помощью графика калибровки бюретки, подготовленного ранее, и вычтите ошибку конечной точки или поправку на холостой результат. Теперь повторите ту же процедуру с двумя другими образцами по одному. От объема кислоты и массы Na 2 CO 3 используется для расчета молярности раствора HCl. Среднее отклонение от средней молярности не должно превышать 0,2% от среднего.
Титрование образца кальцинированной соды
Высушите неизвестный образец в печи в течение 1 часа при 110°C и охладите в эксикаторе. Используя бутылку для взвешивания, точно взвесьте 2,5 г с точностью ± 0,0001 г. С помощью бутыли для промывания добавьте небольшое количество дистиллированной воды в бутылку для взвешивания, а затем перенесите растворенный материал в чистую мерную колбу на 250 мл, используя воронку с широким стержнем и промывную воду. Добавьте в мерную колбу дополнительное количество дистиллированной воды и доведите до калибровочной метки. Добавляя воду, обязательно хорошо перемешивайте содержимое колбы, взбалтывая его. Однако не переворачивайте колбу на этом этапе. Только после заполнения до метки можно его инвертировать. При заполнении до калибровочной отметки используйте пипетку, чтобы добавить последние несколько капель. Следующий шаг будет включать использование мерной пипетки на 25 мл. Нажмите здесь, чтобы получить полезные советы по использованию мерной пипетки. При использовании резиновой груши для набора жидкости в пипетку не нажимайте грушу на конец пипетки. При необходимости обратитесь за помощью к инструктору. Как только вы почувствуете, что умеете пользоваться пипетками, с помощью пипетки на 25 мл перенесите три аликвоты по 50 мл неизвестного раствора в три отдельные колбы Эрленмейера на 250 мл. Использование пипетки на 25 мл для отмеривания этих аликвот значительно проще, чем использование пипетки на 50 мл, с которой трудно обращаться из-за ее размера.
Добавьте в мерную колбу дополнительное количество дистиллированной воды и доведите до калибровочной метки. Добавляя воду, обязательно хорошо перемешивайте содержимое колбы, взбалтывая его. Однако не переворачивайте колбу на этом этапе. Только после заполнения до метки можно его инвертировать. При заполнении до калибровочной отметки используйте пипетку, чтобы добавить последние несколько капель. Следующий шаг будет включать использование мерной пипетки на 25 мл. Нажмите здесь, чтобы получить полезные советы по использованию мерной пипетки. При использовании резиновой груши для набора жидкости в пипетку не нажимайте грушу на конец пипетки. При необходимости обратитесь за помощью к инструктору. Как только вы почувствуете, что умеете пользоваться пипетками, с помощью пипетки на 25 мл перенесите три аликвоты по 50 мл неизвестного раствора в три отдельные колбы Эрленмейера на 250 мл. Использование пипетки на 25 мл для отмеривания этих аликвот значительно проще, чем использование пипетки на 50 мл, с которой трудно обращаться из-за ее размера. Титруйте каждый образец по одному, как в процедуре стандартизации кислоты.
Титруйте каждый образец по одному, как в процедуре стандартизации кислоты.
Отчет
На основании ваших экспериментальных данных рассчитайте для каждой взятой аликвоты процентное содержание Na 2 CO 3 в неизвестном веществе. Ваш отчет должен включать следующие данные.
- Неизвестный номер
- Масса каждого образца натрия карбоната безводного
- Объем HCl на каждую пробу безводного карбоната натрия
- Средняя молярность используемой HCl
- Масса вашего неизвестного образца.
- Аликвотный объем неизвестного раствора для титрования
- Для каждой взятой аликвоты дайте чистый объем кислоты, израсходованный на конечную точку бромкрезолового зеленого (скорректированный объем, который будет использоваться для расчета процентного содержания карбоната натрия).
- Процент Na 2 CO 3 в кальцинированной соде на каждую титруемую аликвоту
- Среднее процентное содержание Na 2 CO 3 в кальцинированной соде
- Среднее отклонение от среднего значения отдельных значений процентного содержания Na 2 СО 3 .

- Страницы лабораторной тетради, содержащие соответствующие данные
Вопросы о карбонатности кальцинированной соды
- Почему раствор кипятят непосредственно перед достижением второй точки эквивалентности?
- В вашем анализе предполагалось, что кальцинированная сода представляет собой чистый Na 2 CO 3 . Если некоторое количество Na 2 CO 3 заменить равным количеством формульных весов NaHCO 3 , как изменится объем кислоты от (а) начальной точки до конечной точки фенолфталеина? б) конечной точки фенолфталеина к конечной точке бромкрезолового зеленого? (в) от начальной точки до конечной точки бромкрезолового зеленого?
- Ссылаясь на вопрос 2. выше, как изменились бы объемы, если бы некоторые из Na 2 CO 3 были заменены равным количеством формульных весов NaOH?
- Почему розовый цвет в первой точке эквивалентности исчезает постепенно?
- Какой первичный стандарт используется для стандартизации HCl?
- Что подразумевается под «методом аликвотных порций»? Почему он используется в этом анализе?
Авторы и авторство
- Ульрих де ла Камп и Оливер Сили (Калифорнийский государственный университет, Домингес-Хиллз).

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Оливер Сили
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги

Кальцинированная сода Статистика и информация
Национальным информационным центром по минералам
Статистические данные и информация о мировых поставках, спросе и потоках минерального сырья или соляные растворы, содержащие карбонат натрия (оба называются «природная кальцинированная сода»), или производятся одним из нескольких химических процессов (называемые «синтетическая кальцинированная сода»). Это важное сырье для производства стекла, химикатов, моющих средств и других важных промышленных продуктов. В 1998, с точки зрения производства, кальцинированная сода была 11-м по величине неорганическим химикатом из всех отечественных неорганических и органических химикатов, за исключением нефтехимического сырья. Хотя кальцинированная сода составляла лишь 2% от общего объема нетопливной минеральной промышленности США в размере 39 миллиардов долларов, ее использование во многих диверсифицированных продуктах вносило существенный вклад в валовой внутренний продукт Соединенных Штатов. Поскольку кальцинированная сода используется в производстве листового стекла для автомобилестроения и строительства зданий, которые являются важными экономическими секторами отечественной экономики, ежемесячные данные о производстве кальцинированной соды включаются в ежемесячные экономические показатели промышленного производства Советом Федеральной резервной системы, который следит за состоянием экономики США.
Поскольку кальцинированная сода используется в производстве листового стекла для автомобилестроения и строительства зданий, которые являются важными экономическими секторами отечественной экономики, ежемесячные данные о производстве кальцинированной соды включаются в ежемесячные экономические показатели промышленного производства Советом Федеральной резервной системы, который следит за состоянием экономики США.
Подпишитесь , чтобы получать уведомления по электронной почте, когда на эту страницу добавляется новая публикация. На вкладке «Вопросы» на странице настроек подписчика выберите «Кальцинированная сода» и любые другие варианты, которые могут вас заинтересовать. Дополнительную информацию см. на list services странице.
Ежемесячные публикацииОбзоры горнодобывающей промышленности (за прошлые годы см. архивы )
- Кальцинированная сода
Формат PDF:
2023: | Январь |
2022: | Ян | февраль | март | апр | Май | июнь | июль | август | Сентябрь | октябрь | Ноя | Декабрь |
XLSX Формат:
2023: | Январь |
2022: | Ян | февраль | март | апр | май | июнь | июль | август | Сентябрь | октябрь | Ноя | Декабрь | - Производство отдельных полезных ископаемых в США (Ежеквартальные обзоры горнодобывающей промышленности)
Обзоры минерального сырья
- Кальцинированная сода
PDF Format:
| 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 |2013 |2014 |2015 |2016 |2017 |2018 | 2019 | 2020 | 2021 | 2022 | 2023 | - Приложения
Ежегодник полезных ископаемых
- Кальцинированная сода
PDF Format:
| 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 |
XLS Формат:
| 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | Версия 2019 г.




