состав и свойства вещества, меры безопасности и применение
Главная » Удобрения и подкормки
Содержание
Любым растениям требуется полноценное питание для нормального развития и роста. Калийные подкормки помогают им гораздо спокойнее переносить заморозки и засухи. А цветущим культурам калий нужен для образования почек. Садоводы активно применяют в качестве удобрения калиевую селитру. Это очень популярная подкормка, которая оказывает благотворное влияние на растения.
Свойства и состав удобрения
Калиевая селитра представляет собой очень популярное удобрение для растений, произрастающих в любой почве. Она улучшает состояние растений и увеличивает их защиту перед внешними факторами. Селитра повышает всасываемость питательных веществ корнями, стабилизирует фотосинтез и дыхание растений. Благодаря такой подкормке культуры гораздо реже сталкиваются с заболеваниями. В ее составе находятся всего два активных компонента:
- азот;
- калий.

Она представляет собой белоснежный кристаллообразный порошок. Если его хранить слишком долго, то он может слежаться, однако химические свойства его при этом не страдают. Так или иначе, но калиевую селитру рекомендуется хранить в запакованном пакете.
Смотрите это видео на YouTube
Особенности применения
На садовых участках и огородах проводят внекорневое и корневое удобрение селитрой. В этом средстве почти нет хлора, поэтому им можно обрабатывать даже картофель, табак и виноград. Отлично воспринимают эту подкормку томаты, свекла, морковь, ежевика, малина, смородина, декоративные и цветочные культуры.
Опытные дачники, понимающие, для чего нужна калиевая селитра, не рекомендуют подкармливать ею капусту, редьку и зелень. Эти растения не очень хорошо ее воспринимают.
Пользоваться такой подкормкой очень просто. В продаже калиевая селитра продается в небольших пакетах для дачи и сада, а для сельскохозяйственных угодий ее пакуют в объемные мешки.
Меры предосторожности
Перед применением калиевой селитры нужно позаботиться о мерах безопасности. Работать с этим веществом нужно в защитных перчатках из прорезиненного материала. Также желательно защитить глаза очками. Желательно надевать перед процедурой обработки плотную одежду и приобрести респиратор, так как пары подкормки могут навредить здоровью.
Если вещество случайно попало на поверхность кожи, то его нужно как можно скорее смыть водой и обработать пораженное место антисептическим препаратом. Калийный нитрат представляет собой окислитель, который вступает в химреакцию с легко воспламеняющимися веществами, поэтому хранить это удобрение нужно как можно дальше от подобных соединений
. В помещении, где находится калиевая селитра, запрещено курить. Также следует оградить доступ маленьких детей и домашних животных к подкормке.
При использовании удобрения необходимо обеспечить растениям защиту. Чтобы препарат эффективно впитался, его внесение рекомендуется делать при поливе. Не стоит слишком усердствовать с селитрой на кислых грунтах, поскольку эта подкормка еще больше их окислит. Чтобы предотвратить ожог культур, удобрение необходимо вносить максимально осторожно, следя за тем, чтобы оно не попадало на стебли и листки.
Не стоит слишком усердствовать с селитрой на кислых грунтах, поскольку эта подкормка еще больше их окислит. Чтобы предотвратить ожог культур, удобрение необходимо вносить максимально осторожно, следя за тем, чтобы оно не попадало на стебли и листки.
Смотрите это видео на YouTube
Приготовление своими руками
Чтобы сделать калиевую селитру своими руками, нужно сначала подготовиться к процедуре и обзавестись всеми необходимыми веществами.
Купить хлорид калия и аммиачную селитру можно в любом специализированном магазине, причем стоят они очень дешево.
Изготавливается смесь по следующей схеме:
- 100 г калийного хлорида нужно тщательно перемешать в 350—400 мл теплой и чистой воды. Размешивать смесь нужно до полного растворения активного вещества. После этого состав необходимо хорошенько процедить.
- Отфильтрованный раствор нужно поместить в эмалированный сосуд и поставить его на огонь.
 После закипания в емкость нужно аккуратно высыпать 95 грамм аммиачной селитры. Кипятить средство нужно в течение 3—4 минут, постоянно помешивая. Затем его нужно снять с газа.
После закипания в емкость нужно аккуратно высыпать 95 грамм аммиачной селитры. Кипятить средство нужно в течение 3—4 минут, постоянно помешивая. Затем его нужно снять с газа. - Теплую смесь необходимо поместить в бутылку из пластика и дождаться ее остывания. После того как раствор охладится, его нужно поместить на 1—1,5 часа в холодильную камеру. Затем состав нужно подержать 3 часа в морозилке.
- После охлаждающих процедур воду из бутылочки следует аккуратно слить. На дне емкости останется готовая к применению субстанция. Ее кристаллики нужно подсушить в теплом и сухом помещении на бумажном листке в течение 3—4 суток.
Смотрите это видео на YouTube
Примечательно, что сейчас дачники все чаще отказываются от использования минеральных подкормок в пользу органических. Однако специалисты не советуют прибегать к подобной затее, потому что минеральные удобрения бывают совершенно незаменимы для богатого и качественного урожая.
Кроме этого, они улучшают зимостойкость и работу иммунитета у самых разных культур.
Понравилась статья? Поделиться с друзьями:
Селитра калиевая (нитрат калия) — Ботаничка
Селитра калиевая (нитрат калия) – широко востребованное азотно-калийное удобрение, в состав которого включено 13% азота и 45 – 46% калия. Применятся в весенне-летний период для жидких корневых и внекорневых подкормок культур, как в открытом, так и в защищенном грунте. Представляет собой хорошо растворимый в воде белый кристаллический порошок. Легко воспламеняется.
| Состав | |
| Азот (N) | до 14% |
| Калий (K2O) | до 46% |
Переоценить значимость азота в жизни растений невозможно. Данный элемент входит в состав белков, оказывает влияние на интенсивность развитие растений, усиливает плодоношение. Его недостаток можно определить по следующим признакам:
- начиная с нижней части растения листья высветляются, в направлении от кончиков к середине;
- стебли и листовой аппарат теряют свою упругость;
- растение отстает в росте.

Неблагоприятен для растений и избыток азота. Его можно определить по:
- необычно темному цвету листвы;
- образованию особенно крупных, сочных листьев;
- задержке начала цветения;
- задержке развития урожая.
Не менее важен для растений и калий. Данный элемент стимулирует всхожесть семян, обеспечивает полноценное развитие растительного организма, повышает его устойчивость к перепаду суточных температур. При его недостатке у растений формируются неполноценные клетки, из которых затем формируется неполноценный низкокачественный урожай.
Определить недостаток калия у растений можно по разным признакам, – в зависимости от культуры они отличаются. В целом же у растений, страдающих калийным голоданием может наблюдаться:
- снижение тургора – листья вянут, поникают;
- на кончиках листьев развивается некроз — явление под названием «краевой ожог».
Однако негативное влияние оказывает и избыток калия. Определить его можно по состоянию листьев: между их жилками появляются высветляющиеся мозаичные пятна, которые быстро буреют, листва опадает.
Список культур для применения:
- Декоративные
- Овощные
- Плодово-ягодные
Когда и как применяется
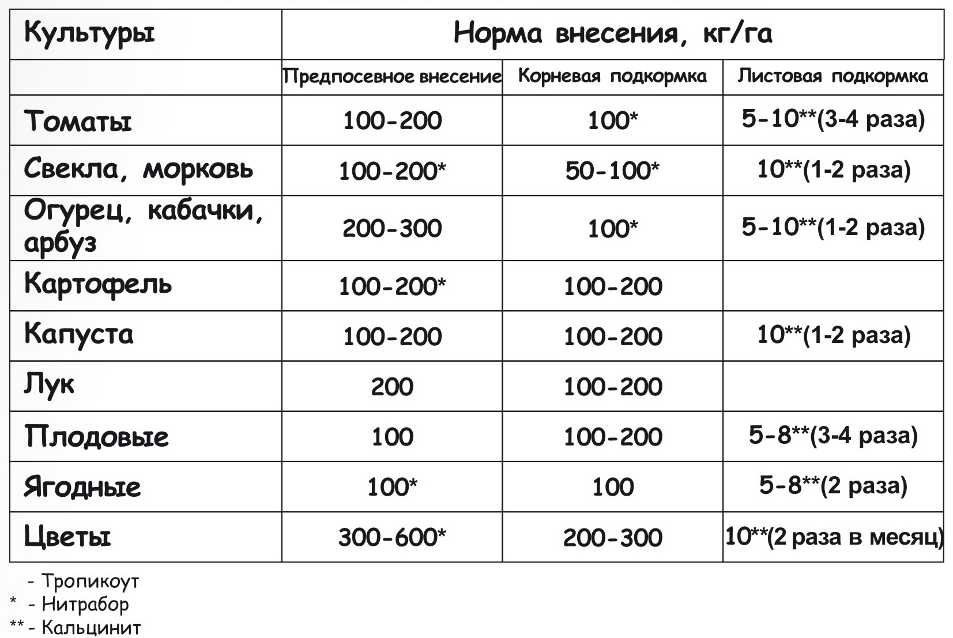
Селитра калиевая применяется в качестве одно- или двукратной корневой и внекорневой подкормки в периоды наиболее активного развития растений. Заметно усиливает вкус и повышает качество плодов. Дозировка и количество внесений разнится в зависимости от культуры.
Лучшим вариантом внесения считается внесение в виде водного раствора. При внесении в сухом виде необходима незамедлительная заделка в почву на глубину 7 – 8 см и последующий обильный полив.
| Сроки и способы применения | |
| Апрель | |
| Май | Припосевное внесение |
| Июнь | Подкормки |
| Июль | Подкормки |
| Август | Подкормки |
Дозировка
- Плодово-ягодные и овощные культуры – 1 – 5 некорневых подкормок в период вегетации с интервалом 10 – 15 дней, раствором удобрения в концентрации 10-20 г на 1 л воды, с расходом рабочего раствора:
- травянистые растения – 1,0 – 1,5 л на 10 кв.
 м,
м, - кустарники – 1,5 – 2 л на 10 кв. м,
- деревья – 2 л (на молодое растение), 5 – 8 л (на взрослое растение).
- травянистые растения – 1,0 – 1,5 л на 10 кв.
- Корневые подкормки в период активного роста, с интервалом 10 – 15 дней, но не более 5 подкормок, раствором в концентрации 10 – 15 г на 10 л воды, с расходом рабочей жидкости – 4 –10 л на 1 кв. м.
- Ягодные и декоративные кустарники – корневые подкормки в период активного роста, с интервалом 10 – 15 дней, но не более 5 подкормок, раствором в концентрации 10 – 20 г на 10 л воды, с расходом рабочей жидкости – 10 – 20 л на 1 растение.
- Плодовые и декоративные деревья – корневые подкормки в период активного роста, с интервалом 10 – 15 дней, но не более 5 подкормок, раствором удобрения в концентрации 25 г на 10 л воды, с расходом рабочей жидкости – 10 – 20 л на 1 растение.
- Цветочно-декоративные культуры (открытый грунт) – корневые подкормки в период активного роста, с интервалом 10 – 15 дней, но не более 5 подкормок, раствором удобрения в концентрации 10 – 20 г на 10 л воды, с расходом рабочей жидкости – 5 – 10 л на 1 кв.
 м.
м. - Цветочно-декоративные культуры (горшечные) – корневые подкормки в период активного роста, с интервалом 10 – 15 дней, но не более 5 подкормок, раствором удобрения в концентрации 10 – 20 г на 10 л воды, до увлажнения земляного кома.
1 столовая ложка вмещает 15 г удобрения.
Ознакомиться с полным ассортиментом продукции компании «Буйские удобрения» и узнать, как её приобрести, вы можете на сайте компании: www.bhzshop.ru
Читайте больше о удобрениях и их применении, а также подписывайтесь на новости компании «Буйские удобрения» в социальных сетях и на Ботаничке:
Нитрат калия | 7757-79-1
Описание
Нитрат калия (химическая формула: KNO3) представляет собой нитрат калия. Это кристаллическая соль и сильный окислитель, который можно специально использовать при изготовлении пороха, в качестве удобрения и в медицине. Его можно получить путем реакции между нитратом аммония и гидроксидом калия или, альтернативно, путем реакции между нитратом аммония и хлоридом калия. Нитрат калия имеет различные применения. Его основные области применения включают: удобрения, удаление пней, ракетное топливо и фейерверки. Его также можно использовать для производства азотной кислоты. Это также полезно для консервирования продуктов и приготовления пищи. В фармакологии его можно использовать для лечения астмы и снижения высокого кровяного давления.
Нитрат калия имеет различные применения. Его основные области применения включают: удобрения, удаление пней, ракетное топливо и фейерверки. Его также можно использовать для производства азотной кислоты. Это также полезно для консервирования продуктов и приготовления пищи. В фармакологии его можно использовать для лечения астмы и снижения высокого кровяного давления.
Использование
- Нитрат калия используется в основном в производстве пороха или других взрывчатых веществ, но также используется для фейерверков, спичек люцифера, для соления мяса, для производства некоторых видов стекла, для флюса в металлургических анализах, для некоторых красителей и в медицине.
- В сельском хозяйстве калийная селитра используется как водорастворимый и практически не содержащий хлора источник нитратно-азотных и калийных питательных веществ. Из-за специфических характеристик и преимуществ продукта целевые рынки связаны с ценными культурами, такими как овощи, фрукты и цветы.

- Нитрат калия используется в самых разных областях, включая производство стекла, взрывчатых веществ для горнодобывающих и строительных работ, обработки металлов, фейерверков, а в последнее время — как средство резкого повышения эффективности установок по концентрации солнечной энергии (CSP), как описано в следующий абзац.
азотнокислое удобрение
Калийная селитра — водорастворимое NK-удобрение, содержащее 13,7 % нитратного азота и 46 % оксида калия (38,4 %). Нитрат калия (KNO3) является растворимым источником двух основных питательных веществ, необходимых для растений. Он обычно используется в качестве удобрения для ценных культур, которые извлекают выгоду из нитратного (NO3-) питания и источника калия (K+), не содержащего хлорида (Cl-).
Производство
Производители обычно производят удобрение из нитрата калия (иногда называемое нитратом калия или NOP) путем взаимодействия хлорида калия (KCl) с источником нитрата. В зависимости от целей и доступных ресурсов нитрат может быть получен из нитрата натрия, азотной кислоты или аммиачной селитры. Полученный KNO3 идентичен независимо от производственного процесса.Нитрат калия обычно продается в виде водорастворимого кристаллического материала, в первую очередь предназначенного для растворения и нанесения водой, или в виде гранул для внесения в почву.Традиционно это соединение известно как селитра.
Приложение
Производители ценят удобрение KNO3, особенно в условиях, когда необходим хорошо растворимый источник питательных веществ, не содержащий хлоридов. В таких почвах весь азот сразу же доступен для поглощения растениями в виде нитратов, что не требует дополнительного микробного воздействия и трансформации почвы. Производители ценных овощных и садовых культур иногда предпочитают использовать источник питания на основе нитратов, чтобы повысить урожайность и качество.
 Нитрат калия содержит относительно высокую долю калия, при этом отношение азота к калию составляет примерно один к трем. Многие культуры имеют высокие потребности в калии и могут удалять столько же или даже больше калия, чем азота при сборе урожая. Внесение KNO3 в почву производится перед вегетационным периодом или в качестве добавки в течение вегетационного периода. Разбавленный раствор иногда распыляют на листву растений для стимуляции физиологических процессов или восполнения дефицита питательных веществ. Некорневое внесение калия во время развития плодов дает преимущества некоторым культурам, поскольку эта стадия роста часто совпадает с высокой потребностью в калии во время снижения корневой активности и поглощения питательных веществ. Он также широко используется для выращивания тепличных растений и гидропонного выращивания. Нитрат калия составляет лишь небольшую часть мирового рынка калийных удобрений. Он в основном используется там, где его уникальный состав и свойства могут принести особую пользу производителям.
Нитрат калия содержит относительно высокую долю калия, при этом отношение азота к калию составляет примерно один к трем. Многие культуры имеют высокие потребности в калии и могут удалять столько же или даже больше калия, чем азота при сборе урожая. Внесение KNO3 в почву производится перед вегетационным периодом или в качестве добавки в течение вегетационного периода. Разбавленный раствор иногда распыляют на листву растений для стимуляции физиологических процессов или восполнения дефицита питательных веществ. Некорневое внесение калия во время развития плодов дает преимущества некоторым культурам, поскольку эта стадия роста часто совпадает с высокой потребностью в калии во время снижения корневой активности и поглощения питательных веществ. Он также широко используется для выращивания тепличных растений и гидропонного выращивания. Нитрат калия составляет лишь небольшую часть мирового рынка калийных удобрений. Он в основном используется там, где его уникальный состав и свойства могут принести особую пользу производителям. Кроме того, с ним легко обращаться и применять, и он совместим со многими другими удобрениями, в том числе со специальными удобрениями для многих ценных специальных культур, а также с удобрениями, используемыми для зерновых и волокнистых культур.
Кроме того, с ним легко обращаться и применять, и он совместим со многими другими удобрениями, в том числе со специальными удобрениями для многих ценных специальных культур, а также с удобрениями, используемыми для зерновых и волокнистых культур.Ссылки
- https://en.wikipedia.org/wiki/Нитрат калия
- https://pubchem.ncbi.nlm.nih.gov/compound/potassium_nitrate#section=Top
- http://www.cropnutrition.com/калий-нитрат
Описание
Нитрат калия представляет собой твердое бесцветное кристаллическое ионное соединение, которое существует в виде минерала. нитрат. Нитрат калия также известен как селитра. Название селитра происходит от латинского sal petrae, что означает соль камня или соль Петры. он термин селитра или чилийская селитра также используется для нитрата натрия, NaNO3.
Химические свойства
Нитрат калия представляет собой легковоспламеняющиеся, водорастворимые, белые или бесцветные кристаллы белого или бесцветного цвета, без запаха, с солоноватым вкусом, плавящиеся при 337°С. Используется в пиротехнике, взрывчатых веществах и спичках, как удобрение и как аналитический реагент.
Используется в пиротехнике, взрывчатых веществах и спичках, как удобрение и как аналитический реагент.
Физические свойства
Бесцветные прозрачные кристаллы или белый зернистый или кристаллический порошок; ромбоэдрическая структура; плотность 2,11 г/см 3 при 20°С; плавится при 334°С; разлагается при 400°С с выделением кислорода; растворим в холодной воде 13,3 г/100 мл при 0°С; хорошо растворим в кипящей воде 247 г/100 мл при 100°С; понижает температуру воды при растворении; очень мало растворим в этаноле; растворим в глицерине и жидком аммиаке.
История
Самое известное использование селитры в истории человечества
в качестве основного ингредиента пороха. Нитрат калия, используемый в порохе, первоначально был получен из природного минерала.
залежи селитры. Небольшие количества, образующиеся в виде высолов на влажных каменных стенах, были идентифицированы еще в 2000 г. до н.э. в шумерских письменах. По мере расширения использования черного пороха
с развитием оружия спрос на селитру превысил предложение. Это усугублялось
во времена войны. Чтобы удовлетворить спрос на селитру для производства черного пороха, селитра
развивалась промышленность, которая следовала предписанным методам производства большого количества селитры.
Этот метод зависел от обработки грязи, полученной из мест, где нитраты естественным образом накапливались.
форма. Это были участки, в которых скапливались отходы жизнедеятельности животных, такие как грязь.
полы амбаров, конюшен, пастушьих загонов, пещер или подвалов. Соединения аммиака в моче
и фекальные отходы в этих районах подвергались нитрификации с образованием нитратов, которые в сочетании
с калием в почве с образованием селитры.
до н.э. в шумерских письменах. По мере расширения использования черного пороха
с развитием оружия спрос на селитру превысил предложение. Это усугублялось
во времена войны. Чтобы удовлетворить спрос на селитру для производства черного пороха, селитра
развивалась промышленность, которая следовала предписанным методам производства большого количества селитры.
Этот метод зависел от обработки грязи, полученной из мест, где нитраты естественным образом накапливались.
форма. Это были участки, в которых скапливались отходы жизнедеятельности животных, такие как грязь.
полы амбаров, конюшен, пастушьих загонов, пещер или подвалов. Соединения аммиака в моче
и фекальные отходы в этих районах подвергались нитрификации с образованием нитратов, которые в сочетании
с калием в почве с образованием селитры.
Использование
Хотя селитра чаще всего используется для производства черного пороха, нитрат калия также используется в качестве удобрения. В первой половине XVII века Иоганн Рудольф Глаубер (1604–1668) добыл селитру из загонов для животных и открыл ее применение для стимулирования роста растений. Глаубер включал селитру вместе с другими питательными веществами в смеси удобрений. Работа Глаубера одной из первых указала на важность круговорота питательных веществ в питании растений.
В первой половине XVII века Иоганн Рудольф Глаубер (1604–1668) добыл селитру из загонов для животных и открыл ее применение для стимулирования роста растений. Глаубер включал селитру вместе с другими питательными веществами в смеси удобрений. Работа Глаубера одной из первых указала на важность круговорота питательных веществ в питании растений.
Использование
Это натуральное вещество является продуктом разложения извести и мочи. Белые гранулы или порошок растворимы в воде 1:3, но нерастворим в спирте. Нитрат калия, а также называемая селитрой или селитрой, смешивалась с серной кислотой для азотнокислого хлопка для производства коллодия. Это также используется с магнием для изготовления флэш-порошка и добавляется в проявители сульфата железа для получения холодных белых тонов в коллодий положительный.
Использование
Нитрат калия является консервантом и фиксатором цвета в мясе. который существует в виде бесцветных призм, белых гранул или порошка. в нем есть
растворимость 1 г в 3 мл воды при 25°С. см. нитраты.
который существует в виде бесцветных призм, белых гранул или порошка. в нем есть
растворимость 1 г в 3 мл воды при 25°С. см. нитраты.
Использование
В фейерверках, флюсах, мариновании мяса; производство азотной кислоты; производство стекла, спичек, пороха; замораживающие смеси. Сельскохозяйственное удобрение. Консервант в пищевых продуктах. В зубных пастах для снижения гиперчувствительности зубов.
Методы производства
Нитрат калия может быть получен несколькими способами. Он производится в промышленных масштабах путем взаимодействия хлорида калия с азотной кислотой при высокой температуре. Нитрозилхлорид, продукт, полученный в результате реакции, в этом производственном процессе превращается в хлор. Кроме того, азотная кислота частично рециркулируется в процессе. Реакции (Dancy, W.B. 1981. Potassium Compounds. In Kirk-Othmer Encyclopedia of Chemical Technology, 39). 0050 рд . изд. Стр. 939-42. Нью -Йорк: Wiley Interscience):
0050 рд . изд. Стр. 939-42. Нью -Йорк: Wiley Interscience):
3Kcl + 4HNO 3 → 3KNO 3 + CL 2 + NOCL + 2H 2 O
2NOCL + 4HNO 3 → 6NO 2 + CL + CL + CL + CLA + + + CL + . 2H 2 O
4NO 2 + O 2 + 2H 2 O →4HNO 3
Нитрат калия также можно получить смешиванием горячего насыщенного раствора хлорида калия и нитрата натрия. Реакция:
K++ Clˉ+ Na++ NO 3 ˉ→NaCl↓+ K++ NO 3 ˉ
Хлорид натрия менее растворим, чем KCl, NaNo 3 и KNo 3 . Он выделяется путем кристаллизации. Оставшийся раствор охлаждают до температуры окружающей среды. Нитрат калия кристаллизуется.
Определение
ЧЭБИ: Неорганическая азотнокислая соль калия.
торговая марка
Холал модифицированный; Холал простой; Таблетки Девитта от болей в спине и суставах; Виридит к.
Всемирная организация здравоохранения (ВОЗ)
Нитрат калия раньше использовался как мочегонное средство. Его использование для этого цель теперь считается устаревшей, но она все еще доступна по крайней мере в одной стране для коррекции дефицита калия. Это также широко разрешено в концентрации порядка 5% в запатентованных зубных пастах. В некоторых странах Препарат был запрещен из-за потенциального канцерогенного риска, связанного с чрезмерное употребление нитратов и превращение их в нитрозамины.
Общее описание
Кристаллическое твердое вещество от белого до грязно-серого цвета. Вода. Негорюч, но ускоряет горение горючих материалов. Если в огонь вовлечены большие количества или горючий материал мелко измельчен, может произойти взрыв. Может взорваться при длительном воздействии тепла или огня. Токсичные оксиды азота образуются при пожарах. Используется в твердом топливе, взрывчатых веществах, удобрениях.
Реакции воздуха и воды
Растворим в воде.
Профиль реактивности
Нитрат калия в смеси с алкиловыми эфирами может взорваться из-за образования алкилнитратов; смеси с фосфором, хлоридом олова (II) или другими восстановителями могут реагировать со взрывом [Bretherick 1979. p. 108-109]. Порошок сурьмы, смешанный с нитратом калия, взрывается при нагревании [Mellor 9:282 1946-47]. Смесь трисульфида сурьмы и нитрата калия взрывается до красного каления [Mellor 9:524. 1946-47]. Дисульфид мышьяка образует взрывоопасные смеси при смешивании с нитратом калия [Mellor 9:270.1946-47]. Смесь ацетата натрия и нитрата калия может вызвать взрыв [Pieters 1957. p. 30]. Смесь нитрата калия и гипофосфита натрия представляет собой мощное взрывчатое вещество [Mellor 8:881. 1946-47]. Смесь порошкообразного циркония и нитрата калия взрывается при нагревании выше точки плавления [Mellor 7:116. 1946-47].
1946-47].
Опасность
Опасность пожара и взрыва при при ударе током или нагревании, или при контакте с органическими веществами. риалы, сильный окислитель.
Опасность для здоровья
Воздействие может вызвать легкое раздражение глаз, носа и горла.
Воспламеняемость и взрывоопасность
негорючий
Сельскохозяйственное использование
Нитрат калия (KNO3) представляет собой калиевую соль азотной кислоты, также известную как селитра или нитрат калия. Это белая кристаллическая соль, встречающаяся в природе в виде селитры или селитры. Его можно использовать как удобрение для обычного внесения и фертигации. Калий (44 % K2O) и азот (13 %) входят в состав NK-удобрений, которые служат источником калия, где нежелательно дополнительное содержание хлоридов.
Сельскохозяйственный сорт калийной селитры является сыпучим и неслеживающимся, с размером частиц в диапазоне от 1500 до 400 микрон.
Нитрат калия, который является слегка гигроскопичным и гранулированным, может вноситься в почву грузовиками, распределителями удобрений или распылением с воздуха. В смешанном удобрении порошкообразный сорт калийной селитры не слеживается. Нитрат калия получают реакцией хлорида калия с азотной кислотой следующим образом: Нитрат калия образует сверху легко разрушаемую корку. Он химически нейтрален, а соотношение оксидов азота и калия в нем составляет примерно 1:3. Он успешно используется в качестве источника азота и калия для табака, помидоров, картофеля, кукурузы, цитрусовых и гвоздик.
Промышленное использование
Нитрат калия также называют селитрой и селитрой, хотя обычно они относятся к нативному минералу. Вещество состава KNO3, используется во взрывчатых веществах, для воронения стали, в качестве удобрений. Смесь азотнокислого калия и азотнокислого натрия используется для ванн закалки стали. Смесь плавится при 250°С. Нитрат калия образуется при взаимодействии хлорида калия с нитратом натрия. Встречается в виде бесцветных призматических кристаллов или в виде кристаллического белого порошка. Он имеет острый солоноватый вкус и хорошо растворяется в воде. Удельный вес составляет 2,1, а температура плавления составляет 337°C.
Смесь азотнокислого калия и азотнокислого натрия используется для ванн закалки стали. Смесь плавится при 250°С. Нитрат калия образуется при взаимодействии хлорида калия с нитратом натрия. Встречается в виде бесцветных призматических кристаллов или в виде кристаллического белого порошка. Он имеет острый солоноватый вкус и хорошо растворяется в воде. Удельный вес составляет 2,1, а температура плавления составляет 337°C.
Нитрат калия содержит большой процент кислорода, который легко отдается и хорошо подходит для пиротехнических составов. При горении дает красивое фиолетовое пламя. Используется в сигнальных ракетах и сигнальных ракетах.
Большинство эмалей содержат окислитель в виде нитрата калия или натрия. Необходимо лишь небольшое количество нитрата; От 2 до 4% достаточно для поддержания окислительных условий в большинстве плавильных операций.
В глазури он иногда используется в качестве флюса вместо оксида калия, но из-за его стоимости и растворимости в глазури содержится очень мало его. Там, где условия не позволяют использовать достаточное количество калийного полевого шпата, в смесь вводят окись калия, обычно в виде нитрата во фритте.
Там, где условия не позволяют использовать достаточное количество калийного полевого шпата, в смесь вводят окись калия, обычно в виде нитрата во фритте.
Нитрит калия представляет собой твердое вещество состава KNO 2 , используемое в качестве ингибитора ржавчины, для регенерации солей-теплоносителей и для производства красителей.
Биохим/физиол Действия
Нитрат калия служит источником нитрата для роста клеток. Он также индуцирует синтез липидов у водорослей Neochloris oleoabundans.
Профиль безопасности
Отравление внутривенно
маршрут. Умеренно токсичен при приеме внутрь. Ан
экспериментальный тератоген. Экспериментальный
репродуктивные эффекты. Данные мутации
сообщил. Проглатывание больших количеств может
вызвать гастроэнтерит. Хроническое воздействие может
вызывают анемию, нефрит и
метгемоглобинемия. При нагревании реакция
с гидроксидом кальция + полихлорированные
фенолы образуют чрезвычайно токсичные хлорированные
бензотоксины. Мощный окислитель. Порох — это
смесь азотнокислого калия + сера +
древесный уголь. Взрывная реакция с алюминием
+ нитрат бария + перхлорат калия +
вода (в запасе), бор + ламинак +
трихлорэтилен. Образует взрывоопасные смеси
с лактозой, порошкообразными металлами (например,
титан, сурьма, германий), металл
сульфиды (например, трисульфид сурьмы, барий
сульфид, сульфид кальция, германий
моносульфид, дисульфид титана, мышьяк
дисульфид, дисульфид молибдена), неметаллы
(например, бор, углерод, белый фосфор,
мышьяк), органические материалы, фосфиды (например,
фосфид меди(l1), медь
монофосфид), восстановители (например,
фосфинат натрия, тиосульфат натрия),
ацетат натрия. Может бурно реагировать под
соответствующие условия с 1,3-
бис(трихлорметад)бензол, бор
фосфид, F2, щид кальция, древесный уголь,
нитрид хрома, гипофосфат натрия,
ma2O2 + декстроза), красный фосфор, (S +
As2S3), дикарбид тория, трихлорэтилен,
цинк, цирконий. При нагревании до
при разложении выделяет очень ядовитые пары
NOx и K2O.
Мощный окислитель. Порох — это
смесь азотнокислого калия + сера +
древесный уголь. Взрывная реакция с алюминием
+ нитрат бария + перхлорат калия +
вода (в запасе), бор + ламинак +
трихлорэтилен. Образует взрывоопасные смеси
с лактозой, порошкообразными металлами (например,
титан, сурьма, германий), металл
сульфиды (например, трисульфид сурьмы, барий
сульфид, сульфид кальция, германий
моносульфид, дисульфид титана, мышьяк
дисульфид, дисульфид молибдена), неметаллы
(например, бор, углерод, белый фосфор,
мышьяк), органические материалы, фосфиды (например,
фосфид меди(l1), медь
монофосфид), восстановители (например,
фосфинат натрия, тиосульфат натрия),
ацетат натрия. Может бурно реагировать под
соответствующие условия с 1,3-
бис(трихлорметад)бензол, бор
фосфид, F2, щид кальция, древесный уголь,
нитрид хрома, гипофосфат натрия,
ma2O2 + декстроза), красный фосфор, (S +
As2S3), дикарбид тория, трихлорэтилен,
цинк, цирконий. При нагревании до
при разложении выделяет очень ядовитые пары
NOx и K2O. См. также НИТРАТЫ.
См. также НИТРАТЫ.
Потенциальное воздействие
Используется для изготовления взрывчатых веществ, пороха, фейерверки, ракетное топливо; спички, удобрения, флюсы, стекло производство; и как мочегонное средство
Доставка
UN1486 Нитрат калия, класс опасности: 5.1; Метки: 5.1-Окислитель.
Методы очистки
Кристаллизуется из горячей воды (0,5 мл/г) при охлаждении (см. KNO2 ниже). Высушите в течение 12 часов под вакуумом при 70°. Растворимость в воде 13,3% при 0°, 110% при 60° и 246% при 100°. После двух перекристаллизаций техническая соль имела
Несовместимость
Мощный окислитель. Опасно
реактивный и чувствительный к трению и удару при смешивании с
органические материалы и многие материалы. Насильственные реакции
с восстановителями; химически активные металлы; древесный уголь,
трихлорэтилен.
Влияние состава на плотность многокомпонентного расплава азотнокислых солей. (Технический отчет)
Влияние состава на плотность многокомпонентного расплава нитратных солей. (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другие сопутствующие исследования
Измеряли плотность расплавленных нитратных солей, чтобы определить влияние компонентов на плотность многокомпонентных смесей. Расплавленные соли состояли из различных пропорций нитратов калия, натрия, лития и кальция. Измерения плотности проводились с использованием архимедова метода, и результаты сравнивались с данными, представленными в литературе для отдельных составляющих солей или простых комбинаций, таких как бинарная смесь Солнечной соли NaNO3 и KNO3. Добавление нитрата кальция обычно увеличивало плотность по сравнению с нитратом калия или нитратом натрия, в то время как нитрат лития уменьшал плотность. Температурная зависимость плотности описывается линейным уравнением независимо от состава. Молярный объем и, следовательно, плотность многокомпонентных смесей можно рассчитать как функцию температуры с использованием правила линейной аддитивности, основанного на свойствах отдельных компонентов.
Добавление нитрата кальция обычно увеличивало плотность по сравнению с нитратом калия или нитратом натрия, в то время как нитрат лития уменьшал плотность. Температурная зависимость плотности описывается линейным уравнением независимо от состава. Молярный объем и, следовательно, плотность многокомпонентных смесей можно рассчитать как функцию температуры с использованием правила линейной аддитивности, основанного на свойствах отдельных компонентов.
- Авторов:
- Брэдшоу, Роберт В.
- Дата публикации:
- Исследовательская организация:
- Sandia National Laboratories (SNL), Альбукерке, Нью-Мексико, и Ливермор, Калифорния (США)
- Организация-спонсор:
- USDOE
- Идентификатор ОСТИ:
- 983681
- Номер(а) отчета:
- SAND2009-8221
РНН: US201014%%1757
- Номер контракта с Министерством энергетики:
- АК04-94АЛ85000
- Тип ресурса:
- Технический отчет
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 25 НАКОПЛЕНИЕ ЭНЕРГИИ; КАЛЬЦИЙ; НИТРАТЫ КАЛЬЦИЯ; ДАННЫЕ; ПЛОТНОСТЬ; УРАВНЕНИЯ; ФУНКЦИИ; ЛИТИЙ; НИТРАТЫ ЛИТИЯ; СМЕСИ; РАСПЛАВЛЕННЫЕ СОЛИ; НИТРАТЫ; КАЛИЙ; КАЛИЯ НИТРАТЫ; СОЛИ; НАТРИЙ; НАТРИЯ НИТРАТЫ; ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ; ОБЪЕМ; ССП; Концентрация солнечной энергии
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Брэдшоу, Роберт В. Влияние состава на плотность многокомпонентных расплавленных нитратных солей. . США: Н. П., 2009.
Веб. дои: 10.2172/983681.
Влияние состава на плотность многокомпонентных расплавленных нитратных солей. . США: Н. П., 2009.
Веб. дои: 10.2172/983681.
Копировать в буфер обмена
Брэдшоу, Роберт В. Влияние состава на плотность многокомпонентных расплавленных нитратных солей. . Соединенные Штаты. https://doi.org/10.2172/983681
Копировать в буфер обмена
Брэдшоу, Роберт В. 2009.
«Влияние состава на плотность многокомпонентных расплавов азотнокислых солей». Соединенные Штаты. https://doi.org/10.2172/983681. https://www.osti.gov/servlets/purl/983681.
Копировать в буфер обмена
@статья{ости_983681,
title = {Влияние состава на плотность многокомпонентных расплавов азотнокислых солей. },
},
автор = {Брэдшоу, Роберт В.},
abstractNote = {Плотность расплавленных нитратных солей была измерена для определения влияния компонентов на плотность многокомпонентных смесей. Расплавленные соли состояли из различных пропорций нитратов калия, натрия, лития и кальция. Измерения плотности проводились с использованием архимедова метода, и результаты сравнивались с данными, представленными в литературе для отдельных составляющих солей или простых комбинаций, таких как бинарная смесь Солнечной соли NaNO3 и KNO3. Добавление нитрата кальция обычно увеличивало плотность по сравнению с нитратом калия или нитратом натрия, в то время как нитрат лития уменьшал плотность. Температурная зависимость плотности описывается линейным уравнением независимо от состава. Молярный объем и, следовательно, плотность многокомпонентных смесей можно рассчитать как функцию температуры с использованием правила линейной аддитивности, основанного на свойствах отдельных компонентов.},
дои = {10.


 После закипания в емкость нужно аккуратно высыпать 95 грамм аммиачной селитры. Кипятить средство нужно в течение 3—4 минут, постоянно помешивая. Затем его нужно снять с газа.
После закипания в емкость нужно аккуратно высыпать 95 грамм аммиачной селитры. Кипятить средство нужно в течение 3—4 минут, постоянно помешивая. Затем его нужно снять с газа.
 м,
м, м.
м.