Сульфит бария, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
17. Определение оксида бария
17.1. Ошибка повторяемости и расхождение между результатами параллельных определений не должны превышать значений, указанных в табл. 17.
Таблица 17
%
Массовая доля оксида бария
|
|
|
До 1,0 включ. |
±0,04 |
0,06 |
Св. 1,0 до 4,0 «
|
±0,15 |
0,20 |
» 4,0 » 10,0 «
| ±0,30 | 0,40 |
» 10,0 » 15,0 «
| ±0,40 | 0,60 |
17. 2.
Гравиметрический метод
2.
Гравиметрический метод
Метод основан на осаждении оксида бария из соляно-кислого раствора в виде серно-кислого бария и нахождении массовой доли оксида бария при взвешивании выделенного оксида.
Присутствующая в анализируемой пробе кремнекислота находится в растворимой форме и не мешает определению оксида бария.
17.2.1. Средства анализа
Весы лабораторные общего назначения.
Печь муфельная.
Кислота соляная по ГОСТ 3118 и раствор 1:3.
Кислота серная по ГОСТ 4204, раствор массовой концентрацией 50 г/куб.дм.
Аммиак водный по ГОСТ 3760, раствор 1:1,5.
Серебро азотно-кислое по ГОСТ 1277, раствор массовой концентрацией 10 г/куб.дм.
Смесь для сплавления по п. 6.4.1.
17.2.2. Проведение анализа
Навеску
материала массой 0,5 г сплавляют с 2 г
смеси для сплавления. После охлаждения
плав растворяют в 40 — 50 куб. см теплого
раствора соляной кислоты в стакане
вместимостью 300 — 400 куб.см до полного
растворения. Полученный раствор
разбавляют водой до 200 — 250 куб.см, не
обращая внимания на возможное выпадение
осадка серно-кислого бария, нейтрализуют
аммиаком до появления легкой мути
гидроксидов, которую растворяют
несколькими каплями соляной кислоты,
и добавляют в раствор избыток 2 куб.см
той же кислоты.
см теплого
раствора соляной кислоты в стакане
вместимостью 300 — 400 куб.см до полного
растворения. Полученный раствор
разбавляют водой до 200 — 250 куб.см, не
обращая внимания на возможное выпадение
осадка серно-кислого бария, нейтрализуют
аммиаком до появления легкой мути
гидроксидов, которую растворяют
несколькими каплями соляной кислоты,
и добавляют в раствор избыток 2 куб.см
той же кислоты.
Затем
раствор нагревают до кипения, прибавляют
15 куб.см горячего раствора серной кислоты
и кипятят в течение 1 — 2 мин. Раствор с
осадком выдерживают в теплом месте до
тех пор, пока жидкость над осадком не
станет прозрачной, затем фильтруют
через двойной плотный фильтр «синяя
лента» в мерную колбу вместимостью
500 куб.см и промывают горячей водой до
исчезновения реакции на ион хлора.
Осадок вместе с фильтром переносят в
предварительно прокаленный и взвешенный
фарфоровый тигель, подсушивают, озоляют
и прокаливают в муфельной печи при
температуре 800 — 850 град.С в течение 20 —
30 мин. Тигель с прокаленным осадком
охлаждают в эксикаторе и взвешивают.
Прокаливание повторяют до постоянной
массы.
Тигель с прокаленным осадком
охлаждают в эксикаторе и взвешивают.
Прокаливание повторяют до постоянной
массы.
Фильтр, полученный после отделения осадка, разбавляют до метки водой, перемешивают и используют для определения массовой доли оксида кальция по п. 7.2.
17.2.3. Обработка результатов
Массовую долю оксида бария () в процентах вычисляют по формуле
где | — | масса тигля с прокаленным осадком серно-кислого бария, г;
|
| — | масса пустого прокаленного тигля, г;
|
| — | масса навески пробы, г;
|
0,657 | — | коэффициент
пересчета серно-кислого бария на оксид
бария.
|
17.3. Фототурбидиметрический метод
Метод основан на взаимодействии ионов бария и сульфат-ионов с образованием суспензии сульфата бария в кислой среде в присутствии защитного коллоида и фотометрировании степени помутнения раствора.
17.3.1. Средства анализа
Весы лабораторные общего назначения.
Печь муфельная.
Фотоэлектроколориметр концентрационный.
Кислота соляная по ГОСТ 3118, раствор 1:3.
Кислота ортофосфорная по ГОСТ 6552.
Крахмал растворимый по ГОСТ 10163 : 0,5 г крахмала смешивают со 100 куб.см кипящей воды, кипятят 5 мин, фильтруют и охлаждают.
Калий серно-кислый по ГОСТ 4145.
Барий серно-кислый по ГОСТ 3158.
Смесь для сплавления по п. 6.4.1.
17.3.2. Подготовка к анализу
17.3.2.1. Приготовление стандартных образцов
К
пяти навескам ОСО сырьевой смеси массой
5 г добавляют соответственно 0,1; 0,2; 0,3;
0,4; 0,5 г серно-кислого бария, что должно
соответствовать массовой доле оксида
бария в полученных стандартных образцах
1,29; 2,53; 3,72; 4,87; 5,97%.
Смеси тщательно перемешивают и проверяют массовую долю элемента по п. 17.2.2, после чего вносят коррективы в массовые доли оксида бария в стандартных образцах.
Для анализа материалов с массовой долей оксида бария менее 1,0% приготовленную и проверенную по содержанию элемента серию стандартных образцов разбавляют ОСО сырьевой смеси в соотношении 1:4, получая, таким образом, вторую серию стандартных образцов с массовой долей оксида бария 0,26; 0,51; 0,74; 0,97; 1,19%.
17.3.2.2. Построение градуировочного графика
Навески
стандартных образцов массой 0,10 г помещают
в платиновые тигли, добавляют по 0,1 г
серно-кислого калиия и 1 г смеси для
сплавления, тщательно перемешивают и
сплавляют в течение 10 мин при температуре
(900±100)°С, плав с тиглем охлаждают и
помещают в стакан вместимостью 300 куб.см.
В тигель добавляют 10 куб.см раствора
соляной кислоты 1:3 и 10 куб.см крахмала.
Растворение ведут на магнитной мешалке
в течение 5 мин, помещая магнитный элемент
внутрь тигля и прикрыв стакан часовым
стеклом. Мерным цилиндром отмеряют 200
куб.см воды с добавлением 10 капель
ортофосфорной кислоты и 10 куб.см раствора
соляной кислоты, обмывают частью
приготовленного раствора тигель, после
чего тигель удаляют из стакана, а
оставшийся в цилиндре раствор вливают
в стакан.
Мерным цилиндром отмеряют 200
куб.см воды с добавлением 10 капель
ортофосфорной кислоты и 10 куб.см раствора
соляной кислоты, обмывают частью
приготовленного раствора тигель, после
чего тигель удаляют из стакана, а
оставшийся в цилиндре раствор вливают
в стакан.
Для созревания коллоидной суспензии сульфата бария раствор в стакане перемешивают в течение 10 мин на магнитной мешалке. Полученные градуировочные растворы фотометрируют относительно дистиллированной воды, используя зеленый светофильтр с максимумом светопропускания при длине волны 540 нм и кювету с толщиной поглощающего свет слоя 50 мм.
По полученным результатам определений оптической плотности и известной массовой доле оксида бария в фотометрируемых объемах строят градуировочный график или составляют калибровочное уравнение.
При
массовой доле оксида бария менее 1,0%
используют вторую серию стандартных
образцов, выполняя все вышеуказанные
операции, но используя синий светофильтр
с максимумом светопропускания при длине
волны 490 нм.
17.3.3. Проведение анализа
В два платиновых тигля помещают: в один — 0,10 г анализируемой пробы; в другой — 0,10 г близкого по массовой доле к анализируемой пробе стандартного образца. Далее в оба тигля добавляют по 0,1 г серно-кислого калия и 1 г смеси для сплавления. Все дальнейшие операции по п. 17.3.2.2.
17.3.4. Обработка результатов
Перед вычислением массовой доли оксида бария вводят поправку на изменение условий фотометрирования в соответствии с п. 1.18.
Массовую долю оксида бария в процентах определяют непосредственно по графику или находят по калибровочному уравнению.
Контрольная работа №3
8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. |
8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. |
8 класс Контрольная работа по химии №3 Вариант 1 1. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. |
8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. |
8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. | 8 класс Контрольная работа по химии №3 Вариант 1 1. Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Медь→Хлорид меди(II) →Гидроксид меди(II) →Оксид меди(II) →Сульфат меди(II) → Медь. 3. В трех склянках без этикеток находятся растворы карбоната натрия, нитрата натрия и сульфата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите объем водорода (н.у.), образующегося при взаимодействии 48 г магния с избытком серной кислоты. |
8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. |
8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. |
8 класс Контрольная работа по химии №3 Вариант 2 1. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. |
8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. |
8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. | 8 класс Контрольная работа по химии №3 Вариант 2 1. 2. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ: Водород→Соляная кислота→Хлорид железа(II) →Хлорид магния→Соляная кислота→Хлорид натрия. 3. В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. 4. Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды. |
Формула оксида бария – структура, свойства, применение, примеры вопросов
Оксид бария – замечательное (синтетическое) химическое соединение, подходящее для применения в оптике и керамике. Он втягивает атомы воды из общего климата при комнатной температуре. Это широко используется для покрытия горячих катодов в электронно-лучевых трубках, создания оптического коронного стекла и многого другого. Он также используется в качестве специального осушителя газа и растворителей. Это соединение проявляется от белого тона до желтого тона. При взаимодействии с водой образуется гидроксид бария. Он не проводит электричество, как другие оксидные соединения. Он имеет плотность 5,72 г/мл и является негорючим соединением.
Это широко используется для покрытия горячих катодов в электронно-лучевых трубках, создания оптического коронного стекла и многого другого. Он также используется в качестве специального осушителя газа и растворителей. Это соединение проявляется от белого тона до желтого тона. При взаимодействии с водой образуется гидроксид бария. Он не проводит электричество, как другие оксидные соединения. Он имеет плотность 5,72 г/мл и является негорючим соединением.
Барий
Барий — щелочной металл, химический элемент Ba и ядерный номер 56. Это пятый элемент в периодической таблице 2. Из-за высокой реакционной способности барий никогда не встречается в природе в свободном виде. Наиболее широко известными минералами бария являются барит и витерит.
- Символы: Ba
- Атомная масса: 137,327 u
- Атомный номер: 56
- Радиус Ван-дер-Ваальса: 268 мкм
- Температура плавления: 727°C
- Плотность: 3,5 г.чм -3 при 20 ° C
- Стандартный потенциал: -2,90 В
- Состояние окисления: 2 +
Oxygen. газам и чрезвычайно восприимчив. Все компоненты на Земле реагируют с кислородом, образуя кислородсодержащие соединения. Соединения кислорода, парные смеси кислорода с меньшими электроотрицательными компонентами, называются оксидами. Примеры оксидов включают Na 2 O, CaO, Al 2 O 3 , CO 2 , N 2 O 3 , Cl 2 O и XeO 2 . Оксид — это категория химического соединения, в состав которого входит один или несколько атомов кислорода, а также другой элемент, такой как Li 2 O, CO 2 , H 2 O и т. д.
газам и чрезвычайно восприимчив. Все компоненты на Земле реагируют с кислородом, образуя кислородсодержащие соединения. Соединения кислорода, парные смеси кислорода с меньшими электроотрицательными компонентами, называются оксидами. Примеры оксидов включают Na 2 O, CaO, Al 2 O 3 , CO 2 , N 2 O 3 , Cl 2 O и XeO 2 . Оксид — это категория химического соединения, в состав которого входит один или несколько атомов кислорода, а также другой элемент, такой как Li 2 O, CO 2 , H 2 O и т. д.
Формула оксида бария
Химическая формула оксида бария: BaO. Его молярная масса 153,33 г/моль, а плотность 5,72 г/см 9 .0020 3 . Это кубическая структура. BaO образуется при окислении солей бария и карбоната бария. Барий потребляет кислород для создания оксида бария. (Один ион бария нейтрализует один ион кислорода, эти два иона объединяются с образованием оксида бария, BaO. ) Оксид бария
) Оксид бария
- Когда соль бария окисляется с получением оксида бария, оксид бария, судя по всему, представляет собой белое нерастворимое тонкодисперсное вещество.
- При 20°С оксид бария распадается на 3,48 г/100 мл, а при 100°С распадается на 90,8 г/100 мл.
- В этаноле, разбавленных минеральных кислотах и щелочах оксид бария растворим.
- Температура плавления оксида бария составляет 1923 градуса по Цельсию, 3493° по Фаренгейту или 2196° по Кельвину.
- Оксид бария кипит при 2000 градусов по Цельсию, 3630 градусов по Фаренгейту или 2270 градусов по Кельвину.
- Оксид бария имеет толщину 5,72 грамма на кубический сантиметр.
Химические свойства оксида бария
- Всякий раз, когда соль бария окисляется, образуется оксид бария, иначе называемый барием. Это негорючее, гигроскопичное вещество белого цвета.
- Поскольку соли бария окисляются, субатомное уравнение для оксида бария — BaO.
 Сопутствующее условие дает уравнение для оксида бария:
Сопутствующее условие дает уравнение для оксида бария:
2Ba + O 2 → 2BaO
Производство оксида бария
При нагревании карбоната бария образуется оксид бария или монооксид бария (BaCO 3 ). Для его получения можно использовать нагревание вещества нитрата бария (Ba(NO 3 ) 2 ). Кроме того, при разложении различных солей бария часто образуется оксид бария.
2BA + O 2 → 2BAO
Baco 3 → BAO + CO 2
Использование бария Оксид
- Используется в производстве оптического кронового стекла.
- Оксид бария используется в процессе разделения изомеров.

- Действует как окислитель.
- Оксид бария является поставщиком кислорода из-за колебаний температуры.
- Используется для покрытия трубок с горячим катодом.
- Используется в производстве топлива.
- Используется в реакциях с этиленоксидом и спиртами в качестве катализатора этоксилирования, которое происходит при температуре от 150°C до 200°C.
- Соляная кислота и гидроксид натрия
- Бромистоводородная кислота и гидроксид калия
- Hydrochloric acid and Ammonia
- Hydrochloric acid and potassium hydroxide
- Hydrochloric acid and magnesium hydroxide
- Hydrochloric acid and Ferric oxide
- Nitric acid and Barium hydroxide
- Phosphoric acid and Calcium гидроксид
- Серная кислота и гидроксид стронция
- Соляная кислота и гидроксид стронция
. Использование бария
.0009 Используется в качестве абсорбента во многих химических реакциях.
Примеры вопросов
Вопрос 1: Каковы вопросы безопасности при использовании оксида бария?
Ответ :
В случае попадания на кожу или в глаза или при вдыхании вызывает мучения и покраснение. это более опасно при попадании внутрь. Это может вызвать тошноту и послабление кишечника, потерю подвижности мышц, сердечно-сосудистую аритмию и может привести к смерти. При проглатывании следует немедленно обратиться за медицинской помощью.
Вопрос 2: По какой причине мы обрабатываем вольфрамовые катоды оксидом бария в натриевых лампах?
Ответ:
Работоспособность вольфрама снижается, когда оксид бария хранится на проволочной нити.
Иными словами, вольфрам тем эффективнее разряжает электроны и тем более эффективно работает.
Вопрос 3: Как приготовить BaO?
Ответ:
Мы можем получить оксид бария двумя способами:
Во-первых, барий реагирует с кислородом с образованием оксида бария:2Ba + O 2 → 2BaO
Далее оксид бария путем нагревания карбоната бария:
BaCO 3 → BaO + CO 2
Вопрос 4: Как при получении оксида бария термическим разложением карбоната бария добавляется углерод в реакционную смесь?
Ответ:
Карбонат бария из-за очень высокой энергии решетки разлагается примерно при 1400°C.
BaCO 3 → BaO + CO 2 .
При такой высокой температуре реакция становится обратимой. Добавленный углерод соединяется с CO 2 , образуя CO, и, таким образом, реакция становится необратимой,
CO 2 + C → 2CO.
Вопрос 5: Каково использование BaO?
Ответ :
Оксид бария используется в процессе разделения изомеров. Он используется в качестве абсорбента во многих химических реакциях.
Используется в производстве оптического кронового стекла. Используется в реакции этиленоксида и спиртов в качестве катализатора этоксилирования, которое происходит где-то в диапазоне 150˚C и 200˚C.
Вопрос 6: Что такое глотательный тест с барием?
Ответ:
Барий используется во время глотательного теста, чтобы сделать определенные области тела более четкими на рентгеновском снимке. Рентгенолог на самом деле захочет увидеть размер и состояние глотки и горла. Человек также сможет воспринимать то, как вы глотаете. Эти тонкости, наверное, не будут видны на стандартном X-beam. Барий используется для визуализирующих тестов желудочно-кишечного тракта.
Вопрос 7: Что такое клизма с барием?
Ответ:
Бариевая клизма — это рентгенологическое исследование, позволяющее выявить изменения или аномалии в пищеварительном органе (толстой кишке). Система дополнительно называется рентгеном толстой кишки.
Очищение — это введение жидкости в прямую кишку через небольшую трубку. В этой ситуации жидкость содержит металлическое вещество (барий), покрывающее оболочку толстой кишки. Обычно рентгеновский луч создает неблагоприятную картину нежных тканей, однако бариевое покрытие дает в целом четкие очертания толстой кишки.
| » » » | |||||||||||||||||||||||||||||||||
Тенар заметил, что оксид бария поглощает кислород, вероятно, в количестве, равном тому, который уже присутствует, и образует пероксид бария, Ba O 2 . Недавняя работа по каталитическому ускорению реакции с помощью различных оксидов, например меди, цинка, кадмия, магния, кальция, кремния, сурьмы, висмута, урана, вольфрама и оксидов молибдена, предположила возможное возрождение процесса Брина. при более благоприятных температурных условиях. Некоторые из упомянутых оксидов образуют с барием устойчивые соли и поэтому не годятся для коммерческих целей, так как они, без сомнения, вскоре выведут оксид бария из строя. Пероксид бария представляет собой белый порошок, устойчивый в обычных условиях, если он безводный, и защищенный от двуокиси углерода. Он плавится при ярко-красном тепле с выделением кислорода. При нагревании с водородом, водой, серой, углеродом, окисью углерода, двуокисью серы или аммиаком он восстанавливается. При нагревании с хлором или йодом кислород заменяется галогеном. С концентрированной серной кислотой при обычных температурах выделяется озонированный кислород. С разбавленной соляной кислотой образуется перекись водорода, а с концентрированной — кислород. Давления диссоциации пероксида бария при различных температурах были впервые исследованы Ле Шателье. Трудность определения значительно усугубляется тем фактом, что образуется твердый раствор оксида и пероксида бария, так что на давление при любой температуре будет влиять соотношение этих двух присутствующих и, кроме того, необходимость наличие водяного пара. Однако диссоциация была тщательно изучена Хильдебрандом. Как уже говорилось, в качестве катализатора необходимо небольшое количество воды. Следовательно, после того, как часть пероксида разложится, будет присутствовать гидроксид бария. Начиная с пероксида, система сначала двухвариантна. Есть три компонента: вода, оксид бария и кислород; и три фазы: гидроксид бария, ненасыщенный твердый раствор оксида бария в пероксиде бария и газообразная фаза, состоящая из кислорода и водяного пара. Следовательно, есть две степени свободы. При любой температуре давление кислорода будет меняться в зависимости от концентрации твердого раствора, которая будет зависеть от доли разложившегося пероксида бария. Когда примерно одна треть перекиси разлагается, перекись бария насыщается окисью бария, и система становится моновариантной за счет появления второго твердого раствора двух, образуя четвертую фазу. Состав двух насыщенных твердых растворов может незначительно меняться при изменении температуры, но при постоянной температуре останется постоянным, хотя количество второго раствора будет увеличиваться за счет первого по мере уменьшения доли пероксида бария. Были изучены условия, необходимые для производства 100-процентной пероксида бария из оксида бария. Кислород определенного содержания влаги, меньшего давления паров гидроксида бария при рассматриваемой температуре, пропускали под давлением чуть более одной атмосферы над нагретым до определенной температуры в электрической печи оксидом бария. На последовательные равные образцы воздействовали в течение равного времени и анализировали продукт. Аналогичные эксперименты проводились с воздухом. Были получены следующие результаты: —
With sufficient water present to give the vapour pressure of barium hydroxide, and sufficient barium oxide to produce the моновариантной системы были получены следующие значения давления и сопоставлены со значениями, рассчитанными по уравнению log 10 p = -6850/T + 1,75 log 10 T + 3,807, где T — абсолютная температура, а p выражено в мм. Все они ниже значений Ле Шателье. Теплота соединения оксида бария и кислорода, рассчитанная по этим результатам, составляет 18,71 кал. на грамм-молекулу пероксида. Расхождение со значением Бертело, равным 12,1 кал, кажется слишком большим, чтобы его можно было объяснить образованием твердых растворов. Безводный пероксид бария соединяется с водой с выделением 9.1 кал. теплоты на грамм-молекулу. Октагидрат, BA O 2 .8 H 2 O , в жемчужных пластинах, образуется, но формула BA 5. O 58.9028.9028. . O и 7 H 2 O также присвоены ему. Когда пероксид бария получают путем осаждения раствора гидроксида бария перекисью водорода, октагидрат всегда образуется при обычных температурах, если на одну молекулу гидроксида приходится менее одной молекулы перекиси водорода, и при температуре выше 60°С независимо от состава решение. Жобер запатентовал способ получения гидратированного пероксида бария выщелачиванием сульфида бария кипящей водой, охлаждением до 25—30°С и добавлением пероксида натрия в холодную воду. Пероксид бария отделяется в виде чешуек, которые можно отфильтровать, промыть и отжать. Октагидрат выцветает на воздухе, также образуется карбонат. Бертло упоминает моногидрат, теплота гидратации 1,4 кал., но, вероятно, это пероксигидрат. Пероксид бария может быть определен йодометрически путем добавления йодида калия к раствору соединения в соляной кислоте и титрования выделившегося йода тиосульфатом, или путем титрования перманганатом раствора соляной кислоты, к которому впоследствии добавлено значительное количество раствора сульфата марганца . Раствор серной кислоты использовать нельзя, так как выпавший в осадок сульфат несет с собой большое количество перекиси, которая не вступает в реакцию. Пероксид бария может использоваться для отбеливания, но его основное применение заключается в производстве пероксида водорода путем разложения кислотой. | |||||||||||||||||||||||||||||||||
Подробные пояснения – Lambda Geeks
В этой статье мы рассмотрим примеры кислотно-основных реакций с их подробным объяснением.
Кислоты — это химические вещества, которые отдают протон H+, а основания — это химические соединения, которые принимают протон.
Когда основание и кислота вступают в химическую реакцию, образуется соль и вода как продукт их реакции.
Читайте также: 5+ примеров металлической связи: объяснение и подробные факты
Пример кислотно-основной реакции Соляная кислота и гидроксид натрияСоляная кислота является сильной кислотой. Он полностью диссоциирует в водном растворе с образованием H+ и Cl-. Гидроксид натрия является сильным основанием, диссоциирует на Na+ и OH-. В ходе реакции Na+ соединяется с Cl- с образованием соли хлорида натрия NaCl, а H+ соединяется с OH- с образованием воды.
Бромистоводородная кислота и гидроксид калия Бромистоводородная кислота является сильной кислотой. Он полностью диссоциирует в водном растворе с образованием H+ и Br-. Гидроксид калия является сильным основанием, диссоциирует на К+ и ОН-. В ходе реакции K+ соединяется с Br- с образованием соли KBr, бромида калия, а H+ соединяется с OH- с образованием воды.
Соляная кислота полностью диссоциирует в водном растворе с образованием H+ и Cl-. Это сильная кислота. Аммиак не является сильным основанием. Эта реакция не соответствует кислотно-щелочным критериям из-за того, что происходит только образование соли, а не воды. Соляная кислота и аммиак реагируют с образованием хлорида аммония.
Соляная кислота и гидроксид калияСоляная кислота является сильной кислотой, которая полностью диссоциирует в водном растворе с образованием H+ и Cl-. Гидроксид калия является сильным основанием, диссоциирует на К+ и ОН-. В ходе реакции K+ соединяется с Cl- с образованием соли хлорида калия KCl, а H+ соединяется с OH- с образованием воды.
Соляная кислота и гидроксид магния Будучи сильной кислотой, соляная кислота диссоциирует с образованием H+ и Cl-. Гидроксид магния действует как основание. Он диссоциирует с образованием Mg +2 ион магния и ион гидроксида OH-. В ходе реакции вместе с водой образуется хлорид магния.
В ходе реакции вместе с водой образуется хлорид магния.
Соляная кислота полностью диссоциирует в водном растворе с образованием H+ и Cl-. Это сильная кислота. Оксид железа диссоциирует на Fe +3 и гидроксид-ион OH-. Хлорное железо – продукт реакции оксида железа и соляной кислоты.
Азотная кислота и гидроксид барияАзотная кислота в водном растворе диссоциирует на ионы H+ и NO3-. Гидроксид бария диссоциирует Ba +2 и OH-. При реакции азотной кислоты и гидроксида бария в качестве продукта образуется нитрат бария.
Фосфорная кислота и гидроксид кальция Фосфорная кислота является сильной кислотой. В водном растворе диссоциирует с образованием ионов гидроксония H+, PO 4 –. Гидроксид кальция действует как основание, в водном растворе диссоциирует с образованием Са+ и ОН-. В результате реакции образуются соль фосфата кальция и вода.
Серная кислота полностью диссоциирует в водном растворе с образованием H 2+ и SO 4 2 -. Это сильная кислота. Гидроксид стронция является основанием. Соль, сульфат стронция, образуется с водой как продукт реакции между серной кислотой и гидроксидом стронция.
Соляная кислота и гидроксид стронцияБудучи сильной кислотой, соляная кислота диссоциирует с образованием H+ и Cl-. Гидроксид стронция диссоциирует с образованием Sr+ и OH-. H+ и OH- связаны с образованием воды, а ион стронция и хлорид-ион связаны с образованием хлорида стронция.
Читайте также: Является ли HBr ионным или ковалентным: почему? Как, характеристики и подробные факты
Часто задаваемые вопросы: Вопрос: Что такое сильная кислота?Ответ : Сильная кислота определяется как,
Химические вещества полностью диссоциируют в водный раствор и производят ион гидроксония или протон H+.




 Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.
Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.

 Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота.
Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота.

 Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.
Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.

 Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота.
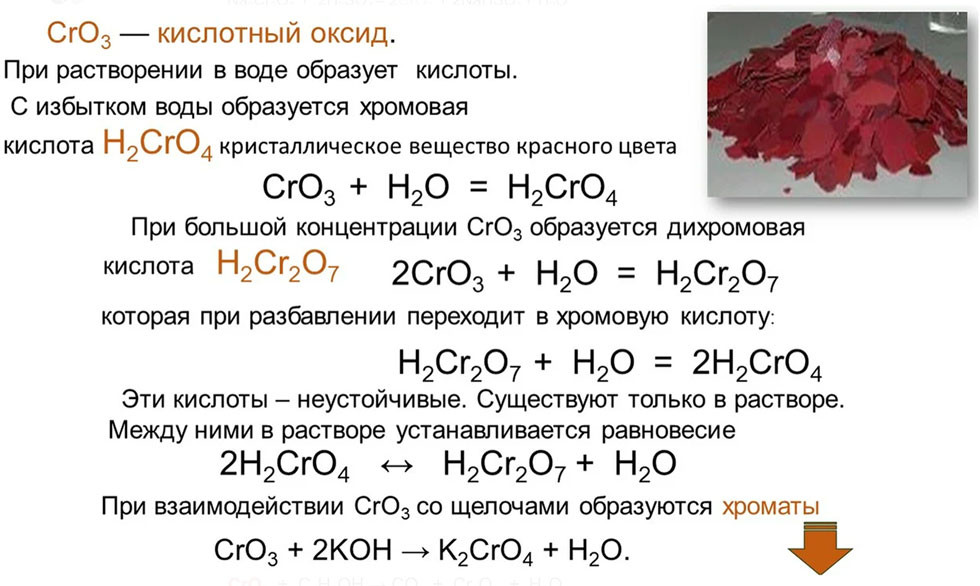
Напишите уравнения всех возможных реакций между следующими веществами: оксид бария, оксид серы (IV), гидроксид натрия, азотная кислота.

 Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.
Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.
 Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды.
Вычислите массу гидроксида калия, образовавшегося при взаимодействии 3,9 г оксида калия с избытком воды.
 Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота.
Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота.

 В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.
В трех склянках без этикеток находятся растворы серной кислоты, сульфата натрия, нитрата натрия. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций. Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.
Как химическим путем распознать, какое вещество находится в каждой из склянок? Напишите уравнения реакций.

 Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота.
Напишите уравнения всех возможных реакций между следующими веществами: нитрат бария, гидроксид натрия, сульфат меди(II), соляная кислота. Сопутствующее условие дает уравнение для оксида бария:
Сопутствующее условие дает уравнение для оксида бария:
 Иными словами, вольфрам тем эффективнее разряжает электроны и тем более эффективно работает.
Иными словами, вольфрам тем эффективнее разряжает электроны и тем более эффективно работает.

 Скорость реакции практически равна нулю при обычных температурах, но достигает заметной скорости выше 400° С. В то же время, однако, поскольку соединение с кислородом сопровождается выделением 12,1 кал. на грамм-молекулу увеличивается склонность снова диссоциировать на окись бария и кислород, поэтому для полного превращения в перекись необходимо повышенное давление кислорода. Так, нагревая оксид попеременно при более низкой, а затем при более высокой температуре на воздухе, оказалось возможным использовать его как средство выделения кислорода из воздуха. Было замечено, что реагенты не должны быть абсолютно безводными, но в то же время количество присутствующей воды должно быть небольшим. Процесс был модифицирован Брином, который поддерживал постоянную температуру и попеременно повышал и понижал давление. Воздух должен был быть предварительно очищен от углекислого газа и органических веществ, а также необходима пористая окись. Процесс Брина для получения кислорода в настоящее время заменен методами фракционирования воздуха.
Скорость реакции практически равна нулю при обычных температурах, но достигает заметной скорости выше 400° С. В то же время, однако, поскольку соединение с кислородом сопровождается выделением 12,1 кал. на грамм-молекулу увеличивается склонность снова диссоциировать на окись бария и кислород, поэтому для полного превращения в перекись необходимо повышенное давление кислорода. Так, нагревая оксид попеременно при более низкой, а затем при более высокой температуре на воздухе, оказалось возможным использовать его как средство выделения кислорода из воздуха. Было замечено, что реагенты не должны быть абсолютно безводными, но в то же время количество присутствующей воды должно быть небольшим. Процесс был модифицирован Брином, который поддерживал постоянную температуру и попеременно повышал и понижал давление. Воздух должен был быть предварительно очищен от углекислого газа и органических веществ, а также необходима пористая окись. Процесс Брина для получения кислорода в настоящее время заменен методами фракционирования воздуха.
 Феррицианид калия восстанавливается пероксидом бария с образованием двойного ферроцианида калия-бария и свободного кислорода, и эту реакцию можно использовать как средство оценки пероксида бария. С формальдегидом получают формиат бария и водород. При нагревании до красноты с осажденным металлическим золотом получают ярко-зеленую массу, которая при обработке водой дает раствор аурата бария Ba ( Au O 2 ) 2 .
Феррицианид калия восстанавливается пероксидом бария с образованием двойного ферроцианида калия-бария и свободного кислорода, и эту реакцию можно использовать как средство оценки пероксида бария. С формальдегидом получают формиат бария и водород. При нагревании до красноты с осажденным металлическим золотом получают ярко-зеленую массу, которая при обработке водой дает раствор аурата бария Ba ( Au O 2 ) 2 . Опыты по давлению паров гидроксида бария не указывают на образование твердого раствора с оксидом, и то же самое, вероятно, верно для пероксида и гидроксида.
Опыты по давлению паров гидроксида бария не указывают на образование твердого раствора с оксидом, и то же самое, вероятно, верно для пероксида и гидроксида. Точка, в которой система становится моновариантной, зависит от количества присутствующей воды и, следовательно, от количества образующегося гидроксида бария. Система снова становится дивариантной, когда около 98% перекиси разложилось.
Точка, в которой система становится моновариантной, зависит от количества присутствующей воды и, следовательно, от количества образующегося гидроксида бария. Система снова становится дивариантной, когда около 98% перекиси разложилось.

