Угольная кислота и её соли — урок. Химия, 8–9 класс.
Угольная кислота
Угольная кислота h3CO3 — раствор углекислого газа в воде. Это слабая двухосновная кислота. Она образуется при растворении в воде оксида углерода(\(IV\)) и в свободном виде из раствора не выделяется. При попытке выделения кислота легко разлагается на углекислый газ и воду:
h3CO3⇄CO2↑+h3O.
Угольная кислота диссоциирует ступенчато. На первой ступени образуется гидрокарбонат-ион и ион водорода:
h3CO3⇄HCO3−+H+.
Гидрокарбонат-ион частично распадается на карбонат-ион и ещё один ион водорода:
HCO3−⇄CO32−+H+.
Диссоциация протекает слабо, ионов водорода в растворе содержится немного. Поэтому раствор углекислого газа (угольная кислота) имеет слегка кисловатый вкус и меняет окраску лакмуса на розовую (не красную).
Соли угольной кислоты
Как двухосновная угольная кислота образует два ряда солей: средние — карбонаты (K2CO3, CaCO3) и кислые — гидрокарбонаты (NaHCO3, Ca(HCO3)2).
Из карбонатов растворяются в воде соли натрия, калия и аммония. Гидрокарбонаты растворяются лучше.
Обрати внимание!
Все соли угольной кислоты реагируют с более сильными кислотами.
В результате выделяется углекислый газ, что позволяет использовать эту реакцию как качественную на карбонаты и гидрокарбонаты:
CaCO3+2HCl=CaCl2+h3O+CO2↑,
NaHCO3+HNO3=NaNO3+h3O+CO2↑.
Реакция карбоната с кислотой
Обрати внимание!
Карбонаты и гидрокарбонаты взаимопревращаемы.
Карбонаты превращаются в гидрокарбонаты при пропускании через их раствор или взвесь углекислого газа:
CaCO3+h3O+CO2=Ca(HCO3)2.
Обратное превращение происходит при нагревании:
Ca(HCO3)2=tCaCO3↓+h3O+CO2↑.
С присутствием в воде гидрокарбонатов кальция и магния связана временная жёсткость воды. Временная — потому что при нагревании растворимые кислые соли разлагаются, и ионы металлов связываются в нерастворимые карбонаты.
Применение солей угольной кислоты
Na2CO3 — карбонат натрия, или сода. Применяется в производстве стекла, мыла, бумаги.
NaHCO3 — гидрокарбонат натрия, или питьевая сода. Используется в быту и пищевой промышленности как разрыхлитель теста. Находит применение в медицине.
K2CO3 — карбонат калия, или поташ. Применяется в производстве жидкого мыла, стекла, в качестве удобрения.
CaCO3 — карбонат кальция. В природе встречается в виде мела, мрамора, известняка. Применяются как строительные и отделочные материалы, а также в производстве негашёной извести, цемента, стекла.
Приемная комиссия БГМУ
ПРОГРАММЫ ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ДЛЯ ПОСТУПАЮЩИХ В БГМУ
ПРОГРАММА ПО ХИМИИ
Общие указания
На экзамене по химии поступающий в ВУЗ должен:
— показать знание основных теоретических положений химии как одной из важнейших естественных наук, лежащих в основе научного понимания природы;
— уметь применять теоретические положения химии при рассмотрении классов неорганических и органических веществ и их соединений;
— уметь раскрывать зависимость свойств веществ от их состава и строения;
— знать свойства важнейших веществ, применяемых в народном хозяйстве и в быту;
— понимать научные принципы важнейших химических производств (не углубляясь в детали устройства различной аппаратуры)
— решать типовые и комбинированные задачи по основным разделам химии.
На экзамене можно пользоваться следующими таблицами:
— «Растворимость оснований, кислот и солей в воде»,
— «Электрохимический ряд стандартных электродных потенциалов».
При решении задач разрешается пользоваться калькулятором.
Теоретические основы химии.
Предмет и задачи химии. Место химии среди естественных наук.
1. Основные понятия химии.
Основы атомно-молекулярного учения. Понятие атома, элемента, вещества. Простое вещество, сложное вещество. Понятие об аллотропных модификациях. Относительная атомная и относительная молекулярная масса. Стехиометрия: закон сохранения массы вещества, постоянство состава. Моль. Молярная масса. Закон Авогадро и его следствие. Уравнение Менделеева-Клапейрона. Явления физические и химические. Валентность и степень окисления.
2. Периодический закон и периодическая система элементов Д.И. Менделеева. Строение атома. Химическая связь. Строение вещества.
Строение ядер и электронных оболочек атомов химических элементов (s-, p-, d-элементов). Периодический закон химических элементов Д.И. Менделеева и строение периодической системы. Изотопы. Характеристика отдельных химических элементов главных подгрупп на основании положения в периодической системе и строения атома. Значение периодического закона для понимания научной картины мира, развития науки и техники.
Виды химической связи: Ковалентная (полярная и неполярная), ионная, металлическая, водородная. Механизм образования и примеры соединений. Модель гибридизации орбиталей. Агрегатные состояния веществ, вещества аморфные и кристаллические. Типы кристаллических решеток.
3. Основные закономерности протекания химических реакций.
Классификация химических реакций: реакции соединения, разложения, замещения, ионного обмена. Окислительно–восстановительные реакции, важнейшие окислители и восстановители. Электролиз. Тепловые эффекты химических реакций. Термохимические уравнения. Закон Гесса и следствия из него. Скорость химических реакций. Зависимости скорости от природы реагирующих веществ, концентрации, температуры. Катализ. Обратимость химических реакций. Химическое равновесие и условия его смещения.
Окислительно–восстановительные реакции, важнейшие окислители и восстановители. Электролиз. Тепловые эффекты химических реакций. Термохимические уравнения. Закон Гесса и следствия из него. Скорость химических реакций. Зависимости скорости от природы реагирующих веществ, концентрации, температуры. Катализ. Обратимость химических реакций. Химическое равновесие и условия его смещения.
4. Растворы. Электролитическая диссоциация.
Растворы. Растворимость веществ. Зависимость растворимости веществ от их природы, температуры, давления. Типы растворов. Выражение состава раствора (массовая доля, объемная доля, молярная концентрация). Значение растворов в промышленности, медицине, быту. Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты. Ионные уравнения реакций.
Неорганическая химия.
1. Основные классы неорганических соединений.
Оксиды, кислоты, гидроксиды, соли: классификация, номенклатура, способы получения и свойства. Амфотерность. Гидролиз солей.
2. Неметаллы.
Водород, его химические и физические свойства.
Вода. Физические, химические свойства. Кристаллогидраты. Значение воды в промышленности, сельском хозяйстве, быту, природе. Охрана водоемов от загрязнения.
Общая характеристика элементов YII группы главной подгруппы. Хлор. Физические, химические свойства. Свойства и способы получения галогеноводородов, галогенидов, кислородсодержащих соединений хлора.
Общая характеристика элементов главной подгруппы YI группы. Кислород, его получение, сравнение физических и химических свойств кислорода и озона. Окислительно–восстановительные реакции с участием пероксида водорода. Сера, ее физические и химические свойства. Соединения серы: сероводород, оксиды серы (IY, YI). Серная и сернистая кислоты, их свойства, соли серной и сернистой кислот. Производство серной кислоты.
Общая характеристика элементов Y группы главной подгруппы. Азот. Физические и химические свойства. Свойства аммиака и солей аммония, оксидов азота (I, II, IY), азотистой кислоты и нитритов, азотной кислоты и нитратов. Производство аммиака и азотной кислоты. Фосфор, его физические и химические свойства. Свойства соединений фосфора: фосфороводорода, фосфидов, оксида фосфора (Y), фосфорной кислоты и фосфатов.
Общая характеристика элементов IY группы главной подгруппы. Углерод, его аллотропные модификации, физические и химические свойства.. Свойства соединений углерода: оксидов (II, IY), угольной кислоты и ее солей. Свойства кремния, оксида кремния, кремниевой кислоты и силикатов.
3. Металлы.
Положение в периодической системе. Особенности строения атомов металлов. Металлическая связь. Характерные физические и химические свойства. Электрохимический ряд напряжений металлов. Коррозия металлов.
Общая характеристика IА- и IIА- групп периодической системы. Свойства натрия, калия, кальция и магния и их соединений. Жесткость воды и способы ее устранения. Свойства алюминия и его соединений. Свойства железа, оксидов, гидроксидов и солей железа (II и III). Природные соединения железа. Свойства перманганата калия: восстановление перманганат иона в кислой, нейтральной и щелочной средах.
Медико-биологическое значение соединений указанных металлов.
Органическая химия.
1. Теоретические положения органической химии.
Основные положения теории химического строения А.М. Бутлерова. Зависимость свойств веществ от химического строения. Виды изомерии. Электронная природа химических связей в молекулах органических соединений, способы разрыва связей, понятие о свободных радикалах.
2. Основные классы органических соединений.
Углеводороды.
Гомологический ряд предельных углеводородов, их электронное и пространственное строение (sp3-гибридизация).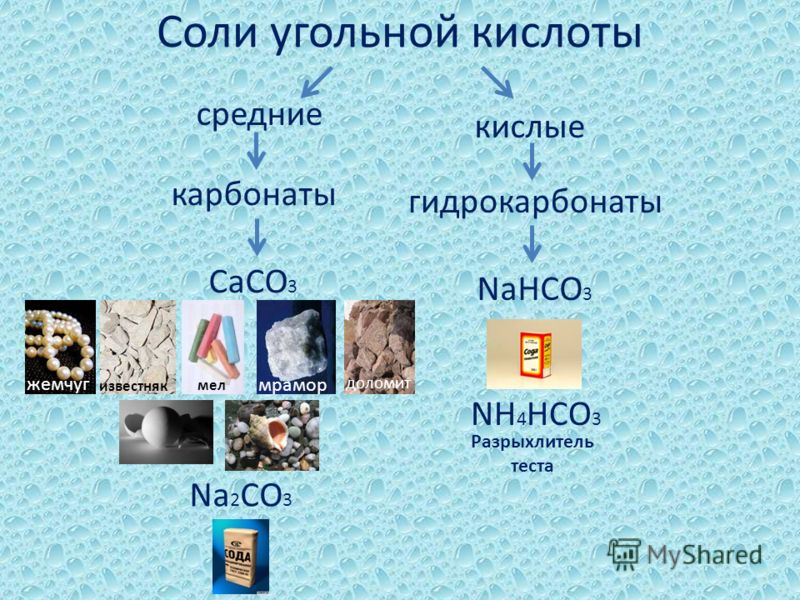 Номенклатура, физические и химические свойства, способы получения предельных углеводородов. Циклоалканы.
Номенклатура, физические и химические свойства, способы получения предельных углеводородов. Циклоалканы.
Гомологический ряд этиленовых углеводородов. Двойная связь: σ– и p – связи, sp2–гибридизация. Изомерия углеродного скелета и положение двойной связи. Номенклатура этиленовых углеводородов. Физические и химические свойства, способы получения. Природный каучук, его строение и свойства.
Гомологический ряд ацетиленовых углеводородов. Тройная связь, sp–гибридизация. Номенклатура, физические и химические свойства, способы получения. Получение ацетилена карбидным способом и из метана.
Ароматические углеводороды (арены). Бензол, электронное и пространственное строение, химические свойства. Гомологи бензола. Понятие о взаимном влиянии атомов на примере толуола.
Природные источники углеводородов: нефть, природный газ и попутные нефтяные газы, уголь. Фракционная перегонка нефти. Крекинг. Ароматизация нефтепродуктов. Охрана окружающей среды при нефтепереработке.
Кислородсодержащие соединения.
Спирты, их строение. Номенклатура, химические свойства, способы получения спиртов. Многоатомные спирты, номенклатура, особые свойства (этиленгликоль, глицерин). Ядовитость спиртов, их губительное действие на организм человека. Фенол, его строение, физические и химические свойства фенола.
Альдегиды, их строение. Номенклатура, физические и химические свойства. Получение и применение муравьиного и уксусного альдегидов. Понятие о кетонах.
Карбоновые кислоты, их строение. Карбоксильная группа, взаимное влияние карбоксильной группы и углеводного радикала. Физические и химические свойства карбоновых кислот. Муравьиная, уксусная, стеариновая, олеиновая, бензойная кислоты. Получение и применение карбоновых кислот. Сложные эфиры. Строение, химические свойства. Реакция этерификации.
Азотсодержащие соединения.
Амины алифатические и ароматические, их строение. Номенклатура, химические свойства, способы получения аминов.
Аминокислоты. Строение, химические свойства, изомерия.
Понятие об азотсодержащих гетероциклических соединениях на примере пиридина и пиррола.
3. Важнейшие природные соединения.
Жиры, строение, химические свойства, их роль в природе.
Углеводы: строение и свойства глюкозы, рибозы, дезоксирибозы, сахарозы, крахмала и целлюлозы. Применение целлюлозы и её производных. Понятие об искусственных волокнах.
Синтез пептидов, их строение. Строение, структура и свойства белков. Успехи в изучении и синтезе белков. Значение микробиологической промышленности. Строение нуклеотидов и полинуклеотидов. Различие в строении РНК и ДНК. Биологическая роль указанных классов соединений.
Типовые расчетные задачи
1. Вычисление массовой или объемной доли компонента.
2. Вычисление молярной концентрации.
3. Вычисление относительных плотностей веществ в газообразном состоянии.
4. Вычисление объема газообразного вещества известной массы или известного количества при нормальных условиях.
5. Установление молекулярной формулы вещества по массовой доле элементов или по массам продуктов сгорания.
6. Вычисление массы (объема, количества вещества) одного из участников реакции по известной массе (объему, количеству вещества) другoгo участника реакции.
7. То же, с предварительным нахождением, какое из веществ вступает в реакцию полностью.
8. То же, с учетом выхода продукции реакции в процентах от теоретически возможного.
9. То же, с учетом массовой доли примесей в реагенте.
10. Определение состава соли (кислая или средняя) по массам веществ, вступающих в реакцию.
11. Определение состава двухкомпонентной смеси по массам веществ, образующихся в ходе одной или нескольких реакций.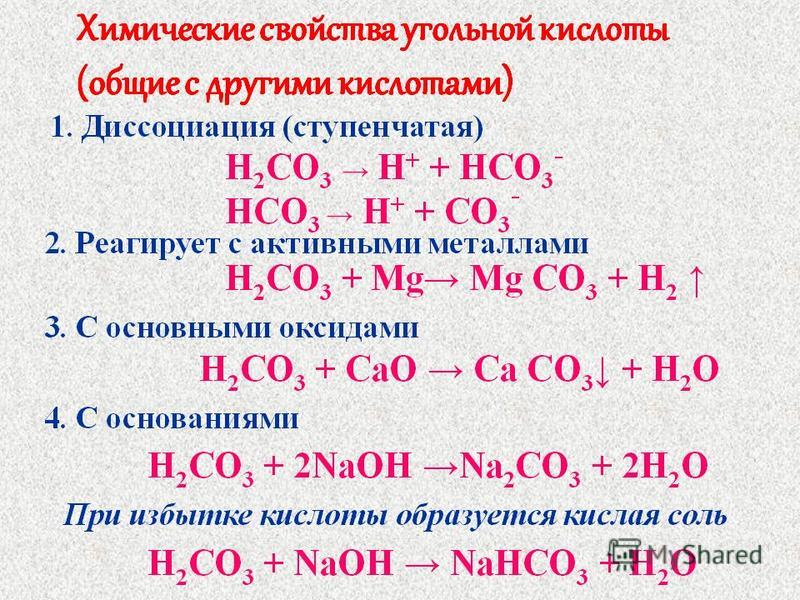
Все расчетные задачи могут быть как в прямом, так и в обратном вариантах (например, расчет массовой доли вещества по его массе и известной массе раствора или же расчет массы вещества по известной массовой доле и массе раствора). Сложные задачи включают в себя две или больше перечисленных типовых задач.
Рекомендуемая литература:
1. Рудзитис Г.Е., Фельдман Ф.Г. Химия для 8–11 классов. М.: «Просвещение», 2011.
- Гузей Л.С. и др. Химия для 8-11 классов. М., «Дрофа», 2004.
- В.В. Еремин, Н.Е. Кузьменко, А.А. Дроздов, В.В. Лунин. Химия для 8-11 классов. М.: Дрофа, 2008
- Габриелян О.С. Химия для 8-11 классов. М., «Дрофа», 2005.
- Гольдфарб Я.Л., Ходаков Ю.Б., Додонов Ю.Б. Сборник задач и упражнений по химии. — М.: «Дрофа», 2005.
- Е.А. Еремина, О.Н. Рыжова Справочник школьника по химии. Еремина М.: Издательство «Экзамен», 2006.
Дополнительная литература:
1. Хомченко Г.П. Химия для поступающих в ВУЗы. М.: «Высшая школа», 2003.
2. Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в ВУЗы. М., «Высшая школа», 2005.
3. Кузьменко Н.Е., Магдесиева Н.Н., Еремин В.В. Задачи по химии для абитуриентов. Курс повышенной сложности. – М: «Высшая школа», 2004.
4. Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия для школьников старших классов и поступающих в ВУЗы. М., «Дрофа», 2008.
5. Егоров А.С., Дионисьев В.Д., Ермакова В.К. и др. Химия. Пособие – репетитор. Ростов-на-Дону, «Феникс», 2006.
Программа вступительных испытаний по биологии
1. Биология как наука.
Биология — наука о живой природе. Вклад биологии в формирование современной научной картины мира и общей культуры личности. Значение биологической науки для сельского хозяйства, промышленности, медицины, охраны природы. Методы биологии. Уровни организации живого: молекулярный, клеточный, организменный, популяционно-видовой, экосистемный, биосферный. Свойства живых систем: особенности химического состава, обмен веществ и энергии, открытость, рост, самовоспроизведение, наследственность и изменчивость, раздражимость, саморегуляция; их проявление уживотных, растений, грибов и бактерий.
Методы биологии. Уровни организации живого: молекулярный, клеточный, организменный, популяционно-видовой, экосистемный, биосферный. Свойства живых систем: особенности химического состава, обмен веществ и энергии, открытость, рост, самовоспроизведение, наследственность и изменчивость, раздражимость, саморегуляция; их проявление уживотных, растений, грибов и бактерий.
2. Строение и функционирование клетки.
Основные положения клеточной теории, ее значение в современной науке. Клетка — структурная и функциональная единица живого. Клеточное строение организмов как отражение единства живой природы.
Химический состав клеток. Содержание химических элементов в клетке. Вода, минеральные соли и другие неорганические вещества, их роль в жизнедеятельности. Особенности структуры и функции органических веществ: белков, углеводов, липидов, нуклеиновых кислот в связи с их функциями. Строение и функции органоидов клетки; взаимосвязь этих компонентов как основа ее целостности.
Многообразие клеток. Прокариотные и эукариотные клетки. Особенности строения клеток растений, животных и грибов. Вирусы — неклеточные формы. Роль вирусов как возбудителей заболеваний, их профилактика.
Клеточный метаболизм и его составляющие — ассимиляция (анаболизм) и диссимиляция (катаболизм). Пластический и энергетический обмен. Ферменты, их свойства и роль в метаболизме. Основные этапы пластического обмена. Репликация ДНК. Гены. Генетический код и его свойства. Транскрипция. Трансляция. Роль матричных процессов в реализации наследственной информации. Автотрофные и гетеротрофные организмы. Этапы фотосинтеза и роль хлорофилла в этом процессе. Биосферное значение фотосинтеза. Хемосинтез. Основные этапы энергетического обмена. Брожение и клеточное дыхание, метаболическая роль кислорода. Роль АТФ в энергетическом и пластическом обмене. Взаимосвязь энергетического и пластического обмена.
3. Размножение и индивидуальное развитие организмов.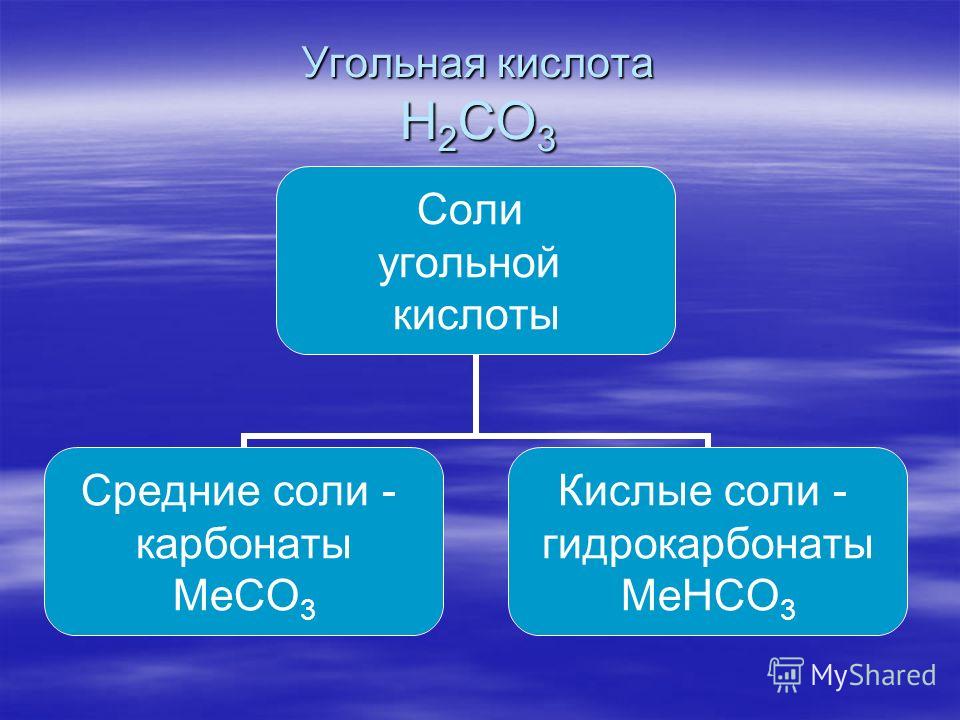
Деление клетки — основа роста, развития и размножения организмов. Митоз и мейоз — основные способы деления эукариотной клетки. Интерфаза. Этапы митоза и мейоза. Значение митоза и мейоза. Половое и бесполое размножение, их роль в природе. Способы бесполого размножения у животных, растений и грибов. Развитие половых клеток. Оплодотворение у животных и растений. Двойное оплодотворение — особенность цветковых растений. Чередование полового и бесполого поколений (гаметофита и спорофита) у растений.
Онтогенез – индивидуальное развитие организма, основные этапы онтогенеза. Эмбриональное и постэмбриональное развитие. Основные этапы развития зародыша (на примере животных). Прямое развитие и развитие с метаморфозом (непрямое). Понятие жизненного цикла.
4. Основы генетики и селекции.
Генетика — наука о наследственности и изменчивости организмов. Основные методы генетики. Гибридологический анализ, моно-, ди- и полигибридное скрещивание. Основные понятия генетики: ген, аллель, признак, гомозигота и гетерозигота, доминантность и рецессивность, генотип, фенотип и норма реакции. Законы наследственности, установленные Г. Менделем, и условия их выполнения. Цитологические основы выполнения законов Г.Менделя. Полное и неполное доминирование.
Хромосомная теория наследственности. Сцепленное наследование и его цитологические основы, нарушение сцепления. Кроссинговер (перекрест хромосом) и его значение. Генетическое определение пола, половые хромосомы и аутосомы, наследование признаков, сцепленных с полом. Генотип как целостная исторически сложившаяся система. Понятие о взаимодействии и множественном действии генов. Роль генотипа и факторов внешней среды в формировании фенотипа.
Формы изменчивости организмов: модификационная и наследственная изменчивость, мутационная и комбинативная изменчивость, их роль в природе. Причины мутаций. Влияние окружающей среды на мутационный процесс, мутагены. Главные источники комбинативной изменчивости: независимое поведение гомологичных хромосом в мейозе, кроссинговер, оплодотворение. Значение генетики для здравоохранения. Наследственные заболевания человека и меры их профилактики. Влияние радиоактивного излучения и химических мутагенов (в том числе никотина, алкоголя и наркотических веществ) на наследственность человека.
Главные источники комбинативной изменчивости: независимое поведение гомологичных хромосом в мейозе, кроссинговер, оплодотворение. Значение генетики для здравоохранения. Наследственные заболевания человека и меры их профилактики. Влияние радиоактивного излучения и химических мутагенов (в том числе никотина, алкоголя и наркотических веществ) на наследственность человека.
Генетика — теоретическая основа селекции. Порода животных и сорт растений. Основные методы селекции растений и животных: мутагенез, полиплоидия, гибридизация, искусственный отбор. Современные биотехнологии: генная и клеточная инженерия, микробиологический синтез, их роль в развитии здравоохранения, промышленности, сельского хозяйства и охраны природы.
5. Многообразие живой природы.
5.1. Система органического мира
Классификация организмов и роль К.Линнея как основоположника научной систематики. Основные систематические категории: вид, род, семейство, отряд (порядок), класс, тип (отдел), царство. Особенности строения и функционирования представителей основных царств живой природы: бактерий, растений, животных и грибов.
5.2. Царство бактерий
Основные черты строения и жизнедеятельности бактерий, их размножение. Споры. Роль бактерий в биосфере. Значение бактерий для сельского хозяйства, промышленности и медицины. Болезнетворные бактерии и борьба с ними.
5.3. Царство грибов.
Формы вегетативного тела грибов. Шляпочные грибы, их строение, питание, размножение. Плесневые грибы. Дрожжи. Экологические группы грибов. Грибы-паразиты, вызывающие болезни растений, животных и человека. Микориза. Роль грибов в биосфере и значение для человека.
Лишайники – организмы симбиотического происхождения, образованные микобионтом (гриб) и фикобионтом (цианобактерия или зеленая одноклеточная водоросль). Строение лишайников. Экологические и морфологические группы. Питание. Размножение. Роль лишайников в биосфере и значение для человека.
Экологические и морфологические группы. Питание. Размножение. Роль лишайников в биосфере и значение для человека.
5.4. Царство растений.
Общая характеристика растений. Роль растений в структуре экосистемы и значение для человека. Классификация растений. Низшие и высшие растения. Жизненный цикл у растений, чередование поколений спорофита и гаметофита. Эволюция жизненного цикла у растений.
Низшие растения (Водоросли). Эволюция и формы вегетативного тела. Основные отделы водорослей – Зеленые, Бурые и Красные. Строение и жизнедеятельность одноклеточных водорослей (хламидомонада). Нитчатые водоросли (Улотрикс) и водоросли с пластинчатым слоевищем. Размножение водорослей и жизненные циклы. Роль водорослей в биосфере и значение для человека.
Выход растений на сушу. Понятие о тканях и органах у растений. Характеристика отдела Риниевых (Псилофитов).
Отдел Моховидные. Зеленые мхи. Строение, размножение и жизненный цикл кукушкина льна. Мох сфагнум, особенности его строения. Образование торфа, его значение.
Отделы Плауновидные, Хвощевидные, Папоротниковидные: характеристика, основные представители, их строение и биология. Жизненный цикл и размножение папоротника.
Отдел Голосеменные: характеристика строения и размножения. Распространение хвойных. Биологическое значение семени. Роль голосеменных в биосфере и значение для человека.
Отдел Покрытосеменные (цветковые). Строение цветка. Семезачаток. Двойное оплодотворение. Образование семян и плодов. Роль покрытосеменных в биосфере и значение для человека. Классификация Покрытосеменных: классы Двудольных и Однодольных, их особенности. Отличительные признаки растений основных семейств; их биологические особенности (семейства Крестоцветные, Розоцветные, Бобовые, Пасленовые, Сложноцветные, Лилейные, Злаки). Основные группы тканей растений (образовательные, покровные, механические, проводящие, основные). Вегетативные органы высших растений. Строение и функции корня, виды корней, типы корневой системы, видоизменения (метаморфозы) корня. Побег. Почки. Стебель. Ветвление побега. Строение и функции стебля, видоизменения побегов (корневище, клубень, луковица). Строение и функции листа, типы листьев, листорасположение, типы жилкования.
Вегетативные органы высших растений. Строение и функции корня, виды корней, типы корневой системы, видоизменения (метаморфозы) корня. Побег. Почки. Стебель. Ветвление побега. Строение и функции стебля, видоизменения побегов (корневище, клубень, луковица). Строение и функции листа, типы листьев, листорасположение, типы жилкования.
Генеративные органы цветковых растений. Строение цветка в связи со способами опыления. Цветки однополые и обоеполые. Формула цветка. Соцветия и их биологическое значение. Строение и классификация семян (на примере однодольного и двудольного растения) и плодов. Типы прорастания семян, питание и рост проростка. Распространение плодов и семян. Значение цветков, плодов и семян в природе и жизни человека. Происхождение растений. Основные этапы эволюции растительного мира: возникновение фотосинтеза, возникновение одноклеточных и многоклеточных водорослей, выход растений на сушу (псилофиты), появление споровых и семенных растений. Филогенетические связи в растительном мире.
5.5. Царство животных
Простейшие животные. Общая характеристика простейших: строение клеток, питание, дыхание, выделение, движение, поведение и размножение. Разнообразие простейших: обыкновенная амеба, эвглена зеленая и гетеротрофные жгутиконосцы, инфузория-туфелька и другие. Отличия простейших от многоклеточных животных. Их значение в природе и жизни человека. Паразитические простейшие – возбудители заболеваний человека и животных.
Многоклеточные животные. Особенности строения многоклеточных животных. Основные ткани, органы и их системы. Типы симметрии тела животных. Двухслойные и трехслойные животные.
Типы Кишечнополостные, Плоские черви, Круглые черви, Кольчатые черви. Характеристика их строения и основных процессов жизнедеятельности (внешнее строение, система покровов, движение и мускулатура, питание и пищеварительная система, дыхание, выделение и выделительная система, распределение веществ в организме, полость тела, нервная система, особенности поведения, половая система и способы размножения). Жизненные циклы важнейших представителей. Характеристика основных классов. Роль в экосистемах и жизни человека. Паразитические представители плоских и круглых червей, их значение для здравоохранения и сельского хозяйства. Профилактика паразитарных заболеваний.
Жизненные циклы важнейших представителей. Характеристика основных классов. Роль в экосистемах и жизни человека. Паразитические представители плоских и круглых червей, их значение для здравоохранения и сельского хозяйства. Профилактика паразитарных заболеваний.
Тип Членистоногие. Характеристика строения и основных процессов
жизнедеятельности. Классы: Ракообразные, Паукообразные, Насекомые. Особенности членистоногих в связи с освоением наземно-воздушной среды обитания. Основные отряды насекомых: Прямокрылые, Жесткокрылые, Чешуекрылые, Двукрылые, Перепончатокрылые. Насекомые с полным и неполным превращением. Многообразие насекомых, их роль в экосистемах и жизни человека. Методы борьбы с насекомыми — вредителями сельскохозяйственных культур и переносчиками заболеваний. Охрана насекомых.
Тип Моллюски. Характеристика строения и основных процессов жизнедеятельности, основные классы (Брюхоногие, Двустворчатые, Головоногие). Роль моллюсков в водных и наземных экосистемах.
Тип Хордовые. Общая характеристика типа. Основные классы хордовых: Ланцетники, Хрящевые рыбы, Костные рыбы, Земноводные, Пресмыкающиеся, Птицы, Млекопитающие. Характеристика их строения и основных процессов жизнедеятельности в связи с особенностями среды обитания и образа жизни. Происхождение основных классов и эволюция позвоночных. Выход позвоночных на сушу и освоение ими наземно-воздушной среды обитания. Характеристика основных отрядов. Роль различных хордовых в экосистемах и жизни человека, охрана и регуляция численности. Основные домашние и сельскохозяйственные животные: происхождение, биологические основы их содержания, кормления, разведения.
Эволюция животного мира.
Происхождение Простейших и Многоклеточных животных. Происхождение основных типов животного царства. Усложнение строения и жизнедеятельности животных в процессе эволюции. Положение человека в системе царства животных, доказательства его систематической принадлежности.
6. Человек и его здоровье.
Общий обзор организма человека: основные ткани и системы органов. Значение знаний о строении, жизнедеятельности организма и гигиене человека для охраны его здоровья.
Органы и системы органов человека.
Система покровов. Строение и функции кожи. Производные кожи: волосы и ногти. Роль кожи в терморегуляции, закаливание организма. Гигиена кожи, профилактика и первая помощь при ожогах, обморожениях, и механических травмах.
Опорно-двигательная система и движение. Основные элементы опорно-двигательной системы человека. Части скелета: осевой скелет, скелет конечностей и их поясов. Строение костей и их функции. Основные типы костей и их соединений. Суставы. Хрящи, сухожилия, связки. Строение мышц и их функции. Основные группы мышц человека. Первая помощь при ушибах, растяжении связок, переломах и вывихах.
Кровь и кровообращение. Понятие внутренней среды организма, значение постоянства внутренней среды. Кровь, лимфа и тканевая жидкость. Состав крови человека: плазма крови и различные форменные элементы, их строение и функции. Иммунитет и его типы. Антигены и антитела. Роль И.И. Мечникова в создании учения об иммунитете. Инфекционные заболевания и борьба с ними. Прививки и их роль в профилактике инфекционных заболеваний. Группы крови. Переливание крови, донорство. Свертывание крови. Строение системы кровообращения: сердце и сосуды (артерии, капилляры, вены). Большой и малый круги кровообращения. Предупреждение сердечно-сосудистых заболеваний. Первая помощь при кровотечениях. Вредное влияние курения, употребления алкоголя и наркотиков на сердечно-сосудистую систему.
Дыхательная система и газообмен. Основные компоненты дыхательной системы. Строение легких, механизм вдоха и выдоха, газообмен. Значение дыхания. Гигиена органов дыхания. Заболевания органов дыхания и их профилактика. Предупреждение распространения инфекционных заболеваний. Чистота атмосферного воздуха как фактор здоровья. Приемы первой помощи при отравлении угарным газом и спасении утопающего.
Заболевания органов дыхания и их профилактика. Предупреждение распространения инфекционных заболеваний. Чистота атмосферного воздуха как фактор здоровья. Приемы первой помощи при отравлении угарным газом и спасении утопающего.
Органы пищеварения и питание. Строение и функции пищеварительной системы. Отделы пищеварительного тракта и их функции. Пищеварительные железы. Роль ферментов в пищеварении. Регуляция пищеварения, исследования И.П. Павлова. Пищевые продукты и питательные вещества: белки, липиды, углеводы, минеральные вещества, вода, витамины. Гигиена органов пищеварения, рациональное питание. Значение питания и пищеварения. Обмен веществ и энергии в организме человека, профилактика нарушений метаболизма. Роль витаминов в организме, их содержание в пищевых продуктах. Профилактика пищевых отравлений, кишечных инфекций и паразитарных заболеваний.
Выделение. Строение мочевыделительной системы человека. Органы мочевыделительной системы и их функции. Образование первичной и вторичной мочи. Профилактика заболеваний. Роль других систем органов в выделении продуктов метаболизма.
Размножение и развитие. Мужская и женская половая система, их строение и функция. Образование половых клеток. Основные этапы индивидуального развития человека. Причины нарушения индивидуального развития; наследственные болезни, их причины и предупреждение. Инфекции, передающиеся половым путем, их профилактика.
Нервная и гуморальная регуляция процессов жизнедеятельности. Основные железы внутренней секреции и их значение для роста, развития и регуляции функций организма. Основные гормоны человека. Строение нервной системы, ее отделы: центральная и периферическая нервная система. Строение и функции головного и спинного мозга. Соматическая и вегетативная нервная система. Органы чувств, их строение и функции. Анализаторы. Нарушения работы анализаторов и их профилактика. Условные и безусловные рефлексы, рефлекторные дуги. Высшая нервная деятельность, речь и мышление. Сознание как функция мозга. Социальная и биологическая обусловленность поведения человека. Роль И.М. Сеченова и И.П. Павлова в создании учения о высшей нервной деятельности. Нарушения деятельности нервной системы и их предупреждение. Сон, его значение и гигиена. Взаимосвязь процессов нервной и гуморальной регуляции.
Нарушения работы анализаторов и их профилактика. Условные и безусловные рефлексы, рефлекторные дуги. Высшая нервная деятельность, речь и мышление. Сознание как функция мозга. Социальная и биологическая обусловленность поведения человека. Роль И.М. Сеченова и И.П. Павлова в создании учения о высшей нервной деятельности. Нарушения деятельности нервной системы и их предупреждение. Сон, его значение и гигиена. Взаимосвязь процессов нервной и гуморальной регуляции.
7. Эволюция органического мира.
Доказательства эволюции живой природы. История эволюционного учения; К. Линней, Ж.Кювье, Ж.-Б.Ламарк и их роль в развитии науки. Основные положения теории Ч. Дарвина, ее значение. Популяции и их структура. Численность популяций, возрастной и половой состав, формы совместного существования особей. Изменчивость в популяциях. Факторы (движущие силы) эволюции. Естественный отбор — направляющий фактор эволюции. Формы естественного отбора (движущий, стабилизирующий, разрывающий). Борьба за существование. Роль экологии в изучении механизмов эволюционных преобразований. Возникновение приспособленности, ее относительный характер. Вид и его критерии. Механизмы видообразования. Изоляция и ее типы, роль географической изоляции. Микроэволюция и макроэволюция, соотношение их механизмов. Роль изучения онтогенеза в познании механизмов эволюции органического мира. Биогенетический закон. Биологический прогресс и регресс. Ароморфоз, идиоадаптация, общая дегенерация; соотношение путей эволюции. Эволюционные параллелизмы и конвергенция, их причины. Гомологичные и аналогичные органы. Основные этапы эволюции жизни. Происхождение жизни на Земле. Наиболее важные ароморфозы в эволюции живой природы. Происхождение и эволюция человека. Доказательства происхождения человека от животных. Этапы эволюции человека. Движущие силы антропогенеза. Возникновение человеческих рас. Биологическое и социальное в природе человека.
Биологическое и социальное в природе человека.
8. Организм и окружающая среда. Экосистемы. Биосфера.
Экология — наука о взаимоотношении организмов и окружающей среды, значение экологии. Понятие окружающей среды и экологического фактора, классификация экологических факторов. Действие экологических факторов. Ограничивающие факторы. Понятие экологической ниши. Основные абиотические факторы: свет, температура, влажность, их роль в жизни организмов. Периодические явления в жизни природы: биологические ритмы, фотопериодизм. Типы межвидовых взаимоотношений: конкуренция, хищничество, паразитизм, симбиоз. Разнообразие популяций, их возрастная и половая структура. Динамика численности популяций и ее причины. Биологические сообщества — многовидовые системы, взаимосвязь организмов в сообществе. Экосистема и биогеоценоз. Видовая и пространственная структура экосистем. Роль редких видов в природе и меры по их охране. Трофическая структура экосистем: продуценты, консументы, редуценты. Правило экологической пирамиды. Пищевые цепи и сети. Круговорот веществ и превращение энергии в экосистемах. Саморегуляция — одно из важнейших свойств экосистем. Внешние и внутренние причины изменения экосистем, экологическая сукцессия. Влияние человека на природные экосистемы, специфика действия антропогенных факторов. Сравнение естественных и искусственных экосистем. Агроэкосистемы и экосистемы городов. Значение биологического разнообразия для нормального функционирования естественных экосистем, сохранение биологического разнообразия. Значение природоохранных мероприятий и рационального природопользования. Биосфера как глобальная экосистема, ее границы. Вклад В.И.Вернадского в разработку учения о биосфере. Функции живого вещества. Особенности распределения биомассы в биосфере. Биологический круговорот. Эволюция биосферы. Глобальные изменения в биосфере и их причины. Влияние деятельности человека на эволюцию биосферы.
Влияние деятельности человека на эволюцию биосферы.
Общие указания
На экзамене по биологии поступающий в высшее учебное заведение должен показать:
- знание главнейших понятий, закономерностей и законов, касающихся строения, жизни и развития растительного, животного и человеческого организмов, развития живой природы;
- знание строения и жизни растений, животных, человека, основных групп растений и классификации животных;
- умение обосновывать выводы, оперировать понятиями при объяснении явлений природы с приведением примеров из практики сельскохозяйственного и промышленного производства, здравоохранения и т.д. Этому умению придается особое значение, так как оно будет свидетельствовать об осмысленности знаний, о понимании излагаемого материала экзаменующимся.
Рекомендуемая литература:
1. Каменский А.А. Общая биология 10-11 класс. М.: Дрофа, 2013г.
2. Пономарева И.Н. Биология 10 класс. Профильный уровень. М.: Вентана-Граф, 2013.
3. Трайтак Д.И. Биология 5-6 класс. М.: Мнемозина, 2013. ФГОС.
4. Пасечник В.В. Биология 7 класс. М.: Просвещение, 2015 г. ФГОС.
5. Рохлов В.С. Биология. Человек 8 класс. М.: Дрофа, 2010 г.
6. Пасечник В.В. Биология. Человек 8 класс. М.: Просвещение, 2011.
7. Каменский А.А. Биология. Введение в экологию. М.: Дрофа, 2011.
8. Бородин П.М., Высоцкая Л.В., Дымшиц Г.М. и др. Биология (профильный уровень). 10-11 класс. В 2-х частях. М.: Просвещение, 2014.
9. Дубинина Н.В., Пасечник В.В. Биология. Бактерии, грибы, растения. 6 класс. М.: Дрофа, 2014.
10. Каменский А.А., Криксунов Е.А., Пасечник В.В. Биология. Общая биология. 10-11 класс. М.: Дрофа, 2014.
11. Колесов Д.В., Маш Р.Д., Беляев И.Н. Биология. Человек. 8 класс. М.: Дрофа, 2014.
12. Пасечник В.В. Биология. 7 класс (серия «Линия жизни»). М.: Просвещение, 2013.
13. Пасечник В.В., Каменский А.А., Швецов Г.Г. (под ред. Пасечника В.В.) Биология. 8 класс. М.: Просвещение, 2013.
14. Пасечник В.В., Суматохин С.В., Калинова Г.С. (под ред. Пасечника В.В.) Биология. 7 кл. М.: Просвещение, 2013.
ПРОГРАММЫ ПО РУССКОМУ ЯЗЫКУ
Программы по русскому языку составлена в соответствии со школьной программой.
Цель: выявить наиболее грамотных абитуриентов, знающих орфографические и пунктуационные правила, культуру речи, умеющих точно выражать мысли, используя разнообразную лексику и различные грамматические конструкции.
ПРОГРАММА ПО РУССКОМУ ЯЗЫКУ
1. Орфография
1. Правописание гласных в корне. Проверяемые безударные гласные. Непроверяемые безударные гласные. Чередующиеся гласные а-о, и-е. Гласные после шипящих. Гласные после ц. Буквы э — е. Буква й..
2. Правописание согласных в корне. Звонкие и глухие согласные. Двойные согласные в корне и на стыке приставки и корня. Непроизносимые согласные.
3. Употребление прописных букв. Прописные буквы в начале текста. Собственные имена лиц. Клички животных, наименования видов растений, сортов вин. Имена действующих лиц в произведениях. Названия документов, памятников старины, произведений искусства. Наименование должностей и званий. Названия литературных произведений и органов печати и др.
4. Разделительныеъ и ь. Употребление ъ. Употребление ь.
5. Правописание приставок. Приставки на з~. Приставка с-. Приставки пре- и при-. Гласные ы и и после приставок.
6. Гласные после шипящих и ц в суффиксах и окончаниях. Гласные о и епосле шипящих. Гласные после ц.
Гласные после ц.
7. Правописание имен существительных. Окончания имен существительных. Суффиксы имен существительных. О и Е после шипящих в корне.
8. Правописание имен прилагательных. Окончания имен прилагательных. Суффиксы имен прилагательных.
9. Правописание сложных слов. Соединительные гласные о и е. Сложные слова без соединительной гласной. Правописание сложных существительных. Правописание сложных прилагательных.
10. Правописание имен числительных. Числительные количественные, порядковые, собирательные, дробные. Числительное пол-.
11. Правописание местоимений. Отрицательные местоимения.
12. Правописание глаголов. Личные окончания глаголов. Употребление ь в глагольных формах. Суффиксы глаголов.
13. Правописание причастий. Гласные в суффиксах причастий. Правописание н и нн в причастиях и отглагольных прилагательных.
14. Правописание наречий. Гласные на конце наречий. Наречия на шипящую. Отрицательные наречия. Слитное написание наречий. Дефисное написание наречий. Раздельное написание наречных сочетаний.
15. Правописание предлогов. Сложные предлоги. Слитное написание предлогов и предложных словосочетаний.
16. Правописание союзов. Слитное написание союзов. Раздельное написание союзов.
17. Правописание частиц.
2. Пунктуация
1. Знаки препинания в конце предложения и при перерыве речи.
2. Тире между членами предложения.
3. Знаки препинания в предложениях с однородными членами.
4. Знаки препинания при повторяющихся словах.
5. Знаки препинания в предложениях с обособленными членами.
6. Знаки препинания в предложениях с уточняющими, пояснительными и присоединительными членами предложения.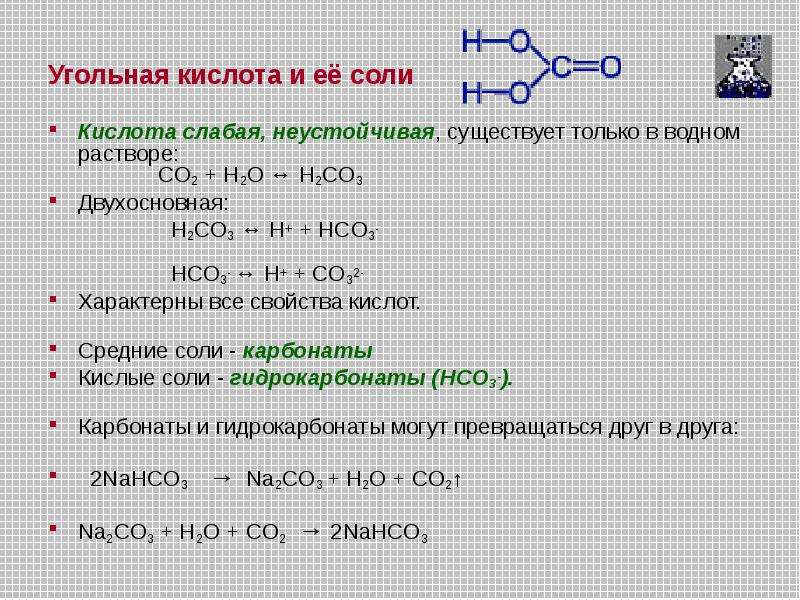
7. Знаки препинания при словах, грамматически не связанных с членами предложения.
8. Знаки препинания при междометиях, частицах, утвердительных, отрицательных и вопросительно-отрицательных словах.
9. Знаки препинания в сложносочиненных предложениях.
10. Знаки препинания в сложноподчиненных предложениях.
11. Знаки препинания при оборотах, не являющихся придаточными предложениями.
12. Знаки препинания в бессоюзных сложных предложениях.
13. Знаки препинания при прямой речи.
14. Знаки препинания при цитатах.
15. Употребление кавычек.
3. Культура речи.
1. Нормативный аспект культуры речи. Языковые нормы: орфоэпические (произношение), акцентологические (ударение), орфографические (написание), словообразовательные, лексические, морфологические, синтаксические, пунктуационные.
2. Функциональные стили русского языка: научный, официально-деловой, газетно-публицистический, художественный, разговорный.
Примеры тестов.
Задание 1. Укажите номер слова, в котором пропущена буква А.
1. Р…птание
2. Раств…рить
3. Г…ворливый
4. Утв…рь
Задание 2. Укажите номер слова, в котором пропущена И.
1. Об…скивать
2. Пред…нфарктный.
3. Спорт…гра.
4. С…скной.
Задание 3. Укажите номер предложения, в котором между подлежащим и сказуемым на месте подчеркнутого пробела тире не ставится.
1. Самое большое счастье для человека _ приносить людям радость.
2. Офицер этот _ не чета вам.
3. Любить тайгу _ значит восстанавливать ее богатства.
4. Трижды пять _ пятнадцать.
Задание 4. Укажите номер предложения с обстоятельством, в котором на месте подчеркнутого пробела запятая не ставится.
1. Очнувшись _ я некоторое время не мог опомниться.
2. Ворча и оглядываясь _ Каштанка вошла в комнату.
3. Он знал, что бросается _ очертя голову _ в омут, куда и заглядывать не стоило.
4. Отправляя Метелицу в разведку _ Левинсон наказал ему вернуться той же ночью.
Задание 5. Ударение неправильно поставлено в слове:
1) цепочка
2) оптовый
3) каталог
4) афиняне
5) свекла
Задание 6. Нормы сочетаемости слов нарушены в словосочетании:
1) основать выводы
2) разъяснять ошибки
3) беспокоиться за родителей
4) оплатить за проезд
5) мириться с недостатками
Литература
1. Баранов М.Т. Русский язык. Справочные материалы: пособие для учащихся общеобразовательных организаций / М.Т. Баранов, Т.А. Костяева, А.В. Прудникова; под ред. Н.М. Шанского. – 13-е изд.- М.: Просвещение, 2014. — 285 с.
2. Введенская Л.А. Русский язык и культура: учебное пособие/ Л.А. Введенская, М.Н. Черкасова. = Изд. 14-е, стер. — Ростов н/Д.: Феникс, 2013. – 38, [1] c.
3. Голуб И.Б. Русский язык: справочник/ И.Б. Голуб. – М.: КНОРУС, 2014. — 190 с.
4. Греков В.Ф. Пособие для занятий по русскому языку в старших классах/ В.Ф. Греков, С.Е. Крючков, Л.А. Чешко. — М., Просвещение, любое издание.
5. Розенталь Д.Э. Русский язык. Сборник правил и упражнений/ Д.Э. Розенталь. – М.: ЭКСМО. 2014. – 432 с.
Интеллектуальная игра по химии
- Приветствие.
- Представление команд.
- Представление жюри. Жюри заносит результаты конкурсов в оценочный лист (Приложение 1).
- Содержание:
- разминка
- ответ с подсказками
- отгадай кроссворд
- конкурс капитанов
- угадай реакцию
- Пожелание успеха.

Первый конкурс «Разминка» (Приложение 2)
Условия конкурса: право ответа есть у каждой команды. Прослушав вопрос, капитан команды через 1 мин. передаёт жюри ответ, написанный на листке. Правильный ответ приносит команде 1 балл.
1) Одно простое вещество хорошо горит, другое – поддерживает горение. Их соединение пригодно для тушения огня.
Назовите эти вещества.
Напишите уравнение реакции их взаимодействия.
Ответ: H2 – водород
O2 – кислород
2H2 + O2 = 2H2O – вода
2) Назовите не менее пяти способов разделения смесей.
Варианты ответов: фильтрование, выпаривание, кристаллизация, дистилляция, перегонка, хроматография, флотация, действие магнитом, отстаивание.
3) Расположите химические элементы в порядке увеличения радиуса атомов: алюминий, калий, фосфор, хлор, натрий.
Ответ:
4) Расположите вещества в порядке уменьшения скорости их реакции с разбавленной серной кислотой:
цинк, магний, железо, раствор гидроксида натрия.
Ответ:
5) Расположите формулы солей в порядке увеличения числа букв в названии: KNO3, K2CO3, K2SO4, KJ
Ответ:
|
KJ |
KNO3 |
K2SO4 |
K2CO3 |
иодид |
нитрат |
сульфат |
карбонат |
5 букв |
6 букв |
7 букв |
8 букв |
Второй конкурс «Ответ с подсказкой» (Приложение 3)
Вопросы второго конкурса приносят командам от 1 до 5 баллов в зависимости от количества использованных подсказок. Ответ после первой подсказки оценивается в 5 баллов, после второй – в 4 балла и т.д. Команда, угадавшая ответ поднимает руку. Ошибка лишает права команду ответить повторно.
Ответ после первой подсказки оценивается в 5 баллов, после второй – в 4 балла и т.д. Команда, угадавшая ответ поднимает руку. Ошибка лишает права команду ответить повторно.
Вопрос 1: Угадайте химический элемент.
- По распространению в земной коре он уступает лишь кислороду, кремнию и алюминию.
- В организме человека его содержится около 3 г., из них примерно 2 г. – в крови.
- Первоначально источником простого вещества этого элемента были упавшие на Землю метеориты, которые содержали его почти в чистом виде.
- В честь этого элемента был назван целый период человеческой истории.
- Простое вещество этого элемента обладает магнитными свойствами.
Ответ: элемент железо Fe.
Вопрос 2: Назовите имя учёного.
- Великий русский учёный первым в России разработал способ получения цветных стёкол.
- Из цветных стёкол он создал панораму «Полтавская битва».
- К его заслугам относится открытие закона сохранения массы веществ.
- А.С. Пушкин назвал его «первым университетом».
- Главный ВУЗ нашей страны назван его именем.
Ответ: Михаил Васильевич Ломоносов.
Вопрос 3: Угадайте металл.
- Упадок и распад Римской империи, по мнению некоторых учёных, были обусловлены отравлением этим веществом.
- Раньше его добавляли в плохое вино для улучшения вкуса.
- В Древнем Риме его широко использовали для изготовления кухонной посуды, водопроводных труб, монет, гирь.
- В настоящее время он применяется для предохранения от коррозии телеграфных и электрических подземных проводов, изготовления аккумуляторов.
- Оловянный припой представляет собой сплав олова с этим металлом.
Ответ: свинец.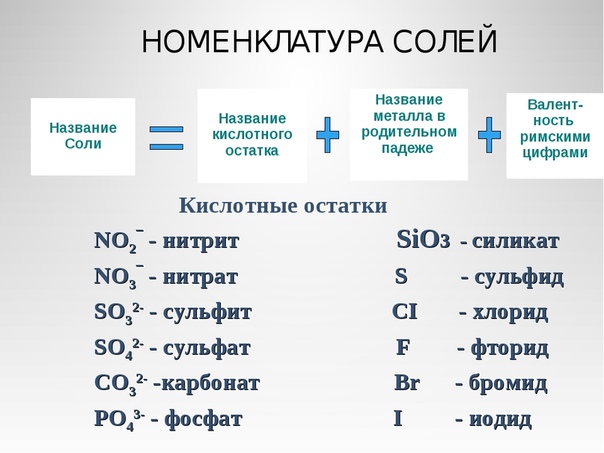
Вопрос 4: Угадайте неметалл.
- В земной коре его содержание едва достигает 0,4% по массе.
- Этот элемент необходим для существования животных и растений, он входит в состав белков, аминокислот, нуклеиновых кислот, хлорофилла, гемоглобина (16-18%).
- Ему не повезло с названием: его называли «флогистированный», «мефитический», «испорченный», «безжизненный».
- В составе простого вещества он содержится в атмосфере. На каждый квадратный метр земной поверхности его приходится 8 тонн.
- Свойства простого вещества характеризуют как инертные.
Ответ: элемент азот N.
Вопрос 5: Угадайте газ.
- В 1890 г. он явился причиной гибели экипажа океанского парусника «Мальборо». Корабль не получил никаких повреждений, но, потеряв управление, блуждал в океане.
- Он входит в состав вулканических газов.
- Он также содержится и в выхлопных газах.
- Он образуется при неполном сгорании углерода.
- При отравлении им наступает кислородное голодание тканей, в особенности клеток центральной нервной системы.
Ответ: угарный газ CO.
Третий конкурс «Реши кроссворд» (Приложение 4, Приложение 5, Приложение 6)
В течение 3 минут команды отгадывают кроссворд. На 1 листе капитан записывает окончательный ответ и передаёт членам жюри. Полностью решённый кроссворд оценивается в 5 баллов, частично – в 3 балла.
- NaH
- CuSiO3
- BaI2
- FeCl3
- K2CrO4
- Li2O
- MgSO4
- KMnO4
- ZnCO3
- Na2O2
- SO3
- KAlO2
- Al(NO3)3
Зашифрованное слово: соль угольной кислоты.
Ответ: гидрокарбонат.
Конкурс капитанов (Приложение 7)
Приглашаются капитаны на жеребьёвку. Для каждого капитана приготовлено по 5 вопросов. Правильный ответ оценивается в 2 балла. Возможна подсказка. Помощь команды приносит только 1 балл.
Первый блок вопросов.
1. Какой химический элемент не существует?
|
1. Таллий |
2. Галлий |
3. Валлий |
4. Калий |
Ответ: 3. Валлий.
2. Что не является частицей атомного ядра?
1. Нейрон |
2. Протон |
3. Нуклон |
4. Электрон |
Ответ: 4. Электрон.
3. Какой газ преимущественно содержит атмосфера Солнца?
|
1. Водород |
2. Гелий |
3. Азот |
4. Кислород |
Ответ: 1. Водород H2 78%.
4. Какое вещество в твёрдом состоянии называют «сухим льдом»?
|
1. Воду |
2. Азот |
3. Углекислый газ |
4. |
Ответ: 3. Углекислый газ CO2
5. Что не является солью?
|
1. Мел |
2. Песок |
3. Известняк |
4. Гипс |
Ответ: 2. Песок SiO2.
Второй блок вопросов
1. Что означает название «озон» в переводе с греческого?
|
1. Грозовой |
2. Защищающий |
3. Безжизненный |
4. Пахнущий |
Ответ: 4. O3 – озон – «пахнущий».
2. Какой элемент назван в честь шведского изобретателя и промышленника?
|
1. Кюрий |
2. Нильсборий |
3. Нобелий |
4. Фермий |
Ответ: 3. Альфред Нобель.
3. Объёмная доля какого газа в воздухе минимальная?
|
1. Углекислого |
2. Кислорода |
3. Азота |
4. Аргона |
Ответ: 1.Углекислый газ CO2 – 0,03%.
4. Раствор гидроксида какого металла называют «известковой водой»?
|
1. |
2. Кальция |
3. Бария |
4. Магния |
Ответ: 2. Кальция Ca(OH)2
5. На корнях каких растений живут бактерии, усваивающие атмосферный азот?
|
1. Паслёновых |
2. Бобовых |
3. Зонтичных |
4. Крестоцветных |
Ответ: 2. Бобовых.
Третий блок вопросов
1. Как называют процесс распада вещества на составные части?
|
1. Дисфункция |
2. Дистилляция |
3. Диссоциация |
4. Ассоциация |
Ответ: 3. Диссоциация
2. Как называют смесь двух объёмов водорода и одного объёма кислорода?
|
1. Водородный |
2. Гремучий |
3. Веселящий |
4. Взрывной |
Ответ: 2. Гремучий газ.
3. Какое вещество не содержит в своём составе химический элемент углерод?
|
1. |
2. Графит |
3. Уголь |
4. Кварц |
Ответ: 4. Кварц SiO2.
4. Именем какого небесного тела алхимики называли серебро?
|
1. Солнца |
2. Луны |
3. Венеры |
4. Марса |
Ответ: 2. Луны.
5. В какой цвет окрашивают пламя соли натрия?
|
1. Жёлтый |
2. Фиолетовый |
3. Красный |
4. Зелёный |
Ответ: 1. Жёлтый.
Конкурс «Угадай реакцию» (Приложение 8, Приложение 9, Приложение 10)
Командам предлагается просмотреть видеофрагмент без звука и подсказок. Ваша задача – написать уравнение реакции, лежащее в основе химического превращения.
Каждый видеофрагмент оценивается в 5 баллов.
- 2Al + 3Br2 = 2AlBr3
- 2Al + 3S = Al2S3
- 4P + 5O2 = 2P2O5
Игра окончена.
Жюри подводит итоги. Составляется итоговый протокол (Приложение 11).
Проходит награждение победителей и призёров.
Тест. Угольная кислота. Карбонаты. Жёсткость воды
© 2020, ООО КОМПЭДУ, http://compedu. ru При поддержке проекта http://videouroki.net
ru При поддержке проекта http://videouroki.net
Список вопросов теста
Вопрос 1
В результате кипячения водного раствора гидрокарбонатат кальция в осадок выпадает:
Варианты ответов
- оксид кальция
- карбид кальция
- гидроксид кальция
- карбонат кальция
Вопрос 2
Осадок выпадает при пропускании углекислого газа через раствор:
Варианты ответов
- известковой воды
- гидроксида бария
- карбоната натрия
- гидроксида натрия
Вопрос 3
Оцените суждения:
Варианты ответов
- временную жёсткость удаляют кипячением
- угольная кислота является одноосновной
- карбонат кальция практически нерастворим в воде
- кальцинированная сода — это гидрокарбонат кальция
Вопрос 4
Охарактеризуйте свойства угольной кислоты:
Варианты ответов
- является сильным электролитом в водных растворах
- диссоциирует в водных растворах в две стадии
- образует средние и кислые соли
- является двухосновной кислотой
Вопрос 5
Временная жёсткость обусловлена наличием в воде:
Варианты ответов
- хлорида кальция
- гидрокарбонатов кальция и магния
- сульфата магния
- хлорида магния
Вопрос 6
Гидрокарбонат кальция вступает в реакции:
Варианты ответов
- термического разложения
- с соляной кислотой
- с азотной кислотой
- с угольной кислотой
Вопрос 7
Сколько (т) известняка нужно прокалить, чтобы получить 5,6 т негашёной извести?
Вопрос 8
Какой объём (л) углекислого газа (н. у.) образуется при прокаливании 1250 г известняка, содержащего 20% примесей?
у.) образуется при прокаливании 1250 г известняка, содержащего 20% примесей?
Вопрос 9
Укажите число веществ, которое образуется при разложении (NH4)2CO3.
Вопрос 10
Укажите формулу соли, которая применяется в хлебопечении и пищевой промышленности:
Варианты ответов
K2CO3
NaHCO3
Na2CO3
CaCO3
Соль или эфир угольной кислоты, 9 букв — разгадки кроссвордов, ответы, решатель
Примеры использования карбоната.

Если во время испарения на посуде появляются пятна, возьмите несколько капель соляной и серной кислот, выпарите, а затем обработайте карбонатом соды.
Этот результат аналогичен тому, который следует из погружения листьев в крепкий раствор одной части карбоната от до 109, или 146, или даже 218 воды, так как в этом случае листья парализуются и перегиба не происходит, хотя железы почернеют, а протоплазма в клетках щупалец подвергается сильной агрегации.
Кусок листа, погруженный в несколько капель раствора одной части карбоната аммиака на 437 воды, имел все железы и все щупальца были загнуты на 5 м.
Первый эффект карбоната и некоторых других солей аммиака, а также некоторых других жидкостей — потемнение или почернение желез.
Аналогичный результат был получен при погружении всего на 15 минут в раствор, состоящий из одной части карбоната аммиака и 218 воды, и прилегающие клетки щупалец, на которых располагались сосочки, теперь также содержали агрегированные массы протоплазма.
При сильном прострации с холодными конечностями следует вводить карбонат аммиака в дозах от одной до двух крупинок каждый второй час в слизистой гуммиарабика.
Из вышеизложенных экспериментов мы узнаем, что края листьев скручиваются внутрь, когда они возбуждены простым давлением предметов, не дающих растворимого вещества, предметами, дающими такое вещество, и некоторыми жидкостями, а именно настоем сырого мяса и недельным раствором карбонат аммиака .
Статоцисты в таких существах открываются внешнему миру через узкие отверстия, и статолиты — это не частицы карбоната кальция , а скорее частицы песка, которые существо фактически помещает в статоцисты.
Таким образом, частица сахара, добавленная к секрету вокруг железы, вызывает гораздо большее увеличение секреции и гораздо меньшую агрегацию, чем частица карбоната аммиака, введенная таким же образом.
Далее мы увидим, что пурпурная жидкость внутри чувствительных нитей Dionaea, которые не секретируют, также подвергается агрегации под действием слабого раствора карбоната аммиака.
Другие жидкости, помимо раствора карбоната , например, настой сырого мяса, производят такой же эффект.
После короткой фазы свободного плавания гаптофиты сконструировали для себя крошечные замысловатые доспехи из карбоната кальция .
Один из этих же листьев затем помещали в слабый раствор карбоната , и через 1 час. 45 мес.
Затем я добавил минутную каплю раствора одной части карбоната аммиака в 109 воды, и через 1 час. осмотрел образцы.
Лист этого растения и, для сравнения, лист свежего растения были погружены на 1 час.в довольно крепком растворе карбоната аммиака.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
карбоновая кислота | Структура, свойства, формула, использование и факты
Карбоновая кислота , любой из класса органических соединений, в которых атом углерода (C) связан с атомом кислорода (O) двойной связью и с гидроксильной группой (OH) одинарной связью. Четвертая связь связывает атом углерода с атомом водорода (H) или с какой-либо другой одновалентной объединяющей группой. Карбоксильная (COOH) группа названа так из-за онильной группы carb (C = O) и группы hydr oxyl .
Четвертая связь связывает атом углерода с атомом водорода (H) или с какой-либо другой одновалентной объединяющей группой. Карбоксильная (COOH) группа названа так из-за онильной группы carb (C = O) и группы hydr oxyl .
Спирты могут окисляться с образованием альдегидов, кетонов и карбоновых кислот. Окисление органических соединений обычно увеличивает количество связей углерода с кислородом и может уменьшать количество связей с водородом.
Encyclopædia Britannica, Inc.Основной химической характеристикой карбоновых кислот является их кислотность. Как правило, они более кислые, чем другие органические соединения, содержащие гидроксильные группы, но обычно слабее, чем известные минеральные кислоты (например,g., соляная кислота, HCl, серная кислота, H 2 SO 4 и т. д.).
Карбоновые кислоты широко встречаются в природе. Жирные кислоты являются компонентами глицеридов, которые, в свою очередь, являются компонентами жира. Гидроксильные кислоты, такие как молочная кислота (содержится в кисломолочных продуктах) и лимонная кислота (содержится в цитрусовых), а также многие кетокислоты являются важными продуктами метаболизма, которые существуют в большинстве живых клеток. Белки состоят из аминокислот, которые также содержат карбоксильные группы.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишись сейчасСоединения, в которых OH карбоксильной группы заменен некоторыми другими группами, называются производными карбоновых кислот, наиболее важными из которых являются ацилгалогениды, ангидриды кислот, сложные эфиры и амиды.
Производные карбоновых кислот имеют различные применения. Например, в дополнение к использованию в качестве дезинфицирующего средства муравьиная кислота, простейшая карбоновая кислота, используется при обработке текстиля и в качестве кислотного восстановителя. Уксусная кислота широко используется в производстве целлюлозных пластиков и сложных эфиров. Аспирин, сложный эфир салициловой кислоты, получают из уксусной кислоты. Пальмитиновая кислота и стеариновая кислота важны для производства мыла, косметики, фармацевтических препаратов, свечей и защитных покрытий. Стеариновая кислота также используется в производстве резины. Акриловая кислота используется в виде сложного эфира при производстве полимеров (длинноцепочечных молекул), известных как акрилаты. Метакриловая кислота служит сложным эфиром и полимеризуется с образованием люцита. Олеиновая кислота используется в производстве мыла, моющих средств и текстильных изделий.
Аспирин, сложный эфир салициловой кислоты, получают из уксусной кислоты. Пальмитиновая кислота и стеариновая кислота важны для производства мыла, косметики, фармацевтических препаратов, свечей и защитных покрытий. Стеариновая кислота также используется в производстве резины. Акриловая кислота используется в виде сложного эфира при производстве полимеров (длинноцепочечных молекул), известных как акрилаты. Метакриловая кислота служит сложным эфиром и полимеризуется с образованием люцита. Олеиновая кислота используется в производстве мыла, моющих средств и текстильных изделий.
таблеток аспирина.
© Джеймс Стюарт Гриффит / Shutterstock.comНоменклатура карбоновых кислот и их солей
Название карбоновой кислоты по ИЮПАК происходит от названия самой длинной углеродной цепи, содержащей карбоксильную группу, путем удаления последнего -е из название исходного алкана и добавление суффикса -oic, за которым следует слово «кислота». Цепь пронумерована, начиная с углерода карбоксильной группы. Поскольку считается, что углерод карбоксильной группы представляет собой углерод 1, нет необходимости давать ему номер.Например, соединение CH 3 CH 2 COOH имеет три атома углерода и называется пропановой кислотой, от пропана, названия трехуглеродной цепи, с -ойной кислотой, суффиксом для этого класса соединений, добавленным . Если карбоновая кислота содержит двойную связь углерод-углерод, окончание меняется с -ановой кислоты на -еноевую кислоту, чтобы указать на наличие двойной связи, и число используется для обозначения местоположения двойной связи.
Большинство простых карбоновых кислот, вместо того, чтобы называться их названиями IUPAC, чаще упоминаются общими названиями, которые старше их систематических названий.Большинство простых карбоновых кислот изначально были выделены из биологических источников; поскольку их структурные формулы часто были неизвестны во время изоляции, им давали имена, которые обычно происходили от названий источников. Например, CH 3 CH 2 CH 2 COOH, масляная кислота, впервые полученная из масла, была названа в честь латинского butyrum , что означает «масло». Кислоты, содержащие нечетное число атомов углерода больше девяти, обычно не имеют общих названий.Причина в том, что длинноцепочечные карбоновые кислоты были первоначально выделены из жиров (которые представляют собой сложные эфиры карбоновых кислот), и, как правило, эти жиры содержат карбоновые кислоты только с четным числом атомов углерода (потому что процесс, с помощью которого живые организмы синтезируют такие жирные кислоты, вызывает молекулы вместе в двухуглеродные части).
Например, CH 3 CH 2 CH 2 COOH, масляная кислота, впервые полученная из масла, была названа в честь латинского butyrum , что означает «масло». Кислоты, содержащие нечетное число атомов углерода больше девяти, обычно не имеют общих названий.Причина в том, что длинноцепочечные карбоновые кислоты были первоначально выделены из жиров (которые представляют собой сложные эфиры карбоновых кислот), и, как правило, эти жиры содержат карбоновые кислоты только с четным числом атомов углерода (потому что процесс, с помощью которого живые организмы синтезируют такие жирные кислоты, вызывает молекулы вместе в двухуглеродные части).
При использовании общепринятых названий заместители в углеводородной цепи обозначаются греческими буквами, а не числами, и счет начинается не с углерода карбоксильной группы, а с соседнего углерода.Например, общее название следующего соединения γ-аминомасляной кислоты, сокращенно ГАМК. Его название по ИЮПАК — 4-аминобутановая кислота. ГАМК является тормозным нейромедиатором в центральной нервной системе человека.
Соли карбоновых кислот имеют такое же название, как и соли неорганических соединений; сначала называют катион, а затем анион, как в хлориде натрия. Для карбоновых кислот название аниона получено путем замены оканчивающейся -oic acid в названии IUPAC или -ic acid в общепринятом названии на -ate.Некоторыми примерами являются ацетат натрия, CH 3 COONa; формиат аммония, HCOONH 4 ; и бутаноат калия (бутират калия), CH 3 CH 2 CH 2 COOK.
Номенклатура карбоновых кислот — Химия LibreTexts
Система номенклатуры ИЮПАК присваивает этим классам характерный суффикс. Окончание –e удаляется из названия родительской цепи и заменяется на –ановая кислота . Поскольку группа карбоновой кислоты всегда должна находиться на конце углеродной цепи, ей всегда дается позиция №1 в нумерации, и нет необходимости включать ее в название.
Многие карбоновые кислоты называются общими названиями. Эти названия были выбраны химиками, чтобы обычно описывать источник, где находится соединение. В обычных названиях альдегидов атомы углерода рядом с карбоксильной группой часто обозначаются греческими буквами. Атом, смежный с карбонильной функцией, — это альфа, следующий удаляемый атом — бета и так далее.
| Формула | Общее название | Источник | Название ИЮПАК | Точка плавления | Температура кипения |
|---|---|---|---|---|---|
| HCO 2 H | муравьиная кислота | муравьев (L.formica) | метановая кислота | 8,4 ºC | 101 ºC |
| CH 3 CO 2 H | уксусная кислота | уксус (L. ацетум) | этановая кислота | 16,6 ºC | 118 ºC |
| CH 3 CH 2 CO 2 H | пропионовая кислота | молоко (Gk. Protus prion) | пропановая кислота | -20.8 ºC | 141 ºC |
| Канал 3 (Канал 2 ) 2 CO 2 H | масляная кислота | сливочное масло (L. butyrum) | бутановая кислота | -5,5 ºC | 164 ºC |
| Канал 3 (Канал 2 ) 3 CO 2 H | валериановая кислота | корень валерианы | пентановая кислота | -34,5 ºC | 186 ºC |
| Канал 3 (Канал 2 ) 4 CO 2 H | капроновая кислота | коз (L. каперсы) каперсы) | гексановая кислота | -4,0 ºC | 205 ºC |
| Канал 3 (Канал 2 ) 5 CO 2 H | энантовая кислота | лозы (греч. Oenanthe) | гептановая кислота | -7,5 ºC | 223 ºC |
| Канал 3 (Канал 2 ) 6 CO 2 H | каприловая кислота | козы (L. caper) | октановая кислота | 16.3 ºC | 239 ºC |
| Канал 3 (Канал 2 ) 7 CO 2 H | пеларгоновая кислота | пеларгония (трава) | нонановая кислота | 12,0 ºC | 253 ºC |
| Канал 3 (Канал 2 ) 8 CO 2 H | каприновая кислота | козы (L. caper) | декановая кислота | 31,0 ºC | 219 ºC |
Пример (общие имена выделены красным)
Обозначение карбоксильных групп, добавленных к кольцу
Когда к кольцу добавляется карбоксильная группа, к названию циклического соединения добавляется суффикс -карбоновая кислота .Углероду кольца, присоединенному к карбоксильной группе, присваивается номер местоположения №1.
Обозначение карбоксилатов
Соли карбоновых кислот именуются путем написания названия катиона, за которым следует название кислоты с окончанием –ic acid , замененным на окончание –ate . Это верно как для системы номенклатуры ИЮПАК, так и для общей системы номенклатуры.
Обозначение карбоновых кислот, содержащих другие функциональные группы
Карбоновые кислоты имеют наивысший приоритет по номенклатуре системой IUPAC. Это означает, что карбоксильной группе дается наименьший возможный номер местоположения и включен соответствующий суффикс номенклатуры. В случае молекул, содержащих функциональные группы карбоновой кислоты и спирта, ОН называют гидроксильным заместителем. Однако обычно удаляют -1 в гидроксиле.
Это означает, что карбоксильной группе дается наименьший возможный номер местоположения и включен соответствующий суффикс номенклатуры. В случае молекул, содержащих функциональные группы карбоновой кислоты и спирта, ОН называют гидроксильным заместителем. Однако обычно удаляют -1 в гидроксиле.
В случае молекул, содержащих карбоновую кислоту и функциональные группы альдегидов и / или кетонов, карбонил называется «оксо» заместителем.
В случае молекул, содержащих карбоновую кислоту и аминогруппу, амин называют «амино» заместителем.
Когда карбоновые кислоты входят в состав алкена, соблюдается следующий порядок:
(номер расположения алкена) — (название префикса для самой длинной углеродной цепи минус окончание -ан) — (окончание -еновая кислота указывает на присутствие алкена и карбоновой кислоты)
Помните, что карбоновая кислота имеет приоритет, поэтому она должна получить наименьший возможный номер местоположения. Также помните, что при необходимости необходимо указать номенклатуру цис / транс или E / Z для алкена.
Название дикарбоновых кислот
Для дикарбоновых кислот номера положений обеих карбоксильных групп опущены, поскольку ожидается, что обе функциональные группы занимают концы родительской цепи. Окончание –диовая кислота добавляется к концу родительской цепи.
Reach Zinc — Угольная кислота, соль цинка, основная (EC 257-467-0)
Угольная кислота, соль цинка, основная (EC 257-467-0)
Описание / характеристики вещества
- Название и другие идентификаторы вещества:
Вещество Углеродная кислота, соль цинка, основная является монокомпонентным веществом (происхождение: неорганическое)
Используется следующее общественное название: карбонат цинка основной
| Номер ЕС: | 257-467-0 |
| Название ЕС: | Угольная кислота, соль цинка, основная |
| Номер CAS (инвентарь ЕС): | 51839-25-9 |
| Название ИЮПАК: | гидроксикарбонат цинка |
| Химическая формула: | Zn (x / 2 + y) (OH) x (CO 3 ) y |
| Диапазон молекулярной массы: | 99,3947 — 125. 4179 4179 |
- Состав вещества
Название: Угольная кислота, соль цинка, основная
Степень чистоты:> 80 — <100% (по массе)
| Составляющая | Типичная концентрация | Диапазон концентраций | Примечания |
Угольная кислота, соль цинка, основная EC No.: 257-467-0 | 98,1% (мас.) | > 80 — <100% (мас. / Мас.) |
| Примеси | Типичная концентрация | Диапазон концентраций | Примечания |
Оксид цинка EC No.: 215-222-5 | ок. 0,5% (мас. / Мас.) | > = 0 — <20% (мас. / Мас.) | |
Сульфат натрия Номер ЕС: 231-820-9 | 0,8% (мас.) | > 2 — <15% (мас. / Мас.) | Если изготовлено из сульфата цинка |
Хлорид натрия Номер ЕС: 231-820-9 | 0.8% (мас. / Мас.) | 0-2% (по массе) | При изготовлении из хлорида цинка |
- Классификация
Загрузите информацию о классификации из документа внизу страницы. Углекислота, соль цинка, основание были самоклассифицированы в положениях DSD 67/538 / EC и CLP 1272/2008 / EEC.
В этом документе упоминаются ТОЛЬКО конечные точки, по которым классифицируется вещество.
(Размер: 0,02 МБ)
|
Пищевая сода — сильное лекарство
Бикарбонат натрия, широко известный как пищевая сода, секретируется поджелудочной железой и помогает пищеварению. Он помогает нейтрализовать желудочную кислоту, которая образуется в процессе пищеварения, и помогает в расщеплении определенных ферментов. Уровень бикарбоната натрия в организме не должен быть ни слишком низким, ни слишком высоким, чтобы пищеварение функционировало нормально, а пищеварительный тракт оставался здоровым.
Он помогает нейтрализовать желудочную кислоту, которая образуется в процессе пищеварения, и помогает в расщеплении определенных ферментов. Уровень бикарбоната натрия в организме не должен быть ни слишком низким, ни слишком высоким, чтобы пищеварение функционировало нормально, а пищеварительный тракт оставался здоровым.
Бикарбонат натрия — одно из лучших лекарств в природе. Компания Arm & Hammer начала продавать его в 1846 году, а в 1926 году выпустила буклет о том, как использовать его в качестве лекарства.Возможно, это самое полезное вещество, о котором мы знаем — существуют книги и веб-сайты, на которых рассказывается о сотнях распространенных и невероятно разнообразных применений. Но прежде чем мы рассмотрим некоторые способы использования пищевой соды, давайте сначала разберемся, что это такое.
Пищевая сода (или бикарбонат натрия) — это мононатриевая соль угольной кислоты, которая образует ионы натрия и бикарбоната. Это образование ионов увеличивает содержание бикарбоната в плазме и буферизует избыточную концентрацию ионов водорода, что приводит к повышению pH крови.
Он превращается в углекислый газ (CO2), когда достигает желудочного сока. Вы можете поэкспериментировать, выдавив свежий лимон на немного пищевой соды — вы сразу увидите, как он пузырится и превращается в углекислый газ.
Бикарбонат натрия, или, скорее, углекислый газ, является ключом к кислороду в нашем организме. Кислород без углекислого газа невероятно опасен, даже смертельно опасен. Таким образом, углекислый газ на самом деле не является отходом; врачи любят думать об этом как об отходах обмена веществ, но когда мы тренируемся, мы на самом деле вырабатываем много углекислого газа, который очень полезен и полезен, и именно поэтому упражнения очень полезны.
Чем больше у нас углекислого газа, тем больше расширяются кровеносные сосуды, увеличивается кровоток и больше кислорода доставляется к различным частям тела. Если мы не обращаем внимания на свое дыхание, мы можем избавиться от слишком большого количества углекислого газа. Затем уровни в крови снижаются, и кровеносные сосуды сужаются, что затрудняет доставку кислорода ко всем тканям в одинаковой концентрации.
Затем уровни в крови снижаются, и кровеносные сосуды сужаются, что затрудняет доставку кислорода ко всем тканям в одинаковой концентрации.
Двуокись углерода также очень важна для митохондрий.Они производят углекислый газ, поэтому хороший уровень углекислого газа является признаком здоровых митохондрий.
Итак, когда мы берем дополнительный бикарбонат натрия, который затем превращается в углекислый газ, мы почти мгновенно увеличиваем доставку кислорода к клеткам. Это фундаментальный вопрос при лечении любого заболевания.
А бикарбонат натрия — буфер в крови, помогающий контролировать уровень pH, что также имеет решающее значение для нашего здоровья. В экстренных случаях врачи даже вводят бикарбонат натрия внутривенно в качестве жизненно необходимого лекарства для уравновешивания уровней pH, если кровь пациента становится слишком кислой.
Пищевая сода может помочь излечить симптомы кислотного рефлюкса (ГЭРБ) почти мгновенно, нейтрализуя кислоту, которая течет вверх. При приеме бикарбоната натрия практически сразу становится заметно, что pH мочи изменяется и становится более щелочным.
Пищевая сода также может помочь в процессе детоксикации от химической токсичности, тяжелых металлов и радиации. При лечении рака бикарбонат натрия является идеальным лекарством, потому что он увеличивает содержание кислорода и углекислого газа, а раковые клетки не любят кислород.
Также было показано, что прием пищевой соды помогает снизить утомляемость и повысить работоспособность. Некоторые исследования даже показали, что ежедневная доза пищевой соды может помочь уменьшить разрушительное воспаление при аутоиммунных заболеваниях, таких как ревматоидный артрит.
Единственное, к чему вам нужно проявлять осторожность, — это принимать слишком много бикарбоната натрия, который может увеличить потребление соли, что у некоторых людей может вызвать проблемы. Слишком много бикарбоната натрия снижает уровень калия.
Самый простой и эффективный способ принимать бикарбонат натрия — это положить чайную ложку пищевой соды в стакан воды и добавить немного свежевыжатого лимонного сока. Вы просто пьете его два или три раза в день.
Вы просто пьете его два или три раза в день.
Ученые используют шкалу pH для измерения кислотности раствора. Шкала идет от 0 до 14, значения ниже 7 указывают на кислый раствор; значения выше 7 указывают на щелочной (или основной) раствор; а нейтральные растворы, такие как чистая вода, имеют значение pH 7.Пищевая сода — это щелочное или щелочное вещество.
Это означает, что когда мы растворяем пищевую соду в воде, она образует щелочной раствор. Например, 0,1-молярный раствор пищевой соды имеет pH около 8,3. Лимонный сок содержит лимонную кислоту и имеет pH около 3. Поэтому добавление пищевой соды к лимонному соку повысит pH, чтобы получить более нейтральный раствор. И вкуснее!
Пищевая сода может быть очень полезна не только внутри, но и снаружи.Например, наша кожа обычно имеет слабокислый pH около 5,7. Основы, такие как пищевая сода, увеличивают и уравновешивают pH, что может помочь при многих кожных заболеваниях и сделать кожу более здоровой.
Он также полезен для наших зубов благодаря своим антибактериальным свойствам и способности удалять зубной налет, не разрушая зубную эмаль. Чистка зубов небольшим количеством пищевой соды может помочь удалить поверхностные пятна с зубов.
Вы даже можете использовать пищевую соду в качестве дезодоранта — даже небольшое количество порошка более эффективно и намного безопаснее для вашего тела, чем самые популярные дезодоранты и спреи.
Пищевая сода также может быть очень эффективной при лечении укусов насекомых — нанесение пищевой соды и водной пасты на место укуса может быстро уменьшить зуд.
Это всего лишь несколько примеров, у пищевой соды гораздо больше преимуществ. Вы можете выполнить быстрый поиск на YouTube, и вы найдете видео, демонстрирующие десятки других полезных применений пищевой соды.
Покупая пищевую соду, просто убедитесь, что вы покупаете пищевой продукт без алюминия, чтобы вы наносили его в чистом виде в свое тело или на него.
•••
Айда Эрсой — директор по питанию и фитнесу в The Diet Doc Hawaii.


 Кислород
Кислород Калия
Калия Алмаз
Алмаз
 В этом упражнении учащиеся изучают данные о температуре и плотности, чтобы определить …
В этом упражнении учащиеся изучают данные о температуре и плотности, чтобы определить … 04 КБ]
04 КБ] Студенты об …
Студенты об … 00 КБ]
00 КБ] Он предоставляет студентам основные такс …
Он предоставляет студентам основные такс …