Сода — химическая формула пищевой, кальцинированной
Пищевая сода, или, как её называют иначе, столовая, питьевая, чайная, знакома, пожалуй, всем: её используют для придания тесту пышности и рыхлости, для очищения посуды и кафеля, для уничтожения вредителей в саду и огороде, для устранения огрубевшей кожи со стоп и отбеливания зубов – перечислять можно долго, однако при всём этом мало кто задумывается о химических свойствах порошка или о том, какая формула у соды. И совершенно зря, поскольку знание природы вещества и сведений относительно его физических и химических качеств зачастую позволяет расширить кругозор относительно возможностей и сфер его использования.
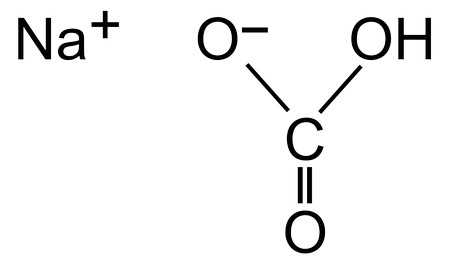
К тому же, далеко не всем известно, что сода имеет несколько разновидностей, которые отличаются друг от друга не только по своим характеристикам, но и по степени безопасности для здоровья человека. Вот как раз об этом мы и поговорим.
Содержание статьи
Определение и формула соды
- Пищевая (чайная, питьевая, столовая) – наиболее распространённый вариант, с химической точки зрения именуемый как бикарбонат натрия, гидрокарбонат натрия, натрий двууглекислый или пищевая добавка Е500. Вещество представляет собой мелкокристаллический порошок, который характеризуется белым цветом, слабовыраженным запахом и наличием солёно-горького вкуса. В науке пищевая сода обозначается записью NaHCO₃
- Кальцинированная сода (техническая, стиральная) – вещество, получившее своё второе название по причине его использования в качестве средства для стирки белья и одежды. Карбонат натрия (так именуют его химики) внешне очень подобен пищевой соде, однако путать два этих вещества не стоит: кальцинированная сода является щёлочью сильного действия, которая при неправильном и неосторожном обращении может вызывать раздражения и ожоги слизистых и кожных покровов. Химическая формула карбоната натрия выглядит следующим образом: Na₂СО₃
- Каустическая сода (каустик) – известна как едкая щёлочь, едкий натр, имеет и другое название – гидрокссид натрия. Вещество обладает сильно выраженными щелочными характеристиками, имеет вид твёрдых гранул белого цвета, у которых отсутствует какой-либо запах. Несмотря на то, что едкий натр зарекомендовал себя как эффективное чистящее средство, использовать его следует осторожно: высокая концентрация гидроксида натрия разъедает соединения органического происхождения и вызывает ожоги кожи. В области химии каустическая сода обозначается формулой NaOH
Таким образом, принципиальная разница между тремя названными разновидностями заключается в степени щелочной реакции, которую они способны создавать, и, соответственно, в сферах деятельности человека, где они могут использоваться.
Пищевая сода
Пожалуй, в каждом доме есть картонная коробочка, дизайн которой не меняется вот уже много лет. В ней содержится белый мелкокристаллический порошок, практически не обладающий запахом, но отличающийся немного горьковатым вкусом, – речь идёт о пищевой соде, которая используется людьми в различных целях и становится настоящим помощником по удалению загрязнений, уничтожению вредителей, лечению различных заболеваний.
Первая сода, полученная искусственным путём, появилась лишь в XVIII веке, благодаря опытам французского учёного Анри Дюамеля де Монсо, который с этой целью использовал метод кристаллизации. Промышленным способом содовый порошок стали производить сначала в России: этому послужило открытие химика Э. Лаксмана, выяснившего, что при спекании древесного угля и смеси сульфата натрия можно получить натрий двууглекислый. Однако широкого распространения данная методика всё же не получила, и со временем, начиная с 1791 года, содовый порошок стали производить посредством сплавления древесного угля, смеси сульфата натрия и мела. Такая технология была открыта французским учёным Н. Лебманом. С 1838-1840-х г был предложен аммиачный метод, который отличался не только экономичностью, но и возможностью получать соду более высокого качества. С тех пор и до настоящего времени натрий двууглекислый получают именно этим способом.
Гидрокарбонат натрия характеризуется рядом определённых химических свойств: при нагревании до 60 С он начинает плавится, в результате чего распадается на карбонат натрия, углекислый газ и воду. Именно таким образом из натрия двууглекислого получают другую разновидность – кальцинированную соду. Вещество не растворяется в ацетоне и спирте, однако довольно хорошо растворяется в тёплой или горячей воде. При взаимодействии с ней образуется раствор, обладающий слабощелочной средой, в связи с чем соду, которая по своей сути является натриевой солью угольной кислоты, нередко называют щёлочью. рН воды, в которой растворяется бикарбонат натрия, равен 8-9, что и указывает на не агрессивность получаемого содержимого. Нередко такое вещество используют в качестве лечебного средства, при помощи которого понижают повышенную кислотность и борются с изжогой, грибковыми заболеваниями, неприятным запахом изо рта.
Химическая реакция также происходит в результате соединения натрия двууглекислого с кислотами и, в частности, с уксусом. При взаимодействии этих двух компонентов пищевая сода начинает выделять углекислый газ и воду, вследствие чего можно наблюдать специфическое «шипение». Именно такую реакцию мы получаем на кухне при замешивании теста: высвобождение углекислого газа в результате взаимодействия натрия двууглекислого и уксуса способствует «росту» пирога и приданию ему рыхлости и воздушности.
Интересное видео: Химическая реакция уксуса с содой красиво
Однако применяется содовый порошок не только в сфере кулинарии: зачастую он «спасает» тогда, когда под рукой не оказывается чистящих средств, но есть загрязнения, которые нужно срочно устранить. При помощи соды можно избавиться от многих пятен на поверхности стола или холодильника, вымыть посуду и кафель. За счёт безопасности для здоровья, пищевую соду можно применять в качестве очищающего средства для мытья именно детской посуды, ведь ни одна промышленная жидкость не может похвастаться таким важным критерием. Называть качества гидрокарбоната натрия, которые могут быть полезными для человека, можно довольно долго, но об этом мы поговорим несколько позже.
Кальцинированная, или бельевая, техническая сода
Ещё одна разновидность соды – карбонат натрия, или кристаллическая, бельевая, стиральная сода. Своё второе название она получила в соответствии с той сферой, в которой применяется: вещество отлично устраняет различные загрязнения, в виду чего его иногда используют вместо стирального порошка.
Формула кальцинированной соды выражается записью Na2CO3. Вещество выпускают в двух формах: в виде крупных кристаллов (тип А) и в виде порошка (тип В). В зависимости от критерия принадлежности к одной из марок, карбонат натрия применяется в различных областях.
Кальцинированная сода характеризуется белым цветом и отсутствием запаха, она хорошо растворяется в воде и довольно легко впитывает запахи и влагу, превращаясь при этом в твёрдое вещество. Карбонат натрия является сильной щёлочью (рН 11), поэтому обращаться с ним нужно крайне осторожно.
В промышленности кальцинированную соду получают несколькими методами:
- из нефелинового сырья;
- из соды, добываемой в природе;
- аммиачно-хлоридным способом;
- посредством карбонизации каустической соды.
Интересное видео: Технологии производства соды
Естественным путём соду добывают из золы морских водорослей, некоторых озёр, а также в подземных солях в виде минералов термонатрита, натрона, трона, нахколита. Странами, богатыми данным веществом, являются США, Россия, Канада, Мексика, ЮАР, Кения. Из пластиковых металлов соду получают посредством прокаливания, а из озёр – при помощи кристаллизации.
Самый распространённый метод получения соды – аммиачно-хлоридный. Данная технология изготовления позволяет производить вещество высокого качества, но при минимуме затрат. В условиях низких температур раствор хлористого натрия подвергается насыщению двуокисью углеводорода и аммиаком. Вследствие этого процесса выпадает осадок натрия двууглекислого, который проходит фильтрацию и дальнейшее кальцинирование. Именно так и получается кальцинированная сода.
Каустическая сода
Наиболее сильной щёлочью из всех разновидностей соды выступает едкий натр, или, иначе говоря, каустик, каустическая сода. В области химии данное вещество носит название гидроксид натрия и имеет формулу NaOH. При высоких концентрациях каустическая сода способна разъедать соединения органического происхождения, вызывать ожоги и сильные раздражения, она обладает и рядом других опасных свойств, в связи с чем её транспортируют исключительно в водонепроницаемых мешках.
Внешне гидроксид натрия представляет собой твёрдое вещество белого цвета, у которого отсутствует какой-либо запах. Каустик прекрасно растворяется в спиртовых растворах и воде, но не взаимодействует с эфирами и ацетоном. Кроме того, едкий натр вступает в реакцию с оловом, цинком, свинцом, алюминием, а с аммиаком – воспламеняется. Каустическая сода не горит, однако кипит и плавится при температуре, составляющей не менее 390 С. Вещество обладает способностью к нейтрализации загрязнений и жиров, в связи с чем оправдано его применение в качестве очищающего средства.
В промышленности гидроксид натрия производят, начиная с середины XVIII века. Вплоть до ХХ столетия при изготовлении едкого натра применялась аммиачная и известковая технология получения. Впоследствии был открыт электрохимический метод, который является приоритетным до сегодняшнего дня. Ведущие позиции по производству каустической соды сейчас занимают такие страны, как США, Китай, а также многие европейские государства.
Общие химические свойства соды
Все три разновидности соды относятся к классу натриевых солей угольной кислоты. Они обладают щелочными характеристиками при взаимодействии с водой, но уровень рН при этом отличается, в связи с чем только пищевая сода может применяться в домашней кулинарии и народной медицине, поскольку именно гидрокарбонат натрия имеет самый низкий водородный показатель. За счёт того, что любой вид соды можно по праву назвать щёлочью, использовать каждое из веществ допускается с целью устранения жира и загрязнений: гидрокарбонат натрия, а также кристаллическая и каустическая сода прекрасно справляются с данной задачей.
Сходство химических свойств заключается не только в принадлежности к солям, имеющим щелочные качества, но и в способности достаточно хорошо растворяться в воде. Кроме того, и пищевая, и кальцинированная сода не взаимодействуют со спиртовыми растворами, то есть не могут растворяться в них, чем одновременно отличаются от едкого натра.
От степени агрессивности веществ зависит место их применения: если гидрокарбонат натрия активно используется в быту, кулинарии и при лечении различных заболеваний, то сфера, в которой просто необходимо участие карбоната и гидроксида натрия, – это промышленность.
Контактировать с кальцинированной содой и особенно каустиком следует очень осторожно: оба вещества, за счёт высокого уровня рН, являются сильными раздражителями, которые могут спровоцировать ожоги слизистой и кожных покровов и даже вызвать интоксикацию организма.
Применение
Самым распространённым вариантом в домашнем обиходе является гидрокарбонат натрия. Чаще всего его используют в кондитерском деле, поскольку при взаимодействии пищевой соды и уксуса происходит выделение углекислого газа, придающего выпечке пышную и рыхлую структуру. К слову сказать, именно натрий двууглекислый выступает основным компонентом привычного всем разрыхлителя, который в кулинарии зачастую применяется вместо самой пищевой соды. Однако только этим важность компонента на кухне не ограничивается. Некоторые хозяйки идут на уловку и добавляют данное вещество в омлет, за счёт чего он получается не только вкусным, но и воздушным. Другие применяют содовый порошок для размягчения слишком жёсткого мяса или ускорения процесса приготовления гороха, фасоли. При помощи пищевой соды допускается промывание фруктов и овощей: это позволяет уничтожить нитраты, а заодно – продлить срок их хранения. Если добавить небольшое количество соды в кастрюлю, можно предотвратить прилипание круп к её дну или свёртывание молока в процессе его кипячения.
Видео — 20 НЕОБЫЧНЫХ ПРИМЕНЕНИЙ СОДЫ | ЛАЙФХАКИ С СОДОЙ
Ещё одно, несомненно, важное достоинство гидрокарбоната натрия – наличие у данного вещества целого спектра лечебных свойств: противогрибкового, антисептического, антибактериального, дезинфицирующего, смягчающего. Чаще всего пищевую соду используют для нейтрализации повышенной кислотности в организме и последующего восстановления водного баланса.
Натрий двууглекислый становится настоящим помощником при:
- боли в горле во время простудных заболеваний;
- изжоге;
- ожогах, раздражениях, вызванных укусами насекомых;
- молочнице, грибковых поражениях стоп;
- отбеливании зубной эмали;
- инфекционных заболеваниях полости рта;
- интоксикации, в том числе и алкогольной;
- обезвоживании организма;
- остеохондрозе, болях в суставах, подагре;
- аритмии и повышенном АД;
- морской болезни;
- фурункулах, натоптышах, мозолях;
- гипергидрозе;
- похудении;
- онкологических заболеваниях (согласно одной из теорий).
В быту актуальным становится абсолютно любой вид соды, однако контактировать с карбонатом или гидроксидом натрия следует очень осторожно, в связи с чем перед началом работы рекомендуется надевать резиновые перчатки. Средства достаточно эффективно справляются с различными загрязнениями, однако для удаления давнишних пятен рекомендуется использовать кальцинированную соду, которая также подойдёт для освежения деталей стиральной машины и уничтожения с них накипи.
При помощи пищевой соды можно до блеска вычистить раковину, столешницу, сантехнику, ковры, посуду, при этом необходимо помнить, что изделия из алюминия отмывать с применением даже неагрессивного гидрокарбоната натрия нельзя, так как они покрыты специальной оксидной плёнкой, предохраняющей металл от окисления и проникновения в пищу вредных компонентов. Однако пищевая сода станет находкой для очищения других деликатных поверхностей: линолеума, мрамора, кафеля. Её использование актуально в том случае, если нужно избавиться от неприятного запаха, например, в холодильнике. А вот для отбеливания белья и устранения пятен с одежды чаще всего применяют кальцинированную соду, поскольку именно карбонат натрия с подобной задачей справляется гораздо лучше.
В промышленности широкой популярностью пользуется каустическая сода. Она принимает участие в следующих отраслях:
- целлюлозно-бумажная: производство искусственных волокон, картона и бумаги;
- строительство: укрепление фундаментов, изготовление газобетона;
- текстиль: отбеливание тканей и регенерация резины;
- химическая промышленность: очищение нефтепродуктов, производство масляной продукции;
- военная отрасль: применение в противогазе с целью устранения углекислого газа из воздуха, нейтрализация опасных газов.
Также каустическая сода используется практически на каждом предприятии, поскольку выполняет роль средства, очищающего промышленное оборудование и инвентарь от жира и загрязнений. Вместе с тем, едкий натр нередко выступает компонентом, входящим в состав стиральных порошков, мыла, косметической продукции.
Техника безопасности
Гидрокарбонат натрия при взаимодействии с водой в небольших концентрациях является нетоксичным для здоровья человека веществом. Однако это совершенно не говорит о том, что содовый порошок безопасен. По степени пожаро — и взрывоопасности он относится к 3-му классу. Отдельно следует рассматривать ограничения присутствия натрия двууглекислого в воздухе: 5 мг на куб.метр. Хранить вещество необходимо в недоступном для детей и животных месте.
Работая с карбонатом натрия, в целях предотвращения ожогов кожных покровов, необходимо надевать резиновые перчатки, что же касается каустической соды, то для контактирования с ней одних перчаток, как правило, недостаточно: кроме них, применяется маска, халат, а также специальные очки.
Соду можно по праву назвать универсальным средством, которое имеет довольно широкую популярность, за счёт своего применения в различных сферах деятельности. Однако одновременно с этим не стоит умалять её способность оказывать негативное воздействие на организм человека, в связи с чем рекомендуется помнить о мерах предосторожности, а также чётко соблюдать правильные пропорции при выполнении лечебных и бытовых растворов.
posode.ru
Химическая формула Физические свойства
Спецификация
Область применения соды кальцинированной Сода кальцинированная марок А и Б используется в производстве стекла всех видов, в том числе: хрусталя, оптического и медицинского стекла, стеклоблоков, пеностекла, силиката натрия растворимого, керамических плиток, компонента фритт для глазурей; черной и цветной металлургии: для производства свинца, цинка, вольфрама, стронция, хрома, для десульфуризации и дефосфации чугуна, в очистке отходящих газов, для нейтрализации сред.Для производства электровакуумного стекла используется сода кальцинированная марки А высшего сорта со строго нормированным гранулометрическим составом.Сода кальцинированная марки Б применяется в химической промышленности для производства синтетических моющих средств и жирных кислот, при очистке рассолов, в производстве фосфорных, хромовых, бариевых, натриевых солей как карбонатсодержащее сырье, в производстве глицеринов, аллилового спирта; целлюлозно-бумажной, анилино-красочной и лакокрасочной и нефтяной промышленностях. Упаковка, транспортирование, хранение Соду кальцинированную упаковывают в бумажные мешки массой 50 кг, мягкие специализированные контейнеры разового использования массой 800 кг (марка А) и 500 кг (марка Б).Соду кальцинированную транспортируют насыпью – в содовозах и хопперах, упакованную в мягкие специализированные контейнеры перевозят по железной дороге в полувагонах и крытых вагонах.Соду кальцинированную, упакованную в мешки, перевозят любым видом транспорта, предохраняя продукт от попадания влаги.Гарантийный срок хранения соды кальцинированной марки А – 3 мес., марки Б – 6 мес., упакованной в мягкие специализированные контейнеры – 5 лет с даты изготовления. Сода кальцинированная – гигроскопический продукт, который при хранении на открытом воздухе слеживается, а на воздухе поглощает углекислоту и влагу. Применяется пищевой и химической промышленности. Сода кальцинированная марок «А» применяется в производстве стекла всех видов. Марка «Б» — только в химической индустрии. Химическая формула соды кальцинированной – Na 2 CO 3 . Безопасность продукта: сода кальцинированная, взрыво — и пожаробезопасна, по степени влияния на организм человека относится к веществам 3-го класса опасности. Соду кальцинированную техническую марки А упаковывают в мягкую тару разового использования, в пятислойные бумажные мешки. Упакованную в мешки соду, можно транспортировать любыми видами транспорта, только в закрытых транспортных средствах. Продукт марки «Б» транспортируется в специальным транспортом насыпью или крытых вагонах. Мягкие контейнеры перевозятся только в крытых вагонах. Техническую кальцинированную соду хранят в специальных бункерах, складских помещениях, защищая от воздействия влаги. Сода кальцинированная марки «А» хранится – 3 месяца, марки «Б» – 6 месяцев, а сода которая упакованная в мягкую тару – 5 лет. Основные меры безопасности в работе с кальцинированной содой: вдыхание пыли вызывает раздражение дыхательных путей, коньюктивит. Концентрированный раствор, который случайно попадет в глаза, может привести к неврозу, ожогу, помутнению роговицы – при долгой работе с раствором. Раствор очень ед | ||||||
otzi.ru
Кальцинированная сода — DCS
Кальцинированная сода используется в растворах на водяной основе как источник ионов карбоната для осаждения ионов кальция, повышения pH, флокуляции растворов при забурке. Кальцинированная сода является общим названием для карбоната натрия (Na2CO3). Кальцинированная сода — слабое основание, которое растворимо в воде и при диссоциации образует ионы натрия (Na+), и ионы карбоната (CO32-) в растворе.
ОСНОВНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА
| Внешний вид | Белый порошок. | |
| Химическая формула | Na2CO3 | |
| Плотность | 2510 кг/м3 | |
| pH 1% раствора | 11.4 | |
| 51г/100мл пресной воды (при 30°С) |
ОБЛАСТЬ И СПОСОБ ПРИМЕНЕНИ
Кальцинированная сода используется в основном для уменьшения растворимого кальция в растворах на водной основе. Также использует для увеличения pH и флокуляции растворов при забурке. Ионы кальция присутствует в воде для приготовления раствора, они могут привести к флокуляции бурового раствора, что может привести к увеличению реологии, гелеобразования и водоотдачи. Концентрации при обработке раствора кальцинированной содой лежат в диапазоне от 0,25 до 2 фунт/баррель (от 0,7 до 5,7 кг/м3), в зависимости от концентрации онов кальция в растворе. Один фунт (0,45 кг) кальцинированной соды будет удалять 1,283 фунтов (0,58 кг), сульфата кальция (ангидрит). Обрабатывать раствор следует аккуратно, при избытке кальцинированной соды возникнет карбонатная флокуляция раствора. Карбонатные ионы превращаются в бикарбонатные ионы (HCO3—) когда pH раствора уменьшается ниже 11.3
Химическая реакция осаждения ионов кальция описывается следующей формулой:
Ca2+ + Na2CO3 -> CaCO3 + 2Na+ (9.7 < pH < 11.7)
Расчетная формула для уменьшения жесткости:
Кальцинированная сода (фунт / баррель) = Ca (мг/л) x 0.00093 x Fw
Где: Fw = Содержание воды при ретортном анализе (% воды/100)
ПРЕИМУЩЕСТВА
- Широкодоступный и дешевый источник ионов карбоната для осаждения ионов кальция при одновременном повышении рН
- Эффективно уменьшает концентрацию ионов кальция в растворах на водяной основе, даже при маленьких концентрациях.
- Эффективный флокулянт для забурки.
ОГРАНИЧЕНИЯ
- Увеличивает рН и не может быть использован для обработки раствора при загрязнениия цементом, или в растворах где нужен высокий рН, слабо растворим при высоком значении рН.
- Перенасыщение приводит к карбонатному загрязнению; даже незначительный избыток ионов карбоната может вызвать значительное увеличение ДНС, гелеобразования и водоотдачи.
ТОКСИЧНОСТЬ И ОБРАЩЕНИЕ
Кальцинированная сода прошла экологическую сертификацию и допущена к применению на территории РФ в качестве компонента буровых растворов..
Следует обращаться в соответствии с требованиями MSDS и общими требованиями к транспортировке, хранению и использованию промышленных химреагентов. Рекомендуется использовать средства индивидуальной защиты (очки, перчатки) и соблюдать правила личной гигиены.
Кальцинированную соду следует медленно вводить в систему. Нельзя мешать кальцинированную соду с другими хим веществами, особенно с кислотами, каустической содой или известью.
УПАКОВКА И ХРАНЕНИЕ
Кальцинированную соду упаковывают в 50- и 100 фунтов (22.7- и 45.4-кг), многослойные, бумажные мешки. Кальцинированная сода широкодоступный реагент и может поставляться в других упаковках. Хранить в сухом месте, вдали от кислот и воды.
dcs-alliance.com
Кальцинированная техническая сода: состав, формула, характеристики
Кальцинированная сода (натрия карбонат, натрий углекислый) – вещество белого цвета в виде кристаллов или порошка. Оно знакомо многим домохозяйкам как отличное средство для уборки в доме, особенно на кухне или в ванной. В те времена, когда большого выбора средств бытовой химии не было, этим порошком мыли посуду, проводили дезинфекцию предметов, выводили пятна на одежде, избавлялись от накипи.
 Даже такие агрессивные вещества как кислоты, щелочи являются полезными, если их правильно использовать
Даже такие агрессивные вещества как кислоты, щелочи являются полезными, если их правильно использоватьКарбонат натрия был известен людям с очень давних пор. Еще до нашей эры этот минерал находили в природных источниках и использовали в разных целях. Первые положительные опыты по получению кальцинированной соды при сжигании определенного вида морских водорослей были проведены в 18 веке. Промышленное производство этого вещества началось еще в 1787 году. Затем почти через 100 лет химик Эрнест Сольве в Бельгии открыл новый способ производства, который отличался своей простотой и меньшей затратностью. Этот метод используется для изготовления большей части углекислого натрия и по сей день.
Свойства вещества
Сода кальцинированная представляет собой бесцветный порошок без запаха, хорошо растворимый в воде, но не растворяемый в ацетоне, этиловом спирте. Растворимость в воде сильно зависит от ее температуры, чем она выше, тем большая концентрация образуется. Карбонат натрия характеризуется свойством поглощать водяные пары из воздуха, поэтому при хранении на открытом воздухе слеживается, образуя плотные комки. Именно из-за этого свойства хранить его требуется в плотно укупоренной таре, не пропускающей воздух.
Химическая формула углекислого натрия – Na2CO3. Он легко вступает в реакцию с кислотами с образованием углекислого газа и воды. При растворении в воде ее гидроксильная группа взаимодействует с натрием, в результате чего получается сильное основание – NaOH (едкий натр). Благодаря этому свойству, кристаллическая кальцинированная сода имеет славу хорошего чистящего средства.
При работе с этим средством стоит использовать защитные средства: перчатки, маску, очки. При попадании порошка или жидкости на кожу и слизистые можно получить химический ожог!
Способы получения
В современном мире имеется несколько методов синтеза кальцинированной соды. Самым экологичным из них является разработка минералов, в составе которых она содержится: натрон, трона, нахколит, термонатрит. Значимые месторождения этих веществ находятся в Соединенных Штатах Америки, Мексике, Канаде, африканских странах.
Первый промышленный способ получения углекислого натрия был запатентован французом Николя Лебланом. Он заключался в совместном плавлении сульфата натрия, карбоната кальция (мела) с древесным углем. В этой реакции образуются сульфид кальция, карбонат натрия. После завершения реакции полученный состав заливают водой, в котором сульфид кальция выпадает в осадок, а сода растворяется. Последующее выпаривание воды позволяет получить ее кристаллическую форму. На основании этого метода был построен завод, который производил около 100 килограммов кальцинированной соды в день.
Второй способ был предложен в Англии Хеммингом и Гаррисоном. Он заключается в пропускании через очищенную воду аммиака и углекислого газа с образованием гидрокарбоната аммония. К полученному веществу добавляли поваренную соль, что позволяло в реакции замещения получить гидрокарбонат натрия (пищевую соду), который с помощью нагревания превращался в карбонат натрия, воду и углекислый газ. Этот метод отличался некоторой сложностью и через некоторое время практически перестал использоваться.
 Сода является химически активной, но очень полезной и применяется повсеместно
Сода является химически активной, но очень полезной и применяется повсеместноТретий способ, который используется в современной промышленности и в наше время, был предложен и запатентован бельгийским химиком Сольве. Он немного отличается от метода англичан и заключается в пропускании аммиака, а затем углекислого газа через раствор хлорида натрия. В результате гидрокарбонат натрия при холодной температуре выпадает в осадок. Затем он подвергается фильтрованию и кальцинации при температуре 140−160 градусов. Плюсами этого способа является небольшая затрата энергии, достаточная экономичность и использование распространенных в природе веществ, таких как поваренная соль, мел или известняк, аммиак.
Существуют также другие методы получения кальцинированной соды, например, из содопоташных растворов, при переработке нефелинового сырья и в процессе электролиза воды и диоксида углерода с гидроксидом натрия. Эти способы имеют гораздо меньшее распространение из-за своей сложности или необходимости использования не слишком распространенных компонентов.
Небольшое количество карбоната натрия можно получить в домашних условиях. Для этого в нагретый раствор пищевой соды добавляют порошок извести или мела. После фильтрования получится раствор кальцинированной соды, который можно использовать для бытовых нужд.
Виды кальцинированной соды
Согласно технической документации, углекислый натрий выпускается в нашей стране в 2 видах: гранулированный (марка А) и порошкообразный (марка В). Различие этих форм кальцинированной соды прописано в государственных стандартах и зависит от цели ее дальнейшего использования. Кроме того, существует в каждой марке 3 сорта продукта: высший, первый и второй. Различие между этими веществами заключается в чистоте состава, его плотности, размере полученных частиц, массовых долях сульфатов, хлоридов, железа и нерастворимых остатков. Продукт категории А имеет срок хранения 3 месяца, категории В – 6 месяцев, кроме случаев упаковки в специальные контейнеры. В таком виде срок хранения карбоната натрия достигает 5 лет.
Вне зависимости от марки кальцинированной технической соды, согласно регламенту, она относится к 3 классу опасности (малоопасные вещества). Это означает, что воздействие этого вещества на окружающую природу не велико.
Применение в промышленности
Использование кальцинированной соды происходит на производстве большого количества продукции. В стекольной промышленности это вещество в зависимости от марки и сорта в больших количествах требуется для изготовления хрусталя, медицинских и оптических стеклянных изделий, строительных стеклоблоков. В металлургии оно нужно для получения чугуна, свинца, вольфрама, хрома. Химическая промышленность применяет карбонат натрия в изготовлении красок, пенопласта, средств бытовой химии, для пожаротушения. Производство текстиля использует соду для создания хлопчатобумажных тканей и шелка. Кроме того, данное вещество необходимо для производства резины, обработки кожи и изготовления кожзаменителей, мыловарения.
Такое широкое применение кальцинированной соды происходит благодаря ее дешевизне и доступности. Она может быть использована как составляющее вещество для химических реакций, а также в качестве катализатора процессов.
Домашние рецепты
В домашних условиях этот вид соды используется для смягчения жесткой воды. Для этого ее добавляют от 20 до 50 грамм (1,5-3,5 столовых ложки без горки) в расчете на 10 литров воды в зависимости от степени жесткости. В результате химической реакции соли кальция выпадут в виде осадка.
 Сода отлично удаляет жирные пятна, краску, старую грязь
Сода отлично удаляет жирные пятна, краску, старую грязьДля стирки и кипячения белья требуется от 20 до 100 грамм вещества на 10 литров воды. Если стирка происходит в стиральной машине, то соду в количестве примерно 50 грамм можно добавить непосредственно в барабан вместе с бельем. При ручной – ее разводят в воде вместе со стиральным порошком. При этом важно учитывать рекомендации для стирки одежды на бирках (некоторые ткани можно испортить), а также температуру воды. Она должна быть не ниже 50 градусов.
Для очистки сантехники, кафельной плитки и других сильно загрязненных поверхностей 30−50 грамм кальцинированной соды разводят в одном литре воды. Затем с помощью губки, смоченной в этом растворе, протирают нужное место. После смывают водой и протирают насухо. Для такого применения стоит пользоваться резиновыми перчатками, чтобы не получить раздражение кожи.
Для мытья посуды соду растворяют в теплой воде из расчета 30−50 грамм на 1 литр. Такой раствор удаляет загрязнения и жир с поверхности посуды. После него требуется тщательное полоскание всех предметов в проточной воде.
Для избавления от накипи в чайниках столовую ложку соды добавляют в воду, затем полученная жидкость доводится до кипения и выливается в канализацию. Чайник после такой обработки нужно тщательно промыть водой перед использованием по назначению. В стиральных машинах справиться с проявлениями жесткой воды можно 3−4 столовыми ложками кальцинированной соды. Для этого порошок засыпают в барабан и включают режим стирки при 90−95 градусов без белья.
При всех своих положительных качествах использование карбоната натрия не рекомендуется для следующих поверхностей:
- Деревянные.
- Кирпичные.
- Алюминиевые.
- Лакированные.
- Окрашенные.
- Стекловолоконные.
Это связано с сильной поверхностной активностью кальцинированной соды. Перечисленные выше поверхности неустойчивы к воздействию щелочной среды и могут быть испорчены.
Кальцинированная сода – агрессивное вещество! Ее нужно хранить в недоступных для детей и домашних животных местах. При попадании на кожу или слизистые оболочки порошка или концентрированного раствора нужно промыть пораженное место водой и немедленно обратиться за медицинской помощью.
sodalab.ru
