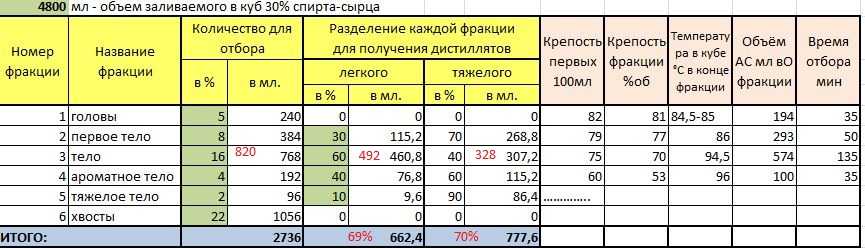
Сколько литров газа в 1 м3. Калькулятор перевода и таблицы
Главная » Недвижимость » МКД » Коммунальные услуги
Рубрика: Коммунальные услугиАвтор: Юрист сайта Антон Щербак
На первый взгляд посчитать сколько литров в кубе газа просто. Однако здесь нужно учитывать особенности газа как физического состояния вещества.
Предлагаем рассмотреть разные способы перевода литров в кубические метры для тех видов газообразных смесей, которые применяются в быту и в качестве топлива. Также у нас вы найдете простой онлайн-калькулятор перевода.
Содержание
- Онлайн калькулятор
- Соотношение литров и кубов
- Особенности перевода для сжиженного газа
- Где применяется сжиженный газ
- Особенности перевода объема для сжиженного газа
- Расчеты для метана
- Примеры расчета
Онлайн калькулятор
Для упрощения преобразования величин без постоянных вычислений существуют онлайн-калькулятор. Ничего сложного – просто вводится одно из количеств.
Ничего сложного – просто вводится одно из количеств.
По умолчанию калькулятор открывается для перевода литров. Перевести метры кубические в литры через данный калькулятор можно, если нажать на стрелки по центру.
Соотношение литров и кубов
Для понимания смысла перевода из л в м3 необходимо разобраться в терминах.
Работая с объемом, нужно понимать, сколько кубических сантиметров в кубическом метре и в литре. В 1 м3 1000000 (один миллион) кубических сантиметров. Литр представляет из себя куб со стороной 10 см. Поэтому 1 литр по-другому именуют дециметром в кубе.
Для газообразных, жидких и твердых тел объёмы переводятся в таких соотношениях:
- 1 куб газа равен 1000 литров. Соответственно, сколько литров в заданном количестве кубов можно вычислить, умножив количество кубов на 1000.
- 1 литр в свою очередь равняется 0,001 (одной тысячной) куба. Соответственно, перевести литры в м3 можно, разделив количество литров на 1000.

Ниже приводится таблица соотношений объемов.
Простой пример: 50 литров природного газа в м3 соответствуют 0,05 (пяти сотым).
При таком переводе не имеют значения топливные факторы. Не учитываются примеси и температура.
Особенности перевода для сжиженного газа
Где применяется сжиженный газ
Газ в современности широко используется в сжиженном виде. Сферы применения:
- Промышленное производство (оборудование для автоматизации производства)
- Электро- и теплоэнергетика
- Запасы, госрезервы. Запас необходим при интенсивном сезонном потреблении.
- Как замена для устаревших видов топлива, таких как бензин и дизель.
- Бытовое потребление – газовые плиты, отопление. Для бытового потребления обычно используется баллонный газ или организуются специальные газопроводы.
Особенности перевода объема для сжиженного газа
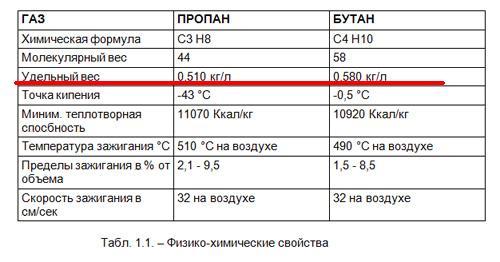
Сжиженный газ представляет из себя смесь газа пропана с бутаном. Теоретически возможно добавление в смеси метана, но в этом нет экономической выгоды. Метан требует повышения прочности баллонов. Комнатная температура позволяет этому газу создавать повышенное давление.
При переходе из жидкого в газообразное физическое состояние объем определяют перечисленные факторы:
- Химический состав
- Температура воздуха
- Давление
- Удельная масса
- Плотность
Перевод литров в баллонах в кубометры топлива выполняется при учете всех этих характеристик. Однако точный состав содержимого баллона определить затруднительно. Также все внешние факторы возможно контролировать.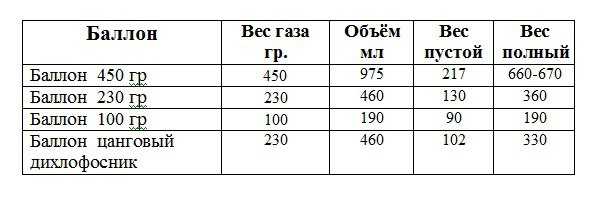
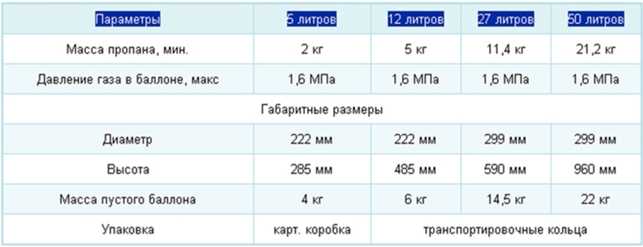
Для расчета объема применяют приблизительное соотношение. Оно гласит, что при 20 градусах Цельсия из литра получится 200 кубов газа.
Актуальной считается формула Pк = Pл/5, где Pк – объем в кубометрах, а Pл – количество литров.
В целях безопасности эксплуатации баллоны заполняются не целиком. Газ заливают максимум на 85% от общего объема ёмкости.
Расчеты для метанаПеревод литров в килограммы для метана определяется простой математической формулой:
V = m / p
где
- V — объем;
- m — масса;
- p — плотность.
В расчете принята плотность метана = 0.7168 кг/м3. Эта цифра актуальна для газообразного состояния.
Плотность метана меняется в зависимости от внешней температуры и давления.
Если необходимо перевести кг в м3, то расчет будет следующим.
1 литр метана имеет вес 0.0007168 килограмм (кг). Это действительно мало.
Сколько литров в килограмме метана? При плотности 0.7168 кг на 1 литр, 1 кг метана будет занимать объем 1395. 1 литра.
1 литра.
Если нужно перевести м3 в тонны, то соотношение будет таким же, как при переводе литров в килограммы.
Примеры расчета
Предположим, требуется узнать, сколько кубометров газа помещается в баллоне. В баллоне смесь пропана-бутана, объем 50 литров.
Смесь пропускается через специальный газосчетчик. Получены следующие данные:
- Масса смеси, закачанной во внутрь, составила примерно 21 кг
- Объем в кубометрах равняется Pл/5, следовательно, 50/5 = 10.
- Баллон заполняется максимум на 85%, получается (10*85)/100 = 8,5 кубометров
Возможен также обратный расчет. Количество литров можно получить, если умножить кубометры на 5. Чтобы вычислить, сколько это — 1000 кубометров газа, нужно 1000*5. Получим 5000 – это 100 баллонов по 50 литров.
Таблица ниже содержит данные, соответствующие наиболее распространенным видам газа технического назначения. Газы заправляются в баллоны при давлении, установленном ГОСТом. Условия закачки должны быть нормальными.
Условия закачки должны быть нормальными.
| Название газа | Объем баллона, л | Объем, м3 | Вес смеси в баллоне, кг |
| Кислород | 40 | 6,4 | 8,3 |
| Азот | 40 | 5,7 | 7,5 |
| Аргон | 40 | 6,3 | 7,5 |
| Углекислота | 40 | 6,0 | 20-24 |
| Пропан | 50 | 9,5 | 21,5 |
| Гелий | 40 | 5,1 | 1 |
Показатель может меняться синхронно с изменением внешних условий среды. Важна температура вне баллона, она влияет на внутреннее давление емкости. Уменьшение давления приводит к меньшему объему газовой смеси на выходе.
Использование такого способа перевода литров газа в метры в кубе примерное. Закупая топливо, важно учитывать факторы помимо объема. Важными являются вес смеси газов, давление внутри баллона.
Когда используются индивидуальные учетные приборы, кубометр – единица измерения по умолчанию. В этом случае перевод не зависит от точного состава смеси. Можно применять обычную физику, соотношение кубических величин, где литр – одна тысячная кубометра.
В этом случае перевод не зависит от точного состава смеси. Можно применять обычную физику, соотношение кубических величин, где литр – одна тысячная кубометра.
Также будет полезно
0 12 767 просмотров
Понравилась статья? Поделиться с друзьями:
404. К сожалению, данная страница не найдена.
| Разделы | |
|---|---|
| Оборудование для производства пенопласта | |
| Несъемная опалубка | |
| Оборудование для производства рубероида | |
| Оборудование для фигурной резки пенопласта | |
| Станки для резки пенопласта | |
| Оборудование для производства СИП панелей | |
| СИП панели — цена. Купить СИП панели | |
| Вибропресс для шлакоблоков | |
| Оборудование для производства полистиролбетона (пенобетона) | |
| Оборудование для производства сэндвич панелей | |
| Конвекторы Аккорд М | |
| Оборудование для производства ЖБИ | |
| Бетоносмеситель (бетономешалка) принудительного действия | |
| Формы для ФБС | |
Фундаментные блоки. Блоки ФБС (цена). Блоки ФБС (цена). |
|
| Формы для колодезных колец | |
| Бетонные кольца для колодца (цена) | |
| Формы для ступеней из бетона ЛС | |
| Формы для перемычек | |
| Формы для бордюров | |
| Формы для дорожных плит | |
| Виброплита | |
| Вибростол | |
| Виброплощадка | |
| Малый бизнес | |
| Шинные мини пилорамы | |
| Оборудование для производства пива | |
Оборудование для производства краски |
|
| Рецепты красок (технологии красок) | |
| Пеноизол | |
| Бадья для бетона | |
| Тара для раствора | |
| Карта сайта (направления развития бизнеса) | |
| Контакты | |
| Главная | |
К сожалению, данная страница не найдена. Вы можете воспользоваться поиском по сайту или выбрать раздел в меню.
Вы можете воспользоваться поиском по сайту или выбрать раздел в меню.
Телефон: +7 473 256-46-33, +7 920 407-62-26, e-mail: [email protected]
| Формы для ФБС |
|---|
| Формы для дорожных плит |
|---|
| Формы для ступеней из бетона |
|---|
| Формы для перемычек |
|---|
| Формы для колодезных колец |
|---|
| Виброплощадка |
|---|
10.
 7: Преобразование молей в объем газа
7: Преобразование молей в объем газа- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53771
Как узнать, сколько газа в этих контейнерах?
Небольшие газовые баллоны часто используются для подачи газов для химических реакций. Газометр даст некоторую информацию о том, сколько газа в баке, но нужны количественные оценки, чтобы реакция могла протекать до конца. Знание того, как рассчитать необходимые параметры для газов, очень полезно, чтобы избежать их исчерпания раньше, чем хотелось бы.
Преобразование между молями и объемом газа
Молярный объем при нормальных условиях можно использовать для преобразования молей в объем газа и из объема газа в моли. Равенство \(1 \: \text{mol} = 22,4 \: \text{L}\) является основой для коэффициента преобразования.
Равенство \(1 \: \text{mol} = 22,4 \: \text{L}\) является основой для коэффициента преобразования.
Пример \(\PageIndex{1}\): Преобразование объема газа в моли
Многие металлы реагируют с кислотами с образованием газообразного водорода. В ходе определенной реакции образуется \(86,5 \: \text{L}\) газообразного водорода при нормальных условиях. Сколько молей водорода было получено?
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу. Известно- \(86.5 \: \text{L} \: \ce{H_2}\)
- \(1 \: \text{моль} = 22,4 \: \text{L}\)
- моль H 2
Применить коэффициент преобразования литров в моли.
\[86,5 \: \text{L} \: \ce{H_2} \times \frac{1 \: \text{моль} \: \ce{H_2}}{22,4 \: \text{L} \: \ce{H_2}} = 3,86 \: \text{mol} \: \ce{H_2}\nonumber \]
Шаг 3: Подумайте о своем результате.
Объем произведенного газа почти в четыре раза превышает молярный объем. Тот факт, что газ является водородом, не играет никакой роли в расчетах.
Пример \(\PageIndex{2}\): преобразование молей в объем газа
Какой объем \(4,96 \: \text{моль}\) из \(\ce{O_2}\) занимает при STP?
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу .
Известный- \(4.96 \: \text{mol} \: \ce{O_2}\)
- \(1 \: \text{моль} = 22,4 \: \text{L}\)
- Объем O 2
\[4,96 \: \text{моль} \times 22,4 \: \text{л/моль} = 111,1 \: \text{л}\номер\]
Шаг 3: Подумайте о своем результате.Объем кажется правильным, учитывая количество молей.
Пример \(\PageIndex{3}\): Преобразование объема в массу
Если мы знаем объем пробы газа на STP, мы можем определить, сколько массы присутствует. Предположим, у нас есть \(867 \: \text{L}\) из \(\ce{N_2}\) в STP. Какова масса газообразного азота?
Предположим, у нас есть \(867 \: \text{L}\) из \(\ce{N_2}\) в STP. Какова масса газообразного азота?
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу. Известно- \(867 \: \text{L} \: \ce{N_2}\)
- \(1 \: \text{моль} = 22,4 \: \text{L}\)
- Молярная масса \(\ce{N_2} = 28,02 \: \text{г/моль}\)
- Масса N 2
Начнем с определения количества молей присутствующего газа. Мы знаем, что 22,4 литра газа при нормальных условиях равны одному молю, поэтому:
\[867 \: \text{L} \times \frac{1 \: \text{mol}}{22,4 \: \text{L}} = 38,7 \: \text{mol}\nonumber \]
Мы также знаем молекулярную массу \(\ce{N_2}\) \(\left( 28,0 \: \text{г/моль} \right)\), поэтому мы можем вычислить вес газообразного азота в 867 литры:
\[38,7 \: \text{моль} \times \frac{28 \: \text{г}}{1 \: \text{моль}} = 1083,6 \: \text{г} \: \ ce{N_2}\nonumber \]
Шаг 3: Подумайте о своем результате.
В многошаговой задаче убедитесь, что единицы проверены.
Резюме
- Показаны преобразования между молями и объемом газа.
Review
- Почему в приведенных выше задачах газ всегда имел нормальную температуру и давление?
- Контейнер содержит 45,2 л газа N 2 при нормальных условиях. Сколько молей газа N 2 в сосуде?
- Если в предыдущей задаче газом был CH 4 газ на STP вместо N 2 газ, то сколько молей CH 4 газ будет?
Эта страница под названием 10.7: Преобразование между молями и объемом газа распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами LibreTexts. Платформа; подробная история редактирования доступна по запросу.
Платформа; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
ChemTeam: Газовый закон — Закон идеального газа
ChemTeam: Газовый закон — Закон идеального газаPV = nRT: закон идеального газа
Пятнадцать примеров
| Закон Бойля | Закон без названия | Закон об идеальном газе, вопросы 1–10 |
| Закон Чарльза | Закон комбинированного газа | Закон идеального газа Пробы 11–25 |
| Закон Гей-Люссака | Закон Дальтона | Все примеры и задачи закона идеального газа |
| Закон Авогадро | Закон Грэма | Вернуться в меню законов ГМТ и газа |
| Закон дайвера |
Закон идеального газа был впервые написан в 1834 году Эмилем Клапейроном. Далее следует лишь один из способов «вывести» закон идеального газа. Для статического образца газа мы можем записать каждый из шести газовых законов следующим образом:
Для статического образца газа мы можем записать каждый из шести газовых законов следующим образом:
PV = k 1
V / T = k 2
P / T = k 3
V / n = k 4
P / n = k 5 / 16
Обратите внимание, что последний закон написан в обратной форме. Нижние индексы у k указывают на то, что будет получено шесть различных значений.
Перемножив их все вместе, вы получите:
P 3 V 3 / n 3 T 3 = k 1 k 2 k 3 k 4 k 5 / k 6
Пусть кубический корень из k 1 k 2 k 3 k 4 k 5 / k 6 называется R.
Единицы отрабатывают:
k 1 = L-атм
k 2 = L / K
k 3 = атм/К
к 4 = л/моль
к 5 = атм/моль
1/к 6 = 1/моль-К
Каждая единица встречается три раза, и кубический корень дает л-атм/моль-К, правильные единицы для R при использовании в контексте газового закона.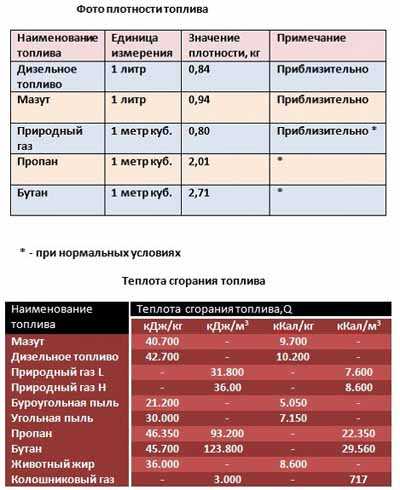
Следовательно, имеем:
PV/нТл = R
или чаще:
PV = нРТ
Р называется газовой постоянной. Иногда его называют универсальной газовой постоянной. Если вы примете достаточное количество химии, вы увидите, что она появляется снова, и снова, и снова.
Числовое значение R
ЗначениеR можно определить разными способами. Это только один из способов:
Предположим, что у нас есть 1000 моль газа на STP. Объем этого количества газа в условиях СТП известен с высокой степенью точности. Мы будем использовать значение 22,414 л.
Кстати, у 22.414 л на СТП есть название. Его называют молярным объемом. Это объем ЛЮБОГО идеального газа при стандартной температуре и давлении.
Подставим наши числа в уравнение:
(1000 атм) (22,414 л) = (1000 моль) (R) (273,15 К)
Обратите внимание на то, как использовались атмосферы, а также на точное значение стандартной температуры.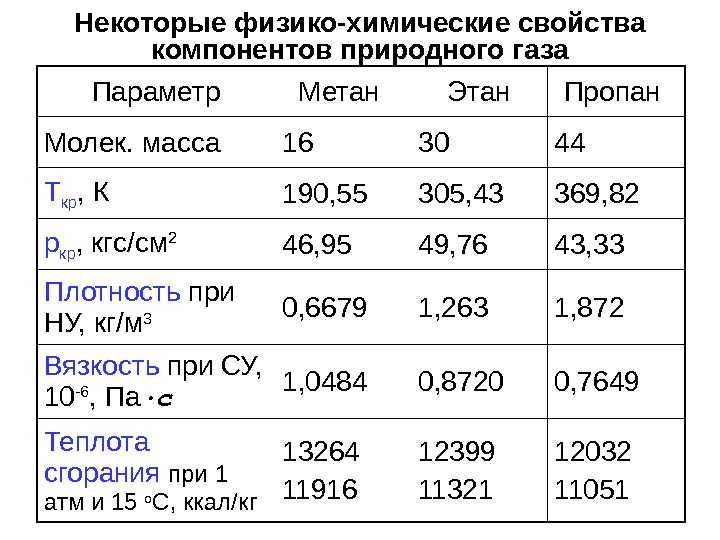
Решение для R дает 0,08206 л атм/моль K при округлении до четырех значащих цифр. Обычно этого достаточно. Запомните значение. Он понадобится вам для решения задач.
Обратите внимание на странную единицу измерения R: произнесите вслух «литр атмосферы на моль Кельвина».
Это не единственное значение R, которое может существовать. (Вот целая куча.) Это зависит от того, какие юниты вы выберете. Те из вас, кто занимается химией больше, чем уровень средней школы, получат 8,31447 Дж на моль Кельвина, но это в другой раз. ChemTeam будет использовать значение 0,08206 в задачах, связанных с газами, почти каждый раз.
Пример №1: Образец газа при 25,0 °C имеет объем 11,0 л и давление 660,0 мм рт.ст. Сколько молей газа содержится в образце?
Решение:
1) PV = nRT:
(660,0 мм рт.ст. / 760,0 мм рт.ст./1,00 атм) (11,0 л) = (n) (0,08206 л атм/моль К) (298 К)Обратите внимание на перевод мм ртутного столба в атм и из Цельсия в Кельвин.
2) Решить:
(0,868421 атм) (11,0 л) н = ––––––––––––––––––––––––––– (0,08206 л атм/моль К) (298 К) n = 0,391 моль
Пример #2: Образец газа при 28,0 °C имеет объем 6,20 л и оказывает давление 720,0 мм рт.ст. Сколько молей газа содержится в образце?
Решение:
1) PV = nRT:
(720,0 мм рт.ст. / 760,0 мм рт.ст./1,00 атм) (6,20 л) = (n) (0,08206 л атм/моль К) (301 К)Обратите внимание на перевод мм ртутного столба в атм и из Цельсия в Кельвин.
2) Рассчитать:
n = 0,238 моль
Пример №3: Рассчитайте приблизительный объем пробы газа массой 0,400 моль при температуре 11,0 °C и давлении 2,43 атм.
Решение:
1) PV = nRT:
(2,43 атм) (V) = (0,400 моль) (0,08206 л атм/моль К) (284 К)
2) Рассчитать:
(0,400 моль) (0,08206 л атм/моль К) (284 К) В = –––––––––––––––––––––––––––––––––––– (2,43 атм) В = 3,84 л
Пример #4: Рассчитайте приблизительную температуру пробы газа массой 0,300 моль при 780 мм рт. ст. и объеме 6,00 л.
Решение:
1) PV = nRT:
(780 мм рт.ст.) (6,00 л) = (0,300 моль) (62,3638 л мм рт.ст./моль·К) (284 К)Обратите внимание на другое значение и единицу измерения R, чтобы они соответствовали использованию мм рт. ст. в качестве единицы измерения давления.
В качестве альтернативы вы можете преобразовать 780 мм рт. ст. в атм, а затем использовать 0,08206 л атм / моль К для значения R.
Здесь можно найти различные значения R.
2) Переставьте PV = nRT, чтобы выделить T:
Т = ПВ/нРТ = [(780,) (6,00)] / [(0,300) (62,3638)]
Т = 250. К
В задаче не указана конечная единица измерения, но чаще всего запрашивается Цельсий.
250 − 273 = −23 °C
Пример №5: Какое давление оказывают 2,3 моль газа при температуре 40 °C и объеме 3,5 л?
Решение:
PV = нРТ(P) (3,5 л) = (2,3 моль) (0,08206 л атм/моль К) (313 К)
P = [(2,3) (0,08206) (313)] / 3,5
Р = 16,9банкомат
Пример #6: Образец сухого газа массой 2,1025 г занимает 2,850 л при 22,00 °C и 740,0 мм рт.ст. Сколько молей газа имеется?
Решение:
1) Я изменю единицы измерения давления на атм. , чтобы сохранить предпочтительное для меня значение R:
, чтобы сохранить предпочтительное для меня значение R:
740,0 мм рт.ст. ÷ 760,0 мм рт.ст./атм = 0,973684 атм
2) Теперь подставьте уравнение и найдите n:
(0,973684 атм) (2,850 л) = (n) (0,08206 л атм/моль К) (295,0 К)До четырех знаков инжира ответ 0,1146 моль.
3) В следующем примере я буду использовать 0,1146329 моль и округлю в конце.
Пример №7: Используя приведенную выше задачу, какова молярная масса газа?
Это очень распространенное использование этого закона, и шансы, что вы увидите этот тип вопроса на тесте, очень высоки.
Важно запомнить единицы измерения молярной массы: граммы на моль.
Из условия задачи мы знаем, что задействовано 2,1025 грамма газа, и мы также знаем, сколько это молей. Мы знаем это, выполнив приведенный выше расчет и получив 0,1146329.мол.
Итак, все, что нам нужно сделать, это разделить граммы газа на количество молей:
2,1025 г ÷ 0,1146329 моль = 18,34 г/моль
Давайте рассмотрим эти шаги для использования закона идеального газа для расчета молярной массы газа:
(1) Вы должны знать граммы вовлеченного газа.Обычно проблема просто дает вам значение, но не всегда. Возможно, вам придется вычислить его.
(2) Вам нужно рассчитать количество молей газа. Используйте PV = nRT и найдите n. Обязательно используйте L, atm и K.
(3) Разделите граммы на моли и вот ваш ответ.
Напоминание: почти со 100% уверенностью вам будет задан вопрос об определении молярной массы на экзамене по газовым законам.
Пример #8: При STP колба объемом 5,00 л, наполненная воздухом, имеет массу 543,251 г. Воздух в колбе заменяется другим газом, и масса колбы составляет 566,107 г. Плотность воздуха 1,29 г/л. Какой газ пришел на смену воздуху?
Решение:
1) Рассчитайте массу воздуха в колбе:
(1,29 г/л) (5,00 л) = 6,45 г
2) Рассчитайте массу колбы:
543,251 г − 6,45 г = 536,801 г
3) Рассчитайте массу неизвестного газа:
566,107 г − 536,801 г = 29,306 г
4) Рассчитайте количество молей неизвестного газа:
PV = нРТ(1,00 атм) (5,00 л) = (n) (0,08206) (273 К)
n = 0,22319 моль
5) Рассчитайте молярную массу неизвестного газа:
29,306 г / 0,22319 моль = 131,3 г/моль
6) Используйте периодическую таблицу, чтобы найти, какой элемент газа ближе всего к 131,3 г/моль. Неизвестный газ может быть ксеноном.
Неизвестный газ может быть ксеноном.
Пример #9: Сосуд при 25,0 °C откачивают до точки, при которой количество оставшегося газа составляет 5,00 x 10 9 молекул на м 3 . Какое давление в сосуде?
Решение с использованием одного кубического метра:
1) Определить количество молей газа в 1 м 3 :
(5,00 x 10 9 молекул) / (6,022 x 10 23 молекул/моль) = 8,303 x 10¯ 15 моль
2) Используйте закон идеального газа:
PV = нРТ(P) (1,00 м 3 ) = (8,303 х 10¯ 15 моль) (8,20575 х 10¯ 5 м 3 атм/моль К) (298 К)
Я посмотрел значение R здесь.
P = 2,03 x 10¯ 16 атм
Раствор на один литр:
ChemTeam не писала этот ответ, внося лишь незначительные изменения стиля.
берут на 1 литр объема, то есть 0,001 м 3 .так что есть 5e6 молекул.
6,022e23 молекул/моль (постоянная Авогадро)
1 моль — это 6,022e23 молекул, поэтому
(5e6 молекул) x (1 моль/6,022e23) = 8,303e-18 мольЗакон идеального газа
PV = нРТ
n = количество молей
R = газовая постоянная = 0,08206 (л атм)/(моль K)
T = температура в Кельвинах
P = абсолютное давление в атм.
V = объем в литрахP = nRT/V = (8,303e-18) (0,08206) (298) / 1 = 2,03e-16 атм
Комментарий ChemTeam: я часто меняю давление на атм, чтобы использовать значение 0,08206. Здесь я просто посмотрел значение R, а не изменил объем на литры. На тесте у вас может не быть такой роскоши, поэтому убедитесь, что вам удобно менять объем, например m 3 , на литры.
Пример № 10: Из следующих газов с плотностью 0,906 г/л при 315 К и 1,16 атм.
(а) Ne
(б) Ar
(в) Kr
(г) Xe
(д) He
Решение №1:
PV = нРТ(1,16 атм) (1,00 л) = (n) (0,08206 л атм/моль К) (315 К)
n = 0,044876 моль
0,906 г / 0,044876 моль = 20,19 г/моль
Решение №2:
PV = нРТPV = (m/M)RT Поскольку плотность = m/V, мы имеем это (после подстановки и перестановки):
ПВМ = мРТ
М = мРТ / PV
М = [(0,906 г) (0,08206 л атм/моль К) (315 К)] / [(1,00 л) (1,16 атм)] = 20,19 г/моль
Неон.
Раствор №3 (без PV = nRT):
При СТП 1 моль газа имеет объем 22,414 л.Используя закон комбинированного газа, преобразуйте объем в 315 K и 1,16 атм:
(22,414) (315/273) (1,00/1,16) = 22,295 л
Теперь вам нужно вычислить плотности, пока вы не получите правильный ответ:
Ne—> 20,180 г / 22,295 л = 0,905 г/л. Для сравнения, вот аргон:
Ar —> 39,95 г/22,295 л = 1,79 г/л
Пример #11: Образец неизвестного двухатомного газа массой 0,105 г, содержащийся в сосуде объемом 125 мл, находится под давлением 560 торр при 23 °C. Какова молярная масса газа? Какова идентичность газа?
Решение:
PV = нРТ(560 торр / 760 торр/атм) (0,125 л) = (n) (0,08206 л атм/моль К) (296 К)
н = 0,003792 моль
0,105 г / 0,003792 моль = 27,7 г/моль
Азот имеет молярную массу 28,0 г/моль
Пример № 12: Если 1,0 г каждого из следующих газов взять при нормальных условиях, какой из них займет наибольший объем?
(а) СО
(б) Н 2 О
(c) CH 4
(d) НЕТ
(e) Все они будут занимать один и тот же объем.Решение:
1) Измените PV = nRT следующим образом:
В = нРТ / ППоскольку RT/P одинаковы для каждого газа, наибольший объем будет у газа с наибольшим числом молей.
2) Следовательно, наибольшее число молей в 1,0 г газа будет у соединения с наименьшей молекулярной массой:
CO —> 28,0 г/моль
H 2 O —> 18,0 г/моль
CH 4 —> 16,0 г/моль
НЕТ —> 30,0 г/моль1,0 г метана, CH 4 , будет иметь наибольший объем при нормальных условиях.
Пример №13: Если 12,8 г жидкого гелия при 1,7 К полностью испарились. Какой объем занимает гелий при СТП?
Решение:
Нас не волнуют 1,7 К. Одна из причин заключается в том, что при 1,7 К гелий еще не является газом, так как гелий испаряется примерно при 4,25 К. Другая причина заключается в том, что нас интересует только положение гелия при СТП, нас не волнует, что делал гелий при более низких температурах.
1) Определить количество молей гелия:
12,8 г / 4,0026 г/моль = 3,1979 моль2) Используйте PV = nRT:
(1,00 атм) (x) = (3,1979 моль) (0,08206 л атм/моль К) (273,15 К)х = 71,6799 л
Инжир «Три сиг», 71,7 л
Использование более распространенных 273 К для стандартной температуры дает 71,6 л. Обязательно используйте значение стандартной температуры, используемое вашим учителем. Это значение, которое он/она использует для подсчета ответов на тесте.
Пример №14: Элементарный газ (это означает, что он состоит из одного элемента) имеет массу 10,3 грамма. Он занимает 58,4 л при 1,00 атм и 2,50 ° C. Определите газ.
Решение:
1) Используем закон идеального газа для определения количества молей присутствующего газа:
PV = нРТ(1,00 атм) (58,4 л) = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (275,50 К)
n = 2,58321 моль
2) Определите молекулярную массу (молярную массу) газа:
10,3 г / 2,58321 моль = 3,99 г/моль (до трех цифр)3) Элементарными газами являются благородные газы, большинство галогенов, водород, кислород и азот.
Мы изучаем атомные веса в периодической таблице и определяем, что это гелий.
Пример №15: Элементарный газ (это означает, что он состоит из одного элемента) имеет массу 10,3 грамма. Он занимает 4,27 л при 1,00 атм и 85,0 ° C. Определите газ.
Решение:
PV = нРТ(1,00 атм) (4,27 л) = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (358,0 К)
n = 0,14535 моль
10,3 г/0,14535 моль = 70,9 г/моль
Ищите число 70,9 в таблице Менделеева и не можете его найти. Что делать? Ага! Помните, что существуют двухатомные газы. Ищите 35,45 (половина 70,9) и найти хлор.
Двухатомный газообразный хлор Cl 2 является ответом.
Дополнительный пример #1: Один из методов оценки температуры в центре Солнца основан на уравнении идеального газа. Если центр принять за смесь газов, средняя молярная масса которых равна 2,04 г/моль, а плотность и давление равны 1,14 г/см 3 и 2,01 х 10 9 атм соответственно, вычислить температуру.
Решение:
1) Используя плотность и молярную массу, определите количество молей газа в 1,00 л:
1,00 л = 1000 мл = 1000 см 3(1,14 г/см 3 ) (1000 см 3 ) = 1140 г
1140 г / 2,04 г/моль = 558,824 моль
Вы можете использовать любой том. Я использовал 1,00 л, чтобы немного упростить расчет PV = nRT.
2) Используйте закон идеального газа:
PV = нРТ(2,01 x 10 9 атм) (1,00 л) = (558,824 моль) (0,08206 л атм/моль К) (Т)
T = 4,38 x 10 7 K (до трех цифр)
Дополнительный пример #2: (a) Газ имеет температуру 300 К и давление 104 кПа. Найти объем, занимаемый 1,05 моль этого газа, считая его идеальным. (b) Предполагая, что молекулы газа можно представить в виде небольших сфер диаметром 3,0 x 10¯ 10 м, определите долю объема, найденного в части (a), которая занята молекулами.

 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
 В качестве альтернативы вы можете преобразовать 780 мм рт. ст. в атм, а затем использовать 0,08206 л атм / моль К для значения R.
В качестве альтернативы вы можете преобразовать 780 мм рт. ст. в атм, а затем использовать 0,08206 л атм / моль К для значения R.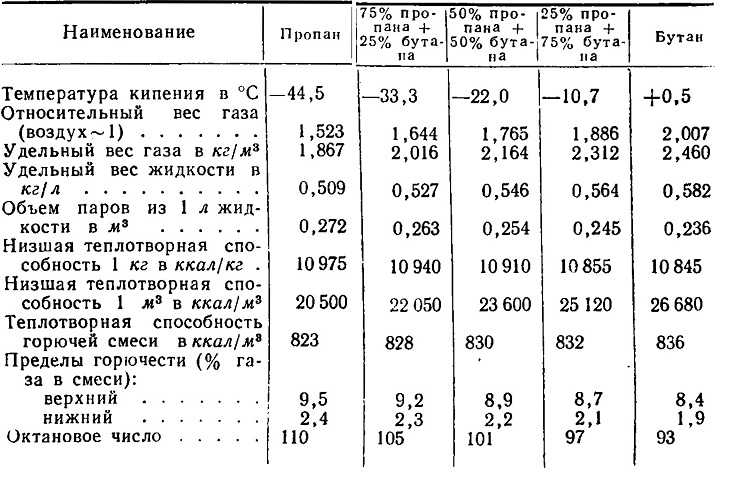 Обычно проблема просто дает вам значение, но не всегда. Возможно, вам придется вычислить его.
Обычно проблема просто дает вам значение, но не всегда. Возможно, вам придется вычислить его. так что есть 5e6 молекул.
так что есть 5e6 молекул. 

 Мы изучаем атомные веса в периодической таблице и определяем, что это гелий.
Мы изучаем атомные веса в периодической таблице и определяем, что это гелий.