Щёлочноземельные металлы — это… Что такое Щёлочноземельные металлы?
| Группа → | 2 | ||
|---|---|---|---|
| ↓ Период | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 | |||
| 7 |
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1]периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10 −10% (от массы земной коры)[4].
См. также
Ссылки
Литература
dic.academic.ru
щелочных и щелочноземельных металлов, алюминия, железа – HIMI4KA

Элементами группы IA являются литий, натрий, калий, рубидий, цезий и франций. Их называют также щелочными металлами. Некоторые их физические свойства приведены в таблице 6.
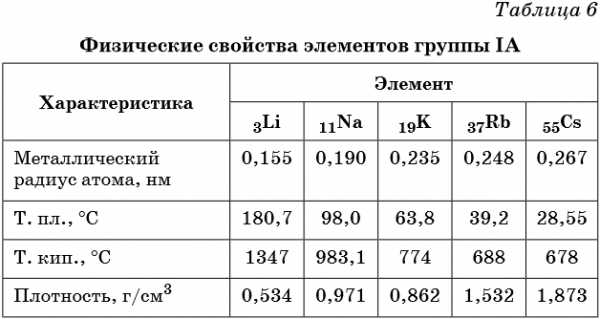
Для щелочных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Общий способ получения щелочных металлов — электролиз расплавов их хлоридов, например:
Калий получают также с помощью натрийтермического метода:
Щелочные металлы химически очень активны, легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +1. Хранят щелочные металлы в герметичной таре под слоем обезвоженного керосина, а литий — под слоем вазелина.
Ниже представлены общие для всех щелочных металлов реакции (Me = Li, Na, K, Rb, Cs):
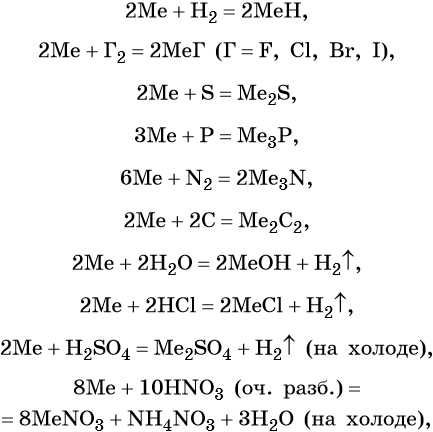
Исключением является реакция с кислородом, в которой щелочные металлы ведут себя по-разному:
Оксиды щелочных металлов Э2O являются типичными основными оксидами, а гидроксиды ЭОН — сильными основаниями (щелочами), сила которых возрастает от лития к цезию.

Элементами IIА-группы являются бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Последние три называют элементами подгруппы кальция или щёлочноземельными металлами. Некоторые свойства элементов IIА-группы приведены в таблице 7.
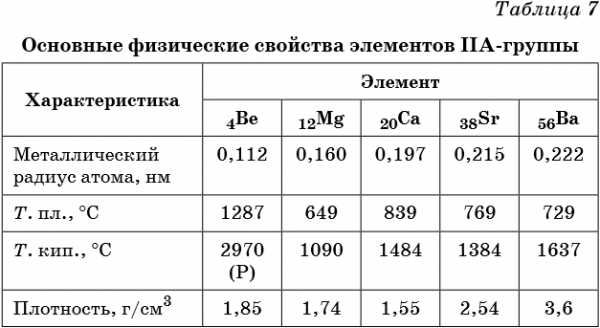
Свойства бериллия и магния несколько отличаются от свойств, характерных для щёлочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку (диагональное сходство).
Для щёлочноземельных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Магний и кальций получают электролизом расплавов их хлоридов, например:
Стронций и барий получают восстановлением их оксидов алюминием или кремнием, например:
Щёлочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2.
Ниже приведены характерные для щёлочноземельных металлов реакции с простыми и сложными веществами (Me = Ca, Sr, Ba):
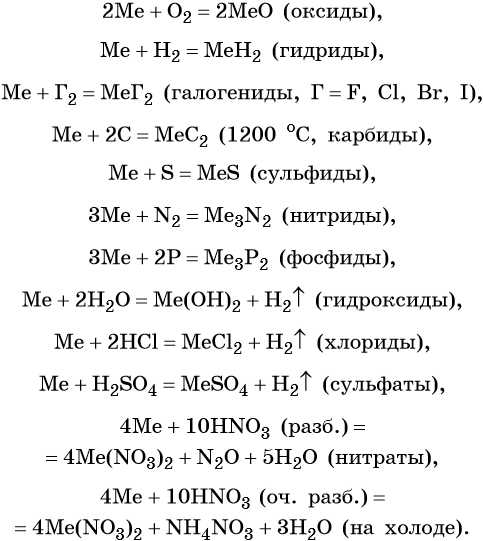
Оксиды щёлочноземельных металлов представляют собой типичные основные оксиды. Они реагируют с кислотами с образованием солей и воды, с кислотными оксидами с образованием солей. Реакция с водой протекает по-разному. Если оксид бария легко реагирует с водой при комнатной температуре с образованием сильной щёлочи Ba(OH)2, то оксид магния может реагировать с водой только при кипячении. Химические свойства оксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
Гидроксиды щёлочноземельных металлов проявляют основные свойства: реагируют с кислотами с образованием основных или средних солей и воды, с кислотными оксидами с образованием солей и воды. Химические свойства гидроксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
Сила оснований увеличивается с увеличением порядкового номера элемента.
Алюминий — химический элемент, расположенный в 3-м периоде IIIA группе. Его электронная формула 1s22s22p63s23p1.
Алюминий пассивируется в воде, концентрированной азотной кислоте из-за образования устойчивой оксидной пленки. Сильный восстановитель.
Химические свойства:

Оксид алюминия — типичный амфотерный оксид, гидроксид алюминия — типичный амфотерный гидроксид.
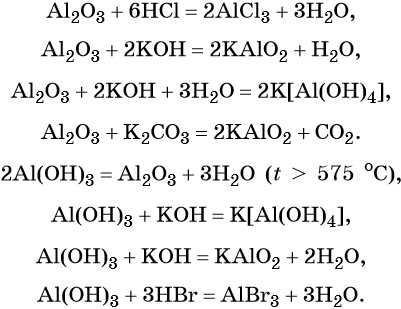
Железо находится в 4-м периоде VIIIБ группе. Его электронная формула 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6.
Химически чистое железо получают разложением его пентакарбонила:
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах.
Упрощённо этот процесс можно описать уравнением:
Характерные для железа химические реакции:
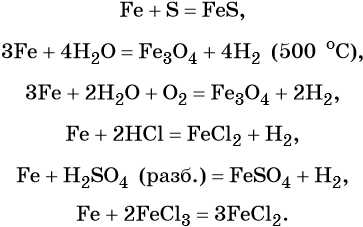
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции.
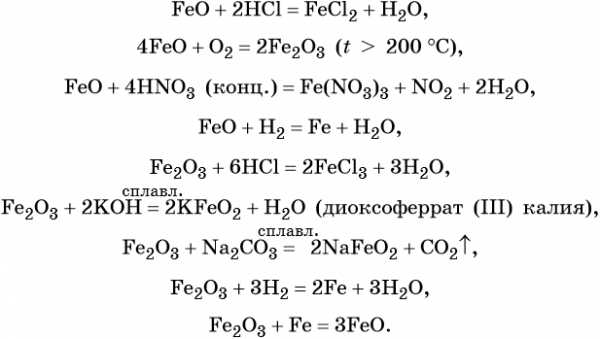
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут так же, как и у входящих индивидуально в его состав оксидов:
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Тренировочные задания
1. Литий при соответствующих условиях вступает в реакцию с каждым из двух веществ
1) кислородом и алюминием
2) серой и хромом
3) оксидом углерода (II) и оксидом меди (I)
4) азотом и фосфором
2. Верны ли следующие утверждения о литии?
А. Литий хранят под слоем вазелина. Б. Взаимодействие лития с кислородом приводит к пероксиду лития.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Натрий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) ртутью и алюминием
2) фосфором и оксидом кальция
3) оксидом серы (IV) и оксидом кальция
4) азотной кислотой и водой
4. Верны ли следующие утверждения о натрии?
А. Натрий не реагирует с фосфором даже при нагревании.
Б. Натрий используют в технике при получении калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Калий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и магнием
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом магния
4) азотной кислотой и оксидом серы (VI)
6. Верны ли следующие утверждения о калии?
А. Калий не реагирует с водой.
Б. Гидрид калия нельзя получить прямой реакцией калия с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Магний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) в одой и железом
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом кремния
4) азотной кислотой и оксидом серы (VI)
8. Верны ли следующие утверждения о магнии?
А. Магний на воздухе покрывается оксидной пленкой.
Б. Магний реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Кальций при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и углеродом
2) фосфором и литием
3) оксидом фосфора (V) и оксидом азота (IV)
4) оксидом бария и оксидом серы (VI)
10. Верны ли следующие утверждения о кальции?
А. Кальций реагирует с азотом при нагревании.
Б. Кальций не реагирует с оксидом фосфора (V).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
11. Барий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и соляной кислотой
2) фосфором и натрием
3) оксидом фосфора (V) и оксидом лития
4) оксидом углерода (IV) и оксидом серы (VI)
12. Верны ли следующие утверждения о барии?
А. Барий не вступает в реакцию с бромом.
Б. Барий вступает в реакцию с водой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Алюминий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) железом и оксидом серы (VI)
14. Верны ли следующие утверждения об алюминии?
А. Алюминий вступает в реакцию с Fe2O3.
Б. Алюминий реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Железо при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) кислородом и оксидом серы (VI)
16. Верны ли следующие утверждения о железе?
А. Железо вступает в реакцию с Fe2O3.
Б. Железо реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Установите соответствие между реагирующими веществами и продуктами реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + HNO3 (разб.) →
Б) Li + S →
В) Li + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) Li2S
3) LiOH
4) LiNO3 + NH4NO3 + H2O
5) LiOH + H2
18. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + O2 →
Б) Li + Cl2 →
В) Li + HNO3 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) LiCl
3) Li2O
4) Li2O2
5) LiNO3 + NH4NO3 + H2O
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + O2 →
Б) Na + H2SO4 →
В) Na + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) NaCl
2) Na2O
3) Na2O2
4) NaCl + H2↑
5) Na2SO4 + H2↑
20. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + HNO3 (разб.) →
Б) Na + O2 →
В) Na + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) NaNO3 + H2↑
2) NaNO3 + NH4NO3 + H2O
3) NaOH + H2↑
4) Na2O
5) Na2O2
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + O2 →
Б) K + HCl →
В) K + S →
ПРОДУКТЫ РЕАКЦИИ
1) K2O
2) KO2
3) K2S
4) KCl + H2O
5) KCl + H2↑
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + H2O →
Б) K + Cl2 →
В) K + H2SO4 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) KH + O2
2) K2SO4
3) KCl
4) K2SO4 + H2↑
5) KOH + H2↑
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + HNO3 (разб.) →
Б) Mg + N2 →
В) Mg + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Mg(NO3)2 + N2O + H2O
2) Mg(NO3)2 + H2↑
3) MgO + H2↑
4) MgCl2 + H2↑
5) Mg3N2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + H2SO4 (разб.) →
Б) Mg + H2 →
В) Mg + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) MgSO4 + SO2 + H2O
2) Mg(NO3)2 + H2↑
3) MgH2
4) MgSO4 + H2↑
5) Mg(NO3)2 + N2O + H2O
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + HNO3 (разб.) →
Б) Ca + P →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(NO3)2 + NO2 + H2O
2) CaCl2 + H2O
3) Ca(NO3)2 + N2O + H2O
4) Ca3P2
5) CaCl2 + H2↑
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + N2 →
Б) Ca + C →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3N2
2) Ca2C
3) CaCl2
4) CaCl2 + H2↑
5) CaC2
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + HNO3 (разб.) →
Б) Ba + H2 →
В) Ba + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) Ba(NO3)2 + N2O3↑ + H2O
2) Ba(NO3)2 + N2O↑ + H2O
3) BaH2
4) Ba(OH)2 + H2↑
5) Ba(OH)2
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + N2 →
Б) Ba + O2 →
В) Ba + C →
ПРОДУКТЫ РЕАКЦИИ
1) BaO
2) Ba2O2
3) Ba3N2
4) BaC2
5) Ba2C
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + HCl →
Б) Al + C →
В) Al + Fe2O3 →
ПРОДУКТЫ РЕАКЦИИ
1) FeAlO2
2) Al2O3 + Fe
3) AlCl3 + H2↑
4) Al4C3
5) Al2C3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + NaOH + H2O →
Б) Al + P →
В) Al + HI →
ПРОДУКТЫ РЕАКЦИИ
1) Na[Al(OH)4] + H2↑
2) AlI3 + H2↑
3) AlP
4) Na[Al(OH)4]
5) Al(OH)3 + H2↑
31. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + HCl →
Б) Fe + H2SO4 (разб.) →
В) Fe + S →
ПРОДУКТЫ РЕАКЦИИ
1) FeCl3 + H2↑
2) Fe2(SO4)3 + H2↑
3) FeSO4 + H2↑
4) FeS
5) FeCl2 + H2↑
32. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + H2O (пар) →
Б) Fe + HNO3 (разб.) →
В) Fe + CuSO4 →
ПРОДУКТЫ РЕАКЦИИ
1) Fe2(SO4)3 + Cu
2) Fe(NO3)3 + NO + H2O
3) FeSO4 + Cu
4) Fe3O4 + H2
5) Fe(NO3)3 + NO2 + H2O
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
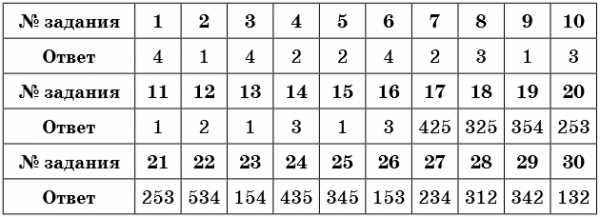
Ответы



himi4ka.ru
11 класс. Химия. Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий — Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы.
Комментарии преподавателя
1. Общие свойства металлов
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
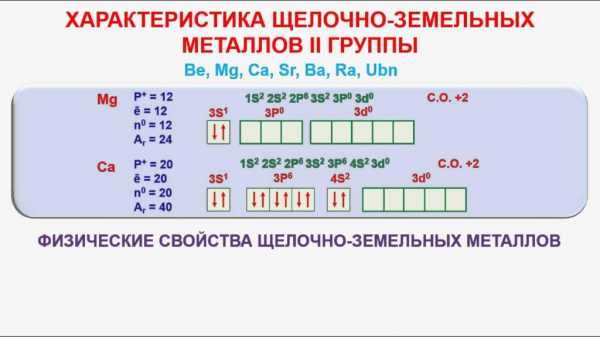
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы). У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Рис. 1
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
2. Щелочные металлы
Свойства металлов
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
2Na + S Na2S
2Na + h3 2NaH
3Na + P Na3P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
Li3N + 3h3O → 3LiOH + Nh4↑
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2h3O → 2LiOH + h3↑
4. Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 h3O
8Na + 5h3SO4 (конц) → 4Na2SO4 + h3S↑ + 4h3O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
NaOH |
Едкий натр (каустическая сода) |
|
NaCl |
Поваренная соль |
|
NaNO3 |
Чилийская селитра |
|
Na2SO4∙10h3O |
Глауберова соль |
|
Na2CO3∙10h3O |
Сода кристаллическая |
|
KOH |
Едкое кали |
|
KCl |
Хлорид калия (сильвин) |
|
KNO3 |
Индийская селитра |
|
K2CO3 |
Поташ |
3. Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl2→ 2СaCl2
Сa + S СaS
Сa + h3 Сah3
3Сa + 2P Сa3 P2-
2. Взаимодействие с кислородом
2Сa + O2 → 2CaO
3. Взаимодействие с водой
Sr + 2h3O → Sr(OH)2 + h3↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4h3O
4Ca + 10h3SO4 (конц) → 4CaSO4 + h3S↑ + 5h3O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 3Ba + Al2O3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
Рис. 2
СaO + h3O → Ca(OH)2
Ca(OH)2 + CO2↑ → CaCO3↓+ h3O
CaCO3↓+ h3O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2h3O, алебастр – CaSO4∙0,5h3O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.
Рис. 3
Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2h3O →Ca(OH)2 + C2h3↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.
Рис. 4
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2 CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов h3PO4- ,Cl-, NO3- и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
4. Алюминий
Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.
Рис. 5
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
Химические свойства алюминия
1. Реакция с галогенами
2Al + 3I2 2AlI3
2. Сгорает при нагревании с выделением большого количества теплоты
4Al + 3O2 2Al2O3 + Q . При этом может развиваться температура до 35000С.
3. Реакция с неметаллами
2Al + 3S Al2S3
2Al + N2 2AlN
4Al + 3С Al4С3
4. Взаимодействует с водой
2Al + 6h3O → 2Al(OH)3 +3h3↑ Если снять амальгамированием или механически пленку.
Амальгамирование – это нанесение на поверхность небольшого количества ртути.
5. Алюминий активно восстанавливает металлы из их оксидов (алюмотермия)
Cr2O3 + 2Al → Al2O3 + 2Cr; этот способ используется при получении многих металлов: Mn, Cr, V, W, Ba, Sr и др.
6. Взаимодействует с кислотами-неокислителями
2Al + 6HCl →2AlCl3 + 3h3↑
Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации. С разбавленной серной или азотной кислотой взаимодействует
8Al + 30HNO3 →8Al(NO3)3 + 3Nh5NO3 + 9h3O
7. Взаимодействие со щелочами. Al, Al2O3, Al(OH)3 взаимодействуют со щелочами:
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑ (амфотерные свойства).
Al2O3 + 2NaOH = 2NaAlO2 + h3O
8. Реагирует с растворами солей
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Применение алюминия
Рис. 6
Алюминий широко применяется в быту и технике, так как он довольно легок, коррозионно-устойчив и нетоксичен. См. Рис. 6. Часто используются сплавы алюминия. Основной – это дуралюмин (дюралюминий, дюраль). Это сплав алюминия, содержащий медь (массовая доля – 1,4-13%) и небольшие количества магния, марганца и других компонентов. Используется как конструкционный материал в авиа- и машиностроении.
5. Смеси, регенерирующие кислород
Оксиды и пероксиды способны реагировать с углекислым газом, образуя карбонат и кислород.
Na2O2 + CO2 → Na2CO3 + 1/2O2
KO2 + CO2 → K2CO3 + 3/2O2
Если сложить эти 2 уравнения реакции, то получится смесь, выделяющая и 2 моль углекислого газа, и 2 моль кислорода.
Na2O2 + 2KO2 + 2 CO2 → Na2CO3 + K2CO3 + 2О2. Суммарный объём газа в левой и правой части уравнения будет одинаков. Постоянство объёма газа очень важно, так как такие смеси применяются для удаления CO2 и превращения его в нужный для дыхания кислород, например, в подводных лодках или космических станциях. Но там не должно происходить перепада давления.
Подведение итога урока
На уроке была раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий». Вы узнали общие свойства и закономерности щелочных и щелочноземельных элементов, изучили по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений было рассмотрено такое понятие, как жесткость воды. Познакомились с алюминием, его свойствами и сплавами. Вы узнали, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
ИСТОЧНИКИ
источник видео — https://www.youtube.com/watch?v=VMT8vWlJOdM
https://www.youtube.com/watch?v=tvve_WN4DBk
источник презентации — http://ppt4web.ru/khimija/khimicheskie-svojjstva-metallov0.html
источник презентации — http://prezentacii.com/po_himii/1661-schelochnye-metally.html
источник презентации — http://prezentacii.com/po_himii/6431-schelochnozemelnye-metally.html
источник презентации — http://presentaci.ru/download/75082/
www.kursoteka.ru
Щелочноземельные металлы Щелочные металлы — Справочник химика 21
Растворимость перхлоратов щелочных, щёлочноземельных металлов, магния и аммония (г/100 мл раствора при 25° С) [c.735]Э. Группа химических элементов, у которых происходит заполнение электронных оболочек 5-электронами включают семейства щелочных и щёлочноземельных металлов, а также водород. [c.508]
Алкоголяты других щелочных и щёлочноземельных металлов, а также алюминия образуются аналогичным образом. Алкоголяты алюминия A1(0R)3, детально изученные в 1899—1906 гг. В. Е. Тищенко (1861—1941 гг.), перегоняются без разложения и могут рассматриваться как сложные эфиры гидроокиси алюминия, обладающей кислотными свойствами. [c.105]
Помимо воды, гидроокиси щелочных металлов очень легко растворяются в спирте. Только гидроокись лития умеренно растворима как в воде, так и в спирте и образует, таким образом, переход к гидроокисям щёлочноземельных металлов. Она также менее гигроскопична, чем гидроокиси других щелочных металлов, но кристаллизуется из водного раствора в виде гидрата ЬЮН-НгО. [c.205]
Неспецифические носители захватывают радионуклиды за счёт процессов сорбции. Поэтому процесс осаждения не является специфическим и коллекторные носители на основе гидроксида железа (III) и гидратированного диоксида марганца широко используются в радиохимическом анализе для отделения радионуклидов металлов, образующих нерастворимые гидроксиды, от радионуклидов щелочных и щёлочноземельных металлов. Примером может служить отделение иттрия-90 от стронция-90 при осаждении гидроксида железа (III). [c.116]
Кристаллогидраты данных соединений гигроскопичны. Нитраты Зт, Ей, 0(1 способны образовывать двойные соединения с нитратами аммония, щелочных, щёлочноземельных и других металлов состава [c.219]
Опыт всецело подтверждает этот вывод. Так, например, щелочные и щёлочноземельные металлы, обладающие малой работой выхода, уменьшают потенциал зажигания, если покрыть катод плёнкой таких металлов. Этим пользуются прп изготовлении приборов газового разряда, рассчитанных на употребление в схемах низкого напряжения. [c.251]
Добывание и предварительная очистка различных газов для наполнения производятся способами, описанными в курсах химии и в электрохимии. В отношении редких инертных газов смотрите монографии [131—133]. Инертные газы добываются из воздуха при его сжижении. Они имеются в продаже в стальных баллонах при давлениях в десятки атмосфер и в этом случае требуют обязательной доочистки пропусканием через активированный уголь, или же спектрально чистые в стеклянных баллонах под давлением около 600 мм В тех исследованиях, при которых сказывается влияние ничтожно малых примесей посторонних газов, спектрально чистые инертные газы также необходимо дополнительно очищать путём длительной тренировки разрядной трубки с применением специальных электродов, покрытых слоем щелочного или щёлочноземельного металла [118, 128]. [c.62]
Поведение щелочных и щёлочноземельных металле находит объяснение в больших атомных объёмах этих металлов, позво-ляющих первичным электронам проникать глубоко в толщу металла, что затем сильно затрудняет свободный вылет вторичных. электронов. В противоположность этому, в случае металлов [c.137]
Рассмотрим сначала способы получения паров металлов. Их два испарение при нагреве и распыление путём бомбардировки поверхности металла быстрыми (1-50 кэВ) ионами или нейтралами. Последнее явление обнаружено в газовых разрядах и поэтому получило название катодного распыления (падающие на катод ионы вызывают распыление катодного вещества). Легко испаряемых металлов немало, в их числе — щелочные и щёлочноземельные, в некоторых изотопах которых имеется постоянная потребность. Испарённые атомы имеют температуру нагревателя (0,1-0,2 эВ), поэтому требуется не только ионизовать пары, но и дополнительно нагреть полученные ионы. [c.315]
Необычайно высокое сродство алюминия к кисл Ц у пс сравнению со всеми другими металлами, кроме щелочных, щёлочноземельных и редкоземельных, непосредственно явствует из табл. на, стр. 148. [c.474]
КРИПТАТЫ, м мн. Комплексные соединения, центральным атомом у которых является главным образом щелочной или щёлочноземельный металл, а лигандами-крип-танды. [c.226]
ЦЕОЛИТЫ. 4 мн. Алюмосиликаты щелочных и щёлочноземельных металлов, твёрдые вещества с регулярной пористой структурой используются при сущке, очистке и разделении смесей веществ, как катализаторы и др. [c.489]
Л2ВК(Х0 )в, (А= щелочной металл, В = РЬ, щелочно или щёлочноземельный металл). [c.930]
Все металлы щелочной и щёлочноземельной групп, а так се металлы третьей группы обладают, несмотря на малые работы выхода электронов, чрезвычайно нВзкими здаченнями коэффициента вторичной эмиссии (во всех случаях 8[c.137]
chem21.info
Химические свойства щелочноземельных металлов. Перечень щелочноземельных металлов :: SYL.ru
Вторая группа периодической системы Д. И. Менделеева содержит группу элементов, очень похожих по своим свойствам на щелочные металлы, однако уступающих им по активности. В нее входят бериллий и магний, а также кальций, стронций, барий и радий. Они известны под общим названием — щелочноземельные элементы. В нашей статье мы ознакомимся с их распространением в природе и применением в промышленности, а также изучим важнейшие химические свойства щелочноземельных металлов.

Общая характеристика
Все атомы выше перечисленных элементов содержат на внешнем энергетическом слое по два электрона. Взаимодействуя с другими веществами, они всегда отдают свои отрицательные частицы, переходя в состояние катионов с зарядом 2+. В окислительно–восстановительных реакциях элементы ведут себя как сильные восстановители. По мере увеличения заряда ядра, химические свойства щелочноземельных металлов и их активность усиливаются. На воздухе они быстро окисляются, образуя на своей поверхности оксидную пленку. Общая формула всех оксидов – RO. Им соответствуют гидроксиды с формулой R(OH)2. Их основные свойства и растворимость в воде также возрастают с увеличением порядкового номера элемента.
Особые свойства бериллия и магния
По некоторым своим свойствам первые два представителя главной подгруппы второй группы несколько отличаются от других щелочноземельных элементов. Это проявляются, в частности, во время их взаимодействия с водой. Например, химические свойства бериллия таковы, что он вообще не вступает в реакцию с H2O. Магний же взаимодействует с водой лишь при нагревании. Зато все щелочноземельные элементы легко реагируют с нею при обычной температуре. Какие же вещества при этом образуются?

Основания щелочноземельных металлов
Являясь активными элементами, кальций, барий и другие представители группы быстро вытесняют водород из воды, в результате получаются их гидроксиды. Взаимодействие щелочноземельных металлов с водой протекает бурно, с выделением тепла. Растворы оснований кальция, бария, стронция мылкие на ощупь, при попадании на кожу и слизистую оболочку глаз вызывают сильные ожоги. Первой помощью в таких случаях будет обработка раневой поверхности слабым раствором уксусной кислоты. Он нейтрализует щелочь и уменьшит риск возникновения некроза поврежденных тканей.
Химические свойства щелочноземельных металлов
Взаимодействие с кислородом, водой и неметаллами – это главный перечень свойств металлов, входящих во вторую группу периодической системы химических элементов. Например, кальций даже в обычных условиях вступает в реакции с галогенами: фтором, хлором, бромом и йодом. При нагревании он соединяется с серой, углеродом и азотом. Жесткое окисление – горение, заканчивается образованием оксида кальция: 2Ca + O2 = 2 CaO. Взаимодействие металлов с водородом приводит к появлению гидридов. Они представляют собой тугоплавкие вещества белого цвета, имеющие ионные кристаллические решетки. К важным химическим свойствам щелочноземельных металлов относится их взаимодействие с водой. Как уже говорилось ранее, продуктом этой реакции замещения будет гидроксид металла. Отметим также, что в главной подгруппе второй группы наиболее значимое место занимает кальций. Поэтому остановимся на его характеристике подробнее.
Кальций и его соединения
Содержание элемента в земной коре составляет до 3,5%, что указывает на его широкое распространение в составе таких минералов, как известняк, мел, мрамор и кальцит. В состав природного кальция входит шесть видов изотопов. Он также содержится в источниках природной воды. Соединения щелочных металлов подробно изучаются в курсе неорганической химии. Например, на уроках в 9 классе учащиеся узнают, что кальций – это легкий, но прочный металл серебристо-белого цвета. Температура его плавления и кипения выше, чем у щелочных элементов. Основной способ получения – электролиз смеси расплавленных солей хлорида и фторида кальция. К основным химическим свойствам относятся его реакции с кислородом, водой и неметаллами. Из соединений щелочных металлов наибольшее значение для промышленности имеют оксид и основание кальция. Первое соединение получают из мела или известняка методом их выжигания.

Далее из окиси кальция и воды образуется гидроксид кальция. Смесь его с песком и водой называют строительным известковым раствором. Он продолжает применяться в качестве штукатурки и для соединения кирпичей при кладке стен. Раствор гидроксида кальция, называемый известковой водой, используют в качестве реактива для обнаружения углекислого газа. При пропускании двуокиси углерода через прозрачный водный раствор Ca(OH)2, наблюдается его помутнение вследствие образования нерастворимого осадка карбоната кальция.
Магний и его характеристика
Химия щелочноземельных металлов изучает свойства магния, акцентируя внимание на некоторых его особенностях. Он представляет собой очень легкий, серебристо-белый металл. Магний, расплавленный в атмосфере с высокой влажностью, активно поглощает из водяного пара молекулы водорода. Остывая, металл практически полностью выделяет их обратно в воздух. Он очень медленно реагирует с водой по причине образования малорастворимого соединения – гидроксида магния. Щелочи на магний не действуют вовсе. Не реагирует металл с некоторыми кислотами: концентрированной сульфатной и плавиковой, вследствие его пассивации и образования на поверхности защитной пленки. Большинство же минеральных кислот растворяют металл, что сопровождается бурным выделением водорода. Магний – сильный восстановитель, он замещает многие металлы из их оксидов или солей:
BeO + Mg = MgO + Be.
Металл вместе с бериллием, марганцем, алюминием применяют в качестве легирующей добавки к стали. Особенно ценными свойствами обладают магнийсодержащие сплавы — электроны. Их используют в самолетостроении и производстве автомобилей, а также в деталях оптической техники.
Роль элементов в жизнедеятельности организмов
Приведем примеры щелочноземельных металлов, соединения которых распространены в живой природе. Магний является центральным атомом в молекулах хлорофилла у растений. Он участвует в процессе фотосинтеза и входит в состав активных центров зеленого пигмента. Атомы магния фиксируют световую энергию, преобразуя ее затем в энергию химических связей органических соединений: глюкозы, аминокислот, глицерина и жирных кислот. Важную роль выполняет элемент в качестве необходимого компонента ферментов, регулирующих обмен веществ в организме человека. Кальций – макроэлемент, обеспечивающий эффективное прохождение электрических импульсов по нервной ткани. Присутствие его фосфорнокислых солей в составе костей и зубной эмали придает им твердость и прочность.
Бериллий и его свойства
К щелочноземельным металлам относятся также бериллий, барий и стронций. Рассмотрим бериллий. Элемент мало распространен в природе, в основном, встречается в составе минералов, например, берилла. Его разновидности, содержащие разноцветные примеси, образуют драгоценные камни: изумруды и аквамарины. Особенностью физических свойств является хрупкость и высокая твердость. Отличительной чертой атома элемента является наличие на втором снаружи энергетическом уровне не восьми, как у всех остальных щелочноземельных металлов, а только двух электронов.

Поэтому радиус атома и иона непропорционально мал, энергия ионизации большая. Это обуславливает высокую прочность кристаллической решетки металла. Химические свойства бериллия также отличают его от других элементов второй группы. Он реагирует не только с кислотами, но и с растворами щелочей, вытесняя водород и, образуя гидроксобериллаты:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2.
Металл имеет ряд уникальных характеристик. Благодаря способности пропускать рентгеновские лучи, его применяют для изготовления окошек рентгеновских трубок. В ядерной промышленности элемент считается наилучшим замедлителем и отражателем нейтронов. В металлургии он применяется как ценная легирующая добавка, повышающая антикоррозионные свойства сплавов.
Стронций и барий
Элементы достаточно распространены в природе и, так же, как щелочноземельный металл магний, входят в состав минералов. Назовем их: это барит, целестин, стронцианит. Барий имеет вид пластичного металла серебристо-белого цвета. Как и кальций, представлен несколькими изотопами. На воздухе активно взаимодействует с его компонентам – кислородом и азотом, образуя оксид и нитрид бария. По этой причине металл хранят под слоем парафина или минерального масла, избегая его контакта с воздухом. Оба металла при нагревании до 500°C образуют пероксиды.

Из них практическое применение имеет перекись бария, используемая в качестве отбеливателя тканей. Химические свойства щелочноземельных металлов – бария и стронция, похожи на свойства кальция. Однако их взаимодействие с водой протекает значительно активнее, а образовавшиеся основания являются более сильными, чем гидроксид кальция. Барий применяют в качестве добавки к жидкометаллическим теплоносителям, уменьшающей коррозию, в оптике, при изготовлении вакуумных электронных приборов. Стронций востребован в производстве фотоэлементов и люминофоров.
Качественные реакции с использованием ионов щелочноземельных металлов
Соединения бария и стронция – это примеры щелочноземельных металлов, широко используемых в пиротехнике по причине яркого окрашивания пламени их ионами. Так, сульфат или карбонат стронция дает карминово-красное свечение пламени, а соответствующие соединения бария – желто-зеленое. Для обнаружения ионов кальция в лаборатории на пламя горелки насыпают несколько крупинок хлорида кальция, пламя окрашивается в кирпично-красный цвет.

Раствор хлорида бария применяют в аналитической химии для выявления в растворе ионов кислотного остатка сульфатной кислоты. Если при сливании растворов образуется белый осадок сульфата бария – значит, в нем находились частицы SO42-.
В нашей статье мы изучили свойства щелочноземельных металлов и привели примеры их применения в различных отраслях промышленности.
www.syl.ru
Щёлочноземельные металлы — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Группа → | 2 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 | |||||||
| 5 | |||||||
| 6 | |||||||
| 7 | |||||||
| 8 |
| ||||||
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы[1]периодической таблицы элементов: бериллий, магний, кальций, стронций, барий, радий и унбинилий[2][3].
Физические свойства
К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств.
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации, кДж·моль−1 | Сродство к электрону, кДж·моль−1 | ЭО | Металл. радиус, нм | Ионный радиус, нм | tпл, °C | tкип, °C | ρ, г/см³ | ΔHпл, кДж·моль−1 | ΔHкип, кДж·моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,034 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,066 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,112 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,134 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
а Радиоактивные изотопы
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
- <math>\mathsf{Be + 2H^+ \longrightarrow Be^{2+} + H_2\uparrow}</math>
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
- <math>\mathsf{Be + 2OH^- + 2H_2O\rightarrow [Be(OH)_4]^{2-} + H_2\uparrow}</math>
При проведении реакции с расплавом щелочи при 400—500 °C образуются диоксобериллаты:
- <math>\mathsf{Be + 2OH^- \rightarrow BeO_2^{2-} + H_2\uparrow}</math>
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (кроме магния, реакция которого с водой происходит только при внесении раскалённого порошка магния в воду):
- <math>\mathsf{Sr + 2H_2O \longrightarrow Sr(OH)_2 + H_2 \uparrow}</math>
Также, кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
- <math>\mathsf{Ca + H_2 \longrightarrow CaH_2}</math>
- <math>\mathsf{3Sr + N_2 \longrightarrow Sr_3N_2}</math>
Оксиды
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
- <math>\mathsf{2BeO + 4 NaOH + 2H_2O \longrightarrow 2Na_2[Be(OH)_4]}</math>
- <math>\mathsf{BeO + 2 HCl \longrightarrow BeCl_2 + H_2O}</math>
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
- <math>\mathsf{MgO + 2HCl \longrightarrow MgCl_2 + H_2O}</math>
- <math>\mathsf{MgO + H_2O \longrightarrow Mg(OH)_2}</math>
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
- <math>\mathsf{CaO + H_2O \longrightarrow Ca(OH)_2}</math>
- <math>\mathsf{SrO + 2HCl \longrightarrow SrCl_2 + H_2O}</math>
- <math>\mathsf{BaO + Al_2O_3\ \xrightarrow{t^o}\ Ba(AlO_2)_2}</math>
- <math>\mathsf{BaO + 2Al(OH)_3\ \xrightarrow{t^o}\ Ba(AlO_2)_2 + 3H_2O}</math>
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
- <math>\mathsf{Be(OH)_2 + 2KOH \longrightarrow K_2BeO_2 + 2H_2O}</math>
- <math>\mathsf{Be(OH)_2 + 2HCl \longrightarrow BeCl_2 + 2H_2O}</math>
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого <math>Mg(OH)_2</math> до очень сильного <math>Ra(OH)_2</math>, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
- <math>\mathsf{Ba(OH)_2 + SO_3 \longrightarrow BaSO_4 + H_2O}</math>
- <math>\mathsf{3Sr(OH)_2 + 2H_3PO_4\longrightarrow Sr_3(PO_4)_2 + 6H_2O}</math>
- <math>\mathsf{Ra(OH)_2 + Al_2O_3 \longrightarrow Ra(AlO_2)_2 + H_2O}</math>
- <math>\mathsf{Ba(OH)_2 + Zn(OH)_2 \longrightarrow Ba[Zn(OH)_4]}</math>
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
Биологическая роль
Магний содержится в тканях животных и растений (хлорофилл), является кофактором многих ферметативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях, так как схож с ним по свойствам. В организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария и бериллия ядовиты. Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Напишите отзыв о статье «Щёлочноземельные металлы»
Примечания
- ↑ По новой классификации ИЮПАК. По устаревшей классификации относятся к главной подгруппе II группы периодической таблицы.
- ↑ [old.iupac.org/publications/books/rbook/Red_Book_2005.pdf Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005]. — International Union of Pure and Applied Chemistry, 2005. — P. 51.
- ↑ [www.chemsoc.org/visElements/pages/data/intro_groupii_data.html Group 2 — Alkaline Earth Metals], Royal Society of Chemistry.
- ↑ Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
Отрывок, характеризующий Щёлочноземельные металлы
У княжны выступили на глаза слезы досады. Она отвернулась и хотела опять спросить у графини, где пройти к нему, как в дверях послышались легкие, стремительные, как будто веселые шаги. Княжна оглянулась и увидела почти вбегающую Наташу, ту Наташу, которая в то давнишнее свидание в Москве так не понравилась ей.Но не успела княжна взглянуть на лицо этой Наташи, как она поняла, что это был ее искренний товарищ по горю, и потому ее друг. Она бросилась ей навстречу и, обняв ее, заплакала на ее плече.
Как только Наташа, сидевшая у изголовья князя Андрея, узнала о приезде княжны Марьи, она тихо вышла из его комнаты теми быстрыми, как показалось княжне Марье, как будто веселыми шагами и побежала к ней.
На взволнованном лице ее, когда она вбежала в комнату, было только одно выражение – выражение любви, беспредельной любви к нему, к ней, ко всему тому, что было близко любимому человеку, выраженье жалости, страданья за других и страстного желанья отдать себя всю для того, чтобы помочь им. Видно было, что в эту минуту ни одной мысли о себе, о своих отношениях к нему не было в душе Наташи.
Чуткая княжна Марья с первого взгляда на лицо Наташи поняла все это и с горестным наслаждением плакала на ее плече.
– Пойдемте, пойдемте к нему, Мари, – проговорила Наташа, отводя ее в другую комнату.
Княжна Марья подняла лицо, отерла глаза и обратилась к Наташе. Она чувствовала, что от нее она все поймет и узнает.
– Что… – начала она вопрос, но вдруг остановилась. Она почувствовала, что словами нельзя ни спросить, ни ответить. Лицо и глаза Наташи должны были сказать все яснее и глубже.
Наташа смотрела на нее, но, казалось, была в страхе и сомнении – сказать или не сказать все то, что она знала; она как будто почувствовала, что перед этими лучистыми глазами, проникавшими в самую глубь ее сердца, нельзя не сказать всю, всю истину, какою она ее видела. Губа Наташи вдруг дрогнула, уродливые морщины образовались вокруг ее рта, и она, зарыдав, закрыла лицо руками.
Княжна Марья поняла все.
Но она все таки надеялась и спросила словами, в которые она не верила:
– Но как его рана? Вообще в каком он положении?
– Вы, вы… увидите, – только могла сказать Наташа.
Они посидели несколько времени внизу подле его комнаты, с тем чтобы перестать плакать и войти к нему с спокойными лицами.
– Как шла вся болезнь? Давно ли ему стало хуже? Когда это случилось? – спрашивала княжна Марья.
Наташа рассказывала, что первое время была опасность от горячечного состояния и от страданий, но в Троице это прошло, и доктор боялся одного – антонова огня. Но и эта опасность миновалась. Когда приехали в Ярославль, рана стала гноиться (Наташа знала все, что касалось нагноения и т. п.), и доктор говорил, что нагноение может пойти правильно. Сделалась лихорадка. Доктор говорил, что лихорадка эта не так опасна.
– Но два дня тому назад, – начала Наташа, – вдруг это сделалось… – Она удержала рыданья. – Я не знаю отчего, но вы увидите, какой он стал.
– Ослабел? похудел?.. – спрашивала княжна.
– Нет, не то, но хуже. Вы увидите. Ах, Мари, Мари, он слишком хорош, он не может, не может жить… потому что…
Когда Наташа привычным движением отворила его дверь, пропуская вперед себя княжну, княжна Марья чувствовала уже в горле своем готовые рыданья. Сколько она ни готовилась, ни старалась успокоиться, она знала, что не в силах будет без слез увидать его.
Княжна Марья понимала то, что разумела Наташа словами: сним случилось это два дня тому назад. Она понимала, что это означало то, что он вдруг смягчился, и что смягчение, умиление эти были признаками смерти. Она, подходя к двери, уже видела в воображении своем то лицо Андрюши, которое она знала с детства, нежное, кроткое, умиленное, которое так редко бывало у него и потому так сильно всегда на нее действовало. Она знала, что он скажет ей тихие, нежные слова, как те, которые сказал ей отец перед смертью, и что она не вынесет этого и разрыдается над ним. Но, рано ли, поздно ли, это должно было быть, и она вошла в комнату. Рыдания все ближе и ближе подступали ей к горлу, в то время как она своими близорукими глазами яснее и яснее различала его форму и отыскивала его черты, и вот она увидала его лицо и встретилась с ним взглядом.
Он лежал на диване, обложенный подушками, в меховом беличьем халате. Он был худ и бледен. Одна худая, прозрачно белая рука его держала платок, другою он, тихими движениями пальцев, трогал тонкие отросшие усы. Глаза его смотрели на входивших.
Увидав его лицо и встретившись с ним взглядом, княжна Марья вдруг умерила быстроту своего шага и почувствовала, что слезы вдруг пересохли и рыдания остановились. Уловив выражение его лица и взгляда, она вдруг оробела и почувствовала себя виноватой.
«Да в чем же я виновата?» – спросила она себя. «В том, что живешь и думаешь о живом, а я!..» – отвечал его холодный, строгий взгляд.
В глубоком, не из себя, но в себя смотревшем взгляде была почти враждебность, когда он медленно оглянул сестру и Наташу.
Он поцеловался с сестрой рука в руку, по их привычке.
– Здравствуй, Мари, как это ты добралась? – сказал он голосом таким же ровным и чуждым, каким был его взгляд. Ежели бы он завизжал отчаянным криком, то этот крик менее бы ужаснул княжну Марью, чем звук этого голоса.
– И Николушку привезла? – сказал он также ровно и медленно и с очевидным усилием воспоминанья.
– Как твое здоровье теперь? – говорила княжна Марья, сама удивляясь тому, что она говорила.
– Это, мой друг, у доктора спрашивать надо, – сказал он, и, видимо сделав еще усилие, чтобы быть ласковым, он сказал одним ртом (видно было, что он вовсе не думал того, что говорил): – Merci, chere amie, d’etre venue. [Спасибо, милый друг, что приехала.]
Княжна Марья пожала его руку. Он чуть заметно поморщился от пожатия ее руки. Он молчал, и она не знала, что говорить. Она поняла то, что случилось с ним за два дня. В словах, в тоне его, в особенности во взгляде этом – холодном, почти враждебном взгляде – чувствовалась страшная для живого человека отчужденность от всего мирского. Он, видимо, с трудом понимал теперь все живое; но вместе с тем чувствовалось, что он не понимал живого не потому, чтобы он был лишен силы понимания, но потому, что он понимал что то другое, такое, чего не понимали и не могли понять живые и что поглощало его всего.
– Да, вот как странно судьба свела нас! – сказал он, прерывая молчание и указывая на Наташу. – Она все ходит за мной.
Княжна Марья слушала и не понимала того, что он говорил. Он, чуткий, нежный князь Андрей, как мог он говорить это при той, которую он любил и которая его любила! Ежели бы он думал жить, то не таким холодно оскорбительным тоном он сказал бы это. Ежели бы он не знал, что умрет, то как же ему не жалко было ее, как он мог при ней говорить это! Одно объяснение только могло быть этому, это то, что ему было все равно, и все равно оттого, что что то другое, важнейшее, было открыто ему.
Разговор был холодный, несвязный и прерывался беспрестанно.
– Мари проехала через Рязань, – сказала Наташа. Князь Андрей не заметил, что она называла его сестру Мари. А Наташа, при нем назвав ее так, в первый раз сама это заметила.
– Ну что же? – сказал он.
– Ей рассказывали, что Москва вся сгорела, совершенно, что будто бы…
Наташа остановилась: нельзя было говорить. Он, очевидно, делал усилия, чтобы слушать, и все таки не мог.
– Да, сгорела, говорят, – сказал он. – Это очень жалко, – и он стал смотреть вперед, пальцами рассеянно расправляя усы.
– А ты встретилась с графом Николаем, Мари? – сказал вдруг князь Андрей, видимо желая сделать им приятное. – Он писал сюда, что ты ему очень полюбилась, – продолжал он просто, спокойно, видимо не в силах понимать всего того сложного значения, которое имели его слова для живых людей. – Ежели бы ты его полюбила тоже, то было бы очень хорошо… чтобы вы женились, – прибавил он несколько скорее, как бы обрадованный словами, которые он долго искал и нашел наконец. Княжна Марья слышала его слова, но они не имели для нее никакого другого значения, кроме того, что они доказывали то, как страшно далек он был теперь от всего живого.
– Что обо мне говорить! – сказала она спокойно и взглянула на Наташу. Наташа, чувствуя на себе ее взгляд, не смотрела на нее. Опять все молчали.
– Andre, ты хоч… – вдруг сказала княжна Марья содрогнувшимся голосом, – ты хочешь видеть Николушку? Он все время вспоминал о тебе.
Князь Андрей чуть заметно улыбнулся в первый раз, но княжна Марья, так знавшая его лицо, с ужасом поняла, что это была улыбка не радости, не нежности к сыну, но тихой, кроткой насмешки над тем, что княжна Марья употребляла, по ее мнению, последнее средство для приведения его в чувства.
– Да, я очень рад Николушке. Он здоров?
Когда привели к князю Андрею Николушку, испуганно смотревшего на отца, но не плакавшего, потому что никто не плакал, князь Андрей поцеловал его и, очевидно, не знал, что говорить с ним.
wiki-org.ru
Щёлочноземельные металлы — это… Что такое Щёлочноземельные металлы?
| Группа → | 2 | ||
|---|---|---|---|
| ↓ Период | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 | |||
| 7 |
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1]периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
Литература
dikc.academic.ru
