Урок 9. Щелочные и щёлочноземельные металлы – HIMI4KA

Щелочные металлы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает


Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
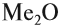
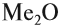
Этот оксид растворяется в воде, реагирует с нею:


Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:


Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:


Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:




Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:


Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:


Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.


Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
Вопросы
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na+ и OH– притягиваются слабее, чем Са2+ и ОН–.
Поэтому первые два элемента этой подгруппы не образуют щелочей:
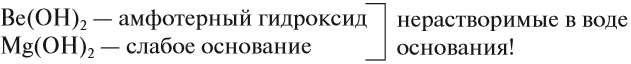
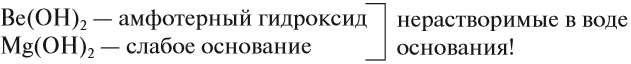
Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
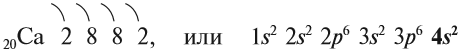
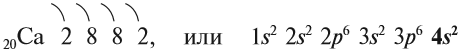
Имея два валентных электрона: …4s2, кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
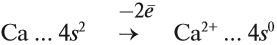
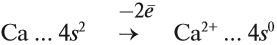
Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
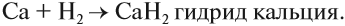
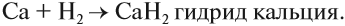
Рассмотрим как происходит взаимодействие кальция с азотом:


Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:


Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).
Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
- Са(ОН)2 + СO2 →
- Са(ОН)2 + H3PO4 →
- Са(ОН)2 + Na2CO3 →
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:


Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни. Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
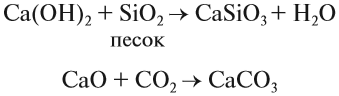
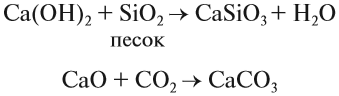
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
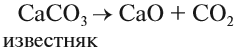
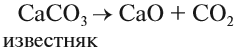
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
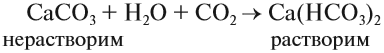
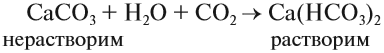
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
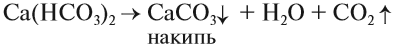
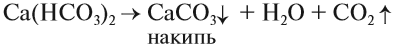
Накипь, конечно, можно растворить при помощи соляной кислоты:


Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:


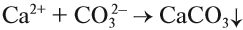
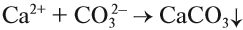
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.


Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba. Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Щелочные и щелочноземельные металлы — это… Что такое Щелочные и щелочноземельные металлы?
- Щелочные и щелочноземельные металлы
(хим.), или металлы щелочей и щелочных земель. Нерастворимые в воде окислы металлов, а также и некоторых неметаллов прежде называли землями за их порошковый вид. Среди этих земель легко отличить такие, которые хотя и мало растворимы, но образуют более или менее прочные гидраты, обладающие явной щелочной реакцией. Металлы, дающие щелочные земли, принадлежат к более основной подгруппе II группы периодической системы, т. е. это Mg, Са, Sr, Ва и, может быть, Ra (радий). Металлы, окиси коих хорошо растворимы в воде и дают прочные гидраты, которые называются едкими щелочами, по преимуществу принадлежат к более основной подгруппе I группы периодической системы, т. е. это Li, Na, К, Rb и Cs.
С. Колотов.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон. 1890—1907.
- Щелочная синь
- Апсида
Смотреть что такое «Щелочные и щелочноземельные металлы» в других словарях:
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — ПОДГРУППА IIA БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ Строго говоря, эта подгруппа состоит из двух типов элементов. Бериллий и магний элементы коротких периодов более сходны между собой, чем с другими четырьмя… … Энциклопедия Кольера
щелочноземельные металлы — [alkali earth metals] группа, включающая Са, Sr, Ba и Ra; первые три применяются в металлургии в качестве раскислителей; Смотри также: Металлы щелочные металлы чистые металлы ультрачистые металлы … Энциклопедический словарь по металлургии
ЩЕЛОЧНЫЕ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — Щелочные и щелочноземельные металлы и их соли (Na, К, Mg, Ca, Sr, Li, Ba). Соли щелочных и щелочноземельных металлов присутствуют в сточных водах машиностроительной, целлюлозно бумажной, химической, азотнотуковой, электротехнической, красильной,… … Болезни рыб: Справочник
Щелочные — и щелочноземельные Металлы (хим.), или Металлы щелочей ищелочных земель. Нерастворимые в воде окислы металлов, а также инекоторых неметаллов, прежде называли землями за их порошковый вид.Среди этих земель легко отличить такие, который хотя и мало … Энциклопедия Брокгауза и Ефрона
МЕТАЛЛЫ — МЕТАЛЛЫ, простые хим. вещества (элементы), обладающие комплексом характерных, б. или м. ясно выраженных физ. признаков, создающих благоприятные условия для их практического применения, как то: твердость, ковкость, специфический блеск, высокий уд … Большая медицинская энциклопедия
МЕТАЛЛЫ — МЕТАЛЛЫ, химические элементы, обладающие высокой тепло и электропроводностью, атомы которых связаны в кристаллические решетки единственным в своем роде способом. Смеси таких элементов (СПЛАВЫ) также являются металлами. Около трех четвертей всех… … Научно-технический энциклопедический словарь
Металлы как горючие — Металлы как ракетное горючие, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но уменьшает… … Википедия
Металлы как горючее — Металлы как ракетное горючее, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но… … Википедия
Щелочные металлы — Группа → 1 ↓ Период 2 3 Литий … Википедия
щелочные металлы — [alkali metals] группа, включающая Li, Na, К, Rb, Cs, Fr. Смотри также: Металлы чистые металлы ультрачистые металлы тяжелые металлы … Энциклопедический словарь по металлургии
Книги
- Химия за 30 секунд, Коллектив авторов. Химические элементы – это строительные кубики жизни, но все ли мы знаем о них? Можете ли вы поддержать разговор о достижениях современной науки за обедом с друзьями? А знаете ли вы, какой… Подробнее Купить за 189 руб аудиокнига
ЩЕЛОЧНЫЕ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — это… Что такое ЩЕЛОЧНЫЕ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ МЕТАЛЛЫ?
ЩЕЛОЧНЫЕ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
Щелочные и щелочноземельные металлы и их соли (Na, К, Mg, Ca, Sr, Li, Ba). Соли щелочных и щелочноземельных металлов присутствуют в сточных водах машиностроительной, целлюлозно-бумажной, химической, азотнотуковой, электротехнической, красильной, полиграфической и резиновой промышленностей. Поступление калия происходит в результате вымывания из почв калийных удобрений, а также с атмосферной пылью.
Токсичность.
Гипертонические растворы солей, особенно несбалансированные, действуют на пресноводных рыб как настоящие яды. По данным Schmitz, пороговые концентрации хлоридов составляют для карпа и линя 5,0 г/л, окуня — 10,7 г/л, угря и форели — 11,25 г/л. Для большинства пресноводных рыб безвредной границей солености считают 1,0 г/л (1%о). Многие пресноводные рыбы не способны жить н в морской воде, в которой соли сбалансированы. Так, уклея, гольян, карп, линь, пескарь погибают в морской воде в среднем за 1 ч. При разбавлении ее до 20 — 30%-ной концентрации она становится безвредной.
Щелочные и щелочно-земельные металлы относятся к группе слаботоксичных веществ. В нижеследующей таблице приведены те соединения, токсичность которых обусловлена катионами или изменением солености (о других солях см. ). Токсические концентрации этих соединений для кормовых организмов находятся примерно в тех же границах, что и для рыб.
| Токсичность некоторых соединений щелочных и щелочно-земельных металлов для рыб | |||||
| Металл | Соединение | Вид рыб | Летальные концентрации | Авторы | |
| г/л | экспозиция | ||||
| Na | NaCl | Плотва, линь, карп и др. | 12,0 — 15,0 | 24 ч | Н. Liebmann, 1960 |
| NaBr | Карп | 25,0 | 24 ч | Тот же | |
| NaClO3 | Карп, плотва | 18,0 | 24 ч | ” | |
| NaNO3 | Плотва | 15,0 | 24 ч | ” | |
| Колюшка | 1,85 | 24 ч | J. Jones, 1939 | ||
| Карп | 20,0 | 4 ч | Scheuring и др., 1934 | ||
| NaNO2 | Гольян | 0,5 | 45 ч | Klinger, 1957 | |
| Американский сомик | 0,029 | 48 ч | М. Kanikoff, 1975 | ||
| Na2SO4 | Карась | 19,7 | 8 дней | Scheuring и др., 1950 | |
| Линь, окунь | 19,7 | 2 дня | Те же | ||
| Радужная форель | 19,7 | 34 ч | ” | ||
| NaHCO3 | Карп | 10,0 | 48 ч | Н. Liebmann, 1960 | |
| Na2CO3 | Лососевые рыбы | 0,07 — 0,08 | 5 дней | М. Грушко, 1969 | |
| Карповые | 0,3 — 0,5 | 4 дня | Тот же | ||
| K | KCl | Окунь | 10,0 | 18 ч | Н. Liebmann, 1960 |
| Карась | 4,0 | 24 ч | Тот же | ||
| K2S04 | Угорь | 4,3 | 24 ч | ” | |
| Карп, форель | Больше 20,0 | 24 ч | ” | ||
| Угорь | 5,0 | 24 ч | ” | ||
| K3P04 | Рыбы | 1,0 | 24 ч | Wallen и др., 1957 | |
| Са | CaCl2 | Карп, окунь | 15,0 | 24 ч | Н. Liebmann, 1960 |
| Mg | MgCl2 | Золотые рыбки | 10,3 | 16 ч | Тот же |
| Mg(N03)2 | Карп | 20,0 | 5 дней | ” | |
| Золотые рыбки | 11,7 | 15 ч | ” | ||
| Колюшка | 1,8 | 10 дней | J. Jones, 1939 | ||
| MgSO4 | Угорь | 31,0 | 24 ч | Н. Liebmann, 1960 | |
| Ва | BaCl2 | Лосось серебристый (молодь) | 15,8 мг Ва/л | 72 ч | Я. М. Грушко, 1972 |
| Угорь | 2,0 | 36 ч | Н. Liebmann, 1960 | ||
| Золотые рыбки | 9,4 | 14 ч | Тот же | ||
| Ba(NO3)2 | Колюшка | 0,5 | 7 дней | J. Jones, 1939 | |
| Li | LiCl | Молодь ручьевой форели | 10,6 | 16 ч | Н. Liebmann, 1960 |
Симптомы и патоморфологические изменения. В высоких концентрациях соли натрия и других элементов обладают локальным действием. Кожа и жабры рыб обильно покрываются слизью. При отравлении солями натрия кожа становится темной, а калия — более светлой. В жабрах наблюдается сморщивание и распад эпителия. При снижении концентрации соли действуют на нервную систему, вызывая паралич нервно-мышечного аппарата. Отравившиеся рыбы плавают кругообразно, а затем толчкообразно, слабо реагируют на раздражения, опрокидываются на бок и гибнут с явлениями паралича. Дыхание у них неравномерное, дыхательный ритм ускорен. Смерть наступает от асфиксии. При воздействии нитритов кровь становится темно-шоколадного цвета, сохраняющегося несколько часов после смерти. В ней резко повышено количество метгемоглобина.
Повышение содержания ионов калия в воде н крови рыб сопровождается нарушением осмотического равновесия и увеличением или уменьшением размера ядер эритроцитов.
Диагноз основан на анализе характера течения интоксикации, определении степени загрязнения водоема и выявления источников поступления сточных вод, содержащих соединения металлов.
По результатам определения жесткости воды и содержания хлоридов, сульфатов, нитратов судят о степени солености воды. Для определения концентрации металлов применяют специальные колориметрические и спектрографические методы.
Профилактика заключается в соблюдении установленных для рыбоводства гидрохимических нормативов. Допустимые пределы их составляют: жесткость — более 7 мг-экв/л, сульфат-ионы — 100 мг/л, хлорид-ионы — 300 мг/л, нитрат-ионы — 40 мг/л (9,1 мг/л N), нитрит-ионы — 0,08 мг/л (0,02 мг/л N), катионы Na — 120 мг/л, Са — 180 мг/л, К — 50 мг/л, Mg — 40 мг/л.
Болезни рыб: Справочник. — М.. Г. В. Васильков, Л. И. Грищенко, В. Г. Енгашев и др.; Под ред. В. С. Осетрова.. 1989.
11 класс. Химия. Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий — Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы.
Комментарии преподавателя
1. Общие свойства металлов
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы). У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.


Рис. 1
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
2. Щелочные металлы
Свойства металлов
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
2Na + S  Na2S
Na2S
2Na + h3 2NaH
2NaH
3Na + P  Na3P
Na3P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
Li3N + 3h3O → 3LiOH + Nh4↑
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2h3O → 2LiOH + h3↑
4. Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 h3O
8Na + 5h3SO4 (конц) → 4Na2SO4 + h3S↑ + 4h3O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
|
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ |
|
|
NaOH |
Едкий натр (каустическая сода) |
|
NaCl |
Поваренная соль |
|
NaNO3 |
Чилийская селитра |
|
Na2SO4∙10h3O |
Глауберова соль |
|
Na2CO3∙10h3O |
Сода кристаллическая |
|
KOH |
Едкое кали |
|
KCl |
Хлорид калия (сильвин) |
|
KNO3 |
Индийская селитра |
|
K2CO3 |
Поташ |
3. Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl2→ 2СaCl2
Сa + S  СaS
СaS
Сa + h3 Сah3
Сah3
3Сa + 2P  Сa3 P2-
Сa3 P2-
2. Взаимодействие с кислородом
2Сa + O2 → 2CaO
3. Взаимодействие с водой
Sr + 2h3O → Sr(OH)2 + h3↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4h3O
4Ca + 10h3SO4 (конц) → 4CaSO4 + h3S↑ + 5h3O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al  3Ba + Al2O3
3Ba + Al2O3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.

Рис. 2
СaO + h3O → Ca(OH)2
Ca(OH)2 + CO2↑ → CaCO3↓+ h3O
CaCO3↓+ h3O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2h3O, алебастр – CaSO4∙0,5h3O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.

Рис. 3
Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2h3O →Ca(OH)2 + C2h3↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.

Рис. 4
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Ca(HCO3)2  CaCO3↓ + СО2↑ + Н2О
CaCO3↓ + СО2↑ + Н2О
Постоянная жесткость воды обусловлена наличием катионов Ca2+., Mg2+ и анионов h3PO4- ,Cl-, NO3- и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
4. Алюминий
Алюминий и его соединения
Алюминий занимает 4-е место по распространенности в земной коре, уступая кремнию, кислороду и водороду. В природе он присутствует в виде алюмосиликатов, глин и бокситов. Рис. 5.

Рис. 5
По своим химическим свойствам он гораздо менее активен, чем щелочные и щелочноземельные металлы. Во многом это связано с образованием не его поверхности тончайшей пленки оксида, которая препятствует или замедляет многие химические реакции.
Химические свойства алюминия
1. Реакция с галогенами
2Al + 3I2 2AlI3
2AlI3
2. Сгорает при нагревании с выделением большого количества теплоты
4Al + 3O2 2Al2O3 + Q . При этом может развиваться температура до 35000С.
2Al2O3 + Q . При этом может развиваться температура до 35000С.
3. Реакция с неметаллами
2Al + 3S  Al2S3
Al2S3
2Al + N2 2AlN
2AlN
4Al + 3С  Al4С3
Al4С3
4. Взаимодействует с водой
2Al + 6h3O → 2Al(OH)3 +3h3↑ Если снять амальгамированием или механически пленку.
Амальгамирование – это нанесение на поверхность небольшого количества ртути.
5. Алюминий активно восстанавливает металлы из их оксидов (алюмотермия)
Cr2O3 + 2Al → Al2O3 + 2Cr; этот способ используется при получении многих металлов: Mn, Cr, V, W, Ba, Sr и др.
6. Взаимодействует с кислотами-неокислителями
2Al + 6HCl →2AlCl3 + 3h3↑
Алюминий не реагирует с концентрированными азотной и серной кислотами из-за пассивации. С разбавленной серной или азотной кислотой взаимодействует
8Al + 30HNO3 →8Al(NO3)3 + 3Nh5NO3 + 9h3O
7. Взаимодействие со щелочами. Al, Al2O3, Al(OH)3 взаимодействуют со щелочами:
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑ (амфотерные свойства).
Al2O3 + 2NaOH = 2NaAlO2 + h3O
8. Реагирует с растворами солей
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Применение алюминия

Рис. 6
Алюминий широко применяется в быту и технике, так как он довольно легок, коррозионно-устойчив и нетоксичен. См. Рис. 6. Часто используются сплавы алюминия. Основной – это дуралюмин (дюралюминий, дюраль). Это сплав алюминия, содержащий медь (массовая доля – 1,4-13%) и небольшие количества магния, марганца и других компонентов. Используется как конструкционный материал в авиа- и машиностроении.
5. Смеси, регенерирующие кислород
Оксиды и пероксиды способны реагировать с углекислым газом, образуя карбонат и кислород.
Na2O2 + CO2 → Na2CO3 + 1/2O2
KO2 + CO2 → K2CO3 + 3/2O2
Если сложить эти 2 уравнения реакции, то получится смесь, выделяющая и 2 моль углекислого газа, и 2 моль кислорода.
Na2O2 + 2KO2 + 2 CO2 → Na2CO3 + K2CO3 + 2О2. Суммарный объём газа в левой и правой части уравнения будет одинаков. Постоянство объёма газа очень важно, так как такие смеси применяются для удаления CO2 и превращения его в нужный для дыхания кислород, например, в подводных лодках или космических станциях. Но там не должно происходить перепада давления.
Подведение итога урока
На уроке была раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий». Вы узнали общие свойства и закономерности щелочных и щелочноземельных элементов, изучили по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений было рассмотрено такое понятие, как жесткость воды. Познакомились с алюминием, его свойствами и сплавами. Вы узнали, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
ИСТОЧНИКИ
источник видео — https://www.youtube.com/watch?v=VMT8vWlJOdM
https://www.youtube.com/watch?v=tvve_WN4DBk
источник презентации — http://ppt4web.ru/khimija/khimicheskie-svojjstva-metallov0.html
источник презентации — http://prezentacii.com/po_himii/1661-schelochnye-metally.html
источник презентации — http://prezentacii.com/po_himii/6431-schelochnozemelnye-metally.html
источник презентации — http://presentaci.ru/download/75082/
Разница между щелочными металлами и щелочноземельными металлами — Разница Между
Все элементы на земле можно разделить на металлы, неметаллы, металлоиды и инертные газы. Инертные газы — это элементы с нулевой реакционной способностью из-за наличия стабильного внешнего октета. Мет
Основное отличие — щелочные металлы от щелочноземельных металлов
Все элементы на земле можно разделить на металлы, неметаллы, металлоиды и инертные газы. Инертные газы — это элементы с нулевой реакционной способностью из-за наличия стабильного внешнего октета. Металлоиды — это элементы, которые обладают определенными свойствами как металлов, так и неметаллов. Неметаллы — это элементы, которые не обладают какими-либо свойствами металлов. Металлы — это элементы, обладающие уникальным набором свойств, в том числе отличной электрической и теплопроводностью и блеском. Металлы размещаются на левой стороне и средней части таблицы Менделеева. Все металлы в периодических таблицах делятся на три группы, а именно; щелочные металлы, щелочноземельные металлы и переходные металлы. Основное различие между щелочными металлами и щелочноземельными металлами заключается в том, что щелочные металлы имеют один валентный электрон на самой внешней орбите в то время как щелочноземельные металлы имеют два валентных электрона на самой внешней орбите.
В этой статье рассматриваются,
1. Что такое щелочные металлы
— определение, характеристики, свойства, примеры
2. Что такое щелочноземельные металлы?
— определение, характеристики, свойства, примеры
3. В чем разница между щелочными металлами и щелочноземельными металлами
Какие щелочные металлы
Щелочные металлы — это элементы, которые имеют только один валентный электрон в своей внешней оболочке. Эти металлы помещаются в группу IA периодической таблицы. Эти металлы включают литий, натрий, калий, рубидий, цезий и франций. Пожертвовав один электрон во внешней оболочке атому, принимающему электроны, эти металлы становятся положительно заряженными и получают электронную конфигурацию благородного газа. Все щелочные металлы являются ионными и показывают электровалентность. Тенденция к донорству электронов возрастает вниз по группе, поскольку положительно заряженное ядро имеет меньше сил притяжения к внешнему электрону из-за присутствия большего количества заполненных электронами внутренних оболочек. В отличие от большинства других металлов, щелочные металлы мягкие с низкой плотностью и низкой температурой плавления. Эти металлы являются наиболее реакционноспособными из всех металлов периодической таблицы.
Что такое щелочноземельные металлы
Щелочноземельные металлы — это металлы, которые имеют два валентных электрона в своей внешней оболочке. Существует шесть щелочноземельных металлов, в том числе бериллий, магний, кальций, стронций, барий и радий. Они становятся стабильными, приобретая электронную конфигурацию благородных газов за счет пожертвования их внешних электронов. Когда электроны отдаются электроотрицательному атому, щелочноземельные металлы становятся положительно заряженными. Щелочноземельные металлы являются высокореактивными металлами и помещаются во второй столбец периодической таблицы. Эти металлы являются строительными блоками для всего в мире. Эти металлы часто встречаются в форме сульфатов в природе. Примеры включают минералы, такие как гипс; сульфат кальция, эпсомит; сульфат магния и барит; сульфат бария.
Рисунок 1: Периодическая таблица, показывающая щелочные и щелочноземельные металлы
Разница между щелочными металлами и щелочноземельными металлами
Количество электронов в самой внешней оболочке атома
Щелочные металлы: Каждый щелочной металл имеет один электрон.
Щелочноземельные металлы: Каждый щелочноземельный металл имеет два электрона.
Природа металла
Щелочные металлы: Щелочные металлы мягкие.
Щелочноземельные металлы: Щелочноземельные металлы являются твердыми.
Точки плавления
Щелочные металлы: Щелочные металлы имеют низкие температуры плавления.
Щелочноземельные металлы: Щелочные металлы имеют относительно высокие температуры плавления.
Природа гидроксида металла
Щелочные металлы: Гидроксиды щелочных металлов являются сильно основными.
Щелочноземельные металлы: Гидроксиды щелочноземельных металлов являются относительно менее основными.
Разложение карбонатов
Щелочные металлы: Карбонаты щелочных металлов не разлагаются.
Щелочноземельные металлы: Карбонаты щелочноземельных металлов разлагаются с образованием оксида при нагревании до высоких температур.
Нагрев нитратов
Щелочные металлы: Нитраты щелочных металлов дают соответствующие нитраты и кислород в качестве продуктов.
Щелочноземельные металлы: Нитраты щелочноземельных металлов дают соответствующие
Урок по химии на тему «Щелочные и щелочно
 Тема: Щелочные и щелочно — земельные металлы.
Тема: Щелочные и щелочно — земельные металлы.
Студенты I курса;
Цели и задачи:
Образовательная:
— изучение подгрупп щелочных и щелочноземельных металлов по периодической системе;
— понятия о физических свойствах;
— понятия о химических свойствах;
— соединения щелочных и щелочноземельных металлов, их свойства и нахождение в природе.
Воспитательная:
— развитие умения слушать учителя;
— воспитывать высокую работоспособность и организованность;
— формирование атмосферы сотрудничества в системе студент- преподаватель.
Развивающая:
— прививать интерес к изучаемой дисциплине;
— навык работы с опорными конспектами;
— формирование умений работы в парах, навыков взаимоконтроля, самостоятельной творческой работы.
Методическая идея занятия:
— реализация деятельностного подхода и работа с опорными конспектами.
Тип занятия: комбинированный урок.
Вид занятия: урок усвоения новых знаний с использованием информационно- компьютерных технологий и опорных конспектов.
Учебно-организационная деятельность:
— фронтальная, индивидуальная, парная.
Средства обучения:
— мультимедиа презентация;
— периодическая система;
— опорные конспекты;
— дидактические материалы.
Материально- техническое обеспечение занятия: компьютер, проектор, экран.
Вид контроля: тематический.
Методы контроля:
-устный фронтальный опрос;
— письменный тестовый контроль;
— творческие задания: подготовка презентаций по истории открытия и нахождения в природе металлов.
Методы обучения:
— объяснительно- иллюстративный;
— частично- поисковый;
— фреймовые опоры;
— тестирование.
Междисциплинарные связи: история, информатика, биология, география.
Литература:
Этапы деятельностиВремя
Деятельность преподавателя
Деятельность обучающихся
Примечание
1. Организационный момент занятия
— взаимное приветствие;
— определение отсутствующих;
— организация студентов на учебную деятельность;
— знакомство студентов с порядком проведения занятия
— сообщение фамилий отсутствующих;
— указание причин отсутствия.
Организация внимания студентов для работы на занятиях.
Таблица личных достижений, знакомство с критериями.
2. Проверка уровня усвоения предыдущих знаний, необходимых при изучении нового материала.
1. Что такое период, на что указывает номер периода.
2. Группа, на что указывает номер группы.
3. Порядковый номер, его значение.
4. Закономерности изменения свойств элементов в периоде?
5. Закономерности изменения свойств элементов в группе?
6. Место нахождения металлов и особенности строения атомов металлов.
7. Чем являются металлы в реакциях и какова их степень окисления?
Студенты отвечают на вопросы, выполняют тесты по вариантам, осуществляют взаимопроверку.
Выявление знаний периодической системы и строения атомов металлов.
Формирование заинтересованности студентов осваивать новые знания.
3.Обобшение информации преподавателем.
Мы обобщили знания о периодической системе и общей характеристики металлов. Можно приступить к изучению новой темы.
4. Изучение нового материала.
Преподаватель напоминает, что результаты студенты будут фиксировать в таблице личных достижений и критериями оценок.
Преподаватель излагает ассоциацию. Они в семиэтажном доме.
На верхнем уровне имея электронов один иль два
В квартирах восстановителей- героев,
Вы угадали кто это друзья?
Дополнительная ассоциация: никогда не встречаются в свободном виде, легко режутся ножом. С этими металлами связаны хорошо известные нам вещества: сода, поваренная соль, марганцовка, зола.
Что это за металлы?
Студенты работают над определением темы занятия. Создают банк ассоциаций в тетради
Студенты участвуют в обсуждении, выдвигают предположения. Фиксируют ассоциации в тетрадь.
Студенты должны понять чему они будут учиться.
5. Сообщение темы и формирование цели учебного занятия.
Тема: Щелочные и щелочноземельные металлы.
План занятия:
1. Положение в переодической системе.
2. Изменение свойств в группах.
3. Физические свойства.
4. Химические свойства.
5. Соединения щелочных и щелочноземельных металлов.
6. История открытия и нахождения в природе.
Записывают тему и план занятия.
Изучают тему с использованием мультимедийной презентации, опорных конспектов.
Презентация творческих работ.
Преподаватель говорит о практической значимости темы.
Вовлечение студентов в учебный процесс. Развитие самооценки творческих способностей.
6. Рефлексия
Преподаватель задаёт вопросы для проверки степени усвоения нового материала.
— особенности строения щелочных и щелочноземельных металлов.
— особенности физических свойств.
— изменение свойств соединений металлов.
— что для себя узнали нового?
— подчеркнуть ассоциации действительно верные.
— добавить ассоциации изученные на занятии.
Студенты отвечают на вопросы, заполняют таблицы смежных достижений, переводят баллы в оценки.
Возвращение к ассоциациям.
Осознание студентами того, что было изучено на занятии.
7. Домашнее задание.
Дополнить опорный конспект уравнениями химических реакций.
Студенты получают опорный конспект.
8. Подведение итогов занятия.
Преподаватель подводит итоги занятия, выделяет наиболее активных студентов, подводит итоги.
Студенты оценивают свою работу.
Занятие завершается формируется позитивное отношение к дисциплине.
Преподаватель: Неделькина И. М.
Приложение
Опорный конспект.
Щелочноземельные металлы и их соединения.
Строение атома и расположение в периодической системе. (2 группа, главная подгруппа)
Me= Be, Mg, Ca, Sr, Ba, Ra
увеличение→атомного номера, радиуса атома, металлических свойств, восстановительных свойств
Схема распределения валентных электронов
s p
n↑↓→→→-2e (степень окисления +2, валентность 2)
Природные соединения и минералы:
разновидности берилла: 3BeO∙Al2O3∙6SiO2+Cr2O3— изумруд
3BeO∙Al2O3∙6SiO2+ Fe- аквамарин
(BeAl2)O4+Cr- александрит
Mg: MgCO3∙CaCO3-доломит
MgCO3-магнезит
MgCl2∙6H2O- бишофит
Сa: CaCO3— кальцит
CaSO4∙2H2O- гипс
СаF2— флюорит
Физические свойства
Мео→Металлическая кристаллическая решётка→Металл. хим. связь→
Химические свойства
I. Взаимодействует с простыми веществами
Meo→H2 t MeH2
→Cl2 t MeCl2
→C t MeC2
→S t MeS
→O2 t MeO
II. Взаимодействуют со сложными веществами
Meo→H2O кроме Ве Me(ОH)2
→НCl MeCl2+Н2
→разб. HNO3 Me(NO3)2+NH4NO3+H2O
→конц. HNO3 Me(NO3)2+N2O+H2O
→конц. H2SO4 MeSO4+H2S+H2O
→соли Ме кислотный остаток +Ме
Соединения щелочноземельных металлов
Оксиды основные (кроме ВеО) Ме=О МеО
Гидроксиды Ме(ОН)2 Ме-ОН
\
ОН
Ве(ОН)2, Mg(OH)2, Ca(OH)2, Sr(OH)2, Ba(OH)2
→→→→→→→→→→→→→→→→→→→
увеличение силы основания и растворимости
Опорный конспект.
Щелочные металлы и их соединения.
Щелочные металлы- это металлы которые при взаимодействии с водой образуют растворимые основания- щёлочи.
Строение атома и расположение в периодической системе. (1 группа, главная подгруппа)
Me= Li, Na, K, Rb, Cs, Fr
увеличение→атомного номера, радиуса атома, металлических свойств, восстановительных свойств
Схема распределения валентных электронов
s p
n↑→→→-1e (степень окисления +1, валентность 1)
Природные соединения и минералы:
NaCl-галит (каменная соль)
KCl-сильвит
K[AlSi3O8]-калиевый полевой шпат, ортоклаз
Физические свойства
Мео→Металлическая кристаллическая решётка→Металл. хим. связь→
Химические свойства
I. Взаимодействует с простыми веществами
Meo→H2 t MeH
→Cl2 t MeCl
→C t Me2C2
→S t Me2S
→O2 t Me2O
II. Взаимодействуют со сложными веществами
Meo→H2O н.у MeОH+Н2
→НCl MeCl+Н2
→разб. HNO3 MeNO3+NH4NO3+H2O
→конц. HNO3 MeNO3+N2O+H2O
→конц. H2SO4 Me2SO4+H2S+H2O
→соли Ме кислотный остаток +Ме
Соединения щелочных металлов
Оксиды основные Ме2О Ме-О-Ме
Гидроксиды (щёлочи) Ме-О-Н
МеОН↔Ме++ОН—
Приложение №1. Тест.
В-I
1. Четыре электрона находятся во внешнем слое атома
а) кислорода; в) бериллия
б) кремния; г) калия
2. Металлические свойства в ряду элементов В→Al→Ca
а) увеличиваются в) равны
б) уменьшаются г) не меняются
3. В атоме химического элемента, расположенном в III периоде, V группе общее число электронов
а) 3 б) 5 в) 15 г) 31
4. Неметаллические свойства больше, чем у кислорода
а) Ca б) N в) F г) Na
5. В ряду элементов Li→Na→K увеличивается
а) число электронов на внешнем уровне
б) радиус атома
в) неметаллические свойства
г) степень окисления
6. Число электронов во внешнем слое атома, ядро которого содержит 12 протонов, равно
а) 4 б) 6 в) 8 г)2
7. Кремний в соединениях является
а) окислителем в) окислителем и восстановителем
б) восстановителем г) нейтральным
8. Степень окисления кислорода в соединении Na2O
а) +2 б)0 в)-1 г)-2
9. Правильные утверждения- это:
а) период включает элементы многих групп
б) каждый период обязательно содержит s-, p- и d-элементы
в) каждая А-группа состоит из 6 элементов
г) переходные элементы расположены между s- элементами (слева) и р-элементами (справа)
10. В периодической системе элементов номер периода всегда соответствует числу
а) всех электронов в атоме
б) валентных электронов в атоме
в) электронов только на внешнем уровне атома
г) уровней, по которым распределены электроны в атоме
11. Порядковый номер элемента соответствует в атоме
а) сумме числа протонов и числа нейтронов
б) сумме числа протонов и числа электронов
в) разности округлённой атомной массы и числа электронов
г) разности округлённой атомной массы и числа нейтронов
12. Набор, содержащий только металлы, — это
а) Са, Не, Sr, Ar
б) Ag, Ne, Mo, Cl
в) Сd, Hg, Cr, Mn
г) Na, Mg, Si, Al
13. Неметаллические свойства в ряду элементов F-O-S-P
а) усиливаются в) не изменяются
б) ослабевают г) не знаю
В-II
1. Число электронов во внешнем слое атома, ядро которого содержит 20 протонов, равно
а) 15 б) 2 в) 7 г) 1
2. Неметаллические свойства простых веществ усиливаются в ряду
а) P→Si→Al
б) F→Cl→Br
в) Se→S→O
г) N→P→As
3. Степень окисления водорода в соединении NH3 равна
а) +2 б) -3 в) +1 г) +3
4. В ряду элементов Na→Mg→Al уменьшаются
а) неметаллические свойства
б) радиус атома
в) металлические свойства
г) число электронов на внешнем слое
5. В атоме химического элемента, расположенном в I группе, в III периоде общее число электронов
а) 15 б) 9 в) 11 г) 20
6. Магний в соединениях является
а) окислителем
б) восстановителем
в) нейтральным
г) окислителем и восстановителем
7. Металлические свойства больше чем у Li
а) Al
б) K
в) S
г) B
8. Шесть электронов во внешнем слое находится у атома
а) S
б) Fe
в) B
г) Na
9. В периодической системе элементов номер группы всегда соответствует числу
а) всех электронов в атоме
б) валентных электронов в атоме
в) электронов только на внешнем уровне атома
г) уровней, по которым распределены электроны в атоме
10. В 4-м периоде число элементов равно
а) 2 б) 8 в) 18 г)32
11. Сходные химические свойства имеют элементы
а) Ca и Сl
б) Cr и Se
в) Ge и Sn
г) Al и Ar
12. Неметаллические свойства галогенов с увеличением порядкового номера
а) возрастают
б) понижаются
в) остаются без изменений
г) не знаю
13. Неметаллические свойства в ряду элементов Al-Si-C-N
а) усиливаются в) не изменяются
б) ослабевают г) не знаю


Тест 2
В-II
1. Самый активный щелочной металл:
а)Na; б)K; в)Li; г)Сs.
2. Раствор гидроксида натрия окрашивает метилоранж в следующий цвет:
а) жёлтый; б) красный; в) синий; г) оранжевый.
3. атомы щелочных металлов на внешнем уровне имеют:
а) по одному электрону;
б) по два электрона;
в) полностью заполненный внешний уровень.
4. Все элементы 2 группы являются:
а) типичными восстановителями; б) типичными окислителями;
в) переходные элементы.
5. Атомы щелочноземельных металлов имеют:
а) степень окисления +2; б) степень окисления -1;
в) степень окисления +1.
6. Все щелочноземельные металлы горят в атмосфере кислорода, образуя:
а) оксид состава МеО; б) гидроксид состава МеОН
в) оксиды Ме2О.
7. Для щелочных металлов характерна:
а) высокая плотность;
б) жёлто- красный цвет;
в) все легко режутся ножом.
8. Пара металлов, обладающих наиболее сходными свойствами:
а) Al и Na; б)K и Na; в) K и Mn.
Ответы
В-II
1.г
2. а
3. а
4. а
5. а
6. а
7. в
8. б
Тест 2.
В-I
1. Элементы основной подгруппы 1 группы имеют названия:
а) щелочные; б) щелочноземельные; в) галогены; г) переходные элементы.
2. Наиболее лёгкоплавный металл:
а)Rb; б)Cs; в)Li; г)Na;
3. Все элементы 1 группы относятся:
а) типичные окислители; б) типичные восстановители;
в) окислители и восстановители; г) переходные элементы.
4. Атомы из щелочноземельных металлов имеют:
а) по 1 е на внешнем уровне; б) по 2е на внешнем уровне;
в) заполненный внешний уровень.
5. Все щелочноземельные металлы очень активны и поэтому:
а) самовоспламеняются на воздухе;
б) хранятся в Н2О;
в) хранятся в керосине.
6. Металлические свойства щелочных металлов с ростом порядкового номера:
а) не изменяются; б) усиливаются; в) уменьшаются.
7. Щелочные металлы в природе не встречаются в свободном виде, потому что:
а) их в природе мало; б) эти металлы чрезвычайно химически активны;
в) эти металлы взаимодействуют с водой.
8. Радий завершающий 2 группу является:
а) очень твёрдым; б) самым распространённым в земной коре;
в) радиоактивным.
Ответы
В-I
1. а
2. б
3. б
4. б
5. в
6. б
7. б
8. в
Таблица личных достижений
тема: «Щелочные и щелочноземельные металлы».
Ф.И.О. студента
ВводныйТест 1
Устные ответы
Творческая
работа
Опорный
конспект
Тест 2
итоговый
Критерии оценки
1. Тест 1 за каждый правильный ответ 1 балл (максимум 13 баллов).
2. Устные ответы 1 балл.
3. Творческая работа 5 баллов.
4. Тест 2 за каждый правильный ответ 1балл (максимум 8 баллов).
5. Опорный конспект за каждое уравнение 1 балл (максимум 10 баллов)
Система перевода баллов в оценку
«5»- от 26 до 30 баллов; «4»- от 21 до 25 баллов; «3»- от 20.
Таблица личных достижений
тема: «Щелочные и щелочноземельные металлы».
Ф.И.О. студента
ВводныйТест 1
Устные ответы
Творческая
работа
Опорный
конспект
Тест 2
итоговый
Критерии оценки
1. Тест 1 за каждый правильный ответ 1 балл (максимум 13 баллов).
2. Устные ответы 1 балл.
3. Творческая работа 5 баллов.
4. Тест 2 за каждый правильный ответ 1балл (максимум 8 баллов).
5. Опорный конспект за каждое уравнение 1 балл (максимум 10 баллов)
Система перевода баллов в оценку
«5»- от 26 до 30 баллов; «4»- от 21 до 25 баллов; «3»- от 20.
щелочных и щелочноземельных металлов, алюминия, железа – HIMI4KA

Элементами группы IA являются литий, натрий, калий, рубидий, цезий и франций. Их называют также щелочными металлами. Некоторые их физические свойства приведены в таблице 6.


Для щелочных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Общий способ получения щелочных металлов — электролиз расплавов их хлоридов, например:
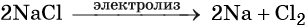
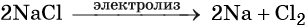
Калий получают также с помощью натрийтермического метода:


Щелочные металлы химически очень активны, легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +1. Хранят щелочные металлы в герметичной таре под слоем обезвоженного керосина, а литий — под слоем вазелина.
Ниже представлены общие для всех щелочных металлов реакции (Me = Li, Na, K, Rb, Cs):


Исключением является реакция с кислородом, в которой щелочные металлы ведут себя по-разному:
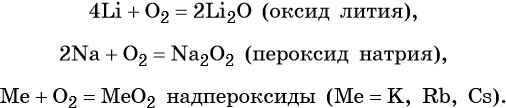
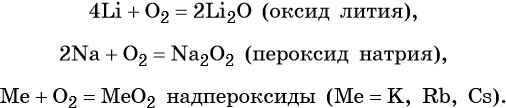
Оксиды щелочных металлов Э2O являются типичными основными оксидами, а гидроксиды ЭОН — сильными основаниями (щелочами), сила которых возрастает от лития к цезию.


Элементами IIА-группы являются бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Последние три называют элементами подгруппы кальция или щёлочноземельными металлами. Некоторые свойства элементов IIА-группы приведены в таблице 7.

Свойства бериллия и магния несколько отличаются от свойств, характерных для щёлочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку (диагональное сходство).
Для щёлочноземельных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Магний и кальций получают электролизом расплавов их хлоридов, например:


Стронций и барий получают восстановлением их оксидов алюминием или кремнием, например:


Щёлочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2.
Ниже приведены характерные для щёлочноземельных металлов реакции с простыми и сложными веществами (Me = Ca, Sr, Ba):
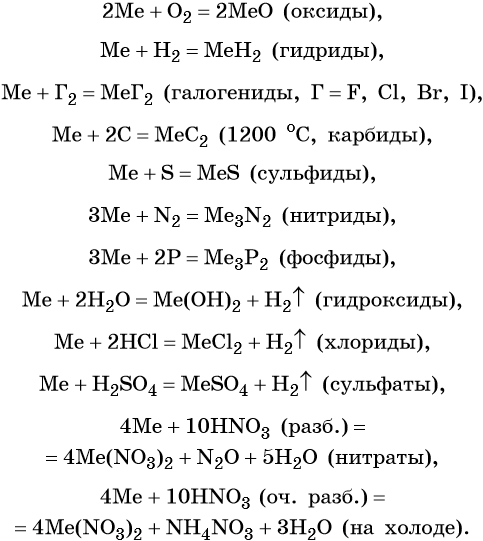
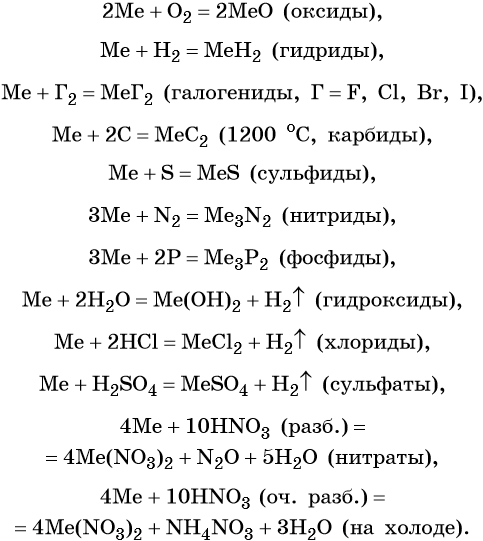
Оксиды щёлочноземельных металлов представляют собой типичные основные оксиды. Они реагируют с кислотами с образованием солей и воды, с кислотными оксидами с образованием солей. Реакция с водой протекает по-разному. Если оксид бария легко реагирует с водой при комнатной температуре с образованием сильной щёлочи Ba(OH)2, то оксид магния может реагировать с водой только при кипячении. Химические свойства оксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):


Гидроксиды щёлочноземельных металлов проявляют основные свойства: реагируют с кислотами с образованием основных или средних солей и воды, с кислотными оксидами с образованием солей и воды. Химические свойства гидроксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
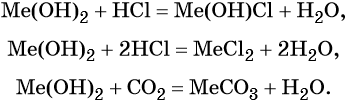
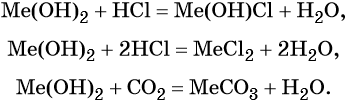
Сила оснований увеличивается с увеличением порядкового номера элемента.
Алюминий — химический элемент, расположенный в 3-м периоде IIIA группе. Его электронная формула 1s22s22p63s23p1.
Алюминий пассивируется в воде, концентрированной азотной кислоте из-за образования устойчивой оксидной пленки. Сильный восстановитель.
Химические свойства:


Оксид алюминия — типичный амфотерный оксид, гидроксид алюминия — типичный амфотерный гидроксид.


Железо находится в 4-м периоде VIIIБ группе. Его электронная формула 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6.
Химически чистое железо получают разложением его пентакарбонила:


Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах.
Упрощённо этот процесс можно описать уравнением:


Характерные для железа химические реакции:




FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции.


Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут так же, как и у входящих индивидуально в его состав оксидов:




Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
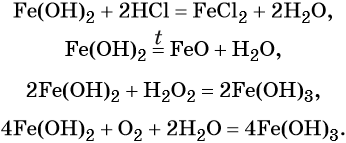
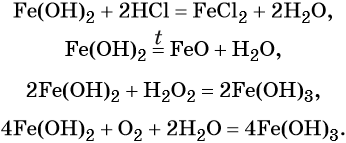
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
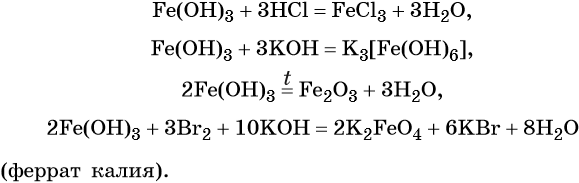
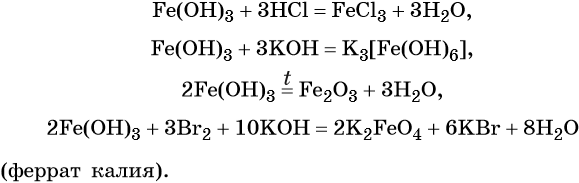
Тренировочные задания
1. Литий при соответствующих условиях вступает в реакцию с каждым из двух веществ
1) кислородом и алюминием
2) серой и хромом
3) оксидом углерода (II) и оксидом меди (I)
4) азотом и фосфором
2. Верны ли следующие утверждения о литии?
А. Литий хранят под слоем вазелина. Б. Взаимодействие лития с кислородом приводит к пероксиду лития.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Натрий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) ртутью и алюминием
2) фосфором и оксидом кальция
3) оксидом серы (IV) и оксидом кальция
4) азотной кислотой и водой
4. Верны ли следующие утверждения о натрии?
А. Натрий не реагирует с фосфором даже при нагревании.
Б. Натрий используют в технике при получении калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Калий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и магнием
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом магния
4) азотной кислотой и оксидом серы (VI)
6. Верны ли следующие утверждения о калии?
А. Калий не реагирует с водой.
Б. Гидрид калия нельзя получить прямой реакцией калия с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Магний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) в одой и железом
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом кремния
4) азотной кислотой и оксидом серы (VI)
8. Верны ли следующие утверждения о магнии?
А. Магний на воздухе покрывается оксидной пленкой.
Б. Магний реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Кальций при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и углеродом
2) фосфором и литием
3) оксидом фосфора (V) и оксидом азота (IV)
4) оксидом бария и оксидом серы (VI)
10. Верны ли следующие утверждения о кальции?
А. Кальций реагирует с азотом при нагревании.
Б. Кальций не реагирует с оксидом фосфора (V).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
11. Барий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и соляной кислотой
2) фосфором и натрием
3) оксидом фосфора (V) и оксидом лития
4) оксидом углерода (IV) и оксидом серы (VI)
12. Верны ли следующие утверждения о барии?
А. Барий не вступает в реакцию с бромом.
Б. Барий вступает в реакцию с водой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Алюминий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) железом и оксидом серы (VI)
14. Верны ли следующие утверждения об алюминии?
А. Алюминий вступает в реакцию с Fe2O3.
Б. Алюминий реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Железо при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) кислородом и оксидом серы (VI)
16. Верны ли следующие утверждения о железе?
А. Железо вступает в реакцию с Fe2O3.
Б. Железо реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Установите соответствие между реагирующими веществами и продуктами реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + HNO3 (разб.) →
Б) Li + S →
В) Li + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) Li2S
3) LiOH
4) LiNO3 + NH4NO3 + H2O
5) LiOH + H2
18. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + O2 →
Б) Li + Cl2 →
В) Li + HNO3 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) LiCl
3) Li2O
4) Li2O2
5) LiNO3 + NH4NO3 + H2O
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + O2 →
Б) Na + H2SO4 →
В) Na + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) NaCl
2) Na2O
3) Na2O2
4) NaCl + H2↑
5) Na2SO4 + H2↑
20. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + HNO3 (разб.) →
Б) Na + O2 →
В) Na + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) NaNO3 + H2↑
2) NaNO3 + NH4NO3 + H2O
3) NaOH + H2↑
4) Na2O
5) Na2O2
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + O2 →
Б) K + HCl →
В) K + S →
ПРОДУКТЫ РЕАКЦИИ
1) K2O
2) KO2
3) K2S
4) KCl + H2O
5) KCl + H2↑
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + H2O →
Б) K + Cl2 →
В) K + H2SO4 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) KH + O2
2) K2SO4
3) KCl
4) K2SO4 + H2↑
5) KOH + H2↑
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + HNO3 (разб.) →
Б) Mg + N2 →
В) Mg + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Mg(NO3)2 + N2O + H2O
2) Mg(NO3)2 + H2↑
3) MgO + H2↑
4) MgCl2 + H2↑
5) Mg3N2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + H2SO4 (разб.) →
Б) Mg + H2 →
В) Mg + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) MgSO4 + SO2 + H2O
2) Mg(NO3)2 + H2↑
3) MgH2
4) MgSO4 + H2↑
5) Mg(NO3)2 + N2O + H2O
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + HNO3 (разб.) →
Б) Ca + P →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(NO3)2 + NO2 + H2O
2) CaCl2 + H2O
3) Ca(NO3)2 + N2O + H2O
4) Ca3P2
5) CaCl2 + H2↑
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + N2 →
Б) Ca + C →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3N2
2) Ca2C
3) CaCl2
4) CaCl2 + H2↑
5) CaC2
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + HNO3 (разб.) →
Б) Ba + H2 →
В) Ba + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) Ba(NO3)2 + N2O3↑ + H2O
2) Ba(NO3)2 + N2O↑ + H2O
3) BaH2
4) Ba(OH)2 + H2↑
5) Ba(OH)2
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + N2 →
Б) Ba + O2 →
В) Ba + C →
ПРОДУКТЫ РЕАКЦИИ
1) BaO
2) Ba2O2
3) Ba3N2
4) BaC2
5) Ba2C
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + HCl →
Б) Al + C →
В) Al + Fe2O3 →
ПРОДУКТЫ РЕАКЦИИ
1) FeAlO2
2) Al2O3 + Fe
3) AlCl3 + H2↑
4) Al4C3
5) Al2C3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + NaOH + H2O →
Б) Al + P →
В) Al + HI →
ПРОДУКТЫ РЕАКЦИИ
1) Na[Al(OH)4] + H2↑
2) AlI3 + H2↑
3) AlP
4) Na[Al(OH)4]
5) Al(OH)3 + H2↑
31. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + HCl →
Б) Fe + H2SO4 (разб.) →
В) Fe + S →
ПРОДУКТЫ РЕАКЦИИ
1) FeCl3 + H2↑
2) Fe2(SO4)3 + H2↑
3) FeSO4 + H2↑
4) FeS
5) FeCl2 + H2↑
32. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + H2O (пар) →
Б) Fe + HNO3 (разб.) →
В) Fe + CuSO4 →
ПРОДУКТЫ РЕАКЦИИ
1) Fe2(SO4)3 + Cu
2) Fe(NO3)3 + NO + H2O
3) FeSO4 + Cu
4) Fe3O4 + H2
5) Fe(NO3)3 + NO2 + H2O
33. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
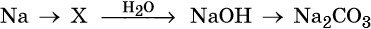
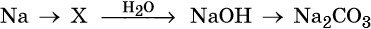
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
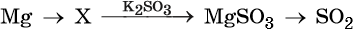
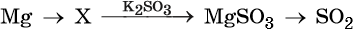
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
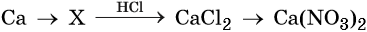
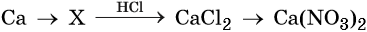
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
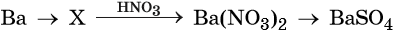
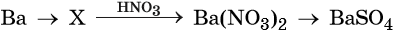
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
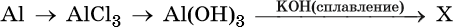
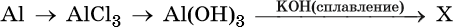
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
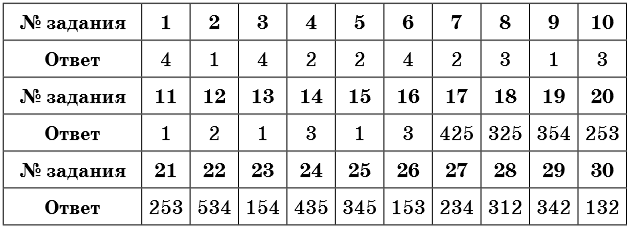
Ответы

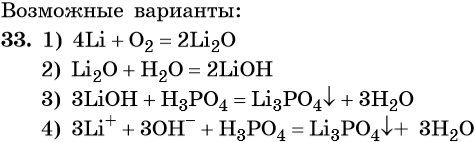
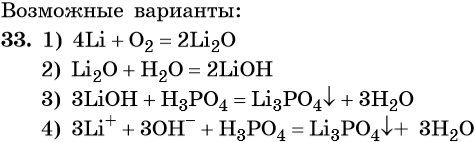






Щелочные и щелочноземельные металлы
Элементы первой группы периодической таблицы (за исключением водорода — см. Ниже) известны как щелочные металлы , потому что они образуют щелочные растворы, когда реагируют с водой. В эту группу входят элементы литий , натрий , калий , рубидий , цезий и франций . Каждый из этих элементов имеет только один валентный электрон, что означает, что они образуют только слабые металлические связи.В результате они относительно мягкие и имеют низкие температуры плавления.
Электрон с одной валентностью легко теряется, что делает эти металлы очень реактивными. Они бурно реагируют как с воздухом, так и с водой — например, при контакте натрия с водой он бурно реагирует с образованием гидроксида натрия и водорода. Тепло реакции фактически воспламеняет водород! Щелочные металлы также легко соединяются с элементами семнадцатой группы ( хлор , фтор , бром и т. Д.) с образованием стабильных ионных соединений , таких как хлорид натрия.
Щелочные металлы (выделены) занимают первую группу в периодической таблице.
Вторая группа таблицы Менделеева включает элементы бериллий , магний , кальций , стронций , барий и радий .Элементы этой группы, которые все блестящие и серебристо-белые на вид, известны как щелочноземельные металлы , . Как и щелочные металлы, они образуют щелочные растворы при взаимодействии с водой. Термин «земля» исторический; это было общее название, используемое алхимиками для оксидов этих элементов (которые когда-то считались элементами сами по себе).
Все элементы второй группы имеют на своей внешней оболочке двух электронов.Таким образом, металлические связи в щелочноземельных металлах прочнее, чем в щелочных металлах, что приводит к более высоким температурам плавления, но они все еще довольно реактивны, потому что два внешних электрона легко теряются. В результате они не встречаются в природе в своем элементарном состоянии.
Все щелочноземельные металлы, кроме одного, реагируют с галогенами ( хлор , фтор и т.д.) с образованием ионных соединений (за исключением хлорида бериллия, поскольку связь ковалентная).Все щелочно-земельные металлы, за исключением бериллия и магния, также реагируют с водой с образованием газообразного водорода и их соответствующих гидроксидов (однако магний будет реагировать с паром ). По сути, чем тяжелее щелочноземельный металл, тем интенсивнее он вступает в реакцию с водой.
Щелочноземельные металлы (выделены) занимают вторую группу в периодической таблице.
Магний является пятым по распространенности элементом на Земле, за ним следует кальций на восьмом месте, что тоже хорошо, поскольку и магний, и кальций жизненно важны для всех живых существ, включая человека! Магний участвует в огромном множестве биохимических реакций; помимо прочего, он необходим для здоровья костей и зубов.Кальций составляет примерно два процента от общей массы нашего тела, большая часть которого находится в наших зубах и костях.
.
Щелочноземельный металл | химический элемент
Щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
таблица Менделеева Современная версия периодической таблицы элементов. Британская энциклопедия, Inc.Возникновение, свойства и использование
До XIX века неметаллические, нерастворимые в воде и неизменные в огне вещества назывались землей.Эти земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированная сода и поташ), назывались щелочноземельными. Таким образом, щелочные земли отличались от щелочных и других земель, таких как оксид алюминия и редкие земли. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные земли, затем стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году.
Как и в случае щелочных металлов Группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны и становятся положительными ионами (катионами). Поэтому большинство их типичных соединений являются ионными: соли, в которых металл присутствует в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат ионы M + ), хлорида натрия ( NaCl) и оксид натрия (Na 2 O).
Оксиды щелочно-земельных металлов являются основными (то есть щелочными, в отличие от кислых). Наблюдается довольно устойчивое усиление электроположительного характера при переходе от бериллия, самого легкого члена группы, к радию, наиболее тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются очень активными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчасЗа исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести наиболее распространенных элементов на Земле) и играют важную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны.Этот металл никогда не производился в промышленных масштабах, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, их в значительной степени вытеснили менее дорогие альтернативы.
История
Самым ранним из известных щелочноземельных металлов была известь (лат. calx ), которая теперь известна как оксид кальция; его использовали в древности в составе раствора. Магнезия (название происходит, вероятно, от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочноземельный элемент, отличный от извести; он заметил, что магнезия дает растворимый сульфат, в то время как полученный из извести, как известно, нерастворим.В 1774 году шведский химик Карл Вильгельм Шееле, открывший кислород, обнаружил, что минерал под названием тяжелый шпат или барис (по-гречески «тяжелый») содержит новую землю, которая стала известна как барита (оксид бария). Другая земля, стронция (оксид стронция), была идентифицирована лондонскими химиками Уильямом Крукшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), обнаруженного в свинцовой шахте в Стронциане в Аргайлшире, Шотландия. Бериллия (оксид бериллия) была извлечена из минерала берилла и признана землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году.Хотя сначала его путали с глиноземом (оксидом алюминия), потому что оба они растворяются в щелочи, бериллий оказался отличным от других; В отличие от глинозема, он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально бериллия называлась glucina (греч. glykys , «сладкая») из-за ее сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Кристалл аквамарина Кристалл аквамарина, драгоценной формы минерала берилла (силикат бериллия и алюминия).Берилл также является коммерческим источником бериллия. © Стефан Пицко / Dreamstime.comМагний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены как нечистые металлы английским химиком сэром Хэмфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделения щелочных металлов, калия и натрия. Позднее щелочноземельные металлы были получены восстановлением их солей свободными щелочными металлами, и именно таким образом (действие калия на хлорид бериллия) бериллий был впервые выделен немецким химиком Фридрихом Велером и французским химиком Антуаном Бюсси. самостоятельно в 1828 г.Радий был открыт в 1898 году по радиоактивности французскими физиками Пьером и Мари Кюри, которые к 1902 году выделили его в виде хлорида радия из урана. Металлический радий был выделен в 1910 году в результате совместной работы Марии Кюри и французского химика Андре-Луи Дебьерна.
Аппарат, использованный Мари и Пьером Кюри для изучения радия Аппарат, использованный Мари и Пьером Кюри для исследования отклонения бета-лучей от радия в магнитном поле, 1904 год.Семья Кюри и их помощник Ж. Бемон открыли радиоактивный элемент радий в 1898 году. © Photos.com/Jupiterimages .12.3: Группа II — Щелочные земли
Группа IIA, также известная как щелочноземельных металлов , включает бериллий, магний, кальций, стронций, барий и радий. Последний член группы, Ra, радиоактивен и здесь рассматриваться не будет. Все щелочноземельные металлы — это серебристо-серые металлы, пластичные и относительно мягкие. Однако из следующей таблицы видно, что они намного плотнее, чем металлы группы IA, и их температуры плавления значительно выше.Они также тверже щелочных металлов. Это может быть связано с общей конфигурацией валентных электронов нс 2 для щелочноземельных металлов, которая включает два электрона на атом металла в металлической связи (вместо одного, как в щелочном металле).
| Элемент | Символ | Электронная конфигурация | Обычное состояние окисления < | Радиус / м | |
|---|---|---|---|---|---|
| Атомный | Ионный (M 2+ ) | ||||
| Барий | Ba | [Xe] 6 с 2 | +2 | 198 | 135 |
| Бериллий | Be | [He] 2 с 2 | +2 | 89 | 31 |
| Кальций | Ca | [Ar] 4 с 2 | +2 | 174 | 99 |
| Магний | мг | [Ne] 3 с 2 | +2 | 136 | 65 |
| Стронций | Sr | [Kr] 5 с 2 | +2 | 191 | 113 |
| Символ | Энергия ионизации / МДж моль –1 | Плотность / г см –3 | Электроотрицательность | Температура плавления (в ° C) | ||
|---|---|---|---|---|---|---|
6.10: Щелочноземельные металлы — Chemistry LibreTexts
Бенгальские огни, подобные тем, что используют по праздникам, делают праздничное дополнение ко многим торжествам. Вы можете использовать их сами. Но будьте осторожны, потому что их пламя действительно горячее! Яркое белое пламя возникает при горении магния. Магний — это легкий металл, который горит при очень высокой температуре. Другие применения магния включают съемку со вспышкой, вспышки и фейерверки. Магний — это металл второй группы периодической таблицы, о которой вы прочитаете в этой концепции.
Вторая группа
Барий \ (\ left (\ ce {Ba} \ right) \) — один из шести элементов во второй группе периодической таблицы, которая показана ниже. Элементы этой группы называются щелочноземельных металлов . Эти металлы серебристого или серого цвета. Они относительно мягкие и имеют низкую плотность, хотя и не такие мягкие и легкие, как щелочные металлы.
Рисунок \ (\ PageIndex {1} \) : Период 2 периодической таблицы Менделеева.Реакционная способность щелочноземельных металлов
Все щелочноземельные металлы обладают схожими свойствами, потому что все они имеют два валентных электрона.Они с готовностью отказываются от своих двух валентных электронов, чтобы достичь полного внешнего энергетического уровня, который является наиболее стабильным расположением электронов. В результате они очень реактивны, хотя и не так реакционны, как щелочные металлы в группе 1. Например, щелочноземельные металлы будут реагировать с холодной водой, но не взрывоопасно, как щелочные металлы. Из-за своей реакционной способности щелочноземельные металлы никогда не существуют в природе как чистые вещества. Вместо этого они всегда сочетаются с другими элементами.
Реакционная способность щелочноземельных металлов возрастает от верхних к нижним позициям группы.Это потому, что атомы становятся больше сверху вниз, поэтому валентные электроны находятся дальше от ядра. Когда валентные электроны дальше от ядра, они менее сильно притягиваются ядром и легче удаляются от атома. Это делает атом более реактивным.
Примеры щелочноземельных металлов
Чтобы лучше понять щелочноземельные металлы, давайте подробнее рассмотрим два из них: кальций \ (\ left (\ ce {Ca} \ right) \) и стронций \ (\ left (\ ce {Sr} \ right ) \).Кальций — мягкий серый нетоксичный щелочноземельный металл. Хотя чистого кальция в природе не существует, соединения кальция очень распространены в земной коре и морской воде. Кальций также является самым распространенным металлом в организме человека и встречается в виде соединений кальция, таких как фосфат кальция и карбонат кальция. Эти соединения кальция содержатся в костях и делают их твердыми и крепкими. В скелете среднего взрослого человека содержится около килограмма кальция. Поскольку кальций, как и барий, поглощает рентгеновские лучи, кости выглядят белыми на рентгеновских изображениях.Кальций — важный компонент здорового питания человека. Хорошие источники кальция в пище показаны на рисунке ниже.
Рисунок \ (\ PageIndex {2} \): Все эти продукты и напитки богаты кальцием.Стронций — щелочноземельный металл серебристого цвета, который даже мягче кальция. Соединения стронция довольно распространены и имеют множество применений — от фейерверков до цемента и зубной пасты. В фейерверках соединения стронция вызывают темно-красные взрывы. В зубной пасте, подобной изображенной на рисунке ниже, соединение хлорида стронция снижает чувствительность зубов.
Рисунок \ (\ PageIndex {3} \): Хлорид стронция, соединение, содержащееся в некоторых зубных пастах, снижает чувствительность зубов.Сводка
- Элементы в группе 2 периодической таблицы называются щелочноземельными металлами. Они серебристого или серого цвета. Они также относительно мягкие и имеют небольшую плотность.
- Щелочноземельные металлы очень реактивны, потому что они легко отдают свои два валентных электрона для достижения полного внешнего энергетического уровня, который является наиболее стабильным расположением электронов.Реактивность возрастает сверху вниз по группе.
- Примеры щелочноземельных металлов включают кальций, который необходим для прочности костей, и стронций, который используется для производства цемента и других продуктов.
Узнать больше
По следующему URL-адресу посмотрите, как четыре различных щелочноземельных металла реагируют с водой. После просмотра видео ответьте на следующие вопросы:
1. Наблюдайте за реакциями на видео, а затем ранжируйте щелочноземельные металлы от наиболее до наименее активных с водой.
2. Чем объясняется разница в реактивности?
3. Предскажите реакционную способность бериллия с водой. Какое место он занял бы в вашем рейтинге?
4. Какие вещества образуются в каждой реакции, которую вы наблюдали в видео?
Авторы и авторство
Фонд CK-12, созданный Шэрон Бьюик, Ричардом Парсонс, Терез Форсайт, Шонной Робинсон и Жаном Дюпоном.
