Щелочные и щелочноземельные металлы — это… Что такое Щелочные и щелочноземельные металлы?
- Щелочные и щелочноземельные металлы
(хим.), или металлы щелочей и щелочных земель. Нерастворимые в воде окислы металлов, а также и некоторых неметаллов прежде называли землями за их порошковый вид. Среди этих земель легко отличить такие, которые хотя и мало растворимы, но образуют более или менее прочные гидраты, обладающие явной щелочной реакцией. Металлы, дающие щелочные земли, принадлежат к более основной подгруппе II группы периодической системы, т. е. это Mg, Са, Sr, Ва и, может быть, Ra (радий). Металлы, окиси коих хорошо растворимы в воде и дают прочные гидраты, которые называются едкими щелочами, по преимуществу принадлежат к более основной подгруппе I группы периодической системы, т. е. это Li, Na, К, Rb и Cs.
С. Колотов.
Энциклопедический словарь Ф.
- Щелочная синь
- Апсида
Смотреть что такое «Щелочные и щелочноземельные металлы» в других словарях:
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — ПОДГРУППА IIA БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ Строго говоря, эта подгруппа состоит из двух типов элементов. Бериллий и магний элементы коротких периодов более сходны между собой, чем с другими четырьмя… … Энциклопедия Кольера
щелочноземельные металлы — [alkali earth metals] группа, включающая Са, Sr, Ba и Ra; первые три применяются в металлургии в качестве раскислителей; Смотри также: Металлы щелочные металлы чистые металлы ультрачистые металлы … Энциклопедический словарь по металлургии
ЩЕЛОЧНЫЕ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — Щелочные и щелочноземельные металлы и их соли (Na, К, Mg, Ca, Sr, Li, Ba).
Соли щелочных и щелочноземельных металлов присутствуют в сточных водах машиностроительной, целлюлозно бумажной, химической, азотнотуковой, электротехнической, красильной,… … Болезни рыб: Справочник
Щелочные — и щелочноземельные Металлы (хим.), или Металлы щелочей ищелочных земель. Нерастворимые в воде окислы металлов, а также инекоторых неметаллов, прежде называли землями за их порошковый вид.Среди этих земель легко отличить такие, который хотя и мало … Энциклопедия Брокгауза и Ефрона
МЕТАЛЛЫ — МЕТАЛЛЫ, простые хим. вещества (элементы), обладающие комплексом характерных, б. или м. ясно выраженных физ. признаков, создающих благоприятные условия для их практического применения, как то: твердость, ковкость, специфический блеск, высокий уд … Большая медицинская энциклопедия
МЕТАЛЛЫ
 Смеси таких элементов (СПЛАВЫ) также являются металлами. Около трех четвертей всех… … Научно-технический энциклопедический словарь
Смеси таких элементов (СПЛАВЫ) также являются металлами. Около трех четвертей всех… … Научно-технический энциклопедический словарьМеталлы как горючие — Металлы как ракетное горючие, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но уменьшает… … Википедия
Металлы как горючее — Металлы как ракетное горючее, используемые в ракетных топливах, относятся в основном ко второму периоду периодической системы элементов, и только некоторые из них к третьему. Добавка циркония приводит к большой плотности топлива, но… … Википедия
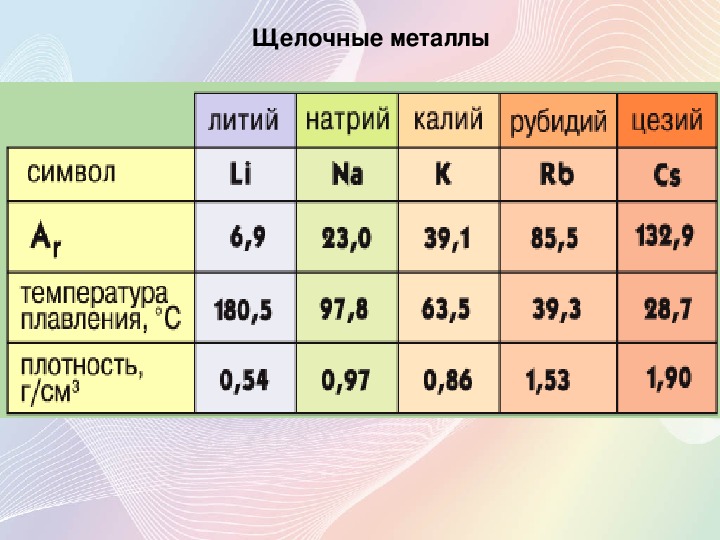
Щелочные металлы — Группа → 1 ↓ Период 2 3 Литий … Википедия
щелочные металлы — [alkali metals] группа, включающая Li, Na, К, Rb, Cs, Fr. Смотри также: Металлы чистые металлы ультрачистые металлы тяжелые металлы … Энциклопедический словарь по металлургии
Книги
- Химия за 30 секунд, Коллектив авторов.
 Химические элементы – это строительные кубики жизни, но все ли мы знаем о них? Можете ли вы поддержать разговор о достижениях современной науки за обедом с друзьями? А знаете ли вы, какой… Подробнее Купить за 189 руб аудиокнига
Химические элементы – это строительные кубики жизни, но все ли мы знаем о них? Можете ли вы поддержать разговор о достижениях современной науки за обедом с друзьями? А знаете ли вы, какой… Подробнее Купить за 189 руб аудиокнига
Урок 9. Щелочные и щёлочноземельные металлы – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Щелочные металлы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:
Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
урок 2.3), например:
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.
Эти вещества применяются и в технических целях.
Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
Вопросы
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na+ и OH– притягиваются слабее, чем Са2+ и ОН–.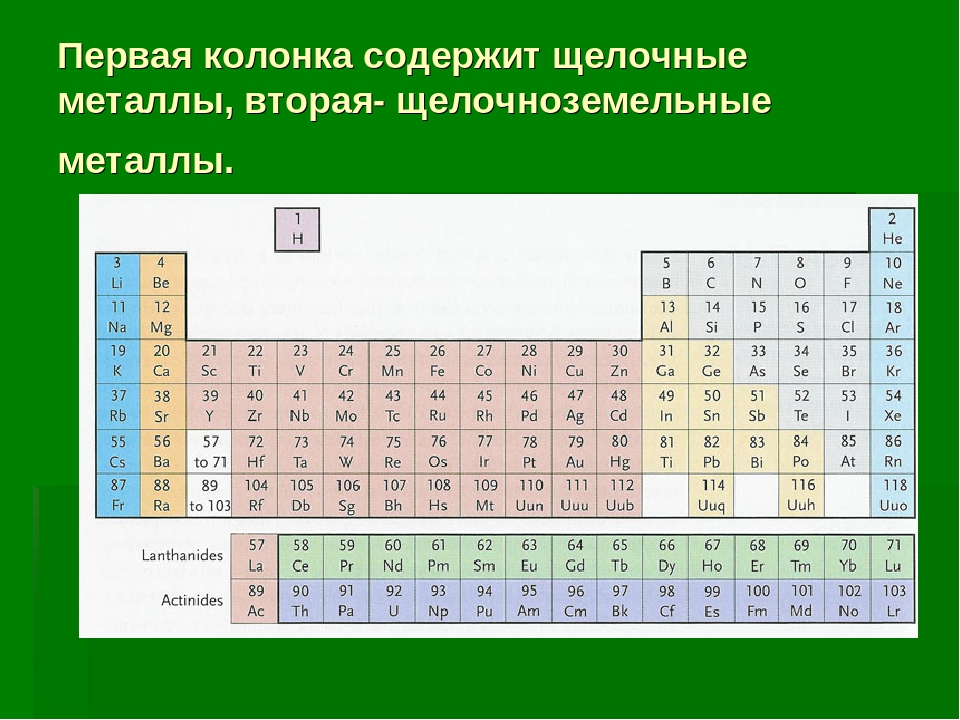
Поэтому первые два элемента этой подгруппы не образуют щелочей:
Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
Строение атома кальция изображается схемой:
Имея два валентных электрона: …4s2, кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
Рассмотрим как происходит взаимодействие кальция с азотом:
Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:
Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).

Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
- Са(ОН)2 + СO2 →
- Са(ОН)2 + H3PO4 →
- Са(ОН)2 + Na2CO3 →
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:
Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни. Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
Накипь, конечно, можно растворить при помощи соляной кислоты:
Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.
Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba. Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс.
Щелочноземельными металлами называют \(4\) химических элемента \(I\)\(I\)\(A\) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций \(Ca\), стронций \(Sr\), барий \(Ba\), радий \(Ra\).
Электронное строение атомов
На внешнем энергетическом уровне атомы металлов \(IIA\) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления \(+2\).
Этим объясняется сходство их свойств.
Для металлов \(I\)\(I\)\(A\) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.

Нахождение в природе
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Тем не менее, металлы \(I\)\(I\)\(A\) группы имеют разные значения температуры плавления, плотности и других физических свойств.
Химические свойства
Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
Они являются сильными восстановителями.
Щелочноземельные металлы активно реагируют с:
водой, образуя соответствующие гидроксиды и выделяя водород:
Ba+2h3O=Ba(OH)2+h3↑;
кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
Ba+2HCl=BaCl2+h3↑;
с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
Bа+Cl2=BаCl2,
Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=эл. токCa+Cl2↑.
Металлы щелочные и щелочноземельные — Справочник химика 21
Среди элементарных веществ к типичным восстановителям принадлежат активные металлы (щелочные и щелочноземельные, цинк, алюминий, железо и др.
Помещения цехов, производств, установок с наличием твердых веществ, взаимодействующих с образованием горючих газов и воспламеняющихся на воздухе карбиды щелочных и щелочноземельных металлов щелочные и щелочноземельные металлы (калий, натрий, литий [c.381]
Солеобразные гидриды образуют наиболее активные металлы (щелочные и щелочноземельные). Эти соединения построены по типу ионных, т. е. состоят из поло китель-ных ионов металла и отрицательных ионов водорода. Последнее подтверждается практически — при электролизе расплава соединения водород будет выделяться на аноде.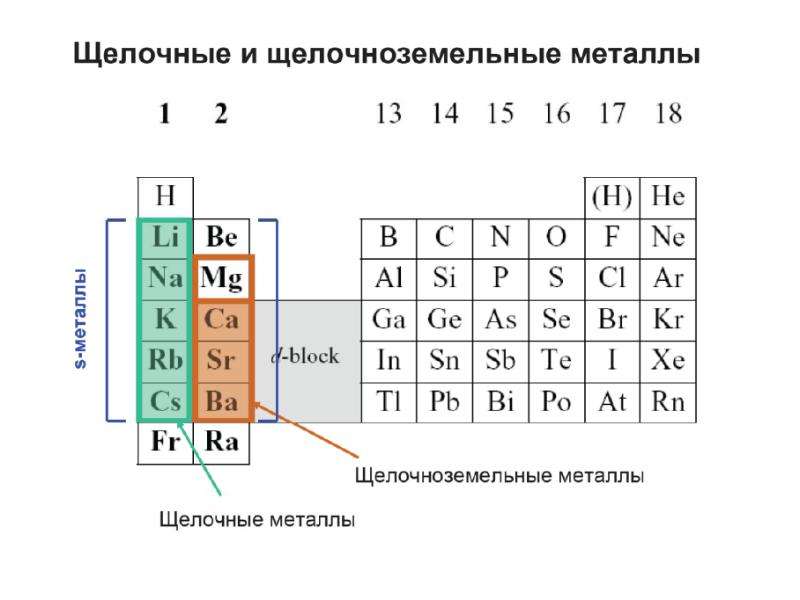
Минеральные компоненты нефти. В состав нефти входят многие элементы. В золе нефтей обнаружены металлы щелочные и щелочноземельные Ь, Ыа, К, Ва, Са, 5г, Мн металлы подгруппы меди Си, Ag, Аи цинка 2п, Сё, Hg бора В, А1, Са ванадия V, [c.31]
Поэтому по окислительной активности водород существенно уступает галогенам. По этой же причине ясно выраженный ионный характер проявляют лишь гидриды наиболее активных металлов — щелочных и щелочноземельных, например КН и СаНа. [c.276]
Углерод непосредственно соединяется со многими металлами, образуя карбиды — соединения, в которых углерод электроотрицателен. Степень окисления углерода в карбидах различна. Различны и химические свойства карбидов. С активными металлами — щелочными и щелочноземельными — углерод образует солеподобные карбиды, в которых атомы углерода связаны между собой тройной связью в группировку — С С —, как, например, в СаС . Степень окисления углерода в них —1.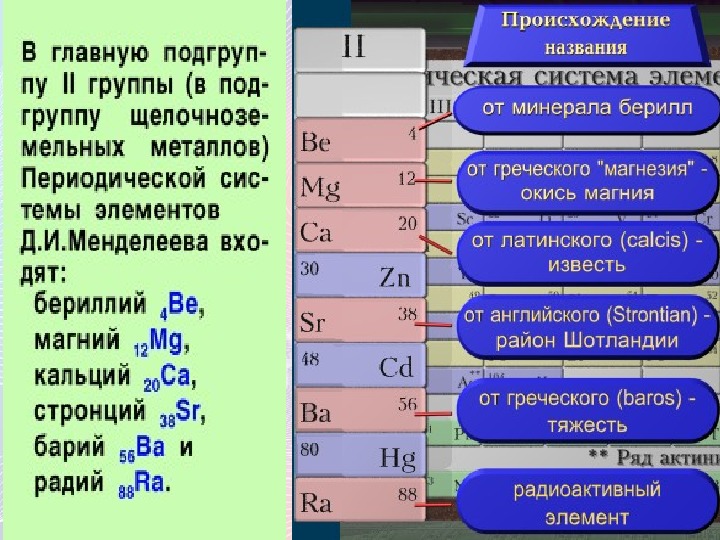
Распределительная хроматография на целлюлозе применялась также для выделения тория из руд, при анализе сплавов и сталей, для разделения благородных металлов, щелочных и щелочноземельных металлов и некоторых других элементов [102]. [c.175]
Оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с кальция) при обычных условиях непосредственно взаимодействуют с водой, образуя гидроксиды, которые являются сильными, растворимыми в воде основаниями — щелочами, например, [c.9]
Подобные полярные связи образуются и в том случае, когда для образования связывающего дублета электроны предоставляет каждый из атомов, но только тогда, когда из-эа структурного расположения и неодинакового притяжения электронного дублета различными атомными ядрами связывающая электронная пара смещена от центра связи к одному из ядер. Такая связь образуется в молекуле воды, в которой предполагается значительная степень ионного взаимодействия. Полярные связи образуются при связывании элементов, сильно различающихся по электроотрицательности. Это неудивительно, особенно для связей, которые образует кислород или фтор с некоторыми ионами металлов (щелочные и щелочноземельные металлы). [c.159]
Такая связь образуется в молекуле воды, в которой предполагается значительная степень ионного взаимодействия. Полярные связи образуются при связывании элементов, сильно различающихся по электроотрицательности. Это неудивительно, особенно для связей, которые образует кислород или фтор с некоторыми ионами металлов (щелочные и щелочноземельные металлы). [c.159]
IV. Самовозгорающиеся и самовоспламеняющиеся вещества — металлы щелочные и щелочноземельные (калий, натрий, кальций), металлы пирофорные (алюминий в виде пыли или пудры, цинковая пыль и др.), карбид кальция, перекиси, фосфор белый и желтый, фосфористые натрий и кальций и др. хранение этих веществ недопустимо вместе с другими огнеопасными веществами всех групп. При отсутствии последних вещества группы IV можно хранить в изолированных помещениях общих огнестойких складов.
При аналитических операциях необходимо обеспечить присутствие в пламени свободных атомов определяемого элемента. Здесь следует учитывать два фактора возможность образования простых молекул (МеО, МеОН и некоторых других) и степень ионизации атома определяемого металла. Щелочные и щелочноземельные металлы ионизируются сравнительно легко, поэтому при их определении методом атомной абсорбции возникают затруднения. Однако определение кальция и других щелочноземельных элементов облегчается тем, что постоянной примесью воздуха является натрий, который создает высокую фоновую концентрацию электронов. Последняя снижает степень ионизации кальция [22]. [c.147]
Здесь следует учитывать два фактора возможность образования простых молекул (МеО, МеОН и некоторых других) и степень ионизации атома определяемого металла. Щелочные и щелочноземельные металлы ионизируются сравнительно легко, поэтому при их определении методом атомной абсорбции возникают затруднения. Однако определение кальция и других щелочноземельных элементов облегчается тем, что постоянной примесью воздуха является натрий, который создает высокую фоновую концентрацию электронов. Последняя снижает степень ионизации кальция [22]. [c.147]
Дуговой разряд поддерживается либо между металлическими электродами, если они достаточно устойчивы к нагреванию и окислению, либо между угольными электродами. Каналы в них обычно содержат набивку в виде окислов или солей исследуемых металлов. Непосредственно электродами дуги может служить большинство металлов и их сплавов. Легкоплавкие и легкоокисляемые металлы (щелочные и щелочноземельные) применяются в виде сплавов с более стойкими металлами. Некоторые из них могут служить электродами дуги, если поместить ее в атмосферу инертного газа или в вакуум. Наиболее широко распространена дуга с ртутными электродами [10.16]. Вакуумная ртутная дуга в кварцевом сосуде является одним из широко применяемых источников яркого ультрафиолетового излучения. Одна из конструкций такого рода дуги изображена на рис. 10.11, а. Ртуть в количестве 15—20 см содержится в электродных отростках, которые во время работы охлаждаются ребристыми алюминиевыми радиаторами. Для зажигания дуги ее слегка наклоняют. Переливающаяся из анодного отростка ртуть образует проводящую цепь, при разрыве которой зажигается дуга.
Некоторые из них могут служить электродами дуги, если поместить ее в атмосферу инертного газа или в вакуум. Наиболее широко распространена дуга с ртутными электродами [10.16]. Вакуумная ртутная дуга в кварцевом сосуде является одним из широко применяемых источников яркого ультрафиолетового излучения. Одна из конструкций такого рода дуги изображена на рис. 10.11, а. Ртуть в количестве 15—20 см содержится в электродных отростках, которые во время работы охлаждаются ребристыми алюминиевыми радиаторами. Для зажигания дуги ее слегка наклоняют. Переливающаяся из анодного отростка ртуть образует проводящую цепь, при разрыве которой зажигается дуга.
Молекулярный водород при обычной температуре химически малоактивен. Только фтор соединяется с ним при обычных условиях , хлор — при освещении, кислород — только при поджигании смеси. При повышенной температуре водород вступает в соединение со многими элементами, преимущественно с неметаллами, но и с сильно электроположительными металлами (щелочными и щелочноземельными). [c.60]
[c.60]
Металлы (щелочные и щелочноземельные) [c.379]
К образованию комплексов способны преимущественно сравнительно малоактивные металлы. Щелочные и щелочноземельные металлы образуют комплексы сравнительно редко. В качестве комплек-сообразователей чаще выступают металлы В-групп и металлы групп П1А и IVA. В центре комплекса располагается атом или ион металла. [c.20]
В качестве окислителя вода вступает в реакцию с активными металлами — щелочными и щелочноземельными. [c.154]
Наиболее активные металлы (щелочные и щелочноземельные) даже при обычных условиях взаимодействуют с водой. Мерой активности металлов могут служить величины их стандартных электродных потенциалов (см. стр. 133). Электродные потенциалы малоактивных металлов (Си, Hg, Ag, Au и других) выражаются положительными величинами, а более активных металлов — отрицательными величинами. [c.350]
Химические свойства водорода.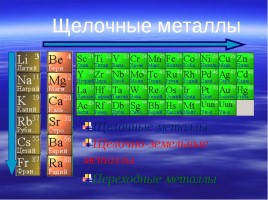 Пока атомы водорода сцеплены в молекулу, водород — почти такой же химически инертный газ, как азот. На холоду и в темноте водород соединяется только с самым электроотрицательным элементом — фтором. Но при нагревании водород соединяется как с большинством неметаллов, так и с наиболее электроположительными из металлов — щелочными и щелочноземельными металлами. [c.277]
Пока атомы водорода сцеплены в молекулу, водород — почти такой же химически инертный газ, как азот. На холоду и в темноте водород соединяется только с самым электроотрицательным элементом — фтором. Но при нагревании водород соединяется как с большинством неметаллов, так и с наиболее электроположительными из металлов — щелочными и щелочноземельными металлами. [c.277]
Более активные металлы (щелочные и щелочноземельные) вытесняют водород даже из воды (стр. 107). [c.101]
Для наглядности Менделеев приводит сопоставление двух групп металлов — щелочных и щелочноземельных — в случае истинных атомных весов, согласных с теорией Жерара, и в случае эквивалентных весов. В первом случае имеем [c.165]
Из величин собственных потенциалов, приведенных в табл. 11, видно, что потенциалы многих металлов (щелочных и щелочноземельных, магния, алюминия и др.) не могут быть определены экспериментально, так как на поверхности соответствующих [c.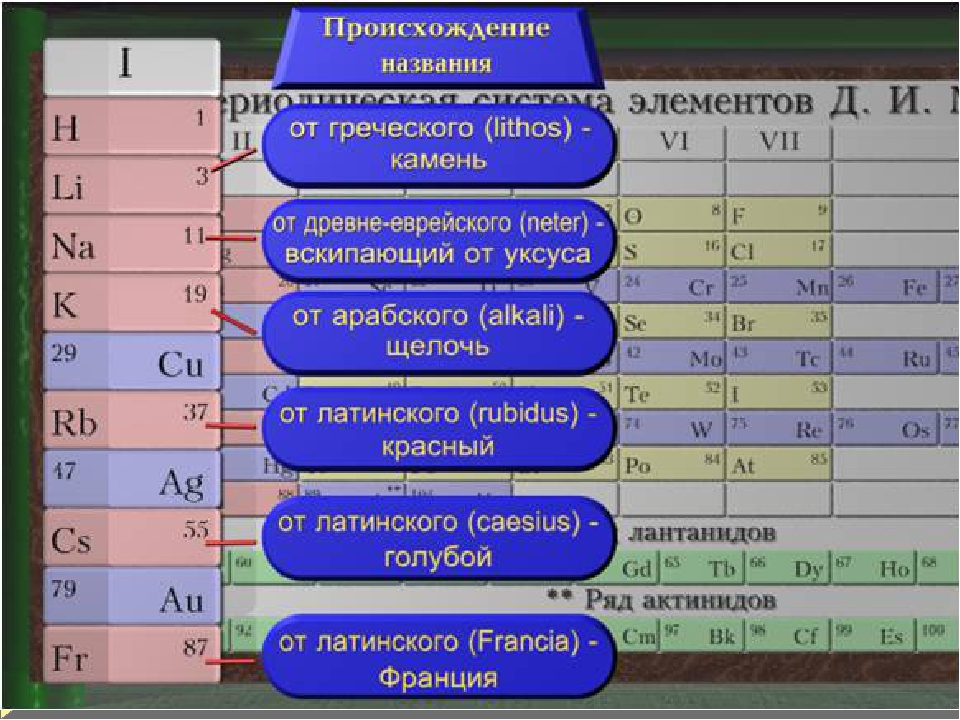 328]
328]
Наиболее активные металлы (щелочные и щелочноземельные) даже при обычных условиях взаимо-. действуют с водой. [c.192]
Предположим сначала, что электрон переходит от Л к В. Переход в этом направлении можно представить происходящим в две ступени. На первой ступени энергия затрачивается на отрыв, например одного внешнего электрона от атома Л. Величина этой энергии, называющейся энергией, или потенциалом ионизации 1а зависит от энергии притяжения между внешним электроном и остальной частью атома, содержащей положительно заряженное ядро. Энергии ионизации имеют наименьшие значения у наиболее активных металлов (щелочных и щелочноземельных), у которых легче всего удалить электрон. [c.297]
Так, мы видим, что в левой части ряда напряжений находятся наиболее легко окисляющиеся и вообще самые энергичные металлы—щелочные и щелочноземельные. Наоборот, справа находятся благородные , т.
 е. наиболее инертные химически металлы Ag, Pt, Au. [c.171]
е. наиболее инертные химически металлы Ag, Pt, Au. [c.171]Металлы щелочные и щелочноземельные. Взвешиваемые формы — МгО и МО. При сожжении органических соединений, содержащих щелочные или щелочноземельные металлы, углерод может частично оставаться в контейнере в форме термостойких карбонатов. В присутствии в зоне сожжения оксида вольфрама (VI) или оксида кремния (в виде дробленого кварца) образуются вольфраматы [7] или силикаты [176] металлов, и диоксид углерода полностью выделяется в газообразной форме. Если же металл в веществе связан с сульфогруппой, то остаток представляет собой его сульфат [c.100]
Металлы щелочные и щелочноземельные 17 1710 Рубидий хлористый (концентрат) [c.35]
Амальгамы (от франц. amalgama) — жидкие или твердые сплавы, образующиеся при растворении в ртути различных металлов. Щелочные и щелочноземельные металлы и некоторые другие элементы образуют со ртутью устойчивые соединения. При нагревании А.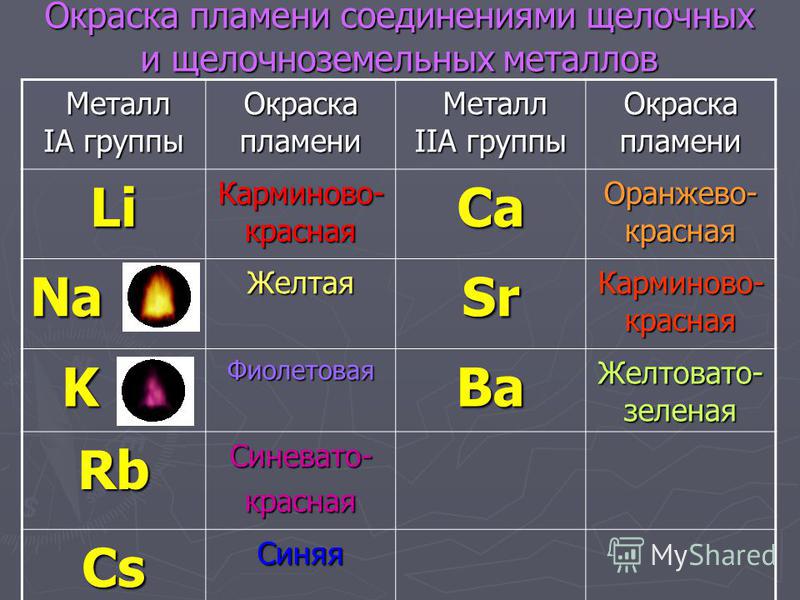 меди, серебра, золота и др. отгоняется ртуть. Железо не образует А., поэтому ртуть можно перевозить в стальных сосудах. А. используют при золочении металлических изделий, в производстве зеркал. А. щелочных металлов и цинка в химии применяют как восстановители. А. используют при электролитическом получении редких металлов, извлечении некоторых металлов из руд (см. Амальгамация). [c.14]
меди, серебра, золота и др. отгоняется ртуть. Железо не образует А., поэтому ртуть можно перевозить в стальных сосудах. А. используют при золочении металлических изделий, в производстве зеркал. А. щелочных металлов и цинка в химии применяют как восстановители. А. используют при электролитическом получении редких металлов, извлечении некоторых металлов из руд (см. Амальгамация). [c.14]
Окислительно-восстановительные свойства. Алюминий—се ребристо-белый металл. Нормальный окислительно-восстановительный потенциал системы А1з+ в кислой среде равен —1,28 а. а в щелочной среде окислительно-восстановительный потенциал системы АЮ /А равен —2,35 в. Поэтому алюминий хорошо растворяется в соляной и разбавленной серной кислотах. Еще легче он растворяется в щелочах, так как в щелочном растворе потенциал алюминия приближается к потенциалу наиболее активных металлов (щелочных и щелочноземельных). [c.327]
Металлы с наименьшими алгебраическими величинами нормальных электродных потенциалов.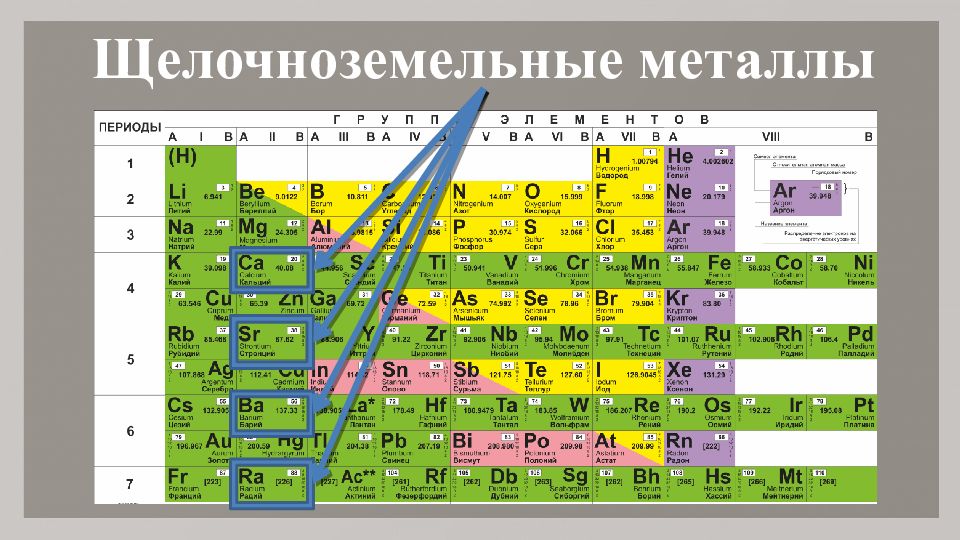 Сюда относятся все типичные металлы (щелочные и щелочноземельные, а также алюминий). Ионы этих металлов характеризуются наименьшим сродством к электрону. При электролизе водных растворов солей указанных металлов на катоде восстанавливаются не их катионы, а молекулы воды (и в известной мере ионы водорода) (см. ниже — пример 3). [c.293]
Сюда относятся все типичные металлы (щелочные и щелочноземельные, а также алюминий). Ионы этих металлов характеризуются наименьшим сродством к электрону. При электролизе водных растворов солей указанных металлов на катоде восстанавливаются не их катионы, а молекулы воды (и в известной мере ионы водорода) (см. ниже — пример 3). [c.293]
Очевидно, металлы как восстановители, будут вступать в реакции с различными окислителями, среди которых могут быть простые вещества (неметаллы), кислоты, соли менее активных металлов и некоторые другие соединения. Так, все металлы образуют соединения с кислородом — окислы. При этом окислы наиболее активных металлов (щелочных и щелочноземельных) характеризуются основными свойствами. С уменьшением же активности металлов свойства окислов изменяются от основных, в которых металлы проявляют низшую степень окисления, через амфотерные с промежуточной степенью окисления к кислотным, где проявляется их высшая степень окисления. Например, хром может существовать в трех различных степенях окисления — -2, +3, -Ьб. Проявляя низшую из них, он образует основной окисел СгО, которому соответствует гидроокись Сг (0Н)2. Хром со степенью окисления 4-6 образует кислотный окисел СгОз, которому соответствует хромовая кислота НзСгО . И, наконец, хром с промежуточной степенью окисления образует амфотерный окисел СГзОз, которому соответствует гидроокись Сг(ОН)з. Из этого примера видно, что металлы, имеющие различную степень окисления, могут проявлять свойства как металлов, так и неметаллов. [c.283]
Проявляя низшую из них, он образует основной окисел СгО, которому соответствует гидроокись Сг (0Н)2. Хром со степенью окисления 4-6 образует кислотный окисел СгОз, которому соответствует хромовая кислота НзСгО . И, наконец, хром с промежуточной степенью окисления образует амфотерный окисел СГзОз, которому соответствует гидроокись Сг(ОН)з. Из этого примера видно, что металлы, имеющие различную степень окисления, могут проявлять свойства как металлов, так и неметаллов. [c.283]
Из величин собственных потенциалов, приведенных в табл. И, видно, что потенциалы многих металлов (щелочных и щелочноземельных, магния, алюминия и др.) не могут быть определены экспериментально, так как на поверхности соответствующих электродов должно происходить восстановление водорода. Во многих случаях (Mg, Al, Сг) экспериментальные трудности увеличиваются за счет образования на поверхности металлов окисных пленок и слоев адсорбированного кислорода (гл. XIII, 3). Чем ближе потенциал к линии аЬ и чем медленнее происходит восстановление водорода на поверхности данного металла, тем меньше будет ошибка при измерении, обусловленная этим процессом. Так, очень малая скорость восстановления [c.329]
Так, очень малая скорость восстановления [c.329]
Единственными ионными сульфидами являются сульфиды наиболее электроположительных металлов (щелочных и щелочноземельных), у которых положительные ионы имеют малые заряды, а также сул -фиды некоторых переходных элементов, которые тоже могут образовать И01И,1 с малым зарядом. Такие сульфиды имеют структуры, подобные структурам соответствующих окислов (см, структуры сульфидов и окислов щелочных и щелочноземельных металлов, МпО и. Чп8, содержащие ионы М+ или М- + ). [c.354]
Зо 1Ьные компоненты в газойлевых фракциях продуктов переработки нефти и каменноугольной смолы представлены металлоорганическими комплексами никеля, ванадия, молибдена, железа и других металлов, щелочными и щелочноземельными солями нафтеновых кислот, а также высокодисперсными примесями катализаторной пыли и других минеральных веществ [6, 7]. Содержание зольных компонентов в сырье для сажи достигает 0,05%. [c.9]
Ф. энергично соединяется с большинством металлов. Щелочные и щелочноземельные металлы воспламеняются на холоду, а В1, 8и, Т1, Мо, — при незначительном нагревании. Hg, РЬ, и, V реагируют с Ф. нри комнатной теми-ре, Р1 — ири темп-ре темнокрасного каления. При взаимодействии металлов с Ф. образуются, как правило, высшие фториды — и Ра, МоРб, Н Р.2 и т. д. Нек-рые фториды (СоРз, МнРз, АйРа, 8ЬР5, РЬР4) обладают фторирующими свойствами и иашли применение как фторирующие реагенты (см. Фторорганические соединения). Ре, Си, А1, N1, 2п практически ие взаимодействуют с Ф. нри обычных теми-рах благодаря образованию заш.итной нленки фторида. В порошкообразном состоянии металлы реагируют с Ф. при слабом нагревании. При сильном нагревании все металлы способны к горению в атмосфере Ф. (о фторидах металлов см. Натрия фторид. Калия фторид. Серебра галогениды п т. д.). [c.288]
энергично соединяется с большинством металлов. Щелочные и щелочноземельные металлы воспламеняются на холоду, а В1, 8и, Т1, Мо, — при незначительном нагревании. Hg, РЬ, и, V реагируют с Ф. нри комнатной теми-ре, Р1 — ири темп-ре темнокрасного каления. При взаимодействии металлов с Ф. образуются, как правило, высшие фториды — и Ра, МоРб, Н Р.2 и т. д. Нек-рые фториды (СоРз, МнРз, АйРа, 8ЬР5, РЬР4) обладают фторирующими свойствами и иашли применение как фторирующие реагенты (см. Фторорганические соединения). Ре, Си, А1, N1, 2п практически ие взаимодействуют с Ф. нри обычных теми-рах благодаря образованию заш.итной нленки фторида. В порошкообразном состоянии металлы реагируют с Ф. при слабом нагревании. При сильном нагревании все металлы способны к горению в атмосфере Ф. (о фторидах металлов см. Натрия фторид. Калия фторид. Серебра галогениды п т. д.). [c.288]
Окраска пламени. В пламени паяльной трубки или газовой горелки соедпнения нек-рых элементов, особенно металлов щелочной и щелочноземельной группы, переходят в парообразное соедпне-пие и окрашивают пламя в характерный цвет. Труднолетучие соединения сами по себе окраски пламени но дагот, поэтому предварительно их разлагают смачиванием соляной, реже серной к-той. В случае присутствия двух, трех элементов, папр. N8, К и [c.15]
Труднолетучие соединения сами по себе окраски пламени но дагот, поэтому предварительно их разлагают смачиванием соляной, реже серной к-той. В случае присутствия двух, трех элементов, папр. N8, К и [c.15]
Если мы перейде.м к -металлам щелочных земель, то так как гидратация их может быть легко определена, а теплота образования водных окисей известна, образование безводных окисей определить легко, и вот приблизительные числа для вс 1Х трех м-еталлов Са — 131 ООО кал, барий — 124.000 кал, 5г—среднее—-120.000 кал. Эта лруппа, подобно предыдущей, с возрастанием атомного веоа увеличивает зн-ергию по отношению 1К галоидам и уменьшает -по отношению к О. Для всех этих металлов — щелочных и щелочноземельных — числа получены очень большие, далее следуют -металлы тяжелые с числами гораздо меньшими. [c.214]
Рассмотренные методы получения металлов восстановлением их окислов при высокой температуре называют пирометаллургическими. Активные металлы (щелочные и щелочноземельные, магний и алюминий) получают электролизом их расплавов.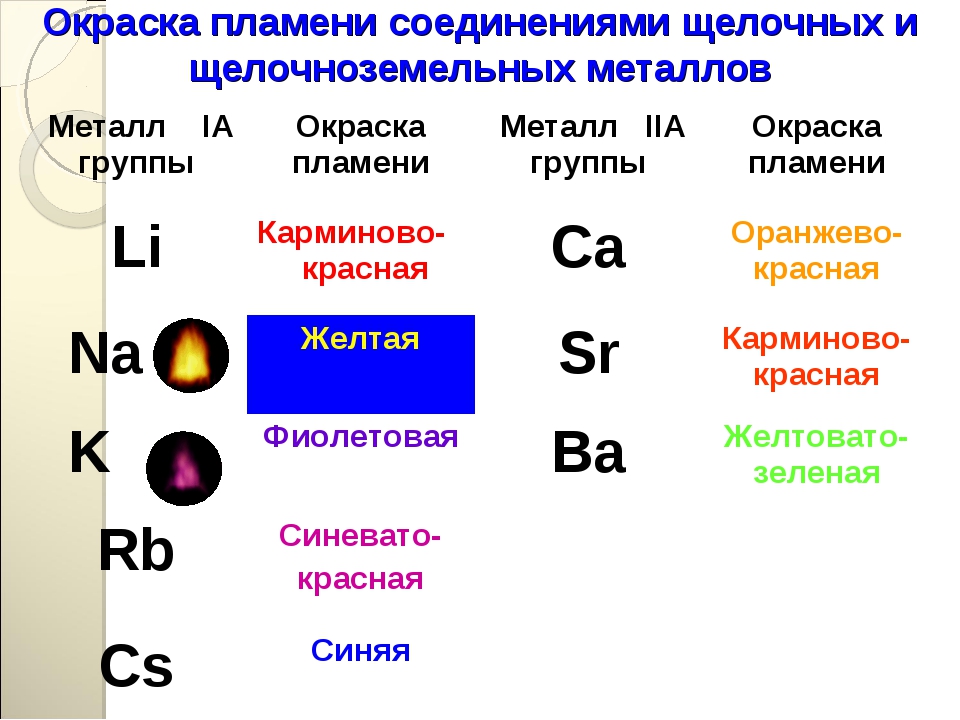 Неактивные металлы, например медь, в чистом виде получают электролизом водных растворов их солей. В ряде случаев с целью извлечения металла из руды последнюю обрабатывают растворамй кислот, щелочей или солей, а затем из получившегося раствора металл выделяют химическим путем, вытесняя его более активным металлом или электролизом. [c.377]
Неактивные металлы, например медь, в чистом виде получают электролизом водных растворов их солей. В ряде случаев с целью извлечения металла из руды последнюю обрабатывают растворамй кислот, щелочей или солей, а затем из получившегося раствора металл выделяют химическим путем, вытесняя его более активным металлом или электролизом. [c.377]
Тест «Щелочные и щелочноземельные металлы»
Тест « Щелочные и щелочноземельные металлы»
(контрольный срез знаний)
Цель: проверить знания и умения учащихся то теме «Щелочные и щелочноземельные металлы»
Умения:
определять положение металлов в периодической системе Д.И. Менделеева;
определять строение атома;
определять степень окисления;
составлять полные и сокращенные ионные уравнения
определять продукты реакции;
решать цепочки уравнений;
определять окислитель и восстановитель, писать электронный баланс;
расставлять коэффициенты;
определять молярную массу и молярный объем;
составлять пропорцию.
Знания:
тривиальные названия соединений;
химические свойства металлов, оксидов и гидроксидов;
качественные реакции;
историю открытия металлов.
Предлагаемые тестовые задания содержат теоретические и практические вопросы, соответствующие требованиям государственного стандарта химического образования: основные понятия, законы химии, строение, свойства, получение важнейших классов веществ, изучаемых в 8 классе и 9 классе (I и II четверть)
Количество вариантов: 2
На решение варианта, состоящего из 15 заданий, отводится 40 минут. Тесты состоят из части А (13 заданий )– с выбором правильного ответа из предложенных, и части В (2 задания – цепочка превращений и задача) — ответы учащиеся должны предложить сами.
Оценивание заданий:
Часть А – 1 балл
Часть Б:
Цепочка превращений:
— получение оксида – 1 балл;
— получение гидроксида – 1 балл;
— получение соли – 1 балл;
— метод электронного баланса – 2 балла;
— ионные уравнения – 1 балл.
Задача:
— составление уравнения – 1 балл;
— определение молярной массы – 1 балл;
— определение молярного объема – 1 балл;
— составление пропорции – 1 балл;
— ответ – 1 балл;
— оформление задачи – 1 балл.
Критерии для оценивания тематического теста:
«2» — менее 12 баллов
«3» — 12 — 17 баллов
«4» — 18 — 23 баллов
«5» — 24 — 25 баллов
Тест «Щелочные и щелочноземельные металлы»
Вариант I
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочноземельные металлы находятся в: 1) I A группе; 2) II А группе; 3) IV А группе 4) VIII А группе | 2 |
2 | Какой из указанных металлов является щелочным: 1) Mg; 2) Zn; 3) Ba; 4) K | 4 |
3 | Степень окисления щелочных металлов: 1) +1; 2) +2; 3) -2; 4) +3 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме магния: 1) 2,8,2; 2) 2,8,1; 3) 2,8,8,1; 4) 1,8,8,1 | 1 |
5 | Щелочноземельные металлы: А. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения не верны; 2) Верны А и Б; 3) Верны А и С | 2 |
6 | При взаимодействии с кислородом натрий образует: 1) оксид; 2) пероксид; 3) натрий не реагирует с кислородом. | 2 |
7 | Каустическая сода: 1) NaOH; 2) KOH; 3) Mg (OH)2; 4) NaCl | 1 |
8 | С каким из следующих веществ реагирует кальций? 1) Na2O; 2) NaCl; 3) Cu; 4) h3O | 4 |
9 | С каким из следующих веществ реагирует гидроксид калия? 1) СO2; 2) NaCl; 3) KNO3; 4) Ba(OH)2 | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Na3PO4 и Ca(NO3)2 1) NaNO3; 2) Ca (OH)2; 3) Ca3(PO4)2; 4) NaOH | 3 |
11 | Какая из следующих реакций относится к реакциям ионного обмена? 1) CaO + h3O → Ca (OH)2 2) Ba (NO3)2 + Na2SO4 → BaSO4 + 2 NaNO3 3) 2 Mg + TiO2 → 2 MgO + Ti 4) 3 Ba + N2 → Ba3N2 | 2 |
12 | Соли калия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 4 |
13 | Английский химик впервые получивший магний в 1808г. 1) Г.Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон | 1 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Ba → BaO → Ba(OH)2 → BaSO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде
1) 2 Ba0 + O02 → 2 Ba+2O-2
Ba0 – 2e → Ba+2 2 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) BaO + h3O → Ba(OH)2
3) Ba(OH)2 + h3SO4 → BaSO4 + 2 h3O
Ba2+ + 2OH- + 2H+ + SO42- → BaSO4 + 2 h3O
2. Решите задачу (6 баллов). При взаимодействии натрия массой 10 г с водой выделился водород. Определите объём водорода (н.у.).
Дано | Решение |
m(Na) = 10г | 0. 2Na + 2 h3O → 2NaOH + h3 2 моль 1 моль 1) 2) х = 0,215 (моль) 3) Ответ: V(h3) = 4.816 (л) |
Найти: V(h3) — ? |
Тест «Щелочные и щелочноземельные металлы»
Вариант II
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочные металлы находятся в: 1) I A группе; 2) III А группе; 3) VII Б группе 4) VI А группе | 1 |
2 | Какой из указанных металлов является щелочноземельным: 1) Sr; 2) Cs; 3) Na; 4) Al | 1 |
3 | Степень окисления щелочноземельных металлов: 1) +2; 2) +4; 3) +3; 4) -1 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме калия: 1) 2,8,7,2; 2) 2,8,8,1; 3) 2,8,1; 4) 1,8,8,2 | 2 |
5 | Щелочные металлы: А. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения верны; 2) Верны А и Б; 3) Верны А и В | 2 |
6 | Реакция сжигания магния сопровождается: 1) взрывом; 2) вспышкой; 3) нет ярко выраженных признаков химической реакции. | 2 |
7 | Английская соль: 1) CaSO4; 2) Ca (OH)2; 3) MgSO4; 4) CaCO3 | 3 |
8 | С каким из перечисленных веществ реагирует калий? 1) Na2O; 2) h3O; 3) Ca (OH)2; 4) Mg | 2 |
9 | С каким веществом реагирует гидроксид кальция? 1) NaOH; 2) Na2O; 3) HCl; 4) h3O | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Ba (NO3)2 и Na2SO4 1) NaNO3; 2)BaSO4; 3)NaHSO4; 4) Ba (OH)2 | 2 |
11 | Какая из следующих реакций выражается сокращенным ионным уравнением H + + OH — → h3O 1) 2 HCl + Cu (OH)2 → CuCl2 + 2 h3O 2) HBr + KOH → KBr + h3O 3) h3SO3 + 2 RbOH → Rb2SO3 + 2 h3O | 2 |
12 | Соли натрия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 3 |
13 | Шведский химик, открывший литий в 1817г: 1) Г. | 4 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Li → Li2O→ LiOH → Li3PO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде.
1) 4 Li0 + O02 → 2 Li+2O-2
Li0 – 1e → Li+ 4 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) Li2O + h3O → 2 LiOH
3) 3LiOH + h4PO4 → Li3PO4 + 3 h3O
3 Li+ + 3OH- + 3H+ + PO43- → Li3PO4 + 3 h3O
2. Решите задачу (6 баллов). При взаимодействии магния с хлором объемом 11,2 л (н.у.), образуется хлорид магния. Определите массу хлорида магния.
Дано | Решение |
V(Cl2) = 11. | 0.5 моль х моль 2Mg + Cl2 → MgCl2 1 моль 1 моль 1) 2) х = 0,5 (моль) 3) Ответ: m(MgCl2) = 45.5 (г) |
Найти: m(MgCl2) — ? |
Щелочные и щелочноземельные металлы, свойства, получение
Модуль состоит из трёх кадров, на которых представлен текст, уравнения реакций, интерактивные схемы, видеоролики. В том числе, ученику предлагается просмотреть и прослушать материал о свойствах щелочных и щелочноземельных металлов и способах их получения, путём выбора активных зон.
Категория пользователей
Обучаемый, Преподаватель
Контактное время
15 минут
Интерактивность
Средняя
Дисциплины
Химия
/ Неорганическая химия
/ Металлы и неметаллы
/ Металлы
/ Общая характеристика элементов главной подгруппы I и II группы.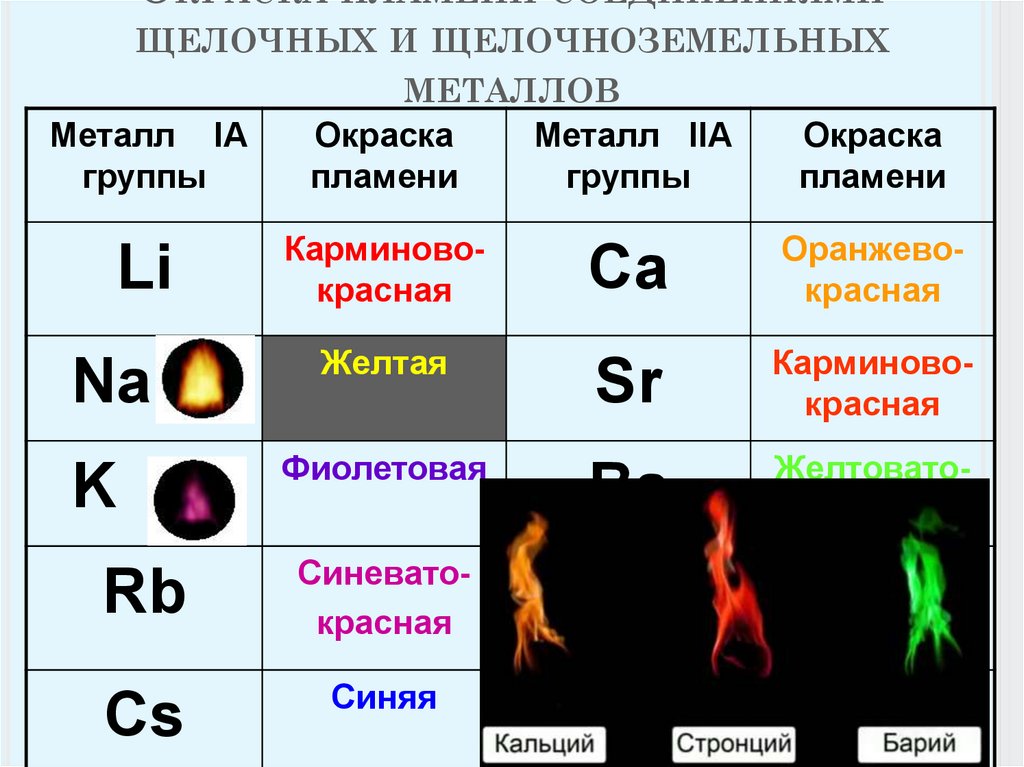 Щелочные и щелочно-земельные металлы, свойства и получение, применение, нахождение в природе
Щелочные и щелочно-земельные металлы, свойства и получение, применение, нахождение в природе
Уровень образования
Профессионально-техническая подготовка, повышение квалификации
Статус
Завершенный вариант (готовый, окончательный)
Тип ИР сферы образования
информационный модуль
Место издания
Москва
Ключевые слова
щелочные и щелочноземельные металлы
Автор
Морозов Михаил Николаевич
Марийский государственный технический университет
Издатель
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл., 3,
Сайт —
http://www. mmlab.ru
mmlab.ru
Эл. почта —
[email protected]
Правообладатель
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул., 51
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/html
Объем цифрового ИР
10 530 122 байт
Проигрыватель
OMS-player версии от 1.0
Категория модифицируемости компьютерного ИР
открытый
Признак платности
бесплатный
Наличие ограничений по использованию
есть ограничения
Рубрикация
Ступени образования
Основное общее образование
Целевое назначение
Учебное
Тип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)
Классы общеобразовательной школы
9
Уровень образовательного стандарта
Федеральный
Характер обучения
Базовое
|
Тушение натрия, калия и сплава натрий-калий
Тушение лития
Тушение пожаров водой
|
Щелочные и щелочноземельные металлы
Элементы первой группы периодической таблицы (за исключением водорода — см. Ниже) известны как щелочные металлы , потому что они образуют щелочные растворы, когда реагируют с водой. В эту группу входят элементы литий , натрий , калий , рубидий , цезий и франций . Каждый из этих элементов имеет только один валентный электрон, что означает, что они образуют только слабые металлические связи.В результате они относительно мягкие и имеют низкие температуры плавления.
Каждый из этих элементов имеет только один валентный электрон, что означает, что они образуют только слабые металлические связи.В результате они относительно мягкие и имеют низкие температуры плавления.
Электрон с одной валентностью легко теряется, что делает эти металлы очень реактивными. Они бурно реагируют как с воздухом, так и с водой — например, когда натрий вступает в контакт с водой, он бурно реагирует с образованием гидроксида натрия и водорода. Тепло реакции фактически воспламеняет водород! Щелочные металлы также легко соединяются с элементами семнадцатой группы ( хлор , фтор , бром и т. Д.)) с образованием стабильных ионных соединений , таких как хлорид натрия.
Щелочные металлы (выделены) занимают первую группу в периодической таблице.
Вторая группа периодической таблицы включает элементы бериллий , магний , кальций , стронций , барий и радий . Элементы в этой группе, которые все блестящие и серебристо-белые на вид, известны как щелочноземельные металлы . Как и щелочные металлы, они образуют щелочные растворы при взаимодействии с водой. Термин «земля» исторический; это было общее название, используемое алхимиками для оксидов этих элементов (которые когда-то считались элементами сами по себе).
Элементы в этой группе, которые все блестящие и серебристо-белые на вид, известны как щелочноземельные металлы . Как и щелочные металлы, они образуют щелочные растворы при взаимодействии с водой. Термин «земля» исторический; это было общее название, используемое алхимиками для оксидов этих элементов (которые когда-то считались элементами сами по себе).
Все элементы второй группы имеют на своей внешней оболочке двух электронов.Таким образом, металлические связи в щелочноземельных металлах прочнее, чем в щелочных металлах, что приводит к более высоким температурам плавления, но они все еще довольно реактивны, потому что два внешних электрона легко теряются. В результате они не встречаются в природе в своем элементарном состоянии.
Все щелочноземельные металлы, кроме одного, реагируют с галогенами ( хлор , фтор и т. Д.) С образованием ионных соединений (за исключением хлорида бериллия, поскольку связь ковалентная). Все щелочноземельные металлы, за исключением бериллия и магния, также реагируют с водой с образованием газообразного водорода и их соответствующих гидроксидов (однако магний будет реагировать с паром ). По сути, чем тяжелее щелочноземельный металл, тем интенсивнее он вступает в реакцию с водой.
Все щелочноземельные металлы, за исключением бериллия и магния, также реагируют с водой с образованием газообразного водорода и их соответствующих гидроксидов (однако магний будет реагировать с паром ). По сути, чем тяжелее щелочноземельный металл, тем интенсивнее он вступает в реакцию с водой.
Щелочноземельные металлы (выделены) занимают вторую группу в периодической таблице.
Магний является пятым по распространенности элементом на Земле, за ним следует кальций на восьмом месте, что тоже хорошо, поскольку и магний, и кальций жизненно важны для всего живого, включая человека! Магний участвует в большом количестве биохимических реакций; помимо прочего, он необходим для здоровья костей и зубов.Кальций составляет примерно два процента от общей массы нашего тела, большая часть которого находится в наших зубах и костях.
Щелочноземельный металл — обзор
6.
 4.5 Диффузия катионов
4.5 Диффузия катионовСобраны экспериментальные данные по диффузии щелочных и щелочноземельных металлов (Na + , Cs + , Sr 2+ ) в глинистых материалах. на рисунках 6.7–6.10. Данные по α в сравнении с ρ b, глиной показаны на рисунке 6.7, где каждая фигура соответствует отдельному иону. Пунктирные линии на рисунке 6.7 рассчитаны на основе предположения, что адсорбцию катионов можно описать с помощью линейного коэффициента адсорбции K d = q / C b , что дает:
Рисунок 6.7. Экспериментальные данные для α в зависимости от ρ б, глины для (а) Na + , (б) Cs + и (в) Sr 2+ в бентоните, уравновешенном 0 .1 моль л −1 раствора NaCl (закрашенные красные символы (серые в печатных версиях)) и в глинистых породах, уравновешенных синтетическими грунтовыми водами (открытые синие символы (светло-серые в печатных версиях)).
Рисунок 6.8. Экспериментальные данные для d ( α ) / d (log I ) в зависимости от ρ б, глины для (а) Na + , (б) Cs + , и (c) Sr 2+ в бентоните (закрашенные красные символы (серые в печатных версиях)) и в глинистых породах (открытый синий символ (светло-серый в печатных версиях)).
Рисунок 6.9. Экспериментальные данные для D a / D 0 в зависимости от ρ b, глины в бентоните для (а) Na + , (б) Cs + и (в ) Sr 2+ (закрашенные зеленые символы (темно-серые в печатных версиях): наилучших доступных данных ; бледно-голубые символы (серые в печатных версиях): данных, полученных без отбора проб профилей концентрации в глине ; незакрашенный оранжевый символы (светло-серые в печатных версиях): данных, полученных методами TD или ID без учета влияния фильтрующих пластин ).
Рисунок 6.10. Экспериментальные данные для ( D a / D 0 ) аниона / ( D a / D 0 ) воды как функции ρ b, глина для (а) Na + , (б) Cs + и (в) Sr 2+ в бентоните (закрашенные красные символы (темно-серые в печатных версиях)) и в глинистых породах (открытые синие символы (светло-серые в печатных версиях)).
(6.17) α = ϕ + ρbKd
Согласно уравнению (6.17), значения катионов α должны увеличиваться с ρ b (и с ρ b, глина , если f глина зафиксировано), как экспериментально наблюдается на рисунке 6.7 в случае бентонита, уравновешенного 0,1 моль л раствора -1 NaCl. Пунктирные линии на рис. 6.7 были рассчитаны с использованием значений K d , выбранных для заключения в скобки значений α в бентоните. Результат: K d = 3–11 дм 3 кг −1 для Na + , 50–1000 дм 3 кг −1 для Cs + и 70–220 дм 3 кг −1 для Sr 2+ .Большой диапазон значений K d , связанный с данными диффузии Cs + , может отражать существование различных центров адсорбции на поверхностях глинистых минералов с очень разным сродством к Cs + (рис. 6.2). Это может усложнить интерпретацию данных диффузии Cs + , вызывая значительные эффекты адсорбционной конкуренции (Jakob et al., 2009) и сильное влияние концентрации цезия на диффузионные свойства Cs + (Gimmi and Kosakowski, 2011).Значения α катионов в глинистых породах примерно на порядок ниже, чем в бентоните, со значительным разбросом. Это различие согласуется с более низкой удельной поверхностью глинистой фракции в глинистых породах, чем в бентоните (из-за сжатых межслоевых пространств иллита), а также с более высокой ионной силой, используемой для диффузионных измерений в глинистых породах (0,1 –0,24 моль л –1 , в случае данных глинистых пород, представленных для Cs + на Рисунке 6.
Результат: K d = 3–11 дм 3 кг −1 для Na + , 50–1000 дм 3 кг −1 для Cs + и 70–220 дм 3 кг −1 для Sr 2+ .Большой диапазон значений K d , связанный с данными диффузии Cs + , может отражать существование различных центров адсорбции на поверхностях глинистых минералов с очень разным сродством к Cs + (рис. 6.2). Это может усложнить интерпретацию данных диффузии Cs + , вызывая значительные эффекты адсорбционной конкуренции (Jakob et al., 2009) и сильное влияние концентрации цезия на диффузионные свойства Cs + (Gimmi and Kosakowski, 2011).Значения α катионов в глинистых породах примерно на порядок ниже, чем в бентоните, со значительным разбросом. Это различие согласуется с более низкой удельной поверхностью глинистой фракции в глинистых породах, чем в бентоните (из-за сжатых межслоевых пространств иллита), а также с более высокой ионной силой, используемой для диффузионных измерений в глинистых породах (0,1 –0,24 моль л –1 , в случае данных глинистых пород, представленных для Cs + на Рисунке 6. 7).
7).
Экспериментальные данные по зависимости значений α катионов от солености (рис. 6.8) показывают значительный разброс и отсутствие четкой зависимости от ρ b, глина . Средние зарегистрированные значения d (log α ) / d (log I ) для катионов в бентоните при 0,1 моль л -1 NaCl составляют -0,8 ± 0,3 для Na + , -1,0 ± 0,2 для Cs + и −1,2 ± 0,2 для Sr 2+ . Первые два значения согласуются с ожидаемыми на основе теории ионного обмена для реакции гомовалентного обмена ( d (log α ) / d (log I ) = -1) (Glaus et al., 2007). Среднее зарегистрированное значение для Sr 2+ значительно менее отрицательно, чем значение -2, ожидаемое для гетеровалентной реакции обмена Sr 2+ –Na + , что, возможно, указывает на то, что адсорбция Sr 2+ модулируется образование ионных пар, таких как SrHCO 3 + или SrSO 4 (Cole et al. , 2000; Appelo et al., 2010).
, 2000; Appelo et al., 2010).
Экспериментальные данные для D a / D 0 для катионов в бентоните в направлении, параллельном уплотнению, показывают сильную зависимость от ρ b, глины (рисунок 6.9), как также сообщалось в случае воды и анионов. Данные по соотношению ( D a / D 0 ) катион / ( D a / D 0 ) вода показывают, что присутствие глинистых минералов имеет большее влияние на значения катионов D a , чем на воду (рис. 6.10). Отношение ( D a / D 0 ) катион / ( D a / D 0 ) вода практически одинакова в бентоните и глинистых породах и составляет не сильно зависит от ρ б, глина в пределах точности экспериментальных данных.Для сравнения, модели, основанные на теории EDL с предположением, что частицы слоя Штерна (поверхностные комплексы) неподвижны, предсказывают, что ( D a / D 0 ) катион / ( D a / D 0 ) вода увеличивается с ρ b, глина (Шайнберг и Кемпер, 1966; Ким и др. , 1993), тогда как модели, которые учитывают более медленную диффузию молекул воды, расположенных в прямом контакт с поверхностью глинистых минералов прогнозирует небольшое увеличение ( D a / D 0 ) катион / ( D a / D 0 ) вода с ρ b, глина (Bourg et al., 2007; Бург и Спозито, 2010).
, 1993), тогда как модели, которые учитывают более медленную диффузию молекул воды, расположенных в прямом контакт с поверхностью глинистых минералов прогнозирует небольшое увеличение ( D a / D 0 ) катион / ( D a / D 0 ) вода с ρ b, глина (Bourg et al., 2007; Бург и Спозито, 2010).
As ρ b, глина и I приближаются к нулю, экспериментальные данные по ( D a / D 0 ) катион / ( D a / D 0 ) вода должна дать оценку отношения коэффициентов диффузии катионов на поверхности глинистых минералов и в объемной жидкой воде (Bourg et al., 2007, 2008; Bourg and Sposito, 2010). Средние значения ( D a / D 0 ) катион / ( D a / D 0 ) вода представлены на рисунке 6.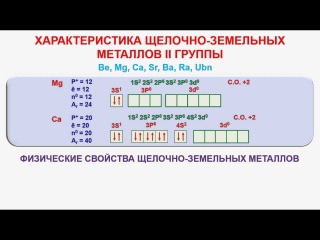 10 при ρ b, глина <1,2 кг дм −3 и I = 0 моль л −1 равняется 0,54 ± 0,13 для Na + , 0,03 ± 0,01 для Cs + и 0,13 ± 0,01 для Sr 2+ . Эти значения примерно согласуются с данными по электропроводности разбавленных смектитовых дисперсий, согласно которым адсорбированные ионы Na + , Cs + и Ca 2+ в 0,55, 0,15 и 0,15 раза подвижнее тех же ионов. в объемной воде соответственно (Cremers, 1968).Эти значения также согласуются с МД-моделированием внешних базальных поверхностей смектита Na + / Ca 2+ (где внешнесферные поверхностные комплексы Na + , основные адсорбированные частицы Na + , диффузные в 0,48 ± 0,08 раза). так же быстро, как в объемной жидкой воде (Bourg, Sposito, 2011a)) и межслоевых нанопор Na + -смектита (где Na + , Cs + и Sr 2+ диффундируют 0,24 ± 0,14, 0,06 ± В среднем в 0,03 и 0,13 ± 0,07 раза быстрее, чем в объемной жидкой воде, в двух- и трехслойных гидратах (Bourg, Sposito, 2010)).
10 при ρ b, глина <1,2 кг дм −3 и I = 0 моль л −1 равняется 0,54 ± 0,13 для Na + , 0,03 ± 0,01 для Cs + и 0,13 ± 0,01 для Sr 2+ . Эти значения примерно согласуются с данными по электропроводности разбавленных смектитовых дисперсий, согласно которым адсорбированные ионы Na + , Cs + и Ca 2+ в 0,55, 0,15 и 0,15 раза подвижнее тех же ионов. в объемной воде соответственно (Cremers, 1968).Эти значения также согласуются с МД-моделированием внешних базальных поверхностей смектита Na + / Ca 2+ (где внешнесферные поверхностные комплексы Na + , основные адсорбированные частицы Na + , диффузные в 0,48 ± 0,08 раза). так же быстро, как в объемной жидкой воде (Bourg, Sposito, 2011a)) и межслоевых нанопор Na + -смектита (где Na + , Cs + и Sr 2+ диффундируют 0,24 ± 0,14, 0,06 ± В среднем в 0,03 и 0,13 ± 0,07 раза быстрее, чем в объемной жидкой воде, в двух- и трехслойных гидратах (Bourg, Sposito, 2010)). Эти результаты ясно демонстрируют, что адсорбированные ионы Na + сохраняют значительную подвижность (van Schaik et al., 1966; Gimmi and Kosakowski, 2011), что противоречит предположениям нескольких модельных исследований (Jo et al., 2006; Leroy et al., др., 2006). Значительно более низкая подвижность адсорбированного Cs + по сравнению с Na + может быть связана со значительными различиями в адсорбционном поведении, поскольку Na + и Cs + имеют тенденцию образовывать комплексы на внешней и внутренней поверхности, соответственно, на глинистые минеральные базальные поверхности (Marry et al., 2008a; Бург и Спозито, 2011b).
Эти результаты ясно демонстрируют, что адсорбированные ионы Na + сохраняют значительную подвижность (van Schaik et al., 1966; Gimmi and Kosakowski, 2011), что противоречит предположениям нескольких модельных исследований (Jo et al., 2006; Leroy et al., др., 2006). Значительно более низкая подвижность адсорбированного Cs + по сравнению с Na + может быть связана со значительными различиями в адсорбционном поведении, поскольку Na + и Cs + имеют тенденцию образовывать комплексы на внешней и внутренней поверхности, соответственно, на глинистые минеральные базальные поверхности (Marry et al., 2008a; Бург и Спозито, 2011b).
Соленость практически не влияет на значения катионов D a / D 0 , как показано на рисунке 6.11. (Однако соленость влияет на D e из-за своего воздействия на α .) Такое поведение контрастирует с поведением анионов (рис. 6.6 (c)). Это различие между зависимостью от солености D a для катионов и анионов согласуется с теорией Гуи-Чепмена, согласно которой соленость оказывает гораздо более сильное влияние на характерный масштаб длины, связанный с исключением анионов, чем на масштаб, связанный с адсорбцией катионов. , явление, известное как конденсация противоионов (Sposito, 2004).Экспериментальные данные по энергии активации диффузии катионов (рисунок 6.12) показывают, что зависимость T от D a в бентоните значительно больше, чем в объемной жидкой воде при ρ b, глине > 1,3. кг дм -3 , что также наблюдается для анионов на Рисунке 6.6 (d). Моделирование методом МД показывает, что это увеличение E a является результатом диффузии катионов, происходящей преимущественно в межслоевых нанопорах (двух- и трехслойных гидратах) при ρ b, глина > 1.3 кг дм −3 и преимущественно на внешних базальных поверхностях частиц глинистых минералов при более низких степенях уплотнения (Holmboe, Bourg, 2014).
Это различие между зависимостью от солености D a для катионов и анионов согласуется с теорией Гуи-Чепмена, согласно которой соленость оказывает гораздо более сильное влияние на характерный масштаб длины, связанный с исключением анионов, чем на масштаб, связанный с адсорбцией катионов. , явление, известное как конденсация противоионов (Sposito, 2004).Экспериментальные данные по энергии активации диффузии катионов (рисунок 6.12) показывают, что зависимость T от D a в бентоните значительно больше, чем в объемной жидкой воде при ρ b, глине > 1,3. кг дм -3 , что также наблюдается для анионов на Рисунке 6.6 (d). Моделирование методом МД показывает, что это увеличение E a является результатом диффузии катионов, происходящей преимущественно в межслоевых нанопорах (двух- и трехслойных гидратах) при ρ b, глина > 1.3 кг дм −3 и преимущественно на внешних базальных поверхностях частиц глинистых минералов при более низких степенях уплотнения (Holmboe, Bourg, 2014).
Рисунок 6.11. Экспериментальные данные для d ( D a / D 0 ) / d (log I ) для (а) Na + , (б) Cs + и ( c) Sr 2+ , построено как функция ρ b, глины в бентоните (закрашенные красные символы (серые в печатных версиях) и глинистых породах (открытые синие символы (светло-серые в печатных версиях)) .
Рисунок 6.12. Экспериментальные данные по энергии активации диффузии E a в зависимости от ρ b, глина для Na + (желтые ромбы (светло-серые в печатных версиях)), Cs + (зеленые треугольники (темно-серый в печатных версиях)) и Sr 2+ (синие квадраты (серые в печатных версиях)) в бентоните.
Элементы группы 2: щелочноземельные металлы
- Последнее обновление
- Сохранить как PDF
Щелочноземельные металлы группы 2 включают бериллий, магний, кальций, барий, стронций и радий и являются мягкими серебристыми металлами, которые имеют менее металлический характер, чем щелочные металлы группы 1. Хотя многие характеристики являются общими для всей группы, более тяжелые металлы, такие как Ca, Sr, Ba и Ra, почти так же реактивны, как и щелочные металлы 1-й группы. Все элементы в группе 2 имеют два электрона в валентных оболочках, что дает им степень окисления +2.
Хотя многие характеристики являются общими для всей группы, более тяжелые металлы, такие как Ca, Sr, Ba и Ra, почти так же реактивны, как и щелочные металлы 1-й группы. Все элементы в группе 2 имеют два электрона в валентных оболочках, что дает им степень окисления +2.
- Группа 2: Химические свойства щелочноземельных металлов
- Включает элементы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Включает тенденции атомных и физических свойств, тенденции реакционной способности, характер растворимости в гидроксидах и сульфатах, тенденции термического разложения нитратов и карбонатов, а также некоторые нетипичные свойства бериллия.
- Группа 2: Физические свойства щелочноземельных металлов
- На этой странице исследуются тенденции в некоторых атомных и физических свойствах элементов Группы 2: бериллия, магния, кальция, стронция и бария. В разделах ниже рассматриваются тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности и физических свойств.

- Химия бериллия (Z = 4)
- Название Бериллий происходит от греческого слова beryllos, которое является названием драгоценного камня берилла.Элемент представляет собой тугоплавкий серебристо-белый металл, который является первым членом щелочноземельных металлов. Его не так много в окружающей среде, и он встречается в основном в минерале берилле с алюминием и кремнием.
- Химия магния (Z = 12)
- Магний является элементом второй группы и восьмым по распространенности элементом в земной коре. Магний легкий, серебристо-белый и прочный. Как и алюминий, он образует вокруг себя тонкий слой, предотвращающий ржавление при контакте с воздухом.Мелкие частицы магния также могут загореться при контакте с воздухом.
- Химия кальция (Z = 20)
- Кальций — 20-й элемент периодической таблицы Менделеева. Это металл группы 2, также известный как щелочно-земельный металл, и он не содержит d-орбитальных электронов.
 Кальций является пятым по содержанию элементом по массе (3,4%) как в земной коре, так и в морской воде. Все живые организмы (фактически, даже мертвые) имеют кальций и нуждаются в нем для выживания.
Кальций является пятым по содержанию элементом по массе (3,4%) как в земной коре, так и в морской воде. Все живые организмы (фактически, даже мертвые) имеют кальций и нуждаются в нем для выживания.
- Химия стронция (Z = 38)
- Стронций — это элемент 2 группы, который не встречается в свободном виде из-за его чрезвычайной реакционной способности с кислородом и водой.В природе он встречается только в соединениях с другими элементами, такими как стронцианит. Он мягче кальция и сильнее разлагает воду. Он имеет серебристый вид, но затем желтеет с образованием оксида. Стронций назван в честь шотландской деревни на Стронтиане.
- Химия бария (Z = 56)
- Барий — мягкий серебристо-белый металл с температурой плавления 1000 К. Из-за реакции с воздухом барий в чистом виде не встречается в природе. форма, но может быть извлечена из минерального барита.
- Химия радия (Z = 88)
- Радий получил свое название от латинского слова «радиус» или «луч».
 Все изотопы радия радиоактивны, многие из них светятся, легко вступая в реакцию с кислородом и водой. Металл был открыт и выделен в 1911 году Мари Кюри.
Все изотопы радия радиоактивны, многие из них светятся, легко вступая в реакцию с кислородом и водой. Металл был открыт и выделен в 1911 году Мари Кюри.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Каковы свойства щелочноземельных металлов?
Щелочноземельные металлы — одна группа элементов в периодической таблице.Элементы, выделенные желтым цветом в периодической таблице на рисунке, относятся к группе щелочноземельных элементов. Вот посмотрите на расположение и свойства этих элементов:
Расположение щелочных земель в Периодической таблице
Щелочноземельные элементы — это элементы, относящиеся к группе IIA периодической таблицы. Это второй столбец таблицы. Список элементов, относящихся к щелочноземельным металлам, невелик. В порядке возрастания атомного номера шесть названий элементов и символов:
Это второй столбец таблицы. Список элементов, относящихся к щелочноземельным металлам, невелик. В порядке возрастания атомного номера шесть названий элементов и символов:
- Бериллий (Be)
- Магний (Mg)
- Кальций (Ca)
- Стронций (Sr)
- Барий (Ba)
- Радий (Ra)
Если элемент 120 произведен, скорее всего, это будет новый щелочноземельный металл.В настоящее время радий — единственный из этих элементов, который является радиоактивным и не содержит стабильных изотопов. Элемент 120 тоже будет радиоактивным. Все щелочноземельные элементы, кроме магния и стронция, содержат по крайней мере один радиоизотоп, который встречается в природе.
Свойства щелочноземельных металлов
Щелочноземельные земли обладают многими характерными свойствами металлов. Щелочные земли имеют низкое сродство к электрону и низкую электроотрицательность. Как и в случае щелочных металлов, свойства зависят от легкости потери электронов. У щелочноземельных металлов есть два электрона на внешней оболочке. Они имеют меньшие атомные радиусы, чем щелочные металлы. Два валентных электрона не связаны прочно с ядром, поэтому щелочноземельные металлы легко теряют электроны с образованием двухвалентных катионов.
У щелочноземельных металлов есть два электрона на внешней оболочке. Они имеют меньшие атомные радиусы, чем щелочные металлы. Два валентных электрона не связаны прочно с ядром, поэтому щелочноземельные металлы легко теряют электроны с образованием двухвалентных катионов.
Сводка общих свойств щелочноземельных металлов
- Два электрона во внешней оболочке и полная внешняя электронная оболочка
- Низкое сродство к электрону
- Низкая электроотрицательность
- Относительно низкая плотность
- Относительно низкие температуры плавления и кипения металлов
- Обычно ковкий и пластичный.Относительно мягкий и прочный.
- Элементы легко образуют двухвалентные катионы (такие как Mg 2+ и Ca 2+ ).
- Щелочноземельные металлы очень реактивны, хотя и в меньшей степени, чем щелочные металлы. Из-за их высокой реакционной способности щелочноземельные земли не встречаются в природе свободными.
 Однако все эти элементы встречаются в природе. Они распространены в самых разных соединениях и минералах.
Однако все эти элементы встречаются в природе. Они распространены в самых разных соединениях и минералах. - Эти элементы блестящие и серебристо-белые, как чистые металлы, хотя обычно кажутся тусклыми, поскольку вступают в реакцию с воздухом с образованием поверхностных оксидных слоев.
- Все щелочноземельные элементы, кроме бериллия, образуют едкие щелочные гидроксиды.
- Все щелочноземельные металлы реагируют с галогенами с образованием галогенидов. Галогениды представляют собой ионные кристаллы, за исключением хлорида бериллия, который является ковалентным соединением.
Интересный факт
Щелочноземельные земли получили свое название от своих оксидов, которые были известны человечеству задолго до того, как были выделены чистые элементы. Эти оксиды были названы бериллием, магнезией, известью, стронцией и баритой.Слово «земля» в этом смысле происходит от старого термина, используемого химиками для описания неметаллического вещества, которое не растворяется в воде и сопротивляется нагреванию. Только в 1780 году Антуан Лавуазье предположил, что земли представляют собой соединения, а не элементы.
Только в 1780 году Антуан Лавуазье предположил, что земли представляют собой соединения, а не элементы.
Соли щелочных и щелочноземельных металлов тетразолона: интересная структура и превосходная термостабильность
Тетразолон (5-оксотетразол) был синтезирован умеренной стратегией в три стадии (добавление, циклизация и каталитическое гидрирование), избегая нестабильного промежуточного диазония, как сообщалось во время предыдущего получения.Соли щелочных и щелочноземельных металлов с литием ( 1 ), натрием ( 2 ), калием ( 3 ), рубидием ( 4 ), цезием ( 5 ), магнием ( 6 ), кальцием ( 7 ), стронций ( 8 ) и барий ( 9 ) были получены и полностью охарактеризованы с использованием элементного анализа, ИК- и ЯМР-спектроскопии, ДСК и ТГ-анализа. Все соли металлов были охарактеризованы как с помощью дифракции рентгеновских лучей на монокристалле . Они кристаллизуются в общих пространственных группах с высокой плотностью от 1 до 1.479 ( 1 ) до 3,060 г / см −3 ( 5 ). Кроме того, кристаллические структуры 7 , 8 и 9 обнаруживают интересные пористые энергетические координационные полимеры с сильными взаимодействиями водородных связей. Все новые соли обладают хорошей термической стабильностью с температурой разложения от 215,0 ° C ( 4 ) до 328,2 ° C ( 7 ), что значительно выше, чем у описанной богатой азотом соли нейтрального тетразолона.Чувствительность к удару и трению была проверена с использованием стандартных методов, и все исследованные соединения на основе тетразолона можно отнести к категории нечувствительных. Испытание на пламя этих солей металлов подтверждает их потенциальное использование в качестве пиротехнических средств, не содержащих перхлоратов, или экологически чистых нечувствительных энергетических материалов.
Они кристаллизуются в общих пространственных группах с высокой плотностью от 1 до 1.479 ( 1 ) до 3,060 г / см −3 ( 5 ). Кроме того, кристаллические структуры 7 , 8 и 9 обнаруживают интересные пористые энергетические координационные полимеры с сильными взаимодействиями водородных связей. Все новые соли обладают хорошей термической стабильностью с температурой разложения от 215,0 ° C ( 4 ) до 328,2 ° C ( 7 ), что значительно выше, чем у описанной богатой азотом соли нейтрального тетразолона.Чувствительность к удару и трению была проверена с использованием стандартных методов, и все исследованные соединения на основе тетразолона можно отнести к категории нечувствительных. Испытание на пламя этих солей металлов подтверждает их потенциальное использование в качестве пиротехнических средств, не содержащих перхлоратов, или экологически чистых нечувствительных энергетических материалов.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Карбонилы щелочноземельных металлов нарушают правила | Research
Более тяжелые элементы группы 2, похоже, вовлекают свои пустые d-орбитали в связь в большей степени, чем предполагалось ранее. Кальций, стронций и барий могут образовывать 18-электронные октакарбонильные комплексы с монооксидом углерода, более похожие на те, что образуются переходными металлами, чем другие элементы основной группы. Новые результаты бросают вызов предыдущим представлениям о координационной химии и расширяют пределы общепринятого правила.
Кальций, стронций и барий могут образовывать 18-электронные октакарбонильные комплексы с монооксидом углерода, более похожие на те, что образуются переходными металлами, чем другие элементы основной группы. Новые результаты бросают вызов предыдущим представлениям о координационной химии и расширяют пределы общепринятого правила.
Элементы подразделяются на элементы основной группы, которые включают s- и p-блоки периодической таблицы, переходные металлы (d-блок) и лантаноиды и актиниды (f-блок). В качестве элементов основной группы Ca, Sr и Ba обычно образуют связи, используя свои s- и p-валентные орбитали, следуя «правилу октетов», согласно которому атомы имеют тенденцию объединяться таким образом, что в их валентной оболочке имеется восемь электронов.Переходные металлы приносят еще пять d-орбиталей, которые необходимо заполнить для достижения такой стабильной конфигурации, что приводит к аналогичному правилу 18-электронов для этих элементов.
Гернот Френкинг из Марбургского университета, Германия, и его коллеги в Китае продемонстрировали, что принцип 18 электронов не ограничивается переходными металлами. «Наблюдение за щелочноземельными комплексами M (CO) 8 указывает на то, что вековое правило октетов для элементов основной группы, которое преподается во всех учебниках химии, неприменимо для некоторых атомов», — говорит Френкинг.В недавнем сотрудничестве с Минфэй Чжоу из Университета Фудань он проанализировал колебательные спектры Ba (CO) + и Ba (CO) — и был озадачен результатами. 2 «Сигнал для режима растяжения катиона С – О привлек мое внимание, потому что он был сдвинут на гораздо более низкие волновые числа по сравнению с свободным СО», — говорит Френкинг. «Я работал над такими системами в течение 20 лет и сразу понял, что происходит что-то странное». Теоретический анализ подтвердил его предположение о том, что атом Ва использует d-орбитали вместо s или p-орбиталей в связи.Ранее сообщалось о подобном поведении Ba, но только в экзотических системах. 3
«Наблюдение за щелочноземельными комплексами M (CO) 8 указывает на то, что вековое правило октетов для элементов основной группы, которое преподается во всех учебниках химии, неприменимо для некоторых атомов», — говорит Френкинг.В недавнем сотрудничестве с Минфэй Чжоу из Университета Фудань он проанализировал колебательные спектры Ba (CO) + и Ba (CO) — и был озадачен результатами. 2 «Сигнал для режима растяжения катиона С – О привлек мое внимание, потому что он был сдвинут на гораздо более низкие волновые числа по сравнению с свободным СО», — говорит Френкинг. «Я работал над такими системами в течение 20 лет и сразу понял, что происходит что-то странное». Теоретический анализ подтвердил его предположение о том, что атом Ва использует d-орбитали вместо s или p-орбиталей в связи.Ранее сообщалось о подобном поведении Ba, но только в экзотических системах. 3
Затем исследователи создали комплексы Ca, Sr и Ba с CO в холодной неоновой матрице и проанализировали систему с помощью инфракрасной спектроскопии. Они обнаружили комплексы с восемью лигандами CO, расположенными в углах куба вокруг металлического центра. Частоты растяжения связей CO подтверждают наличие обратной связи между металлами и лигандами CO. «CO формирует свою основную связь с металлами, отдавая металлу два своих внешних электрона (так называемое σ-пожертвование)», — объясняет Питер Арментраут из Университета Юты, США.«Но металлы могут образовывать обратные связи, отдавая электроны металлов на незанятые разрыхляющие орбитали на CO. Это ослабляет связь CO, что может быть обнаружено спектроскопически». Арментроут указывает, что каждый комплекс также имеет по два неспаренных электрона. «Это делает их похожими на O 2 , и это одна из причин, по которой эти молекулы обладают реакционной способностью», — говорит он.
Они обнаружили комплексы с восемью лигандами CO, расположенными в углах куба вокруг металлического центра. Частоты растяжения связей CO подтверждают наличие обратной связи между металлами и лигандами CO. «CO формирует свою основную связь с металлами, отдавая металлу два своих внешних электрона (так называемое σ-пожертвование)», — объясняет Питер Арментраут из Университета Юты, США.«Но металлы могут образовывать обратные связи, отдавая электроны металлов на незанятые разрыхляющие орбитали на CO. Это ослабляет связь CO, что может быть обнаружено спектроскопически». Арментроут указывает, что каждый комплекс также имеет по два неспаренных электрона. «Это делает их похожими на O 2 , и это одна из причин, по которой эти молекулы обладают реакционной способностью», — говорит он.
Ссылки
1. X Wu et al , Science , 2018, 361 , 912 (DOI: 10.1126 / science.aau0839)
2.X Wu и др. , Angew. Chem. Int. Эд. , 2018, 57 , 3974 (DOI: 10.

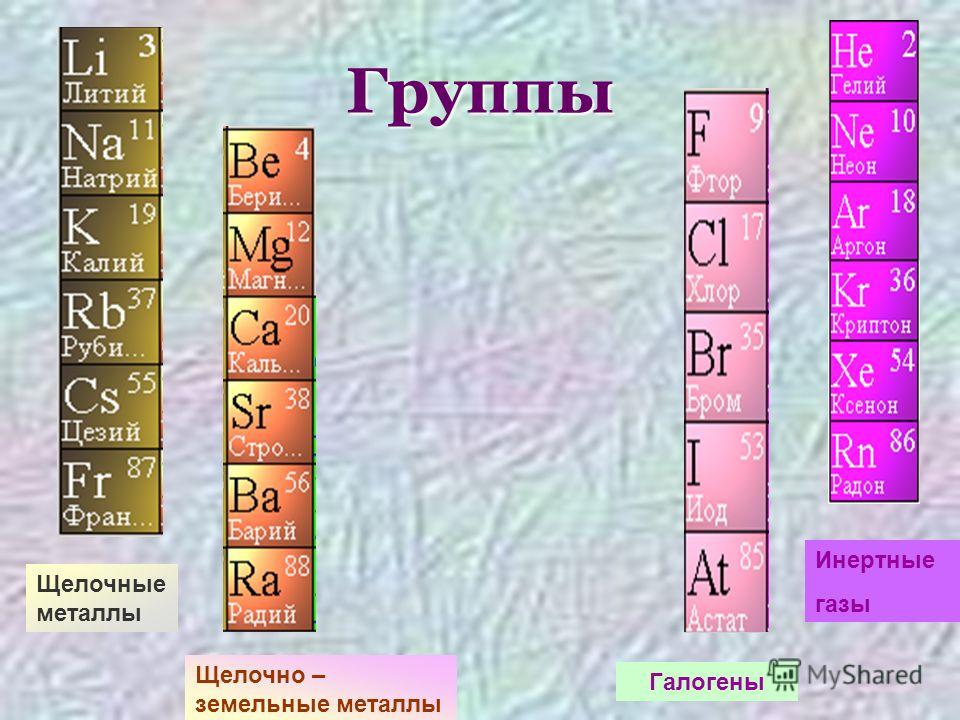
 Смеси таких элементов (СПЛАВЫ) также являются металлами. Около трех четвертей всех… … Научно-технический энциклопедический словарь
Смеси таких элементов (СПЛАВЫ) также являются металлами. Около трех четвертей всех… … Научно-технический энциклопедический словарь Химические элементы – это строительные кубики жизни, но все ли мы знаем о них? Можете ли вы поддержать разговор о достижениях современной науки за обедом с друзьями? А знаете ли вы, какой… Подробнее Купить за 189 руб аудиокнига
Химические элементы – это строительные кубики жизни, но все ли мы знаем о них? Можете ли вы поддержать разговор о достижениях современной науки за обедом с друзьями? А знаете ли вы, какой… Подробнее Купить за 189 руб аудиокнига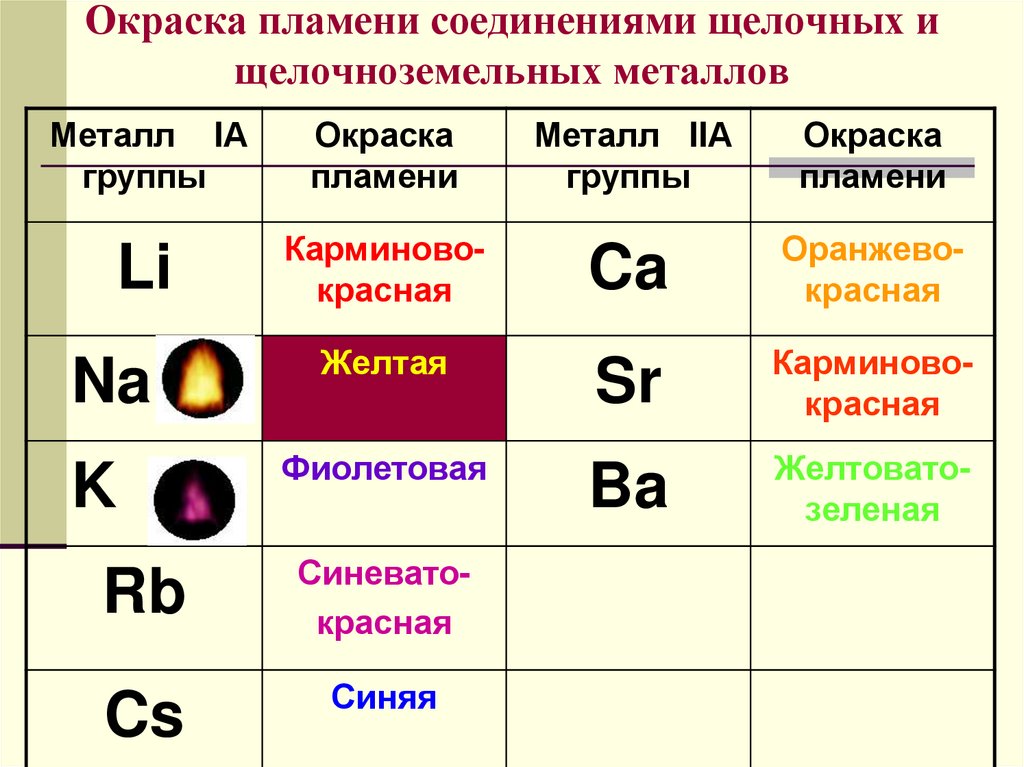

 Серебристо – белые.
Серебристо – белые. :
: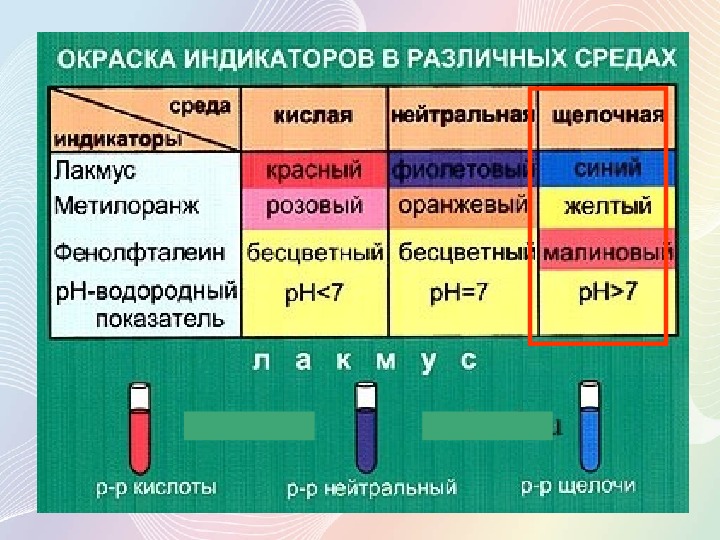 43 моль х моль
43 моль х моль Серебристо – белые.
Серебристо – белые. Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон
Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон 2 л
2 л
 Поваренная соль предпочтительнее песка, поскольку при высокой температуре натрий и калий могут реагировать с диоксидом кремния.
Поваренная соль предпочтительнее песка, поскольку при высокой температуре натрий и калий могут реагировать с диоксидом кремния. Если на горящий в какой-либо емкости натрий вылить небольшое количество керосина, образовавшийся в результате очаг пламени можно полностью загасить с помошью углекислотного огнетушителя.
Если на горящий в какой-либо емкости натрий вылить небольшое количество керосина, образовавшийся в результате очаг пламени можно полностью загасить с помошью углекислотного огнетушителя.



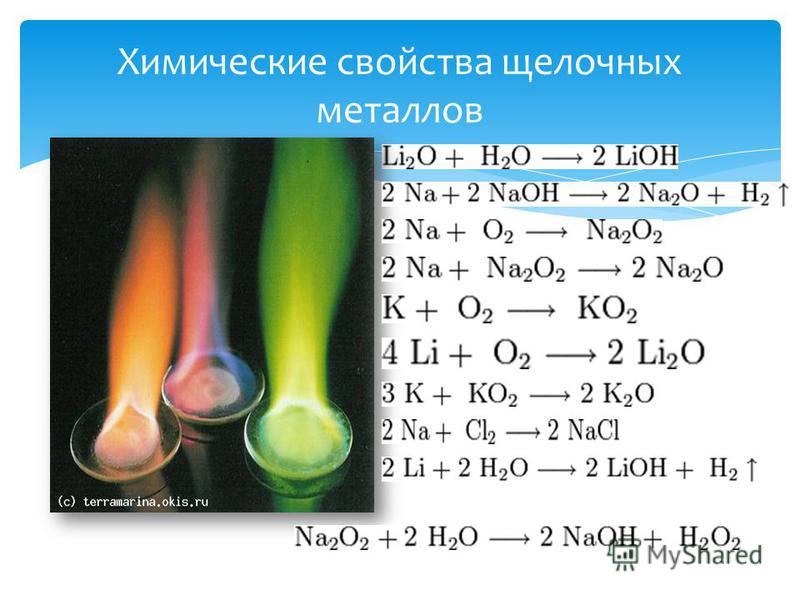 )
)

 Кальций является пятым по содержанию элементом по массе (3,4%) как в земной коре, так и в морской воде. Все живые организмы (фактически, даже мертвые) имеют кальций и нуждаются в нем для выживания.
Кальций является пятым по содержанию элементом по массе (3,4%) как в земной коре, так и в морской воде. Все живые организмы (фактически, даже мертвые) имеют кальций и нуждаются в нем для выживания. Все изотопы радия радиоактивны, многие из них светятся, легко вступая в реакцию с кислородом и водой. Металл был открыт и выделен в 1911 году Мари Кюри.
Все изотопы радия радиоактивны, многие из них светятся, легко вступая в реакцию с кислородом и водой. Металл был открыт и выделен в 1911 году Мари Кюри.
 Однако все эти элементы встречаются в природе. Они распространены в самых разных соединениях и минералах.
Однако все эти элементы встречаются в природе. Они распространены в самых разных соединениях и минералах.