Соединения щелочноземельных металлов
Щелочноземельные металлы образуют основные оксиды, которые получают термическим разложением карбонатов или нитратов:
СаCO3 = СаO + CO2; 2Ba(NO3)2 = 2BaO + 4NO2 + O2
Энергично взаимодействуют с водой с образованием растворимых сильных оснований (щелочей).
При переходе от Ca(OH)2 к Ba(OH)2 растворимость заметно увеличивается (от 0,02 М до 0,2 М), в том же направлении увеличивается термическая устойчивость гидроксидов и усиливаются основные свойства. По силе основания уступают только гидроксидам щелочных металлов. Раствор Ва(ОН)2 – баритовая вода – лабораторный реактив на CO2.
Катионы
щелочноземельных металлов образуют
соли со всеми кислотами. Хорошо растворимы
галогениды, нитраты, перхлораты и
большинство кислых солей.
Ba2+ + SO42- = BaSO4
Присутствие в природной воде растворимых солей кальция и магния обуславливает ее жесткость. Количественно жесткость измеряют суммарной концентрацией катионов Ca2+ и Mg2+ (ммоль экв/л). Различают временную (карбонатную) и постоянную жесткость. Первая удаляется кипячением:
t t
Ca(HCO3)2 = CaCO3 + CO2 + H2O; Mg(HCO3)2 = Mg(OH)2 + 2CO2
Для
удаления постоянной жесткости к воде
добавляют вещества (соду, фосфат натрия
и т.
Гидриды представляют собой белые солеподобные вещества, разлагающиеся водой с выделением водорода, сильные восстановители. В отличие от бериллия и магния, гидриды щелочноземельных металлов можно получить прямым синтезом:
t
Ca + H2 = CaH2
Литература: [1] с. 587 — 599, [2] с. 481 — 486, [3] с. 447 — 460
7.4. Элементы ia-подгруппы (щелочные металлы)
Элементы
IA-подгруппы: литий — Li, натрий — Na, калий
— K, рубидий — Rb, цезий — Cs и радиоактивный
франций часто называют щелочными
металлами. Общая формула ns1 обуславливает проявление щелочными
металлами степени окисления +1.
Увеличение эффективного радиуса и уменьшение энергии ионизации в ряду Li – Na – K – Rb – Cs сопровождается заметным увеличением активности металлов. Небольшой радиус атома лития вызывает довольно сильные отличия данного элемента от остальных щелочных металлов, что в первую очередь проявляется в склонности к образованию ковалентных связей. Для натрия и особенно элементов подгруппы калия образование ковалентных связей нетипично. Малый размер и большая энергия гидратации катиона лития приводит к нарушению ожидаемой последовательности расположения щелочных металлов в ряду стандартных электродных потенциалов (литий стоит в нем первым). Нарушается ожидаемая последовательность активности щелочных металлов и в расплавах, в которых натрий более активен, что связано с образованием его ионом более прочных кристаллических решеток:
t
KOH + Na = NaOH + K
Литий,
натрий, калий и рубидий — серебристо-белые
металлы, цезий золотисто-желтого цвета. На воздухе поверхность лития, натрия и
калия очень быстро тускнеет, рубидий и
цезий самопроизвольно воспламеняются.
Литий, натрий и калий хранят под слоем
вазелина или вазелинового масла, рубидий
и цезий хранят в запаянных ампулах.
Металлы очень легкие и легкоплавкие,
имеют довольно большой диапазон жидкого
состояния. Щелочные металлы очень
мягкие, натрий и калий легко режутся
ножом.
На воздухе поверхность лития, натрия и
калия очень быстро тускнеет, рубидий и
цезий самопроизвольно воспламеняются.
Литий, натрий и калий хранят под слоем
вазелина или вазелинового масла, рубидий
и цезий хранят в запаянных ампулах.
Металлы очень легкие и легкоплавкие,
имеют довольно большой диапазон жидкого
состояния. Щелочные металлы очень
мягкие, натрий и калий легко режутся
ножом.
Свойства | Li | Na | K | Cs | |
Плотность, г/см3 | 0,53 | 0,97 | 0,86 | 1,53 | 1,90 |
Т. | 181 | 98 | 64 | 39 | 29 |
Т.кип., С | 1340 | 886 | 771 | 630 | 672 |
Кларк, мол.% | 0,02 | 2,4 | 1,4 | 710-3 | 110-8 |
Литий,
натрий и калий весьма распространены
в природе, образуют много самостоятельных
минералов: LiAl(SiO3)2 — сподумен, LiAl(PO4)F
— амблигонит, NaCl галит (каменная или
поваренная соль), Na2SO410H2O
— мирабилит, KCl — сильвин, NaClKCl
— сильвинит, KClMgCl26H2O
— карналлит, КClMgSO43H2O
— каинит. Рубидий и цезий самостоятельных
минералов не образуют, встречаются в
виде примесей в минералах калия.
Рубидий и цезий самостоятельных
минералов не образуют, встречаются в
виде примесей в минералах калия.
Литий и натрий получают электролизом ионных расплавов. Калий обычно получают восстановлением расплавов его соединений натрием или магнием.
Литий применяется в качестве легирующей добавки, придает сплавам твердость и пластичность. Натрий используется как теплоноситель в ядерных реакторах и восстановитель в металлотермии, а также как катализатор процессов полимеризации диенов. В лабораториях натрий широко используется для осушки газов и органических растворителей. Калий используется в промышленности как восстановитель и теплоноситель (в основном в виде жидкого сплава с натрием). Рубидий и цезий в основном применяются для изготовления фотоэлементов.
Химические
свойства. Очень
активные металлы, реагируют со всеми
неметаллами, кроме инертных газов.
Состав продуктов окисления кислородом
зависит от природы металла: литий
образует оксид, натрий и калий — перекисные
соединения.
4Li + O2 = 2Li2O; 2Na + O2 = Na2O2; K + O2 = KO2
пероксид натрия супероксид калия
С водой реагируют очень энергично, калий — со взрывом:
2K + 2H2O = 2KOH + H2
Растворимы в аммиаке, с которым реагируют в присутствии катализатора:
2Na + 2NH3 = 2NaNH2 + H2
Растворимы в ртути, образуя амальгамы, которые медленно разлагаются водой и используются в качестве мягкого восстановителя. Активно реагируют с оксидами, отбирая у них кислород, горят в атмосфере оксида углерода(IV):
t t
4Na + SiO2 = 2Na2O + Si; 4Li + CO2 = 2Li2O + C
Урок «Взаимодействие щелочных и щелочноземельных металлов с растворами солей» | План-конспект урока по химии (9 класс) по теме:
Тема: Взаимодействие щелочных и щелочноземельных металлов с растворами солей
Тип урока: урок освоения новых знаний.
Цели урока.
Обучающие:
- На основе проблемного демонстрационного опыта формировать у учащихся правильное представление о взаимодействии щелочных и щелочно-земельных металлов с растворами различных солей.
Развивающие:
- развитие познавательного интереса, коммуникативных качеств, умение сравнивать, обобщать, выделять главное и прогнозировать
- развитие внимания, умения наблюдать, способствовать развитию исследовательских навыков.
Воспитательные:
- воспитывать в детях чувства товарищества, умения работать в коллективе, воспитывать интерес у обучающихся к урокам химии, соблюдать технику безопасности при работе с веществами.
Учитель. Вспомните, какие металлы взаимодействуют с растворами солей?
Учитель. Давайте сначала посмотрим опыт:
Взаимодействие раствора сульфата меди (II) с железом
Опыт 1. Взаимодействие раствора сульфата меди (II) с железом.
Учитель. Какие признаки реакции вы наблюдали?
признак реакции: выделение красной меди, изменение цвета раствора (с течением времени) с голубого на желтоватый
CuSO4 + Fe = FeCI2 + Cu
Опыт 2. Взаимодействие раствора сульфата железа (II) с медью
Взаимодействие раствора сульфата железа (II) с медью
В раствор хлорида железа (II) опускаем медную пластину, через 2-3 минуты вынимаем пластину из раствора. Что вы наблюдаете?
Ответ: никаких изменений с медной пластиной не произошло.
Вывод: Хлорид хлорида железа (II) не вступает в реакцию с медью. Почему?
FeSO4 + Cu = р. н. и
С растворами солей, реагируют металлы, стоящие в электрохимическом ряду напряжений металлов впереди металла, входящего в состав данной соли. При этом более активный металл вытесняет менее активный из раствора соли.
Задание: допишите уравнения возможных химических реакций
А) Pb(NO3)2 + Ni →
Б) CuCl2 + Zn →
В) CuCl2 + Ag →
Учитель. Будут ли щелочные и щелочноземельные металлы взаимодействовать с растворами солей и вытеснять менее активные металлы из растворов этих солей?
Не будем торопиться с составлением уравнения химических реакций. Обратимся сначала к химическому эксперименту.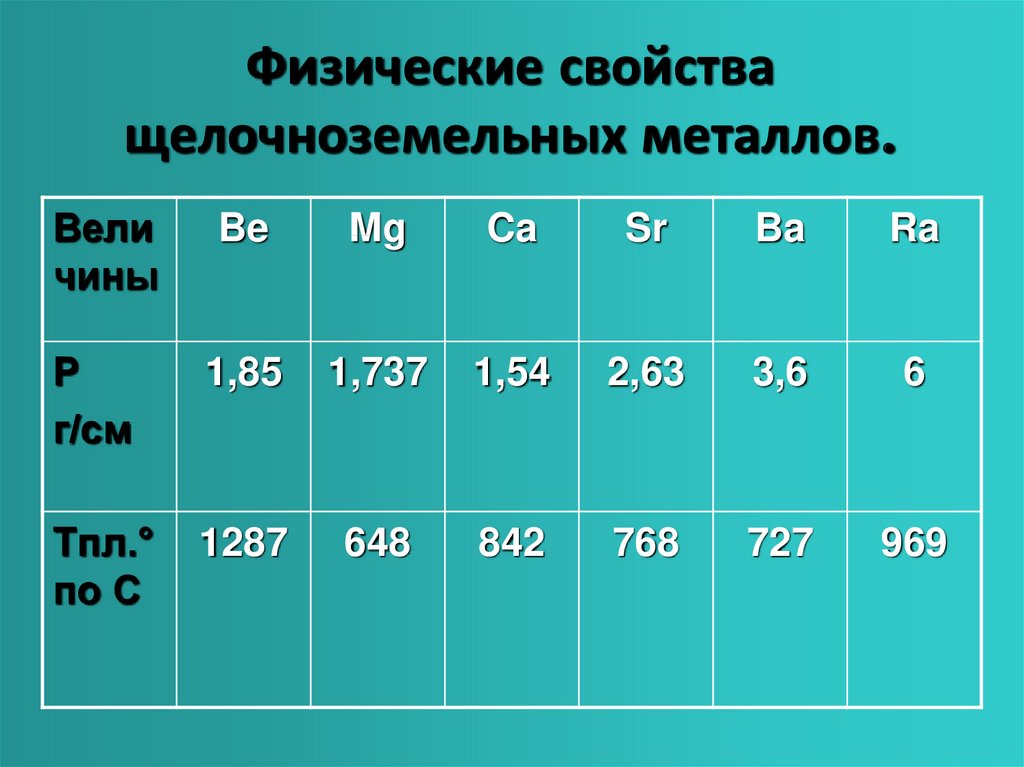
Опыт 3 . Взаимодействие раствора сульфата меди (II) с литием.
Возьмем для первого эксперимента щелочной металл литий и поместим его небольшой кусочек в раствор соли сульфата меди (II)
В ходе эксперимента наблюдаем, что на поверхности раствора соли протекает энергичная реакция, сопровождающаяся выделением пузырьков газа. Одновременно, идёт образование осадка сначала голубого цвета, который сразу превращается в осадок черного цвета.
Если к пробирке с выделяющимся газом поднести горящую лучинку раздаётся характерный хлопок. Так сгорает газ водород.
Признак реакции – выделение газа, образование черного осадка
Схема: CuSO4 (раствор) + Li → h3↑ + осадок чёрного цвета
Проблемная ситуация
Почему при взаимодействии лития с раствором сульфата меди(II) образуется чёрный осадок?
Давайте рассуждать. Если бы литий вступил в реакцию замещения с сульфатом меди (II), мы наблюдали бы, как и в первом опыте, образование меди в виде красного налёта. Но мы этого не увидели. Следовательно, что можно предположить?
Но мы этого не увидели. Следовательно, что можно предположить?
Гипотеза:
Щелочной металл литий вступает в реакцию не с солью, а с водой.
Рассуждаем дальше. В ходе опыта наблюдается выделение газа, который сгорает с характерным звуком. Этот газ водород. Выделение водорода возможно при взаимодействии щелочного металла лития с водой.
Щелочной металл активно взаимодействует с водой, образуя щелочь гидроксил лития и водород. Эта реакция экзотермична и сопровождается выделением большого количества теплоты.
2 Li + 2h3O = 2LiOH + h3 ↑+ Q t = 70 º
Образующийся в ходе реакции гидроксид лития не дает осадка, так как он растворимый, следовательно, на этом реакции не закончились.
Гидроксид лития вступает в реакцию с сульфатом меди (II), образуя осадок синего цвета гидроксид меди (II), но этот осадок очень быстро превращается в чёрный. Почему?
2LiОН + CuSO4 = Li2SO4 + Cu(OH)2
Разложение полученного гидроксида меди (II) (температура выше 50°С): Cu(OH)2 = CuO + h3O
или в обобщенном виде:
2Li + h3O + CuSO4 = Li2SO4 + h3↑ + CuO
Итог.
Уравнения последовательно протекающих реакций:
2Li + 2h3O = 2LiOH + h3↑ + Q
2LiOH + CuSO4 = Cu(OH)2 + Li2SO4
Cu(OH)2 = h3O + CuO
В обобщённом виде:
2Li+2h3O+CuSO4=CuО+h3О +h3↑+Li2SO4
Вопрос:
Будут ли щелочноземельные металлы взаимодействовать с растворами солей, так же как и щелочные?
Опыт 4. Взаимодействие раствора хлорида меди (II) с кальцием.
Рассмотрим взаимодействие щелочноземельного металла кальция с раствором хлорида меди (II)
В ходе эксперимента наблюдаем выделение пузырьков газа и образование осадка голубого цвета. Превращение голубого осадка в чёрный в данной химической реакции не наблюдается.
Уравнения последовательно протекающих реакций:
Са + 2h3O = Са(OH) 2 + h3↑
Са(OH) 2 + CuCl2= Cu(OH)2 + СаCl2
В обобщённом виде:
Са(OH) 2 + 2h3O+CuCl2=CuCl2 +h3↑+ Cu(OH)2
Вопрос.
Почему при взаимодействии щелочных металлов с растворами солей гидроксид меди (II) разлагается до оксида меди (II), а с щелочноземельными металлами такого не происходит?
Ответ. Дело в том, что кальций менее активный металл, чем литий и его теплоты гидратации недостаточно для разложения гидроксида меди (II).
Дело в том, что кальций менее активный металл, чем литий и его теплоты гидратации недостаточно для разложения гидроксида меди (II).
Вопрос: В чём отличие в свойствах щелочных и щелочноземельных металлов при взаимодействии их с растворами солей от других металлов?
Обобщение и выводы:
Щелочные и щелочноземельные металлы не вытесняют менее активные металлы из растворов солей, а протекают более сложные химические процессы с участием воды.
Вопрос: возможно ли вытеснение активным металлом менее активного из его соли?
Реакцию вытеснения более активным металлом менее активного (стоящего правее) из его соли для этих металлов можно осуществить только в расплаве соли, поскольку с водой они непосредственно и активно взаимодействуют
2 Na+ ZnCl2 → Zn + 2NaCl
сплавление
Задание на дом:
Составьте уравнения реакций между: литием и раствором хлорида магния
Составьте уравнения реакций между: литием и раствором хлорида железа (III)
Учитель. Сегодняшнее занятие я хотела бы закончить следующими словами:
Сегодняшнее занятие я хотела бы закончить следующими словами:
Человек рождается на свет,
Чтоб творить, дерзать – и не иначе.
Чтоб оставить в жизни добрый след
И решить все трудные задачи.
Человек рождается на свет…
Для чего? Ищите свой ответ!
Далее учитель оценивает работу групп и отдельных учащихся.
Подведение итогов урока.
Биологическое значение щелочных и щелочноземельных металлов
Элементы расположены в периодической таблице по строкам и столбцам в соответствии со сходством их химических и физических свойств. Элементы в первой колонке известны как элементы группы 1 , в состав которых входят следующие элементы: литий, натрий, калий, рубидий, цезий и франций. Все эти элементы имеют схожие свойства, кроме лития, поэтому все элементы этой группы, включая литий (хотя у него разные свойства), известны как 9.0003 Щелочные металлы .
Элементы во второй колонке известны как Элементы группы 2 , в состав которых входят следующие элементы: бериллий, магний, кальций, стронций, барий и радий. Все эти элементы имеют схожие свойства, кроме бериллия, поэтому все элементы этой группы, кроме бериллия, известны как щелочноземельные металлы .
Все эти элементы имеют схожие свойства, кроме бериллия, поэтому все элементы этой группы, кроме бериллия, известны как щелочноземельные металлы .
- Атомные радиусы: двигаться сверху вниз. Следовательно, атомные радиусы щелочных металлов увеличиваются вниз по колонке от лития до франция.
- Энергия ионизации: Энергия ионизации или энтальпия ионизации — это минимальное количество энергии, необходимое для удаления электронов из энергетических оболочек атома. Щелочные металлы обладают низкими энергиями ионизации, так как атомы щелочных металлов имеют большие размеры, из-за которых заряд ядра атома может быть перевесить, так что вырвать электрон из энергетической оболочки затруднительно. Тенденция энергий ионизации противоположна атомным радиусам, поэтому энергии ионизации уменьшаются по мере продвижения вниз по группе.
- Электроотрицательность: Всякий раз, когда атом элемента образует связь с атомом другого элемента, используя общие электронные пары, каждый атом пытается притянуть к себе общую электронную пару, это имеет тенденцию притягивать общую электронную пару, что известно как электроотрицательность.
 . Электроотрицательность щелочных металлов уменьшается вниз по группе.
. Электроотрицательность щелочных металлов уменьшается вниз по группе. - Энергия гидратации: Энергия гидратации – это количество энергии, выделяемой при гидратации одного моля ионов. Энергия гидратации щелочных металлов следует противоположной тенденции, поскольку энергия гидратации ионов означает, что энтальпия гидратации ионов уменьшается вниз по группе по мере увеличения размера атома.
LI + > NA + > K + > RB + > CS +
Физические свойства Alkali Metals:
9002 9003 .Использование щелочных металлов:
- Литий используется для изготовления различных типов сплавов, один из которых известен как белый металл.

- Литий также используется для хранения энергии в электрохимических элементах.
- В фотоэлементах цезий используется в качестве электрода.
- Калий в основном используется в удобрениях, инсектицидах и пестицидах.
- Натрий, особенно жидкий натрий, может использоваться в ядерных реакторах в качестве теплоносителя .
Щелочные металлы легко реагируют с воздухом и водой, поэтому во избежание какой-либо реакции эти металлы следует хранить под каким-либо маслом. Все щелочные металлы играют очень важную роль в существовании и поддержании жизненного цикла. Давайте посмотрим на биологическую важность всех щелочных металлов один за другим.
- Биологическое значение лития: литий важен для человека, так как его высокая концентрация оказывает токсическое действие, он естественным образом встречается в почве и, следовательно, включается в пищевую цепь, что говорит о биологическом значении, поэтому он обладает антиоксидантным действием и используется во многих лекарствах.
 используется для лечения депрессии и тревожных расстройств использует соединения лития. Хлорид лития используется для лечения гипертонии.
используется для лечения депрессии и тревожных расстройств использует соединения лития. Хлорид лития используется для лечения гипертонии. - Биологическое значение натрия: Натрий играет очень важную роль в балансировке воды в организме человека, ионы натрия используются для передачи нервных импульсов, эти ионы натрия также отвечают за сокращение и расслабление мышц. Достаточное количество натрия в организме помогает предотвратить различные нарушения организма, такие как почечная недостаточность, сердечная недостаточность и т. д.
- Биологическое значение калия: Калий очень важен, так как он поддерживает осмотическое давление между клетками и интерстициальной жидкостью, он используется для лечат многие заболевания, такие как гипокалиемия, слабость мышц, сердечные заболевания и т. д. Ионы калия помогают питательным веществам пищи перемещаться внутри клеток и выводить продукты жизнедеятельности из клеток.
- Биологическое значение рубидия: рубидий способствует стимуляции метаболизма.
 Некоторые изотопы рубидия используются при лечении тяжелых сердечных заболеваний. Ионы рубидия также присутствуют в мышцах.
Некоторые изотопы рубидия используются при лечении тяжелых сердечных заболеваний. Ионы рубидия также присутствуют в мышцах. - Биологическое значение цезия: Химические свойства цезия в основном аналогичны свойствам калия, поэтому в организме цезий может заменить калий, который очень вреден, поэтому люди в основном избегают ионов цезия.
- Биологическое значение франция: На самом деле франций не играет никакой биологической роли как таковой.
- Атомные радиусы: двигаться сверху вниз. Следовательно, атомные радиусы щелочноземельных металлов увеличиваются вниз по столбцу, также по сравнению с щелочными металлами размер щелочноземельных металлов меньше, потому что заряд ядра этих элементов больше, чем у щелочных металлов.
Be< Mg< Ca< Sr< Ba< Ra
- Энергия ионизации: Энергия ионизации или энтальпия ионизации — это минимальное количество энергии, необходимое для удаления электронов из энергетических оболочек атома.
 Щелочноземельные металлы имеют низкие энергии ионизации, так как атомы щелочноземельных металлов имеют большие размеры, из-за которых трудно вынести электроны из энергетической оболочки. Тенденция энергий ионизации противоположна атомным радиусам, поэтому энергии ионизации уменьшаются по мере продвижения вниз по группе.
Щелочноземельные металлы имеют низкие энергии ионизации, так как атомы щелочноземельных металлов имеют большие размеры, из-за которых трудно вынести электроны из энергетической оболочки. Тенденция энергий ионизации противоположна атомным радиусам, поэтому энергии ионизации уменьшаются по мере продвижения вниз по группе.
Be> Mg> Ca> Sr> Ba> Ra
- Электроотрицательность: Всякий раз, когда атом элемента образует связь с атомом другого элемента, используя общие электронные пары, каждый атом пытается притянуть общие электронная пара к себе, это имеет тенденцию притягивать общую пару электронов, известное как электроотрицательность. Электроотрицательность щелочноземельных металлов уменьшается вниз по группе.
Be> Mg> Ca> Sr> Ba> Ra
- Энергия гидратации: Энергия гидратации – это количество энергии, выделяемой при гидратации одного моля ионов. Энергия гидратации щелочноземельных металлов следует противоположной тенденции, так как размер атома означает, что энтальпия гидратации ионов уменьшается вниз по группе по мере увеличения размера атома.

Be> Mg> Ca> Sr> Ba> Ra
Физические свойства щелочноземельных металлов:
- Внешний вид щелочноземельных металлов серебристо-белый.
- Это мягкие металлы.
- Они имеют более высокую температуру кипения, чем щелочные металлы.
- Эти элементы могут быть испытаны пламенем, так как они окрашиваются в разные цвета при воздействии пламени.
- Эти металлы могут проводить электричество.
- Щелочноземельные металлы обладают высокой электроположительностью, поэтому их природа является электроположительной.
- Среди щелочноземельных металлов магний не дает окраски при воздействии пламени.
- Щелочноземельные металлы являются хорошими проводниками тепла.
- Плотность щелочноземельных металлов выше, чем у щелочных металлов.
- Среди щелочноземельных металлов плотность кальция самая низкая.
- Эти металлы растворимы в воде.
Использование щелочноземельных металлов:
- Магний используется для изготовления различных типов сплавов.

- Магний также используется в лекарствах для приема антацидов.
- Радий используется для лечения рака.
- Кальций используется для извлечения различных элементов.
- Барий используется для удаления воздуха из вакуумных трубок.
- Кальций используется для производства карбоната кальция, который используется для производства различных продуктов, таких как мел, мрамор, известняк и т. д.
- Щелочноземельные металлы выделяют газообразный водород при взаимодействии с кислотами, этот газообразный водород можно использовать для других целей.
- Щелочноземельные металлы используются в производстве электрохимических и фотоэлектрических элементов.
- Сплавы магния используются в производстве самолетов и истребителей.
- Гипс также состоит из кальция и используется в отделке, дизайне и огнезащите.
Щелочноземельные металлы имеют большое значение как для жизни животных, так и для жизни растений, эти элементы играют более чем одну роль в химических и биологических процессах. Давайте посмотрим на биологическую важность всех щелочноземельных металлов один за другим.
Давайте посмотрим на биологическую важность всех щелочноземельных металлов один за другим.
- Биологическое значение бериллия: Бериллий используется в образцах крови для выявления ВИЧ и других заболеваний. Он также используется в рентгеновских экспериментах для изготовления окон излучения. Бериллиевая маммография — это метод, используемый для обнаружения опухолей и рака молочной железы.
- Биологическое значение магния: Магний участвует в синтезе белков и росте клеток. Он играет жизненно важную роль в движении мышц и кровяном давлении. Магний придает прочность костям и зубам, помогает вылечить астму и другие заболевания легких. Он также предотвращает свертывание крови.
- Биологическое значение кальция: Кальций необходим для укрепления костей, он также формирует клеточные стенки и способствует свертыванию крови в случае травм. Кальций делает тело сильным и здоровым.
- Биологическое значение стронция: Стронций в основном используется для восстановления костей, так как он способствует усвоению кальция и помогает фиксировать треснувшие или сломанные кости за счет взаимодействия кальция и стронция.

- Биологическое значение бария: барий не является биологически важным для человека, так как оказывает токсическое действие, небольшое количество раствора бария может вызвать проблемы с дыханием, а также увеличивает частоту сердечных сокращений и кровяное давление. Существует вероятность повреждения почек и сердца при употреблении бария.
- Биологическое значение радия: Радий радиоактивен, и из-за его токсичности радий не имеет большого биологического применения.
Вопрос 1: Как можно использовать цезий и калий в коммерческих целях?
Ответ:
Цезий и калий обладают особой способностью терять электроны, поглощая энергию солнечного света, когда световые лучи падают на эти элементы, что приводит к фотоэлектрическому эффекту, из-за которого цезий и калий коммерчески используются в качестве электродов в фотоэлектрические элементы.
Вопрос 2: Укажите 3 медицинских применения магния.
Ответ:
- Магний используется в лекарствах для приема антацидов.
- Оксид магния используется при лечении запоров.
- Магний также используется в качестве анестезии при введении солей магния в организм человека.
Вопрос 3: Почему литий имеет свойства, отличные от остальных членов его группы?
Ответ:
Есть две основные причины, по которым свойства лития отличаются от его членов группы:
- Размер: Атомный размер лития действительно очень мал
- Поляризационная способность: Поляризационная способность может быть определена как отношение заряд элемента к радиусу этого элемента. Литий обладает высокой поляризующей способностью, поскольку его размер очень мал, поэтому заряд, деленный на радиус, дает большое число.
Вопрос 4: Почему свойства бериллия отличаются от свойств остальных членов его группы?
Ответ:
Различие свойств бериллия и его членов в основном обусловлено двумя причинами:
- не следует тем же тенденциям, что и другие щелочноземельные металлы.
- Атомный номер: Поскольку атомный номер бериллия равен 4, его координационное число не может быть больше 4, в то время как другие члены той же группы также могут иметь координационное число 6.
Вопрос 5: Почему радий не имеет большого биологического значения?
Ответ:
Радий по своей природе радиоактивен, и из-за его токсичности радий не может быть использован в биологическом отношении. В медицине он используется только для производства газа радона, который используется при лечении рака.
Кристалл бората щелочного металла–щелочноземельного металла LiBa3(OH)(B9O16)[B(OH)4] как новый нелинейно-оптический материал для глубокого УФ-излучения
Кристалл бората щелочного металла и щелочноземельного металла LiBa
3 (OH)(B 9 O 16 )[B(OH) 4 ] в качестве нового нелинейно-оптического материала для работы в глубоком УФ-диапазоне† Чао
Ву, и Цзюньлин
Песня, и Лунхуа
Ли, 9 лет0040 с Марк Г. Хамфри д а также
Чи
Чжан* и
Хамфри д а также
Чи
Чжан* и
Принадлежности автора
* Соответствующие авторы
и Китайско-австралийский совместный исследовательский центр функциональных молекулярных материалов, Школа химической инженерии и материаловедения, Университет Цзяннань, Уси 214122, КНР
Электронная почта: [email protected]
б Китайско-австралийский совместный исследовательский центр функциональных молекулярных материалов, Школа химических наук и инженерии, Университет Тунцзи, Шанхай, 200092, КНР
 edu.cn
edu.cnв Школа химии и химического машиностроения, Университет Цзянсу, Чжэньцзян 212013, КНР
д Исследовательская школа химии, Австралийский национальный университет, Канберра, Австралия
Электронная почта: [email protected]
Аннотация
Новый нецентрозимметричный щелочный металлический металл -металлургия борат с формулой Liba 3 (OH) (B O 16 ) [B (OH) 9310 4 ) [B (OH) 7310 4 ) синтезирован удобным гидротермальным методом. Структура имеет трехмерный цеолитоподобный каркас и состоит из [B 9 O 19 (OH)] 12− первичная строительная единица с 6-членными кольцевыми каналами вдоль оси c . Катионы Ba и анионы [B(OH) 4 ] − инкапсулированы в шестичленные кольцевые каналы, а катионы Li располагаются между двумя соседними 19 (OH)] 12− кластеров. Измерения генерации второй гармоники (ГВГ) показывают, что LiBa 3 (OH)(B 9 O 16 )[B(OH) 4 ] является фазовым согласованием типа I, с реакцией ГВГ ок. В 1,2 раза больше, чем KH 2 PO 4 . Кроме того, он демонстрирует широкий диапазон прозрачности с коротким краем УФ-отсечки (<200 нм), что позволяет предположить, что LiBa 3 (OH)(B 9 O 16 )[B (OH) 4 ] представляет собой нелинейно-оптический материал с потенциалом глубокого УФ-излучения.
Структура имеет трехмерный цеолитоподобный каркас и состоит из [B 9 O 19 (OH)] 12− первичная строительная единица с 6-членными кольцевыми каналами вдоль оси c . Катионы Ba и анионы [B(OH) 4 ] − инкапсулированы в шестичленные кольцевые каналы, а катионы Li располагаются между двумя соседними 19 (OH)] 12− кластеров. Измерения генерации второй гармоники (ГВГ) показывают, что LiBa 3 (OH)(B 9 O 16 )[B(OH) 4 ] является фазовым согласованием типа I, с реакцией ГВГ ок. В 1,2 раза больше, чем KH 2 PO 4 . Кроме того, он демонстрирует широкий диапазон прозрачности с коротким краем УФ-отсечки (<200 нм), что позволяет предположить, что LiBa 3 (OH)(B 9 O 16 )[B (OH) 4 ] представляет собой нелинейно-оптический материал с потенциалом глубокого УФ-излучения.

 пл.,
С
пл.,
С . Электроотрицательность щелочных металлов уменьшается вниз по группе.
. Электроотрицательность щелочных металлов уменьшается вниз по группе.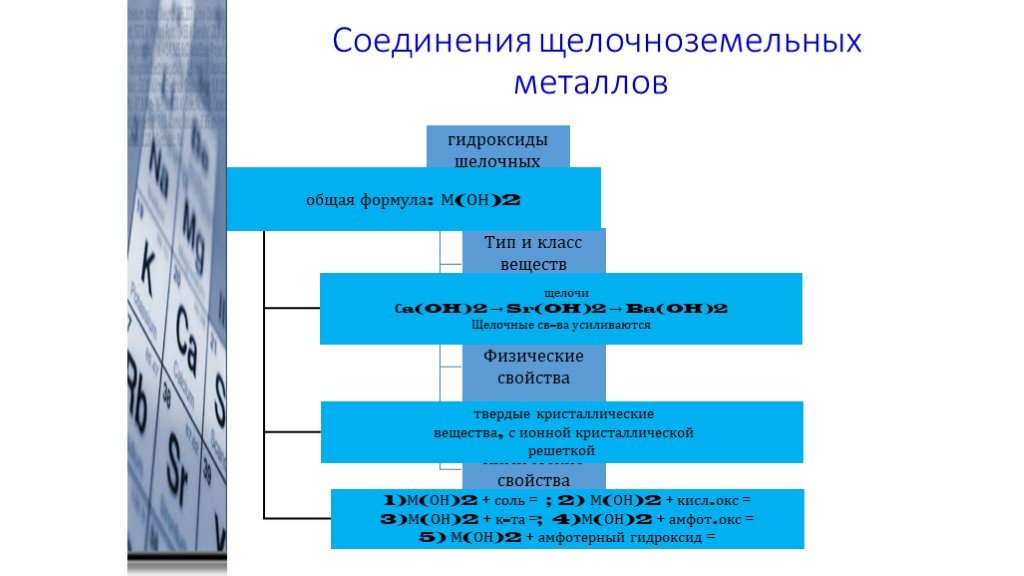
 используется для лечения депрессии и тревожных расстройств использует соединения лития. Хлорид лития используется для лечения гипертонии.
используется для лечения депрессии и тревожных расстройств использует соединения лития. Хлорид лития используется для лечения гипертонии. Некоторые изотопы рубидия используются при лечении тяжелых сердечных заболеваний. Ионы рубидия также присутствуют в мышцах.
Некоторые изотопы рубидия используются при лечении тяжелых сердечных заболеваний. Ионы рубидия также присутствуют в мышцах. Щелочноземельные металлы имеют низкие энергии ионизации, так как атомы щелочноземельных металлов имеют большие размеры, из-за которых трудно вынести электроны из энергетической оболочки. Тенденция энергий ионизации противоположна атомным радиусам, поэтому энергии ионизации уменьшаются по мере продвижения вниз по группе.
Щелочноземельные металлы имеют низкие энергии ионизации, так как атомы щелочноземельных металлов имеют большие размеры, из-за которых трудно вынести электроны из энергетической оболочки. Тенденция энергий ионизации противоположна атомным радиусам, поэтому энергии ионизации уменьшаются по мере продвижения вниз по группе.


