| Тема урока: Бериллий, магний и щелочноземельные металлы. Цель урока: Дать общую характеристику щелочноземельным металлам в свете общего, особенного и единичного по трем формам существования химических элементов: атомов, простых веществ и сложных веществ. Задачи урока:
Оборудование и реактивы: кальций, вода, фенолфталеиновый, пинцет, нож, пробирки. 2. Работа по новой теме. Слайд 4: Атомы этих элементов лишь немного меньше по размерам, чем атомы соответствующих щелочных металлов, а в связи с этим металлы главной подгруппы 2 группы по химической активности и другим свойствам должны быть с ними сходны. Слайд 6: Бериллий, магний и щелочноземельные металлы – как простые вещества. Бериллий. Слайд 7: Магний Слайд 8: Кальций Слайд 9: Стронций Слайд 10: Барий Слайд 11: Радий Слайд 12: Плотность их увеличивается от бериллия к барию, а температура плавления наоборот, уменьшается. Слайд 14: Взаимодействие металлов с кислородом воздуха. Щелочноземельные металлы взаимодействуют с кислородом воздуха, покрываясь пленкой оксида (исключение барий, смесь оксида и пероксида), поэтому их хранят под слоем керосина или в запаянных ампулах. Слайд 15: Взаимодействие с неметаллами. Реакция идет как правило при нагревании. Взаимодействие металлов с водой. Из всех металлов главной подгруппы 2 группы только бериллий не взаимодействует с водой (препятствует защитная пленка на его поверхности), магний реагирует с ней медленно, остальные металлы – бурно. Демонстрация опыта: Взаимодействие кальция с водой. Пишем уравнение реакции: Ca + 2 HOH = Ca (OH)2 + H2 Гашеная известь Вспомним реакцию взаимодействие щелочных металлов с водой. Происхождение название щелочноземельные металлы связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли». Слайд 16: Учащиеся выполняют задание №2 Оксиды этих металлов – твердые, белые, тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства, кроме бериллия, имеющего амфотерный характер Слайд 18: Взаимодействие оксидов с водой. Оксид магния малоактивен в реакции с водой, все остальные оксиды очень бурно с ней взаимодействуют. При этом выделяется значительное количество энергии. Поэтому, реакция оксида кальция с водой называется гашением извести, а образующийся гидроксид кальция – гашеной известью. Получают оксиды обжигом карбонатов: Негашеная известь Жженая магнезия Так как многие соли щелочноземельных металлов нерастворимы, то реакция нейтрализации может сопровождаться выделением осадка. Слайд 20: Соли. Слайд 21: Учащиеся выполняют задания № 3, № 4, № 5. Слайд 22: Карбонат кальция. Одно из самых распространенных соединений на Земле. Хорошо известны такие содержащие его минералы, как мел, мрамор, известняк. Самый важный из этих минералов – известняк. Без него не обходится ни одно строительство. Известняк – сырьё для получения цемента, гашеной и негашеной извести, стекла и дл. Природный мел представляет собой остатки раковин древних животных. Один из примеров его использования вы хорошо знаете – это школьный мел, зубные пасты. Мел применяют в производстве бумаги, резины, а также для побелки. Мрамор – это минерал скульпторов, архитекторов и облицовщиков. Слайд 23: ОАО «Тургоякское рудоуправление» Производит известняк флюсовый. Наиболее крупные месторождения мрамора на территории области – это Коелгинское (Еткульский район), Баландинское (Сосновский район), Уфалейское (район г. Слайд 24: Практическое применение карбоната магния. Слайд 25: Практическое применение сульфата магния. Слайд 26: Практическое применение фосфата кальция. Слайд 27: Практическое применение сульфата бария. Слайд 28: Подведение итогов урока. Работы учащиеся сдают преподавателю на проверку. Оценка результатов на следующем уроке. Слайд 29: Домашнее задание. Задания по теме: «Бериллий, магний и щелочноземельные металлы» ***** а) Mg + S = ……… 3.Установите признак, объединяющий указанные объекты: 4.Можно ли кусочки щелочноземельного металла для опыта брать руками: а) да, можно б) нет, эти металлы взаимодействуют с водой кожи рук, что может вызвать ожог в) нет, т.к. это не гигиенично, металл может быть загрязнен г) нет, т.к. щелочноземельные металлы имеют низкую температуру плавления и в руках могут расплавиться 5.Растворение оксида кальция в воде может сопровождаться: а) кипением и разбрызгиванием смеси б) происходит спокойно в) раздражением верхних дыхательных путей г) общим отравлением Задания по теме: «Бериллий, магний и щелочноземельные металлы». *** Ф.И учащихся__________________________класс_______ 2.Вставьте пропущенные формулы веществ в уравнения реакций. Назовите продукты реакции: а) Са + …. = CaS Не забудьте уравнять!
А.  CaS CaSБ. MgO В. CaO Г. Ca (OH)2 Д. BaCl2 4.Можно ли кусочки щелочноземельного металла для опыта брать руками: а) да, можно б) нет, эти металлы взаимодействуют с водой кожи рук, что может вызвать ожог в) нет, т.к. это не гигиенично, металл может быть загрязнен г) нет, т.к. щелочноземельные металлы имеют низкую температуру плавления и в руках могут расплавиться 5.Растворение оксида кальция в воде может сопровождаться: а) кипением и разбрызгиванием смеси б) происходит спокойно в) раздражением верхних дыхательных путей г) общим отравлением *** — для «слабых» учеников Работа предполагается в группах по 2 человека. Технологическая карта урока «Бериллий, магний и щелочноземельные металлы».
Список литературы
Интернет-ресурсы:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Магний и щелочноземельные металлы
ХИМИЯ | КЛАСС 9 | № РАЗДЕЛА | № УРОКА | ДАТА |
Магний и щелочноземельные металлы.
Цель. Дать общую характеристику металлов главной подгруппы II группы.
Задачи.
Образовательные: дать общую характеристику металлов главной подгруппы II группы; рассмотреть основные физические и химические свойства этих элементов.
Развивающие: продолжить формирование устойчивого интереса к химической науке и практике, положительных мотивов учения, развивать логическое мышление и интеллектуальные умения (анализировать, сравнивать, устанавливать причинно-следственные связи, делать выводы), внимательность, самостоятельность при выполнении заданий; совершенствовать умения составления уравнений химических реакций.
Воспитательные: воспитывать интерес к химии как науке, сознательное отношение к химическим знаниям
Планируемые результаты
Знают: ЩЗМе ,основные физические и химические свойства этих элементов.
Умеют: дают общую характеристику металлов главной подгруппы II группы; составлять уравнения химических реакций., сравнивать св-ва Щ и ЩЗМе, обьяснять сходсто и различие в химических св-вах этих Ме
Тип урока: изучения нового материала
Формы работы: фронтальная, индивидуальная, самостоятельная
Методы обучения:Частично-поисковый; беседа
Ход урока.
1. Организационный момент.
2. Актуализация опорных знаний Повторение изученного материала
Письменный опрос.
Базовый уровень.
Вставьте пропущенные формулы, подпишите названия сложных веществ
Для слабых учеников. | РЕШЕНИЕ |
2K + ?→2KH 2K + ?→ 2KCl 2K + S → ? 2K + 2H2 O→ ?+ H2 2K +2 HCl→?+ ? ? + HCl→ KCl + ? | 2K + H2 →2KH 1. 2K +Cl2→2KCl 2. 3. 2K + 2H2 O→ 2KOH+ H2 4. 2K +2 HCl→2KCl+ H2 5. 2K +2 HCl→2KCl+ H2 |
Повышенный уровень.
1. Взаимодействие металла калия с водой относится к реакциям: а) замещения в) обмена б) соединенияг) разложения
2. С оксидом лития взаимодействуют вещества, формулы которых: 1) NaCl 2) SO3 3) HCl 4) NaOH 5) CuO а) 1,2 в)2, 4 б) 2,3 г) 2, 5
3. С образованием соли с оксидом калия взаимодействует вещество, формула которого:
а) H2O в)P2O5 б) CuO г)CaO
4. С раствором гидроксида калия не реагирует вещество, формула которого:
а) P2O5 в)H3PO4 б) SO2 г)Na
5. При взаимодействии раствора гидроксида лития с оксидом азота (V)
образуются вещества, формулы которых: а)
Li2O, NO,
H2O
в) LiNO3, H2O б) LiNO2, O2,
H2O г)
LiNO2, O2,
H2
При взаимодействии раствора гидроксида лития с оксидом азота (V)
образуются вещества, формулы которых: а)
Li2O, NO,
H2O
в) LiNO3, H2O б) LiNO2, O2,
H2O г)
LiNO2, O2,
H2
6. Осуществить превращения Na Na2O2 Na2O NaOH Na2SO4
3Актуализация новых знаний Изучение новой темы.
бериллий | 9 | 2s2 | +2 | )) | ||
Магний | 24 | 3s2 | +2 | ))) | ||
Кальций | 40 | 4s2 | +2 | )))) | ||
Стронций | 88 | 5s2 | +2 | ))))) | ||
Барий | 137 | 6s2 | +2 | )))))) | ||
Радий | [226] | 7s2 | +2 | ))))))) |
1. К
щелочноземельным металлам относят : Ca, Sr, Ba, Ra
К
щелочноземельным металлам относят : Ca, Sr, Ba, Ra
Ве — амфотерный металл, Mg – металл, Сa, Sr,Ba — щёлочноземельные металлы Ra –радиоактивный элемент
— Общим является одинаковое строение внешнего электронного слоя
— Элементы проявляют СО +2
— Атомы элементов являются сильными восстановителями, т.к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами.
— С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.
— Mg хранится на воздухе, ЩЗМ под слоем керосина.
Физкультминутка
2.Беседа по вопросам:
?— Что общего в строении атомов ЩМ?
— Как меняются восстановительные свойства ЩМ в группе?
— Почему ЩМ хранят под слоем керосина?
— Перечислить физические свойства ЩМ.
— Как получают ЩМ?
— Перечислить основные химические свойства ЩМ.
— Какой характер имеют оксиды ЩМ?
— В какой цвет окрашиваю пламя соли лития, натрия, калия?
Объяснение учителя: казалось, все эти элементы находятся в одной группе, в главной подгруппе, но по какой-то причине магний и бериллий к группе щелочноземельных металлов (ЩЗМ) не относят?! Оказывается, если магний по свойства во многом тяготеет к ЩЗМ, то бериллий стоит как бы особняком. По свойствам он ближе к алюминию, расположенному по диаганали от него в III группе. По какой причине не относят к ЩЗМ магний мы узнаем сегодня чуть позже.
2. Физические свойства.
Ве, Мg, Са, Ва – легкие, серебристо-белые металлы, Sr – золотистый оттенок
Характерный металлический блеск
Ве – твердый, хрупкий светло-серый
Мg – относительно мягкий, пластичный ковкий
Са – твердый, пластичный
Sr — ковкий
Ва – пластичный, ковкий.
Ra – радиоактивный элемент.
Бериллий – встречается в природе в виде минералов: берилла, хризоберилла и их разновидностей: изумруда, аквамарина, александрита – известных как драгоценные камни.
Бериллий и его растворимые в воде соединения высокотоксичны (ядовиты). Даже ничтожно малая примесь его в воздухе приводит к тяжёлым заболеваниям. Он находит широкое применение в технике. Добавляя к меди он сильно повышает её твёрдость, прочность, химическую стойкость, делает похожей на сталь. Основной потребитель бериллия – атомная энергетика. Потребность в нём с каждым годом растёт.
Магний был
впервые получен Деви в 1808 году из белой магнезии (магнезит MqCO3) –
минерала найденного близ греческого города Магнезия. По названию
минерала и дали название простому веществу и химическому элементу. Сульфат
магния (одна из распространённых солей магния) называют ещё горькой солью – она
придаёт морской воде горьковатый вкус. Данная соль магния используется в
качестве слабительного средства.
-?Как вы думаете почему остальные металлы этой группы, главной подгруппы названы ЩЗМ?
Так они именуются по той причине, что их гидроксиды, подобно гидроксидам ЩМ растворимы в воде, то есть являются щелочами.
«Земельными они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде оксидов имеют землистый вид…» — Д.И.Менделеев.
Кальций занимает пятое место по распространённости. Так же впервые получен Деви в 1808 году. Название элемента происходит от латинского слова «кальс», что значит, «известь, мягкий камень». Встречается в виде гипса, кальцита (Кальцит образует залежи мела, мрамора, известняка.
?-Подумайте из чего кальцит формируется?
Поэтому неудивительно, что иногда в
известняках находят ракушки или отпечатки животных.
?-Где он применяется? (гипсовые слепки, карнизы, лепнина, штукатурка потолков, в хирургии, бумажная промышленность).
Стронций встречается реже в виде минерала целестина, что с латинского означает «небесный» — сульфат стронция, образован розово-красными, бледно-голубыми кристаллами. Своё название он (стронций) получил от названия шотландской деревни Стронциан, близ которой в конце XVIII века найден редкий минерал стронцианит SrCO3.
Барий встречается в виде барита BaSO4 («барис»- тяжёлый с латинского). Показ образца бария с помощью фотофрагмента компьютерного диска «Самоучитель – химия». Применяется для изготовления радиоламп, в кожевенном деле (для удаления шерсти), в сахарном производстве, для приготовления фотобумаги, выплавке специальных окон.
ЗАДАНИЕ 4..Установите соответствие.
С увеличением порядкового номера элемента в главной подгруппе II группы Периодической системы свойства элементов и образуемых ими веществ изменяются следующим образом:
СВОЙСТВА ИЗМЕНЕНИЯ
А) усиливаются Б) не изменяется В) уменьшается Г) увеличивается | 1) восстановительные свойства 2) радиус атома 3) электроотрицательность 4) число электронов на внешнем уровне
|
ФИЗКУЛЬТМИНУТКА
5. .
Химические свойства элементов II группы главной подгруппы
.
Химические свойства элементов II группы главной подгруппы
Химические свойства элементов II группы главной подгруппы
1.С кислородом | 2Mе+O2=2MO (оксид) |
2.С галогенами | Mе+Cl2=MCl2 (хлорид |
3.С серой | Mе+S=MS (сульфид) |
4.С азотом | 3Mе+N2=M3N2 (нитрид) |
5.С водородом | Mе+H2=MH2 (гидрид) |
6.С водой | Mе+2H2O=M(OH)2+H2 Ca + H2Oà Ca (OH)2 + H2 Вывод . Мg + H2O = MgO + H2 Вывод. Магний вытесняет из воды водород только при нагревании. Менее активен, чем кальций, поскольку в группе стоит выше. |
-? Взаимодействуют ли магний и кальций с кислотами?
| Mg +2HCl = MgCl2 +H2 Вывод. Магний взаимодействует с кислотами, вытесняя водород, а кальций взаимодействует с водой, которая содержится в растворе кислоты. |
7. Mg,Са способны восстанавливать редкие металлы.) | 2Mg + TiO2 = 2MgO +Ti – магниетермия 5Ca + V2O5 = 5CaO +2V- кальциетермия |
.
4 Закрепление.
- Впишите знак <, > или = вместо *:
а) заряд ядра: Ca * Mg, Be * Ba, Mg * Al, Ca *K
б) число электронных слоев: Ca * Mg, Be * Ba, Mg * Al, Ca *K
в) число электронов на внешнем уровне: Ca * Mg, Be * Ba, Mg * Al, Ca *K
г) радиус атома: Ca * Mg , Be * Ba, Mg * Al, Ca *K
д) восстановительные свойства: Ca * Mg, Be * Ba , Mg * Al, Ca *K
2. Вставьте недостающую информацию.
Са + …. = 2СаО … + … = Be3N2
Mg + … = MgSO4 + … …+ Cl2 = SrCl2
3. Крестики — нолики. Металлы, вступающие в реакцию с водой
Cu | Al | Mn |
Са | Zn | Mg |
Ag | Hg | Pt |
:РЕФЛЕКСИЯ
5. Домашнее
задание. П 44 , конспект, *заполнить таблицу **решить
задачу
Домашнее
задание. П 44 , конспект, *заполнить таблицу **решить
задачу
***Творческое задание: составить кроссворд
1. кроссворд по теме: «Щелочноземельные металлы, бериллий и магний».
ПО ГОРИЗОНТАЛИ:
1.Минерал, содержащий карбонат кальция; является важным строительным материалом.
7. Минерал, образующийся из остатков раковин древних животных.
8. Mg + N2 = … .
ПО ВЕРТИКАЛИ:
2. CaSO4 * 2h3 O
3. Mg + …. = Mgh3
4. Группа металлов, в которую входит кальций, барий, стронций, радий.
5. Щелочноземельный металл.
6. …+ Н2О=Са(ОН)2 +Н2
9. Степень окисления магния в соединениях.
**Решить задачу
Дано: m(Na)=11,5г ω (примеси) = 2% ŋпр (Н2) = 95% . V(Н2)пр. | 1. Решение задач №2 Решение: 0,5 моль 0,25моль 2Na + 2Н2О = 2NaOH + Н2↑ 2 моль 1 моль М(Na) = 23г/моль 1. Вычислим массу чистого вещества: ω (Na) = 100% — 2% = 98% m(Naчист) = m(Na) · ω (Na) = 11,5 · 0,98 = 11,27г 2. Найдем количество вещества натрия: n (Na) = m(Na)/ М(Na) = 11,27/23 = 0,49 моль = 0,5 моль 3. n(Н2) = 0,25 моль 4. V(Н2) теор = n(Н2) · Vm = 0,25 · 22,4 = 5,6л 5. V(Н2)пр = V(Н2) теор · ŋ (Н2) = 5,6 · 0,95 = 5,32л Ответ: V(Н2)пр = 5,32л
|
*2. Заполните таблицу «Характеристика элементов главной подгруппы
2 группы ПСХЭ Д. И. Менделеева».
И. Менделеева».
Название и символ элемента | Состав ядра атома | Строение электронной оболочки | Характерные степени окисления | Формула и характер оксида | Формула и характер гидроксида |
Бериллий | |||||
Магний | |||||
Кальций |
ПРИЛОЖЕНИЕ К УРОКУ ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
Письменный
опрос.
Базовый уровень.
Вставьте пропущенные формулы, подпишите названия сложных веществ
Для слабых учеников. | РЕШЕНИЕ |
2K + ?→2KH 2K + ?→ 2KCl 2K + S → ? 2K + 2H2 O→ ?+ H2 2K +2 HCl→?+ ? ? + HCl→ KCl + ? | 2K + H2 →2KH 6. 2K +Cl2→2KCl 7. 2K + S → K2S 8. 2K + 2H2 O→ 2KOH+ H2 9. 2K +2 HCl→2KCl+ H2 10. |
Повышенный уровень.
2. Взаимодействие металла калия с водой относится к реакциям: а) замещения в) обмена б) соединенияг) разложения
3. С оксидом лития взаимодействуют вещества, формулы которых: 1) NaCl 2) SO3 3) HCl 4) NaOH 5) CuO а) 1,2 в)2, 4 б) 2,3 г) 2, 5
4. С образованием соли с оксидом калия взаимодействует вещество, формула которого:
а) H2O в)P2O5 б) CuO г)CaO
5. С раствором гидроксида калия не реагирует вещество, формула которого:
а) P2O5 в)H3PO4 б) SO2 г)Na
7. При взаимодействии раствора гидроксида лития с оксидом азота (V)
образуются вещества, формулы которых: а)
Li2O, NO,
H2O
в) LiNO3, H2O б) LiNO2, O2,
H2O г)
LiNO2, O2,
H2
При взаимодействии раствора гидроксида лития с оксидом азота (V)
образуются вещества, формулы которых: а)
Li2O, NO,
H2O
в) LiNO3, H2O б) LiNO2, O2,
H2O г)
LiNO2, O2,
H2
3.Установите соответствие.
С увеличением порядкового номера элемента в главной подгруппе II группы Периодической системы свойства элементов и образуемых ими веществ изменяются следующим образом:
СВОЙСТВА ИЗМЕНЕНИЯ
А) усиливаются Б) не изменяется В) уменьшается Г) увеличивается | 1) восстановительные свойства 2) радиус атома 3) электроотрицательность 4) число электронов на внешнем уровне
|
Закрепление 4. Впишите знак <, > или = вместо *:
а) зарядядра: Ca * Mg, Be * Ba, Mg * Al, Ca *K
б) число электронных слоев: Ca * Mg, Be * Ba, Mg * Al, Ca *K
в) число электронов на внешнем уровне: Ca * Mg, Be * Ba, Mg * Al, Ca *K
г) радиусатома: Ca * Mg, Be * Ba, Mg * Al, Ca *K
д) восстановительные свойства: Ca * Mg, Be * Ba, Mg * Al, Ca *K
5. При
взаимодействии раствора гидроксида лития с оксидом азота (V) образуются
вещества, формулы которых: а) Li2O,
NO, H2O
в) LiNO3, H2O
б) LiNO2, O2,
H2O
г) LiNO2, O2,
H2
При
взаимодействии раствора гидроксида лития с оксидом азота (V) образуются
вещества, формулы которых: а) Li2O,
NO, H2O
в) LiNO3, H2O
б) LiNO2, O2,
H2O
г) LiNO2, O2,
H2
4.Впишите знак <, > или = вместо *:
а) зарядядра: Ca * Mg, Be * Ba, Mg * Al, Ca *K
б) число электронных слоев: Ca * Mg, Be * Ba, Mg * Al, Ca *K
в) число электронов на внешнем уровне: Ca * Mg, Be * Ba, Mg * Al, Ca *K
г) радиусатома: Ca * Mg, Be * Ba, Mg * Al, Ca *K
д) восстановительные свойства: Ca * Mg, Be * Ba, Mg * Al, Ca *K
2. Вставьте недостающую информацию.
Са + …. = 2СаО … + … = Be3N2
Mg + … = MgSO4 + … …+ Cl2 = SrCl2
Бериллий – встречается
в природе в виде минералов: берилла, хризоберилла и их разновидностей: изумруда,
аквамарина, александрита – известных как драгоценные камни.
Бериллий и его растворимые в воде соединения высокотоксичны (ядовиты). Даже ничтожно малая примесь его в воздухе приводит к тяжёлым заболеваниям. Он находит широкое применение в технике. Добавляя к меди он сильно повышает её твёрдость, прочность, химическую стойкость, делает похожей на сталь. Основной потребитель бериллия – атомная энергетика. Потребность в нём с каждым годом растёт.
Магний был впервые получен Деви в 1808 году из белой магнезии (магнезит MqCO3) – минерала найденного близ греческого города Магнезия. По названию минерала и дали название простому веществу и химическому элементу. Сульфат магния (одна из распространённых солей магния) называют ещё горькой солью – она придаёт морской воде горьковатый вкус. Данная соль магния используется в качестве слабительного средства. Сплавы с магнием прочнее, твёрже, легко полируются, обрабатываются и их используют в автомобильной промышленности, авиационной, ракетной технике.
Так они именуются по той причине,
что их гидроксиды, подобно гидроксидам ЩМ растворимы в воде, то есть являются
щелочами.
«Земельными они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде оксидов имеют землистый вид…» — Д.И.Менделеев.
Кальций занимает пятое место по распространённости. Так же впервые получен Деви в 1808 году. Название элемента происходит от латинского слова «кальс», что значит, «известь, мягкий камень». Встречается в виде гипса, кальцита (показ фотофрагментов на компьютере, диск «Самоучитель – химия»).
Кальцит образует залежи мела, мрамора, известняка.
он применяется: (гипсовые слепки, карнизы, лепнина, штукатурка потолков, в хирургии, бумажная промышленность).
Стронций встречается
реже в виде минерала целестина, что с латинского означает «небесный» — сульфат
стронция, образован розово-красными, бледно-голубыми кристаллами. Своё название
он (стронций) получил от названия шотландской деревни Стронциан, близ которой в
конце XVIII века найден редкий минерал стронцианит SrCO3.
Барий встречается в виде барита BaSO4 («барис»- тяжёлый с латинского). Показ образца бария с помощью фотофрагмента компьютерного диска «Самоучитель – химия». Применяется для изготовления радиоламп, в кожевенном деле (для удаления шерсти), в сахарном производстве, для приготовления фотобумаги, выплавке специальных окон.
***Творческое задание: составить кроссворд кроссворд по теме: «Щелочноземельные металлы, бериллий и магний».
ПО ГОРИЗОНТАЛИ:
1.Минерал, содержащий карбонат кальция; является важным строительным материалом.
7. Минерал, образующийся из остатков раковин древних животных.
8. Mg + N2 = … .
ПО ВЕРТИКАЛИ:
2. CaSO4 * 2h3 O
3. Mg + …. = Mgh3
4. Группа металлов, в которую входит кальций, барий, стронций, радий.
5. Щелочноземельный металл.
6. …+ Н2О=Са(ОН)2 +Н2
9. Степень окисления магния в соединениях.
Характеристики магния и кальция.
 ‘magnesia alba’ или белый магний). Он обнаружил, что мел теряет меньше массы, чем белая магнезия, при нагревании до температуры разложения, как при синтезе негашеной извести. Работа Джозефа Блэка над известняком помогла открыть магний и кальций десятилетия спустя. (Изображение: Джеймс Хит/общественное достояние)
‘magnesia alba’ или белый магний). Он обнаружил, что мел теряет меньше массы, чем белая магнезия, при нагревании до температуры разложения, как при синтезе негашеной извести. Работа Джозефа Блэка над известняком помогла открыть магний и кальций десятилетия спустя. (Изображение: Джеймс Хит/общественное достояние)Открытие магния и кальция
Зная то, что мы знаем сегодня, причина разницы в массе (упомянутая выше) ясна из периодической таблицы. Большая атомная масса кальция означает, что кальций составляет больший процент от его карбоната по массе, чем магний от его карбоната. Таким образом, удаление двуокиси углерода приводит к большему изменению массы образца карбоната магния.
В то время даже кислород еще не был открыт, поэтому Джозеф Блэк не мог быть уверен, что он сделал. Тем не менее, его измерения ясно показали, что эти два вещества были разными соединениями. Он назвал эти соединения «магнезией» и «известью».
В 1808 году, взяв намек из работы Блэка, Хамфри Дэви использовал свою знаменитую технику электролиза с вольтовой батареей, чтобы заставить электроны вернуться к металлам магнезии и извести. Недавно открытые элементы были названы магнием из-за исходного материала магнезии и кальцием из-за процесса прокаливания.
Недавно открытые элементы были названы магнием из-за исходного материала магнезии и кальцием из-за процесса прокаливания.
Где найти магний?
Магний — один из самых распространенных элементов в нашем мире. Четное и небольшое количество протонов гарантирует, что элемент-12 будет производиться в здоровых количествах во время звездного нуклеосинтеза. А его стремление к соединению с кремнием помогает еще больше сконцентрировать его у поверхности земли.
Плотные породы на дне моря и вулканические породы на поверхности континентов — первые места, где встречается магний. (Изображение: CSIRO/Public domain)Чаще всего он появляется в минералах, образующих плотные породы на морском дне, а также в вулканических породах, выдавливаемых на поверхность континентов во время извержений. По массе это седьмой по распространенности элемент в земной коре.
Как и многие другие элементы, сосредоточенные на поверхности Земли, минералы, содержащие магний, медленно химически выветриваются и высвобождают свой магний в море. Каждый литр морской воды в среднем содержит около одного грамма растворенного магния. Чтобы представить это количество магния в перспективе, в Мировом океане растворено около одного миллиарда килограммов этого элемента.
Каждый литр морской воды в среднем содержит около одного грамма растворенного магния. Чтобы представить это количество магния в перспективе, в Мировом океане растворено около одного миллиарда килограммов этого элемента.
Подобно щелочным металлам, магний имеет сравнительно низкий первый потенциал ионизации. Если мы проверим его положение в ряду активности, мы увидим, что магний находится довольно высоко в списке, поэтому неудивительно, что он всегда встречается в природе в своей ионной форме.
Эта статья взята непосредственно из серии видео Понимание периодической таблицы . Смотрите прямо сейчас на Wondrium .
Простота производства и хранения
Сам по себе металлический магний можно производить, хранить и использовать, не беспокоясь о реакции всего образца с воздухом вокруг него. Он не будет быстро тускнеть, не говоря уже о том, чтобы раскрошиться или загореться. Это связано с тенденцией магния быстро образовывать твердый пассивирующий оксидный внешний слой, который защищает оставшийся металлический магний внутри образца.
Но, если мы нагреем магний достаточно сильно, его склонность вступать в реакцию с кислородом приводит к одному из его наиболее известных применений. Хотя магний трудно воспламеняется, сам по себе металлический магний довольно энергично горит на воздухе, как только он начинает работать. Когда магний горит, атомы магния излучают линейчатый спектр, состоящий из нескольких цветных линий, которые в сочетании образуют сильный белый свет.
Другие свойства магния
Магний — металл с удивительно низкой плотностью, его вес составляет 1,7 грамма на миллилитр. Его плотность примерно в два раза выше, чем у его соседа из щелочного металла, натрия, но менее чем на две трети плотности его соседа справа, алюминия.
Эта тенденция, конечно, имеет смысл, поскольку переход от натрия к магнию и алюминию упаковывает более массивное ядро в атом с той же валентной оболочкой. Это означает более массивные атомы с меньшим атомным радиусом — это больший вес на единицу объема.
Таким образом, магний создает полезный баланс. Он намного менее активен на воздухе, чем натрий, из-за своего пассивирующего оксидного слоя. Но магний гораздо менее плотный, чем алюминий. Сочетание этих свойств делает магний популярным выбором для включения в металлические сплавы, которые должны быть легкими, прочными и устойчивыми к коррозии.
Он намного менее активен на воздухе, чем натрий, из-за своего пассивирующего оксидного слоя. Но магний гораздо менее плотный, чем алюминий. Сочетание этих свойств делает магний популярным выбором для включения в металлические сплавы, которые должны быть легкими, прочными и устойчивыми к коррозии.
Магний также имеет большое биологическое значение во многих отношениях. Возможно, наиболее интересной является его роль в фотосинтезе и красота осенней листвы. Магний находится в центре класса молекул, называемых хлорофиллами, которые являются важными соединениями, используемыми растениями для сбора энергии света для осуществления фотосинтеза.
Кальций и его повышенная склонность к окислению
Чуть ниже магния в таблице кальций также встречается в природе только в виде ионов. Эти ионы кальция появляются в костях, в молоке и во многих минералах вокруг нас. Но в отличие от магния, вы почти наверняка не будете носить кальций в кармане или вообще вступать в прямой контакт с ним.
Это связано с тем, что более удаленные валентные электроны кальция на четвертом энергетическом уровне легче удалить, в результате чего металлический кальций окисляется гораздо легче. Таким образом, работа с чистым металлическим кальцием требует мер предосторожности.
Литофильная природа кальция гарантирует, что геологические процессы всегда вытаскивают кальций из глубоких подземных слоев на поверхность в виде пород на основе кремния, таких как гранит. Эти камни в конечном итоге выветриваются, высвобождая часть этого кальция в морскую воду, где его концентрация в четыре раза выше, чем у магния, и он является излюбленным элементом для формирования раковин из карбоната кальция, используемых многими морскими существами для защиты.
И, конечно же, «кальций» важен для «костей», где он составляет около 40% массы гидроксиапатита кальция, основного минерала, из которого состоит кость. В этом минерале кальций находится в своей степени окисления +2, счастливый и стабильный с полной оболочкой третьей валентности.
В этом минерале кальций находится в своей степени окисления +2, счастливый и стабильный с полной оболочкой третьей валентности.
Общие вопросы о магнии и кальции
В: Что такое «магнезия» и «известь»?
Во время своих исследований мела и белой магнезии исследователь Джозеф Блэк отметил, что мел теряет меньше массы, чем белая магнезия, после нагревания до температуры разложения. Его измерения показали, что эти два вещества были разными соединениями, которые он назвал «магнезией» и «известью».
В: Как были открыты кальций и магний?
В 1808 году Хамфри Дэви заставил электроны вернуться на металлы магнезии и извести, используя метод электролиза с помощью гальванической батареи. Эти недавно открытые элементы были названы магнием и кальцием.
В: Почему магний легко производить, хранить и использовать?
Магний имеет тенденцию быстро образовывать твердый оксидный слой, который защищает оставшийся в нем металлический магний, что делает его относительно простым в хранении и приготовлении.
Продолжайте читать
Водород: номер элемента 1
Гелий и водород: сходства и различия
Водород и гелий: два элемента в строке 1 периодической таблицы
Периодическая таблица — щелочноземельные металлы
Не такие уж и страшные двойки: Щелочноземельные металлы
Второй столбец периодической таблицы называется второй группой. Его также называют семейством щелочноземельных металлов. Бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Тебе этого достаточно?
Давным-давно, еще до появления Playstation, iPhone, автомобилей и даже коммерческого электричества, ученые называли «элементы», которые были неметаллическими, нерастворимыми в воде и огнестойкими, «Землями». 5 На самом деле эти «элементы» представляли собой соединения, состоящие из металла и кислорода. Позднее эти соединения были переименованы в оксиды . Металлические компоненты оксидов вели себя по-разному, но все же напоминали металлы семейства щелочных. После небольшого мозгового штурма и смешения названий две концепции были объединены, чтобы создать существо Франкенштейна, которое мы теперь называем щелочноземельными металлами.
После небольшого мозгового штурма и смешения названий две концепции были объединены, чтобы создать существо Франкенштейна, которое мы теперь называем щелочноземельными металлами.
Барий, щелочноземельный металл.
Это здоровое семейство находится в s-блоке периодической таблицы, что означает, что их два валентных электрона находятся на s-орбитали. Вот несколько электронных конфигураций щелочноземельных металлов:
• Бериллий: [He]2s 2
• Магний: [Ne]3s 2
• Стронций: [Kr]5s 2
Щелочноземельные элементы потерять два ничтожных электрона для достижения сверхстабильной конфигурации благородного газа. Кусок пирога, верно? На самом деле это — это , для этих элементов довольно легко потерять свои валентные электроны. Элементы не так реактивны, как их соседи по первой группе, но они все же очень реактивны.
Examples of Reactions Involving Alkaline Earth Metals:
Ca ( s ) + Cl 2 ( g ) 2CaCl 2 ( s )
2Mg ( s ) + O 2 ( г ) 2MgO ( s )
Из-за своей высокой реакционной способности щелочноземельные металлы не встречаются в природе в их элементарных формах. Вместо этого их можно найти в земной коре с их +2 степень окисления , то есть заряд, который они получают после потери двух валентных электронов. Для достижения этого состояния эти элементы могут образовывать галогенидные комплексы вида MX 2 (где М — металл, а X — галогенид) или комплексы оксидов металлов. Кто знал, что земная кора может быть такой интересной!
Вместо этого их можно найти в земной коре с их +2 степень окисления , то есть заряд, который они получают после потери двух валентных электронов. Для достижения этого состояния эти элементы могут образовывать галогенидные комплексы вида MX 2 (где М — металл, а X — галогенид) или комплексы оксидов металлов. Кто знал, что земная кора может быть такой интересной!
Состав земной коры.
Металлы второй группы тверже и плотнее, чем члены первой группы, но значения твердости и плотности все еще относительно низкие по сравнению с другими металлами периодической таблицы. Эти металлы также серебристого цвета и мягкие. Не мягкий кролик, но более хрупкий, чем заурядный камень.
Несколько металлов второй группы серебра: магний, кальций и барий.
Щелочноземельные металлы играют огромную роль в биологии. Например, магний абсолютно необходим всем организмам. 6 Это ключевой компонент хлорофилла, зеленого пигмента растений, отвечающего за фотосинтез. Очевидно, что если кто-то хочет иметь суперсилу по сбору солнечной энергии (Человек-растение?), ему следует начать принимать жевательные витамины с магнием.
Очевидно, что если кто-то хочет иметь суперсилу по сбору солнечной энергии (Человек-растение?), ему следует начать принимать жевательные витамины с магнием.
Когда растениям не хватает магния, их листья начинают желтеть. Этот процесс называется хлорозом. Если не лечить, хлороз приведет к гибели растения.
Не любитель растений? Не беспокоит фотосинтез? Ну, магний также играет ключевую роль в организме человека. Это второй по распространенности элемент в клетках человека и четвертый по распространенности положительно заряженный ион в организме человека. 7 В клетках организма Mg выполняет буквально сотни функций.
Сколько раз твоя мама говорила тебе пить молоко? «Это полезно для ваших костей!» Мама права? Конечно. Одна чашка молока содержит примерно 300 мг кальция. 8 Кальций, как оказалось, является еще одним незаменимым щелочноземельным металлом. Это помогает сохранить наши кости сильными, а наши мышцы функционируют должным образом. Еще одна причина всегда слушать маму.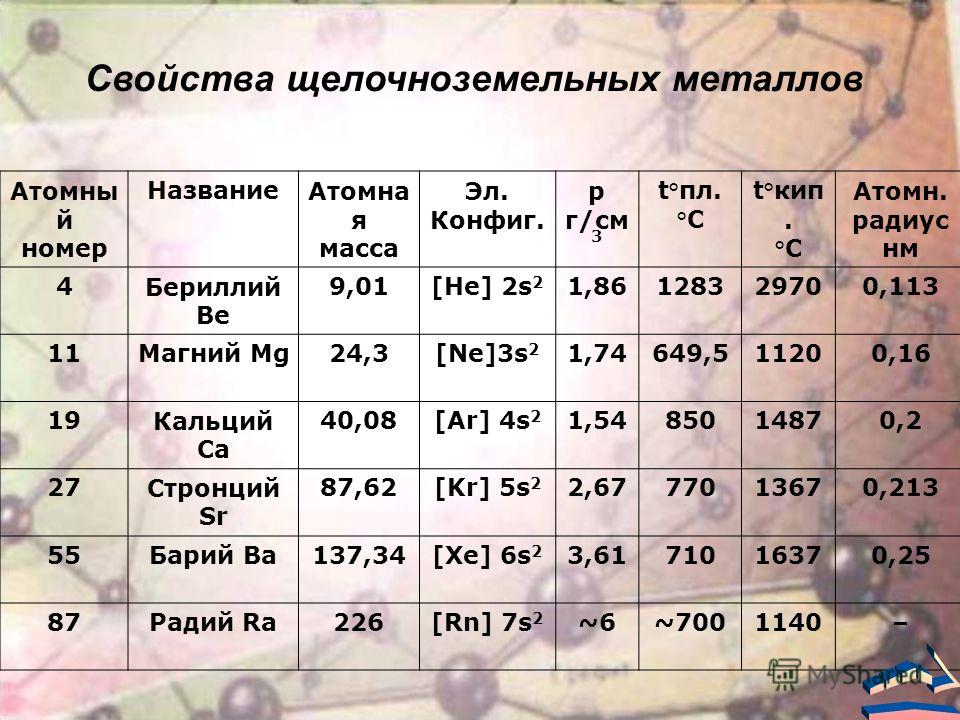


 Окрашивание пламени солей щелочноземельных металлов.
Окрашивание пламени солей щелочноземельных металлов.

 В.Уфалей).
В.Уфалей). Допишите уравнения реакций, уравняйте:
Допишите уравнения реакций, уравняйте:









 Миасса применение соединения кальция (Берёзовский карьер).
Миасса применение соединения кальция (Берёзовский карьер).
 В., Ключникова О.В. « Современные технологии в процессе преподавания химии» М.: ООО 5 за знания, 2008.
В., Ключникова О.В. « Современные технологии в процессе преподавания химии» М.: ООО 5 за знания, 2008. 2K + S → K2S
2K + S → K2S Кальций активный металл, поэтому вытесняет водород из воды.
Кальций активный металл, поэтому вытесняет водород из воды. — ?
— ? 2K +2 HCl→2KCl+
H2
2K +2 HCl→2KCl+
H2