щелочных и щелочноземельных металлов, алюминия, железа – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
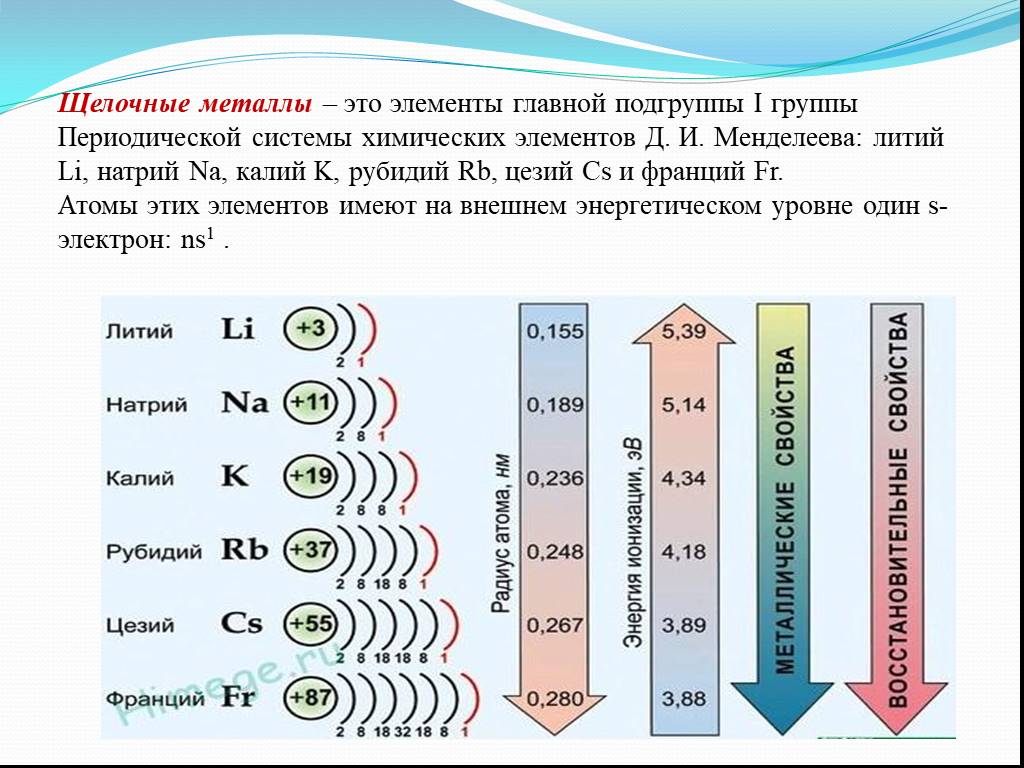
Элементами группы IA являются литий, натрий, калий, рубидий, цезий и франций. Их называют также щелочными металлами. Некоторые их физические свойства приведены в таблице 6.
Для щелочных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Общий способ получения щелочных металлов — электролиз расплавов их хлоридов, например:
Калий получают также с помощью натрийтермического метода:
Щелочные металлы химически очень активны, легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +1. Хранят щелочные металлы в герметичной таре под слоем обезвоженного керосина, а литий — под слоем вазелина.
Ниже представлены общие для всех щелочных металлов реакции (Me = Li, Na, K, Rb, Cs):
Исключением является реакция с кислородом, в которой щелочные металлы ведут себя по-разному:
Оксиды щелочных металлов Э2O являются типичными основными оксидами, а гидроксиды ЭОН — сильными основаниями (щелочами), сила которых возрастает от лития к цезию.
Элементами IIА-группы являются бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Последние три называют элементами подгруппы кальция или щёлочноземельными металлами. Некоторые свойства элементов IIА-группы приведены в таблице 7.
Свойства бериллия и магния несколько отличаются от свойств, характерных для щёлочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку (диагональное сходство).
Для щёлочноземельных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Магний и кальций получают электролизом расплавов их хлоридов, например:
Стронций и барий получают восстановлением их оксидов алюминием или кремнием, например:
Щёлочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2.
Ниже приведены характерные для щёлочноземельных металлов реакции с простыми и сложными веществами (Me = Ca, Sr, Ba):
Оксиды щёлочноземельных металлов представляют собой типичные основные оксиды. Они реагируют с кислотами с образованием солей и воды, с кислотными оксидами с образованием солей. Реакция с водой протекает по-разному. Если оксид бария легко реагирует с водой при комнатной температуре с образованием сильной щёлочи Ba(OH)2, то оксид магния может реагировать с водой только при кипячении. Химические свойства оксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
Гидроксиды щёлочноземельных металлов проявляют основные свойства: реагируют с кислотами с образованием основных или средних солей и воды, с кислотными оксидами с образованием солей и воды. Химические свойства гидроксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
Сила оснований увеличивается с увеличением порядкового номера элемента.
Алюминий — химический элемент, расположенный в 3-м периоде IIIA группе.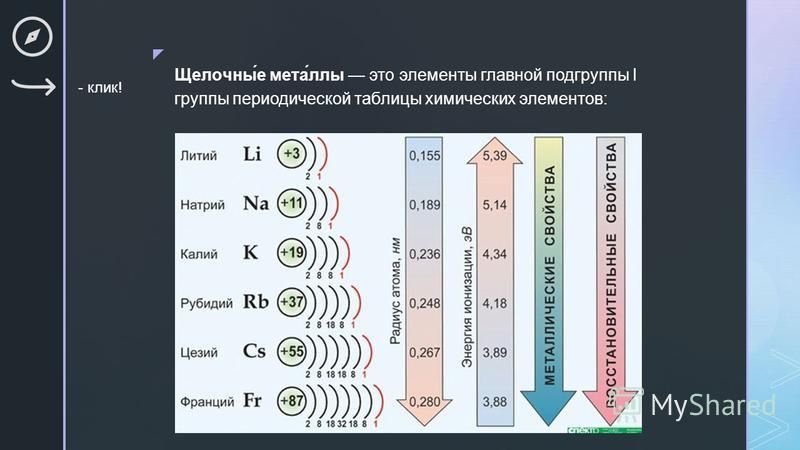 Его электронная формула 1s22s22p63s23p1.
Его электронная формула 1s22s22p63s23p1.
Алюминий пассивируется в воде, концентрированной азотной кислоте из-за образования устойчивой оксидной пленки. Сильный восстановитель.
Химические свойства:
Оксид алюминия — типичный амфотерный оксид, гидроксид алюминия — типичный амфотерный гидроксид.
Железо находится в 4-м периоде VIIIБ группе. Его электронная формула 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6.
Химически чистое железо получают разложением его пентакарбонила:
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах.
Упрощённо этот процесс можно описать уравнением:
Характерные для железа химические реакции:
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции.
Оба оксида вступают в окислительно-восстановительные реакции.
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут так же, как и у входящих индивидуально в его состав оксидов:
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Тренировочные задания
1. Литий при соответствующих условиях вступает в реакцию с каждым из двух веществ
1) кислородом и алюминием
2) серой и хромом
3) оксидом углерода (II) и оксидом меди (I)
4) азотом и фосфором
2. Верны ли следующие утверждения о литии?
А. Литий хранят под слоем вазелина. Б. Взаимодействие лития с кислородом приводит к пероксиду лития.
Литий хранят под слоем вазелина. Б. Взаимодействие лития с кислородом приводит к пероксиду лития.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Натрий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) ртутью и алюминием
2) фосфором и оксидом кальция
3) оксидом серы (IV) и оксидом кальция
4) азотной кислотой и водой
4. Верны ли следующие утверждения о натрии?
А. Натрий не реагирует с фосфором даже при нагревании.
Б. Натрий используют в технике при получении калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Калий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и магнием
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом магния
4) азотной кислотой и оксидом серы (VI)
6. Верны ли следующие утверждения о калии?
Верны ли следующие утверждения о калии?
А. Калий не реагирует с водой.
Б. Гидрид калия нельзя получить прямой реакцией калия с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Магний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) в одой и железом
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом кремния
4) азотной кислотой и оксидом серы (VI)
8. Верны ли следующие утверждения о магнии?
А. Магний на воздухе покрывается оксидной пленкой.
Б. Магний реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Кальций при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и углеродом
2) фосфором и литием
3) оксидом фосфора (V) и оксидом азота (IV)
4) оксидом бария и оксидом серы (VI)
10. Верны ли следующие утверждения о кальции?
Верны ли следующие утверждения о кальции?
А. Кальций реагирует с азотом при нагревании.
Б. Кальций не реагирует с оксидом фосфора (V).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
11. Барий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и соляной кислотой
2) фосфором и натрием
3) оксидом фосфора (V) и оксидом лития
4) оксидом углерода (IV) и оксидом серы (VI)
12. Верны ли следующие утверждения о барии?
А. Барий не вступает в реакцию с бромом.
Б. Барий вступает в реакцию с водой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Алюминий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) железом и оксидом серы (VI)
14. Верны ли следующие утверждения об алюминии?
Верны ли следующие утверждения об алюминии?
А. Алюминий вступает в реакцию с Fe2O3.
Б. Алюминий реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Железо при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) кислородом и оксидом серы (VI)
16. Верны ли следующие утверждения о железе?
А. Железо вступает в реакцию с Fe2O3.
Б. Железо реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Установите соответствие между реагирующими веществами и продуктами реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + HNO3 (разб.) →
Б) Li + S →
В) Li + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) Li2S
3) LiOH
4) LiNO3 + NH4NO3 + H2O
5) LiOH + H2
18. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + O2 →
Б) Li + Cl2 →
В) Li + HNO3 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) LiCl
3) Li2O
4) Li2O2
5) LiNO3 + NH4NO3 + H2O
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + O2 →
Б) Na + H2SO4 →
В) Na + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) NaCl
2) Na2O
3) Na2O2
4) NaCl + H2↑
5) Na2SO4 + H2↑
20. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + HNO3 (разб.) →
Б) Na + O2 →
В) Na + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) NaNO3 + H2↑
2) NaNO3 + NH4NO3 + H2O
3) NaOH + H2↑
4) Na2O
5) Na2O2
21. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + O2 →
Б) K + HCl →
В) K + S →
ПРОДУКТЫ РЕАКЦИИ
1) K2O
2) KO2
3) K2S
4) KCl + H2O
5) KCl + H2↑
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + H2O →
Б) K + Cl2 →
В) K + H2SO4 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) KH + O2
2) K2SO4
3) KCl
4) K2SO4 + H2↑
5) KOH + H2↑
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + HNO3 (разб.) →
Б) Mg + N2 →
В) Mg + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Mg(NO3)2 + N2O + H2O
2) Mg(NO3)2 + H2↑
3) MgO + H2↑
4) MgCl2 + H2↑
5) Mg3N2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + H2SO4 (разб.) →
Б) Mg + H2 →
В) Mg + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) MgSO4 + SO2 + H2O
2) Mg(NO3)2 + H2↑
3) MgH2
4) MgSO4 + H2↑
5) Mg(NO3)2 + N2O + H2O
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + HNO3 (разб.) →
Б) Ca + P →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(NO3)2 + NO2 + H2O
2) CaCl2 + H2O
3) Ca(NO3)2 + N2O + H2O
4) Ca3P2
5) CaCl2 + H2↑
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + N2 →
Б) Ca + C →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3N2
2) Ca2C
3) CaCl2
4) CaCl2 + H2↑
5) CaC2
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + HNO3 (разб.) →
Б) Ba + H2 →
В) Ba + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) Ba(NO3)2 + N2O3↑ + H2O
2) Ba(NO3)2 + N2O↑ + H2O
3) BaH2
4) Ba(OH)2 + H2↑
5) Ba(OH)2
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + N2 →
Б) Ba + O2 →
В) Ba + C →
ПРОДУКТЫ РЕАКЦИИ
1) BaO
2) Ba2O2
3) Ba3N2
4) BaC2
5) Ba2C
29. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + HCl →
Б) Al + C →
В) Al + Fe2O3 →
ПРОДУКТЫ РЕАКЦИИ
1) FeAlO2
2) Al2O3 + Fe
3) AlCl3 + H2↑
4) Al4C3
5) Al2C3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + NaOH + H2O →
Б) Al + P →
В) Al + HI →
ПРОДУКТЫ РЕАКЦИИ
1) Na[Al(OH)4] + H2↑
2) AlI3 + H2↑
3) AlP
4) Na[Al(OH)4]
5) Al(OH)3 + H2↑
31. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + HCl →
Б) Fe + H2SO4 (разб.) →
В) Fe + S →
ПРОДУКТЫ РЕАКЦИИ
1) FeCl3 + H2↑
2) Fe2(SO4)3 + H2↑
3) FeSO4 + H2↑
4) FeS
5) FeCl2 + H2↑
32. Установите соответствие между реагирующими веществами и продуктами реакций.
Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + H2O (пар) →
Б) Fe + HNO3 (разб.) →
В) Fe + CuSO4 →
ПРОДУКТЫ РЕАКЦИИ
1) Fe2(SO4)3 + Cu
2) Fe(NO3)3 + NO + H2O
3) FeSO4 + Cu
4) Fe3O4 + H2
5) Fe(NO3)3 + NO2 + H2O
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Для второго превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Ответы
Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния →
← Окислительно-восстановительные реакции. Окислитель и восстановитель
Опыты по химии. Щелочные и щелочно-земельные металлы
Чтобы поделиться, нажимайте
Взаимодействие щелочных металлов с водой
Щелочные металлы: литий, натрий, калий — очень активны. На воздухе они реагируют с кислородом и водяными парами, поэтому их хранят под слоем керосина. Литий — самый легкий из всех металлов, он легче керосина. Извлечем кусочек лития из керосина, очистим его. Литий достаточно твердый по сравнению с другими щелочными металлами и с трудом режется ножом. Поместим кусочек лития в чашку Петри, наполненную водой. Литий энергично реагирует с водой с выделением водорода и образованием щелочи — гидроксида лития. При добавлении капли раствора фенолфталеина в чашку Петри появляется малиновая окраска. Натрий — более мягкий металл, легко режется ножом. Срез натрия — серебристо-белый, быстро тускнеет на воздухе. Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь — гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться.
На воздухе они реагируют с кислородом и водяными парами, поэтому их хранят под слоем керосина. Литий — самый легкий из всех металлов, он легче керосина. Извлечем кусочек лития из керосина, очистим его. Литий достаточно твердый по сравнению с другими щелочными металлами и с трудом режется ножом. Поместим кусочек лития в чашку Петри, наполненную водой. Литий энергично реагирует с водой с выделением водорода и образованием щелочи — гидроксида лития. При добавлении капли раствора фенолфталеина в чашку Петри появляется малиновая окраска. Натрий — более мягкий металл, легко режется ножом. Срез натрия — серебристо-белый, быстро тускнеет на воздухе. Кусочек натрия помещаем на поверхность воды. Попадая в воду, натрий плавится и начинает быстро двигаться по поверхности воды, подгоняемый пузырьками выделяющегося водорода. Кусочек натрия уменьшается на глазах. В процессе реакции также образуется щелочь — гидроксид натрия. С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается. В целях безопасности чашку Петри следует накрыть стеклянной пластинкой. Из трех щелочных металлов наиболее активным является калий.
2 Li + 2 H2O = 2 LiOH + H2
2 Na + 2 H2O = 2 NaOH + H2
2 K + 2 H2O = 2 KOH + H2
Оборудование: чашки Петри, фильтровальная бумага, пинцет, скальпель.
Техника безопасности. Соблюдать правила работы со щелочными металлами. Кусочки металлов, используемых в опыте, не должны быть больше рисового зерна.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Горение кальция на воздухе
Кальций — серебристо-белый очень твердый металл. Ввиду высокой химической активности его хранят под слоем керосина. Для того чтобы поджечь кальций на воздухе, нужна очень высокая температура. В присутствии кислорода кальций загорается при более низких температурах. Извлечем кальций из керосина, промокнем керосин фильтровальной бумагой. Опустим кусочек кальция в расплавленный нитрат калия. Как известно, нитрат калия при нагревании разлагается с выделением кислорода:
Ввиду высокой химической активности его хранят под слоем керосина. Для того чтобы поджечь кальций на воздухе, нужна очень высокая температура. В присутствии кислорода кальций загорается при более низких температурах. Извлечем кальций из керосина, промокнем керосин фильтровальной бумагой. Опустим кусочек кальция в расплавленный нитрат калия. Как известно, нитрат калия при нагревании разлагается с выделением кислорода:
2КNO3= 2KNO2 + O2
Внесем кальций вместе с небольшим количеством нитрата калия в пламя горелки. Кальций загорается кирпично-красным пламенем. Основным продуктом горения кальция на воздухе является оксид кальция:
2Са + О2 = 2СаО
Оборудование: тигельные щипцы, горелка, шпатель.
Техника безопасности. Соблюдать правила пожарной безопасности. На рабочем столе поместить теплоизолирующую прокладку.
На рабочем столе поместить теплоизолирующую прокладку.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Жесткость воды
Жесткость воды обусловлена ионами кальция и магния. Природная вода всегда содержит соли магния и кальция. Сравним свойства жесткой и свободной от солей дистиллированной воды. В колбы с жесткой и дистиллированной водой добавим мыльный раствор. Закроем колбы и взболтаем их. В колбе с дистиллированной водой образуется обильная пена. В колбе с жесткой водой появились нерастворимые в воде соединения кальция и магния. Вот поэтому в жесткой воде мыло не мылится.
С17H35COONa → C17H35 COO— + Na+
2 C17H35 COO— + Ca2+ = (C17H35 COO)2Ca↓
2 C17H35 COO— + Mg2+ = (C17H35 COO)2Mg↓
Оборудование: колбы, химические стаканы, пипетка.
Техника безопасности. Опыт безопасен.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Приготовление жидкого сплава натрия и калия
Свойства сплавов отличаются от свойств исходных металлов. При комнатной температуре натрий и калий – твердые вещества. Температура плавления натрия 97,8 °С, температура плавления калия 63, 5 °С. Сейчас вы увидите, что сплав натрия и калия при комнатной температуре – жидкость.Сплав получается при плотном контакте натрия и калия. Из-за высокой активности металлов действие происходит в стакане с керосином. Прижмем кусочки металлов друг к другу и слегка потрем. На дно стакана падают капли жидкого сплава. Мы увидели, что температура плавления сплава оказалась ниже температуры плавления исходных металлов.
Оборудование: пинцет, скальпель, стакан химический, фильтровальная бумага.
Техника безопасности. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Самовозгорание цезия на воздухе
Цезий – чрезвычайно активный щелочной металл. Он имеет серебристо-белый цвет, при обычной температуре вязкую, пастообразную консистенцию. Температура плавления цезия 28,7 °С. Из за высокой активности металл хранят в запаянных стеклянных ампулах. Цезий реагирует с водой со взрывом. На воздухе цезий мгновенно воспламеняется. Если раздавить ампулу цезия, то мы увидим легкий дымок. Соприкоснувшись с кислородом воздуха цезий сгорел. При сгорании цезия образуются не оксиды, а пероксиды и надпероксиды цезия.
2Сs + O2 = Cs2O2
Сs + O2 = CsO2
Оборудование: щипцы, огнезащитная прокладка.
Техника безопасности. При разбивании ампулы с цезием использовать защитный экран, работать только в защитных очках.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Способы устранения жесткости воды
В природной воде растворены соли кальция и магния. Это гидрокарбонаты и сульфаты. Покажем два способа осаждения гидрокарбонатов для уменьшения жесткости воды. Первый способ – кипячение. При кипячении* растворимые гидрокарбонаты переходят в нерастворимые карбонаты, и жесткость воды уменьшается.
Сa(HCO3)2 = CaCO3 ↓ + H2O + CO2↑
Второй способ – добавление известковой воды. При добавлении известковой воды гидрокарбонаты переходят в карбонаты и вода становится более мягкой.
Сa(HCO3)2+ Ca(OH)2 = CaCO3 ↓ +2 H2O
Но жесткость воды зависит еще и от сульфатов кальция и магния. Сульфаты кальция и магния можно удалить с помощью карбоната натрия. При добавлении карбоната натрия сульфаты переходят в нерастворимые карбонаты кальция и магния.
Сульфаты кальция и магния можно удалить с помощью карбоната натрия. При добавлении карбоната натрия сульфаты переходят в нерастворимые карбонаты кальция и магния.
CaSO4 + Na2CO3= CaCO3 ↓+ Na2SO4
Теперь мы знаем, как уменьшить жесткость воды. Накипь внутри чайника ‑ это осадок карбонатов кальция и магния с примесью сульфата кальция. Накипь можно удалить со стенок, используя разбавленный раствор уксусной кислоты.
Оборудование: пробирки, штатив для пробирок, химические стаканы, пипетка, спиртовка, шпатель, держатель для пробирок.
Техника безопасности.
Требуется соблюдение правил обращения с нагревательными приборами.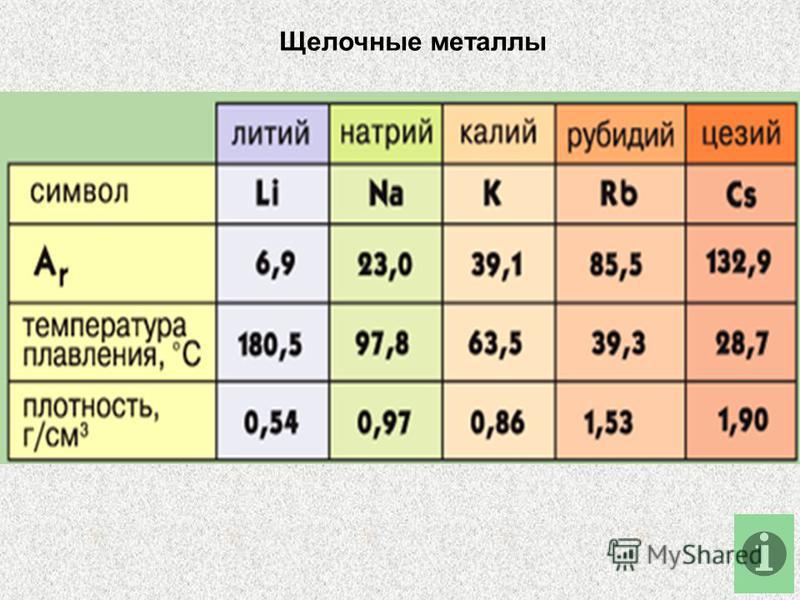
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Щелочные и щелочноземельные металлы и их роль в организме человека презентация, доклад
Щелочные и Щелочноземельные
металлы и их роль
в организме человека
Са
Rb
Sr
K
Fr
Na
Li
Ra
Cs
Ba
900igr.net
Щелочные металлы
Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде.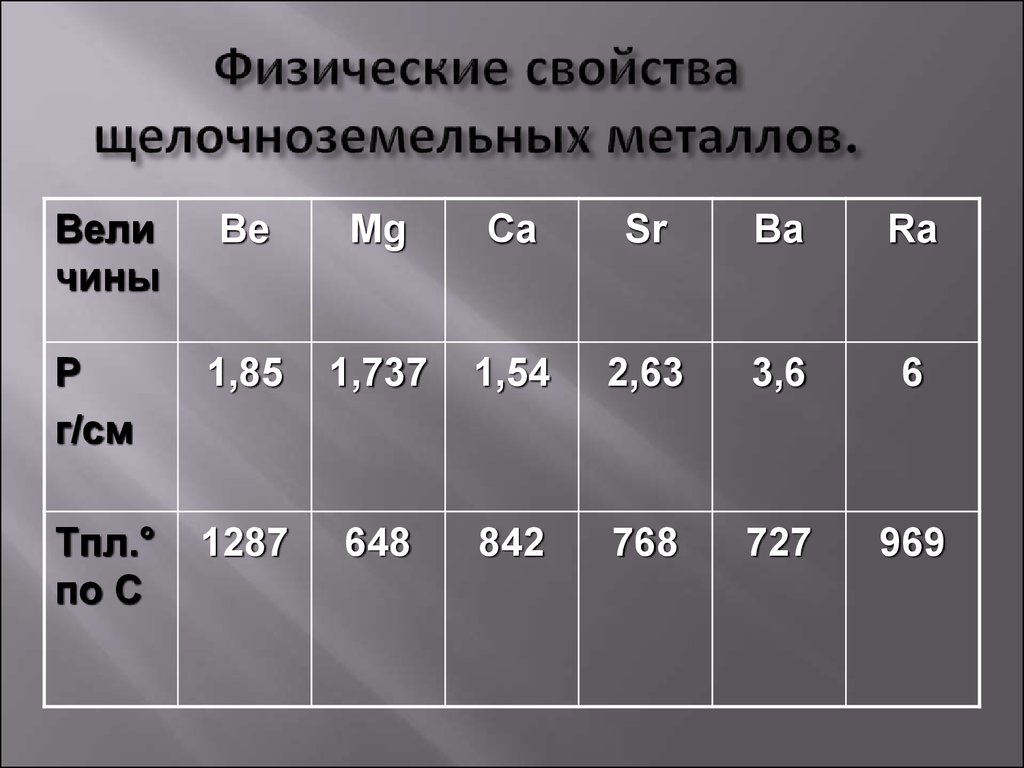 По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Общая характеристика
НАХОЖДЕНИЕ В ПРИРОДЕ
Li: Li2O • Al2O3 • 4SiO2 – сподумен
Na: NaCl — каменная соль
Na2SO4 • 10h3O — глауберова соль (мирабилит)
NaNO3 – чилийская селитра
K: KCl • NaCl – сильвинит
KCl • MgCl2 • 6h3O – карналлит
K2O • Al2O3 • 6SiO2 – полевой шпат (ортоклаз)
Сподумен
Карналлит
Каменная соль
ПОЛУЧЕНИЕ
Литий
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой.
2LiCl(ж) = 2Li + Cl2
В дальнейшем полученный литий очищают методом вакуумной дистилляции.
ПОЛУЧЕНИЕ
Натрий
Первым способом получения натрия стала реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000°C:
Na2CO3+2C=2Na+3CO
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия.
ПОЛУЧЕНИЕ
Калий
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %).
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород: 4OH− − 4e− → 2h3O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре.
ПОЛУЧЕНИЕ
Рубидий
Большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов RbAl(SO4)2·12h3O, KAl(SO4)2·12h3O, CsAl(SO4)2·12h3O. Смесь разделяют многократной перекристаллизацией.
 Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозёма из нефелина.
Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозёма из нефелина.Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов.
ПОЛУЧЕНИЕ
Цезий
Существует несколько лабораторных методов получения цезия. Он может быть получен:
нагревом в вакууме смеси хромата или дихромата цезия с цирконием;
разложением азида цезия в вакууме;
нагревом смеси хлорида цезия и специально подготовленного кальция.
Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
ПОЛУЧЕНИЕ
Франций
Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций.
Физические свойства
В виде простых веществ — мягкие, серебристо белые металлы, цезий имеет золотисто-желтый цвет. Плотности лития, натрия и калия меньше плотности воды ( 1 г/см3), температура плавления плавно уменьшается от лития (180оС) к цезию (28оС). Так же изменятся и температура кипения — от 1337оС у лития до 668оС у цезия. Твердость щелочных металлов мала — они легко режутся ножом.

Химические свойства
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1) Взаимодействие с водой. Важное свойство щелочных металлов – их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
2Li + 2h3O => 2LiOH + h3
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2) Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Химические свойства
4Li + O2 => 2Li2O(оксид лития)
K + O2 => KO2(надпероксид калия)
3) В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 => 2LiCl (галогениды)
2Na + S => Na2S (сульфиды)
2Na + h3 => 2NaH (гидриды)
6Li + N2 => 2Li3N (нитриды)
2Li + 2C => 2Li2C2 (карбиды)
4) Взаимодействие с другими веществами. При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
Химические свойства
2Na + 2Nh4 => 2NaNh3 + h3
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
KNh3 + h3O => KOH + Nh4
Щелочные металлы взаимодействуют с органическими веществами — спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
2Na + 2Ch4Ch3OH => 2Ch4Ch4ONa + h3
2Na + 2Ch4COOH => 2Ch4COONa + h3
5) Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
Li+ — карминово-красный; Na+ — жёлтый
K+, Rb+, Cs+ — фиолетовый
Химические свойства
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Li2O + h3O => 2LiOH
K2O + SO3 => K2SO4
Na2O + 2HNO3 => 2NaNO3 + h3O
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Na2O2 + 2NaI + 2h3SO4 => I2 + 2Na2SO4 + 2h3O
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
Na2O2 + 2h3O => 2NaOH + h3O2
2KO2 + 2h3O => 2KOH + h3O2 + O2
Роль металлов в организме человека
Литий
В течение суток в организм взрослого человека поступает около 100 мкг лития. Ионы лития Li+ быстро и практически полностью абсорбируются из желудочно-кишечного тракта, по-видимому, из тонкого кишечника, а также из мест парентерального введения. Ионы лития легко проникают через биологические мембраны. Среднее содержание лития (в мкг/г), в различных органах значительно различается: в лимфоузлах – 200, легких – 60, печени – 7, цельной крови – 6, мышцах – 5, мозге – 4. Литий можно обнаружить в костях, кишечнике, надпочечниках и других тканях. Выведение лития осуществляется преимущественно через почки и в меньшей степени с калом и потом.
В организме литий, по-видимому, способствует высвобождению магния из клеточных «депо» и тормозит передачу нервного импульса, тем самым, снижая возбудимость нервной системы.
Ионы лития Li+ быстро и практически полностью абсорбируются из желудочно-кишечного тракта, по-видимому, из тонкого кишечника, а также из мест парентерального введения. Ионы лития легко проникают через биологические мембраны. Среднее содержание лития (в мкг/г), в различных органах значительно различается: в лимфоузлах – 200, легких – 60, печени – 7, цельной крови – 6, мышцах – 5, мозге – 4. Литий можно обнаружить в костях, кишечнике, надпочечниках и других тканях. Выведение лития осуществляется преимущественно через почки и в меньшей степени с калом и потом.
В организме литий, по-видимому, способствует высвобождению магния из клеточных «депо» и тормозит передачу нервного импульса, тем самым, снижая возбудимость нервной системы.
 Скелет, несомненно, является местом активного взаимодействия лития с магнием, кальцием и другими минеральными компонентами костной ткани.
Имеются данные о влиянии лития на нейро-эндокринные процессы, жировой и углеводный обмен. В обменных процессах литий активно взаимодействует с ионами K+ и Na+ .
Скелет, несомненно, является местом активного взаимодействия лития с магнием, кальцием и другими минеральными компонентами костной ткани.
Имеются данные о влиянии лития на нейро-эндокринные процессы, жировой и углеводный обмен. В обменных процессах литий активно взаимодействует с ионами K+ и Na+ . Роль металлов в организме человека
Литий
Назначение препаратов лития на фоне дефицита натрия опасно для здоровья, т.к. может вызывать поражение почек. Кроме того, к побочным эффектам терапии препаратами лития, можно отнести угнетение функции щитовидной железы путем блокирования литием высвобождения ТТГ-рилизинг фактора, ТТГ и тироксина. Под влиянием лития возрастает поглощение глюкозы, синтез гликогена и уровень инсулина в сыворотке крови больных диабетом, применяющих препараты лития, снижается уровень глюкозы и кетоновых тел в моче. Литий обладает инсулиноподобным эффектом.
Токсическая доза для человека: 92-200 мг.
Летальная доза для человека: данные отсутствуют.
Роль металлов в организме человека
Натрий
Натрий широко распространен во всех органах, тканях и биологических жидкостях организма человека.
В противоположность калию, большая часть натрия находится во внеклеточных жидкостях — около 50%, в костях и хрящах — около 40% и менее 10% — внутри клеток.
Натрий играет важную роль в процессе внутриклеточного и межклеточного обмена. Вместе с калием натрий участвует в возникновении нервного импульса, играет роль в механизме кратковременной памяти, влияет на состояние мышечной и сердечно-сосудистой систем; ионы натрия и хлора также играют важную роль в секреции соляной кислоты в желудке.
Соотношение ионов натрия и калия выполняют два важных взаимосвязанных процесса: поддерживают постоянное осмотическое давление и постоянный объем жидкости. Потребление натрия в большом количестве ведет к потере калия. Именно для этого важное значение имеет сбалансированное поступление в организм как калия, так и натрия.
Именно для этого важное значение имеет сбалансированное поступление в организм как калия, так и натрия.
Суточная потребность человека, как правило, перекрывается потреблением поваренной соли, которая является основным источником натрия. В сутки человек употребляет 10-12 г поваренной соли, в том числе в хлебе и натуральных пищевых продуктах.
Роль металлов в организме человека
Натрий
Ряд ученых высказывают мнение, что количество потребляемой соли в сутки должно быть значительно меньше и ограничиваться содержанием ее в продуктах питания. Считается, что употребление большого количества поваренной соли является одной из основных причин развития гипертонической болезни.
В тоже время отмечается, что потребность в натрии увеличивается пропорционально его потере с мочой и потом. При значительных физических нагрузках, особенно в жаркое время года или во время работы в горячих цехах, потребность в поваренной соли возрастает до 20 г в сутки.
Всасывание натрия при поступлении в организм человека начинается уже в желудке и происходит в основном в тонком кишечнике.
Недостаточность натрия в организме (гипонатриемия) развивается:
при недостаточном поступлении натрия в организм с пищей (при анорексии, заболеваниях пищеварительного тракта, бессолевой диете и др.)
при избыточном выведении натрия почками (почечная недостаточность, гипокортицизм, лечение диуретиками)
при избыточном выведении натрия через кожу (длительное обильное потоотделение, обширные ожоги кожи)
при потере натрия (повторные рвоты, поносы, удаление жидкости при асците, гидротораксе)
Роль металлов в организме человека
Натрий
при избыточном поступлении в организм воды или при патологической задержке ее в организме (при сердечной недостаточности, циррозах печени и др.), при которых развивается так называемая гипонатриемия от разведения, хотя общее количество натрия в организме может быть нормальным или даже повышенным.
Проявляется гипонатриемия при суточном поступлении натрия с пищей менее 0,5 г следующими признаками: сухая кожа со сниженными эластичностью и тургором, нередко судороги в мышцах голеней, ано-рексия, жажда, тошнота и рвота, апатия, сонливость, иногда спутанность сознания. Отмечается значительное снижение артериального давления, тахикардия. Выделение мочи резко снижено или отсутствует (олигурия или анурия). Лечение проводят только в плане комплексной терапии с учетом основной патологии, которая вызвала гипонатриемию.
При избыточном употреблении в пищу поваренной соли отмечается задержка в организме жидкости, которая затрудняет работу сердца и почек, может вызвать повышение артериального давления. В этих случаях резко ограничивают в суточном рационе количество поваренной соли («бессолевая диета») для больных с сердечно-сосудистой недостаточностью, гипертонической болезнью и рядом заболеваний почек. В такой диете количество хлоридов натрия ограничивается содержанием в натуральных продуктах (0,5-3 г в сутки).
В медицинской практике используются растворы натрия хлорида, чаще 0,9% раствор для приготовления растворов различных лекарственных препаратов и для внутривенного введения по медицинским показаниям.
Роль металлов в организме человека
Калий
Калий, как и натрий, играет большую роль в образовании буферных систем, предотвращающих сдвиги реакции среды и обеспечивающих их постоянство. Калий относится к основным внутриклеточным катионам, являясь необходимым компонентом внутриклеточной среды всех живых организмов. В организме человека около 98% калия находится внутри клеток тканей. Для всех тканей характерно определенное соотношение концентраций между калием и натрием, который содержится преимущественно во внеклеточной среде.
В некоторых физиологических процессах калий выступает как антогонист натрия: увеличение концентрации калия в организме приводит к выведению из организма натрия. Соединения калия оказывают влияния на коллоидное состояние тканей, способствуют выведению из организма жидкости. Это свойство калия используют в так называемых «калиевых диетах» (диета с повышенным содержанием калия) при сердечно-сосудистой и почечной недостаточности для повышения мочевыделения и выведения натрия.
Это свойство калия используют в так называемых «калиевых диетах» (диета с повышенным содержанием калия) при сердечно-сосудистой и почечной недостаточности для повышения мочевыделения и выведения натрия.
Общее содержание калия в организме человека составляет 160-250 г. Но это количество меняется в зависимости от возраста, пола, конституции человека. Эти сдвиги связаны и с изменением клеточной массы тела.
Калий в основном содержится в растительных продуктах питания, с которыми поступает в организм человека.
Наиболее богаты содержанием калия: соя, фасоль, горох.
Роль металлов в организме человека
Калий
Существенными источниками калия являются крупы, картофель, хлеб, абрикосы, персики, бананы и другие продукты.
Суточная потребность калия для взрослого человека 2-3 г в сутки, а для ребенка — 16-30 мг на кг массы тела. Необходимый минимум потребления калия для человека в сутки составляет около 1 г. При нормальном пищевом рационе суточная потребность в калии полностью удовлетворяется, но отмечаются еще сезонные колебания в потреблении калия. Так, весной его потребление невысоко — около 3 г/сутки, а осенью максимальное потребление — 5-6 г/сутки.
При нормальном пищевом рационе суточная потребность в калии полностью удовлетворяется, но отмечаются еще сезонные колебания в потреблении калия. Так, весной его потребление невысоко — около 3 г/сутки, а осенью максимальное потребление — 5-6 г/сутки.
Для нормального обмена веществ в пищевом рационе должно выдерживаться соотношение между калием и натрием — 1:2.
Учитывая тенденцию современных людей к употреблению с пищей большого количества поваренной соли, также возрастает и потребность в калии, который может нейтрализовать неблагоприятное влияние избытка количества натрия на организм.
Недостаток поступления калия с пищей может привести к дистрофии даже при нормальном содержании белков в рационе. Нарушение обмена калия проявляется при хронических заболеваниях почек и сердечно-сосудистой системы, при заболеваниях желудочно-кишечного тракта (особенно, сопровождающихся поносом и рвотой), при заболевании желез внутренней секреции и другой патологии.
Роль металлов в организме человека
Калий
Недостаток калия в организме проявляется прежде всего нарушениями нервно-мышечной и сердечнососудистой систем (сонливость, нарушение движений, дрожание конечностей, замедленное сердцебиение). В лечебных целях применяются препараты калия.
В лечебных целях применяются препараты калия.
Избыток калия наблюдается значительно реже, но представляет собой крайне опасное состояние: вялые параличи конечностей, изменения со стороны сердечно-сосудистой системы. Такое состояние может проявляться при выраженном обезвоживании организма, гиперкортицизме с нарушением функции почек и при введении больному большого количества калия.
Роль металлов в организме человека
Рубидий, Цезий и Франций
Цезий и рубидий относят к малоизученым микроэлементам. Эти элементы находятся в окружающей среде и поступают в организм различными путями, в основном с пищей. Установлено их постоянное наличие в организме. Однако до сих пор эти элементы не считаются биотическими.
Рубидий и цезий найдены во всех исследованных органах млекопитающих и человека. Поступая в организм с пищей, они быстро всасываются из желудочно-кишечного тракта в кровь. Средний уровень рубидия в крови составляет 2,3-2,7 мг/л, причем его концентрация в эритроцитах почти в три раза выше, чем в плазме. Рубидий и цезий весьма равномерно распределяется в органах и тканях, причем, рубидий, в основном, накапливается в мышцах, а цезий поступает в кишечник и вновь реабсорбируется в нисходящих его отделах.
Рубидий и цезий весьма равномерно распределяется в органах и тканях, причем, рубидий, в основном, накапливается в мышцах, а цезий поступает в кишечник и вновь реабсорбируется в нисходящих его отделах.
Известна роль рубидия и цезия в некоторых физиологических процессах. В настоящее время установлено стимулирующее влияние этих элементов на функции кровообращения и эффективность применения их солей при гипотониях различного происхождения. Исходя из выраженного гипертензивного и сосудосуживающего действия, соли цезия еще в 1888 г. впервые были применены С.С.Боткиным при нарушениях функции сердечно-сосудистой системы. В лаборатории И.П.Павлова С.С.Боткиным было установлено, что хлориды цезия и рубидия вызывают повышение артериального давления на длительное время и, что это действие связано, главным образом, с усилением сердечно-сосудистой деятельности и сужением периферических сосудов.
Роль металлов в организме человека
Рубидий, Цезий и Франций
Установлено адреноблокирующее и симпатомиметическое действие солей цезия и рубидия на центральные и периферические адренореактивные структуры, которое особенно ярко выражено при подавлении тонуса симпатического отдела центральной нервной системы и дефиците катехоламинов. Солям этих металлов свойственен, главным образом, бетта-адреностимулирующий эффект.
Солям этих металлов свойственен, главным образом, бетта-адреностимулирующий эффект.
Соли рубидия и цезия оказывают влияние на неспецифические показатели иммунобиологической резистентности — они вызывают значительное увеличение титра комплемента, активности лизоцима, фагоцитарной активности лейкоцитов. Есть указание на стимулирующее влияние солей рубидия и цезия на функции кроветворных органов. В микродозах они вызывают стимуляцию эритро- и лейкопоэза (на 20-25%), заметно повышают резистентность эритроцитов, увеличивают содержание гемоглобина в них.
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии.
Франций. Соль франция FrCl использовалась для обнаружения раковых опухолей, но по причине чрезвычайно высокой стоимости эту соль в масштабных разработках использовать невыгодно.
Щелочноземельные
металлы
Щёлочноземельные металлы — химические элементы: кальций Ca, стронций Sr, барий Ba, радий Ra. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щёлочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов.
Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щёлочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов.
Общая характеристика
НАХОЖДЕНИЕ В ПРИРОДЕ
Ca: CaCO3 – кальцит (известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2h3O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат (флюорит)
Sr: SrSO4 – целестин
SrCO3 – стронцианит
Ba: BaSO4 – барит
BaCO3 – витерит
Барит
Целестин
Ангидрит
ПОЛУЧЕНИЕ
Кальций
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C:
4CaO + 2Al => CaAl2O4 + 3Ca
СаCl2 => Ca + Cl2
ПОЛУЧЕНИЕ
Стронций
Существуют три способа получения стронция:
термическое разложение некоторых соединений
электролиз
восстановление оксида и хлорида
Основным промышленным способом получения металлического стронция является термическое восстановление его оксида алюминием. Далее полученный стронций очищается возгонкой.
Далее полученный стронций очищается возгонкой.
4SrO+ 2Al => 3Sr+ SrO·Al2O3
Электролитическое получение стронция электролизом расплава смеси SrCl2 и NaCl не получило широкого распространения из-за малого выхода по току и загрязнения стронция примесями.
При термическом разложении гидрида или нитрида стронция образуется мелкодисперсный стронций, склонный к легкому воспламенению.
ПОЛУЧЕНИЕ
Барий
Основное сырье для получения бария — баритовый концентрат (80-95 % BaSO4), который в свою очередь получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
BaSO4 + 4С = BaS + 4CO↑
BaSO4 + 2Ch5 = BaS + 2С + 4h3O↑
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
BaS + 2h3O = Ba(OH)2 + h3S↑
BaS + h3O + CO2 = BaCO3 + h3S↑
Ba(OH)2 = BaO + h3O↑
BaCO3 = BaO + CO2↑
Металлический барий получают из оксида восстановлением алюминием в вакууме при 1200-1250°С:
4BaO + 2Al = 3Ba + BaAl2O4
Очищают барий перегонкой в вакууме или зонной плавкой.
ПОЛУЧЕНИЕ
Радий
Получить чистый радий в начале ХХ в. стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в. в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Физические свойства
Внешне – серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов. Твердость по группе уменьшается сверху вниз, барий по твердости близок к свинцу. Температуры плавления щелочноземельных металлов выше, чем у щелочных и составляют: для кальция 851оС, стронция 770оС, бария 710оС. Плотности щелочноземельных металлов в подгруппе сверху вниз увеличиваются и равны для Са, Sr и Ва, соответственно 1,54, 2,63 и 3,76 г/см3.
Химические свойства
1) Реакция с водой. Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
Ca + 2h3O => Ca(OH)2 + h3
2) Реакция с кислородом. Все металлы образуют оксиды RO, барий-пероксид – BaO2.
Ba + O2 => BaO2
3) С другими неметаллами образуются бинарные соединения:
Ba + S => BaS (сульфиды)
Ca + h3 => Cah3 (гидриды)
Ca + 2C => CaC2 (карбиды)
3Ba + 2P => Ba3P2 (фосфиды)
Химические свойства
4) Все металлы растворяются в кислотах:
Ca + 2HCl => CaCl2 + h3
5) Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
Ca2+ — темно-оранжевый
Sr2+- темно-красный
Ba2+ — светло-зеленый
Роль металлов в организме человека
Кальций
Наряду с пластической и структурной функциями (основа минерального компонента костной ткани), кальций играет решающую роль в осуществлении многих физиологических и биохимических процессов. Он необходим для нормальной возбудимости нервной системы и сократимости мышц, является активатором ряда ферментов и гормонов и важнейшим компонентом свертывающей системы крови.
Он необходим для нормальной возбудимости нервной системы и сократимости мышц, является активатором ряда ферментов и гормонов и важнейшим компонентом свертывающей системы крови.
Содержание кальция в организме взрослого человека — около 20 г на 1 кг массы тела, а у новорожденного — 9 г на 1 кг массы тела. Около 99% всего кальция, находящегося в организме человека, содержится в костной и хрящевой тканях в виде различных соединений. Остальная часть кальция содержится внутри клеток мягких тканей и во внеклеточной жидкости.
Необходимая суточная доза потребления кальция с пищей для взрослого человека составляет 0,8-1,1 г. Однако, надо учитывать, что не все формы кальция, содержащиеся в пище, легко усваиваются организмом.
Усвоение кальция идет очень трудно. Соединения кальция нерастворимы в воде, а поэтому, попадая с пищей в организм человека лишь частично переходят в растворимые соединения под влиянием желудочного сока и щелочной среды тонкого кишечника. Только желчные кислоты способны перевести большую часть кальция в усвояемые формы. Считается, что наиболее усвояемые формы кальция содержатся в молоке, а поэтому сбалансированный рацион должен включать в себя не менее 0,5 л молока в сутки.
Считается, что наиболее усвояемые формы кальция содержатся в молоке, а поэтому сбалансированный рацион должен включать в себя не менее 0,5 л молока в сутки.
Роль металлов в организме человека
Кальций
Выводится кальций из организма в зависимости от характера пищи, с которой поступает. В растущем организме процесс окостенения происходит при нормальном соотношении между кальцием и фосфором в суточном пищевом рационе. Регулирует это соотношение витамин Д.
Пониженное содержание кальция в организме человека (гипокальциемия) наблюдается при нарушении функции паращитовидных желез (гипопаратиреоидизме), нарушении всасывания в кишечнике, недостаточном выделении желчи и других заболеваниях. Гипокальциемия проявляется: тетанией (повышенная возбудимость нервной системы, проявляющаяся судорожными приступами), трофическими нарушениями, катарактой, выкрашиванием зубов, выпадением волос.
Повышенное содержание кальция в организме человека (гиперкальциемия) наблюдается при избыточном введении солей кальция, повышенном их всасывании из кишечника, снижении выделения кальция через почки, при повышенном употреблении витамина Д и ряде заболеваний. Проявляется гиперкальциемия задержкой роста, ухудшением аппетита, рвотой, запорами, жаждой, повышенным мочевыделением, снижением тонуса мышц, повышением рефлексов, ухудшением памяти, реже — спутанностью сознания. Возможно отложение кальция в сосудах почек, в органах и даже в роговице глаз.
Проявляется гиперкальциемия задержкой роста, ухудшением аппетита, рвотой, запорами, жаждой, повышенным мочевыделением, снижением тонуса мышц, повышением рефлексов, ухудшением памяти, реже — спутанностью сознания. Возможно отложение кальция в сосудах почек, в органах и даже в роговице глаз.
Кроме медикаментозных препаратов, назначаемых при гипокальциемии и недостатке кальция в пищевом рационе, кальций входит наравне с другими химическими элементами в комплексы поливитаминов.
Роль металлов в организме человека
Стронций
Вместе с пищей в организм взрослого человека поступает 0,8–3,0 мг стронция в сутки. При избыточном поступлении стронция возникает так называемый «стронциевый рахит» или «уровская болезнь». Это эндемическое заболевание, впервые обнаруженное у населения, проживающего вблизи реки Уров в Восточной Сибири. «Уровская болезнь» возникает вследствие вытеснения ионов кальция ионами стронция из костной ткани или повышенного поступления в организм стронция на фоне дефицита кальция. Накопление в организме стронция приводит к поражению всего организма, однако наиболее типичным для этого заболевания является развитие дистрофических изменений костно-суставной системе в период роста и развития организма (формируется симметричный деформирующий остеопороз из-за торможения роста костей со стороны метаэпифизарных хрящей). Болезнь впервые описана у человека российскими врачами Н.М. Кашиным и Е.В. Беком в 1895-1900 гг (второе название уровской болезни – болезнь Кашина-Бека). Как правило, это заболевание сопровождается выраженным нарушением фосфорно-кальциевого соотношения в крови, дисбактериозом кишечника.
Накопление в организме стронция приводит к поражению всего организма, однако наиболее типичным для этого заболевания является развитие дистрофических изменений костно-суставной системе в период роста и развития организма (формируется симметричный деформирующий остеопороз из-за торможения роста костей со стороны метаэпифизарных хрящей). Болезнь впервые описана у человека российскими врачами Н.М. Кашиным и Е.В. Беком в 1895-1900 гг (второе название уровской болезни – болезнь Кашина-Бека). Как правило, это заболевание сопровождается выраженным нарушением фосфорно-кальциевого соотношения в крови, дисбактериозом кишечника.
Стронций, поступающий с пищей, относительно плохо усваивается организмом (около 5-10%). В основном богаты стронцием растительные продукты, а также кости и хрящи. Абсорбция стронция происходит в основной, 12-перстной и подвздошной кишке. Абсорбированный в организме стронций затем выводится, в основном с мочой, в меньшей степени с желчью. В фекалиях находится неабсорбированный стронций.
Роль металлов в организме человека
Стронций
В организме взрослого человека массой 70 кг находится около 320 мг стронция, причем его основное количество (до 99%) депонировано в костях. Относительно высоки концентрации стронция в лимфатических узлах (0,30±0,08 мкг/г), легких (0,20±0,02), яичниках (0,14±0,06), печени и почках (0,1±0,03). В цельной крови обнаружено 0,02±0,002 мкг/мл стронция.
Токсическая доза для человека: не токсичен.
Летальная доза для человека: нет данных.
Роль металлов в организме человека
Барий
Барий относится к токсичным ультрамикроэлементам. Содержание бария в организме взрослого человека составляет около 20 мг, среднесуточное поступление лежит в пределах 0,3-1 мг. Всасываемость растворимых солей бария в желудочно-кишечном тракте составляет около 10%, иногда этот показатель доходит до 30%. В дыхательных путях резорбция достигает 60-80%. Содержание бария в плазме крови изменяется параллельно изменениям концентрации кальция. В незначительных количествах барий находится во всех органах и тканях, однако всего его больше в головном мозге, мышцах, селезенке и хрусталике глаза. Около 90% всего содержащегося в организме бария концентрируется в костях и зубах.
В дыхательных путях резорбция достигает 60-80%. Содержание бария в плазме крови изменяется параллельно изменениям концентрации кальция. В незначительных количествах барий находится во всех органах и тканях, однако всего его больше в головном мозге, мышцах, селезенке и хрусталике глаза. Около 90% всего содержащегося в организме бария концентрируется в костях и зубах.
Установлено, что при ишемической болезни сердца, хронической коронарной недостаточности, заболеваниях органов пищеварения содержание бария в тканях снижается. Даже в ничтожных концентрациях барий оказывает выраженное влияние на гладкие мышцы.
Токсическая доза для человека: 200 мг.
Летальная доза для человека: 3,7 г.
Роль металлов в организме человека
Радий
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
щелочноземельный металл | Свойства, список и реактивность
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Сэр Хамфри Дэви
- Похожие темы:
- кальций магний бериллий радий барий
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Происхождение, свойства и использование
До 19 века неметаллические вещества, нерастворимые в воде и не изменяющиеся при воздействии огня, назывались землями. Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Как и у щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны, превращаясь в положительные ионы (катионы). Таким образом, большинство их типичных соединений являются ионными: соли, в которых металл встречается в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0033 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (т. е. щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, самому тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются высокореактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
За исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести самых распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
История
Самым ранним из известных щелочноземельных элементов была известь (лат. calx ), которая, как теперь известно, представляет собой оксид кальция; он использовался в древние времена в составе раствора. Магнезия (название, вероятно, происходит от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочная земля, отличная от извести; он заметил, что магнезия дает растворимый сульфат, тогда как известь, как известно, нерастворима. В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Другая земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Магний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены в виде нечистых металлов английским химиком сэром Хамфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделения щелочных металлов калия и натрия. . Позднее щелочноземельные металлы были получены восстановлением их солей свободными щелочными металлами, и именно таким путем (действием калия на хлорид бериллия) бериллий был впервые выделен немецким химиком Фридрихом Вёлером и французским химиком Антуаном Бюсси. независимо в 1828 г. Радий был открыт в 189 г.8 с помощью его радиоактивности французскими физиками Пьером и Марией Кюри, которые к 1902 году выделили его в виде хлорида радия из настурана. Металлический радий был выделен в 1910 году благодаря совместной работе Марии Кюри и французского химика Андре-Луи Дебьерна.
независимо в 1828 г. Радий был открыт в 189 г.8 с помощью его радиоактивности французскими физиками Пьером и Марией Кюри, которые к 1902 году выделили его в виде хлорида радия из настурана. Металлический радий был выделен в 1910 году благодаря совместной работе Марии Кюри и французского химика Андре-Луи Дебьерна.
щелочноземельный металл | Свойства, список и реактивность
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Сэр Хамфри Дэви
- Похожие темы:
- кальций магний бериллий радий барий
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Происхождение, свойства и использование
До XIX века неметаллические, нерастворимые в воде и не изменяющиеся при воздействии огня вещества назывались землями. Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Как и у щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны, превращаясь в положительные ионы (катионы). Таким образом, большинство их типичных соединений являются ионными: соли, в которых металл встречается в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0033 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0033 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (т. е. щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, самому тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются высокореактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
За исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести самых распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести самых распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
История
Самым ранним из известных щелочноземельных элементов была известь (лат. calx ), которая, как теперь известно, представляет собой оксид кальция; он использовался в древние времена в составе раствора. Магнезия (название, вероятно, происходит от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочная земля, отличная от извести; он заметил, что магнезия дает растворимый сульфат, тогда как известь, как известно, нерастворима. В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Другая земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Другая земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Подпишитесь сейчас
Магний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены в виде нечистых металлов английским химиком сэром Хамфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделения щелочных металлов калия и натрия. . Позднее щелочноземельные металлы были получены восстановлением их солей свободными щелочными металлами, и именно таким путем (действием калия на хлорид бериллия) бериллий был впервые выделен немецким химиком Фридрихом Вёлером и французским химиком Антуаном Бюсси. независимо в 1828 г. Радий был открыт в 189 г.8 с помощью его радиоактивности французскими физиками Пьером и Марией Кюри, которые к 1902 году выделили его в виде хлорида радия из настурана. Металлический радий был выделен в 1910 году благодаря совместной работе Марии Кюри и французского химика Андре-Луи Дебьерна.
Характеристики щелочноземельного металла
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- В этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica.
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это лучший ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и многое другое. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.