Характерные химические свойства щелочных металлов » HimEge.ru
•Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
•Все соединения щелочных металлов имеют ионный характер.
•Практически все соли растворимы в воде.
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги. Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
1. Щелочные металлы активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Реакция щелочных металлов с кислородом:
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Получение щелочных металлов
Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl 2
В небольших масштабах используется также вакуум-термическое получение натрия и калия:
2NaCl+CaC2=2Na+CaCl2+2C;
4KCl+4CaO+Si=4K+2CaCl2+Ca2SiO4.
Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
 Особенности химических свойств s-элементов I группы и их физиологическое действие
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s22s1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li+ со стабильной конфигурацией инертного газа (гелия). Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл. От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li
Малый размер иона Li+, высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е—, занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 22s22p63s1. Единственная степень окисления натрия +1. Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na+ значительно больше, чем Li+, и сольватация его не так велика. Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К+ и Na+ связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами. Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К+, вследствие чего внутриклеточная концентрация К+ значительно выше, чем ионов Na
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв. Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте. При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов. В соединениях калия связь более ионная, а в виде иона К+ он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39К, 40К, 41К. Один из них
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р. Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей. Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации. Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах. Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно. Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах. В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li3N (до 75%) и Li2O. Остальные щелочные металлы образуют пероксиды (Na2O2) и надпероксиды (K2O4 или KO2).
Перечисленные вещества реагируют с водой:
Li3N + 3 H2O = 3 LiOH + NH3 ;
Na2O2 + 2 H2O = 2 NaOH + H2O2 ;
K2O4 + 2 H2O = 2 KOH + H2O2 + O2 .
Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
Na2O2+CO2=Na2CO3+0,5O2 ;
K2O4 + CO2 = K2CO3+ 1,5 O2 .
В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных.
Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
2Li+H2=2LiH.
Гидрид лития используется как сильный восстановитель.
Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
SiO2+2NaOH=Na2SiO3+H2O.
Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 13000С). Некоторые соединения натрия называют содами:
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na2CO3;
б) кристаллическая сода – кристаллогидрат карбоната натрия Na2CO3.10H2O;
в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO3;
г) гидроксид натрия NaOH называют каустической содой или каустиком.
himege.ru
Химические свойства щелочноземельных металлов | Metall
Щелочноземельные металлы принадлежат к элементам II группы периодической системы. По сравнению со щелочными металлами они отличаются большей твердостью, плотностью и наличием характерного серого цвета. Единственное исключение составляет стронций, который можно разрезать обыкновенным кухонным ножом. Они обладают более высокой температурой плавления и кипения, а также большей способностью к ионизации в сравнении с другими щелочными металлами. Эти металлы не встречаются в природных условиях в свободном состоянии.
Они вступают в реакцию со многими органическими веществами, образуя различные металлорганические соединения. Свое название они получили из-за способности их оксидов при взаимодействии с водой образовывать щелочную среду.

Кальций
Активность кальция ниже, чем у более тяжелых металлов II группы периодической системы. Он взаимодействует с кислородом, углекислым газом и галогенами, поэтому в лабораторных условиях его хранят в жидком парафине. С холодной водой он реагирует медленно, но с повышением температуры реакция начинает идти очень быстро. При нагревании в присутствии кислорода он легко воспламеняется.
Барий
Барий окисляется даже при незначительном присутствии кислорода. В воздушной атмосфере он быстро образует оксид и нитрид бария, а в случае нагревания легко воспламеняется. Барий вступает в реакцию со слабоконцентрированными кислотами. Большинство его солей не растворяются в воде. При высоких температурах он образует гидрид бария. Нитрид бария при взаимодействии с окисью углерода образует цианиды. Металл обладает сильными восстановительными свойствами, взаимодействуя с оксидами и сульфидами большинства других металлов.
Стронций
Стронций по своим свойствам находится между барием и кальцием. Он активно вступает в реакцию с водой, при этом образуются гидроксиды бария. С серной и азотной кислотой практически нейтрален, но взаимодействует с другими кислотами. Он легко окисляется в воздушной атмосфере с образованием пленки желтоватого цвета. В порошкообразном состоянии может воспламеняться на воздухе. В реакцию с большинством щелочей не вступает, при сильном нагревании с углекислым газом образует карбид. Его соли растворяются в воде при наличии анионов хлора и йода. Другие его соли в воде практически не растворяются.
Радий
Радий – очень редкий химический элемент. В течение последних ста лет в лабораторных условиях было добыто всего лишь около 1,5 кг этого радиоактивного металла. В природных условиях существует только в виде продукта распада радиоактивных элементов и бывает в составе урановых руд. Химические свойства близки свойствам стронция и бария, но отличаются большей активностью. Радий реагирует с водой с дальнейшим образованием гидроксида радия, являющегося сильным коррозионным основанием.
Магний
Магний в природе существует преимущественно в виде магнезиальных солей. При нагревании выделяет много энергии в виде тепла и света. Он может гореть как в кислороде, так и в углекислом газе. В нагретом состоянии легко взаимодействует с водой, при этом выделяет большое количество энергии. Взаимодействуя с кислотами, он бурно выделяет водород. Реакция с активными окислителями проходит в виде мощного взрыва, например, при соединении с перманганатом калия.
Щелочноземельные металлы находят широкое применение в различных высокотехнологических отраслях техники, придавая используемым в конструкциях сплавам повышенную прочность и легкость, предупреждая возникновение коррозии. В большинстве случаев они добавляются в сплавы в качестве легирующих добавок или используются для восстановления других металлов. В последнее время их стали применять для получения сверхпроводящих и полупроводниковых материалов, а также различных наноструктур. Радиоактивный радий используется в ядерной энергетике, рентгеновских аппаратах и оборудовании для химиотерапии для удаления злокачественных образований.
Читайте также
a-kranm.com
Проверяемые элементы: Характерные химические свойства простых веществ- металлов: щелочных, щелочноземельных, алюминия; переходных металлов: меди,
52bc3c62.png» NAME=»Рисунок 1″ ALIGN=BOTTOM WIDTH=96 HEIGHT=88 BORDER=0>Часть 1. Задание А8.Проверяемые элементы: Характерные химические свойства простых веществ-
металлов: щелочных, щелочноземельных, алюминия; переходных металлов: меди,
цинка, хрома, железа. Характерные химические свойства простых веществ-
неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода,
кремния.
Теория:
Химические свойства — свойства веществ (химических элементов, простых веществ и химических соединений), имеющие отношение к химическим процессам, то есть проявляемые в процессе химической реакции.
Металлы:
Химические свойства металлов:
В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и способностью образовывать положительно заряженные ионы. Следовательно, металлы в свободном состоянии являются восстановителями.
Восстановительная способность различных металлов неодинакова и определяется положением в электрохимическом ряду напряжения металлов:
Li K Rb Cs Ca Na Mg Al Mn Zn Cr Cr Fe Ni Sn Pb Cu Hg Ag Pt Ag Pt Au
Металлы размещены в порядке убывания их восстановительных свойств и усиления окислительных свойств их ионов. Этот ряд характеризует химическую активность металлов только в окислительно-восстановительных реакциях, протекающих в водной среде.
Характерными свойствами для металлов являются следующие:
Восстановление неметаллов Реакции с галогенами и кислородом воздуха протекают с различными скоростями и при различных температурах с разными металлами. Так, щелочные металлы легко окисляются кислородом воздуха и взаимодействуют с простыми веществами, железо и медь взаимодействуют с простыми веществами только при нагревании, золото и платиновые металлы не окисляются вообще. Многие металлы образуют на поверхности оксидную пленку, которая защищает их от дальнейшего окисления. 2Мg + О2 = 2МgО 4Аl + ЗО2 = 2А12О3 2К + Сl2 = 2КСl
Менее энергично металлы взаимодействуют с серой: Сu + S = СuS Fе + S = FеS
Трудно вступают в реакцию с азотом и фосфором: ЗМg + N2 = Мg3N2 (нитрид магния)
ЗСа + 2Р = Са3Р2 (фосфид кальция) Активные металлы взаимодействуют с водородом:
Са + Н2 = СаН2 (гидрид кальция)
Взаимодействие с водой Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода: 2Nа + 2Н2О == 2NаОН + Н2 Са + 2Н2О = Са(ОН)2 + Н2 2Аl + 6Н2O = 2Аl(ОН)3 + ЗН2.
^
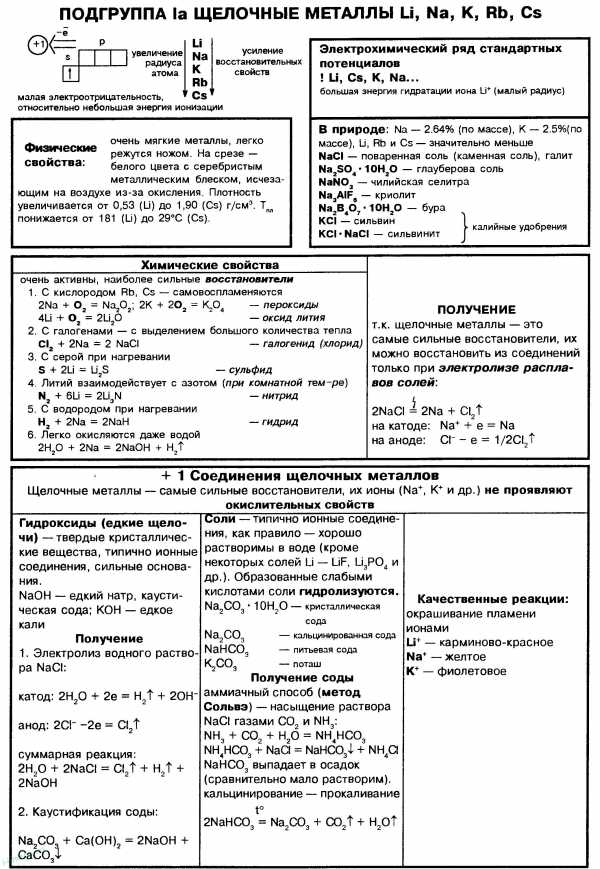
К щелочным металлам относятся элементы первой группы, главной подгруппы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
^
| 1. | С кислородом (Rb, Cs — самовоспламеняются) | 2Na+O2=Na2O2; 2K+2O2=K2O4 (пероксиды) 4Li+O2=2Li2O (оксид лития) |
| 2. | С галогенами | 2Na+Cl2=2NaCl |
| 3. | С серой при нагревании | 2Li+S=Li2S (сульфид) |
| 4. | Литий взаимодействует с азотом | 6Li+N2=2Li3N ( нитрид) |
| 5. | С водородом при нагревании | 2Na+h3=2NaH (гидрид) |
| 6. | С водой | 2Na+2h3O=2NaOH+h3 |
^
К щелочноземельным металлам относятся элементы главной подгруппы второй группы: бериллий, магний, кальций, стронций, барий, радий.
^
Щелочноземельные металлы легко реагируют с кислородом, галогенами, неметаллами, водой и кислотами, особенно при нагревании:
— особенно легко эта реакция протекает для кальция и бария, поэтому их хранят в особых условиях
— персульфид бария BaS – люминофор
— при гидролизе ацетиленидов образуется ацетилен:
Алюминий
Химические свойства алюминия:
| 1. | С кислородом | 4Al+3O2=2Al2O3 |
| 2. | С галогенами | 2Al+3Cl2=2AlCl3 |
| 3. | С серой при нагревании | 2Al+3S=Al2S3 |
| 4. | С углеродом | 4Al+3C=Al4C3 |
| 5. | Алюминотермия | 8Al+3Fe3O4=4Al2O3+9Fe |
| 6. | С водой (после разрушения оксидной пленки) | 2Al+6h3O=2Al(OH)3+3h3 |
| 7. | Растворяется в щелочах | 2Al+2NaOH+6h3O=2Na[Al(OH)4]+3h3 |
| 8. | Реагирует с кислотами | 2Al+6HCl=2AlCl3+3h3 |
| 9. | С азотной и концентрированной серной кислотами на холоду не реагируют. При нагревании | Al+6h3SO4(конц.)=Al2(SO4)3+3SO2+6h3O Al+6HNO3=Al(NO3)3+3NO2+3h3O |
^
Химические свойства меди:
| 1. | Взаимодействует с неметаллами при высоких температурах | 2Cu + O2 = 2CuO Cu + Cl2 = CuCl2 |
| 2. | Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях | 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 2h3O Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2h3O Cu + 2h3SO4(конц.) = CuSO4 + SO2+2h3O |
Сплавы меди с оловом — бронзы, с цинком — латуни.
^
Химические свойства цинка:
| 1. | На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO | 2Zn + O2 = 2ZnO. |
| 2. | Оксид цинка реагирует с растворами кислот | ZnO + 2HNO3 = Zn(NO3)2 + h3O |
| 3. | С щелочами | ZnO + 2NaOH = Na2ZnO2 + Н2О |
| 4. | Цинк обычной чистоты активно реагирует с растворами кислот | Zn + 2HCl = ZnCl2 + h3↑, Zn + h3SO4(разб.) = ZnSO4 + h3↑ |
| 5. | С растворами щелочей | Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑, образуя гидроксоцинкаты |
С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(h3O)4]2+ и [Zn(h3O)6]2+.
^
Химические свойства хрома:
В ряду Cr – Mo – W химическая активность падает.
С увеличением степени окисления элементов у их оксидов и гидроксидов законо-мерно происходит ослабление основных свойств и усиление кислотных. Высшим оксидам RO3 соответствуют кислоты h3RO4.
В том же направлении происходит усиление окислительных свойств соединений.
Железо
| 1. | На воздухе железо легко окисляется в присутствии влаги (ржавление) | 4Fe + 3O2 + 6h3 O = 4Fe(OH)3 |
| 2. | Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II,III) | 3Fe + 2O2 = Fe3O4 |
| 3. | При высокой температуре (700–900C) железо реагирует с парами воды | 3Fe + 4h3O = Fe3O4 + 4h3 |
| 4. | Железо реагирует с неметаллами при нагревании | 2Fe + 3Br2 = 2FeBr3 Fe + S = FeS |
| 5. | Железо легко растворяется в соляной и разбавленной серной кислотах | Fe + 2HCl = FeCl2 + h3 Fe + h3SO4(разб.) = FeSO4 + h3 |
| 6. | В концентрированных кислотах–окислителях железо растворяется только при нагревании | 2Fe + 6h3SO4(конц.) = Fe2(SO4)3 + 3SO2 + 6h3O Fe + 6HNO3(конц.) = Fe(NO3)3 + 3NO2 + 3h3O |
| 7. | (На холоде концентрированные азотная и серная кислоты пассивируют железо). Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей. | Fe + CuSO4 = FeSO4 + Cu |
Неметаллы
Химические свойства неметаллов:
Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие.
Атомы самого электроотрицательного элемента – фтора – не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
| Взаимодействие с металлами | 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2 = 2Li3N, 2Ca + O2 = 2CaO |
Вэтих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
| Взаимодействие с другими неметаллами | ||
| 1. | Взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды | 3h3 + N2 = 2Nh4, h3 + Br2 = 2HBr; |
| 2. | взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства | S + O2 = SO2, 4P + 5O2 = 2P2O5; |
| 3. | при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем | 2F2 + O2 = 2OF2 |
| 4. | неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя, менее электроотрицательный – роль восстановителя | S + 3F2 = SF6, C + 2Cl2 = CCl4 |
^
Химические свойсва водорода:
| 1. | Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия | Н2 = 2Н − 432 кДж |
| 2. | При обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция | Ca + Н2 = СаН2 |
| 3. | с единственным неметаллом — фтором, образуя фтороводород | F2 + h3 = 2HF |
| 4. | С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении | О2 + 2Н2 = 2Н2О |
| 5. | Он может «отнимать» кислород от некоторых оксидов | CuO + Н2 = Cu + Н2O |
| 6. | Восстановительные свойства водорода | N2 + 3h3 → 2Nh4 |
| 7. | С галогенами образует галогеноводороды | F2 + h3 → 2HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + h3 → 2HCl, реакция протекает со взрывом, только на свету. |
| 8. | С сажей взаимодействует при сильном нагревании | C + 2h3 → Ch5 |
| 9. | При взаимодействии с активными металлами водород образует гидриды | 2Na + h3 → 2NaH Ca + h3 → Cah3 Mg + h3 → Mgh3 |
| 10. | Гидриды — солеобразные, твёрдые вещества, легко гидролизуются | Cah3 + 2h3O → Ca(OH)2 + 2h3↑ |
| 11. | Оксиды восстанавливаются до металлов | CuO + h3 → Cu + h3O Fe2O3 + 3h3 → 2Fe + 3h3O WO3 + 3h3 → W + 3h3O |
Галогены
Химические свойства галогенов:
Рассмотрим свойства галогенов на примере хлора:
| 1. | Взаимодействие с металлами | Mg + Cl2 = MgCl2 |
| 2. | Реакции с неметаллами | h3 + Cl2 = 2HCl |
| 3. | Взаимодействие со щелочами на холоду | 2NaOH + Cl2 = NaCl + NaClO + h3O |
| 4. | Взаимодействие со щелочами при нагревании | 6NaOH + 3Cl2 = 5NaCl + NaClO3 + 3h3O |
| 5. | Вытеснение менее активных галогенов из галогенидов | 2KBr + Cl2 = 2KCl + Br2 |
| 6. | С водой | h3O + Cl2 = HCl + HClO(хлорная вода) |
Кислород
Химические свойства кислорода:
| 1. | Взаимодействие с металлами | 2Cu + O2 = 2CuO |
| 2. | Горение неметаллов | S+O2 = SO2 |
| 3. | Горение сложных веществ | 2h3S + 3O2 = 2h3O + 2SO2 |
Сера
Химические свойства серы:
| 1. | Горение серы | 2h3S + 3O2 = 2h3O + 2SO2 |
| 2. | Взаимодействие с неметаллами | h3 + S = h3S S+O2 = SO2 |
| 3. | Окисление серной кислотой | S + 2h3SO4 = 2h3O + 3SO2 |
| 4. | Взаимодействие со щелочами при нагревании | S + 2h3SO4 = 2h3O + 3SO2 |
^
Химические свойства азота:
| 1. | Взаимодействие с кислородом | N2+O2=2NO (эл.дуга, 3000 C) |
| 2. | Взаимодействие с щелочными и щелочноземельными металлами | 6Li+N2=2Li3N |
| 3. | С водородом | 3N2+3h3 2Nh4 |
Фосфор
Химические свойства фосфора:
| 1. | Взаимодействие с кислородом | 4P+5O2=2P2O5 |
| 2. | С галогенами | 2P+5Cl5=2PCl5 |
| 3. | С активными металлами | 2P+3Mg=Mg3P2 (фосфид) |
| 4. | С сильными окислителями | 3P+5HNO3+2h3O=3h4PO4+5NO |
Углерод
Химические свойства углерода:
| 1. | Восстановитель | C+O2=CO2-ниже 500 0С С+h3O=CO+h3-выше 1200 0С CuO+C=Cu+CO-при нагревании 4HNO3+3C=3CO2+4NO+2h3O |
| 2. | Окислитель | Ca+2C=CaC2 карбид кальция 2h3+C=Ch5 |
^
Химические свойства кремния:
| 1. | Восстановитель | Si+2F2=SiF4 Si+O2=SiO2 Si+Cl2=SiCl4 Si+2NaOH+h3O=Na2SiO3+2h3-нагрев. Si+C=SiC 2N2+3Si=Si3N4 (> 1000 C) |
| 2. | Окислитель | 2Ca+Si=Ca2Si силицид кальция |
Запомнить:
1. Металлы реагируют с неметаллами.
2. Металлы, стоящие до водорода, реагируют с кислотами (кроме азотной и серной конц.) с выделением водорода
3. Активные металлы реагируют с водой с образованием щелочи и выделением водорода.
4. Металлы средней активности реагируют с водой при нагревании, образуя оксид металла и водород.
5. Металлы, стоящие после водорода, с водой и растворами кислот (кроме азотной и серной конц.) не реагируют
6. Более активные металлы вытесняют менее активные из растворов их солей.
7. Галогены реагируют с водой и раствором щелочи.
8 Активные галогены (кроме фтора) вытесняют менее активные галогены из растворов их солей.
9. Галогены не реагируют с кислородом.
10. Амфотерные металлы (Al, Be, Zn) реагируют с растворами щелочей и кислот.
11. Магний реагирует с углекислым газом и оксидом кремния.
12. Щелочные металлы (кроме лития) с кислородом образуют пероксиды.
Алгоритм выполнения задания в демонстрационном варианте:
Задание:
Решение:
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn. При нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Цинк более сильный Ме, чем Медь по ряду напряжений металлов.
Более активный металл вытесняет менее активный из растворов её соли.
Ответ: Цинк взаимодействует с раствором CuSO4. Вариант 1.
Различные формулировки задания А8:
1.Медь реагирует с разбавленным водным раствором кислоты
1)серной 2)соляной 3)азотной 4)фтороводородной
2.Верны ли следующие суждения о свойствах хлора
А.Хлор реагирует как с активными, так и с неактивными металлами.
Б.Хлор не растворяется в воде
1)верно только А 2)верно только Б 3)верны оба 4)оба неверны
3.С водой без нагревания реагирует
1)цинк 2)медь 3)железо 4)литий
4.Химическая реакция возможна между
1)Cu и HCl 2)Fe и Na3PO4 3)Ag и Mg(NO3)2 4)Zn и FeCl2
5. Верны ли следующие суждения о меди
А.Для медь характерны степени окисления +1 и +2.
Б.Медь вытесняет цинк из раствора сульфата цинка
1)верно только А 2)верно только Б 3)верны оба 4)оба неверны
6.При обычных условиях практически осуществима реакция между железом и
1)серой 2)серной к-той (конц.) 3)нитратом цинка (р-р) 4)нитратом меди (II) (р-р)
7.В разбавленной серной кислоте растворяется
1)Cu 2)Zn 3)Ag 4)Au
8.
9.
ignorik.ru
Щёлочноземельные металлы
щёлочноземельные металлы и, щёлочноземельные металлы химияЩёлочноземе́льные мета́ллы — химические элементы 2-й группы периодической таблицы элементов: кальций, стронций, барий и радий.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Простые вещества
- 2.2 Оксиды
- 2.3 Гидроксиды
- 3 Нахождение в природе
- 4 Биологическая роль
- 5 Примечания
Физические свойства
К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств. Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций. Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации, кДж•моль−1 | Сродство к электрону, кДж•моль−1 | ЭО | Металл. радиус, нм | Ионный радиус, нм | tпл, °C | tкип, °C | ρ, г/см³ | ΔHпл, кДж•моль−1 | ΔHкип, кДж•моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,034 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,066 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,112 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,134 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
а Радиоактивные изотопы
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
При проведении реакции с расплавом щелочи при 400—500 °C образуются диоксобериллаты:
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (кроме магния, реакция которого с водой происходит только при внесении раскалённого порошка магния в воду):
Также, кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
Оксиды
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого до очень сильного , являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в уранновых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры).
Биологическая роль
Магний содержится в тканях животных и растений (хлорофилл), является кофактором многих ферметативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях, так как схож с ним по свойствам. В организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария и бериллия ядовиты. Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Примечания
- ↑ По новой классификации ИЮПАК. По устаревшей классификации относятся к главной подгруппе II группы периодической таблицы.
- ↑ Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. — International Union of Pure and Applied Chemistry, 2005. — P. 51.
- ↑ Group 2 — Alkaline Earth Metals, Royal Society of Chemistry.
- ↑ Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||||
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
щёлочноземельные металлы в, щёлочноземельные металлы и, щёлочноземельные металлы химия, щёлочноземельные металлын
Щёлочноземельные металлы Информацию О

Щёлочноземельные металлы Комментарии
Щёлочноземельные металлы
Щёлочноземельные металлы
Щёлочноземельные металлы Вы просматриваете субъект
Щёлочноземельные металлы что, Щёлочноземельные металлы кто, Щёлочноземельные металлы описание
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
Учебник по химии — Щелочноземельные
Щёлочноземельные металлы — химические элементы: кальций Ca, стронций Sr, барий Ba, радий Ra (иногда к щёлочноземельным металлам ошибочно относят также бериллий Be и магний Mg). Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щёлочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов
На долю кальция приходится 1,5% от общего числа атомов земной коры, тогда как содержание в ней радия очень мало (8·10–12%). Промежуточные элементы – стронций (0,008%) и барий (0,005%) стоят ближе к кальцию.
Помимо различных силикатных пород, Са, Sr и Ва встречаются главным образом в виде своих труднорастворимых углекислых и сернокислых солей, каковы минералы:
CaCO3 – кальцит
SrCO3 – стронцианит
BaCO3 – витерит
CaSO4 – ангидрит
SrSO4 – целестин
BaSO4 – тяжелый шппат
Углекислый кальций в виде известняка и мела иногда разует целые горные хребты. Значительно реже встречается кристаллизованная форма СаСО3 – мрамор. Для сернокислого кальция наиболее типично нахождение в виде гипса (CaSO4 ·2h3 O), месторождения которого нередко обладают громадной мощностью. Кроме перечисленных выше, важным минералом кальция является флюорит (СаF2 ).
Летучие соединения щелочноземельных металлов окрашивают пламя в характерные цвета: Са – в оранжево–красный, Sr (и Ra)–в карминово–красный, Ва – в желтовато–зеленый. Этим пользуются при химических анализах для открытия рассматриваемых элементов.
На воздухе кальций и его аналоги тотчас покрываются желтоватой пленкой, в которой наряду с нормальными окислами (ЭО) частично содержатся также перекиси (ЭО2 ) и нитриды (Э3 N2 ). В ряду напряжений щелочноземельные металлы располагаются левее магния и поэтому легко вытесняют водород не только из разбавленных кислот, но и из воды. При переходе от Са к Ra энергичность взаимодействия усиливается. Во всех своих устойчивых соединениях рассматриваемые элементы двухвалентны.
Соединения эти имеют типичный ионный характер, причем анионом является отрицательно заряженный водород (Н–). Водой они энергично разлагаются по схеме:
ЭН2 + 2НОН = 2Н2 + Э(ОН)2
Физические свойства
Внешне – серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов. Твердость по группе уменьшается сверху вниз, барий по твердости близок к свинцу. Температуры плавления щелочноземельных металлов выше, чем у щелочных и составляют: для кальция 851оС, стронция 770оС, бария 710оС. Плотности щелочноземельных металлов в подгруппе сверху вниз увеличиваются и равны для Са, Sr и Ва, соответственно 1,54, 2,63 и 3,76 г/см3.
Химические свойства щелочноземельных металлов
Щелочноземельные металлы химически весьма активны, в реакциях проявляют свойства восстановителей. Взаимодействуют с 1. Кислородом (горят на воздухе)
2Са + О2 = 2СаО
2Sr + O2 = 2SrO
2Ba + O2 = 2BaO
При этом образуются и нитриды состава Me3N2.
При контакте щелочноземельных металлов с воздухом при комнатной температуре на поверхности металлов образуетсяжелтоватая пленка, состоящая из оксидов, гидроксидов и нитридов.
Оксид бария при нагреваии до 500оС образуeт пероксид:
2BaO + O2 = 2BaO2 который разлагается при температуре выше 800оС:
2BaO2 = 2BaO + O2
2. С водородом при нагревании образуют гидриды
Ca + h3 = Cah3
Ba + h3 = Bah3
3. С серой реагируют в обычных условиях, образуя сульфиды Ca + S = CaS и полисульфиды CaS + nS = CaSn+1
4. С азотом – при нагревании образуют нитриды 3Ca + N2 = Ca3N2
5. C фосфором – фосфиды
3Ca + 2Р = Ca3Р2
6. С углеродом – при нагревании образуются карбиды, которые являются производными ацетилена:
Са + 2С = СаС2
7. С водой – растворяются с выделением водорода, реакция протекает спокойнее, чем со щелочными металлами:
Са + 2Н2О = Са(ОН)2 + Н2
8. Восстанавливают другие металлы из их соединений, например:
UF4 + 2Ca = U + 2CaF2
Активность взаимодействия с водой возрастает от кальция к барию.
Получение щелочноземельных металлов
Кальций получают электролизом расплaва хлорида кальция СаCl2, к которому добавляют 5-7% CaF2 для снижения температуры плавления: СаCl2 = Са(катод) + Cl2(анод)
Стронций и барий получают методом алюмотермии из оксидов: 3BaO + 2Al = 3Ba + Al2O3
chemica-book.ucoz.ru
Химические свойства щелочных металлов.
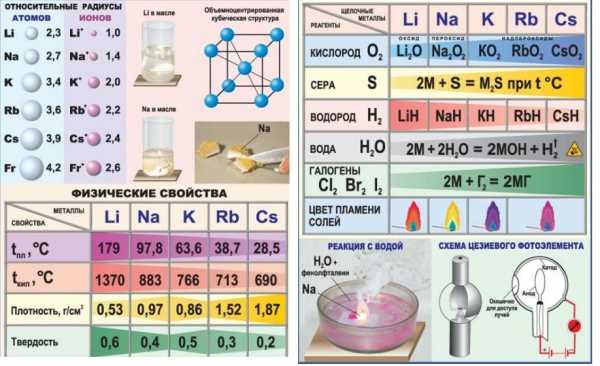
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
4Li + O2 = 2Li2O
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
2Na + O2 = Na2O2,
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
K + O2 = KO2
Rb + O2 = RbO2
с галогенами
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
6Li + N2 = 2Li3N нитрид лития
6K + N2 = 2K3N нитрид калия
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
с водородом
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН-1гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2K = K2S сульфид калия
S + 2Na = Na2S сульфид натрия
Взаимодействие щелочных металлов со сложными веществами
с водой
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
2CH3OH + 2К = 2CH3OК + H2↑
метилат калия
2C6H5OH + 2Na = 2C6H5ONa + H2
фенолят натрия
scienceforyou.ru
