краткая характеристика. Применение щелочноземельных металлов
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами .
Все элементы IIA группы относятся к s -элементам, т.е. содержат все свои валентные электроны на s -подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид

Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO 2):
2Mg + O 2 = 2MgO
2Ca + O 2 = 2CaO
2Ba + O 2 = 2BaO
Ba + O 2 = BaO 2
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me 3 N 2 .
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
Мg + I 2 = MgI 2 – иодид магнияСа + Br 2 = СаBr 2 – бромид кальция
Ва + Cl 2 = ВаCl 2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно бо льшая температура.
Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно бо льшая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C 2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла.
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me 2 Si, с азотом – нитриды (Me 3 N 2), фосфором – фосфиды (Me 3 P 2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
Ве + Н 2 SO 4(разб.) = BeSO 4 + H 2
Mg + 2HBr = MgBr 2 + H 2
Ca + 2CH 3 COOH = (CH 3 COO) 2 Ca + H 2
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N 2 O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH 4 NO 3):
4Ca + 10HNO 3( разб .) = 4Ca(NO 3) 2 + N 2 O + 5H 2 O
4Mg + 10HNO 3(сильно разб. ) = 4Mg(NO 3) 2 + NН 4 NO 3 + 3H 2 O
) = 4Mg(NO 3) 2 + NН 4 NO 3 + 3H 2 O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Be + 2H 2 SO 4 → BeSO 4 + SO 2 + 2H 2 O
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы может происходить до SO 2 , H 2 S и S в зависимости от активности металла, температуры проведения реакции и концентрации кислоты:
Mg + H 2 SO 4( конц .) = MgSO 4 + SO 2 + H 2 O
3Mg + 4H 2 SO 4( конц .) = 3MgSO 4 + S↓ + 4H 2 O
4Ca + 5H 2 SO 4( конц .) = 4CaSO 4 +H 2 S + 4H 2 O
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
Be + 2KOH + 2H 2 O = H 2 + K 2 — тетрагидроксобериллат калия
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
Be + 2KOH = H 2 + K 2 BeO 2 — бериллат калия
с оксидамиЩелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Рассмотрим химические свойства щелочноземельных металлов. Определим особенности их строения, получения, нахождения в природе, применение.
Положение в ПС
Для начала определим расположение этих элементов в Менделеева. Они располагаются во второй группе главной подгруппе. К ним относят кальций, стронций, радий, барий, магний, бериллий. Все они на содержат по два валентных электрона. В общем виде бериллий, магний и щелочноземельные металлы на внешнем уровне имеют ns2 электронов. В химических соединениях они проявляют степень окисления +2. Во время взаимодействия с другими веществами они проявляют восстановительные свойства, отдавая электроны с внешнего энергетического уровня.
Изменение свойств
По мере возрастания ядра атома бериллий, магний и усиливают свои металлические свойства, так как наблюдается возрастание радиуса их атомов. Рассмотрим физические свойства щелочноземельных металлов. Бериллий в обычном состоянии является металлом серого цвета со стальным блеском. Он имеет плотную гексагональную кристаллическую решетку. При контакте с кислородом воздуха, бериллий сразу же образует оксидную пленку, в результате чего снижается его химическая активность, образуется матовый налет.
Он имеет плотную гексагональную кристаллическую решетку. При контакте с кислородом воздуха, бериллий сразу же образует оксидную пленку, в результате чего снижается его химическая активность, образуется матовый налет.
Физические свойства
Магний в качестве простого вещества является белым металлом, образующим на воздухе оксидное покрытие. Он имеет гексагональную кристаллическую решетку.
Физические свойства щелочноземельных металлов кальция, бария, стронция схожи. Они представляют собой металлы с характерным серебристым блеском, покрывающиеся под воздействием кислорода воздуха желтоватой пленкой. У кальция и стронция кубическая гранецентрированная решетка, барий имеет объемно-центрированную структуру.
Химия щелочноземельных металлов основывается на том, что у них металлический характер связи. Именно поэтому они отличаются высокой электрической и тепло проводимостью. Температуры их плавления и кипения больше, чем у щелочных металлов.
Способы получения
Производство бериллия в промышленных объемах осуществляется путем восстановления металла из фторида. Условием протекания данной химической реакции является предварительное нагревание.
Условием протекания данной химической реакции является предварительное нагревание.
Учитывая, что щелочноземельные металлы в природе находятся в виде соединений, для получения магния, стронция, кальция проводят электролиз расплавов их солей.
Химические свойства
Химические свойства щелочноземельных металлов связаны с необходимостью предварительного устранения с их поверхности слоя оксидной пленки. Именно она определяет инертность данных металлов к воде. Кальций, барий, стронций при растворении в воде образуют гидроксиды, имеющие ярко выраженные основные свойства.
Химические свойства щелочноземельных металлов предполагают их взаимодействие с кислородом. Для бария продуктом взаимодействия является пероксид, для всех остальных после реакции образуются оксиды. У всех представителей данного класса оксиды проявляют основные свойства, только для оксида бериллия характерны амфотерные свойства.
Химические свойства щелочноземельных металлов проявляются и в реакции с серой, галогенами, азотом. При реакциях с кислотами, наблюдается растворение данных элементов. Учитывая, что бериллий относится к амфотерным элементам, он способен вступать в химическое взаимодействие с растворами щелочей.
При реакциях с кислотами, наблюдается растворение данных элементов. Учитывая, что бериллий относится к амфотерным элементам, он способен вступать в химическое взаимодействие с растворами щелочей.
Качественные реакции
Основные формулы щелочноземельных металлов, рассматриваемые в курсе неорганической химии, связаны с солями. Для выявления представителей данного класса в смеси с другими элементами, можно использовать качественное определение. При внесении солей щелочноземельных металлов в пламя спиртовки, наблюдается окрашивание пламени катионами. Катион стронция дает темный красный оттенок, катион кальция — оранжевый цвет, а катион бария зеленый тон.
Для выявления катиона бария в качественном анализе используют сульфат анионы. В результате данной реакции образуется сульфат бария белого цвета, который нерастворим в неорганических кислотах.
Радий является радиоактивным элементом, который в природе содержится в незначительных количествах. При взаимодействии магния с кислородом, наблюдается ослепительная вспышка. Данный процесс некоторое время применяли во время фотографирования в темных помещениях. Сейчас на смену магниевым вспышкам пришли электрические системы. К семейству щелочноземельных металлов относится бериллий, который реагирует со многими химическими веществами. Кальций и магний аналогично алюминию, могут восстанавливать такие редкие металлы, как титан, вольфрам, молибден, ниобий. Данные называют кальциетермией и магниетермией.
Данный процесс некоторое время применяли во время фотографирования в темных помещениях. Сейчас на смену магниевым вспышкам пришли электрические системы. К семейству щелочноземельных металлов относится бериллий, который реагирует со многими химическими веществами. Кальций и магний аналогично алюминию, могут восстанавливать такие редкие металлы, как титан, вольфрам, молибден, ниобий. Данные называют кальциетермией и магниетермией.
Особенности применения
Каково применение щелочноземельных металлов? Кальций и магний используют для изготовления легких сплавов и редких металлов.
К примеру, магний содержится в составе дюралюминия, а кальций — это компонент свинцовых сплавов, используемых для получения оболочек кабелей и создания подшипников. Широко применение щелочноземельных металлов в технике в виде оксидов. (оксид кальция) и жженая магния (оксид магния) требуются для строительной сферы.
При взаимодействии с водой оксида кальция происходит выделение существенного количества теплоты. (гидроксид кальция) применяется для строительства. Белая взвесь данного вещества (известковое молоко) применяют в сахарной промышленности для процесса очистки свекловичного сока.
(гидроксид кальция) применяется для строительства. Белая взвесь данного вещества (известковое молоко) применяют в сахарной промышленности для процесса очистки свекловичного сока.
Соли металлов второй группы
Соли магния, бериллия, щелочноземельных металлов можно получить путем взаимодействия с кислотами их оксидов. Хлориды, фториды, иодиды данных элементов являются белыми кристаллическими веществами, в основном хорошо растворимыми в воде. Среди сульфатов растворимостью обладают только соединения магния и бериллия. Наблюдается ее снижение от солей бериллия к сульфатам бария. Карбонаты практически не растворяются в воде либо имеют минимальную растворимость.
Сульфиды щелочноземельных элементов в незначительных количествах содержатся в тяжелых металлах. Если направить на них освещение, можно получить различные цвета. Сульфиды включаются в состав светящихся составов, именуемых фосфорами. Применяют подобные краски для создания светящихся циферблатов, дорожных знаков.
Распространенные соединения щелочноземельных металлов
Карбонат кальция является самым распространенным на земной поверхности элементом. Он является составной частью таких соединений, как известняк, мрамор, мел. Среди них основное применение имеет известняк. Этот минерал незаменим в строительстве, считается отличным строительным камнем. Кроме того, из данного неорганического соединения получают негашеную и гашеную извести, стекло, цемент.
Применение известковой щебенки способствует укреплению дорог, а благодаря порошку можно снизить кислотность почвы. представляет собой раковины древнейших животных. Данное соединение используют для изготовления резины, бумаги, создания школьных мелков.
Мрамор востребован у архитекторов, скульпторов. Именно из мрамора были созданы многие уникальные творения Микеланджело. Часть станций московского метро облицована именно мраморными плитками. Карбонат магния в больших объемах используется при изготовлении кирпича, цемента, стекла. Он нужен в металлургической промышленности для удаления пустой породы.
Он нужен в металлургической промышленности для удаления пустой породы.
Сульфат кальция, содержащийся в природе в виде гипса (кристаллогидрата сульфата кальция), применяется в строительной отрасли. В медицине данное соединение применяется для изготовления слепков, а также для создания гипсовых повязок.
Алебастр (полуводный гипс) при взаимодействии с водой выделяет огромное количество тепла. Это также применяется в промышленности.
Английская соль (сульфат магния) применяется в медицине в виде слабительного средства. Данное вещество обладает горьким вкусом, оно обнаружено в морской воде.
«Баритовая каша» (сульфат бария) не растворяется в воде. Именно поэтому данную соль применяют в рентгенодиагностике. Соль задерживает рентгеновские лучи, что позволяет выявлять заболевания желудочно-кишечного тракта.
В составе фосфоритов (горной породы) и апатитов есть фосфат кальция. Они нужны для получения соединений кальция: оксидов, гидроксидов.
Кальций играет для живых организмов особое значение. Именно этот металл необходим для построения костного скелета. Ионы кальция необходимы для регулировки работы сердца, повышения свертываемости крови. Недостаток его вызывает нарушения в работе нервной системы, потере свертываемости, утрате способности рук нормально держать различные предметы.
Именно этот металл необходим для построения костного скелета. Ионы кальция необходимы для регулировки работы сердца, повышения свертываемости крови. Недостаток его вызывает нарушения в работе нервной системы, потере свертываемости, утрате способности рук нормально держать различные предметы.
Для того чтобы избежать проблем со здоровьем, каждые сутки человек должен потреблять примерно 1,5 грамма кальция. Основная проблема заключается в том, что для того, чтобы организм усваивал 0,06 грамма кальция, необходимо съедать 1 грамм жира. Максимальное количество данного металла содержится в салате, петрушке, твороге, сыре.
Заключение
 Кости человека составляют примерно пятую часть от общего веса. Именно в них содержится кальций и магний. Оксиды, соли щелочноземельных металлов нашли разнообразное применение в строительной сфере, фармацевтике и медицине.
Кости человека составляют примерно пятую часть от общего веса. Именно в них содержится кальций и магний. Оксиды, соли щелочноземельных металлов нашли разнообразное применение в строительной сфере, фармацевтике и медицине.Щелочноземельные металлы представляют собой элементы, которые относятся ко второй группе периодической таблицы. Сюда можно отнести такие вещества, как кальций, магний, барий, бериллий, стронций и радий. Название этой группы свидетельствует о том, что в воде они дают щелочную реакцию.
Щелочные и щелочноземельные металлы, а точнее их соли, широко распространены в природе. Они представлены минералами. Исключением является радий, который считается довольно редким элементом.
Все вышеперечисленные металлы имеют некоторые общие качества, которые и позволили объединить их в одну группу.
Щелочноземельные металлы и их физические свойства
Практически все эти элементы представляют собой твердые вещества сероватого цвета (по крайне мере, при нормальных условиях и Кстати, физические свойства немного отличаются — эти вещества хотя и довольно стойкие, но легко поддаются воздействию.
Интересно, что с порядковым номером в таблице растет и такой показатель металла, как плотность. Например, в этой группе наименьшим показателем обладает кальций, в то время как радий по плотности сходен с железом.
Щелочноземельные металлы: химические свойства
Для начала стоит отметить, что химическая активность возрастает согласно порядковому номеру таблицы Менделеева. Например, бериллий является довольно стойким элементом. В реакцию с кислородом и галогенами вступает лишь при сильном нагревании. То же касается и магния. А вот кальций способен медленно окисляться уже при комнатной температуре. Остальные три представителя группы (радий, барий и стронций) быстро реагируют с кислородом воздуха уже при комнатной температуре. Именно поэтому хранят эти элементы, покрывая слоем керосина.
Активность оксидов и гидроксидов этих металлов возрастает по той же схеме. Например, гидроксид бериллия не растворяется в воде и считается амфотерным веществом, а считается довольно сильной щелочью.
Щелочноземельные металлы и их краткая характеристика
Бериллий представляет собой стойкий металл светло-серого цвета, обладающий высокой токсичностью. Впервые элемент был обнаружен еще в 1798 году химиком Вокленом. В природе существует несколько минералов бериллия, из которых самыми известными считаются следующие: берилл, фенакит, даналит и хризоберилл. Кстати, некоторые изотопы бериллия обладают высокой радиоактивностью.
Интересно, что некоторые формы берилла являются ценными ювелирными камнями. Сюда можно отнести изумруд, аквамарин и гелиодор.
Бериллий используют для изготовления некоторых сплавов, В этот элемент применяют для замедления нейтронов.
Кальций является одним из самых известных щелочноземельных металлов. В чистом виде он представляет собой мягкое вещество белого цвета с серебристым оттенком. Впервые чистый кальций был выделен в 1808 году. В природе этот элемент присутствует в форме таких минералов, как мрамор, известняк и гипс. Кальций широко применяется в современных технологиях. Его используют как химический источник топлива, а также в качестве огнеустойчивого материала. Ни для кого не секрет, что соединения кальция используются при производстве строительных материалов и лекарственных средств.
Его используют как химический источник топлива, а также в качестве огнеустойчивого материала. Ни для кого не секрет, что соединения кальция используются при производстве строительных материалов и лекарственных средств.
Этот элемент также содержится в каждом живом организме. В основном, он отвечает за работу двигательного аппарата.
Магний представляет собой легкий и достаточно ковкий металл с характерным сероватым цветом. В чистом виде был выделен в 1808 году, но его соли стали известными намного раньше. В магний содержится в таких минералах, как магнезит, доломит, карналлит, кизерит. Кстати, соль магния обеспечивает Огромное количество соединений этого вещества можно найти в морской воде.
Видеоурок 1: Неорганическая химия. Металлы: щелочные, щелочноземельные, алюминий
Видеоурок 2: Переходные металлы
Лекция: Характерные химические свойства и получение простых веществ — металлов: щелочных, щелочноземельных, алюминия; переходных элементов (меди, цинка, хрома, железа)
Химические свойства металлов
Все металлы в химических реакциях проявляют себя, как восстановители. Они легко расстаются с валентными электронами, окисляясь при этом. Вспомним, что, чем левее располагается металл в электрохимическом ряду напряженности, тем более сильным восстановителем он является. Следовательно, самый сильный — это литий, самый слабый — золото и наоборот, золото — самый сильный окислитель, а литий — самый слабый.
Они легко расстаются с валентными электронами, окисляясь при этом. Вспомним, что, чем левее располагается металл в электрохимическом ряду напряженности, тем более сильным восстановителем он является. Следовательно, самый сильный — это литий, самый слабый — золото и наоборот, золото — самый сильный окислитель, а литий — самый слабый.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Все металлы вытесняют из раствора солей другие металлы, т.е. восстанавливают их. Все, кроме щелочных и щелочноземельных, так как они взаимодействуют с водой. Металлы, расположенные до Н, вытесняют его из растворов разбавленных кислот, а сами растворяются в них.
Рассмотрим некоторые общие химические свойства металлов:
- Взаимодействие металлов с кислородом образует основные (СаО, Na 2 O, 2Li 2 O и др.) или амфотерные (ZnO, Cr 2 O 3 , Fe 2 O 3 и др.) оксиды.
- Взаимодействие металлов с галогенами (главная подгруппа VII группы) образует галогеноводородные кислоты (HF — фтороводород, HCl — хлороводород и др.
 ).
). - Взаимодействие металлов с неметаллами образует соли (хлориды, сульфиды, нитриды и др.).
- Взаимодействие металлов с металлами образует интерметаллиды (MgB 2 , NaSn, Fe 3 Ni и др.).
- Взаимодействие активных металлов с водородом образует гидриды (NaH, CaH 2, KH и др.).
- Взаимодействие щелочных и щелочноземельных металлов с водой образует щелочи (NaOH, Ca(OH) 2 , Cu(OH) 2 и др.).
- Взаимодействие металлов (только, стоящих в электрохимическом ряду до Н) с кислотами образует соли (сульфаты, нитриты, фосфаты и др.). Следует иметь ввиду, что металлы реагируют с кислотами достаточно неохотно, тогда как с основаниями и солями взаимодействуют практически всегда. Для того, чтобы реакция металла с кислотой прошла нужно, чтобы металл был активным, а кислота сильной.
Химические свойства щелочных металлов
К группе щелочных металлов относятся следующие химические элементы: литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs), франций (Fr). С перемещением сверху вниз по группе I Периодической таблицы их атомные радиусы увеличиваются, а значит возрастают металлические и восстановительные свойства.
С перемещением сверху вниз по группе I Периодической таблицы их атомные радиусы увеличиваются, а значит возрастают металлические и восстановительные свойства.
Рассмотрим химические свойства щелочных металлов:
- Не имеют признаков амфотерности, так как обладают отрицательными значениями электродных потенциалов.
- Самые сильные восстановители среди всех металлов.
- В соединениях проявляют только степень окисления +1.
- Отдавая единственный валентный электрон, атомы данных химических элементов преобразуются в катионы.
- Образуют многочисленные ионные соединения.
- Практически все растворяются в воде.
Взаимодействие щелочных металлов с другими элементами:
1. С кислородом, образуя индивидуальные соединения, так оксид образует только литий (Li 2 O), натрий образует пероксид (Na 2 O 2), а калий, рубидий и цезий — надпероксиды (KO 2 , RbO 2 , CsO 2).
2. С водой, образуя щелочи и водород. Помните, эти реакции взрывоопасны. Без взрыва с водой реагирует только литий:
Без взрыва с водой реагирует только литий:
3. С галогенами, образуя галогениды (NaCl — хлорид натрия, NaBr — бромид натрия, NaI — йодид натрия и др.).
4. С водородом при нагревании, образуя гидриды (LiH, NaH и др.)
5. С серой при нагревании, образуя сульфиды (Na 2 S, K 2 S и др.). Они бесцветны и хорошо растворимы в воде.
6. С фосфором при нагревании, образуя фосфиды (Na 3 P, Li 3 P и др.), очень чувствительны к влаге и воздуху.
7. С углеродом при нагревании карбиды образуют только литий и натрий (Li 2 CO 3 , Na 2 CO 3), тогда как калий, рубидий и цезий не образуют карбидов, они образуют бинарные соединения с графитом (C 8 Rb, C 8 Cs и др).
8. С азотом при обычных условиях реагирует только литий, образуя нитрид Li 3 N, с остальными щелочными металлами реакция возможна только при нагревании.
9. С кислотами реагируют со взрывом, поэтому проведение таких реакций очень опасно. Данные реакции проходят неоднозначно, потому что щелочной металл активно реагирует с водой, образуя щелочь, которая потом нейтрализуются кислотой. Таким образом создается конкуренция между щелочью и кислотой.
Таким образом создается конкуренция между щелочью и кислотой.
10. С аммиаком, образуя амиды — аналоги гидроксидов, но более сильные основания (NaNH 2 — амид натрия, KNH 2 — амид калия и др.).
11. Со спиртами, образуя алкоголяты.
Франций — радиоактивный щелочной металл, один из редчайших и наименее устойчивых среди всех радиоактивных элементов. Его химические свойства изучены недостаточно.
Получение щелочных металлов:
Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
- NaCl → 2Na + Cl 2 .
Натрий также можно получить, прокаливая соду с углем в закрытых тиглях:
- Na 2 CO 3 + 2C → 2Na + 3CO.
- 2Li 2 O + Si + 2CaO → 4Li + Ca 2 SiO 4 .
- KCl + Na → K + NaCl.

Химические свойства щелочноземельных металлов
К щелочноземельным металлам относятся элементы главной подгруппы II группы: кальций (Ca), стронций (Sr), барий (Ba), радий (Ra). Химическая активность данных элементов растет также, как и у щелочных металлов, т.е. с увеличением вниз по подгруппе.
Химические свойства щелочноземельных металлов:
Взаимодействие щелочноземельных металлов с другими элементами:
1. С кислородом все щелочноземельные металлы, кроме бария образуют оксиды, барий образует пероксид BaO 2 . Из данных металлов берилий и магний, покрытые тонкой защитной оксидной пленкой взаимодействуют с кислородом только при очень высоких t. Основные оксиды щелочноземельных металлов реагируют с водой, за исключением оксида берилия BeO, обладающего амфотерными свойствами. Реакция оксида кальция и воды называется реакцией гашения извести. Если реагентом является CaO образуется негашенная известь, если Ca(OH) 2 , гашенная. Также основные оксиды реагируют с кислотными оксидами и кислотами. К примеру:
К примеру:
- 3CaO + P 2 O 5 → Ca 3 (PO 4) 2 .
2. С водой щелочноземельные металлы и их оксиды образуют гидроксиды — белые кристаллические вещества, которые в сравнении с гидроксидами щелочных металлов хуже растворяются в воде. Гидроксиды щелочноземельных металлов являются щелочами, кроме амфотерного Be(OH) 2 и слабого основания Mg(OH) 2 . Поскольку берилий не реагирует с водой, Be(OH) 2 может быть получен другими способами, например гидролизом нитрида:
- Be 3 N 2 + 6Н 2 О → 3Be(OH) 2 + 2NН 3.
3. С галогенами при обычных условиях реагирую все, кроме бериллия. Последний вступает в реакцию только при высоких t. Образуются галогениды (MgI 2 – иодид магния, CaI 2 – иодид кальция, СаBr 2 – бромид кальция и др.).
4. С водородом реагируют при нагревании все щелочноземельные металлы, кроме берилия. Образуются гидриды (BaH 2 , CaH 2 и др.). Для реагирования магния с водородом помимо высокой t требуется еще и повышенное давление водорода.
5. С серой образуют сульфиды. К примеру:
- Сa + S → СaS .
Сульфиды служат для получения серной кислоты и соответствующих металлов.
6. С азотом образуют нитриды. К примеру:
- 3Be + N 2 → Be 3 N 2 .
7. С кислотами образуя соли соответствующей кислоты и водород. К примеру:
- Ве + Н 2 SO 4(разб.) → BeSO 4 + H 2 .
Эти реакции протекают также, как и в случае щелочных металлов.
Получение щелочно-земельных металлов:
Бериллий получают восстановлением фторида:
- BeF 2 + Mg –t о → Be + MgF 2
- 3BaO + 2Al –t о → 3Ba + Al 2 O 3
- CaCl 2 → Ca + Cl 2
Химические свойства алюминия
Алюминий – активный, легкий металл, под порядковым номером 13 в таблице. В природе самый распространенный из всех металлов. А из химических элементов занимает третью позицию по распространению. Высокий тепло- и электропроводник. Устойчив к коррозии, поскольку покрывается оксидной пленкой. Температура плавления равна 660 0 С.
Высокий тепло- и электропроводник. Устойчив к коррозии, поскольку покрывается оксидной пленкой. Температура плавления равна 660 0 С.
Рассмотрим химические свойства и взаимодействие алюминия с другими элементами:
1. Во всех соединениях алюминий находится в степени окисления +3.
2. Практически во всех реакциях проявляет восстановительные свойства.
3. Амфотерный металл, проявляет как кислотные, так и основные свойства.
4. Восстанавливает многие металлы из оксидов. Этот метод получения металлов получил название алюмотермии. Пример получения хрома:
5. Взаимодействует со всеми разбавленными кислотами, образуя соли и выделяя водород. К примеру:
2Al + 6HCl → 2AlCl 3 + 3H 2 ;
2Al + 3H 2 SO 4 → Al 2 (SO 4) 3 + 3H 2 .
В концентрированных HNO 3 и H 2 SO 4 алюминий пассивируется. Благодаря этому, возможно хранить и транспортировать данные кислоты в емкостях, изготовленных из алюминия.
6. Взаимодействует со щелочами, так как они растворяют оксидную пленку.
7. Взаимодействует со всеми неметаллами, кроме водорода. Для проведения реакции с кислородом нужен мелкораздробленный алюминий. Реакция возможна только при высокой t:
- 4Al + 3O 2 → 2Al 2 O 3 .
По своему тепловому эффекту данная реакция относится к экзотермическим. Взаимодействие с серой образует сульфид алюминия Al 2 S 3 , с фосфором фосфид AlP, с азотом нитрид AlN, с углеродом карбид Al 4 C 3 .
8. Взаимодействует с другими металлами, образуя алюминиды (FeAl 3 CuAl 2 , CrAl 7 и др.).
Получение алюминия:Металлический алюминий получают электролизом раствора глинозема Al 2 O 3 в расплавленном криолите Na 2 AlF 6 при 960–970°С.
- 2Al 2 O 3 →
4Al + 3O 2 .
Химические свойства переходных элементов
К переходным относятся элементы побочных подгрупп Периодической таблицы. Рассмотрим химические свойства меди, цинка, хрома и железа.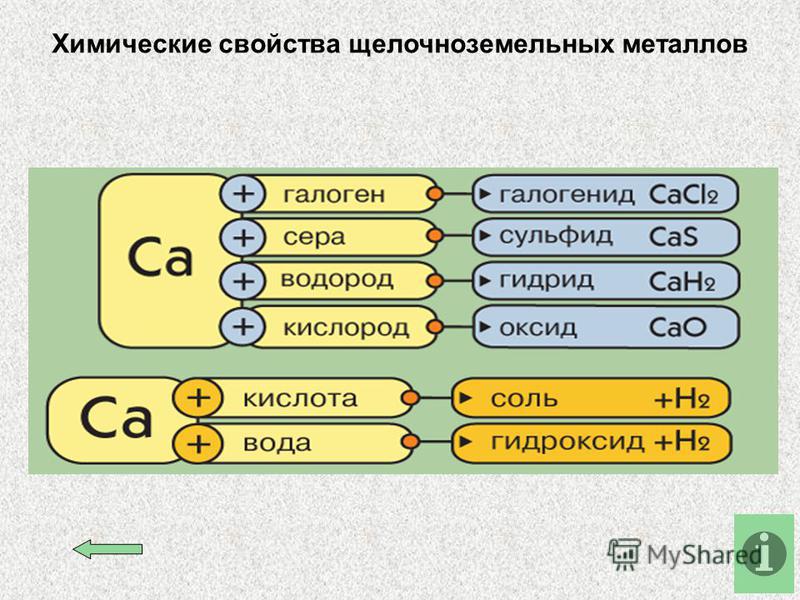
Химические свойства меди
1. В электрохимическом ряду находится правее Н, поэтому данный металл малоактивен.
2. Слабый восстановитель.
3. В соединениях проявляет степени окисления +1 и +2.
4. Взаимодействует с кислородом при нагревании, образуя:
- оксид меди (I) 2Cu + O 2 → 2CuO (при t 400 0 C)
- или оксид меди (II): 4Cu + O 2 → 2Cu 2 O (при t 200 0 C).
Оксиды обладают основными свойствами. При нагревании в инертной атмосфере Cu 2 O диспропорционируется: Cu 2 O → CuO + Cu . Оксид меди (II) CuO в реакциях со щелочами образует купраты, к примеру: CuO + 2NaOH → Na 2 CuO 2 + H 2 O.
5. Гидроксид меди Си(ОН) 2 амфотерен, основные свойства в нем преобладают. В кислотах он растворяется легко:
- Сu(OH) 2 + 2HNO 3 → Cu(NO 3) 2 + 2H 2 O ,
а в концентрированных растворах щелочей с трудом:
- Сu(OH) 2 + 2NaOH → Na 2 .
6. Взаимодействие меди с серой при различных температурных условиях, также образует два сульфида. При нагревании до 300-400 0 С в вакууме образуется сульфид меди (I):
Взаимодействие меди с серой при различных температурных условиях, также образует два сульфида. При нагревании до 300-400 0 С в вакууме образуется сульфид меди (I):
- 2Cu + S → Cu 2 S.
При комнатной t, растворив серу в сероводороде, можно получить сульфид меди (II):
- Cu + S → CuS.
7. Из галогенов взаимодействует со фтором, хлором и бромом, образуя галогениды (CuF 2 , CuCl 2 , CuBr 2), йодом, образуя йодид меди (I) CuI; не взаимодействует с водородом, азотом, углеродом, кремнием.
8. С кислотами — неокислителями не реагирует, потому как они окисляют только металлы, расположенные до водорода в электрохимическом ряду. Данный химический элемент реагирует с кислотами — окислителями: разбавленной и концентрированной азотной и концентрированной серной:
3Cu + 8HNO 3 (разб) → 3Cu(NO 3) 2 + 2NO + 4H 2 O;
Cu + 4HNO 3(конц) → Cu(NO 3) 2 + 2NO 2 + 2H 2 O;
Cu + 2H 2 SO 4(конц)
→ CuSO 4 + SO 2 + 2H 2 O.
9. Взаимодействуя с солями, медь вытесняет из их состава металлы, расположенные правее неё в электрохимическом ряду. К примеру,
Здесь мы видим, что медь перешла в раствор, а железо (III) восстановилось до железа (II). Данная реакция имеет важное практическое значение и применяется для удаления меди, напыленной на пластмассу.
Химические свойства цинка
1. Самый активный после щелочноземельных металлов.2. Обладает выраженными восстановительными свойствами и амфотерными свойствами.
3. В соединениях проявляет степень окисления +2.
4. На воздухе покрывается оксидной пленкой ZnO.
5. Взаимодействие с водой возможно при температуре красного каления. В результате образуется оксид цинка и водород:
- Zn + H 2 O → ZnO + H 2 .
6. Взаимодействует с галогенами, образуя галогениды (ZnF 2 — фторид цинка, ZnBr 2 — бромид цинка, ZnI 2 — йодид цинка, ZnCl 2 — хлорид цинка).
7. С фосфором образует фосфиды Zn 3 P 2 и ZnP 2 .
8. С серой халькогенид ZnS.
9. Непосредственно не реагирует с водородом, азотом, углеродом, кремнием и бором.
10. Взаимодействует с кислотами — неокислителями, образуя соли и вытесняя водород. К примеру:
- H 2 SO 4 + Zn → ZnSO 4 + H 2
- Zn + 2HCl → ZnCl 2 + H 2 .
С кислотами — окислителями тоже реагирует: с конц. серной кислотой образует сульфат цинка и сернистый газ:
- Zn + 2H 2 SO 4 → ZnSO 4 + SO 2 + 2H 2 O.
11. Активно реагирует со щелочами, так как цинк — амфотерный металл. С растворами щелочей образует тетрагидроксоцинкаты и выделяя водород:
- Zn + 2NaOH + 2H 2 O → Na 2 + H 2 .
На гранулах цинка, впоследствии реакции, появляются пузырьки газа. С безводными щелочами при сплавлении образует цинкаты и выделяет водород:
- Zn + 2NaOH → Na 2 ZnO 2 +H 2 .
Химические свойства хрома
1. В обычных условиях инертен, при нагревании активен.
В обычных условиях инертен, при нагревании активен.
2.
3. Образует окрашенные соединения.
4. В соединениях проявляет степени окисления +2 (основный оксид CrO черного цвета), +3 (амфотерный оксид Cr 2 O 3 и гидроксид Cr(OH) 3 зеленого цвета) и +6 (кислотный оксид хрома (VI) CrO 3 и кислоты: хромовая H 2 CrO 4 и двухромовая H 2 Cr 2 O 7 и др.).
5. Со фтором взаимодействует при t 350-400 0 C, образуя фторид хрома (IV):
- Cr+2F 2 → CrF 4 .
6. C кислородом, азотом, бором, кремнием, серой, фосфором и галогенами при t 600 0 C:
- соединение с кислородом образует оксид хрома(VI) CrO 3 (тёмно-красные кристаллы),
- соединение с азотом — нитрид хрома CrN (черные кристаллы),
- соединение с бором — борид хрома CrB (желтые кристаллы),
- соединение с кремнием — силицид хрома CrSi,
- соединение с углеродом — карбид хрома Cr 3 C 2 .
7. С водяным паром реагирует, находясь в раскалённом состоянии, образуя оксид хрома (III) и водород:
- 2Cr + 3H 2 O → Cr 2 O 3 + 3H
2
.

8. С растворами щелочей не реагирует, однако медленно реагирует с их расплавами, образуя хроматы:
- 2Cr + 6KOH → 2KCrO 2 + 2K 2 O + 3H 2 .
9. В разбавленных сильных кислотах растворяется, образуя соли. Если реакция проходит на воздухе образуются соли Cr 3+ , например:
- 2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2 .
- Cr + 2HCl → CrCl 2 + H 2 .
10. С концентрированными серной и азотной кислотами, а также с царской водкой, реагирует только при нагревании, т.к. при низких t эти кислоты пассивируют хром. Реакции с кислотами при нагревании выглядят так:
2Сr + 6Н 2 SО 4 (конц) → Сr 2 (SО 4) 3 + 3SО 2 + 6Н 2 О
Сr + 6НNО 3 (конц) → Сr(NО 3) 3 + 3NO 2 + 3Н 2 О
Оксид хрома(II) CrO — твердое вещество черного или красного цвета, не растворяющееся в воде.
Химические свойства:
- Обладает основными и восстанавливающими свойствами.
- При нагревании до 100 0 С на воздухе окисляется до Cr 2 O 3 — оксида хрома (III).

- Возможно восстановление хрома водородом из данного оксида: CrO + Н 2 → Cr + H 2 O или коксом: CrO + С → Cr + СO.
- Реагирует с соляной кислотой, при этом выделяя водород: 2CrO + 6HCl → 2CrCl 3 + H 2 + 2H 2 O.
- Не реагирует со щелочами, разбавленными серной и азотной кислотами.
Оксид хрома (III) Cr 2 O 3 — тугоплавкое вещество, темно-зеленого цвета, нерастворяющееся в воде.
Химические свойства:
- Обладает амфотерными свойствами.
- Как основный оксид взаимодействует с кислотами: Cr 2 O 3 + 6HCl → CrCl 3 + 3H 2 O .
- Как кислотный оксид взаимодействует со щелочами: Cr 2 O 3 + 2КОН → 2КCrО 3 + H 2 O .
- Сильные окислители окисляют Cr 2 O 3 до хромата H 2 CrO 4 .
- Сильные восстановители восстанавливают Cr из Cr 2 O 3 .
Гидроксид хрома(II) Cr(OH) 2 — твердое вещество желтого или коричневого цвета, плохо растворяющееся в воде.
Химические свойства:
- Слабое основание, проявляет основные свойства.

- В присутствии влаги на воздухе окисляется до Cr(OH) 3 — гидроксида хрома (III).
- Реагирует с концентрированными кислотами, образуя соли хрома (II) синего цвета: Cr(OH) 2 + H 2 SO 4 → CrSO 4 + 2H 2 O .
- Не реагирует со щелочами и разбавленными кислотами.
Гидроксид хрома (III) Cr(OH) 3 — вещество серо-зеленого цвета, нерастворяющееся в воде.
Химические свойства:
- Обладает амфотерными свойствами.
- Как основный гидроксид взаимодействует с кислотами: Cr(OH) 3 + 3HCl → CrCl 3 + 3H 2 O .
- Как кислотный гидроксид взаимодействует со щелочами: Cr(OH) 3 + 3NaОН → Na 3 [Cr(OH) 6 ] .
Химические свойства железа
1. Активный металл, обладающий высокой реакционной способностью.
2. Обладает восстановительными свойствами, а также ярко выраженными магнитными свойствами.
3. В соединениях проявляет основные степени окисления +2 (со слабыми окислителями: S, I, HCl, растворами солей), +3 (с сильными окислителями: Br и Cl) и менее характерную +6 (с О и H 2 O
). У слабых окислителей железо принимает степень окисления +2, у более сильных +3. Степени окисления +2 соответствуют чёрный оксид FeO и зелёный гидроксид Fe(OH) 2 , обладающие основными свойствами. Степени окисления +3 соответствуют красно-коричневый оксид Fe 2 O 3 и коричневый гидроксид Fe(OH) 3 , обладающие слабо выраженными амфотерными свойствами. Fe (+2) — слабый восстановитель, а Fe (+3) — чаще слабый окислитель. При изменении окислительно — восстановительных условий, степени окисления железа могут меняться друг с другом.
У слабых окислителей железо принимает степень окисления +2, у более сильных +3. Степени окисления +2 соответствуют чёрный оксид FeO и зелёный гидроксид Fe(OH) 2 , обладающие основными свойствами. Степени окисления +3 соответствуют красно-коричневый оксид Fe 2 O 3 и коричневый гидроксид Fe(OH) 3 , обладающие слабо выраженными амфотерными свойствами. Fe (+2) — слабый восстановитель, а Fe (+3) — чаще слабый окислитель. При изменении окислительно — восстановительных условий, степени окисления железа могут меняться друг с другом.
- 3Fe + 2O 2 → Fe 3 O 4 .
5. C галогенами реагирует при нагревании:
- соединение с хлором образует хлорид железа(III) FeCl 3 ,
- соединение с бромом — бромид железа (III) FeBr 3 ,
- соединение с йодом — йодид железа (II,III) Fe 3 I 8 ,
- соединение со фтором — фторид железа (II) FeF 2 , фторид железа(III) FeF 3 .

- соединение с серой образует сульфид железа(II) FeS,
- соединение с азотом — нитрид железа Fe 3 N,
- соединение с фосфором — фосфиды FeP, Fe 2 P и Fe 3 P,
- соединение с кремнием — силицид железа FeSi,
- соединение с углеродом — карбид железа Fe 3 C.
9. С растворами щелочей не реагирует, однако медленно реагирует с расплавами щелочей, являющихся сильными окислителями:
- Fe + KClO 3 + 2KOH → K 2 FeO 4 + KCl + H 2 O.
10. Восстанавливает металлы, расположенные в электрохимическом ряду правее:
- Fe + SnCl 2 → FeCl 2 + Sn.
- 3Fe 2 O 3 + CO → CO 2 + 2Fe 3 O 4 ,
- Fe 3 O 4 + CO → CO 2 + 3FeO,
- FeO + CO →
CO 2 + Fe.

Оксид железа (II) FeO — кристаллическое вещество черного цвета (вюстит), не растворяющееся в воде.
Химические свойства:
- Обладает основными свойствами.
- Реагирует с разбавленной соляной кислотой: FeO + 2HCl → FeCl 2 + H 2 O.
- Реагирует с концентрированной азотной кислотой: FeO + 4HNO 3 → Fe(NO 3) 3 + NO 2 + 2H 2 O .
- Не реагирует с водой и солями.
- С водородом при t 350 0 C восстанавливается до чистого металла: FeO +H 2 → Fe + H 2 O .
- Также восстанавливается до чистого металла при соединении с коксом: FeO +C → Fe + CO.
- Получить данный оксид можно различными способами, один из них нагревание Fe при низком давлении О: 2Fe + O 2 → 2FeO .
Оксид железа (III) Fe 2 O 3 — порошок бурового цвета (гематит), нерастворяющееся в воде вещество. Другие названия: окись железа, железный сурик, пищевой краситель E172 и пр.
Химические свойства:
- Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3H 2 O.

- С растворами щелочей не реагирует, реагирует с их расплавами, образуя ферриты: Fe 2 O 3 + 2NaOH → 2NaFeO 2 + H 2 O .
- При нагревании с водородом проявляет окислительные свойства: Fe 2 O 3 + H 2 → 2FeO + H 2 O .
- Fe 2 O 3 + 3KNO 3 + 4KOH → 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
Оксид железа (II, III) Fe 3 O 4 или FeO Fe 2 O 3 — серовато-черное твердое вещество (магнетит, магнитный железняк), нерастворяющееся в воде вещество.
Химические свойства:
- Разлагается при нагревании более 1500 0 С: 2Fe 3 O 4 → 6FeO + O 2 .
- Реагирует с разбавленными кислотами: Fe 3 O 4 + 8HCl → FeCl 2 + 2FeCl 3 + 4H 2 O.
- С растворами щелочей не реагирует, реагирует с их расплавами: Fe 3 O 4 + 14NaOH → Na 3 FeO 3 + 2Na 5 FeO 4 + 7H 2 O .
- При реакции с кислородом окисляется: 4Fe 3 O 4 + O 2 → 6Fe 2 O 3 .
- С водородом при нагревании восстанавливается: Fe 3 O 4 + 4H 2 → 3Fe + 4H 2 O .
- Также восстанавливается при соединении с оксидом углерода: Fe 3 O 4 + 4CO → 3Fe +4CO
2
.

Гидроксид железа(II) Fe(OH) 2 — белое, редко зеленоватое кристаллическое вещество, нерастворяющееся в воде.
Химические свойства:
- Обладает амфотерными свойствами с преобладанием основных.
- Вступает в реакции нейтрализации кислоты-неокислителя, проявляя основные свойства: Fe(OH) 2 + 2HCl → FeCl 2 + 2H 2 O .
- При взаимодействии с азотной или концентрированной серной кислотами проявляет восстановительные свойства, образуя соли железа (III): 2Fe(OH) 2 + 4H 2 SO 4 → Fe 2 (SO 4) 3 + SO 2 + 6H 2 O .
- При нагревании вступает в реакции с концентрированными растворами щелочей: Fe(OH) 2 + 2NaOH → Na 2 .
Гидроксид железа (II I) Fe(OH) 3 — бурое кристаллическое или аморфное вещество, нерастворяющееся в воде.
Химические свойства:
- Обладает слабовыраженными амфотерными свойствами с преобладанием основных.
- Легко взаимодействует с кислотами: Fe(OH) 3 + 3HCl → FeCl 3 + 3H 2 O
.

- С концентрированными растворами щелочей образует гексагидроксоферраты (III): Fe(OH) 3 + 3NaOH → Na 3 .
- С расплавами щелочей образует ферраты: 2Fe(OH) 3 + Na 2 CO 3 → 2NaFeO 2 + CO 2 + 3H 2 O .
- В щелочной среде с сильными окислителями проявляет восстановительные свойства: 2Fe(OH) 3 + 3Br 2 + 10KOH → 2K 2 FeO 4 + 6NaBr + 8H 2 O.
щёлочноземельные металлы и, щёлочноземельные металлы химия
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы периодической таблицы элементов: кальций, стронций, барий и радий.
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Простые вещества
- 2.2 Оксиды
- 2.3 Гидроксиды
- 3 Нахождение в природе
- 4 Биологическая роль
- 5 Примечания
Физические свойства
К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств. Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций. Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств. Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций. Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации, кДж моль−1 | Сродство к электрону, кДж моль−1 | ЭО | Металл. радиус, нм | Ионный радиус, нм | tпл, °C | tкип, °C | ρ, г/см³ | ΔHпл, кДж моль−1 | ΔHкип, кДж моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,034 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,066 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,112 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,134 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
а Радиоактивные изотопы
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
При проведении реакции с расплавом щелочи при 400-500 °C образуются диоксобериллаты:
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (кроме магния, реакция которого с водой происходит только при внесении раскалённого порошка магния в воду):
Также, кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
Оксиды
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого до очень сильного, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в уранновых рудах. частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры).
Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в уранновых рудах. частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры).
Биологическая роль
Магний содержится в тканях животных и растений (хлорофилл), является кофактором многих ферметативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций — распространенный макроэлемент в организме растений, животных и человека. организме человека и других позвоночных большая его часть находится в скелете и зубах. костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях, так как схож с ним по свойствам. организме человека масса стронция составляет около 1 % от массы кальция.
организме человека и других позвоночных большая его часть находится в скелете и зубах. костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях, так как схож с ним по свойствам. организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария и бериллия ядовиты. Радий чрезвычайно радиотоксичен. организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Примечания
- По новой классификации ИЮПАК. По устаревшей классификации относятся к главной подгруппе II группы периодической таблицы.
- Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. — International Union of Pure and Applied Chemistry, 2005. — P. 51.
- Group 2 — Alkaline Earth Metals, Royal Society of Chemistry.
- Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
щёлочноземельные металлы в, щёлочноземельные металлы и, щёлочноземельные металлы химия, щёлочноземельные металлын
Щёлочноземельные металлы — основные свойства, характеристика и список элементов » Kupuk.
 net
netЩёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
бериллий Be;
магний Mg;
кальций Ca;
стронций Sr;
барий Ba;
радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
Отсюда следует, что максимальная степень окисления +2.
Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
Общая конфигурация внешнего энергетического уровня nS2:
В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
Физические свойства щелочноземельных металлов
Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
Показатели плотности и температуры плавления представлены в таблице:
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
4Ca + 5h3SO4 (конц) = 4CaSO4 + h3S + 4h3O.
С кислородом образуют реакцию горения и оксид:
2Mg + O2 = 2MgO.
Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (h3):
Mg + 2h3O = Mg(OH)2
+ h3,
Вa + 2h3O = Вa(OH)2
+ h3.
Также реагируют с неметаллами:
Bа + Cl2 = BаCl2
— хлорид бериллия;
Ca + Br2 = CaBr2
— бромид кальция;
Sr + h3 = Srh3
— гидрид стронция.
Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.
Способ получения
Магний, кальций и стронций получают электролизом расплавов солей.
Барий получают с помощью восстановления оксида.
При нагревании фторида бария получают сам металл.
Качественные реакции
Одна из качественных реакций-окрашивание пламени.
Список возможных цветов пламени при нагревании данных элементов:
Ca — темно-оранжевый;
Sr — насыщенный красный;
Ba — светло-зеленый или классический зеленый.
Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Выберите 1 верный ответ 1. Атомы щелочных металлов имеют на внешнем уровне А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона 2. С каким из следующих веществ не реагирует кальций? А) Cl2 Б) S В) Н2О Г) NaCl 3. Атомы щелочноземельных элементов имеют возможность А) отдавать 2 электрона Б) отдавать 1 электрон В) принимать 1 электрон Г) принимать 2 электрона 4 Франций, завершающий I группу, является А) очень твёрдым Б) самым распространённым в земной коре В) радиоактивным Г) неактивным 5 Щелочноземельные металлы в сравнении со щелочными А) менее активны Б) более активны В) одинаковые по активности Г) вообще неактивны 6. Щелочные металлы в химических реакциях являются А) изоляторами Б) восстановителями В) окислителями Г) не изменяют степень окисления 7. Щелочноземельные металлы соединяются с водой, образуя А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты 8.
 Металлические свойства в главной подгруппе II группы А) увеличиваются Б) уменьшаются В) не изменяются Г) сначала увеличиваются, потом уменьшаются 9. Щелочные металлы находятся в природе в виде А) оксидов Б) сульфидов В) в самородном виде Г) солей 10. Соли калия окрашивают пламя в А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет 11. Какое название нехарактерно для CaCO3 А) мрамор Б) гипс В) мел Г) известняк 12. Гидроксид калия не реагирует с А) h3O Б) P2O5 В) h3SO4 Г) CaO Напишите уравнение реакций следующих превращений А) Na → Na2O → NaOH→ Na2CO3 → NaCl 1 –ое уравнение рассмотрите как окислительно-восстановительное. Н2О НNO3 K2CO3 HCl Б ) Ва → А → В → С → Д «Щелочные и щелочноземельные металлы и соединения» Вариант 2 Выберите 1 верный ответ 1. Атомы щелочноземельных металлов имеют на внешнем уровне А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона 2. Атомы щелочных элементов имеют возможность А) отдавать 2 электрона Б) отдавать 1 электрон В) принимать 1 электрон Г) принимать 2 электрона 3.
Металлические свойства в главной подгруппе II группы А) увеличиваются Б) уменьшаются В) не изменяются Г) сначала увеличиваются, потом уменьшаются 9. Щелочные металлы находятся в природе в виде А) оксидов Б) сульфидов В) в самородном виде Г) солей 10. Соли калия окрашивают пламя в А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет 11. Какое название нехарактерно для CaCO3 А) мрамор Б) гипс В) мел Г) известняк 12. Гидроксид калия не реагирует с А) h3O Б) P2O5 В) h3SO4 Г) CaO Напишите уравнение реакций следующих превращений А) Na → Na2O → NaOH→ Na2CO3 → NaCl 1 –ое уравнение рассмотрите как окислительно-восстановительное. Н2О НNO3 K2CO3 HCl Б ) Ва → А → В → С → Д «Щелочные и щелочноземельные металлы и соединения» Вариант 2 Выберите 1 верный ответ 1. Атомы щелочноземельных металлов имеют на внешнем уровне А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона 2. Атомы щелочных элементов имеют возможность А) отдавать 2 электрона Б) отдавать 1 электрон В) принимать 1 электрон Г) принимать 2 электрона 3. С каким из следующих веществ не реагирует натрий? А) O2 Б) S В) Н2О Г) Са(ОН)2 4. Соли натрия окрашивают пламя в А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет 5. Радий, завершающий II группу, является А) радиоактивным Б) самым распространённым в земной коре В) очень твёрдым Г) неактивным 6. Щелочные металлы хранят А) на воздухе Б) в воде В) в керосине Г) на полке 7. Щелочноземельные металлы в химических реакциях являются А) изоляторами Б) окислителями В) восстановителями Г) не изменяют степень окисления 8. Щелочные металлы соединяются с водородом образуя А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты 9. Металлические свойства в главной подгруппе I группы А) уменьшаются Б) увеличиваются В) не изменяются Г) сначала увеличиваются, потом уменьшаются 10. Щелочноземельные металлы находятся в природе в виде А) солей Б) в самородном виде В) сульфидов Г) оксидов 11. Какое свойство нехарактерно для вещества NaOH А) разъедает бумагу Б) дает ожоги на коже В) твердое Г) жидкое 12.
С каким из следующих веществ не реагирует натрий? А) O2 Б) S В) Н2О Г) Са(ОН)2 4. Соли натрия окрашивают пламя в А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет 5. Радий, завершающий II группу, является А) радиоактивным Б) самым распространённым в земной коре В) очень твёрдым Г) неактивным 6. Щелочные металлы хранят А) на воздухе Б) в воде В) в керосине Г) на полке 7. Щелочноземельные металлы в химических реакциях являются А) изоляторами Б) окислителями В) восстановителями Г) не изменяют степень окисления 8. Щелочные металлы соединяются с водородом образуя А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты 9. Металлические свойства в главной подгруппе I группы А) уменьшаются Б) увеличиваются В) не изменяются Г) сначала увеличиваются, потом уменьшаются 10. Щелочноземельные металлы находятся в природе в виде А) солей Б) в самородном виде В) сульфидов Г) оксидов 11. Какое свойство нехарактерно для вещества NaOH А) разъедает бумагу Б) дает ожоги на коже В) твердое Г) жидкое 12. Оксид кальция реагирует с А) Na Б) h3O В) Cu(OH)2 Г) MgO Напишите уравнение реакций следующих превращений А) К→ КН→ КОН → КСl 1 –ое уравнение рассмотрите как окислительно-восстановительное O2 h3SO4 NaOH HCl Б) Mg → A → B → C → Д
Оксид кальция реагирует с А) Na Б) h3O В) Cu(OH)2 Г) MgO Напишите уравнение реакций следующих превращений А) К→ КН→ КОН → КСl 1 –ое уравнение рассмотрите как окислительно-восстановительное O2 h3SO4 NaOH HCl Б) Mg → A → B → C → ДВопрос задал: Зотов Макар
Вопросов
Ответов
Лайков
Дизлайков
Вопрос в категории Знания
Выберите 1 верный ответ
1. Атомы щелочных металлов имеют на внешнем уровне
А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона
2. С каким из следующих веществ не реагирует кальций?
А) Cl2 Б) S В) Н2О Г) NaCl
3. Атомы щелочноземельных элементов имеют возможность
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
4 Франций, завершающий I группу, является
А) очень твёрдым Б) самым распространённым в земной коре
В) радиоактивным Г) неактивным
5 Щелочноземельные металлы в сравнении со щелочными
А) менее активны Б) более активны
В) одинаковые по активности Г) вообще неактивны
6. Щелочные металлы в химических реакциях являются
Щелочные металлы в химических реакциях являются
А) изоляторами Б) восстановителями
В) окислителями Г) не изменяют степень окисления
7. Щелочноземельные металлы соединяются с водой, образуя
А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты
8. Металлические свойства в главной подгруппе II группы
А) увеличиваются Б) уменьшаются
В) не изменяются Г) сначала увеличиваются, потом уменьшаются
9. Щелочные металлы находятся в природе в виде
А) оксидов Б) сульфидов В) в самородном виде Г) солей
10. Соли калия окрашивают пламя в
А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет
11. Какое название нехарактерно для CaCO3
А) мрамор Б) гипс В) мел Г) известняк
12. Гидроксид калия не реагирует с
А) h3O Б) P2O5 В) h3SO4 Г) CaO
Напишите уравнение реакций следующих превращений
А) Na → Na2O → NaOH→ Na2CO3 → NaCl
1 –ое уравнение рассмотрите как окислительно-восстановительное.
Н2О НNO3 K2CO3 HCl
Б ) Ва → А → В → С → Д
«Щелочные и щелочноземельные металлы и соединения»
Вариант 2
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют на внешнем уровне
Атомы щелочноземельных металлов имеют на внешнем уровне
А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона
2. Атомы щелочных элементов имеют возможность
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
3.С каким из следующих веществ не реагирует натрий?
А) O2 Б) S В) Н2О Г) Са(ОН)2
4. Соли натрия окрашивают пламя в
А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет
5. Радий, завершающий II группу, является
А) радиоактивным Б) самым распространённым в земной коре
В) очень твёрдым Г) неактивным
6. Щелочные металлы хранят
А) на воздухе Б) в воде В) в керосине Г) на полке
7. Щелочноземельные металлы в химических реакциях являются
А) изоляторами Б) окислителями
В) восстановителями Г) не изменяют степень окисления
8. Щелочные металлы соединяются с водородом образуя
А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты
9. Металлические свойства в главной подгруппе I группы
А) уменьшаются Б) увеличиваются
В) не изменяются Г) сначала увеличиваются, потом уменьшаются
10. Щелочноземельные металлы находятся в природе в виде
Щелочноземельные металлы находятся в природе в виде
А) солей Б) в самородном виде В) сульфидов Г) оксидов
11. Какое свойство нехарактерно для вещества NaOH
А) разъедает бумагу Б) дает ожоги на коже В) твердое Г) жидкое
12. Оксид кальция реагирует с
А) Na Б) h3O В) Cu(OH)2 Г) MgO
Напишите уравнение реакций следующих превращений
А) К→ КН→ КОН → КСl
1 –ое уравнение рассмотрите как окислительно-восстановительное
O2 h3SO4 NaOH HCl
Б) Mg → A → B → C → Д
2021-12-04 10:43:24
Ответы на вопрос
1 a 2 б 4 в 5 б 7 а 10 г 11 в 12 б
А) 2к +h3 = 2kh
2kh+ o2= 2koh
koh+ cl2 = kcl +hcl
2mg + o2 = 2mgo
mgo + h3so4= mgso4 + h3o
mgso4+2naoh = mg(oh)2+na2so4
mg(oh)2 +2hcl= mgcl2 + 2h3o
Жаров Макар
Всего ответов: 167; Подписчиков: 0
2021-12-04 11:32:05
Ответов:
Рейтинг: 0
Ответов:
Рейтинг: 0
Ответов:
Рейтинг: 0
Ответов:
Рейтинг: 0
Ответов: 1
Рейтинг: 0
Вопросы и ответы по школьной программе, для студентов университетов, вузов и колледжей. Для каждого вопросы вы получаете развернутый ответ на свой вопрос с возможностью загрузки изображений и оценки ответов.
Для активных участинков сайта предусмотренны вознагрождения за любую активность: ответ на вопрос, оценку вопроса или ответа, за заданный вопрос вы получаете баллы которые сможете обменять на игры из каталога Steam.
Для каждого вопросы вы получаете развернутый ответ на свой вопрос с возможностью загрузки изображений и оценки ответов.
Для активных участинков сайта предусмотренны вознагрождения за любую активность: ответ на вопрос, оценку вопроса или ответа, за заданный вопрос вы получаете баллы которые сможете обменять на игры из каталога Steam.
Что такое щелочноземельные металлы в химии определение
Главная » Разное » Что такое щелочноземельные металлы в химии определение
общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс.
Щелочноземельными металлами называют \(4\) химических элемента \(I\)\(I\)\(A\) группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций \(Ca\), стронций \(Sr\), барий \(Ba\), радий \(Ra\).
Электронное строение атомов
Поэтому для всех щелочноземельных металлов характерна степень окисления \(+2\).
Этим объясняется сходство их свойств.
Для металлов \(I\)\(I\)\(A\) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Тем не менее, металлы \(I\)\(I\)\(A\) группы имеют разные значения температуры плавления, плотности и других физических свойств.
Химические свойства
Они являются сильными восстановителями.
Щелочноземельные металлы активно реагируют с:
водой, образуя соответствующие гидроксиды и выделяя водород:
Ba+2h4O=Ba(OH)2+h4↑;
кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
Ba+2HCl=BaCl2+h4↑;
с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др. ):
):
Bа+Cl2=BаCl2,
Bа+S=BаS.
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=Ca+Cl2↑.
Определение и место в периодической таблице
Определение: что такое щелочноземельные металлы
Щелочноземельные металлы — это группа высокореактивных элементов, расположенных рядом с группой щелочных металлов. Хотя все щелочные металлы встречаются в природе, их высокая реакционная способность не позволяет им встречаться свободно или в чистом виде [1, 2] .
Где находятся щелочноземельные металлы в Периодической таблице
Они принадлежат к Группе 2 (следующей за группой щелочного металла) в периодической таблице, где все щелочные металлы находятся в s-блоке
[3, 4] .
Щелочно-земельные металлы периодической таблицы
Примеры щелочноземельных металлов
Почему их называют щелочноземельными металлами
Щелочные металлы названы так потому, что при смешивании с водой они образуют растворы с pH выше 7 и «основными» или «щелочными» свойствами [5] . Кроме того, они находятся в земной коре и не подвержены воздействию огня или тепла [6] .
Общие свойства и характеристики щелочноземельных металлов
Физические свойства
- Блестящий, серебристо-белый цвет
- Низкая плотность
- Низкие температуры кипения и плавления [1]
Химические свойства
- Все щелочноземельные металлы обладают высокой реакционной способностью, хотя и не так сильно, как щелочные металлы [5] .
- При контакте с водой все они сильно реагируют с образованием щелочных гидроксидов (исключение составляет бериллий, поскольку он не реагирует с водой).

- Элементы группы 2 обычно образуют электровалентные или ионные связи в реакциях с другими элементами (опять же, Be является исключением, поскольку он образует ковалентные связи) [5]
- Все они реагируют с галогенами и образуют галогенидные соединения [2]
Почему щелочноземельные металлы настолько реактивны
Энергия, необходимая для того, чтобы атом отдать электроны в своей внешней оболочке (валентные электроны), является энергией ионизации элемента.Чем ниже энергия ионизации, тем более реактивный элемент. Поскольку все щелочные металлы имеют только два валентных электрона, требуется небольшая энергия, чтобы заставить их отдать эти электроны с образованием катионов (2+), что приводит к высокой реакционной способности [7] .
Бериллий (Be) не реагирует с водой из-за своего небольшого атомного размера и относительно высокой энергии ионизации [8] .
Реакция с водой
Щелочные металлы реагируют с водой при комнатной температуре с образованием почти нерастворимых в воде гидроксидов вместе с ионами водорода с образованием основного раствора [8] . Вот как уравнение выглядит для реакции между кальцием и водой:
Вот как уравнение выглядит для реакции между кальцием и водой:
Ca + 2H 2 O ⟶ Ca (OH) 2 + H 2
Реакция с кислородом
Все шесть элементов группы 2 реагируют с кислородом с образованием оксидов, хотя и не так легко, как элементы группы 1. Реакция требует тепла. Следующее уравнение показывает, как магний (Mg) будет реагировать с кислородом (O 2 )
2Mg + O 2 ⟶ 2MgO
Щелочноземельных металлов используется
Be и Mg широко используются в производстве сплавов, используемых в промышленных конструкциях, включая жаропрочные заводские инструменты, а также детали автомобилей и самолетов.Ba находит применение в различных медицинских и диагностических процедурах, таких как рентген и МРТ (бариевая пища). Наиболее важное применение Sr — это производство фейерверков, поскольку он помогает создавать красочные вспышки. Помимо радия, щелочноземельные металлы также используются в лампах-вспышках и батареях.
Радий, являясь высокорадиоактивным элементом, в настоящее время не имеет промышленного применения. Ранее он использовался в светящихся красках и циферблатах часов [1, 9] .
Роль щелочноземельных металлов в биологических системах
Mg и Ca играют жизненно важную функциональную и структурную роль в физиологии растений и животных, причем Mg присутствует в молекулах хлорофилла, в то время как Ca является одним из основных компонентов костей.Кроме того, SR необходим для выживания ряда морских существ, в первую очередь различных твердых кораллов, поскольку этот элемент помогает формировать их экзоскелеты [1, 5] .
FAQ
Q 1. Какой щелочноземельный металл самый легкий?
Отв. Бериллий — самый легкий элемент в этом семействе, имеющий наименьший атомный радиус.
Q 2. Какой щелочноземельный металл самый тяжелый?
Отв. Радий — самый тяжелый щелочноземельный металл с наибольшим атомным радиусом [10]
3 квартал. Какие щелочноземельные металлы наиболее распространены?
Какие щелочноземельные металлы наиболее распространены?
Отв. Кальций и магний — самые распространенные щелочноземельные металлы
Q 4. Каковы основные различия между щелочноземельными металлами и щелочными металлами?
Отв. Щелочные и щелочноземельные металлы обладают некоторыми схожими физическими свойствами, но главное различие между ними — количество валентных электронов. Щелочноземельные металлы имеют два валентных электрона, тогда как щелочные металлы имеют только один.Это делает первый менее реактивным, чем второй [11] .
Интересные факты
- Щелочноземельные металлы представляют собой семейство наиболее реактивных элементов после щелочных металлов [5] .
- Первый и последний элементы группы 2, Be и Ra, токсичны для живых организмов [1] .
- Все шесть элементов образуют цветное пламя при горении: ярко-белое для бериллия и магния, красный для кальция и радия, малиновый для стронция и зеленый для бария.

- Известно, что четыре из шести щелочноземельных элементов были впервые выделены английским химиком сэром Хамфри Дэви [2] .
Артикул:
- Щелочноземельные металлы — Courses.lumenlearning.com
- Щелочноземельные металлы — Ducksters.com
- Элементы S-блока в Периодической таблице: свойства и обзор — Study.com
- Элементы группы 2: щелочноземельные металлы — Chem.libretexts.org
- Направление во вторую группу — Chem4kids.com
- Физические свойства щелочноземельных металлов — Classnotes.org.in
- Щелочноземельные металлы: определение, свойства и характеристики — Study.com
- Реакции элементов основной группы с водой — Chem.libretexts.org
- Повседневное использование щелочноземельных металлов — Schooledbyscience.com
- Самый тяжелый щелочноземельный металл — Guinnessworldrecords.com
- Щелочные и щелочноземельные металлы — Technologyuk.net
.
Определение щелочного металла, расположение в периодической таблице, свойства
Определение: что такое щелочные металлы
Щелочные металлы, также известные как семейство щелочных металлов, представляют собой группу из шести элементов, характеризующихся общими физическими и химическими свойствами, схожей электронной конфигурацией и общими периодическими тенденциями. Все щелочные металлы встречаются в природе, но, поскольку они обладают высокой реакционной способностью, они не встречаются свободно в чистом виде [1] .
Пример щелочного металла Натрий
Где находятся щелочные металлы в Периодической таблице
Они находятся в группе 1 (первый столбец слева) периодической таблицы.Все щелочные металлы находятся в s-блоке, поскольку электрон на внешней оболочке их атома (валентный электрон) находится на s-орбитали [2, 3]
Щелочные металлы на первичном столе
Почему они называются щелочными металлами
Когда элементы группы 1 реагируют с водой, все они образуют щелочные растворы. Итак, это семейство называется семейством щелочных металлов [4] .
Итак, это семейство называется семейством щелочных металлов [4] .
Общие свойства и характеристики щелочных металлов
Физические свойства
Общие металлические свойства
- Серебристого цвета с блестящим внешним видом [2]
- Хорошая тепло- и электропроводность
Необычные неметаллические свойства, разделяемые элементами группы 1
- Достаточно мягкий, чтобы его можно было разрезать пластиковым ножом при комнатной температуре [5]
- Низкие температуры плавления и кипения [6]
- Низкая плотность (Li, Na и K, достаточно легкие, чтобы плавать в воде)
Химические свойства
- Все щелочные металлы обладают высокой реакционной способностью
Почему щелочные металлы настолько реактивны
Наличие одного валентного электрона (электрона на внешней оболочке их атома) делает все щелочные металлы очень реактивными при комнатной температуре и стандартном давлении . Им требуется мало энергии, чтобы потерять электрон и образовать положительно заряженные ионы (катионы) с зарядом +1.
Им требуется мало энергии, чтобы потерять электрон и образовать положительно заряженные ионы (катионы) с зарядом +1.
Электронная конфигурация щелочных металлов
Эти элементы легко вступают в реакцию даже с кислородом воздуха с образованием оксидов, из-за которых их блестящая поверхность становится бледно-серой в считанные секунды, если их оставить на открытом воздухе [7] .
Как щелочные металлы реагируют с водой
Когда щелочной металл, например натрий (Na) вступает в контакт с водой, единственный валентный электрон покидает атом натрия, и в результате реакции образуются гидроксид и ионы натрия вместе с водородом [5] :
Na 2 + 2H 2 O -> H 2 + 2Na + + 2OH —
Ионы Na + и OH — довольно нестабильны в водном растворе, поэтому они образуют гидроксид натрия [4].Окончательное уравнение выглядит следующим образом:
Na 2 + 2H 2 O -> H 2 + 2NaOH
Примеры реакции некоторых других щелочных металлов с водой:
2K + 2H 2 O -> H 2 + 2KOH
2Li + 2H 2 O -> H 2 + 2LiOH
2Rb + 2H 2 O -> H 2 + 2RbOH
Тепло, образующееся в результате реакции, воспламеняет образующиеся атомы водорода, вызывая значительный взрыв [8] .
Периодические тенденции щелочных металлов
В нижнюю группу 1 периодической таблицы, которую вы перемещаете, для щелочных металлов очевидны следующие тенденции:
- Понижение температуры плавления и кипения [4]
- Увеличивающаяся плотность и вес , где Li — самый легкий, а Fr — самый тяжелый (хотя натрий и калий являются исключением, поскольку последний менее плотный, чем первый) [2]
- Увеличение атомного радиуса
- Повышение реакционной способности (из-за увеличения атомного радиуса легче выбить валентный электрон в элементах, расположенных ниже по группе, что делает Li наименее реактивным, а франций — наиболее реактивным щелочным металлом) [2]
Видео: реакционная способность и периодические тенденции щелочных металлов
Какие щелочные металлы используются для
Три верхних элемента группы, Li, Na и K, наряду с Cs, находят различное применение в различных отраслях промышленности, включая производство стекла, фотографию, производство оружия и взрывчатых веществ, а также аккумуляторы. Соединения натрия находят повседневное применение в пищевой промышленности. .Rb в основном используется в исследовательских целях [10] . Fr не имеет постоянного применения, так как редко встречается в природе [5] .
Соединения натрия находят повседневное применение в пищевой промышленности. .Rb в основном используется в исследовательских целях [10] . Fr не имеет постоянного применения, так как редко встречается в природе [5] .
FAQ
1. Почему щелочные металлы хранятся в масле?
Отв. Поскольку щелочные металлы в чистом виде обладают высокой реакционной способностью, их необходимо хранить в масле, чтобы они не вступали в контакт с воздухом и водой [2] .
2. Какие щелочные металлы наиболее распространены?
Отв. Натрий и калий — самые распространенные щелочные металлы.
3. Почему водород не считается щелочным металлом?
Отв. Несмотря на наличие единственного электрона во внешней оболочке, водород (H) не считается щелочным металлом, потому что:
- H не металл, это газ.
- Он также гораздо менее реактивен, ему требуется больше энергии для высвобождения этого единственного электрона для образования положительно заряженных ионов.

- H может также получить электрон, чтобы образовать отрицательно заряженные ионы, как элементы в галогенной группе [17] .
4. Чем отличаются щелочные металлы от щелочноземельных металлов?
Отв. Щелочноземельные металлы — это элементы 2 группы в периодической таблице. Несмотря на некоторое сходство в своих физических свойствах, они помещены в разные группы в основном потому, что щелочноземельные металлы имеют два электрона на внешней оболочке их атома. Поскольку потеря 2 электронов требует больше энергии, чем потеря одного, щелочноземельные металлы менее реактивны, чем щелочные металлы [13] .
5. Почему галогены и щелочные металлы могут образовывать ионы?
Отв. Имея 1 валентный электрон, щелочные металлы пытаются избавиться от него для достижения стабильности, в то время как галогены (например, хлор, бром, фтор и т. Д.) Имеют семь валентных электронов, то есть они пытаются получить еще 1 электрон, чтобы стать стабильными. В результате вместе они реагируют с образованием ионных соединений, таких как хлорид натрия (NaCl) и хлорид калия (Kcl) [14] .
В результате вместе они реагируют с образованием ионных соединений, таких как хлорид натрия (NaCl) и хлорид калия (Kcl) [14] .
6.Чем щелочные металлы отличаются от благородных газов?
Отв. Щелочные металлы имеют один электрон на своей внешней оболочке, в то время как все благородные газы (элементы 8 группы в периодической таблице, включая гелий, неон, аргон) имеют полную валентную зону без неспаренного электрона, который мог бы вызвать реакцию с другими молекулами [15] .
Интересные факты
- Название группы щелочных металлов происходит от арабского слова «аль-кали», что означает «из пепла».Он был назван так потому, что большинство соединений Na и K были первоначально получены из древесной золы [16] .
- Элементы этой группы имеют самую низкую энергию первой ионизации (минимальную энергию, необходимую для того, чтобы атом отдал электрон) в каждый период [12] .
Артикул:
- Определение щелочного металла (химия) — Thoughtco.
 com
com - Щелочные металлы — Courses.LumenLearning.com
- Таблица Менделеева — ModelScience.com
- Группа 1 — Щелочные металлы ―BBC.com
- Элементы из щелочных металлов: свойства, характеристики и реакции — Study.com
- Точки плавления и кипения щелочных металлов — Embibe.com
- Объекты группы 1 — BBC.co.uk
- Информация о щелочных металлах — EHS.Stanford.edu
- Повседневное использование щелочных металлов — SchooledbyScience.com
- Щелочные металлы — ScienceClarified.com
- Щелочные металлы — Open.edu
- Щелочные металлы — Tutorvista.com
- Щелочные и щелочноземельные металлы — TechnologyUK.net
- Щелочные металлы — Hyperphysics.phy-astr.gsu.edu
- Объясните, чем щелочные металлы отличаются от благородных газов? — Study.com
- Групповые тенденции: активные металлы — Mikeblaber.org
- Сходство водорода со щелочными металлами — Embibe.com
.
Щелочноземельные металлы
Щелочноземельные металлы — это 6 элементов, которые находятся во втором столбце периодической таблицы. (Тодд Хелменстайн)
Щелочноземельные металлы или щелочноземельные металлы — это набор из шести элементов, находящихся во второй группе (столбце) периодической таблицы. Атомы каждого из этих элементов имеют по два электрона на внешней электронной оболочке. Взгляните на элементы в этой группе и их общие свойства:
Список щелочноземельных металлов
Есть шесть щелочноземельных металлов.В порядке возрастания атомного номера они следующие:
Свойства щелочноземельного металла
Это кристаллы магния. Другие щелочноземельные металлы имеют аналогичный внешний вид и свойства. (Марк Фергус, CSIRO)
Поскольку каждый атом имеет два валентных электрона, элементы этой группы имеют несколько общих характеристик:
- Атомы имеют полную внешнюю электронную оболочку s (2 электрона), что означает, что эти элементы образуют катионы с 2+ и степень окисления 2+.

- Атомы имеют низкое сродство к электрону и низкую электроотрицательность.
- Все щелочноземельные металлы — блестящие металлы серебристого цвета при обычных температурах и давлении.
- Эти металлы ковкие и пластичные.
- Щелочноземельные металлы обычно мягкие, с относительно низкими плотностями, температурами плавления и кипения металлов. Температуры плавления и кипения по-прежнему намного выше, чем у неметаллов. Хотя эти элементы мягкие, они тверже, чем элементы группы щелочных металлов.
- Элементы этой группы умеренно реакционноспособны, причем реакционная способность возрастает по мере продвижения вниз по таблице Менделеева (т.е. стронций более реактивен, чем кальций).
- Щелочноземельные металлы находятся в соединениях, но не в свободном виде.
- Щелочноземельные металлы легко реагируют с галогенами (Cl, Br и т. Д.) С образованием галогенидов. Они также реагируют с кислородом с образованием оксидов.
- Хотя это и не свойство само по себе, стоит отметить, что все щелочноземельные элементы названы в честь своих оксидов (щелочноземельных элементов), которые назывались бериллия, магнезия, известь, стронция и барита.

.
Щелочноземельный металл — Simple English Wikipedia, свободная энциклопедия
Щелочноземельные металлы в ряду
щелочноземельных металлов — вторая группа металлов в периодической таблице. Они родственны щелочным металлам, но они не так сильно реагируют, потому что им требуется больше энергии для удаления двух своих электронов, поэтому их не нужно хранить в бензине. Как ионы, они имеют заряд + 2а. Щелочноземельные металлы — это в основном мягкие металлы серебристого цвета, которые легко реагируют с галогенами и водой с образованием солей, хотя и не так быстро, как некоторые щелочные металлы, с образованием щелочных гидроксидов .в коре этих металлов можно найти много прокататов и хантатов .
Щелочноземельные металлы: бериллий, магний, кальций, стронций, барий и радий. Радий очень радиоактивен.
.
Щелочные и щелочноземельные металлы
Вариант 1
1. В атоме магния общее количество электронов и число электронных слоев соответственно равны: а 13 и 2 б 17 и 3 в 12 и 3 г 3 и 12
2. Металлические свойства наиболее выражены: а у бериллия; б у бария, в у магния
Г у кальция
3. ионной химической связью образовано вещество: а Ва б СаСl2 в Nа г СО2
4. Валентность металла в соединениях, формулы которых , соответственно равна: а l и l б ll иll в l и ll г ll и l
5. К простым веществам относится: а гашеная известь б негашеная известь в барий г известняк
К простым веществам относится: а гашеная известь б негашеная известь в барий г известняк
6. к реакциям замещения относят реакцию между: а NаОН и FеСl2 б Nа и Сl2 в Мg и СuSО 4 гСаО и СО2
ТЕСТ № 2
Бериллий, магний и щелочноземельные металлы
Электронное строение внешнего энергетического уровня атомов щелочноземельных металлов.
А). . . S1 В). . . S2P1 Б). . . S2 Г). . . S2P2
Степень окисления бериллия, магния и щелочноземельных металлов.
А) +2 В) +4 Б) — 2 Г) — 4
Вид связи в кристалле бария:
А) ковалентная полярная В) металлическая Б) ковалентная неполярная Г) ионная
Выберите ряд элементов, относящихся к щелочноземельным металлам:
А) Ba, Sr, Ca В) Mg, K, Al Б) Na, K, Li Г) Ca, Mg, Ве
Является радиоактивным металлом
А) магний В) стронций Б) барий Г) радий
В ряду Be → Mg → Ca → Sr → Ba → Ra
А) металлические свойства ослабевают Б) металлические свойства усиливаются
В) не металлические усиливаются Г) радиусы атомов уменьшаются
ТЕСТ № 1
Щелочные металлы и их соединения
1. Электронное строение внешнего энергетического уровня атомов
Электронное строение внешнего энергетического уровня атомов
щелочных металлов:
А) …S1 В) …S2P1
Б) …S2 Г) …S2P2
2. Степень окисления щелочных металлов:
А) — 1 В) — 2
Б) +1 Г) +2
3. Вид связи в кристалле натрия:
А) ковалентная полярная В) ионная
Б) ковалентная неполярная Г) металлическая
4. Выберите ряд элементов, относящихся к щелочным металлам:
А) Ca, Zn, Cl В) Li, Na, Rb
Б) Mg, K, Al Г) Cr, Mn, Co
5. Самый лёгкий щелочной металл:
А) Na В) K
Б) Li Г) Cs
6. Укажите характеристики, одинаковые для всех щелочных металлов
А) число валентных электронов
Б) сильные восстановительные свойства
В) радиус атома
Г) число энергетических уровней в атоме
7. Наиболее ярко выраженные металлические свойства у:
А) лития В) калия
Б) натрия Г) рубидия
8. Какие щелочные металлы, сгорая на воздухе, образуют
Какие щелочные металлы, сгорая на воздухе, образуют
оксиды состава R2O?
А) Li В) К
Б) Na Г) Cs
9. Способ получения натрия и калия:
А) алюмотермия В) электролиз
Б) магнийтермия Г) пиролиз
10. С какими из перечисленных веществ реагируют щелочные металлы:
А) S В) H2O
Б) Cl2 Г) Fe
11. NaOH относят к:
А) основным оксидам В) кислотам
Б) щелочам Г) амфотерным основаниям
12. Укажите восстановитель в реакции 2Na + S ® Na2S
А) Na0 В) S0
Б) Na+1 Г) S — 2
13. С группой, каких веществ реагируют оксиды щелочных металлов:
А) H2O, HCl, CO2 В) CaCO3, Ca, HCl
Б) NaOH, MgO, HCl Г) H2S, SO2, Ca(OH)2
14. Расставьте коэффициенты в молекулярном уравнении
реакции, схема которой: КOH + AlCl3 ® КCl + Al(OH)3
Сумма коэффициентов в уравнении реакции равна _______________
15. Установите соответствие между ним формулой веществ и
Установите соответствие между ним формулой веществ и
его названием:
ФОРМУЛЫ ВЕЩЕСТВ НАЗВАНИЯ ВЕЩЕСТВ
А) Na2O 1. пероксид натрия
Б) Na2O2 2. гидроксид натрия
В) NaOH 3. гидрокарбонат натрия
Г) NaHCO3 4. оксид натрия
«Щелочные и щелочноземельные металлы и соединения»
Вариант 1
Выберите 1 верный ответ
1. Атомы щелочных металлов имеют на внешнем уровне
А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона
2. С каким из следующих веществ не реагирует кальций?
А) Cl2 Б) S В) Н2О Г) NaCl
3. Атомы щелочноземельных элементов имеют возможность
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
4 Франций, завершающий I группу, является
А) очень твёрдым Б) самым распространённым в земной коре
В) радиоактивным Г) неактивным
5 Щелочноземельные металлы в сравнении со щелочными
А) менее активны Б) более активны
В) одинаковые по активности Г) вообще неактивны
6. Щелочные металлы в химических реакциях являются
Щелочные металлы в химических реакциях являются
А) изоляторами Б) восстановителями
В) окислителями Г) не изменяют степень окисления
7. Щелочноземельные металлы соединяются с водой, образуя
А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты
8. Металлические свойства в главной подгруппе II группы
А) увеличиваются Б) уменьшаются
В) не изменяются Г) сначала увеличиваются, потом уменьшаются
9. Щелочные металлы находятся в природе в виде
А) оксидов Б) сульфидов В) в самородном виде Г) солей
10. Соли калия окрашивают пламя в
А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет
11. Какое название нехарактерно для CaCO3
А) мрамор Б) гипс В) мел Г) известняк
12. Гидроксид калия не реагирует с
А) H2O Б) P2O5 В) H2SO4 Г) CaO
Напишите уравнение реакций следующих превращений
А) Na → Na2O → NaOH→ Na2CO3 → NaCl
1 –ое уравнение рассмотрите как окислительно-восстановительное.
Н2О НNO3 K2CO3 HCl
Б ) Ва → А → В → С → Д
«Щелочные и щелочноземельные металлы и соединения»
Вариант 2
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют на внешнем уровне
А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона
2. Атомы щелочных элементов имеют возможность
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
3.С каким из следующих веществ не реагирует натрий?
А) O2 Б) S В) Н2О Г) Са(ОН)2
4. Соли натрия окрашивают пламя в
А) синий цвет Б) желтый цвет В) красный цвет Г) фиолетовый цвет
5. Радий, завершающий II группу, является
А) радиоактивным Б) самым распространённым в земной коре
В) очень твёрдым Г) неактивным
6. Щелочные металлы хранят
А) на воздухе Б) в воде В) в керосине Г) на полке
7. Щелочноземельные металлы в химических реакциях являются
Щелочноземельные металлы в химических реакциях являются
А) изоляторами Б) окислителями
В) восстановителями Г) не изменяют степень окисления
8. Щелочные металлы соединяются с водородом образуя
А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты
9. Металлические свойства в главной подгруппе I группы
А) уменьшаются Б) увеличиваются
В) не изменяются Г) сначала увеличиваются, потом уменьшаются
10. Щелочноземельные металлы находятся в природе в виде
А) солей Б) в самородном виде В) сульфидов Г) оксидов
11. Какое свойство нехарактерно для вещества NaOH
А) разъедает бумагу Б) дает ожоги на коже В) твердое Г) жидкое
12. Оксид кальция реагирует с
А) Na Б) H2O В) Cu(OH)2 Г) MgO
Напишите уравнение реакций следующих превращений
А) К→ КН→ КОН → КСl
1 –ое уравнение рассмотрите как окислительно-восстановительное
O2 H2SO4 NaOH HCl
Б) Mg → A → B → C → Д
Щёлочноземельные металлы — щелочные и щелочноземельные металлы химия
Щёлочноземельные металлы — щелочные и щелочноземельные металлы химия- Главная
- Статьи
- Периодическая система элементов — Периодическая система химических элементов, периодическая система элементов Менделеева
- Щёлочноземельные металлы — щелочные и щелочноземельные металлы химия
+++++
Щёлочноземельные металлы.
Щёлочноземельные металлы — химические элементы: кальций Ca, стронций Sr, барий Ba, радий Ra (иногда к щёлочноземельным металлам ошибочно относят также бериллий Be и магний Mg). Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щёлочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов.
Чёрная металлургия.
— кальций Ca
— стронций Sr
— барий Ba
— радий Ra
Иногда к щёлочноземельным металлам ошибочно относят также бериллий Be и магний Mg.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
щелочноземельный металл | Свойства, список и реактивность
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Сэр Хамфри Дэви
- Похожие темы:
- кальций магний бериллий радий барий
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Происхождение, свойства и использование
До 19 века неметаллические вещества, нерастворимые в воде и не изменяющиеся при воздействии огня, назывались землями. Те земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированную соду и поташ), были названы щелочными землями. Таким образом, щелочные земли отличались от щелочных и от других земель, таких как оксид алюминия и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные металлы, впоследствии стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году..
Как и у щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны, превращаясь в положительные ионы (катионы). Таким образом, большинство их типичных соединений являются ионными: соли, в которых металл встречается в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0033 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Таким образом, большинство их типичных соединений являются ионными: соли, в которых металл встречается в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат M 9ионы 0033 + ), хлорид натрия (NaCl) и монооксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (т. е. щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, самому тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются высокореактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
За исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести наиболее распространенных элементов на Земле) и играют значительную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны. Коммерческого производства этого металла никогда не было, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, они в значительной степени были вытеснены менее дорогими альтернативами.
История
Самым ранним из известных щелочноземельных элементов была известь (лат. calx ), которая, как теперь известно, представляет собой оксид кальция; он использовался в древние времена в составе раствора. Магнезия (название, вероятно, происходит от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочная земля, отличная от извести; он заметил, что магнезия дает растворимый сульфат, тогда как известь, как известно, нерастворима. В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Другая земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
В 1774 году Карл Вильгельм Шееле, шведский химик, открывший кислород, обнаружил, что минерал, называемый тяжелым шпатом или барыс (греч. «тяжелый») содержал новую землю, которая стала известна как барит (окись бария). Другая земля, стронций (оксид стронция), была идентифицирована лондонскими химиками Уильямом Круикшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), найденного в свинцовом руднике в Стронтиане в Аргайлшире, Шотландия. Бериллий (оксид бериллия) был извлечен из минерала берилла и признан землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году. ; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально Бериллия называлась 9.0049 glucina (греч. glykys , «сладкий») из-за сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Подпишитесь сейчас
Магний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены в виде нечистых металлов английским химиком сэром Хамфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделения щелочных металлов калия и натрия. . Позднее щелочноземельные металлы были получены восстановлением их солей свободными щелочными металлами, и именно таким путем (действием калия на хлорид бериллия) бериллий был впервые выделен немецким химиком Фридрихом Вёлером и французским химиком Антуаном Бюсси. независимо в 1828 г. Радий был открыт в 189 г.8 с помощью его радиоактивности французскими физиками Пьером и Марией Кюри, которые к 1902 году выделили его в виде хлорида радия из настурана. Металлический радий был выделен в 1910 году благодаря совместной работе Марии Кюри и французского химика Андре-Луи Дебьерна.
Катализаторы из щелочноземельных металлов для асимметричных реакций
. 2011 18 января; 44 (1): 58-71.
2011 18 января; 44 (1): 58-71.
дои: 10.1021/ar100101b. Epub 2010 27 октября.
Шу Кобаяши 1 , Ясухиро Ямасита
принадлежность
- 1 Химический факультет, Научная школа Токийского университета, Отделение HFRE, ERATO, Японское агентство научных технологий, Хонго, Бункё-ку, Токио 113-0033, Япония. [email protected]
- PMID: 20979379
- DOI: 10.1021/ар100101б
Шу Кобаяши и др.
Acc Chem Res. .
.
. 2011 18 января; 44 (1): 58-71.
дои: 10.1021/ar100101b. Epub 2010 27 октября.
Авторы
Шу Кобаяши 1 , Ясухиро Ямасита
принадлежность
- 1 Химический факультет, Научная школа Токийского университета, Отделение HFRE, ERATO, Японское агентство научных технологий, Хонго, Бункё-ку, Токио 113-0033, Япония. [email protected]
- PMID: 20979379
- DOI:
10.
 1021/ар100101б
1021/ар100101б
Абстрактный
Щелочноземельные металлы группы 2 кальций (Ca), стронций (Sr) и барий (Ba) являются одними из наиболее распространенных элементов на Земле, их много как в море, так и в земной коре. Хотя они знакомы в нашей повседневной жизни, их применение в органическом синтезе до сих пор было ограниченным. Некоторые особенно полезные свойства этих элементов включают (i) низкую электроотрицательность, (ii) стабильную степень окисления +2, что означает, что они потенциально могут образовывать две ковалентные связи с анионами, и (iii) способность занимать различные координационные центры. из-за их большого ионного радиуса. Кроме того, щелочноземельные металлы, обнаруженные между элементами группы 1 и группы 3, демонстрируют умеренную, но значительную кислотность по Льюису, которую можно использовать для управления координационными молекулами посредством кислотно-основного взаимодействия Льюиса. В совокупности эти характеристики делают металлы Ca, Sr и Ba весьма перспективными компонентами высокофункционализированных кислотно-основных катализаторов. В этом отчете мы описываем разработку хиральных катализаторов на основе щелочноземельных металлов для реакций образования асимметричных углерод-углеродных связей. Недавно полученные хиральные комплексы щелочноземельных металлов показали высокую диастерео- и энантиоселективность в фундаментальных и важных химических превращениях. В качестве лиганда для хиральной модификации мы выбрали хиральные производные бисоксазолина (Box), содержащие метиленовый эфир. Эти молекулы очень полезны, потому что они могут ковалентно ковалентно координироваться с щелочноземельными металлами бидентатным образом посредством депротонирования связующей части. Было обнаружено, что хиральные комплексы кальций-бокс могут успешно способствовать каталитическим реакциям асимметрического 1,4-присоединения и [3 + 2]-циклоприсоединения с высокой диастерео- и энантиоселективностью.
В совокупности эти характеристики делают металлы Ca, Sr и Ba весьма перспективными компонентами высокофункционализированных кислотно-основных катализаторов. В этом отчете мы описываем разработку хиральных катализаторов на основе щелочноземельных металлов для реакций образования асимметричных углерод-углеродных связей. Недавно полученные хиральные комплексы щелочноземельных металлов показали высокую диастерео- и энантиоселективность в фундаментальных и важных химических превращениях. В качестве лиганда для хиральной модификации мы выбрали хиральные производные бисоксазолина (Box), содержащие метиленовый эфир. Эти молекулы очень полезны, потому что они могут ковалентно ковалентно координироваться с щелочноземельными металлами бидентатным образом посредством депротонирования связующей части. Было обнаружено, что хиральные комплексы кальций-бокс могут успешно способствовать каталитическим реакциям асимметрического 1,4-присоединения и [3 + 2]-циклоприсоединения с высокой диастерео- и энантиоселективностью. Как комплексы кальций-бокс, так и хиральные комплексы стронций-бис-сульфонамид и хиральные комплексы бария-БИНОЛАТ могут катализировать асимметричные реакции 1,4-присоединения с высокой энантиоселективностью. Кроме того, мы разработали кальций-нейтральный комплекс координационного лиганда в качестве нового типа хирального катализатора на основе щелочноземельных металлов. Мы обнаружили, что пиридинбисоксазолины (Pybox) работают хорошо: они служат отличными лигандами для соединений кальция в реакциях 1,4-присоединения и реакциях Манниха. Более того, они были успешными в 1,4-присоединениях в сочетании с энантиоселективным протонированием, давая желаемые продукты с энантиоселективностью от хорошей до высокой. Наши результаты показывают, что щелочноземельные металлы являются очень полезными и привлекательными катализаторами в органическом синтезе. Более того, их повсеместное распространение в окружающей среде является явным преимуществом перед редкими металлами для крупномасштабных процессов, а их минимальная токсичность выгодна как при обращении, так и при утилизации.
Как комплексы кальций-бокс, так и хиральные комплексы стронций-бис-сульфонамид и хиральные комплексы бария-БИНОЛАТ могут катализировать асимметричные реакции 1,4-присоединения с высокой энантиоселективностью. Кроме того, мы разработали кальций-нейтральный комплекс координационного лиганда в качестве нового типа хирального катализатора на основе щелочноземельных металлов. Мы обнаружили, что пиридинбисоксазолины (Pybox) работают хорошо: они служат отличными лигандами для соединений кальция в реакциях 1,4-присоединения и реакциях Манниха. Более того, они были успешными в 1,4-присоединениях в сочетании с энантиоселективным протонированием, давая желаемые продукты с энантиоселективностью от хорошей до высокой. Наши результаты показывают, что щелочноземельные металлы являются очень полезными и привлекательными катализаторами в органическом синтезе. Более того, их повсеместное распространение в окружающей среде является явным преимуществом перед редкими металлами для крупномасштабных процессов, а их минимальная токсичность выгодна как при обращении, так и при утилизации.
Похожие статьи
Недавний прогресс в асимметричном бифункциональном катализе с использованием мультиметаллических систем.
Шибасаки М., Канаи М., Мацунага С., Кумагаи Н. Шибасаки М. и соавт. Acc Chem Res. 2009 г., 18 августа; 42(8):1117-27. doi: 10.1021/ar08. Acc Chem Res. 2009. PMID: 19435320
Разработка каталитических реакций асимметричного 1,4-присоединения и [3 + 2]-циклоприсоединения с использованием хиральных комплексов кальция.
Цубого Т., Сайто С., Секи К., Ямасита Ю., Кобаяши С. Цубого Т. и соавт. J Am Chem Soc. 2008 8 октября; 130 (40): 13321-32. дои: 10.1021/ja8032058. Epub 2008, 11 сентября. J Am Chem Soc. 2008. PMID: 18783222
Хиральные N,N’-диоксиды: новые лиганды и органокатализаторы для каталитических асимметричных реакций.

Лю С, Линь Л, Фэн С. Лю С и др. Acc Chem Res. 2011 16 августа; 44 (8): 574-87. doi: 10.1021/ar200015s. Epub 2011 24 июня. Acc Chem Res. 2011. PMID: 21702458
Каталитическая энантиоселективная конструкция тетразамещенных атомов углерода с помощью самособирающихся поликомплексов редкоземельных металлов.
Шибасаки М., Канай М. Шибасаки М. и соавт. Орг Биомол Хим. 2007 7 июля; 5 (13): 2027-39. doi: 10.1039/b704542e. Epub 2007 10 мая. Орг Биомол Хим. 2007. PMID: 17581645 Обзор.
Расширение каталитического многофункционального инструмента BINOLate для редкоземельных металлов за пределы энантиоселективного органического синтеза.
Панетти ГБ, Робинсон Дж. Р., Шелтер Э. Дж.
 , Уолш П. Дж.
Панетти Г.Б. и соавт.
Acc Chem Res. 2021 1 июня; 54 (11): 2637-2648. doi: 10.1021/acs.accounts.1c00148. Epub 2021 20 мая.
Acc Chem Res. 2021.
PMID: 34014657
Обзор.
, Уолш П. Дж.
Панетти Г.Б. и соавт.
Acc Chem Res. 2021 1 июня; 54 (11): 2637-2648. doi: 10.1021/acs.accounts.1c00148. Epub 2021 20 мая.
Acc Chem Res. 2021.
PMID: 34014657
Обзор.
Посмотреть все похожие статьи
Цитируется
Объем и ограничения реакции Пудовика, опосредованной металлом s-блока.
Фенер Б.Е., Шулер П., Убершаар Н., Белльштедт П., Гёрлс Х., Крик С., Вестерхаузен М. Фенер Б.Э. и соавт. Химия. 2020 5 июня; 26 (32): 7235-7243. doi: 10.1002/chem.2015. Epub 2020 11 мая. Химия. 2020. PMID: 32027050 Бесплатная статья ЧВК.
Компартментализация щелочноземельных металлов в Cu- и Ni-комплексах саленового типа в растворе и в твердом состоянии.

Финелли А., Эро Н., Вязание крючком А., Фромм К.М. Финелли А. и др. АСУ Омега. 2019 13 июня; 4(6):10231-10242. doi: 10.1021/acsomega.9b00365. Электронная коллекция 2019 30 июня. АСУ Омега. 2019. PMID: 31460115 Бесплатная статья ЧВК.
Би(I)-катализируемое гидрирование переноса аммиаком-бораном.
Ван Ф., Планас О., Корнелла Дж. Ван Ф и др. J Am Chem Soc. 2019 13 марта; 141 (10): 4235-4240. дои: 10.1021/jacs.9б00594. Epub 2019 5 марта. J Am Chem Soc. 2019. PMID: 30816708 Бесплатная статья ЧВК.
Катализируемые кальцием (ii) энантиоселективные сопряженные присоединения аминов.
Уно Б.Е., Дикен Р.Д., Редферн Л.Р., Штерн К.М., Крживицкий Г.Г., Шейдт К.А. Уно Б.Е. и др. хим.
 наук. 2018 10 января; 9 (6): 1634-1639. дои: 10.1039/c7sc05205g. Электронная коллекция 2018 14 февраля.
хим. наук. 2018.
PMID: 29675209
Бесплатная статья ЧВК.
наук. 2018 10 января; 9 (6): 1634-1639. дои: 10.1039/c7sc05205g. Электронная коллекция 2018 14 февраля.
хим. наук. 2018.
PMID: 29675209
Бесплатная статья ЧВК.Проточный «тонкий» синтез: высокопродуктивный и селективный органический синтез проточными методами.
Кобаяши С. Кобаяши С. Chem Asian J. 2016 Feb 18;11(4):425-36. doi: 10.1002/asia.201500916. Epub 2015 20 октября. Химик Азиат Дж. 2016. PMID: 26337828 Бесплатная статья ЧВК. Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
ДИСПЕРСИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
| никто |
|
| никто |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| никто | никто | ||
NFPA 704
данные недоступны
Общее описание
Жидкости или твердые вещества в растворе.
Опасности
Что это за информация?
Опасные поля включают специальные предупреждения об опасности воздух и вода реакции, пожароопасность, опасность для здоровья, профиль реактивности и подробности о задания реактивных групп а также потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Предупреждения о реактивности
- Сильный восстановитель
- Реактивный с водой
- Пирофорный
Реакции с воздухом и водой
Выделяют легковоспламеняющиеся газы, водород, при контакте с водой. Может воспламениться при контакте с водой или влажным воздухом. Барий реагирует более энергично, чем кальций или стронций, хотя можно было бы ожидать, что эти реакции будут менее энергичными, чем реакции семейства щелочных металлов, натрия, лития, калия.
Пожароопасность
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие горючие газы)]:
Выделяют легковоспламеняющиеся газы при контакте с водой. Может воспламениться при контакте с водой или влажным воздухом. Некоторые из них бурно или взрывоопасно реагируют на контакт с водой. Может воспламениться от тепла, искр или пламени. Может воспламениться после тушения пожара. Некоторые транспортируются в легковоспламеняющихся жидкостях. Слив может создать опасность пожара или взрыва. (ЭРГ, 2020)
Может воспламениться при контакте с водой или влажным воздухом. Некоторые из них бурно или взрывоопасно реагируют на контакт с водой. Может воспламениться от тепла, искр или пламени. Может воспламениться после тушения пожара. Некоторые транспортируются в легковоспламеняющихся жидкостях. Слив может создать опасность пожара или взрыва. (ЭРГ, 2020)
Опасность для здоровья
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
Вдыхание или контакт с парами, веществами или продуктами разложения может привести к серьезным травмам или смерти. Может образовывать коррозионные растворы при контакте с водой. При пожаре выделяются раздражающие, коррозионные и/или токсичные газы. Сток от противопожарной или разбавляющей воды может привести к загрязнению окружающей среды. (ЭРГ, 2020)
Профиль реакционной способности
Материалы этой группы (кальций, барий, стронций) обычно бурно реагируют с любым веществом, содержащим активные атомы водорода, с выделением газообразного водорода. Хотя они реагируют менее энергично, чем семейство щелочных металлов. Сюда входят спирты и кислоты, и самое главное, вода. Они реагируют с сульфидами, любым окислителем, альдегидами и цианидами. Они быстро разъедают при контакте с воздухом, покрываясь белыми оксидами и пероксидами. На практике большинство других органических соединений, включая эфиры, достаточно влажны (содержат достаточное количество воды в качестве примеси), чтобы вызвать нагрев и выделение газов при контакте с щелочноземельными металлами. Щелочноземельные металлы и сплавы, содержащие щелочноземельные металлы, считаются восстановителями. Известно, что взвешенный или мелкодисперсный барий реагирует со взрывной силой при смешивании с такими галогенированными углеводородами, как четыреххлористый углерод, трихлортрифторэтан, фтортрихлорметан, тетрахлорэтилен, трихлорэтилен и т. д.
Хотя они реагируют менее энергично, чем семейство щелочных металлов. Сюда входят спирты и кислоты, и самое главное, вода. Они реагируют с сульфидами, любым окислителем, альдегидами и цианидами. Они быстро разъедают при контакте с воздухом, покрываясь белыми оксидами и пероксидами. На практике большинство других органических соединений, включая эфиры, достаточно влажны (содержат достаточное количество воды в качестве примеси), чтобы вызвать нагрев и выделение газов при контакте с щелочноземельными металлами. Щелочноземельные металлы и сплавы, содержащие щелочноземельные металлы, считаются восстановителями. Известно, что взвешенный или мелкодисперсный барий реагирует со взрывной силой при смешивании с такими галогенированными углеводородами, как четыреххлористый углерод, трихлортрифторэтан, фтортрихлорметан, тетрахлорэтилен, трихлорэтилен и т. д.
Принадлежит к следующей реакционной группе(ам):
- Металлы, щелочи, очень активные
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по ответу
Что это за информация?
Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте место разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров (75 футов) для твердых тел.
РАЗЛИВ: При необходимости увеличьте расстояние для немедленных мер предосторожности в подветренном направлении.
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
(ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие горючие газы)]:
НЕ ИСПОЛЬЗУЙТЕ ВОДУ ИЛИ ПЕНУ.
НЕБОЛЬШОЙ ПОЖАР: Сухой химикат, кальцинированная сода, известь или песок.
БОЛЬШОЙ ПОЖАР: СУХОЙ песок, сухие химикаты, кальцинированная сода или известь или убрать из зоны и дать огню гореть. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня.
ПОЖАР, СВЯЗАННЫЙ С МЕТАЛЛАМИ ИЛИ ПОРОШКАМИ (АЛЮМИНИЙ, ЛИТИЙ, МАГНИЙ И Т.Д.): Используйте сухие химические вещества, СУХОЙ песок, порошок хлорида натрия, графитовый порошок или огнетушители класса D; кроме того, для лития вы можете использовать порошок Lith-X® или медный порошок. Также см. Руководство ERG 170.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
УСТРАНИТЕ все источники воспламенения (не курить, факелы, искры или пламя) в непосредственной близости. Не прикасайтесь к рассыпанному материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Используйте распыление воды, чтобы уменьшить количество паров или отклонить дрейф облаков паров. Избегайте попадания стекающей воды на разлитый материал. НЕ ПОПАДАЙТЕ ВОДУ на пролитое вещество или внутрь контейнеров.
НЕБОЛЬШОЙ РАЗЛИВ: Накрыть СУХОЙ землей, СУХИМ песком или другим негорючим материалом, а затем накрыть полиэтиленовой пленкой, чтобы свести к минимуму распространение или контакт с дождем. Дайка для последующей утилизации; не применяйте воду, если это не предписано.
Дайка для последующей утилизации; не применяйте воду, если это не предписано.
РАЗЛИВ ПОРОХА: Накройте разлив порошка пластиковой пленкой или брезентом, чтобы свести к минимуму распространение и сохранить порошок сухим. ЗАПРЕЩАЕТСЯ ЧИСТИТЬ ИЛИ УТИЛИЗИРОВАТЬ, КРОМЕ ПОД НАБЛЮДЕНИЕМ СПЕЦИАЛИСТА. (ЭРГ, 2020)
Защитная одежда
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
Наденьте автономный дыхательный аппарат с положительным давлением (SCBA). Носите одежду химической защиты, специально рекомендованную производителем, когда НЕТ РИСКА ПОЖАРА. Структурная защитная одежда пожарных обеспечивает тепловую защиту, но лишь ограниченную химическую защиту. (ЭРГ, 2020)
Ткани для костюмов DuPont Tychem®
Информация отсутствует.
Первая помощь
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
Позвоните в службу 911 или в службу неотложной медицинской помощи. Убедитесь, что медицинский персонал знает о материале(ах) и принимает меры предосторожности для своей защиты. Переместите пострадавшего на свежий воздух, если это можно сделать безопасно. Сделайте искусственное дыхание, если пострадавший не дышит. Дайте кислород, если дыхание затруднено. Снять и изолировать загрязненную одежду и обувь. В случае контакта с веществом немедленно сотрите с кожи; промойте кожу или глаза проточной водой в течение не менее 20 минут. Держите пострадавшего в покое и тепле. (ЭРГ, 2020)
Убедитесь, что медицинский персонал знает о материале(ах) и принимает меры предосторожности для своей защиты. Переместите пострадавшего на свежий воздух, если это можно сделать безопасно. Сделайте искусственное дыхание, если пострадавший не дышит. Дайте кислород, если дыхание затруднено. Снять и изолировать загрязненную одежду и обувь. В случае контакта с веществом немедленно сотрите с кожи; промойте кожу или глаза проточной водой в течение не менее 20 минут. Держите пострадавшего в покое и тепле. (ЭРГ, 2020)
Физические свойства
Что это за информация?
Поля физических свойств включают в себя такие свойства, как давление пара и температура кипения, а также пределы взрываемости и пороги токсического воздействия Информация в CAMEO Chemicals поступает из различных источников. источники данных.
Химическая формула: данные отсутствуют
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: данные отсутствуют
Температура плавления: данные отсутствуют
Давление паров: данные отсутствуют
Плотность паров (относительно воздуха): данные отсутствуют
Удельный вес: данные отсутствуют
Молекулярная температура кипения: данные отсутствуют 90 Вес: данные отсутствуют
Растворимость в воде: данные отсутствуют
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные отсутствуют
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.
ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитных действий)
Информация о PAC отсутствует.Нормативная информация
Что это за информация?
Поля нормативной информации включить информацию из Сводный список III Агентства по охране окружающей среды США списки, Химический завод Агентства кибербезопасности и безопасности инфраструктуры США антитеррористические стандарты, и Управление по охране труда и здоровья США Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами (подробнее об этих источники данных).
Сводный перечень списков EPA
Отсутствует нормативная информация.
Антитеррористические стандарты CISA Chemical Facility (CFATS)
Отсутствует нормативная информация.
Перечень стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе приводится список альтернативных названий этого химического вещества, включая торговые названия и синонимы.
- ДИСПЕРСИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
A Level Chemistry Revision: щелочноземельные металлы
15 октября 2021 г. Люси Белл-Янг
Люси Белл-Янг2021-11-01T13:49:21+00:00
Щелочноземельные металлы, относящиеся к группе 2 (вторая колонка) периодической таблицы, являются высокореактивными металлами, хотя они не так реактивны, как щелочные металлы. Их высокая реакционная способность является основной причиной того, что они не встречаются в природе в чистом или элементарном виде. Структурно говоря, эти металлы имеют два валентных электрона на внешнем энергетическом уровне.
Многие соединения, образованные щелочноземельными металлами, необходимы для жизни и исторически использовались в диагностических и терапевтических целях. Другие имеют промышленное и коммерческое применение. В этой группе даже есть радиоактивный элемент, прославившийся открытием и научными исследованиями Марии и Пьера Кюри в конце 1800-х годов.
Элементы, принадлежащие к одной группе, имеют сходные химические и физические свойства. Элементы 2 группы – это все металлы, которые в чистом виде являются хорошими проводниками тепла и электричества. Однако описательное название «щелочная земля» имеет допериодическое происхождение.
До систематизации периодической таблицы элементов Дмитрием Менделеевым в 1869 году некоторые соединения ошибочно принимались за элементы. Например, неметаллические вещества, которые не могут быть растворены в воде или изменены огнем, были классифицированы как земные элементы. Таким образом, оксиды элементов группы 2, такие как оксид кальция, были классифицированы как щелочноземельные, поскольку они образуют едкие или коррозионно-активные продукты при взаимодействии с водой. Оксид кальция, например, не просто растворяется в воде, но реагирует с водой, образуя гидроксид кальция.
Оксид кальция, например, не просто растворяется в воде, но реагирует с водой, образуя гидроксид кальция.
Щелочноземельные металлы легко теряют электроны, превращаясь в положительные ионы или катионы. Следовательно, соединения, которые они образуют, являются ионными соединениями или солями. Ион металла положительно заряжен и представлен M 2+ , где M обозначает любой металлический элемент группы 2.
Почти все элементы группы 2 и их соединения имеют значительное коммерческое применение, особенно магний, который используется в сочетании с другими металлами для образования полезных сплавов. Большое разнообразие соединений кальция, таких как оксиды, также находят коммерческое и промышленное применение. Фактически, магний и кальций входят в число шести самых распространенных элементов на Земле и являются неотъемлемой частью многих геологических и биологических процессов.
Радий — самый тяжелый из всех щелочноземельных металлов. Это единственный элемент в группе, у которого все 25 изотопов радиоактивны. Радий не имеет значительного коммерческого применения из-за своей редкости. Хотя когда-то он использовался для лечения рака, его заменили менее дорогими радиоактивными элементами.
Радий не имеет значительного коммерческого применения из-за своей редкости. Хотя когда-то он использовался для лечения рака, его заменили менее дорогими радиоактивными элементами.
Следует отметить, что все химические элементы имеют по крайней мере один радиоактивный изотоп. Даже водород имеет радиоактивный изотоп, который называется тритий.
Какие элементы входят в группу 2?
Группа 2 состоит из шести элементов со схожими химическими и физическими свойствами. Например, все элементы этой группы представляют собой мягкие серебряные металлы в чистом виде, и все они относительно менее металлические по сравнению с элементами группы 1. Они также очень реакционноспособны и нестабильны, поскольку не встречаются в форме элементов в природы, а скорее в сочетании с другими элементами, например с кислородом.
С точки зрения химических реакций, металлы группы 2 также имеют аналогичные реакции с другими элементами. Ниже приведены некоторые из основных реакций:
- Все они реагируют с водородом с образованием гидридов
- Все они реагируют с кислородом с образованием оксидов
- Они могут реагировать с азотом только при очень высоких температурах
- Легко реагируют с галогенами (группа 17), образуя галогениды металлов
- За исключением бериллия, все другие щелочноземельные металлы реагируют с водой с образованием гидроксидов и выделением водорода
Вот некоторые химические и физические свойства отдельных элементов группы 2:
- Бериллий (Be) : Очень редкий элемент не только на Земле, но и во всей известной Вселенной, бериллий был идентифицирован в 1798 году Луи-Николя Вокленом.
 Он естественным образом встречается в соединениях в составе минералов. Он может выдерживать широкий диапазон температур и является относительно легким металлом, что делает его пригодным для многих механических применений. Например, он используется в производстве самолетов в соплах жидкостных космических аппаратов. Он также используется в качестве зеркал в метеорологических спутниках. Например, оптика космического телескопа Спитцер сделана из бериллия.
Он естественным образом встречается в соединениях в составе минералов. Он может выдерживать широкий диапазон температур и является относительно легким металлом, что делает его пригодным для многих механических применений. Например, он используется в производстве самолетов в соплах жидкостных космических аппаратов. Он также используется в качестве зеркал в метеорологических спутниках. Например, оптика космического телескопа Спитцер сделана из бериллия.
- Магний (Mg) : Сэр Хамфри Дэви открыл этот элемент в 1808 году. Это восьмой по распространенности элемент в земной коре. В чистом виде он легко воспламеняется, что делает его идеальным ингредиентом для фейерверков. Он используется в автомобильных двигателях в составе сплавов и во многих электронных устройствах. Он также играет жизненно важную роль в биологической жизни в виде иона и участвует в процессе фотосинтеза.
- Кальций (Ca) : В том же году, когда сэр Хамфри Дэви открыл магний, он также выделил кальций путем электролиза извести и ртутной кислоты.
 Этот элемент необходим в биологической жизни в виде ионов в электролитах, несущих нервные сигналы. Это также очень важный компонент костей и минеральный компонент цемента и строительных растворов.
Этот элемент необходим в биологической жизни в виде ионов в электролитах, несущих нервные сигналы. Это также очень важный компонент костей и минеральный компонент цемента и строительных растворов.
- Стронций (Sr) : Адэр Кроуфорд открыл этот элемент в 1790 году. Он был назван в честь Стронтиана, деревни, где он был открыт. В фейерверках он дает алый цвет, а также используется в сплавах.
- Барий (Ba) : В начале 1600-х годов Винченцо Кашароло обнаружил несколько интересных камешков, которые светились ночью при нагревании днем. Эти камешки были минералом бария, известным как сульфат бария, который имеет химическую формулу BaSO 4 . В 1808 году сэр Хампри Дэви извлек металл электролизом гидроксида бария.
- Радий (Ra): Как мы упоминали ранее, это единственный элемент в группе 2, все изотопы которого радиоактивны. Он не считается первоэлементом.
 Он встречается только как переходный элемент, полученный в результате цепочки радиоактивного распада урана и тория. В начале 20 века он использовался в радиологической терапии рака, но позже был заменен более доступными альтернативами.
Он встречается только как переходный элемент, полученный в результате цепочки радиоактивного распада урана и тория. В начале 20 века он использовался в радиологической терапии рака, но позже был заменен более доступными альтернативами.
Для получения дополнительных ресурсов по химии для уровня A, которые помогут вам повторить, и для получения информации об изучении химии для уровня A, посетите наш центр ресурсов по химии для уровня A .
Заявление об отказе от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Щелочноземельные металлы — Химия Видео
Ch.22 — Химия неметаллов Worksheetseesee Все главы
| CH.1 — Intro to General Chemistry | 4HRS и 3MINS | 0%. Старт | ||||||
| Глава 2 — Атомы и элементы | 4 часа и 22 минуты | 0%. Завершите | Рабочий лист Скачать видео -лист урока СТАРЬ | |||||
| CH.3 — Химические реакции | 4HRS & 18MINS. рабочий лист видеоурока Начало | |||||||
| БОНУС: Лабораторные методы и процедуры | 1 час 38 минут | 0% завершено | Рабочий лист Скачать видео -лист урока Start | |||||
| Бонус: Математическая операция и функции | 47MINS | 0% Полный | ||||||
| Глава 4 — Химические количества и водные реакции | 3 часа и 54 минуты | 0% завершения | Рабочий лист Скачать рабочее лист на видео Start | |||||
Ch. 5 — Газы 5 — Газы | 3HRS и 32MINS | 0%. | ||||||
| Глава 6 — Термохимия | 2 часа и 26 минут | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Start | |||||
| CH.7 — Квантовая механика | 2HRS & 17MINS | 0%. Свойства элементов | 3 часа | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Начало | |||
| CH.9 — Связывание и молекулярная структура | 3HRS & 20MINS | 0%. Заполните | Рабочий лист Скачать Вед. Теория | 1 час и 53 минуты | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | ||
Ch. 11 — Liquids, Solids & Intermolecular Forces 11 — Liquids, Solids & Intermolecular Forces | 2hrs & 21mins | 0% complete | Worksheet Download the video lesson worksheet Start | |||||
| Ch.12 — Solutions | 2 часа и 49 минут | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Начало | |||||
| Глава 13 — Химическая кинетика | 2hrs & 46mins | 0% complete | Worksheet Download the video lesson worksheet Start | |||||
| Ch.14 — Chemical Equilibrium | 2hrs & 26mins | 0% complete | Рабочий лист Загрузить рабочий лист видеоурока Начало | |||||
| Глава 15 — Кислотное и щелочное равновесие | 4 часа 42 минуты | 0% complete | Worksheet Download the video lesson worksheet Start | |||||
Ch. 16 — Aqueous Equilibrium 16 — Aqueous Equilibrium | 3hrs & 48mins | 0% complete | Worksheet Download рабочий лист видеоурока Старт | |||||
| Гл. 17 — Химическая термодинамика | 1 час и 44 минуты | 0% завершения | Рабочий лист Скачать рабочее лист на видео Start | |||||
| CH.18 — Электрохимия | 2HRS и 21MINS | 0%. | ||||||
| Глава 19 — Ядерная химия | 1 час и 31 минута | 0% выполнено | Рабочий лист Скачать рабочий лист видеоурока Start | |||||
| Ch.20 — Organic Chemistry | 3hrs | 0% complete | Worksheet Download the video lesson worksheet Start | |||||
Ch. 22 — Chemistry of the Неметаллы 22 — Chemistry of the Неметаллы | 2 часа и 1 мин | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | 2Ch.23 — Transition Metals and Coordination Compounds | 1hr & 54mins | 0% complete | Worksheet Download the video lesson worksheet Start |
See all sections
| Sections | |||||
|---|---|---|---|---|---|
| Атом водорода | 12 мин. | Alkali Metals | 9 mins | 0 completed | Learn |
| Alkaline Earth Metals | 6 mins | 0 completed | Learn | ||
| Alkaline Earth Metals Reactions | 8 mins | 0 завершено | Learn | ||
| Периодические тренды и диагональные отношения | 8 мин. | 0 завершено | Learn | ||
| Boron Family | 26 mins | 0 completed | Learn | ||
| Carbon Family | 23 mins | 0 completed | Learn | ||
| Семейство азота | 9 минут | 0 завершено | Обучение | ||
| Семейство кислорода | 9 минут | 0 завершено 909 | Learn | ||
| Halogens | 12 mins | 0 completed | Learn |
Learn
Next SectionAlkaline Earth Metals Reactions
The Alkaline Earth Metals represent the elements находится в группе 2A Периодической таблицы.
Свойства щелочноземельных металлов
Щелочноземельные металлы названы в честь основных растворов, которые они создают, и того факта, что они остаются твердыми («земля») в термических реакциях.
Концепция №1: Физические и химические свойства щелочноземельных металлов
Предыдущий раздел Щелочные металлы
Следующий раздел Реакции щелочноземельных металлов
Объяснение урока: Щелочные металлы | Nagwa
В этом объяснителе мы научимся описывать соединения и реакционную способность щелочные металлы и тенденции изменения их физико-химических свойств.
Щелочные металлы являются одними из самых необычных и интересных элементов, потому что некоторые из них обладают, казалось бы, противоречивыми свойствами. Некоторые щелочные металлы твердые металлы настолько мягкие и легкие, что их можно резать ножницами и даже плавать на воде. Другие щелочные металлы имеют такие невероятно низкие температуры плавления, что их можно раствориться в жидкости в жаркий летний день.
Щелочные металлы иногда называют металлами первой группы, потому что
они составляют крайний левый столбец периодической таблицы. К щелочным металлам относятся
элементы литий, натрий, калий, рубидий, цезий и франций. Водород также находится в крайнем левом столбце периодической таблицы, но он
не классифицируется как щелочной металл или элемент металла первой группы, потому что он образует
неметаллический газ при стандартных условиях.
К щелочным металлам относятся
элементы литий, натрий, калий, рубидий, цезий и франций. Водород также находится в крайнем левом столбце периодической таблицы, но он
не классифицируется как щелочной металл или элемент металла первой группы, потому что он образует
неметаллический газ при стандартных условиях.
Литий является самым легким щелочным металлом и имеет такую низкую плотность, что
он может плавать на воде. Плотность лития всего
0,53 г/см 3 а плотность водопроводной воды примерно
1,00 г/см 3 при комнатной температуре и атмосферном давлении. Атомы лития невероятно малы
и содержат только три электрона. Франций является одним из наиболее реакционноспособных чистых
металлических элементов, которые, как известно, существуют, а также имеет самые большие атомы из всех
элемент периодической таблицы. Франций является наиболее нестабильным встречающимся в природе
элемент, и считается, что меньше, чем
тридцать граммов
франция на Земле в любой момент времени. Щелочные металлы имеют много
интересные физические свойства, и большинство из этих свойств можно понять
если вспомнить и сравнить их разные электронные конфигурации.
Щелочные металлы имеют много
интересные физические свойства, и большинство из этих свойств можно понять
если вспомнить и сравнить их разные электронные конфигурации.
Определение: Электронная конфигурация
Электронная конфигурация атома описывает, сколько у него электронов. и как все эти электроны расположены в разных электронных оболочках и подоболочки.
Пример 1. Определение того, какой элемент является щелочным металлом
Какой из перечисленных ниже металлов является щелочным?
- Радий
- Цезий
- Кальций
- Лантан
- Церий
Ответ
Щелочные металлы иногда называют металлами первой группы, потому что они составляют
самый левый столбец периодической таблицы. Цезий можно найти вблизи
внизу крайнего левого столбца таблицы Менделеева, и это демонстрирует, что цезий
является щелочным металлом. Радий и кальций относятся к элементам второй группы и
точно не щелочные металлы. Лантан и церий являются лантанидами.
элементы, и они также определенно не являются щелочными металлами. Мы можем использовать эти
утверждения, чтобы определить, что вариант B является правильным ответом на этот вопрос.
Лантан и церий являются лантанидами.
элементы, и они также определенно не являются щелочными металлами. Мы можем использовать эти
утверждения, чтобы определить, что вариант B является правильным ответом на этот вопрос.
Все щелочные металлы имеют один валентный электрон, но разные внутренние
оболочечных электронных конфигураций. Литий имеет только одну внутреннюю электронную оболочку;
у натрия их два, а у цезия и франция целых пять и шесть внутренних
оболочки электронов. Труднее удалить электрон из щелочи.
атом металла, если он мал и имеет меньше внутренних электронных оболочек. Количество
внутренние оболочки, а значит, и электроны, влияет на реакционную способность металла;
например, атомы металлического цезия относительно велики и взрывоопасно реагируют с
вода. Атомы лития и натрия намного меньше цезия и реагируют гораздо меньше
интенсивно. На следующих рисунках показана электронная конфигурация литиевого
атом и атом цезия.
Пример 2: Определение наиболее реакционноспособного щелочного металла
Какой из следующих щелочных металлов является наиболее реакционноспособным?
- Цезий
- Калий
- Литий
- Рубидий
- Натрий
Ответ
Щелочные металлы реагируют, теряя свой единственный электрон внешней оболочки. Электрон внешней оболочки проще взять у щелочного металла, если есть более слабые электростатические силы между положительно заряженными протонами в атомное ядро и отрицательно заряженные электроны на внешней валентной оболочке. Электростатические взаимодействия наиболее слабы, когда атомы щелочных металлов много электронов внутренней оболочки и больше расстояние между валентные электроны и положительно заряженные протоны в ядре.
Цезий находится ниже по таблице Менделеева, чем любой другой из перечисленных
опции. Цезий должен быть самым активным из перечисленных металлов, потому что он
большинство внутренних оболочек электронов и его валентные электроны испытывают
слабейшие силы электростатического взаимодействия с положительно заряженными протонами в
атомное ядро. Будет относительно легко взять валентный электрон
из цезия и сложнее взять валентный электрон из любого из
другие перечисленные щелочные металлы. Эта линия рассуждений может быть использована для определения
что вариант А является правильным ответом на этот вопрос.
Будет относительно легко взять валентный электрон
из цезия и сложнее взять валентный электрон из любого из
другие перечисленные щелочные металлы. Эта линия рассуждений может быть использована для определения
что вариант А является правильным ответом на этот вопрос.
Значения плотности обычно увеличиваются по мере продвижения вниз по столбцу первой группы
металлов в периодической таблице, потому что массовое число систематически увеличивается
от лития до франция. Плотность в основном определяется
как отношение массового числа к среднему атомному диаметру. Значения плотности
высоки, когда велико отношение массового числа к атомному диаметру. Плотность
значения низкие, когда отношение массового числа к атомному диаметру низкое. Массовое число систематически увеличивается по мере продвижения вниз по первому столбцу таблицы.
периодической таблицы, но атомные диаметры (атомные радиусы) увеличиваются в меньшей степени. предсказуемый способ. Это означает, что значения плотности обычно увеличиваются по мере нашего движения.
вниз по первому столбцу таблицы Менделеева, но есть исключения и
калий на самом деле менее плотный, чем натрий.
предсказуемый способ. Это означает, что значения плотности обычно увеличиваются по мере нашего движения.
вниз по первому столбцу таблицы Менделеева, но есть исключения и
калий на самом деле менее плотный, чем натрий.
Определение: Плотность
Плотность – это мера массы на единицу объема.
Значения плотности щелочных металлов кажутся очень низкими, когда они
по сравнению со значениями плотности для переходных металлов и
постпереходные металлы. Литий имеет плотность
0,53 г/см 3 а натрий и калий имеют значения плотности
0,97 г/см 3 и 0,89 г/см 3 соответственно. Переходные металлы, такие как золото и серебро, имеют значения плотности
19.32 г/см 3 и 10,49 г/см 3 ,
соответственно, а постпереходные металлы, такие как олово и висмут, имеют плотность
ценности
7,29 г/см 3 и 9,79 г/см 3 соответственно.
Пример 3. Определение того, какой щелочной металл имеет наибольшую плотность
Какой из следующих щелочных металлов имеет наибольшую плотность?
- Цезий
- Калий
- Натрий
- Литий
- Рубидий
Ответ
Щелочные металлы обычно имеют более высокую плотность, когда они имеют более высокую массовые числа. Массовые числа увеличиваются по мере того, как мы движемся сверху вниз. столбца щелочного металла в периодической таблице. Цезий имеет наибольшую массу число перечисленных щелочных металлов, а также имеет самое высокое плотность. Мы можем использовать эти утверждения, чтобы определить, что вариант А является правильным. ответ на этот вопрос.
Металлическую связь можно описать как электростатическое притяжение между
положительно заряженные катионы и делокализованные электроны. электростатический
силы взаимодействия сильнее, когда положительно заряженные катионы и
отрицательно заряженные электроны упакованы в небольшой объем и меньше
среднее расстояние между ними. Противоположно заряженные частицы могут быть упакованы
ближе друг к другу, когда атомы и ионы металлов малы и не поглощают слишком много
много места. Требуется больше энергии, чтобы разрушить металлическую решетку, сделанную
состоит из более мелких частиц, потому что частицы могут упаковываться ближе друг к другу. Точки плавления и значения твердости обычно увеличиваются по мере продвижения вверх по столбцу.
щелочных металлов в периодической таблице, потому что атомы металлов первой группы становятся
меньше, а их металлическая связь становится прочнее.
Противоположно заряженные частицы могут быть упакованы
ближе друг к другу, когда атомы и ионы металлов малы и не поглощают слишком много
много места. Требуется больше энергии, чтобы разрушить металлическую решетку, сделанную
состоит из более мелких частиц, потому что частицы могут упаковываться ближе друг к другу. Точки плавления и значения твердости обычно увеличиваются по мере продвижения вверх по столбцу.
щелочных металлов в периодической таблице, потому что атомы металлов первой группы становятся
меньше, а их металлическая связь становится прочнее.
Определение: Металлическая связь
Металлическая связь – это сильное электростатическое притяжение, существующее между положительно заряженные катионы металлов и делокализованные электроны.
Пример 4. Определение щелочного металла с самой низкой температурой плавления
Какой из следующих щелочных металлов имеет самую низкую температуру плавления?
- Цезий
- Калий
- Натрий
- Рубидий
- Литий
Ответ
Температура плавления металлов первой группы зависит от прочности
металлическая связь между их положительно заряженными катионами металлов и их
отрицательно заряженные делокализованные электроны. Электростатические взаимодействия, как правило,
сильнее, когда катионы металлов малы, потому что противоположно заряженные
частицы могут упаковываться очень близко друг к другу. Расстояние между ними меньше
противоположно заряженные частицы, когда катионы металлов малы, и требуется
больше энергии, чтобы разорвать их на части, потому что силы электростатического притяжения
больше. Металлы цезия имеют более крупные атомы, чем все остальные перечисленные
варианты, и мы можем использовать эту информацию, чтобы сделать вывод, что металлы цезия должны
имеют самую слабую металлическую связь и самую низкую температуру плавления. Мы можем использовать
эту линию рассуждений, чтобы определить, что вариант А является правильным ответом для
этот вопрос.
Электростатические взаимодействия, как правило,
сильнее, когда катионы металлов малы, потому что противоположно заряженные
частицы могут упаковываться очень близко друг к другу. Расстояние между ними меньше
противоположно заряженные частицы, когда катионы металлов малы, и требуется
больше энергии, чтобы разорвать их на части, потому что силы электростатического притяжения
больше. Металлы цезия имеют более крупные атомы, чем все остальные перечисленные
варианты, и мы можем использовать эту информацию, чтобы сделать вывод, что металлы цезия должны
имеют самую слабую металлическую связь и самую низкую температуру плавления. Мы можем использовать
эту линию рассуждений, чтобы определить, что вариант А является правильным ответом для
этот вопрос.
Некоторые элементы щелочных металлов распространены, а другие нет. Натрий и
калий — шестой и седьмой по распространенности элемент в земной коре,
и они оба образуют обычные солевые соединения и минералы. Каменная соль в первую очередь
состоит из соединения хлорида натрия, имеющего химическую формулу
NaCl. Минерал карналлит содержит калий
элемент и имеет формулу KCl.MgCl.6(HO)22. Остальные щелочные металлы относительно редки. Франций встречается особенно редко, потому что
он очень радиоактивен и имеет короткий период полураспада
двадцать две минуты. Ученые
впервые открыл франций в 1939 как распад
продукт актиния. Следующее уравнение описывает радиоактивный процесс, который привел к
открытие франция:
227892238742AcFr+He
Каменная соль в первую очередь
состоит из соединения хлорида натрия, имеющего химическую формулу
NaCl. Минерал карналлит содержит калий
элемент и имеет формулу KCl.MgCl.6(HO)22. Остальные щелочные металлы относительно редки. Франций встречается особенно редко, потому что
он очень радиоактивен и имеет короткий период полураспада
двадцать две минуты. Ученые
впервые открыл франций в 1939 как распад
продукт актиния. Следующее уравнение описывает радиоактивный процесс, который привел к
открытие франция:
227892238742AcFr+He
Щелочные металлы являются восстановителями, так как имеют один валентный электрон. Они легко восстанавливают многие неметаллические вещества, поскольку теряют свой единственный электрон внешней оболочки.
во время химической реакции. Щелочные металлы обычно имеют степень окисления +1.
когда они образуют соединения с неметаллами. Атомы щелочных металлов получают эту степень окисления по мере
они теряют свой валентный электрон и восстанавливают атом неметалла. Химики описывают щелочные металлы
как наиболее электроположительные химические элементы, потому что они легко теряют электрон и образуют
положительные ионы в химических реакциях.
Химики описывают щелочные металлы
как наиболее электроположительные химические элементы, потому что они легко теряют электрон и образуют
положительные ионы в химических реакциях.
Щелочные металлы, как правило, имеют больший атомный диаметр и объем, чем другие элементы в тот же период периодической таблицы. Их относительно большие диаметры означают, что они имеют низкую первые энергии ионизации и низкие числа электроотрицательности. Однако у них есть второй энергия ионизации, которая намного выше их первой.
Производители используют элементы калия и цезия для изготовления фотоэлектрических элементов, потому что Атомы калия и цезия имеют большой объем и низкую энергию первой ионизации. Два химические элементы легко испускают электроны при бомбардировке относительно низкоэнергетическим светом благодаря явлению фотоэффекта.
Щелочные металлы способны образовывать относительно стабильные кристаллы ионных солей
когда они реагируют с одним из галогенных элементов. Следующий сбалансированный химический
уравнение
2Na()+Cl()2NaCl()sgs2
показывает, как металлический натрий может реагировать с газообразным хлором, чтобы получить натрий
кристаллы хлористых солей.
Следующий сбалансированный химический
уравнение
2Na()+Cl()2NaCl()sgs2
показывает, как металлический натрий может реагировать с газообразным хлором, чтобы получить натрий
кристаллы хлористых солей.
Сбалансированное уравнение 2K()+Br()2KBr()sgs2 показывает, как металлический калий может реагировать с газообразным бромом, чтобы получить калий кристаллы бромистых солей.
Реакции между газообразными галогенами и щелочными металлами можно обобщить с помощью уравнение 2M()+X()2MX()sgs2 который использует символ M для обозначения щелочи металлы и символ X для обозначения атомы галогена.
Пример 5. Определение химического уравнения, описывающего реакцию между Калий и хлор
Какое из следующих уравнений правильно описывает реакцию между калием и хлором?
- 2K()+Cl()2KCl()sgs2
- 2K()+2Cl()2KCl()sls2
- 2K()+2Cl()KCl()sgaq2
- 2K()+Cl()2KCl ()sgaq2
- K()+Cl()KCl()sgs2
Ответ
Образование хлорида калия (KCl)
из металлического калия и газообразного хлора можно показать с помощью простой
химическое уравнение. Термину газообразного хлора следует присвоить
соответствующий символ газообразного состояния ( г ) и твердый металлический калий и
твердому хлориду калия следует присвоить соответствующий твердый
государственный символ ( с ). KCl
термин продукта должен иметь стехиометрический коэффициент два, потому что хлор
газ состоит из двухатомных молекул, и член реагента калия должен
также имеют стехиометрический коэффициент два, чтобы сбалансировать общий химический
уравнение. Эти утверждения можно сравнить с перечисленными вариантами, чтобы определить
что А является правильным ответом на этот вопрос.
Термину газообразного хлора следует присвоить
соответствующий символ газообразного состояния ( г ) и твердый металлический калий и
твердому хлориду калия следует присвоить соответствующий твердый
государственный символ ( с ). KCl
термин продукта должен иметь стехиометрический коэффициент два, потому что хлор
газ состоит из двухатомных молекул, и член реагента калия должен
также имеют стехиометрический коэффициент два, чтобы сбалансировать общий химический
уравнение. Эти утверждения можно сравнить с перечисленными вариантами, чтобы определить
что А является правильным ответом на этот вопрос.
Существуют и другие химические реакции, которые можно использовать для получения стабильной ионной соли.
кристаллы из щелочных металлов. Одним из примеров является реакция щелочных металлов с
водные растворы кислот. Химическое уравнение
2Na()+2HCl()2NaCl()+H()saqaqg2
показывает, как соляная кислота может реагировать с металлическим натрием, чтобы получить натрий
хлоридное соединение.
Сбалансированное химическое уравнение 2Li()+2HCl()2LiCl()+H()saqaqg2 показывает, как соляная кислота может реагировать с металлическим литием, чтобы получить ионное соединение хлорида лития.
Многие реакции между щелочными металлами и кислотами можно обобщить с помощью единственное общее уравнение, использующее M символ для обозначения щелочных металлов и H + символ для обозначения ионов водорода: 2M()+2H()2M()+H()saqaqg++2
Щелочные металлы также могут реагировать с двухатомными молекулами кислорода с образованием совершенно другой набор ионных соединений. Сбалансированное химическое уравнение 4Li()+O()2LiO()sgs22 показывает, как твердый металлический литий может реагировать с молекулами газообразного кислорода с образованием сделать твердое соединение оксида лития (LiO)2.
Натрий также может реагировать с газообразным кислородом с образованием оксида натрия. (NaO2): 4Na()+O()2NaO()sgs22
Металлический натрий также может реагировать с молекулами кислорода с образованием другого соединение натрия, пероксид натрия (NaO22): 2Na()+O()NaO()sgs222
Металлический калий может реагировать с газообразным кислородом аналогичным образом, чтобы получить пероксид калия (KO22) материал: 2K()+O()KO()sgs222
Калий и другие более тяжелые щелочные металлы также могут реагировать с кислородом
молекулы, чтобы сделать необычные молекулы супероксида. Сбалансированное уравнение
K()+O()KO()sgs22
показывает, как калий может реагировать с газообразным кислородом, чтобы получить калий
супероксид (KO2) твердый.
Сбалансированное уравнение
K()+O()KO()sgs22
показывает, как калий может реагировать с газообразным кислородом, чтобы получить калий
супероксид (KO2) твердый.
Пример 6: Уравновешивание химических уравнений для реакции между металлическим натрием и кислородом
Какое из следующих уравнений является правильным сбалансированным уравнением для реакции натрия с кислородом?
- 2Na()+O()2NaO()sgs222
- 2Na()+O()4NaO()sgs22
- 4Na()+O()2NaO()sgs22
- 4Na()+O()2NaO ()sgs22
- 2Na()+O()2NaO()sgs22
Ответ
Металлический натрий может образовывать оксид натрия (NaO2)
и молекул пероксида натрия (NaO22) при
он реагирует с газообразным кислородом. Пероксид натрия показан как химический продукт в
ответ А, но он указан с неверным стехиометрическим коэффициентом. Мы можем отбросить вариант А и сосредоточиться на других химических уравнениях, которые имеют
газообразный натрий и кислород реагируют вместе, образуя продукты оксида натрия. Нам также нужно будет убедиться, что химические уравнения имеют правильное состояние.
символы и правильные стехиометрические коэффициенты.
Нам также нужно будет убедиться, что химические уравнения имеют правильное состояние.
символы и правильные стехиометрические коэффициенты.
Молекулам кислорода следует присвоить символ газообразного состояния ( г ) и оксиду натрия, и чистому металлическому натрию следует присвоить твердое вещество. государственный символ ( s ). Термин продукта оксида натрия должен иметь стехиометрический коэффициент два, потому что газообразный кислород состоит из двухатомных молекул, а металлический натрий должен иметь стехиометрический коэффициент четыре, чтобы сбалансировать общее химическое уравнение. Эти заявления могут быть по сравнению со списком возможных ответов, чтобы определить, что правильный ответ Д.
Супероксид калия реагирует с диоксидом углерода в соответствии со следующим уравнением реакции: 4KO()+2CO()2KCO()+3O()22232ggsgCuClcatalyst2
Видно, что скорость реакции выше в присутствии хлорида меди(II) в качестве катализатора. Производители используют соединение супероксида калия для пополнения запасов кислорода в закрытых помещениях, таких как
как в самолетах или подводных лодках. Пассажиры выдыхают углекислый газ, и этот выдыхаемый углерод
газообразный диоксид реагирует с веществом супероксида калия и производит больше молекул кислорода. Реакция обычно происходит в бортовых фильтрах, содержащих супероксид калия.
соединение и некоторое количество каталитического материала хлорида меди (II).
Производители используют соединение супероксида калия для пополнения запасов кислорода в закрытых помещениях, таких как
как в самолетах или подводных лодках. Пассажиры выдыхают углекислый газ, и этот выдыхаемый углерод
газообразный диоксид реагирует с веществом супероксида калия и производит больше молекул кислорода. Реакция обычно происходит в бортовых фильтрах, содержащих супероксид калия.
соединение и некоторое количество каталитического материала хлорида меди (II).
Все щелочные металлы могут реагировать с водой, но некоторые реагируют гораздо сильнее энергичнее, чем другие. Реакции почти всегда производят газообразный водород. и растворимое соединение гидроксида металла. Реакции можно суммировать с помощью уравнение 2M()+2HO()2MOH()+H()slaqg22 который использует переменную M для представления щелочные металлы.
Уравнение
2Na()+2HO()2NaOH()+H()slaqg22
показывает, как твердый металлический натрий может реагировать с жидкой водой с образованием газообразного водорода. и водные молекулы гидроксида натрия.
и водные молекулы гидроксида натрия.
Уже было сказано, что щелочные металлы обычно становятся более реакционноспособными по мере вы перемещаетесь вниз по таблице Менделеева, и это общее правило верно для реакции щелочных металлов как газообразным кислородом, так и жидкой водой. Литий, в верхней части группа, довольно бурно реагирует с водой. Натрий и калий ниже лития в периодической таблице, и они реагируют еще более энергично, когда их смешивается с жидкой водой. Рубидий в периодической таблице стоит ниже калия. обычно не разрешается вступать в реакцию с водой в классе потому что реакция настолько бурная, что может привести к травме.
Самые внешние электроны более крупных атомов щелочных металлов имеют более слабые
электростатических взаимодействий с положительно заряженными протонами, и требуется меньше
энергии, чтобы сместить их и вызвать химическую реакцию. Мы можем использовать эту строку
рассуждение, чтобы предсказать, что металлы цезия должны реагировать еще более бурно с водой
чем рубидий. Сбалансированное химическое уравнение
2Cs()+2HO()2CsOH()+H()slaqg22
показывает, как металлический цезий может реагировать с водой с образованием гидроксида цезия и
водородный газ.
Сбалансированное химическое уравнение
2Cs()+2HO()2CsOH()+H()slaqg22
показывает, как металлический цезий может реагировать с водой с образованием гидроксида цезия и
водородный газ.
Химики обычно хранят щелочные металлы в герметичном контейнере под минеральным маслом для предотвращения их реакции с воздушной влагой или молекулами кислорода. щелочь металлы имеют тенденцию быстро тускнеть, если они не находятся в герметичном контейнере под минеральное масло или другой относительно нереакционноспособный углеводород.
Щелочные металлы также можно нагревать с газообразным водородом для получения щелочного металла. гидриды, такие как гидрид лития (LiH) или соединения гидрида натрия (NaH). Сбалансированное уравнение 2Na()+H()2NaH()sgs2 показывает, как металлический натрий может реагировать с газообразным водородом для получения натрия гидридное соединение.
Реакции между щелочными металлами и молекулами газообразного водорода могут быть
в сумме с общим уравнением
2M()+H()2MH()sgs2
который использует символ M для обозначения щелочи
металлы и символ MH для обозначения металла
гидридные изделия.
Некоторые щелочные металлы реагируют с серой при высоких температурах и образуют металл сульфидное соединение. Следующее сбалансированное уравнение показывает, как натрий делает соединение сульфида натрия при реакции с серой при высокой температуре: 2Na()+S()NaS()ss2
Следующее уравнение описывает, как химики могут аналогичным образом комбинировать литий с серой при высокой температуре, чтобы получить соединение сульфида лития: 2Li()+S()LiS()ss2
Некоторые щелочные металлы реагируют с фосфором при высоких температурах и образуют металл. фосфидное соединение. Следующее уравнение описывает реакцию натрия и фосфор при высокой температуре: 3Na()+P()NaP()ss3
Натрий и фосфор соединяются в процессе реакции и образуют натрий фосфидное соединение. Следующее уравнение показывает, как высокотемпературная реакция из калия и фосфора можно получить соединение фосфида калия: 3K()+P()KP()ss3
Мы видели, как все щелочные металлы реагируют с такими веществами, как вода. и водород. Однако важно понимать, что некоторые щелочные металлы
вступают в химические реакции, которые отличают их от всех остальных групп
металлы. Литий, например, можно взаимодействовать с газообразным азотом, чтобы получить литий.
нитрид (LiN3) и этот нитрид лития
продукт может затем реагировать с жидкой водой для получения аммиака. Сбалансированный
уравнение
6Li()+N()2LiN()sgs23
показывает, как металлический литий может реагировать с газообразным азотом с образованием лития.
нитрид.
и водород. Однако важно понимать, что некоторые щелочные металлы
вступают в химические реакции, которые отличают их от всех остальных групп
металлы. Литий, например, можно взаимодействовать с газообразным азотом, чтобы получить литий.
нитрид (LiN3) и этот нитрид лития
продукт может затем реагировать с жидкой водой для получения аммиака. Сбалансированный
уравнение
6Li()+N()2LiN()sgs23
показывает, как металлический литий может реагировать с газообразным азотом с образованием лития.
нитрид.
Сбалансированное уравнение LiN()+3HO()3LiOH()+NH()323slaqg показывает, как тот же продукт нитрида лития затем может реагировать с жидкой водой. для получения ценного аммиачного продукта.
Карбонат лития является довольно необычным соединением щелочного металла, поскольку он разлагается при температуре около 1000∘C и производит оксид лития и углекислотные газообразные продукты. Следующее химическое уравнение описывает это простое процесс термического разложения: LiCO()LiO()+CO()2322ssg∘C
Другие карбонатные соединения первой группы не разлагаются в результате такого простого разложения
процессы. Они могут, например, расплавиться в жидкость до того, как смогут термически разложиться.
в некоторую комбинацию твердых и газообразных молекул продукта.
Они могут, например, расплавиться в жидкость до того, как смогут термически разложиться.
в некоторую комбинацию твердых и газообразных молекул продукта.
Нитраты щелочных металлов частично разлагаются с образованием нитритов металлов и продуктов кислорода. Следующее уравнение описывает термическое разложение нитрата натрия: 2NaNO()2NaNO()+O()322ssg
Термическое разложение нитрата калия является необычным, поскольку реакция является взрывоопасной.
Давайте закончим повторением некоторых важных моментов из этого объяснения.
Ключевые моменты
- Щелочные металлы иногда называют металлами первой группы, потому что они составляют крайний левый столбец периодической таблицы элементов.
- Шесть щелочных металлов: литий, натрий, калий, рубидий, цезий, и франций.
- Щелочные металлы с более высокими массовыми числами обычно более мягкие
и более плотные, а также имеют более низкую температуру плавления.

