Соединения щелочноземельных металлов
Щелочноземельные металлы образуют основные оксиды, которые получают термическим разложением карбонатов или нитратов:
СаCO3 = СаO + CO2; 2Ba(NO3)2 = 2BaO + 4NO2 + O2
Энергично взаимодействуют с водой с образованием растворимых сильных оснований (щелочей).
При переходе от Ca(OH)2 к Ba(OH)2 растворимость заметно увеличивается (от 0,02 М до 0,2 М), в том же направлении увеличивается термическая устойчивость гидроксидов и усиливаются основные свойства. По силе основания уступают только гидроксидам щелочных металлов. Раствор Ва(ОН)2 – баритовая вода – лабораторный реактив на CO2.
Катионы щелочноземельных металлов образуют соли со всеми кислотами. Хорошо растворимы галогениды, нитраты, перхлораты и большинство кислых солей. Плохо растворимы в воде фториды, карбонаты, силикаты и фосфаты. Образование мелкокристаллического осадка сульфата бария является качественной реакцией на сульфат-анион:
Ba2+ + SO42- = BaSO4
Присутствие в природной воде растворимых солей кальция и магния обуславливает ее жесткость. Количественно жесткость измеряют суммарной концентрацией катионов Ca2+ и Mg2+ (ммоль экв/л). Различают временную (карбонатную) и постоянную жесткость. Первая удаляется кипячением:
t t
Ca(HCO3)2 = CaCO3 + CO2 + H2O; Mg(HCO3)2 = Mg(OH) 2 + 2CO2
Для удаления постоянной жесткости к воде добавляют вещества (соду, фосфат натрия и т.п.), переводящие катионы кальция и магния в осадок. Кроме того применяют метод ионного обмена, в этом случае катионы Ca2+ и Mg2+ меняются на катионы водорода или щелочного металла, удерживаемые на поверхности полимерной смолы (катионита).
Гидриды представляют собой белые солеподобные вещества, разлагающиеся водой с выделением водорода, сильные восстановители. В отличие от бериллия и магния, гидриды щелочноземельных металлов можно получить прямым синтезом:
t
Ca + H2 = CaH2
Литература: [1] с. 587 — 599, [2] с. 481 — 486, [3] с. 447 — 460
7.4. Элементы ia-подгруппы (щелочные металлы)
Элементы IA-подгруппы: литий — Li, натрий — Na, калий — K, рубидий — Rb, цезий — Cs и радиоактивный франций часто называют щелочными металлами. Общая формула ns1 обуславливает проявление щелочными металлами степени окисления +1.
Увеличение эффективного радиуса и уменьшение энергии ионизации в ряду Li – Na – K – Rb – Cs сопровождается заметным увеличением активности металлов. Небольшой радиус атома лития вызывает довольно сильные отличия данного элемента от остальных щелочных металлов, что в первую очередь проявляется в склонности к образованию ковалентных связей. Для натрия и особенно элементов подгруппы калия образование ковалентных связей нетипично. Малый размер и большая энергия гидратации катиона лития приводит к нарушению ожидаемой последовательности расположения щелочных металлов в ряду стандартных электродных потенциалов (литий стоит в нем первым). Нарушается ожидаемая последовательность активности щелочных металлов и в расплавах, в которых натрий более активен, что связано с образованием его ионом более прочных кристаллических решеток:
t
KOH + Na = NaOH + K
Литий, натрий, калий и рубидий — серебристо-белые металлы, цезий золотисто-желтого цвета. На воздухе поверхность лития, натрия и калия очень быстро тускнеет, рубидий и цезий самопроизвольно воспламеняются. Литий, натрий и калий хранят под слоем вазелина или вазелинового масла, рубидий и цезий хранят в запаянных ампулах. Металлы очень легкие и легкоплавкие, имеют довольно большой диапазон жидкого состояния. Щелочные металлы очень мягкие, натрий и калий легко режутся ножом.
Свойства | Li | Na | K | Rb | Cs |
Плотность, г/см3 | 0,53 | 0,97 | 0,86 | 1,53 | 1,90 |
Т.пл., С | 181 | 98 | 64 | 39 | 29 |
Т.кип., С | 1340 | 886 | 771 | 630 | 672 |
Кларк, мол.% | 0,02 | 2,4 | 1,4 | 710-3 | 110-8 |
Литий, натрий и калий весьма распространены в природе, образуют много самостоятельных минералов: LiAl(SiO3)2 — сподумен, LiAl(PO4)F — амблигонит, NaCl галит (каменная или поваренная соль), Na2SO410H2O — мирабилит, KCl — сильвин, NaClKCl — сильвинит, KClMgCl26H2O — карналлит, КClMgSO43H2O — каинит. Рубидий и цезий самостоятельных минералов не образуют, встречаются в виде примесей в минералах калия.
Литий и натрий получают электролизом ионных расплавов. Калий обычно получают восстановлением расплавов его соединений натрием или магнием.
Литий применяется в качестве легирующей добавки, придает сплавам твердость и пластичность. Натрий используется как теплоноситель в ядерных реакторах и восстановитель в металлотермии, а также как катализатор процессов полимеризации диенов. В лабораториях натрий широко используется для осушки газов и органических растворителей. Калий используется в промышленности как восстановитель и теплоноситель (в основном в виде жидкого сплава с натрием). Рубидий и цезий в основном применяются для изготовления фотоэлементов.
Химические свойства. Очень активные металлы, реагируют со всеми неметаллами, кроме инертных газов. Состав продуктов окисления кислородом зависит от природы металла: литий образует оксид, натрий и калий — перекисные соединения.
4Li + O2 = 2Li2O; 2Na + O2 = Na2O2; K + O2 = KO2
пероксид натрия супероксид калия
С водой реагируют очень энергично, калий — со взрывом:
2K + 2H2O = 2KOH + H2
Растворимы в аммиаке, с которым реагируют в присутствии катализатора:
2Na + 2NH3 = 2NaNH2 + H2
Растворимы в ртути, образуя амальгамы, которые медленно разлагаются водой и используются в качестве мягкого восстановителя. Активно реагируют с оксидами, отбирая у них кислород, горят в атмосфере оксида углерода(IV):
t t
4Na + SiO2 = 2Na2O + Si; 4Li + CO2 = 2Li2O + C
studfiles.net
Соединения щелочноземельных металлов
СаCO3 = СаO + CO2; 2Ba(NO3)2 = 2BaO + 4NO2 + O2
Энергично взаимодействуют с водой с образованием растворимых сильных оснований (щелочей).
При переходе от Ca(OH)2 к Ba(OH)2 растворимость заметно увеличивается (от 0,02 М до 0,2 М), в том же направлении увеличивается термическая устойчивость гидроксидов и усиливаются основные свойства. По силе основания уступают только гидроксидам щелочных металлов. Раствор Ва(ОН)2 – баритовая вода – лабораторный реактив на CO2.
Катионы щелочноземельных металлов образуют соли со всеми кислотами. Хорошо растворимы галогениды, нитраты, перхлораты и большинство кислых солей. Плохо растворимы в воде фториды, карбонаты, силикаты и фосфаты. Образование мелкокристаллического осадка сульфата бария является качественной реакцией на сульфат-анион:
Ba2+ + SO42- = BaSO4
Присутствие в природной воде растворимых солей кальция и магния обуславливает ее жесткость. Количественно жесткость измеряют суммарной концентрацией катионов Ca2+ и Mg2+ (ммоль экв/л). Различают временную (карбонатную) и постоянную жесткость. Первая удаляется кипячением:
t t
Ca(HCO3)2 = CaCO3 + CO2 + H2O;
2Mg(HCO3)2 = Mg2(OH)2CO3 + 3CO
Для удаления постоянной жесткости к воде добавляют вещества (соду, фосфат натрия и т.п.), переводящие катионы кальция и магния в осадок. Кроме того применяют метод ионного обмена, в этом случае катионы Ca2+ и Mg2+ меняются на катионы водорода или щелочного металла, удерживаемые на поверхности полимерной смолы (катионита).
Гидриды представляют собой белые солеподобные вещества, разлагающиеся водой с выделением водорода, сильные восстановители. В отличие от бериллия и магния, гидриды щелочноземельных металлов можно получить прямым синтезом:
t
Ca + H2 = CaH2
Литература: [1] с. 587 — 599, [2] с. 481 — 486, [3] с. 447 — 460
7.4. Элементы ia-подгруппы (щелочные металлы)
Элементы IA-подгруппы: литий — Li, натрий — Na, калий — K, рубидий — Rb, цезий — Cs и радиоактивный франций часто называют щелочными металлами. Общая формула ns1 обуславливает проявление щелочными металлами степени окисления +1.
Увеличение эффективного радиуса и уменьшение энергии ионизации в ряду Li – Na – K – Rb – Cs сопровождается заметным увеличением активности металлов. Небольшой радиус атома лития вызывает довольно сильные отличия данного элемента от остальных щелочных металлов, что в первую очередь проявляется в склонности к образованию ковалентных связей. Для натрия и особенно элементов подгруппы калия образование ковалентных связей нетипично. Малый размер и большая энергия гидратации катиона лития приводит к нарушению ожидаемой последовательности расположения щелочных металлов в ряду стандартных электродных потенциалов (литий стоит в нем первым). Нарушается ожидаемая последовательность активности щелочных металлов и в расплавах, в которых натрий более активен, что связано с образованием его ионом более прочных кристаллических решеток:
t
KOH + Na = NaOH + K
Литий, натрий, калий и рубидий — серебристо-белые металлы, цезий золотисто-желтого цвета. На воздухе поверхность лития, натрия и калия очень быстро тускнеет, рубидий и цезий самопроизвольно воспламеняются. Литий, натрий и калий хранят под слоем вазелина или вазелинового масла, рубидий и цезий хранят в запаянных ампулах. Металлы очень легкие и легкоплавкие, имеют довольно большой диапазон жидкого состояния. Щелочные металлы очень мягкие, натрий и калий легко режутся ножом.
Свойства | Li | Na | K | Rb | Cs |
Плотность, г/см3 | 0,53 | 0,97 | 0,86 | 1,53 | 1,90 |
Т.пл., С | 181 | 98 | 64 | 39 | 29 |
Т.кип., С | 1340 | 886 | 771 | 630 | 672 |
Кларк, мол.% | 0,02 | 2,4 | 1,4 | 710-3 | 110-8 |
Литий, натрий и калий весьма распространены в природе, образуют много самостоятельных минералов: LiAl(SiO3)2 — сподумен, LiAl(PO4)F — амблигонит, NaCl галит (каменная или поваренная соль), Na2SO410H2O — мирабилит, KCl — сильвин, NaClKCl — сильвинит, KClMgCl26H2O — карналлит, КClMgSO43H2O — каинит. Рубидий и цезий самостоятельных минералов не образуют, встречаются в виде примесей в минералах калия.
Литий и натрий получают электролизом ионных расплавов. Калий обычно получают восстановлением расплавов его соединений натрием или магнием.
Литий применяется в качестве легирующей добавки, придает сплавам твердость и пластичность. Натрий используется как теплоноситель в ядерных реакторах и восстановитель в металлотермии, а также как катализатор процессов полимеризации диенов. В лабораториях натрий широко используется для осушки газов и органических растворителей. Калий используется в промышленности как восстановитель и теплоноситель (в основном в виде жидкого сплава с натрием). Рубидий и цезий в основном применяются для изготовления фотоэлементов.
Химические свойства. Очень активные металлы, реагируют со всеми неметаллами, кроме инертных газов. Состав продуктов окисления кислородом зависит от природы металла: литий образует оксид, натрий и калий — перекисные соединения.
4Li + O2 = 2Li2O; 2Na + O2 = Na2O2; K + O2 = KO2
пероксид натрия супероксид калия
С водой реагируют очень энергично, калий — со взрывом:
2K + 2H2O = 2KOH + H2
Растворимы в аммиаке, с которым реагируют в присутствии катализатора:
2Na + 2NH3 = 2NaNH2 + H2
Растворимы в ртути, образуя амальгамы, которые медленно разлагаются водой и используются в качестве мягкого восстановителя. Активно реагируют с оксидами, отбирая у них кислород, горят в атмосфере оксида углерода(IV):
t t
4Na + SiO2 = 2Na2O + Si; 4Li + CO2 = 2Li2O + C
studfiles.net
Щелочноземельные металлы и их соединения
Щелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Элементы II группы главной подгруппы
1. Положение в Периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с оксидами неметаллов
7.2.6. Взаимодействие с солями и оксидами металлов
Оксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотными и амфотерными оксидами
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Амфотерные свойства оксида бериллия
Гидроксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с амфотерными оксидами и гидроксидами
2.4. Взаимодействие с кислыми солями
2.5. Взаимодействие с неметаллами
2.6. Взаимодействие с металлами
2.7. Взаимодействие с солями
2.8. Разложение при нагревании
2.9. Диссоциация
2.10. Амфотерные свойства гидроскида бериллия
Соли щелочноземельных металлов
Жесткость
1. Постоянная и временная жесткость
2. Способы устранения жесткости
Элементы II группы главной подгруппы
Положение в периодической системе химических элементов
Щелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Электронное строение и закономерности изменения свойств
Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов: ns2, на внешнем энергетическом уровне в основном состоянии находится 2 s-электрона. Следовательно, типичная степень окисления щелочноземельных металлов в соединениях +2.
Рассмотрим некоторые закономерности изменения свойств щелочноземельных металлов.
В ряду Be—Mg—Ca—Sr—Ba—Ra, в соответствии с Периодическим законом, увеличивается атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрицательность.

Физические свойства
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Кристаллическая решетка щелочноземельных металлов в твёрдом состоянии — металлическая. Следовательно, они обладают высокой тепло- и электропроводимостью. Кипят и плавятся при высоких температурах.
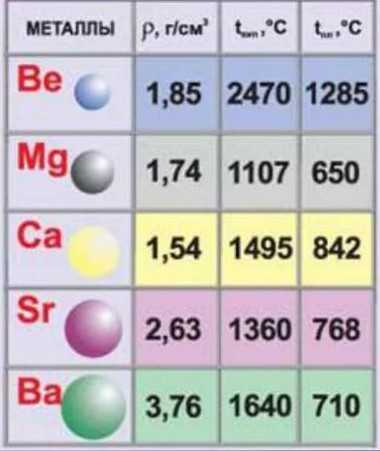
Нахождение в природе
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочноземельные металлы:
Доломит — CaCO3 · MgCO3 — карбонат кальция-магния.

Магнезит MgCO3 – карбонат магния.

Кальцит CaCO3 – карбонат кальция.

Гипс CaSO4 · 2H2O – дигидрат сульфата кальция.

Барит BaSO4 — сульфат бария.

Витерит BaCO3 – карбонат бария.

Способы получения
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
или восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий получают восстановлением оксида бария алюминием в вакууме при 1200 °C:
4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
Качественная реакция на щелочноземельные металлы — окрашивание пламени солями щелочноземельных металлов.

Цвет пламени:
Ca — кирпично-красный
Sr — карминово-красный (алый)
Ba — яблочно-зеленый
Качественная реакция на ионы магния: взаимодействие с щелочами. Ионы магния осаждаются щелочами с образованием белого осадка гидроксида магния:
Mg2+ + 2OH— → Mg(OH)2↓

Качественная реакция на ионы кальция, стронция, бария: взаимодействие с карбонатами. При взаимодействии солей кальция, стронция и бария с карбонатами выпадает белый осадок карбоната кальция, стронция или бария:
Ca2+ + CO32- → CaCO3↓
Ba2+ + CO32- → BaCO3↓

Качественная реакция на ионы стронция и бария: взаимодействие с карбонатами. При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция:
Ba2+ + SO42- → BaSO4↓
Sr2+ + SO42- → SrSO4↓
Также осадки белого цвета образуются при взаимодействии солей кальция, стронция и бария с сульфитами и фосфатами.
| Ионы | Реагенты на ионы | ||||
| карбонаты | сульфаты | фосфаты | сульфиты | окраска пламени | |
| Магний | белый осадок | — | белый осадок | помутнение раствора | |
| Кальций | белый осадок | помутнение раствора | белый осадок | белый осадок | кирпично-красный |
| Стронций | белый осадок | белый осадок | белый осадок | белый осадок | карминово-красный |
| барий | белый осадок | белый осадок | белый осадок | белый осадок | яблочно-зеленый |
Например, при взаимодействии хлорида кальция с фосфатом натрия образуется белый осадок фосфата кальция:
3CaCl2 + 2Na3PO4 → 6NaCl + 2Ca3(PO4)2↓
Химические свойства
1. Щелочноземельные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочноземельные металлы реагируют с галогенами с образованием галогенидов при нагревании.
Например, бериллий взаимодействует с хлором с образованием хлорида бериллия:
Be + Cl2 → BeCl2
1.2. Щелочноземельные металлы реагируют при нагревании с серой и фосфором с образованием сульфидов и фосфоридов.
Например, кальций взаимодействует с серой при нагревании:
Ca + S → CaS
Кальций взаимодействует с фосфором с образованием фосфидов:
3Ca + 2P → Ca3P2
1.3. Щелочноземельные металлы реагируют с водородом при нагревании. При этом образуются бинарные соединения — гидриды. Бериллий с водородом не взаимодействует, магний реагирует лишь при повышенном давлении.
Mg + H2 → MgH2
1.4. С азотом магний взаимодействует при комнатной температуре с образованием нитрида:
6Mg + 2N2 → 2Mg3N2
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
1.5. Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов.
Например, кальций взаимодействует с углеродом с образованием карбида кальция:
Ca + 2C → CaC2
Бериллий реагирует с углеродом при нагревании с образованием карбида — метанида:
2Be + C → Be2C
1.6. Бериллий сгорает на воздухе при температуре около 900°С:
2Be + O2 → 2BeO

Магний горит на воздухе при 650°С с выделением большого количества света. При этом образуются оксиды и нитриды:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Щелочноземельные металлы горят на воздухе при температуре около 500°С, в результате также образуются оксиды и нитриды.
Видеоопыт: горение кальция на воздухе можно посмотреть здесь.
2. Щелочноземельные металлы взаимодействуют со сложными веществами:
2.1. Щелочноземельные металлы реагируют с водой. Взаимодействие с водой приводит к образованию щелочи и водорода. Бериллий с водой не реагирует. Магний реагирует с водой при кипячении. Кальций, стронций и барий реагируют с водой при комнатной температуре.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
2Ca0 + 2H2+O = 2Ca+(OH)2 + H20
2.2. Щелочноземельные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной, разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например, магний реагирует с соляной кислотой:
2Mg + 2HCl → MgCl2 + H2↑
2.3. При взаимодействии щелочноземельных металлов с концентрированной серной кислотой образуется сера.
Например, при взаимодействии кальция с концентрированной серной кислотой образуется сульфат кальция, сера и вода:
4Ca + 5H2SO4(конц.) → 4CaSO4 + S + 5H2O
2.4. Щелочноземельные металлы реагируют с азотной кислотой. При взаимодействии кальция и магния с концентрированной или разбавленной азотной кислотой образуется оксид азота (I):
4Ca + 10HNO3 (конц) → N2O + 4Сa(NO3)2 + 5H2O
При взаимодействии щелочноземельны металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
4Ba + 10HNO3 → 4Ba(NO3)2 + NH4NO3 + 3H2O
2.5. Щелочноземельные металлы могут восстанавливать некоторые неметаллы (кремний, бор, углерод) из оксидов.
Например, при взаимодействии кальция с оксидом кремния (IV) образуются кремний и оксид кальция:
2Ca + SiO2 → 2CaO + Si
Магний горит в атмосфере углекислого газа. При этом образуется сажа и оксид магния:
2Mg + CO2 → 2MgO + C
2.6. В расплаве щелочноземельные металлы могут вытеснять менее активные металлы из солей и оксидов. Обратите внимание! В растворе щелочноземельные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, кальций вытесняет медь из расплава хлорида меди (II):
Ca + CuCl2 → CaCl2 + Cu
Оксиды щелочноземельных металлов
Способы получения
1. Оксиды щелочноземельных металлов можно получить из простых веществ — окислением металлов кислородом:
2Ca + O2 → 2CaO
2. Оксиды щелочноземельных металлов можно получить термическим разложением некоторых кислородсодержащих солей — карбонатов, нитратов.
Например, карбонат кальция разлагается на оксид кальция, оксид азота (IV) и кислород:
2Ca(NO3)2 → 2CaO + 4NO2 + O2
MgCO3 → MgO + CO2
СаСО3 → СаО + СО2
3. Оксиды магния и бериллия можно получить термическим разложением гидроксидов:
Mg(OH)2 → MgO + H2O
Химические свойства
Оксиды кальция, стронция, бария и магния — типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой. Оксид бериллия — амфотерный.
1. Оксиды кальция, стронция, бария и магния взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид магния взаимодействует с углекислым газом с образованием карбоната магния:
MgO + CO2 → MgCO3
2. Оксиды щелочноземельных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид кальция взаимодействует с соляной кислотой с образованием хлорида кальция и воды:
CaO + 2HCl → CaCl2 + H2O
3. Оксиды кальция, стронция и бария активно взаимодействуют с водой с образованием щелочей.
Например, оксид кальция взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
Оксид магния реагирует с водой при нагревании:
MgO + H2O → Mg(OH)2
Оксид бериллия не взаимодействует с водой.
4. Оксид бериллия взаимодействует с щелочами и основными оксидами.
При взаимодействии оксида бериллия с щелочами в расплаве или с основными оксидами образуются соли-бериллаты.
Например, оксид натрия реагирует с оксидом бериллия с образованием бериллата натрия:
Na2O + BeO → Na2BeO2
Например, гидроксид натрия реагирует с оксидом бериллия в расплаве с образованием бериллата натрия:
2NaOH + BeO → Na2BeO2 + H2O
При взаимодействии оксида бериллия с щелочами в растворе образуются комплексные соли.
Например, оксид бериллия реагирует с гидроксидом калия с растворе с образованием тетрагидроксобериллата калия:
2NaOH + BeO + H2O → Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов
Способы получения
1. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих оксидов с водой.
Например, оксид кальция (негашеная известь) при взаимодействии с водой образует гидроксид кальция (гашеная известь):
CaO + H2O → Ca(OH)2
Оксид магния взаимодействует с водой только при нагревании:
MgO + H2O → Mg(OH)2
2. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих металлов с водой.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
2Ca + 2H2O → 2Ca(OH)2 + H2
Магний взаимодействует с водой только при кипячении:
2Mg + 2H2O → 2Mg(OH)2 + H2
3. Гидроксиды кальция и магния можно получить при взаимодействии солей кальция и магния с щелочами.
Например, нитрат кальция с гидроксидом калия образует нитрат калия и гидроксид кальция:
Ca(NO3)2 + 2KOH → Ca(OH)2↓ + 2KNO3
Химические свойства
1. Гидроксиды кальция, стронция и бария реагируют с всеми кислотами (и сильными, и слабыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Гидроксид магния взаимодействует только с сильными кислотами.
Например, гидроксид кальция с соляной кислотой реагирует с образова-нием хлорида кальция:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид бария с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
Ba(OH)2(избыток) + CO2 → BaCO3 + H2O
Ba(OH)2 + 2CO2(избыток) → Ba(HCO3)2
3. Гидроксиды кальция, стронция и бария реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид бария с оксидом алюминия реагирует в расплаве с образованием алюминатов:
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Ba(OH)2 + Al2O3 + 3H2O → Ba[Al(OH)4]2
4. Гидроксиды кальция, стронция и бария взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид кальция реагирует с гидрокарбонатом кальция с образованием карбоната кальция:
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
5. Гидроксиды кальция, стронция и бария взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода). Взаимодействие щелочей с неметаллами подробно рассмотрено в статье про щелочные металлы.
6. Гидроксиды кальция, стронция и бария взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Ca(OH)2 + Zn → CaZnO2 + H2
В растворе образуются комплексная соль и водород:
Ca(OH)2 + 2Al + 6Н2О = Ca[Al(OH)4]2 + 3Н2
7. Гидроксиды кальция, стронция и бария вступают в обменные реакции с растворимыми солями. Как правило, с этими гидроксидами реагируют растворимые соли тяжелых металлов (в ряду активности расположены правее алюминия), а также растоворимые карбонаты, сульфиты, силикаты, и, для гидроксидов стронция и бария — растворимые сульфаты.
Например, хлорид железа (II) реагирует с гидроксидом бария с образованием хлорида бария и осадка гидроксида железа (II):
Ba(OH)2 + FeCl2 = BaCl2+ Fe(OH)2↓
Также с гидроксидами кальция, стронция и бария взаимодействуют соли аммония.
Например, при взаимодействии бромида аммония и гидроксида кальция образуются бромид кальция, аммиак и вода:
2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2
8. Гидроксид кальция разлагается при нагревании до 580оС, гидроксиды магния и бериллия разлагаются при нагревании:
Mg(OH)2 → MgO + H2O
9. Гидроксиды кальция, стронция и бария проявляют свойства сильных оснований. В воде практически полностью диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
Ba(OH)2 ↔ Ba2+ + 2OH—
Гидроксид магния — нерастворимое основание. Гидроксид бериллия проявляет амфотерные свойства.
10. Гидроксид и бериллия взаимодействует с щелочами. В расплаве образуются соли бериллаты, а в растворе щелочей — комплексные соли.
Например, гидроксид бериллия реагирует с расплавом гидроксида натрия:
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O
При взаимодействии гидроксида бериллия с избытком раствора щелочи образуется комплексная соль:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Соли щелочноземельных металлов
Нитраты щелочноземельных металлов
Нитраты кальция, стронция и бария при нагревании разлагаются на нитриты и кислород. Исключение — нитрат магния. Он разлагается на оксид магния, оксид азота (IV) и кислород.
Например, нитрат кальция разлагается при нагревании на нитрит кальция и молекулярный кислород:
Ca(NO3)2 → Ca(NO2)2 + O2
Карбонаты щелочноземельных металлов
1. Карбонаты щелочноземельных металлов при нагревании разлагаются на оксид и воду.
Например, карбонат кальция разлагается при температуре 1200оС на оксид кальция и воду:
CaCO3 → CaO + CO2
2. Карбонаты щелочноземельных металлов под действием воды и углекислого газа превращаются в растворимые в воде гидрокарбонаты.
Например, карбонат кальция взаимодействует с углекислым газом и водой с образованием гидрокарбоната кальция:
CaCO3 + H2O + CO2 → Ca(HCO3)2
3. Карбонаты щелочноземельных металлов взаимодействуют с более сильными кислотами с образованием новой соли, углекислого газа и воды.
Более сильные кислоты вытесняют менее сильные из солей.
Например, карбонат магния взаимодействует с соляной кислотой:
CaCO3 + 2HCl → CaCl2 + CO2↑+ H2O
4. Менее летучие оксиды вытесняют углекислый газ из карбонатов при сплавлении. К менее летучим, чем углекислый газ, оксидам относятся твердые оксиды — оксид кремния (IV), оксиды амфотерных металлов.
Менее летучие оксиды вытесняют более летучие оксиды из солей при сплавлении.
Например, карбонат кальция взаимодействует с оксидом алюминия при сплавлении:
CaCO3 + Al2O3 → Ca(AlO2)2 + CO2↑
Жесткость воды
Постоянная и временная жесткость
Жесткость воды — это характеристика воды, обусловленная содержанием в ней растворенных солей щелочноземельных металлов, в основном кальция и магния (солей жесткости).
Временная (карбонатная) жесткость обусловлена присутствием гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2 в воде.
Постоянная (некарбонатная) жесткость обусловлена присутствием солей, не выделяющихся при кипячении из раствора: хлоридов (CaCl2) и сульфатов (MgSO4) кальция и магния.
Способы устранения жесткости
Существуют химические и физические способы устранения жесткости. Химические способы устранения временной жесткости:
1. Кипячение. При кипячении гидрокарбонаты кальция и магния распадаются на нерастворимые карбонаты, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
2. Добавление извести (гидроксида кальция). При добавлении щелочи растворимые гидрокарбонаты переходят в нерастворимые карбонаты:
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + 2H2O
Химические способы устранения постоянной жесткости — реакции ионного обмена, которые позволяют осадить ионы кальция и магния из раствора:
1. Добавление соды (карбоната натрия). Карбонат натрия связывает ионы кальция и магния в нерастворимые карбонаты:
CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl
2. Добавление фосфатов. Фосфаты также связывают ионы кальция и магния:
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
master-ege.ru
Тест по теме «Щелочноземельные металлы и их соединения»
«Щелочноземельные металлы и соединения»
Вариант 1
Выберите 1 верный ответ
1. Атомы щелочноземельныхых металлов имеют на внешнем уровне:
А)1 электрон Б)2 электрона В)3 электрона Г)4 электрона
2. С каким из следующих веществ не реагирует кальций?
А) Cl2 Б) S В) Н2О Г) NaCl
3. Щелочноземельные металлы в сравнении со щелочными:
А) менее активны Б) более активны
В) одинаковые по активности Г) вообще неактивны
4. Щелочноземельные металлы соединяются с водой, образуя:
А) гидроксиды Б) гидраты В) гидриды Г) карбонаты
5. Металлические свойства в главной подгруппе II группы:
А) увеличиваются Б) уменьшаются В) не изменяются
Г) сначала увеличиваются, потом уменьшаются
6. Соли кальция окрашивают пламя в:
А) синий цвет Б) желтый цвет В) оранжево-красный цвет
Г) фиолетовый цвет
7. Какое название не относится к CaCO3:
А) мрамор Б) гипс В) мел Г) известняк
8. Гидроксид кальция не реагирует с:
А) H2O Б) P2O5 В) H2SO4 Г) MgO
Напишите уравнение реакций следующих превращений
+Н2О +НNO3 +K2CO3 +HCl
Ва → А → В → С → Д
«Щелочноземельные металлы и соединения»
Вариант 2
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют возможность:
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
2.С каким из следующих веществ не реагирует барий?
А) O2 Б) S В) Н2О Г) Са(ОН)2
3. Соли бария окрашивают пламя в:
А) синий цвет Б) желто-зеленый цвет
В) красный цвет Г) фиолетовый цвет
4. Качественной реакцией на СО2 является его реакция с раствором:
А) NaOH Б) KOH В) Ca(OH)2 Г) Mg(OH)2
5. Щелочноземельные металлы хранят:
А) на воздухе Б) в воде В) в керосине Г) на полке
6. Щелочноземельные металлы в химических реакциях являются:
А) изоляторами Б) окислителями
В) восстановителями Г) не изменяют степень окисления
7. Щелочноземельные металлы находятся в природе в виде:
А)солей Б)в самородном виде В)гидроксидов Г)оксидов
8. Оксид кальция реагирует с:
А) Na Б) H2O В) Cu(OH)2 Г) MgO
Напишите уравнение реакций следующих превращений
+O2 +H2SO4 +NaOH +HCl
Mg → A → B → C → Д
«Щелочноземельные металлы и соединения»
Вариант 1
Выберите 1 верный ответ
1. Атомы щелочноземельныхых металлов имеют на внешнем уровне:
А)1 электрон Б)2 электрона В)3 электрона Г)4 электрона
2. С каким из следующих веществ не реагирует кальций?
А) Cl2 Б) S В) Н2О Г) NaCl
3. Щелочноземельные металлы в сравнении со щелочными:
А) менее активны Б) более активны
В) одинаковые по активности Г) вообще неактивны
4. Щелочноземельные металлы соединяются с водой, образуя:
А) гидроксиды Б) гидраты В) гидриды Г) карбонаты
5. Металлические свойства в главной подгруппе II группы:
А) увеличиваются Б) уменьшаются В) не изменяются
Г) сначала увеличиваются, потом уменьшаются
6. Соли кальция окрашивают пламя в:
А) синий цвет Б) желтый цвет В) оранжево-красный цвет
Г) фиолетовый цвет
7. Какое название не относится к CaCO3:
А) мрамор Б) гипс В) мел Г) известняк
8. Гидроксид кальция не реагирует с:
А) H2O Б) P2O5 В) H2SO4 Г) MgO
Напишите уравнение реакций следующих превращений
+Н2О +НNO3 +K2CO3 +HCl
Ва → А → В → С → Д
«Щелочноземельные металлы и соединения»
Вариант 2
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют возможность:
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
2.С каким из следующих веществ не реагирует барий?
А) O2 Б) S В) Н2О Г) Са(ОН)2
3. Соли бария окрашивают пламя в:
А) синий цвет Б) желто-зеленый цвет
В) красный цвет Г) фиолетовый цвет
4. Качественной реакцией на СО2 является его реакция с раствором:
А) NaOH Б) KOH В) Ca(OH)2 Г) Mg(OH)2
5. Щелочноземельные металлы хранят:
А) на воздухе Б) в воде В) в керосине Г) на полке
6. Щелочноземельные металлы в химических реакциях являются:
А) изоляторами Б) окислителями
В) восстановителями Г) не изменяют степень окисления
7. Щелочноземельные металлы находятся в природе в виде:
А)солей Б)в самородном виде В)гидроксидов Г)оксидов
8. Оксид кальция реагирует с:
А) Na Б) H2O В) Cu(OH)2 Г) MgO
Напишите уравнение реакций следующих превращений
+O2 +H2SO4 +NaOH +HCl
Mg → A → B → C → Д
infourok.ru
План-конспект урока по химии (9 класс) по теме: Соединения щелочноземельных металлов
9 класс
Конспект урока по теме
«Соединения щелочноземельных металлов»
Цель: Обобщить знания учащихся и сформировать у них полное разностороннее представление
о природных соединениях щелочноземельных металлов, их свойствах, значении в
природе и использовании человеком
Задачи: 1) обучающие: усвоение учащимися представлений о природных соединениях
щелочноземельных металлов, их значении в природе и использовании
человеком;
2) развивающие: развитие умений составлять формулы веществ по их названиям и
давать названия по химическим формулам; записывать уравнения
химических реакций и рассматривать их с точки зрения
ТЭД и ОВР; отработка навыков проведения химического
эксперимента; показать взаимосвязь химии с другими предметами
(биологией, географией, ИЗО) и областями деятельности человека
(медициной, строительством, сельским хозяйством, архитектурой)
3) воспитывающие: патриотическое, эстетическое воспитание, формирование навыков
ЗОЖ (по предупреждению заболеваний опорно-двигательной
системы)
Оборудование:
- Для лабораторных работ: штатив для пробирок, пробирка, растворы гидроксида кальция, сульфата меди(II) и соляной кислоты, фенолфталеин, коллекции природных соединений щелочноземельных металлов в чашках Петри;
- Для демонстраций: штатив для пробирок, пробирка, оксид кальция, вода, фенолфталеин, скелет человека, зубы млекопитающих, яйца, упаковки от зубных паст, кораллы, жемчуг, мел, мрамор, известняк; коллекция химических соединений щелочноземельных металлов
- Для окончания урока: раздаточный материал
- Технические средства: компьютер, колонки, медиапроектор, экран.
Структура урока:
- Организационный момент
- Повторение пройденного материала
- Изучение нового материала: 1) Генетические ряды щелочноземельных металлов на примере кальция. Оксид и гидроксид кальция. Лабораторная работа «Взаимодействие гидроксида кальция с соляной кислотой и сульфатом меди(II)»; 2) Соли щелочноземельных металлов. Лабораторная работа «Ознакомление с образцами природных соединений кальция». Применение солей
- Закрепление полученных знаний
- Домашнее задание
- Окончание урока
7. Рефлексия
Ход урока
1. Организационный момент
2. Повторение пройденного материала
Фронтальный опрос:
Где в ПСХЭ находятся щелочноземельные металлы?
Какие элементы относятся к щелочноземельным металлам?
Почему они так называются?
Назовите общую особенность в строении атомов элементов II группы главной подгруппы.
Как строение атомов IIА определяет их свойства?
Как меняются металлические свойства элементов IIА группы с увеличением заряда их ядер?
Каково значение кальция в организме человека?
3. Изучение нового материала
Генетические ряды щелочноземельных металлов на примере кальция.
Оксид и гидроксид кальция
Задание. Заполните таблицу:
Название веществ | Формулы соединений |
CaCl2 | |
Карбонат кальция | |
Фосфат кальция | |
CaO | |
Гидроксид кальция | |
BaSO4 | |
Сульфат кальция |
? Каким цветом выделены формулы и названия оксидов, гидроксидов, солей?
Задание. Используя формулы соединений кальция, составьте генетический ряд этого металла (работа у доски)
1 2 3
Ответ: Ca → CaO → Ca(OH)2 → CaCO3
Рассмотрим данные переходы:
- Ca + O2 → CaO (демонстрация видеоролика) (ОВР у доски)
- CaO + h3O → Ca(OH)2 (демонстрация)
Задание. Из предложенного перечня выберите формулы веществ, с которыми может реагировать оксид кальция. Запишите уравнения возможных реакций (самопроверка).
Na, SO2, MgO, HCl, CaCl2, KOH
Ответ: Как основный оксид CaO реагирует с кислотными оксидами и кислотами, образуя соли:
1. СаO + SO2 = CaSO3
2. CaO + 2HCl = CaCl2 +h3O
Применение оксида кальция: используется в нефтеперерабатывающей, нефтехимической (производство присадок и смазок), химической, кожевенной и других отраслях промышленности, в промышленности строительных материалов как вяжущий материал. В пищевой промышленности зарегистрирован в качестве пищевой добавки E529 (регуляторы рН)
- Ca(OH)2 + CO2 → CaCO3 (демонстрация биологического опыта «Дыхание») (Качественная реакция)
У травянистых растений газообмен происходит через устьица на листьях и стеблях, у деревьев и кустарников — на стволах через чечевички или трещины
Новые слова: гашёная известь, негашёная известь, гашение, известковая вода, известковое молоко
Задание (работа с текстом учебника): используя текст учебника на странице 63, составьте соответствия
| А. Оксид кальция Б. Оксид магния В. Гидроксид кальция Г. Реакция оксида кальция с водой, сопровождающаяся выделением большого количества теплоты Д. Прозрачный раствор гидроксида кальция Е. Белая взвесь гидроксида кальция в воде |
? С какими веществами ещё может реагировать гидроксид кальция? (с кислотами и солями)
Лабораторная работа «Взаимодействие гидроксида кальция с соляной кислотой и сульфатом меди(II)» ТБ!
Ca(OH)2 + 2HCl→ CaCl2 + 2h3O (ТЭД у доски)
Ca(OH)2 + СuCl2→ CaCl2 + Cu(OH)2 (ТЭД – дома)
Применение гидроксида кальция:
- при побелке помещений;
- для приготовления известкового строительного раствора и силикатного бетона;
- для умягчение воды;
- для производства известковых удобрений;
- дубление кож;
- получение других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот;
- в пищевой промышленности зарегистрирован в качестве пищевой добавки E526 (регуляторы рН)
- Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока
Задание на дом (дополнительное): Составьте генетический ряд бария
Физкультминутка
Соли щелочноземельных металлов
На демонстрационном столе – склянки с солями (хлорид, нитрат, карбонат, фосфат, сульфат кальция)
? Опишите физические свойства представленных солей
Данные соединение встречаются и в природе в виде минералов
Лабораторная работа «Ознакомление с образцами природных соединений кальция»
Задание. Рассмотрите образцы и запишите в тетрадь названия природных соединений кальция
Применение солей:
На наш урок приглашены специалисты разных областей знаний. В своей работе они не могут обойтись без соединений щелочноземельных металлов.
Задание. По ходу выступлений заполните таблицу:
Соли | Применение солей |
Выступление строителя:
Самый важный из минералов – известняк (карбонат кальция), без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем. Во-вторых, это сырьё для получения цемента, гашёной и негашёной извести, стекла и др. Известковой щебёнкой укрепляют дороги. Природный мел представляет собой остатки раковин древних животных. Мел применяют для побелки, а также и в школе – школьный мел.
Выступление агронома:
Среднего содержания кальция в почвах (1,37%) вполне достаточно для обеспечения физиологических потребностей растений. Тем не менее, соединения кальция вносят в почвы для химической мелиорации: известковым порошком уменьшают кислотность почв, гипсованием устраняют избыточную щёлочность. Нитрат и фосфаты кальция используются как азотные удобрения.
Выступление скульптора:
Минерал скульпторов – мрамор (карбонат кальция). Из него создавал свои прекрасные творения Микеланджело.
Сульфат кальция встречается в природе в виде минерала гипса. Его используют для получения слепков. Для этого применяют полуводный гипс – алебастр.
Выступление хирурга:
Гипс используем и мы, медики, для наложения фиксирующих гипсовых повязок. Сульфат магния, известный под названием горькая или английская соль, используют в качестве слабительного средства. Он содержится в морской воде и придаёт ей горький вкус. Сульфат бария благодаря нерастворимости и способности задерживать рентгеновские лучи применяют в рентгенодиагностике («баритовая каша») для диагностики заболеваний желудочно-кишечного тракта. Остальные соединения бария токсичны.
Из всех заболеваний подростков на первом месте стоят нарушения опорно-двигательного аппарата. Одна из причин – недостаточное содержание кальция в пище. Замедление поступления кальция в костную ткань вызывает деформацию костей у взрослых и рахит у детей. Человек должен получать в день 1,5г кальция. Наибольшее его количество содержится в сыре, твороге, петрушке, салате. Другой хороший источник пищевого кальция, часто не берущийся в расчет — мягкие кости лосося и сардин, которые мы съедаем при потреблении этой пищи.
Выступление стоматолога:
А сколько соединений кальция в составе любой зубной пасты! Из зубной пасты доставляются кальций, фосфор и магний. Кальций и фосфор являются основными строительными элементами эмали зуба. На протяжении всей жизни человека они участвуют в обменных процессах. Необходимость такой добавки обусловлена потребностью зубов в этих элементах при кариесе, и в еще большей степени при некариозных поражениях зубов. Некариозные поражения зубов чаще всего связаны с нарушениями функции щитовидной, поджелудочной, половых желез, заболевания ЖКТ и др., а так же с влиянием внешних неблагоприятных воздействий (ежедневная длительная — более 6 часов — работа с компьютером, экологические влияния) вызывающих заметную убыль минеральных компонентов в тканях зуба, ведущих в начале к повышенной чувствительности зубов, а затем к повреждению в виде кариеса. В связи с этим местное применение паст, содержащих фосфорно-кальциевые добавки, позволяет не только предупредить, но и в известной степени компенсировать потери при наличии заболевания.
Проверка работы некоторых учащихся по заполнению таблицы
Выступление биолога (учитель):
Соединения кальция входят в состав скелетов и зубов позвоночных животных. Такие скелеты называются внутренними, и образованы они фосфатом кальция. На долю кальция приходится более 1,5% массы тела человека, 98% кальция содержится в костях.
? Перечислите функции скелета
! Опорная, защитная, двигательная, кроветворная
А какой ещё тип скелета встречается в природе?
! Наружный
? Какое соединение кальция входит в состав наружного скелета?
! Карбонат кальция
? У каких животных наружный скелет образован карбонатом кальция?
! Раковинные корненожки, кораллы, моллюски (раковина, жемчуг)
? Как образуется жемчуг?
! Жемчужина образуется внутри раковины моллюска в результате попадания туда постороннего предмета (песчинки и др.). Далее вокруг предмета -«затравки» происходит отложение перламутровых слоёв. Добыча морского жемчуга ведётся главным образом в Красном море и Персидском заливе, а также у берегов Шри-Ланки и Японии. Пресноводный жемчуг добывается в Германии, России, Китае и странах Северной Америки. В настоящее время ведётся не только поиск природного жемчуга, но и выращивание его в промышленных масштабах (особенно в Японии). Внутрь устрицы помещаются бусинки из прессованных раковин, после чего устрицы возвращаются в воду. Через определённое время бусины, покрытые слоями перламутра, извлекаются из устриц. Искусственный жемчуг в последнее время широко используется как популярный компонент для создания бижутерии и украшений своими руками. Современные технологии позволяют создать искусственные жемчужины любых размеров, форм и цветов, при этом стоимость такого жемчуга существенно ниже натурального. История знает много примеров поистине гигантских жемчужин. Однако ни одна из них не дошла до наших дней: жемчужины не живут больше 150—200 лет, после этого срока камень, увы, рассыпается.
Выступление географа:
У нас в Карелии есть город, на гербе которого изображён жемчужный венок на голубом поле. Это Кемь. Именно кемский жемчуг из рек Керети, Кеми и Куземки очень хвалили специалисты, считали его образцом пресноводного русского жемчуга «по цвету, блеску и форме». Карельский жемчуг цвет имел серебристый, чуть-чуть голубоватый. Конечно же, самые крупные жемчужные зерна превращали в бусы. Кроме того, им расшивали одежду и головные уборы поморских девушек. В них каждая поморка по праздникам выглядела настоящей царевной. Такими нарядами очень дорожили, берегли их и передавали из поколения в поколение. Мелким жемчугом украшали оклады икон в монастырях, расшивали праздничную одежду священников. Во времена его былой популярности много драгоценных зерен продавалось и за границу. Хитрые иностранные купцы охотно скупали поморский жемчуг, а иногда ввозили его снова в Россию под видом более дорогого «восточного». Поморский жемчуг практически перестали добывать в кемских реках почти 100 лет назад: мало стало перловиц, упали цены на эти прекрасные дары кемских рек. Но времена меняются: сегодня по подсчетам специалистов, в одной из рек северной Карелии обитает около 5 миллионов жемчужниц. Значит, старинный герб Кеми имеет не только историческое значение. Современная Кемь украшена по-настоящему богатым жемчужным венком!
Выступление биолога (учитель):
Мы практически ежедневно встречаемся с ещё одним объектом природы, который на 90% образован карбонатом кальция. Отгадайте загадку:
Может и разбиться,
Может и свариться.
Если хочешь, в птенчика
Может превратиться (Яйцо).
Более десяти лет исследований показали, что яичная скорлупа идеальный источник кальция, который легко усваивается организмом.
Готовят скорлупу так. Яйца моют в теплой воде с мылом, хорошо ополаскивают. Белок и желток выливают из яйца, а скорлупу еще раз прополаскивают и на 5 минут помещают в кипящую воду. Скорлупа яиц, сваренных вкрутую чуть менее активна, но зато готова к использованию. Дозировка от 1,5 до 3 г. в зависимости от возраста. Растереть скорлупу в порошок лучше в ступке. Принимать с утренней едой — с творогами или кашей (раздаточный материал).
- Закрепление полученных знаний
Тест с взаимопроверкой
Задание: Какие утверждения верны?
- Все элементы II группы главной подгруппы относятся к щелочноземельным металлам
- Оксид кальция реагирует с кислотными оксидами и кислотами, образуя соли
- Негашёная известь – это гидроксид кальция
- Помутнение известковой воды вызывает угарный газ
- Карбонат и фосфат кальция — это нерастворимые соли
- Алебастр – это полуводный гипс
- Внутренний скелет характерен для позвоночных животных
- В организме человека 98% кальция содержится в костях
- Яичная скорлупа образована фосфатом кальция
- Природный мел представляет собой остатки раковин древних животных
- Домашнее задание
Обязательное: § 12 стр. 62-67, ? 1 на стр. 67, закончите конспект урока
Дополнительное: Составьте генетический ряд бария, запишите уравнения химических
реакций переходов
Творческое: Придумайте сказку или задачу с привлечением знаний о щелочноземельных
металлах и их соединений
6. Окончание урока
7. Рефлексия
Источники информации:
1. Габриелян, О.С. Химия. 9 класс: учеб. Для общеобразоват. учреждений / О.С. Габриелян. – М.: Дрофа, 2008. – 270 с.
2. http://ru.wikipedia.org/wiki/ — соединения кальция и их применение
nsportal.ru
Краткий конспект подготовки к ЗНО по химии №15 Щелочноземельные металлы
Физические свойства щелочноземельных металлов
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И.Менделеева. Это магний , кальций , стронций , барий и радий .
Практически все эти элементы представляют собой твердые вещества сероватого цвета (по крайне мере, при нормальных условиях и комнатной температуре). Кстати, физические свойства щелочных металлов немного отличаются – эти вещества хотя и довольно стойкие, но легко поддаются воздействию. Интересно, что с порядковым номером в таблице растет и такой показатель металла, как плотность. Например, в этой группе наименьшим показателем обладает кальций, в то время как радий по плотности сходен с железом.
Химические свойства щелочноземельных металлов
Обнаружение ионов металла в солях.
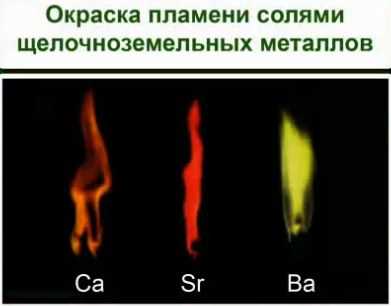
Ионы металлов легко определить по изменению окраски пламени.
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато- зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Металлы — восстановители.
Щелочные и щелочноземельные металлы, как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
1. С неметаллами.
→
→
→
→
2. Взаимодействие с кислородом.
→
3. Взаимодействие с водой.
→ ↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями.
(конц) →
(конц) → ↑
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
→
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария.
→
Применение щелочноземельных металлов
Самыми известными соединениями щелочноземельным металлов являются: – негашеная известь. – гашеная известь или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция .Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.
→
↑ → ↓
↓ → 
Гипс – это , алебастр – . Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. 
Карбонат кальция образует множество различных минералов.
Фосфат кальция — фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция . Его можно получить
→. Одно из его применений – это получение ацетилена.
→↑
Сульфат бария – барит. Используется как эталон белого в некоторых исследованиях.
Жесткость воды
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния и . Такую жесткость воды можно устранить кипячением.
→↓ ↑
Постоянная жесткость воды обусловлена наличием катионов , и анионов и др. Постоянная жесткость воды устраняется только благодаря реакциям ионного обмена, в результате которых ионы магния и кальция будут переведены в осадок.
→ ↓
vneshkoly.com.ua
Химические свойства щелочноземельных металлов. Применение щелочноземельных металлов. Физические свойства щелочноземельных металлов
Рассмотрим химические свойства щелочноземельных металлов. Определим особенности их строения, получения, нахождения в природе, применение.
Положение в ПС
Для начала определим расположение этих элементов в периодической системе Менделеева. Они располагаются во второй группе главной подгруппе. К ним относят кальций, стронций, радий, барий, магний, бериллий. Все они на внешнем энергетическом уровне содержат по два валентных электрона. В общем виде бериллий, магний и щелочноземельные металлы на внешнем уровне имеют ns2 электронов. В химических соединениях они проявляют степень окисления +2. Во время взаимодействия с другими веществами они проявляют восстановительные свойства, отдавая электроны с внешнего энергетического уровня.

Изменение свойств
По мере возрастания ядра атома бериллий, магний и щелочноземельные металлы усиливают свои металлические свойства, так как наблюдается возрастание радиуса их атомов. Рассмотрим физические свойства щелочноземельных металлов. Бериллий в обычном состоянии является металлом серого цвета со стальным блеском. Он имеет плотную гексагональную кристаллическую решетку. При контакте с кислородом воздуха, бериллий сразу же образует оксидную пленку, в результате чего снижается его химическая активность, образуется матовый налет.
Физические свойства
Магний в качестве простого вещества является белым металлом, образующим на воздухе оксидное покрытие. Он имеет гексагональную кристаллическую решетку.
Физические свойства щелочноземельных металлов кальция, бария, стронция схожи. Они представляют собой металлы с характерным серебристым блеском, покрывающиеся под воздействием кислорода воздуха желтоватой пленкой. У кальция и стронция кубическая гранецентрированная решетка, барий имеет объемно-центрированную структуру.
Химия щелочноземельных металлов основывается на том, что у них металлический характер связи. Именно поэтому они отличаются высокой электрической и тепло проводимостью. Температуры их плавления и кипения больше, чем у щелочных металлов.

Способы получения
Производство бериллия в промышленных объемах осуществляется путем восстановления металла из фторида. Условием протекания данной химической реакции является предварительное нагревание.
Учитывая, что щелочноземельные металлы в природе находятся в виде соединений, для получения магния, стронция, кальция проводят электролиз расплавов их солей.

Химические свойства
Химические свойства щелочноземельных металлов связаны с необходимостью предварительного устранения с их поверхности слоя оксидной пленки. Именно она определяет инертность данных металлов к воде. Кальций, барий, стронций при растворении в воде образуют гидроксиды, имеющие ярко выраженные основные свойства.
Химические свойства щелочноземельных металлов предполагают их взаимодействие с кислородом. Для бария продуктом взаимодействия является пероксид, для всех остальных после реакции образуются оксиды. У всех представителей данного класса оксиды проявляют основные свойства, только для оксида бериллия характерны амфотерные свойства.
Химические свойства щелочноземельных металлов проявляются и в реакции с серой, галогенами, азотом. При реакциях с кислотами, наблюдается растворение данных элементов. Учитывая, что бериллий относится к амфотерным элементам, он способен вступать в химическое взаимодействие с растворами щелочей.

Качественные реакции
Основные формулы щелочноземельных металлов, рассматриваемые в курсе неорганической химии, связаны с солями. Для выявления представителей данного класса в смеси с другими элементами, можно использовать качественное определение. При внесении солей щелочноземельных металлов в пламя спиртовки, наблюдается окрашивание пламени катионами. Катион стронция дает темный красный оттенок, катион кальция – оранжевый цвет, а катион бария зеленый тон.
Для выявления катиона бария в качественном анализе используют сульфат анионы. В результате данной реакции образуется сульфат бария белого цвета, который нерастворим в неорганических кислотах.
Радий является радиоактивным элементом, который в природе содержится в незначительных количествах. При взаимодействии магния с кислородом, наблюдается ослепительная вспышка. Данный процесс некоторое время применяли во время фотографирования в темных помещениях. Сейчас на смену магниевым вспышкам пришли электрические системы. К семейству щелочноземельных металлов относится бериллий, который реагирует со многими химическими веществами. Кальций и магний аналогично алюминию, могут восстанавливать такие редкие металлы, как титан, вольфрам, молибден, ниобий. Данные способы получения металлов называют кальциетермией и магниетермией.

Особенности применения
Каково применение щелочноземельных металлов? Кальций и магний используют для изготовления легких сплавов и редких металлов.
К примеру, магний содержится в составе дюралюминия, а кальций — это компонент свинцовых сплавов, используемых для получения оболочек кабелей и создания подшипников. Широко применение щелочноземельных металлов в технике в виде оксидов. Негашеная известь (оксид кальция) и жженая магния (оксид магния) требуются для строительной сферы.
При взаимодействии с водой оксида кальция происходит выделение существенного количества теплоты. Гашеная известь (гидроксид кальция) применяется для строительства. Белая взвесь данного вещества (известковое молоко) применяют в сахарной промышленности для процесса очистки свекловичного сока.
Соли металлов второй группы
Соли магния, бериллия, щелочноземельных металлов можно получить путем взаимодействия с кислотами их оксидов. Хлориды, фториды, иодиды данных элементов являются белыми кристаллическими веществами, в основном хорошо растворимыми в воде. Среди сульфатов растворимостью обладают только соединения магния и бериллия. Наблюдается ее снижение от солей бериллия к сульфатам бария. Карбонаты практически не растворяются в воде либо имеют минимальную растворимость.
Сульфиды щелочноземельных элементов в незначительных количествах содержатся в тяжелых металлах. Если направить на них освещение, можно получить различные цвета. Сульфиды включаются в состав светящихся составов, именуемых фосфорами. Применяют подобные краски для создания светящихся циферблатов, дорожных знаков.
Распространенные соединения щелочноземельных металлов
Карбонат кальция является самым распространенным на земной поверхности элементом. Он является составной частью таких соединений, как известняк, мрамор, мел. Среди них основное применение имеет известняк. Этот минерал незаменим в строительстве, считается отличным строительным камнем. Кроме того, из данного неорганического соединения получают негашеную и гашеную извести, стекло, цемент.
Применение известковой щебенки способствует укреплению дорог, а благодаря порошку можно снизить кислотность почвы. Природный мел представляет собой раковины древнейших животных. Данное соединение используют для изготовления резины, бумаги, создания школьных мелков.
Мрамор востребован у архитекторов, скульпторов. Именно из мрамора были созданы многие уникальные творения Микеланджело. Часть станций московского метро облицована именно мраморными плитками. Карбонат магния в больших объемах используется при изготовлении кирпича, цемента, стекла. Он нужен в металлургической промышленности для удаления пустой породы.
Сульфат кальция, содержащийся в природе в виде гипса (кристаллогидрата сульфата кальция), применяется в строительной отрасли. В медицине данное соединение применяется для изготовления слепков, а также для создания гипсовых повязок.
Алебастр (полуводный гипс) при взаимодействии с водой выделяет огромное количество тепла. Это также применяется в промышленности.
Английская соль (сульфат магния) применяется в медицине в виде слабительного средства. Данное вещество обладает горьким вкусом, оно обнаружено в морской воде.
«Баритовая каша» (сульфат бария) не растворяется в воде. Именно поэтому данную соль применяют в рентгенодиагностике. Соль задерживает рентгеновские лучи, что позволяет выявлять заболевания желудочно-кишечного тракта.
В составе фосфоритов (горной породы) и апатитов есть фосфат кальция. Они нужны для получения соединений кальция: оксидов, гидроксидов.
Кальций играет для живых организмов особое значение. Именно этот металл необходим для построения костного скелета. Ионы кальция необходимы для регулировки работы сердца, повышения свертываемости крови. Недостаток его вызывает нарушения в работе нервной системы, потере свертываемости, утрате способности рук нормально держать различные предметы.
Для того чтобы избежать проблем со здоровьем, каждые сутки человек должен потреблять примерно 1,5 грамма кальция. Основная проблема заключается в том, что для того, чтобы организм усваивал 0,06 грамма кальция, необходимо съедать 1 грамм жира. Максимальное количество данного металла содержится в салате, петрушке, твороге, сыре.

Заключение
Все представители второй группы главной подгруппы таблицы Менделеева необходимы для жизни и деятельности современного человека. Например, магний является стимулятором обменных процессов в организме. Он должен присутствовать в нервной ткани, крови, костях, печени. Магний является активным участником и фотосинтеза у растений, так как он является составной частью хлорофилла. Кости человека составляют примерно пятую часть от общего веса. Именно в них содержится кальций и магний. Оксиды, соли щелочноземельных металлов нашли разнообразное применение в строительной сфере, фармацевтике и медицине.
fb.ru
