Щелочные и щелочноземельные металлы | Quizizz
Browse from millions of quizzesQUIZ
Chemistry
41%accuracy
14plays
Разиля Шарифуллина2 years
Chemistry
Разиля Шарифуллина
14plays
15 questions
15 questions
Show AnswersSee Preview
1.
 Multiple-choice
Multiple-choice30 seconds
1 pt
Атомы щелочных металлов имеют на внешнем уровне
1 электрон
2 электрона
3 электрона
4 электрона
2. Multiple-choice
30 seconds
1 pt
Щелочноземельные металлы в сравнении со щелочными
одинаковые по активности
менее активны
неактивны
более активны
3. Multiple-choice
45 seconds
1 pt
К щелочноземельным металлам относятся
Кальций
Стронций
Натрий
4. Multiple-choice
45 seconds
1 pt
Щелочноземельные металлы соединяются с водой, образуя:
гидроксиды
гидраты
гидриды
гидрокарбонаты
5.
 Multiple-choice
Multiple-choice30 seconds
1 pt
Атому натрия соответствует строение:
2е,9е,2е
2е,8е,3е
2е,8е,1е
2е,8е,8е,1е
6. Multiple-choice
30 seconds
1 pt
При взаимодействии лития с кислородом образуются:
Пероксид лития
Гидроксид лития
Гидрид лития
Оксид лития
7. Multiple-choice
45 seconds
1 pt
Какие вещества образуются при взаимодействии натрия с водой
NaOH +H2
NaH+O2
Na2O+H2
8. Multiple-choice
45 seconds
1 pt
С какими из приведенных веществ реагирует кальций
9.
 Multiple-choice
Multiple-choice30 seconds
1 ptМеталлические свойства в главной подгруппе II группы с ростом заряда ядра
увеличиваются
уменьшаются
не изменяются
сначала увеличиваются, потом уменьшаются
10. Multiple-choice
45 seconds
1 pt
В ряду Be —> Mg —> Ca—> Sr —> Ba
растет электроотрицательность
растет число электронов на ВЭУ
растет металлические свойства
убывает радиус
11. Multiple-choice
45 seconds
1 pt
Щелочами являются:
Ва(OH)2
Mn(OH)2
Be(OH)2
12.
45 seconds
1 pt
Какой из металлов, электронные формулы которых записаны ниже, наиболее активен?
1s22s22p63s1
1s22s22p63s23p64s1
1s22s22p63s23p63d104s2
1s22s1
13. Multiple-choice
30 seconds
1 pt
Вид химической связи в простом веществе натрии:
ионная
металлическая
ковалентная неполярная
ковалентная полярная
14. Multiple-choice
45 seconds
1 pt
Выберите верные утверждения:
Na2CO3 — питьевая сода
СаСО3 — мел, мрамор, известняк
СаSO4 x 2H2O — гипс
NaHCO3 — стиральная сода
MgCO3 — магнезит
15.
 Multiple-choice
Multiple-choice30 seconds
1 pt
Оксиды щелочноземельных металлов проявляют свойства:
Кислотных оксидов
Основных оксидов
Амфотерных оксидов
Несолеобразующих оксидов
Expore all questions with a free account
Already have an account?
Щелочноземельные металлы | 62 plays
Browse from millions of quizzesQUIZ
Chemistry
65%accuracy
62plays
Anna Torn5 years
Chemistry
Anna Torn
62plays
15 questions
No student devices needed. Know more
Know more
15 questions
Show AnswersSee Preview
1. Multiple-choice
45 seconds
1 pt
Атомы щелочноземельных металлов имеют на внешнем уровне…
по одному электрону
по два электрона
полностью заполненный внешний уровень
2. Multiple-choice
45 seconds
1 pt
Атомы щелочноземельных элементов имеют …
возможность терять два внешних электрона, образуя катион со степенью окисления +2
возможность терять единственный внешний электрон, образуя катион со степенью окисления +1
возможность приобретать один электрон на внешний уровень, образуя анион со степенью окисления -1
3.
 Multiple-choice
Multiple-choice30 seconds
1 pt
Радий, завершающий I I группу, является…
очень твёрдым
самым распространённым в земной коре
радиоактивным
4. Multiple-choice
45 seconds
1 pt
Все щелочноземельные металлы горят в атмосфере кислорода, образуя…
оксиды состава МеО
гидроксиды состава МеОН
оксиды Ме2О
5. Multiple-choice
45 seconds1 pt
Все щелочноземельные металлы соединяются с водородом, образуя…
гидроксиды
гидраты
гидриды
6. Multiple-choice
1 minute
1 pt
При взаимодействии щелочноземельных металлов с водой образуютя…
гидриды и кислород
основания и водород
пероксиды и водород
7.
 Multiple-choice
Multiple-choice45 seconds
1 pt
Сульфатом кальция является вещество, имеющее формулу…
Са2SО4
Са(НSО4)2
8. Multiple-choice
45 seconds
1 pt
Металлы I I группы будут взаимодействовать с кислотами те, …
которые в ряду напряжения металлов стоят после Н
которые в ряду напряжения металлов стоят до Н
будут реагировать все
9. Multiple-choice
1 minute
1 pt
Выберите ряд элементов, относящихся к щелочноземельным металлам:
Ba, Sr, Ca
Na, K, Li
Mg, K, Al
Ca, Mg, Ве
10.
 Multiple-choice
Multiple-choice30 seconds
1 pt
Щелочноземельные металлы – это элементы:
1 группы побочной подгруппы
2 группы главной подгруппы
1 группы главной подгруппы
11. Multiple-choice
45 seconds
1 pt
Щелочноземельные металлы хранят…
на воздухе
в воде
в керосине
на полке
12. Multiple-choice
45 seconds
1 pt
Какой из указанных металлов является щелочноземельным?
13. Multiple-choice
1 minute
1 pt
Щелочноземельные металлы:
Достаточно легко режутся ножом.
Неактивные металлы.
Серебристо – белые
14. Multiple-choice
45 seconds
1 pt
Соли бария окрашивают пламя в…
фиолетовый цвет
зелёный цвет
красный цвет
жёлтый цвет
15. Multiple-choice
45 seconds
1 pt
Самый распространенный щелочноземельный металл — это…
бериллий
натрий
кальций
Expore all questions with a free account
Already have an account?
Реакции элементов основной группы с водой
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 608
Вода состоит из двух атомов водорода и атома кислорода. {-}(водн.) + h3(г)} \]
{-}(водн.) + h3(г)} \]
Из этой реакции видно, что образуются ОН — , создавая щелочную или щелочную среду. Элементы группы 1 называются щелочными металлами из-за их способности вытеснять H 2 (g) из воды и создавать щелочной раствор.
Известно также, что щелочные металлы бурно и взрывоопасно реагируют с водой. Это связано с тем, что во время экзотермической реакции выделяется достаточно тепла, чтобы воспламенить H 2 (g).
Рисунок \(\PageIndex{1}\): Реакционная способность металлов лития (вверху), натрия (в центре) и калия (внизу) и воды. (Бесплатно только для образовательного использования, chemlegin). 9-_{(водн.)}+H_{2(г)} \label{4}\]Эту реакцию можно обобщить на все гидриды щелочных металлов.
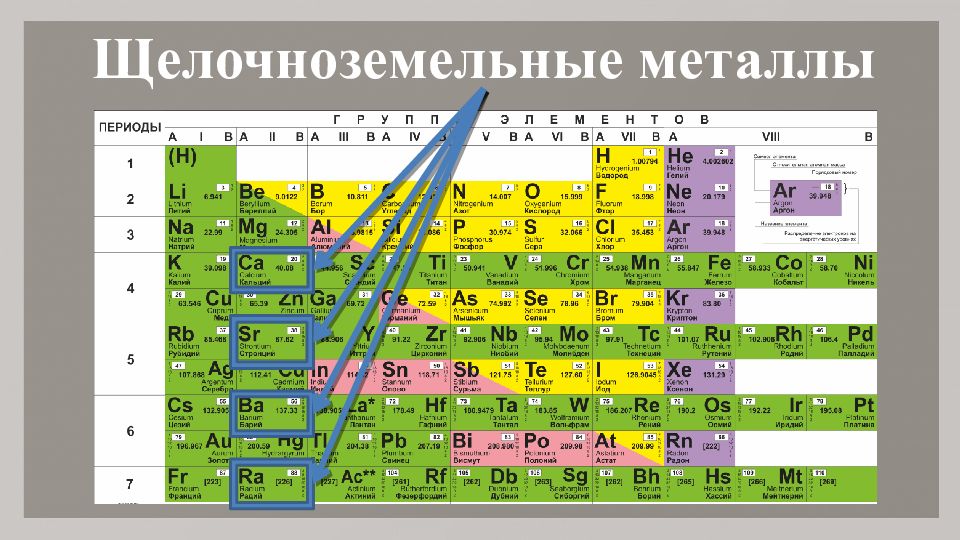
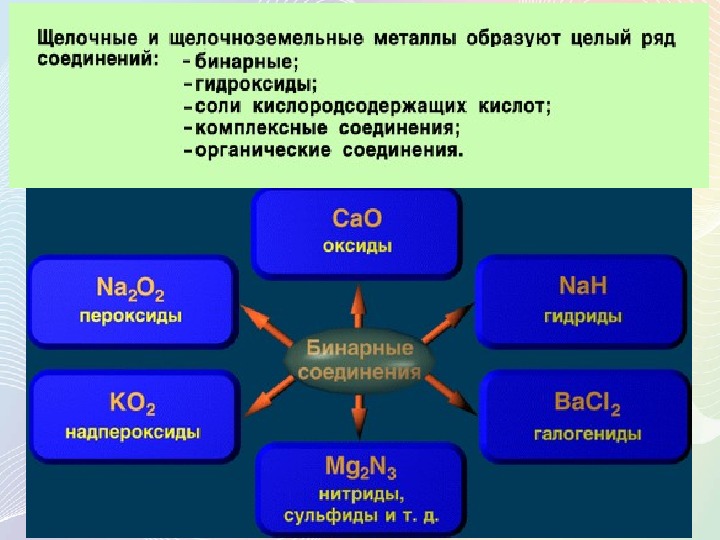
Группа 2: Щелочноземельные металлы
Большинство щелочноземельных металлов также образуют гидроксиды при взаимодействии с водой. Гидроксиды кальция, стронция и бария мало растворимы в воде; однако образуется достаточно ионов гидроксида, чтобы создать щелочную среду.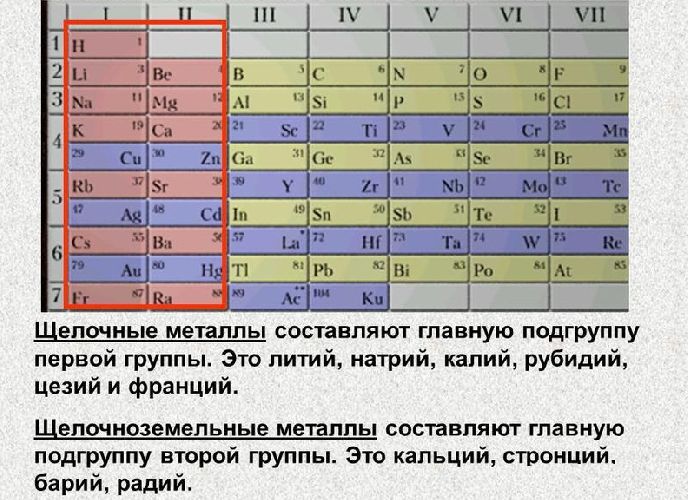 Общая реакция кальция, стронция и бария с водой представлена ниже, где М представляет собой кальций, стронций или барий:
Общая реакция кальция, стронция и бария с водой представлена ниже, где М представляет собой кальций, стронций или барий:
\[M_{(s)} + 2H_2O_{(l)} \longrightarrow M(OH)_{2(aq)}+H_{2\;(g)} \label{5}\]
Магний (Mg) реагирует с водяным паром с образованием гидроксида магния и газообразного водорода. Бериллий (Be) — единственный щелочноземельный металл, не вступающий в реакцию с водой. Это связано с его небольшими размерами и высокой энергией ионизации по сравнению с другими элементами группы.
Оксиды щелочноземельных металлов и вода
Подобно оксидам щелочных металлов, монооксиды щелочноземельных металлов соединяются с водой с образованием гидроксидных солей металлов (как показано в приведенном ниже уравнении). Исключением из этого общего предположения является бериллий, оксид которого (BeO) не реагирует с водой.
\[MO_{(s)}+H_2O_{(l)} \longrightarrow M(OH)_{2(s)} \label{6}\]
Одним из наиболее известных оксидов щелочноземельных металлов является CaO или негашеная известь. Это вещество часто используется для очистки воды и удаления вредных \(SO_{2(g)}\) из промышленных дымовых труб.
Это вещество часто используется для очистки воды и удаления вредных \(SO_{2(g)}\) из промышленных дымовых труб.
Гидриды щелочноземельных металлов и вода
За исключением бериллия (Be), гидриды щелочных металлов реагируют с водой с образованием гидроксида металла и газообразного водорода. Реакцию этих гидридов металлов можно описать ниже:
\[MH_{2(s)}+2H_2O_{(l)} \longrightarrow M(OH)_{2(aq)}+2H_{2(g)} \label{7} \]
Жесткая вода
Два типа жесткой воды включают временную жесткую воду и постоянную жесткую воду. Временно жесткая вода содержит бикарбонат (HCO 3 — ), который при нагревании образует CO 3 -2 (водн.), CO 2 (г) и H 2 O. Ионы бикарбоната реагируют с катионами щелочноземельных металлов и выпадают в осадок из раствора, вызывая образование накипи и проблемы в водонагревателях и сантехнике. Общие катионы в воде включают Mg +2 и Ca +2 . Чтобы смягчить воду, в водоочистные сооружения добавляют гидроксид щелочноземельного металла, такой как гашеная известь [Ca(OH) 2 ]. Это твердое вещество растворяется в воде с образованием иона металла (M +2 ) и ионов гидроксида (OH —). Ионы гидроксида объединяются с ионами бикарбоната в воде, образуя воду и ион карбоната. Затем ион карбоната осаждается вместе с ионом металла с образованием MCO 3 (s). Установки водоподготовки способны удалять осажденный карбонат металла и, таким образом, смягчать воду.
Это твердое вещество растворяется в воде с образованием иона металла (M +2 ) и ионов гидроксида (OH —). Ионы гидроксида объединяются с ионами бикарбоната в воде, образуя воду и ион карбоната. Затем ион карбоната осаждается вместе с ионом металла с образованием MCO 3 (s). Установки водоподготовки способны удалять осажденный карбонат металла и, таким образом, смягчать воду.
Другой тип жесткой воды – постоянная жесткая вода. Постоянная жесткая вода содержит ионы бикарбоната (HCO 3 — ), а также другие анионы, такие как сульфат-ионы (SO 4 -2 ). Затвердевающие частицы часто не удается выпарить. Для смягчения постоянной воды добавляется карбонат натрия (Na 2 CO 3 ). Карбонат натрия осаждает ионы Mg +2 и Ca +2 в виде соответствующих карбонатов металлов и вводит Na + ионов в растворы.
Группа 13: Семейство бора
Элементы группы 13 слабо реагируют с водой. На самом деле бор (B) не реагирует с водой. Одной из примечательных реакций в этой группе является реакция алюминия (Al) с водой. Алюминий, по-видимому, не реагирует с водой, потому что внешний слой оксида алюминия (Al 2 O 3 ) образует твердое вещество и защищает остальную часть металла.
На самом деле бор (B) не реагирует с водой. Одной из примечательных реакций в этой группе является реакция алюминия (Al) с водой. Алюминий, по-видимому, не реагирует с водой, потому что внешний слой оксида алюминия (Al 2 O 3 ) образует твердое вещество и защищает остальную часть металла.
Группа 14: Семейство углерода
По большей части элементы группы 14 не реагируют с водой. Одним интересным следствием этого является то, что олово (Sn) часто напыляют в качестве защитного слоя на железные банки, чтобы предотвратить коррозию банки.
Рис.: Пустая консервная банка. Стальные банки изготавливаются из белой жести (сталь с луженым покрытием) или из стали, не содержащей олова. из Википедии.Группа 15: Семейство азота
Чистые элементы этого семейства не вступают в реакцию с водой. Соединения азота (нитраты и нитриты), а также газообразный азот (N 2 ) растворяются в воде, но не вступают в реакцию.
Группа 16: Семейство кислорода
Как упоминалось ранее, многие оксиды групп 1 и 2 реагируют с водой с образованием гидроксидов металлов. Оксиды неметаллов реагируют с водой с образованием оксокислот. Примеры включают фосфорную кислоту и серную кислоту.
Оксиды неметаллов реагируют с водой с образованием оксокислот. Примеры включают фосфорную кислоту и серную кислоту.
Группа 17: Галогены
Обычно галогены реагируют с водой с образованием галогенидов и гипогалогенидов. Газообразные галогены по-разному реагируют с водой из-за их различной электроотрицательности. Поскольку фтор (\(\ce{F2}\)) настолько электроотрицателен, он может вытеснять газообразный кислород из воды. Продукты этой реакции включают газообразный кислород и фтористый водород. Галогениды водорода реагируют с водой с образованием галоидоводородных кислот (\(\ce{HX}\)). За исключением \(\ce{HF}\), галогеноводородные кислоты являются сильными кислотами в воде. Примером является соляная кислота (\(\ce{HCl}\)), сильная кислота.
\[\ce{Cl2(г) + 2h3O(ж) → HCl(водн.) + HOCl(водн.)}\]
Хлорноватистая (\(\ce{HOCl}\)) кислота является сильным отбеливающим агентом и не очень стабилен в растворе и легко разлагается, особенно под воздействием солнечного света, с выделением кислорода.
\[\ce{ 2 HClO -> 2 HCl + O2}\]
Жидкий бром медленно растворяется в воде с образованием желтовато-коричневого раствора.
\[\ce{Br2(g) + 2h3O(l) → HBr(aq) + HOBr(aq)}\]
Бромноватая (\(\ce{HOBr}\)) кислота является слабым отбеливающим агентом.
\[\ce{I2(g) + 2h3O(l) → HI(aq) + HOI(aq)}\]
Лишь небольшое количество йода растворяется в воде с образованием желтоватого раствора и гипойодистого (\(\ce {HOI}\)) кислота обладает очень слабой отбеливающей способностью.
Группа 18: Инертные газы
Инертные газы не вступают в реакцию с водой.
Общие сведения
| Реагент #1 | Реагент #2 | Продукция |
|---|---|---|
| Металл группы 1 периода 3 или выше | Холодная вода | Гидроксид металла и молекулярный водород |
| Металл группы 2 периода 3 или выше | Холодная вода | Гидроксид металла и молекулярный водород |
| Неметаллический элемент (кроме галогенов) | Холодная вода | Нет реакции |
| Фтор (F 2 ) | Вода | Фторид водорода (HF) и молекулярный кислород (O 2 ) |
| Галоген | Вода | Галоидоводородная кислота или гипогалоидная кислота |
| Металл с E 0 < -4,14 В для низшей степени окисления | Пар | Оксид металла и молекулярный водород |
| Неметаллический галогенид | Вода | Оксид неметалла и галогеноводород |
| Оксид металла | Вода | Гидроксид металла |
| Оксид неметалла | Вода | оксокислота |
Ссылки
- Бирк, Джеймс П.
 «Предсказание неорганических реакций». Применение экспертных систем в химии . Вашингтон: Американское химическое общество, 1989. Печать.
«Предсказание неорганических реакций». Применение экспертных систем в химии . Вашингтон: Американское химическое общество, 1989. Печать. - Хьюи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы строения и относительности . 4-е изд. Нью-Йорк: Колледж ХарперКоллинз, 1993. Печать.
- Massey, A.G. Химия основной группы . Лондон: Эллис Хорводд, 1990. Печать.
- Петруччи и др. Общая химия: принципы и современные приложения. 9изд. Река Аппер-Сэдл, Нью-Джерси, 2007 г. .
Задачи
- Предскажите продукты следующих реакций:
- \(Be_{(s)}+2H_{2}O_{(l)} \longrightarrow\)
- \(Ne_{(g)}+2H_{2}O_{(l)} \longrightarrow\)
- \(Cl_{2\;(g)}+2H_{2}O_{(l)} \longrightarrow\)
- \(Li_2O_{(s)}+2H_{2}O_{(l)} \longrightarrow\)
- Верно/Ложно
- Оксиды металлов образуют основные растворы в воде
- Дифтор не реагирует с водой.
 -_{(водн.)}+H_2 \; {(г) }\)
-_{(водн.)}+H_2 \; {(г) }\)Авторы и ссылки
- Тревор Ландас (Калифорнийский университет, Дэвис)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Гидриды щелочных металлов
- щелочные металлы
- Семья Бор
- Карбоновая серия
- Группа 1
- Галогены
- Жесткая вода
- Гидриды
- Элементы основной группы
- Семейство азота
- Благородные газы
- Оксиды
- Кислородная серия
- Вода
Щелочноземельный металл, бурно реагирующий с водой при комнатной температуре: A) CaB) BeC) MgD) Ba
Ответить
Проверено279,9 тыс.
Подсказка: Элементы группы 2 называются щелочноземельными металлами. Вспомните элементы, входящие в группу 2. Наблюдается тенденция реакционной способности щелочноземельных металлов с водой. По мере того, как мы спускаемся по группе, элементы группы 2 становятся более реактивными по отношению к воде. + просмотров
+ просмотровПолный ответ:
Элементы группы 2 включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), и эти элементы известны как щелочноземельные металлы. Элементы группы 2 реагируют с холодной водой, кроме бериллия и магния, с образованием гидроксида металла и воды.
$M + 2{H_2}O \to M{(OH)_2} + {H_2}$
Магний и бериллий реагируют с водяным паром с образованием оксида металла и газообразного водорода. Щелочноземельные металлы становятся более реактивными по отношению к воде, когда мы спускаемся вниз по группе.
Объяснение приведенной выше тенденции:
Когда щелочноземельные металлы реагируют с водой с образованием оксидов или гидроксидов металлов, образуются ионы металлов. Для образования этих ионов из исходного металла требуется затрата энергии. Первая и вторая энергии ионизации необходимы для превращения атомов металла в ионы с зарядом +2.
Для образования этих ионов из исходного металла требуется затрата энергии. Первая и вторая энергии ионизации необходимы для превращения атомов металла в ионы с зарядом +2.
По мере продвижения вниз по группе энергия ионизации уменьшается, поскольку становится легче образовывать ионы из-за меньшего притяжения электронов к ядру в более тяжелых атомах. Таким образом, реакция становится легче, поскольку энергия, необходимая для образования положительных ионов, падает. Следовательно, это приводит к более низкой энергии активации и, следовательно, к более быстрым реакциям. Барий (Ba) является предпоследним щелочноземельным металлом и самым тяжелым металлом в своей группе. Для образования ионов требуется наименьшая энергия ионизации и, следовательно, энергия активации. Так, он бурно реагирует с водой при комнатной температуре.Таким образом, вариант D правильный.
Примечание:
При взаимодействии металла с холодной водой образуется гидроксид металла, а при взаимодействии металла с паром образуется оксид металла.

 Multiple-choice
Multiple-choice