ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
Свойства щелочноземельных металлов
Физические свойства
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t╟пл. и t╟кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
1. Очень реакционноспособны.
2. Обладают положительной валентностью +2.
3. Реагируют с водой при комнатной температуре (кроме Be) с выделением водорода.
4. Обладают большим сродством к кислороду (восстановители).
5. С водородом образуют солеобразные гидриды ЭH2.
6. Оксиды имеют общую формулу ЭО. Тенденция к образованию пероксидов выражена слабее, чем для щелочных металлов.
Нахождение в природе
Be
3BeO ∙ Al2O3 ∙ 6SiO2 берилл
Mg
MgCO3 магнезит
CaCO3 ∙ MgCO
KCl ∙ MgSO4 ∙ 3H2O каинит
KCl ∙ MgCl2 ∙ 6H2O карналлит
Ca
CaCO3 кальцит (известняк, мрамор и др. )
)
Ca3(PO4)2 апатит, фосфорит
CaSO4 ∙ 2H2O гипс
CaSO4 ангидрит
CaF2 плавиковый шпат (флюорит)
Sr
SrSO4 целестин
SrCO3 стронцианит
Ba
BaSO4 барит
BaCO3 витерит
Получение
Бериллий получают восстановлением фторида:
BeF2 + Mg═ t═ Be + MgF2
Барий получают восстановлением оксида:
3BaO + 2Al═ t═ 3Ba + Al2O3
Остальные металлы получают электролизом расплавов хлоридов:
CaCl2 = Ca + Cl2╜
катод: Ca2+ + 2ē = Ca0
анод: 2Cl— — 2ē = Cl02
MgO + C = Mg + CO
Металлы главной
подгруппы II
группы — сильные восстановители; в
соединениях проявляют только степень
окисления +2. Активность металлов и их
восстановительная способность
увеличивается в ряду: Be
Mg
Ca
Sr
Ba╝
Активность металлов и их
восстановительная способность
увеличивается в ряду: Be
Mg
Ca
Sr
Ba╝
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
Mg + 2H2O═ t═ Mg(OH)2 + H2
Ca + 2H2O = Ca(OH)2 + H2╜
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид BaO2:
2Mg + O2 = 2MgO
Ba + O2 = BaO2
3. С другими неметаллами образуются бинарные соединения:
Be + Cl2 = BeCl2 (галогениды)
Ba + S = BaS (сульфиды)
3Mg + N2 = Mg3N2 (нитриды)
Ca + H2 = CaH2(гидриды)
Ca + 2C = CaC2(карбиды)
3Ba + 2P = Ba3P2(фосфиды)
Бериллий и магний
сравнительно медленно реагируют с
неметаллами.
4. Все металлы растворяются в кислотах:
Ca + 2HCl = CaCl2 + H2╜
Mg + H2
SO4(разб.) = MgSO4 + H2╜Бериллий также растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2╜
5. Качественная реакция на катионы щелочноземельных металлов — окрашивание пламени в следующие цвета:
Ca2+ — темно-оранжевый
Sr2+— темно-красный
Ba2+ — светло-зеленый
Катион Ba2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
Сульфат бария — белый осадок, нерастворимый в минеральных кислотах.
Оксиды щелочноземельных металлов
Получение
1) Окисление металлов (кроме Ba, который образует пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO3═ t═ CaO + CO2╜
2Mg(NO3)2═
Химические свойства
Типичные основные
оксиды. Реагируют с водой (кроме BeO),
кислотными оксидами и кислотами
Реагируют с водой (кроме BeO),
кислотными оксидами и кислотами
MgO + H2O = Mg(OH)2
3CaO + P2O5 = Ca3(PO4)2
BeO + 2HNO3 = Be(NO3)2 + H2O
BeO — амфотерный оксид, растворяется в щелочах:
BeO + 2NaOH + H2O = Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов R(OH)
2Получение
Реакции щелочноземельных металлов или их оксидов с водой: Ba + 2H2O = Ba(OH)2 + H2
CaO(негашеная известь) + H2O = Ca(OH)2(гашеная известь)
Химические свойства
Гидроксиды R(OH)2 — белые кристаллические вещества, в воде
растворимы хуже, чем гидроксиды щелочных
металлов (растворимость гидроксидов
уменьшается с уменьшением порядкового
номера; Be(OH)2 — нерастворим в воде, растворяется в
щелочах). Основность R(OH)2 увеличивается с увеличением атомного
номера:
Основность R(OH)2 увеличивается с увеличением атомного
номера:
Be(OH)2 — амфотерный гидроксид
Mg(OH)2 — слабое основание
остальные гидроксиды — сильные основания (щелочи).
1) Реакции с кислотными оксидами:
Ca(OH)2 + SO2 = CaSO3¯ + H2O
Ba(OH)2 + CO2 = BaCO3¯ + H2O
2) Реакции с кислотами:
Mg(OH)2 + 2CH3COOH
= (CH3COO)2Mg
+ 2H
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
3) Реакции обмена с солями:
Ba(OH)2 + K2SO4 = BaSO4¯+ 2KOH
4) Реакция гидроксида бериллия со щелочами:
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Жесткость воды
Природная вода,
содержащая ионы Ca2+ и Mg2+,
называется жесткой. Жесткая вода при
кипячении образует накипь, в ней не
развариваются пищевые продукты; моющие
средства не дают пены.
Жесткая вода при
кипячении образует накипь, в ней не
развариваются пищевые продукты; моющие
средства не дают пены.
Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость — хлоридов и сульфатов.
Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.
Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca 2+ и Mg2+:
1) кипячением:
Сa(HCO3)2═ t═ CaCO3¯ + CO2 + H2O
Mg(HCO3)2═ t═ MgCO3¯ + CO2 + H2O
2) добавлением известкового молока:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O
3) добавлением соды:
Ca(HCO3)2 + Na2CO3 = CaCO3¯+ 2NaHCO3
CaSO4 + Na2CO3 = CaCO3¯ + Na2SO4
MgCl2 + Na2CO3 = MgCO3¯ + 2NaCl
Для удаления
временной жесткости используют все
четыре способа, а для постоянной — только
два последних.
Термическое разложение нитратов.
Э(NO3)2 =t= ЭO + 2NO2 + 1/2O2
Особенности химиии берилия.
Be(OH)2 + 2NaOH (изб) = Na2[Be(OH)4]
Al(OH)3 + 3NaOH (изб) = Na3[Al(OH)6]
Be + 2NaOH + 2h3O = Na2[Be(OH)4] + h3
Al + 3NaOH + 3h3O = Na3[Be(OH)4] + 3/2h3
Be, Al + HNO3 (Конц) = пассивация
С чем взаимодействуют щелочноземельные металлы
Щелочноземельные металлы и их соединения
Элементы II группы главной подгруппы
1. Положение в Периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
 1.5. Взаимодействие с углеродом
1.5. Взаимодействие с углеродом7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с оксидами неметаллов
7.2.6. Взаимодействие с солями и оксидами металлов
Оксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотными и амфотерными оксидами
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Амфотерные свойства оксида бериллия
Гидроксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с амфотерными оксидами и гидроксидами
2.4. Взаимодействие с кислыми солями
2.
 6. Взаимодействие с металлами
6. Взаимодействие с металлами2.7. Взаимодействие с солями
2.8. Разложение при нагревании
2.9. Диссоциация
2.10. Амфотерные свойства гидроскида бериллия
Соли щелочноземельных металлов
Жесткость
1. Постоянная и временная жесткость
2. Способы устранения жесткости
Элементы II группы главной подгруппы
Положение в периодической системе химических элементовЩелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca
, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов: ns2, на внешнем энергетическом уровне в основном состоянии находится 2 s-электрона. Следовательно, типичная степень окисления щелочноземельных металлов в соединениях +2.
Рассмотрим некоторые закономерности изменения свойств щелочноземельных металлов.
В ряду Be—Mg—Ca—Sr—Ba—Ra, в соответствии с Периодическим законом, увеличивается
атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрицательность.
Физические свойства
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Кристаллическая решетка щелочноземельных металлов в твёрдом состоянии — металлическая. Следовательно, они обладают высокой тепло- и электропроводимостью. Кипят и плавятся при высоких температурах.
Нахождение в природе
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочноземельные металлы:
Доломит — CaCO3 · MgCO3 — карбонат кальция-магния.
Магнезит MgCO3 – карбонат магния.
Кальцит CaCO3 – карбонат кальция.
Гипс CaSO4 · 2H2O – дигидрат сульфата кальция.
Барит BaSO4 — сульфат бария.
Витерит BaCO3 – карбонат бария.
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
или восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий получают восстановлением оксида бария алюминием в вакууме при 1200 °C:
4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакцииКачественная реакция на щелочноземельные металлы — окрашивание пламени солями щелочноземельных металлов.
Цвет пламени:
Ca — кирпично-красный
Sr — карминово-красный (алый)
Ba — яблочно-зеленый
Качественная реакция на ионы магния: взаимодействие с щелочами. Ионы магния осаждаются щелочами с образованием белого осадка гидроксида магния:
Mg2+ + 2OH— → Mg(OH)2↓
Качественная реакция на ионы кальция, стронция, бария: взаимодействие с карбонатами. При взаимодействии солей кальция, стронция и бария с карбонатами выпадает белый осадок карбоната кальция, стронция или бария:
Ca2+ + CO32- → CaCO3↓
Ba2+ + CO32- → BaCO3↓
Качественная реакция на ионы стронция и бария: взаимодействие с карбонатами. При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция:
При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция:
Ba2+ + SO42- → BaSO4↓
Sr2+ + SO42- → SrSO4↓
Также осадки белого цвета образуются при взаимодействии солей кальция, стронция и бария с сульфитами и фосфатами.
Например, при взаимодействии хлорида кальция с фосфатом натрия образуется белый осадок фосфата кальция:
3CaCl2 + 2Na3PO4 → 6NaCl + 2Ca3(PO4)2↓
Химические свойства1. Щелочноземельные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочноземельные металлы реагируют с галогенами с образованием галогенидов при нагревании.
Например, бериллий взаимодействует с хлором с образованием хлорида бериллия:
Be + Cl2 → BeCl2
1.2. Щелочноземельные металлы реагируют при нагревании с серой и фосфором с образованием сульфидов и фосфоридов.
Например, кальций взаимодействует с серой при нагревании:
Ca + S → CaS
Кальций взаимодействует с фосфором с образованием фосфидов:
3Ca + 2P → Ca3P2
1.3. Щелочноземельные металлы реагируют с водородом при нагревании. При этом образуются бинарные соединения — гидриды. Бериллий с водородом не взаимодействует, магний реагирует лишь при повышенном давлении.
При этом образуются бинарные соединения — гидриды. Бериллий с водородом не взаимодействует, магний реагирует лишь при повышенном давлении.
Mg + H2 → MgH2
1.4. С азотом магний взаимодействует при комнатной температуре с образованием нитрида:
6Mg + 2N2 → 2Mg3N2
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
1.5. Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов.
Например, кальций взаимодействует с углеродом с образованием карбида кальция:
Ca + 2C → CaC2
Бериллий реагирует с углеродом при нагревании с образованием карбида — метанида:
2Be + C → Be2C
1. 6. Бериллий сгорает на воздухе при температуре около 900°С:
6. Бериллий сгорает на воздухе при температуре около 900°С:
2Be + O2 → 2BeO
Магний горит на воздухе при 650°С с выделением большого количества света. При этом образуются оксиды и нитриды:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Щелочноземельные металлы горят на воздухе при температуре около 500°С, в результате также образуются оксиды и нитриды.
Видеоопыт: горение кальция на воздухе можно посмотреть здесь.
2. Щелочноземельные металлы взаимодействуют со сложными веществами:
2.1. Щелочноземельные металлы реагируют с водой. Взаимодействие с водой приводит к образованию щелочи и водорода. Бериллий с водой не реагирует. Магний реагирует с водой при кипячении. Кальций, стронций и барий реагируют с водой при комнатной температуре.
Бериллий с водой не реагирует. Магний реагирует с водой при кипячении. Кальций, стронций и барий реагируют с водой при комнатной температуре.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
2Ca0 + 2H2+O = 2Ca+(OH)2 + H20
2.2. Щелочноземельные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной, разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например, магний реагирует с соляной кислотой:
2Mg + 2HCl → MgCl2 + H2↑
2.3. При взаимодействии щелочноземельных металлов с концентрированной серной кислотой образуется сера.
Например, при взаимодействии кальция с концентрированной серной кислотой образуется сульфат кальция, сера и вода:
4Ca + 5H2SO4(конц.) → 4CaSO4 + S + 5H2O
2.4. Щелочноземельные металлы реагируют с азотной кислотой. При взаимодействии кальция и магния с концентрированной или разбавленной азотной кислотой образуется оксид азота (I):
4Ca + 10HNO3 (конц) → N2O + 4Сa(NO3)2 + 5H2O
При взаимодействии щелочноземельных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
4Ba + 10HNO3 → 4Ba(NO3)2 + NH4NO3 + 3H2O
2. 5. Щелочноземельные металлы могут восстанавливать некоторые неметаллы (кремний, бор, углерод) из оксидов.
5. Щелочноземельные металлы могут восстанавливать некоторые неметаллы (кремний, бор, углерод) из оксидов.
Например, при взаимодействии кальция с оксидом кремния (IV) образуются кремний и оксид кальция:
2Ca + SiO2 → 2CaO + Si
Магний горит в атмосфере углекислого газа. При этом образуется сажа и оксид магния:
2Mg + CO2 → 2MgO + C
2.6. В расплаве щелочноземельные металлы могут вытеснять менее активные металлы из солей и оксидов. Обратите внимание! В растворе щелочноземельные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, кальций вытесняет медь из расплава хлорида меди (II):
Ca + CuCl2 → CaCl2 + Cu
Оксиды щелочноземельных металловСпособы получения
1. Оксиды щелочноземельных металлов можно получить из простых веществ — окислением металлов кислородом:
Оксиды щелочноземельных металлов можно получить из простых веществ — окислением металлов кислородом:
2Ca + O2 → 2CaO
2. Оксиды щелочноземельных металлов можно получить термическим разложением некоторых кислородсодержащих солей — карбонатов, нитратов.
Например, карбонат кальция разлагается на оксид кальция, оксид азота (IV) и кислород:
2Ca(NO3)2 → 2CaO + 4NO2 + O2
MgCO3 → MgO + CO2
СаСО3 → СаО + СО2
3. Оксиды магния и бериллия можно получить термическим разложением гидроксидов:
Mg(OH)2 → MgO + H2O
Химические свойстваОксиды кальция, стронция, бария и магния — типичные основные оксиды.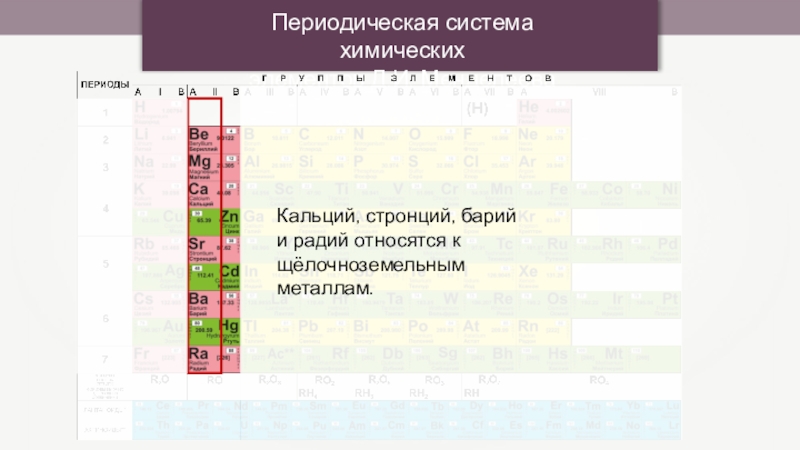 Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой. Оксид бериллия — амфотерный.
Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой. Оксид бериллия — амфотерный.
1. Оксиды кальция, стронция, бария и магния взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид магния взаимодействует с углекислым газом с образованием карбоната магния:
MgO + CO2 → MgCO3
2. Оксиды щелочноземельных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид кальция взаимодействует с соляной кислотой с образованием хлорида кальция и воды:
CaO + 2HCl → CaCl2 + H2O
3. Оксиды кальция, стронция и бария активно взаимодействуют с водой с образованием щелочей.
Например, оксид кальция взаимодействует с водой с образованием гидроксида кальция:
CaO + H2O → 2Ca(OH)2
Оксид магния реагирует с водой при нагревании:
MgO + H2O → Mg(OH)2
Оксид бериллия не взаимодействует с водой.
4. Оксид бериллия взаимодействует с щелочами и основными оксидами.
При взаимодействии оксида бериллия с щелочами в расплаве или с основными оксидами образуются соли-бериллаты.
Например, оксид натрия реагирует с оксидом бериллия с образованием бериллата натрия:
Na2O + BeO → Na2BeO2
Например, гидроксид натрия реагирует с оксидом бериллия в расплаве с образованием бериллата натрия:
2NaOH + BeO → Na2BeO2 + H2O
При взаимодействии оксида бериллия с щелочами в растворе образуются комплексные соли.
Например, оксид бериллия реагирует с гидроксидом калия с растворе с образованием тетрагидроксобериллата калия:
2NaOH + BeO + H2O → Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов Способы получения
1. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих оксидов с водой.
Например, оксид кальция (негашеная известь) при взаимодействии с водой образует гидроксид кальция (гашеная известь):
CaO + H2O → Ca(OH)2
Оксид магния взаимодействует с водой только при нагревании:
MgO + H2O → Mg(OH)2
2. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих металлов с водой.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
2Ca + 2H2O → 2Ca(OH)2 + H2
Магний взаимодействует с водой только при кипячении:
2Mg + 2H2O → 2Mg(OH)2 + H2
3. Гидроксиды кальция и магния можно получить при взаимодействии солей кальция и магния с щелочами.
Например, нитрат кальция с гидроксидом калия образует нитрат калия и гидроксид кальция:
Ca(NO3)2 + 2KOH → Ca(OH)2↓ + 2KNO3
Химические свойства1. Гидроксиды кальция, стронция и бария реагируют с всеми кислотами (и сильными, и слабыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Гидроксид магния взаимодействует только с сильными кислотами.
Например, гидроксид кальция с соляной кислотой реагирует с образова-нием хлорида кальция:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид бария с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
Ba(OH)2(избыток) + CO2 → BaCO3 + H2O
Ba(OH)2 + 2CO2(избыток) → Ba(HCO3)2
3. Гидроксиды кальция, стронция и бария реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид бария с оксидом алюминия реагирует в расплаве с образованием алюминатов:
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Ba(OH)2 + Al2O3 + 3H2O → Ba[Al(OH)4]2
4. Гидроксиды кальция, стронция и бария взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид кальция реагирует с гидрокарбонатом кальция с образованием карбоната кальция:
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
5. Гидроксиды кальция, стронция и бария взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода). Взаимодействие щелочей с неметаллами подробно рассмотрено в статье про щелочные металлы.
6. Гидроксиды кальция, стронция и бария взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Ca(OH)2 + Zn → CaZnO2 + H2
В растворе образуются комплексная соль и водород:
Ca(OH)2 + 2Al + 6Н2О = Ca[Al(OH)4]2 + 3Н2
7. Гидроксиды кальция, стронция и бария вступают в обменные реакции с растворимыми солями. Как правило, с этими гидроксидами реагируют растворимые соли тяжелых металлов (в ряду активности расположены правее алюминия), а также растворимые карбонаты, сульфиты, силикаты, и, для гидроксидов стронция и бария — растворимые сульфаты.
Например, хлорид железа (II) реагирует с гидроксидом бария с образованием хлорида бария и осадка гидроксида железа (II):
Ba(OH)2 + FeCl2 = BaCl2+ Fe(OH)2↓
Также с гидроксидами кальция, стронция и бария взаимодействуют соли аммония.
Например, при взаимодействии бромида аммония и гидроксида кальция образуются бромид кальция, аммиак и вода:
2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2
8. Гидроксид кальция разлагается при нагревании до 580оС, гидроксиды магния и бериллия разлагаются при нагревании:
Mg(OH)2 → MgO + H2O
9. Гидроксиды кальция, стронция и бария проявляют свойства сильных оснований. В воде практически полностью диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
Ba(OH)2 ↔ Ba2+ + 2OH—
Гидроксид магния — нерастворимое основание. Гидроксид бериллия проявляет амфотерные свойства.
10. Гидроксид и бериллия взаимодействует с щелочами. В расплаве образуются соли бериллаты, а в растворе щелочей — комплексные соли.
Например, гидроксид бериллия реагирует с расплавом гидроксида натрия:
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O
При взаимодействии гидроксида бериллия с избытком раствора щелочи образуется комплексная соль:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Соли щелочноземельных металлов Нитраты щелочноземельных металлов
Нитраты кальция, стронция и бария при нагревании разлагаются на нитриты и кислород. Исключение — нитрат магния. Он разлагается на оксид магния, оксид азота (IV) и кислород.
Например, нитрат кальция разлагается при нагревании на нитрит кальция и молекулярный кислород:
Ca(NO3)2 → Ca(NO2)2 + O2
Карбонаты щелочноземельных металлов1. Карбонаты щелочноземельных металлов при нагревании разлагаются на оксид и углекислый газ.
Например, карбонат кальция разлагается при температуре 1200оС на оксид кальция и углекислый газ:
CaCO3 → CaO + CO2
2. Карбонаты щелочноземельных металлов под действием воды и углекислого газа превращаются в растворимые в воде гидрокарбонаты.
Например, карбонат кальция взаимодействует с углекислым газом и водой с образованием гидрокарбоната кальция:
CaCO3 + H2O + CO2 → Ca(HCO3)2
3. Карбонаты щелочноземельных металлов взаимодействуют с более сильными кислотами с образованием новой соли, углекислого газа и воды.
Более сильные кислоты вытесняют менее сильные из солей.
Например, карбонат магния взаимодействует с соляной кислотой:
CaCO3 + 2HCl → CaCl2 + CO2↑+ H2O
4. Менее летучие оксиды вытесняют углекислый газ из карбонатов при сплавлении. К менее летучим, чем углекислый газ, оксидам относятся твердые оксиды — оксид кремния (IV), оксиды амфотерных металлов.
Менее летучие оксиды вытесняют более летучие оксиды из солей при сплавлении.
Например, карбонат кальция взаимодействует с оксидом алюминия при сплавлении:
CaCO3 + Al2O3 → Ca(AlO2)2 + CO2↑
Жесткость водыПостоянная и временная жесткость
Жесткость воды — это характеристика воды, обусловленная содержанием в ней растворенных солей щелочноземельных металлов, в основном кальция и магния (солей жесткости).
Временная (карбонатная) жесткость обусловлена присутствием гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2 в воде.
Постоянная (некарбонатная) жесткость обусловлена присутствием солей, не выделяющихся при кипячении из раствора: хлоридов (CaCl2) и сульфатов (MgSO4) кальция и магния.
Способы устранения жесткостиСуществуют химические и физические способы устранения жесткости. Химические способы устранения временной жесткости:
1. Кипячение. При кипячении гидрокарбонаты кальция и магния распадаются на нерастворимые карбонаты, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
2. Добавление извести (гидроксида кальция). При добавлении щелочи растворимые гидрокарбонаты переходят в нерастворимые карбонаты:
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + 2H2O
Химические способы устранения постоянной жесткости — реакции ионного обмена, которые позволяют осадить ионы кальция и магния из раствора:
1. Добавление соды (карбоната натрия). Карбонат натрия связывает ионы кальция и магния в нерастворимые карбонаты:
CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl
2. Добавление фосфатов. Фосфаты также связывают ионы кальция и магния:
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
Определение и место в периодической таблице
Определение: что такое щелочноземельные металлы
Щелочноземельные металлы — это группа высокореактивных элементов, расположенных рядом с группой щелочных металлов. Хотя все щелочные металлы встречаются в природе, их высокая реакционная способность не позволяет им встречаться свободно или в чистом виде [1, 2] .
Где находятся щелочноземельные металлы в Периодической таблице
Они принадлежат к Группе 2 (следующей за группой щелочного металла) в периодической таблице, где все щелочные металлы находятся в s-блоке [3, 4] .
Щелочно-земельные металлы периодической таблицы
Примеры щелочноземельных металлов
Почему их называют щелочноземельными металлами
Щелочные металлы названы так потому, что при смешивании с водой они образуют растворы с pH выше 7 и «основными» или «щелочными» свойствами [5] . Кроме того, они находятся в земной коре и не подвержены воздействию огня или тепла [6] .
Общие свойства и характеристики щелочноземельных металлов
Физические свойства
- Блестящий, серебристо-белый цвет
- Низкая плотность
- Низкие температуры кипения и плавления [1]
Химические свойства
- Все щелочноземельные металлы обладают высокой реакционной способностью, хотя и не так сильно, как щелочные металлы [5] .
- При контакте с водой все они сильно реагируют с образованием щелочных гидроксидов (исключение составляет бериллий, поскольку он не реагирует с водой).
- Элементы группы 2 обычно образуют электровалентные или ионные связи в реакциях с другими элементами (опять же, Be является исключением, поскольку он образует ковалентные связи) [5]
- Все они реагируют с галогенами и образуют галогенидные соединения [2]
Почему щелочноземельные металлы настолько реактивны
Энергия, необходимая для того, чтобы атом отдать электроны в своей внешней оболочке (валентные электроны), является энергией ионизации элемента.Чем ниже энергия ионизации, тем более реактивный элемент. Поскольку все щелочные металлы имеют только два валентных электрона, требуется небольшая энергия, чтобы заставить их отдать эти электроны с образованием катионов (2+), что приводит к высокой реакционной способности [7] .
Бериллий (Be) не реагирует с водой из-за своего небольшого атомного размера и относительно высокой энергии ионизации [8] .
Реакция с водой
Щелочные металлы реагируют с водой при комнатной температуре с образованием почти нерастворимых в воде гидроксидов вместе с ионами водорода с образованием основного раствора [8] .Вот как уравнение выглядит для реакции между кальцием и водой:
Ca + 2H 2 O ⟶ Ca (OH) 2 + H 2
Реакция с кислородом
Все шесть элементов группы 2 реагируют с кислородом с образованием оксидов, хотя и не так легко, как элементы группы 1. Реакция требует тепла. Следующее уравнение показывает, как магний (Mg) будет реагировать с кислородом (O 2 )
2Mg + O 2 ⟶ 2MgO
Щелочноземельных металлов используется
Be и Mg широко используются в производстве сплавов, используемых в промышленных конструкциях, включая жаропрочные заводские инструменты, а также детали автомобилей и самолетов.Ba находит применение в различных медицинских и диагностических процедурах, таких как рентген и МРТ (бариевая пища). Наиболее важное применение Sr — это производство фейерверков, поскольку он помогает создавать красочные вспышки. Помимо радия, щелочноземельные металлы также используются в лампах-вспышках и батареях.
Радий, являясь высокорадиоактивным элементом, в настоящее время не имеет промышленного применения. Ранее он использовался в светящихся красках и циферблатах часов [1, 9] .
Роль щелочноземельных металлов в биологических системах
Mg и Ca играют жизненно важную функциональную и структурную роль в физиологии растений и животных, причем Mg присутствует в молекулах хлорофилла, в то время как Ca является одним из основных компонентов костей.Кроме того, SR необходим для выживания ряда морских существ, в первую очередь различных твердых кораллов, поскольку этот элемент помогает формировать их экзоскелеты [1, 5] .
FAQ
Q 1. Какой щелочноземельный металл самый легкий?
Отв. Бериллий — самый легкий элемент в этом семействе, имеющий наименьший атомный радиус.
Q 2. Какой щелочноземельный металл самый тяжелый?
Отв. Радий — самый тяжелый щелочноземельный металл с наибольшим атомным радиусом [10]
3 квартал.Какие щелочноземельные металлы наиболее распространены?
Отв. Кальций и магний — самые распространенные щелочноземельные металлы
Q 4. Каковы основные различия между щелочноземельными металлами и щелочными металлами?
Отв. Щелочные и щелочноземельные металлы обладают некоторыми схожими физическими свойствами, но главное различие между ними — количество валентных электронов. Щелочноземельные металлы имеют два валентных электрона, тогда как щелочные металлы имеют только один.Это делает первый менее реактивным, чем второй [11] .
Интересные факты
- Щелочноземельные металлы представляют собой семейство наиболее реактивных элементов после щелочных металлов [5] .
- Первый и последний элементы группы 2, Be и Ra, токсичны для живых организмов [1] .
- Все шесть элементов образуют цветное пламя при горении: ярко-белое для бериллия и магния, красный для кальция и радия, малиновый для стронция и зеленый для бария.
- Известно, что четыре из шести щелочноземельных элементов были впервые выделены английским химиком сэром Хамфри Дэви [2] .
Артикул:
- Щелочноземельные металлы — Courses.lumenlearning.com
- Щелочноземельные металлы — Ducksters.com
- Элементы S-блока в Периодической таблице: свойства и обзор — Study.com
- Элементы группы 2: щелочноземельные металлы — Chem.libretexts.org
- Направление во вторую группу — Chem4kids.com
- Физические свойства щелочноземельных металлов — Classnotes.org.in
- Щелочноземельные металлы: определение, свойства и характеристики — Study.com
- Реакции элементов основной группы с водой — Chem.libretexts.org
- Повседневное использование щелочноземельных металлов — Schooledbyscience.com
- Самый тяжелый щелочноземельный металл — Guinnessworldrecords.com
- Щелочные и щелочноземельные металлы — Technologyuk.net
щелочноземельных металлов — учебный материал для IIT JEE
Группа 2 периодической таблицы состоит из шести металлических элементов.Это бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Название щелочноземельных металлов было дано магнию, кальцию, барию и стронцию, поскольку их оксиды были щелочными по своей природе, и эти оксиды не подвергались воздействию тепла или огня и существовали в земле.
Итак, металлы группы 2 называются щелочноземельными металлами, потому что их гидроксиды являются сильными щелочами (как и гидроксиды щелочных металлов), плюс все они находятся в земной коре.
Подобно щелочным металлам, щелочноземельные металлы также обладают высокой реакционной способностью и, следовательно, не встречаются в свободном состоянии, но, вероятно, распространяются в природе в комбинированном состоянии в виде силикатов, карбонатов, сульфатов и фосфатов.
Элементы | Обилие | Основные минералы | Использует |
Бериллий | от 2,8 до 10-3% | Впервые обнаружен в 1798 году в драгоценных камнях берилле и изумруде (Be 3 Al 2 Si 6 O 1 ) | Используется в коррозионно-стойких сплавах. |
Магний | 2,33%, 7-й по содержанию элемент в земной коре | Чистый магний, впервые полученный в 1800 году, назван в честь района магнезии в Фессалии, Греция, где обнаружены большие месторождения этого минерала. | Легированный алюминием Mg широко используется в качестве конструкционных материалов из-за его высокой прочности, низкой плотности и простоты обработки. |
Кальций | 4,15%, 5-й по содержанию элемент в земной коре. | CaCO 3 .2H 2 O, полученный в чистом виде в 1808 году, кальций происходит от латинского слова calx, что означает «известь» | В качестве легирующего агента для повышения твердости соединений алюминия. Кальций — основная составляющая зубов и костей. |
Стронций | 0,038% | Обнаружен в 1787 году и назван в честь небольшого городка Стронтион (Шотландия) | SrCO 3 используется для производства стекла для кинескопов цветных телевизоров. |
Барий | 0.042% | Обнаружен в минералах витерит (BaCO 3 ) и барит (BaSO 4 ), в честь которых назван. | BaSO 4 используется в медицине как контрастное вещество для желудка и кишечника Рентген |
Радий | Следы | Выделено в виде хлорида в 1898 г. из минеральной настурановой обманки | Используется в радиотерапии рака |
Группа IIA (щелочноземельные металлы) и группы IIB (Zn, Cd, Hg) Mg действует как мостик между IIA и IIB.
S. No. | Недвижимость | IIA (Be, Mg, Ca, Sr, Ba, Ra) | IIB (Zn, Cd, Hg) |
1 | Электронная конфигурация | [Инертный газ] ns 2 | [Инертный газ] (n — 1) d 10 ns 2 |
2. | Блок | S — блок | д — квартал |
3. | Степень окисления | +2 | +2, ртуть также образует димер Hg 2 +2 |
4. | Природа оксида | BeO амфотерный, остальные оксиды — основные. | ZnO — амфотерный, CdO и MgO — основные |
5. | Природа галогенидов | Электронно-дефицитный BeX2, остальные (MX2) ионные: MgCl 2 2 2 2 | ZnCl 2 , CdCl 2 ионные, но менее IIA, HgCl 2 ковалентные. |
6. | Природа сульфатов | Менее растворим в воде и растворимость снижается по группе BeSO 4 > MgSO 4 > CaSO 4 > SrSO 4 > BaSO 4 | Более растворим, чем IIA |
7. | Природа гидроксидов | Растворимость гидроксидов увеличивается по мере продвижения вниз по группе. | Растворимость гидроксидов уменьшается по мере продвижения вниз по группе. |
8. | Природа сульфидов | Растворимый | ZnS, CdS, HgS нерастворимы и выпадают в осадок при солевом анализе. |
9. | Реакционная способность | Увеличивается по мере продвижения вниз по группе Be | Уменьшается при движении вниз по группе Zn> Cd> Hg |
Электронная конфигурация
Общая электронная конфигурация щелочноземельных металлов — ns 2 .
Элементы | Электронная конфигурация |
Be | 1 с 2 2 с 2 |
мг | 1с 2 2с 2 sp |
Щелочноземельные металлы
Щелочноземельные металлы — это 6 элементов, находящихся во втором столбце периодической таблицы. (Тодд Хелменстайн)Щелочноземельные металлы или щелочноземельные металлы — это набор из шести элементов, находящихся во второй группе (столбце) периодической таблицы. Атомы каждого из этих элементов имеют по два электрона на внешней электронной оболочке. Обратите внимание на элементы этой группы и их общие свойства:
Список щелочноземельных металлов
Есть шесть щелочноземельных металлов.В порядке возрастания атомного номера они следующие:
Свойства щелочноземельного металла
Это кристаллы магния. Другие щелочноземельные металлы имеют аналогичный внешний вид и свойства. (Марк Фергус, CSIRO)Поскольку каждый атом имеет два валентных электрона, элементы этой группы имеют несколько общих характеристик:
- Атомы имеют полную внешнюю электронную оболочку s (2 электрона), что означает, что эти элементы образуют катионы с 2+ и степень окисления 2+.
- Атомы имеют низкое сродство к электрону и низкую электроотрицательность.
- Все щелочноземельные металлы — блестящие металлы серебристого цвета при обычных температурах и давлении.
- Эти металлы ковкие и пластичные.
- Щелочноземельные металлы обычно мягкие, с относительно низкими плотностями, температурами плавления и кипения металлов. Температуры плавления и кипения по-прежнему намного выше, чем у неметаллов. Хотя эти элементы мягкие, они тверже, чем элементы группы щелочных металлов.
- Элементы этой группы умеренно реакционноспособны, причем реакционная способность возрастает по мере продвижения вниз по таблице Менделеева (т.е. стронций более реактивен, чем кальций).
- Щелочноземельные металлы находятся в соединениях, но не в свободном виде.
- Щелочноземельные металлы легко реагируют с галогенами (Cl, Br и т. Д.) С образованием галогенидов. Они также реагируют с кислородом с образованием оксидов.
- Хотя это и не свойство само по себе, стоит отметить, что все щелочноземельные элементы названы в честь своих оксидов (щелочноземельных элементов), которые имеют названия бериллий, магнезия, известь, стронция и барита.
Щелочноземельный металл | химический элемент
Щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
таблица МенделееваСовременная версия периодической таблицы элементов.
Encyclopædia Britannica, Inc.Возникновение, свойства и использование
До XIX века неметаллические, нерастворимые в воде и неизменные в огне вещества назывались землей.Эти земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированная сода и поташ), были названы щелочноземельными. Таким образом, щелочные земли отличались от щелочных и других земель, таких как глинозем и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле представляют собой оксиды, соединения металла и кислорода. Металлы, оксиды которых составляют щелочноземельные земли, затем стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году.
Как и в случае щелочных металлов Группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны и становятся положительными ионами (катионами). Поэтому большинство их типичных соединений являются ионными: соли, в которых металл присутствует в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат ионы M + ), хлорида натрия ( NaCl) и монооксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (то есть щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, наиболее тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются очень реактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняЗа исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести наиболее распространенных элементов на Земле) и играют важную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны.Этот металл никогда не производился в промышленных масштабах, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, их в значительной степени вытеснили менее дорогие альтернативы.
История
Самым ранним из известных щелочноземельных металлов была известь (лат. calx ), которая теперь известна как оксид кальция; его использовали в древности в составе раствора. Магнезия (название происходит, вероятно, от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочноземельный элемент, отличный от извести; он заметил, что магнезия дает растворимый сульфат, тогда как полученный из извести, как известно, нерастворим.В 1774 году шведский химик Карл Вильгельм Шееле, открывший кислород, обнаружил, что минерал под названием тяжелый шпат или барис (по-гречески «тяжелый») содержит новую землю, которая стала известна как барита (оксид бария). Еще одна земля, стронция (оксид стронция), была идентифицирована лондонскими химиками Уильямом Крукшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), обнаруженного в свинцовой шахте в Стронтиане в Аргайлшире, Шотландия. Бериллия (оксид бериллия) была извлечена из минерала берилла и признана землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году.Хотя сначала его путали с глиноземом (оксидом алюминия), потому что оба они растворяются в щелочи, бериллий оказался отличным от других; в отличие от глинозема он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально бериллия называлась glucina (греч. glykys , «сладкий») из-за ее сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Кристалл аквамаринаКристалл аквамарина, формы драгоценного камня минерала берилла (силикат алюминия бериллия).Берилл также является коммерческим источником бериллия.
© Стефан Пицко / Dreamstime.comМагний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены как нечистые металлы английским химиком сэром Хэмфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделения щелочных металлов, калия и натрия. Позднее щелочноземельные металлы были получены восстановлением их солей свободными щелочными металлами, и именно таким образом (действие калия на хлорид бериллия) бериллий был впервые выделен немецким химиком Фридрихом Велером и французским химиком Антуаном Бюсси. самостоятельно в 1828 г.Радий был открыт в 1898 году благодаря его радиоактивности французскими физиками Пьером и Мари Кюри, которые к 1902 году выделили его в виде хлорида радия из урана. Металлический радий был выделен в 1910 году в результате совместной работы Марии Кюри и французского химика Андре-Луи Дебьерна.
Аппарат, использованный Мари и Пьером Кюри для изучения радияАппарат, использованный Мари и Пьером Кюри для исследования отклонения бета-лучей от радия в магнитном поле, 1904 год.Кюри и их помощник Ж. Бемон открыли радиоактивный элемент радий в 1898 году.
© Photos.com/Jupiterimages .Химические свойства — HimHelp.ru
На свежем разрезе s–металлы имеют блестящую поверхность, однако, вступая в контакт с кислородом воздуха, они окисляются и быстро тускнеют, поэтому в случае необходимости их хранят под слоем керосина (за исключением бериллия и магния, которые образуют на поверхности защитный слой оксида).
Все s–металлы горят в атмосфере воздуха, образуя оксиды одного или нескольких типов — нормальные оксиды состава Ме2О (I группа) и МеО (II группа), пероксиды состава Мe2O2 (I группа) и МеО2 (II группа), />супероксиды состава МеО2 (I группа) и МеО4 (II группа).
Например, только литий сгорает на воздухе с образованием оксида
4Li + О2 = 2Li2О,
а натрий образует смесь пероксида и супероксида:
3Na + 2О2 = Nа2О2 + NаО2.
Оксиды натрия и калия могут быть получены только при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
К2О2 + 2К = 2К2О.
Все s–металлы, за исключением бериллия, соединяются с водородом при нагревании, образуя гидриды; при взаимодействии с галогенами, серой, азотом, фосфором, углеродом и кремнием образуются соответственно галогениды, сульфиды, нитриды и фосфиды, карбиды и силициды.
При взаимодействии щелочных металлов с водой образуются щелочи и водород. Активность металлов возрастает сверху вниз по группе. Так, литий реагирует с водой относительно медленно, тогда как калий реагирует со взрывом и горит фиолетовым пламенем на поверхности воды.
2Li + 2Н2О = 2LiOН + Н2↑.
Реакционная способность щелочноземельных металлов падает при перемещении снизу вверх II группы. Барий, стронций и кальций энергично реагируют уже с холодной водой:
Са + 2Н2О = Са(ОН)2 + Н2↑.
Магний очень медленно реагирует с холодной водой, но бурно с водяным паром. Бериллий практически не реагирует с холодной водой и медленно реагирует не только с горячей водой, но даже с паром.
С кислотами все щелочные металлы реагируют со взрывом, поэтому такие реакции специально не проводят. Щелочноземельные металлы также бурно реагируют с кислотами; исключением является бериллий.
Металлы I группы, а также кальций, стронций и барий при взаимодействии с жидким аммиаком или при нагревании в парах аммиака, образуют амиды и водород:
2Nа + 2NН3 = 2NаNН2 + Н2↑.
Образующиеся амиды — кристаллы, легко гидролизующиеся с образованием щелочи и аммиака:
КNН2 + Н2О = КОН + NН3↑.
Металлы I и II групп (за исключением бериллия) могут взаимодействовать со спиртами, образуя алкоголяты:
НОСН2–СН2ОН + 2Nа → NaОСН2–СН2ОNа + Н2↑,
а также с органическими кислотами, образуя соли, подобные ацетату натрия СН3СООNа. Натриевые соли высших жирных кислот широко используются для получения мыла.
Щелочные и щелочноземельные металлы способны вступать в реакции и со многими другими органическими веществами, образуя большой набор так называемых металлоорганических соединений.
Получение. Большинство s–металлов имеют высокие электродные потенциалы и являются сильнейшими среди известных восстановителей. Поэтому электролиз водных растворов солей этих металлов не приводит к получению самих металлов, а лишь к образованию щелочей. Свободные металлы получают электролизом расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы.
Для получения магния в промышленных масштабах часто используют морскую воду. На первой стадии катионы Мg2+, содержащиеся в морской воде, осаждают в виде гидроксида магния:
Мg2+ + Са(ОН)2 = Мg(ОН)2↓ + Са2+ .
Далее гидроксид превращают в хлорид магния с помощью соляной кислоты:
Мg(ОН)2 + 2НСl = МgСl2 + 2Н2О,
выпаривают полученный раствор, прокаливают и уже затем подвергают электролизу расплав МgСl2.
Щелочноземельные металлы
Свойства щелочноземельных металлов
|
Атомный |
Название |
Атомная |
Электронная |
r |
t°пл. |
t°кип. |
ЭО |
Атомный |
Степень |
|
4 |
Бериллий Be |
9,01 |
[He] 2s2 |
1,86 |
1283 |
2970 |
1,5 |
0,113 |
+2 |
|
11 |
Магний Mg |
24,3 |
[Ne]3s2 |
1,74 |
649,5 |
1120 |
1,2 |
0,16 |
+2 |
|
19 |
Кальций Ca |
40,08 |
[Ar] 4s2 |
1,54 |
850 |
1487 |
1,0 |
0,2 |
+2 |
|
27 |
Стронций Sr |
87,62 |
[Kr] 5s2 |
2,67 |
770 |
1367 |
1,0 |
0,213 |
+2 |
|
55 |
Барий Ba |
137,34 |
[Xe] 6s2 |
3,61 |
710 |
1637 |
0,9 |
0,25 |
+2 |
|
87 |
Радий Ra |
226 |
[Rn] 7s2 |
~6 |
~700 |
1140 |
0,9 |
– |
+2 |
Физические свойства
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
1. Очень реакционноспособны.
2. Обладают положительной валентностью +2.
3. Реагируют с водой при комнатной температуре (кроме Be) с выделением водорода.
4. Обладают большим сродством к кислороду (восстановители).
5. С водородом образуют солеобразные гидриды Эh3.
6. Оксиды имеют общую формулу ЭО. Тенденция к образованию пероксидов выражена слабее, чем для щелочных металлов.
Нахождение в природе
Be
3BeO • Al2O3 • 6SiO2 – берилл
Mg
MgCO3 – магнезит
CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3h3O – каинит
KCl • MgCl2 • 6h3O – карналлит
Ca
CaCO3 – кальцит (известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2h3O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат (флюорит)
Sr
SrSO4 – целестин
SrCO3 – стронцианит
Ba
BaSO4 – барит
BaCO3 – витерит
Получение
Бериллий получают восстановлением фторида:
BeF2 + Mg –t°® Be + MgF2
Барий получают восстановлением оксида:
3BaO + 2Al –t°® 3Ba + Al2O3
Остальные металлы получают электролизом расплавов хлоридов:
CaCl2 ® Ca + Cl2
катод: Ca2+ + 2e ® Ca0
анод: 2Cl- – 2e ® Cl02
Металлы главной подгруппы II группы — сильные восстановители; в соединениях проявляют только степень окисления +2. Активность металлов и их восстановительная способность увеличивается в ряду: ––Be–Mg–Ca–Sr–Ba®
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являтся сильными основаниями:
Mg + 2h3O –t°® Mg(OH)2 + h3
Ca + 2h3O ® Ca(OH)2 + h3
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
2Mg + O2 ® 2MgO
Ba + O2 ® BaO2
3. С другими неметаллами образуются бинарные соединения:
Be + Cl2 ® BeCl2(галогениды)
Ba + S ® BaS(сульфиды)
3Mg + N2 ® Mg3N2(нитриды)
Ca + h3 ® Cah3(гидриды)
Ca + 2C ® CaC2(карбиды)
3Ba + 2P ® Ba3P2(фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все металлы растворяются в кислотах:
Ca + 2HCl ® CaCl2 + h3
Mg + h3SO4(разб.) ® MgSO4 + h3
Бериллий также растворяется в водных растворах щелочей:
Be + 2NaOH + 2h3O ® Na2[Be(OH)4] + h3
5. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
Ca2+ — темно-оранжевый
Sr2+- темно-красный
Ba2+ — светло-зеленый
Катион Ba2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
Сульфат бария – белый осадок, нерастворимый в минеральных кислотах.
Оксиды щелочноземельных металлов
Получение
1) Окисление металлов (кроме Ba, который образует пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO3 –t°® CaO + CO2
2Mg(NO3)2 –t°® 2MgO + 4NO2 + O2
Химические свойства
Типичные основные оксиды. Реагируют с водой (кроме BeO), кислотными оксидами и кислотами
MgO + h3O ® Mg(OH)2
3CaO + P2O5 ® Ca3(PO4)2
BeO + 2HNO3 ® Be(NO3)2 + h3O
BeO — амфотерный оксид, растворяется в щелочах:
BeO + 2NaOH + h3O ® Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов R(OH)2
Получение
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2h3O ® Ba(OH)2 + h3
CaO(негашеная известь) + h3O ® Ca(OH)2(гашеная известь)
Химические свойства
Гидроксиды R(OH)2 — белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера:
Be(OH)2 – амфотерный гидроксид
Mg(OH)2 – слабое основание
остальные гидроксиды — сильные основания (щелочи).
1) Реакции с кислотными оксидами:
Ca(OH)2 + SO2 ® CaSO3 + h3O
Ba(OH)2 + CO2 ® BaCO3¯ + h3O
2) Реакции с кислотами:
Mg(OH)2 + 2Ch4COOH ® (Ch4COO)2Mg + 2h3O
Ba(OH)2 + 2HNO3 ® Ba(NO3)2 + 2h3O
3) Реакции обмена с солями:
Ba(OH)2 + K2SO4 ® BaSO4¯+ 2KOH
4) Реакция гидроксида бериллия со щелочами:
Be(OH)2 + 2NaOH ® Na2[Be(OH)4]
Жесткость воды
Природная вода, содержащая ионы Ca2+ и Mg2+, называется жесткой. Жесткая вода при кипячении образует накипь, в ней не развариваются пищевые продукты; моющие средства не дают пены.
Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов.
Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.
Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca2+ и Mg2+:
1) кипячением:
Сa(HCO3)2 –t°® CaCO3¯ + CO2 + h3O
Mg(HCO3)2 –t°® MgCO3¯ + CO2 + h3O
2) добавлением известкового молока:
Ca(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2h3O
3) добавлением соды:
Ca(HCO3)2 + Na2CO3 ® CaCO3¯+ 2NaHCO3
CaSO4 + Na2CO3 ® CaCO3¯ + Na2SO4
MgCl2 + Na2CO3 ® MgCO3¯ + 2NaCl
4) пропусканием через ионнообменную смолу
а) катионный обмен:
2RH + Ca2+ ® R2Ca + 2H+
б) анионный обмен:
2ROH + SO42- ® R2SO4 + 2OH-
(где R — сложный органический радикал)
Для удаления временной жесткости используют все четыре способа, а для
постоянной — только два последних.
Металлы щелочные и щелочноземельные — Справочник химика 21
Среди элементарных веществ к типичным восстановителям принадлежат активные металлы (щелочные и щелочноземельные, цинк, алюминий, железо и др.), а также некоторые неметаллы, такие, как водород, углерод (в виде угля или кокса), фосфор, кремний. При этом в кислой среде металлы окисляются до положительна заряженных ионов, а в щелочной среде те металлы, которые образуют амфотерные гидроксиды (например, цинк, алюминий, олово), входят в состав отрицательно заряженных анионов или гидроксокомплексов. Углерод чаще всего окисляется [c.164]Помещения цехов, производств, установок с наличием твердых веществ, взаимодействующих с образованием горючих газов и воспламеняющихся на воздухе карбиды щелочных и щелочноземельных металлов щелочные и щелочноземельные металлы (калий, натрий, литий [c.381]
Солеобразные гидриды образуют наиболее активные металлы (щелочные и щелочноземельные). Эти соединения построены по типу ионных, т. е. состоят из поло китель-ных ионов металла и отрицательных ионов водорода. Последнее подтверждается практически — при электролизе расплава соединения водород будет выделяться на аноде. [c.207]
Минеральные компоненты нефти. В состав нефти входят многие элементы. В золе нефтей обнаружены металлы щелочные и щелочноземельные Ь, Ыа, К, Ва, Са, 5г, Мн металлы подгруппы меди Си, Ag, Аи цинка 2п, Сё, Hg бора В, А1, Са ванадия V, [c.31]
Поэтому по окислительной активности водород существенно уступает галогенам. По этой же причине ясно выраженный ионный характер проявляют лишь гидриды наиболее активных металлов — щелочных и щелочноземельных, например КН и СаНа. [c.276]
Углерод непосредственно соединяется со многими металлами, образуя карбиды — соединения, в которых углерод электроотрицателен. Степень окисления углерода в карбидах различна. Различны и химические свойства карбидов. С активными металлами — щелочными и щелочноземельными — углерод образует солеподобные карбиды, в которых атомы углерода связаны между собой тройной связью в группировку — С С —, как, например, в СаС . Степень окисления углерода в них —1. При взаимодействии этих карбидов с водой они подвергаются гидролизу с образованием гидроксида металла и ацетилена [c.203]
Распределительная хроматография на целлюлозе применялась также для выделения тория из руд, при анализе сплавов и сталей, для разделения благородных металлов, щелочных и щелочноземельных металлов и некоторых других элементов [102]. [c.175]
Оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с кальция) при обычных условиях непосредственно взаимодействуют с водой, образуя гидроксиды, которые являются сильными, растворимыми в воде основаниями — щелочами, например, [c.9]
Подобные полярные связи образуются и в том случае, когда для образования связывающего дублета электроны предоставляет каждый из атомов, но только тогда, когда из-эа структурного расположения и неодинакового притяжения электронного дублета различными атомными ядрами связывающая электронная пара смещена от центра связи к одному из ядер. Такая связь образуется в молекуле воды, в которой предполагается значительная степень ионного взаимодействия. Полярные связи образуются при связывании элементов, сильно различающихся по электроотрицательности. Это неудивительно, особенно для связей, которые образует кислород или фтор с некоторыми ионами металлов (щелочные и щелочноземельные металлы). [c.159]
IV. Самовозгорающиеся и самовоспламеняющиеся вещества — металлы щелочные и щелочноземельные (калий, натрий, кальций), металлы пирофорные (алюминий в виде пыли или пудры, цинковая пыль и др.), карбид кальция, перекиси, фосфор белый и желтый, фосфористые натрий и кальций и др. хранение этих веществ недопустимо вместе с другими огнеопасными веществами всех групп. При отсутствии последних вещества группы IV можно хранить в изолированных помещениях общих огнестойких складов. [c.215]
При аналитических операциях необходимо обеспечить присутствие в пламени свободных атомов определяемого элемента. Здесь следует учитывать два фактора возможность образования простых молекул (МеО, МеОН и некоторых других) и степень ионизации атома определяемого металла. Щелочные и щелочноземельные металлы ионизируются сравнительно легко, поэтому при их определении методом атомной абсорбции возникают затруднения. Однако определение кальция и других щелочноземельных элементов облегчается тем, что постоянной примесью воздуха является натрий, который создает высокую фоновую концентрацию электронов. Последняя снижает степень ионизации кальция [22]. [c.147]
Дуговой разряд поддерживается либо между металлическими электродами, если они достаточно устойчивы к нагреванию и окислению, либо между угольными электродами. Каналы в них обычно содержат набивку в виде окислов или солей исследуемых металлов. Непосредственно электродами дуги может служить большинство металлов и их сплавов. Легкоплавкие и легкоокисляемые металлы (щелочные и щелочноземельные) применяются в виде сплавов с более стойкими металлами. Некоторые из них могут служить электродами дуги, если поместить ее в атмосферу инертного газа или в вакуум. Наиболее широко распространена дуга с ртутными электродами [10.16]. Вакуумная ртутная дуга в кварцевом сосуде является одним из широко применяемых источников яркого ультрафиолетового излучения. Одна из конструкций такого рода дуги изображена на рис. 10.11, а. Ртуть в количестве 15—20 см содержится в электродных отростках, которые во время работы охлаждаются ребристыми алюминиевыми радиаторами. Для зажигания дуги ее слегка наклоняют. Переливающаяся из анодного отростка ртуть образует проводящую цепь, при разрыве которой зажигается дуга. [c.265]
Молекулярный водород при обычной температуре химически малоактивен. Только фтор соединяется с ним при обычных условиях , хлор — при освещении, кислород — только при поджигании смеси. При повышенной температуре водород вступает в соединение со многими элементами, преимущественно с неметаллами, но и с сильно электроположительными металлами (щелочными и щелочноземельными). [c.60]
Металлы (щелочные и щелочноземельные) [c.379]
К образованию комплексов способны преимущественно сравнительно малоактивные металлы. Щелочные и щелочноземельные металлы образуют комплексы сравнительно редко. В качестве комплек-сообразователей чаще выступают металлы В-групп и металлы групп П1А и IVA. В центре комплекса располагается атом или ион металла. [c.20]
В качестве окислителя вода вступает в реакцию с активными металлами — щелочными и щелочноземельными. [c.154]
Наиболее активные металлы (щелочные и щелочноземельные) даже при обычных условиях взаимодействуют с водой. Мерой активности металлов могут служить величины их стандартных электродных потенциалов (см. стр. 133). Электродные потенциалы малоактивных металлов (Си, Hg, Ag, Au и других) выражаются положительными величинами, а более активных металлов — отрицательными величинами. [c.350]
Химические свойства водорода. Пока атомы водорода сцеплены в молекулу, водород — почти такой же химически инертный газ, как азот. На холоду и в темноте водород соединяется только с самым электроотрицательным элементом — фтором. Но при нагревании водород соединяется как с большинством неметаллов, так и с наиболее электроположительными из металлов — щелочными и щелочноземельными металлами. [c.277]
Более активные металлы (щелочные и щелочноземельные) вытесняют водород даже из воды (стр. 107). [c.101]
Для наглядности Менделеев приводит сопоставление двух групп металлов — щелочных и щелочноземельных — в случае истинных атомных весов, согласных с теорией Жерара, и в случае эквивалентных весов. В первом случае имеем [c.165]
Из величин собственных потенциалов, приведенных в табл. 11, видно, что потенциалы многих металлов (щелочных и щелочноземельных, магния, алюминия и др.) не могут быть определены экспериментально, так как на поверхности соответствующих [c.328]
Наиболее активные металлы (щелочные и щелочноземельные) даже при обычных условиях взаимо-. действуют с водой. [c.192]
Предположим сначала, что электрон переходит от Л к В. Переход в этом направлении можно представить происходящим в две ступени. На первой ступени энергия затрачивается на отрыв, например одного внешнего электрона от атома Л. Величина этой энергии, называющейся энергией, или потенциалом ионизации 1а зависит от энергии притяжения между внешним электроном и остальной частью атома, содержащей положительно заряженное ядро. Энергии ионизации имеют наименьшие значения у наиболее активных металлов (щелочных и щелочноземельных), у которых легче всего удалить электрон. [c.297]
Так, мы видим, что в левой части ряда напряжений находятся наиболее легко окисляющиеся и вообще самые энергичные металлы—щелочные и щелочноземельные. Наоборот, справа находятся благородные , т. е. наиболее инертные химически металлы Ag, Pt, Au. [c.171]
Металлы щелочные и щелочноземельные. Взвешиваемые формы — МгО и МО. При сожжении органических соединений, содержащих щелочные или щелочноземельные металлы, углерод может частично оставаться в контейнере в форме термостойких карбонатов. В присутствии в зоне сожжения оксида вольфрама (VI) или оксида кремния (в виде дробленого кварца) образуются вольфраматы [7] или силикаты [176] металлов, и диоксид углерода полностью выделяется в газообразной форме. Если же металл в веществе связан с сульфогруппой, то остаток представляет собой его сульфат [c.100]
Металлы щелочные и щелочноземельные 17 1710 Рубидий хлористый (концентрат) [c.35]
Амальгамы (от франц. amalgama) — жидкие или твердые сплавы, образующиеся при растворении в ртути различных металлов. Щелочные и щелочноземельные металлы и некоторые другие элементы образуют со ртутью устойчивые соединения. При нагревании А. меди, серебра, золота и др. отгоняется ртуть. Железо не образует А., поэтому ртуть можно перевозить в стальных сосудах. А. используют при золочении металлических изделий, в производстве зеркал. А. щелочных металлов и цинка в химии применяют как восстановители. А. используют при электролитическом получении редких металлов, извлечении некоторых металлов из руд (см. Амальгамация). [c.14]
Окислительно-восстановительные свойства. Алюминий—се ребристо-белый металл. Нормальный окислительно-восстановительный потенциал системы А1з+ в кислой среде равен —1,28 а. а в щелочной среде окислительно-восстановительный потенциал системы АЮ /А равен —2,35 в. Поэтому алюминий хорошо растворяется в соляной и разбавленной серной кислотах. Еще легче он растворяется в щелочах, так как в щелочном растворе потенциал алюминия приближается к потенциалу наиболее активных металлов (щелочных и щелочноземельных). [c.327]
Металлы с наименьшими алгебраическими величинами нормальных электродных потенциалов. Сюда относятся все типичные металлы (щелочные и щелочноземельные, а также алюминий). Ионы этих металлов характеризуются наименьшим сродством к электрону. При электролизе водных растворов солей указанных металлов на катоде восстанавливаются не их катионы, а молекулы воды (и в известной мере ионы водорода) (см. ниже — пример 3). [c.293]
Очевидно, металлы как восстановители, будут вступать в реакции с различными окислителями, среди которых могут быть простые вещества (неметаллы), кислоты, соли менее активных металлов и некоторые другие соединения. Так, все металлы образуют соединения с кислородом — окислы. При этом окислы наиболее активных металлов (щелочных и щелочноземельных) характеризуются основными свойствами. С уменьшением же активности металлов свойства окислов изменяются от основных, в которых металлы проявляют низшую степень окисления, через амфотерные с промежуточной степенью окисления к кислотным, где проявляется их высшая степень окисления. Например, хром может существовать в трех различных степенях окисления — -2, +3, -Ьб. Проявляя низшую из них, он образует основной окисел СгО, которому соответствует гидроокись Сг (0Н)2. Хром со степенью окисления 4-6 образует кислотный окисел СгОз, которому соответствует хромовая кислота НзСгО . И, наконец, хром с промежуточной степенью окисления образует амфотерный окисел СГзОз, которому соответствует гидроокись Сг(ОН)з. Из этого примера видно, что металлы, имеющие различную степень окисления, могут проявлять свойства как металлов, так и неметаллов. [c.283]
Из величин собственных потенциалов, приведенных в табл. И, видно, что потенциалы многих металлов (щелочных и щелочноземельных, магния, алюминия и др.) не могут быть определены экспериментально, так как на поверхности соответствующих электродов должно происходить восстановление водорода. Во многих случаях (Mg, Al, Сг) экспериментальные трудности увеличиваются за счет образования на поверхности металлов окисных пленок и слоев адсорбированного кислорода (гл. XIII, 3). Чем ближе потенциал к линии аЬ и чем медленнее происходит восстановление водорода на поверхности данного металла, тем меньше будет ошибка при измерении, обусловленная этим процессом. Так, очень малая скорость восстановления [c.329]
Единственными ионными сульфидами являются сульфиды наиболее электроположительных металлов (щелочных и щелочноземельных), у которых положительные ионы имеют малые заряды, а также сул -фиды некоторых переходных элементов, которые тоже могут образовать И01И,1 с малым зарядом. Такие сульфиды имеют структуры, подобные структурам соответствующих окислов (см, структуры сульфидов и окислов щелочных и щелочноземельных металлов, МпО и. Чп8, содержащие ионы М+ или М- + ). [c.354]
Зо 1Ьные компоненты в газойлевых фракциях продуктов переработки нефти и каменноугольной смолы представлены металлоорганическими комплексами никеля, ванадия, молибдена, железа и других металлов, щелочными и щелочноземельными солями нафтеновых кислот, а также высокодисперсными примесями катализаторной пыли и других минеральных веществ [6, 7]. Содержание зольных компонентов в сырье для сажи достигает 0,05%. [c.9]
Ф. энергично соединяется с большинством металлов. Щелочные и щелочноземельные металлы воспламеняются на холоду, а В1, 8и, Т1, Мо, — при незначительном нагревании. Hg, РЬ, и, V реагируют с Ф. нри комнатной теми-ре, Р1 — ири темп-ре темнокрасного каления. При взаимодействии металлов с Ф. образуются, как правило, высшие фториды — и Ра, МоРб, Н Р.2 и т. д. Нек-рые фториды (СоРз, МнРз, АйРа, 8ЬР5, РЬР4) обладают фторирующими свойствами и иашли применение как фторирующие реагенты (см. Фторорганические соединения). Ре, Си, А1, N1, 2п практически ие взаимодействуют с Ф. нри обычных теми-рах благодаря образованию заш.итной нленки фторида. В порошкообразном состоянии металлы реагируют с Ф. при слабом нагревании. При сильном нагревании все металлы способны к горению в атмосфере Ф. (о фторидах металлов см. Натрия фторид. Калия фторид. Серебра галогениды п т. д.). [c.288]
Окраска пламени. В пламени паяльной трубки или газовой горелки соедпнения нек-рых элементов, особенно металлов щелочной и щелочноземельной группы, переходят в парообразное соедпне-пие и окрашивают пламя в характерный цвет. Труднолетучие соединения сами по себе окраски пламени но дагот, поэтому предварительно их разлагают смачиванием соляной, реже серной к-той. В случае присутствия двух, трех элементов, папр. N8, К и [c.15]
Если мы перейде.м к -металлам щелочных земель, то так как гидратация их может быть легко определена, а теплота образования водных окисей известна, образование безводных окисей определить легко, и вот приблизительные числа для вс 1Х трех м-еталлов Са — 131 ООО кал, барий — 124.000 кал, 5г—среднее—-120.000 кал. Эта лруппа, подобно предыдущей, с возрастанием атомного веоа увеличивает зн-ергию по отношению 1К галоидам и уменьшает -по отношению к О. Для всех этих металлов — щелочных и щелочноземельных — числа получены очень большие, далее следуют -металлы тяжелые с числами гораздо меньшими. [c.214]
Рассмотренные методы получения металлов восстановлением их окислов при высокой температуре называют пирометаллургическими. Активные металлы (щелочные и щелочноземельные, магний и алюминий) получают электролизом их расплавов. Неактивные металлы, например медь, в чистом виде получают электролизом водных растворов их солей. В ряде случаев с целью извлечения металла из руды последнюю обрабатывают растворамй кислот, щелочей или солей, а затем из получившегося раствора металл выделяют химическим путем, вытесняя его более активным металлом или электролизом. [c.377]
Щёлочноземельные металлы
Пользователи также искали:
физические свойства щелочноземельных металлов, гидроксиды щелочноземельных металлов, почему щелочноземельные металлы так называются, получение щелочноземельных металлов, щелочноземельные металлы химические свойства, щелочноземельные металлы применение, щелочные и щелочноземельные металлы таблица, сравните щелочные и щелочноземельные металлы укажите вид связи, металлы, щелочноземельные, щелочноземельных, металлов, щелочные, свойства, гидроксиды щелочноземельных металлов, применение, получение, Щёлочноземельные, почему, называются, химические, таблица, физические, гидроксиды, сравните, укажите, связи, получение щелочноземельных металлов, щелочноземельные металлы применение, Щёлочноземельные металлы, почему щелочноземельные металлы так называются, щелочноземельные металлы химические свойства, щелочные и щелочноземельные металлы таблица, физические свойства щелочноземельных металлов, сравните щелочные и щелочноземельные металлы укажите вид связи, щёлочноземельные металлы,
…
краткая характеристика. Применение щелочноземельных металлов
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы. Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием. В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами .
Все элементы IIA группы относятся к s -элементам, т.е. содержат все свои валентные электроны на s -подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns 2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме 0 – 2e — → Ме +2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO 2):
2Mg + O 2 = 2MgO
2Ca + O 2 = 2CaO
2Ba + O 2 = 2BaO
Ba + O 2 = BaO 2
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me 3 N 2 .
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
Мg + I 2 = MgI 2 – иодид магния
Са + Br 2 = СаBr 2 – бромид кальция
Ва + Cl 2 = ВаCl 2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно бо льшая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C 2 2- , фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me 2 Si, с азотом – нитриды (Me 3 N 2), фосфором – фосфиды (Me 3 P 2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода. Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO. В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
Ве + Н 2 SO 4(разб.) = BeSO 4 + H 2
Mg + 2HBr = MgBr 2 + H 2
Ca + 2CH 3 COOH = (CH 3 COO) 2 Ca + H 2
c кислотами-окислителями
− разбавленной азотной кислотой
С разбавленной азотной кислотой реагируют все металлы IIA группы. При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N 2 O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH 4 NO 3):
4Ca + 10HNO 3( разб .) = 4Ca(NO 3) 2 + N 2 O + 5H 2 O
4Mg + 10HNO 3(сильно разб.) = 4Mg(NO 3) 2 + NН 4 NO 3 + 3H 2 O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
Be + 2H 2 SO 4 → BeSO 4 + SO 2 + 2H 2 O
Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы может происходить до SO 2 , H 2 S и S в зависимости от активности металла, температуры проведения реакции и концентрации кислоты:
Mg + H 2 SO 4( конц .) = MgSO 4 + SO 2 + H 2 O
3Mg + 4H 2 SO 4( конц .) = 3MgSO 4 + S↓ + 4H 2 O
4Ca + 5H 2 SO 4( конц .) = 4CaSO 4 +H 2 S + 4H 2 O
с щелочами
Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении. При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
Be + 2KOH + 2H 2 O = H 2 + K 2 — тетрагидроксобериллат калия
При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
Be + 2KOH = H 2 + K 2 BeO 2 — бериллат калия
с оксидамиЩелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
Рассмотрим химические свойства щелочноземельных металлов. Определим особенности их строения, получения, нахождения в природе, применение.
Положение в ПС
Для начала определим расположение этих элементов в Менделеева. Они располагаются во второй группе главной подгруппе. К ним относят кальций, стронций, радий, барий, магний, бериллий. Все они на содержат по два валентных электрона. В общем виде бериллий, магний и щелочноземельные металлы на внешнем уровне имеют ns2 электронов. В химических соединениях они проявляют степень окисления +2. Во время взаимодействия с другими веществами они проявляют восстановительные свойства, отдавая электроны с внешнего энергетического уровня.
Изменение свойств
По мере возрастания ядра атома бериллий, магний и усиливают свои металлические свойства, так как наблюдается возрастание радиуса их атомов. Рассмотрим физические свойства щелочноземельных металлов. Бериллий в обычном состоянии является металлом серого цвета со стальным блеском. Он имеет плотную гексагональную кристаллическую решетку. При контакте с кислородом воздуха, бериллий сразу же образует оксидную пленку, в результате чего снижается его химическая активность, образуется матовый налет.
Физические свойства
Магний в качестве простого вещества является белым металлом, образующим на воздухе оксидное покрытие. Он имеет гексагональную кристаллическую решетку.
Физические свойства щелочноземельных металлов кальция, бария, стронция схожи. Они представляют собой металлы с характерным серебристым блеском, покрывающиеся под воздействием кислорода воздуха желтоватой пленкой. У кальция и стронция кубическая гранецентрированная решетка, барий имеет объемно-центрированную структуру.
Химия щелочноземельных металлов основывается на том, что у них металлический характер связи. Именно поэтому они отличаются высокой электрической и тепло проводимостью. Температуры их плавления и кипения больше, чем у щелочных металлов.
Способы получения
Производство бериллия в промышленных объемах осуществляется путем восстановления металла из фторида. Условием протекания данной химической реакции является предварительное нагревание.
Учитывая, что щелочноземельные металлы в природе находятся в виде соединений, для получения магния, стронция, кальция проводят электролиз расплавов их солей.
Химические свойства
Химические свойства щелочноземельных металлов связаны с необходимостью предварительного устранения с их поверхности слоя оксидной пленки. Именно она определяет инертность данных металлов к воде. Кальций, барий, стронций при растворении в воде образуют гидроксиды, имеющие ярко выраженные основные свойства.
Химические свойства щелочноземельных металлов предполагают их взаимодействие с кислородом. Для бария продуктом взаимодействия является пероксид, для всех остальных после реакции образуются оксиды. У всех представителей данного класса оксиды проявляют основные свойства, только для оксида бериллия характерны амфотерные свойства.
Химические свойства щелочноземельных металлов проявляются и в реакции с серой, галогенами, азотом. При реакциях с кислотами, наблюдается растворение данных элементов. Учитывая, что бериллий относится к амфотерным элементам, он способен вступать в химическое взаимодействие с растворами щелочей.
Качественные реакции
Основные формулы щелочноземельных металлов, рассматриваемые в курсе неорганической химии, связаны с солями. Для выявления представителей данного класса в смеси с другими элементами, можно использовать качественное определение. При внесении солей щелочноземельных металлов в пламя спиртовки, наблюдается окрашивание пламени катионами. Катион стронция дает темный красный оттенок, катион кальция — оранжевый цвет, а катион бария зеленый тон.
Для выявления катиона бария в качественном анализе используют сульфат анионы. В результате данной реакции образуется сульфат бария белого цвета, который нерастворим в неорганических кислотах.
Радий является радиоактивным элементом, который в природе содержится в незначительных количествах. При взаимодействии магния с кислородом, наблюдается ослепительная вспышка. Данный процесс некоторое время применяли во время фотографирования в темных помещениях. Сейчас на смену магниевым вспышкам пришли электрические системы. К семейству щелочноземельных металлов относится бериллий, который реагирует со многими химическими веществами. Кальций и магний аналогично алюминию, могут восстанавливать такие редкие металлы, как титан, вольфрам, молибден, ниобий. Данные называют кальциетермией и магниетермией.
Особенности применения
Каково применение щелочноземельных металлов? Кальций и магний используют для изготовления легких сплавов и редких металлов.
К примеру, магний содержится в составе дюралюминия, а кальций — это компонент свинцовых сплавов, используемых для получения оболочек кабелей и создания подшипников. Широко применение щелочноземельных металлов в технике в виде оксидов. (оксид кальция) и жженая магния (оксид магния) требуются для строительной сферы.
При взаимодействии с водой оксида кальция происходит выделение существенного количества теплоты. (гидроксид кальция) применяется для строительства. Белая взвесь данного вещества (известковое молоко) применяют в сахарной промышленности для процесса очистки свекловичного сока.
Соли металлов второй группы
Соли магния, бериллия, щелочноземельных металлов можно получить путем взаимодействия с кислотами их оксидов. Хлориды, фториды, иодиды данных элементов являются белыми кристаллическими веществами, в основном хорошо растворимыми в воде. Среди сульфатов растворимостью обладают только соединения магния и бериллия. Наблюдается ее снижение от солей бериллия к сульфатам бария. Карбонаты практически не растворяются в воде либо имеют минимальную растворимость.
Сульфиды щелочноземельных элементов в незначительных количествах содержатся в тяжелых металлах. Если направить на них освещение, можно получить различные цвета. Сульфиды включаются в состав светящихся составов, именуемых фосфорами. Применяют подобные краски для создания светящихся циферблатов, дорожных знаков.
Распространенные соединения щелочноземельных металлов
Карбонат кальция является самым распространенным на земной поверхности элементом. Он является составной частью таких соединений, как известняк, мрамор, мел. Среди них основное применение имеет известняк. Этот минерал незаменим в строительстве, считается отличным строительным камнем. Кроме того, из данного неорганического соединения получают негашеную и гашеную извести, стекло, цемент.
Применение известковой щебенки способствует укреплению дорог, а благодаря порошку можно снизить кислотность почвы. представляет собой раковины древнейших животных. Данное соединение используют для изготовления резины, бумаги, создания школьных мелков.
Мрамор востребован у архитекторов, скульпторов. Именно из мрамора были созданы многие уникальные творения Микеланджело. Часть станций московского метро облицована именно мраморными плитками. Карбонат магния в больших объемах используется при изготовлении кирпича, цемента, стекла. Он нужен в металлургической промышленности для удаления пустой породы.
Сульфат кальция, содержащийся в природе в виде гипса (кристаллогидрата сульфата кальция), применяется в строительной отрасли. В медицине данное соединение применяется для изготовления слепков, а также для создания гипсовых повязок.
Алебастр (полуводный гипс) при взаимодействии с водой выделяет огромное количество тепла. Это также применяется в промышленности.
Английская соль (сульфат магния) применяется в медицине в виде слабительного средства. Данное вещество обладает горьким вкусом, оно обнаружено в морской воде.
«Баритовая каша» (сульфат бария) не растворяется в воде. Именно поэтому данную соль применяют в рентгенодиагностике. Соль задерживает рентгеновские лучи, что позволяет выявлять заболевания желудочно-кишечного тракта.
В составе фосфоритов (горной породы) и апатитов есть фосфат кальция. Они нужны для получения соединений кальция: оксидов, гидроксидов.
Кальций играет для живых организмов особое значение. Именно этот металл необходим для построения костного скелета. Ионы кальция необходимы для регулировки работы сердца, повышения свертываемости крови. Недостаток его вызывает нарушения в работе нервной системы, потере свертываемости, утрате способности рук нормально держать различные предметы.
Для того чтобы избежать проблем со здоровьем, каждые сутки человек должен потреблять примерно 1,5 грамма кальция. Основная проблема заключается в том, что для того, чтобы организм усваивал 0,06 грамма кальция, необходимо съедать 1 грамм жира. Максимальное количество данного металла содержится в салате, петрушке, твороге, сыре.
Заключение
Все представители второй группы главной подгруппы таблицы Менделеева необходимы для жизни и деятельности современного человека. Например, магний является стимулятором обменных процессов в организме. Он должен присутствовать в нервной ткани, крови, костях, печени. Магний является активным участником и фотосинтеза у растений, так как он является составной частью хлорофилла. Кости человека составляют примерно пятую часть от общего веса. Именно в них содержится кальций и магний. Оксиды, соли щелочноземельных металлов нашли разнообразное применение в строительной сфере, фармацевтике и медицине.
Щелочноземельные металлы представляют собой элементы, которые относятся ко второй группе периодической таблицы. Сюда можно отнести такие вещества, как кальций, магний, барий, бериллий, стронций и радий. Название этой группы свидетельствует о том, что в воде они дают щелочную реакцию.
Щелочные и щелочноземельные металлы, а точнее их соли, широко распространены в природе. Они представлены минералами. Исключением является радий, который считается довольно редким элементом.
Все вышеперечисленные металлы имеют некоторые общие качества, которые и позволили объединить их в одну группу.
Щелочноземельные металлы и их физические свойства
Практически все эти элементы представляют собой твердые вещества сероватого цвета (по крайне мере, при нормальных условиях и Кстати, физические свойства немного отличаются — эти вещества хотя и довольно стойкие, но легко поддаются воздействию.
Интересно, что с порядковым номером в таблице растет и такой показатель металла, как плотность. Например, в этой группе наименьшим показателем обладает кальций, в то время как радий по плотности сходен с железом.
Щелочноземельные металлы: химические свойства
Для начала стоит отметить, что химическая активность возрастает согласно порядковому номеру таблицы Менделеева. Например, бериллий является довольно стойким элементом. В реакцию с кислородом и галогенами вступает лишь при сильном нагревании. То же касается и магния. А вот кальций способен медленно окисляться уже при комнатной температуре. Остальные три представителя группы (радий, барий и стронций) быстро реагируют с кислородом воздуха уже при комнатной температуре. Именно поэтому хранят эти элементы, покрывая слоем керосина.
Активность оксидов и гидроксидов этих металлов возрастает по той же схеме. Например, гидроксид бериллия не растворяется в воде и считается амфотерным веществом, а считается довольно сильной щелочью.
Щелочноземельные металлы и их краткая характеристика
Бериллий представляет собой стойкий металл светло-серого цвета, обладающий высокой токсичностью. Впервые элемент был обнаружен еще в 1798 году химиком Вокленом. В природе существует несколько минералов бериллия, из которых самыми известными считаются следующие: берилл, фенакит, даналит и хризоберилл. Кстати, некоторые изотопы бериллия обладают высокой радиоактивностью.
Интересно, что некоторые формы берилла являются ценными ювелирными камнями. Сюда можно отнести изумруд, аквамарин и гелиодор.
Бериллий используют для изготовления некоторых сплавов, В этот элемент применяют для замедления нейтронов.
Кальций является одним из самых известных щелочноземельных металлов. В чистом виде он представляет собой мягкое вещество белого цвета с серебристым оттенком. Впервые чистый кальций был выделен в 1808 году. В природе этот элемент присутствует в форме таких минералов, как мрамор, известняк и гипс. Кальций широко применяется в современных технологиях. Его используют как химический источник топлива, а также в качестве огнеустойчивого материала. Ни для кого не секрет, что соединения кальция используются при производстве строительных материалов и лекарственных средств.
Этот элемент также содержится в каждом живом организме. В основном, он отвечает за работу двигательного аппарата.
Магний представляет собой легкий и достаточно ковкий металл с характерным сероватым цветом. В чистом виде был выделен в 1808 году, но его соли стали известными намного раньше. В магний содержится в таких минералах, как магнезит, доломит, карналлит, кизерит. Кстати, соль магния обеспечивает Огромное количество соединений этого вещества можно найти в морской воде.
Видеоурок 1: Неорганическая химия. Металлы: щелочные, щелочноземельные, алюминий
Видеоурок 2: Переходные металлы
Лекция: Характерные химические свойства и получение простых веществ — металлов: щелочных, щелочноземельных, алюминия; переходных элементов (меди, цинка, хрома, железа)
Химические свойства металлов
Все металлы в химических реакциях проявляют себя, как восстановители. Они легко расстаются с валентными электронами, окисляясь при этом. Вспомним, что, чем левее располагается металл в электрохимическом ряду напряженности, тем более сильным восстановителем он является. Следовательно, самый сильный — это литий, самый слабый — золото и наоборот, золото — самый сильный окислитель, а литий — самый слабый.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Все металлы вытесняют из раствора солей другие металлы, т.е. восстанавливают их. Все, кроме щелочных и щелочноземельных, так как они взаимодействуют с водой. Металлы, расположенные до Н, вытесняют его из растворов разбавленных кислот, а сами растворяются в них.
Рассмотрим некоторые общие химические свойства металлов:
- Взаимодействие металлов с кислородом образует основные (СаО, Na 2 O, 2Li 2 O и др.) или амфотерные (ZnO, Cr 2 O 3 , Fe 2 O 3 и др.) оксиды.
- Взаимодействие металлов с галогенами (главная подгруппа VII группы) образует галогеноводородные кислоты (HF — фтороводород, HCl — хлороводород и др.).
- Взаимодействие металлов с неметаллами образует соли (хлориды, сульфиды, нитриды и др.).
- Взаимодействие металлов с металлами образует интерметаллиды (MgB 2 , NaSn, Fe 3 Ni и др.).
- Взаимодействие активных металлов с водородом образует гидриды (NaH, CaH 2, KH и др.).
- Взаимодействие щелочных и щелочноземельных металлов с водой образует щелочи (NaOH, Ca(OH) 2 , Cu(OH) 2 и др.).
- Взаимодействие металлов (только, стоящих в электрохимическом ряду до Н) с кислотами образует соли (сульфаты, нитриты, фосфаты и др.). Следует иметь ввиду, что металлы реагируют с кислотами достаточно неохотно, тогда как с основаниями и солями взаимодействуют практически всегда. Для того, чтобы реакция металла с кислотой прошла нужно, чтобы металл был активным, а кислота сильной.
Химические свойства щелочных металлов
К группе щелочных металлов относятся следующие химические элементы: литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs), франций (Fr). С перемещением сверху вниз по группе I Периодической таблицы их атомные радиусы увеличиваются, а значит возрастают металлические и восстановительные свойства.
Рассмотрим химические свойства щелочных металлов:
- Не имеют признаков амфотерности, так как обладают отрицательными значениями электродных потенциалов.
- Самые сильные восстановители среди всех металлов.
- В соединениях проявляют только степень окисления +1.
- Отдавая единственный валентный электрон, атомы данных химических элементов преобразуются в катионы.
- Образуют многочисленные ионные соединения.
- Практически все растворяются в воде.
Взаимодействие щелочных металлов с другими элементами:
1. С кислородом, образуя индивидуальные соединения, так оксид образует только литий (Li 2 O), натрий образует пероксид (Na 2 O 2), а калий, рубидий и цезий — надпероксиды (KO 2 , RbO 2 , CsO 2).
2. С водой, образуя щелочи и водород. Помните, эти реакции взрывоопасны. Без взрыва с водой реагирует только литий:
3. С галогенами, образуя галогениды (NaCl — хлорид натрия, NaBr — бромид натрия, NaI — йодид натрия и др.).
4. С водородом при нагревании, образуя гидриды (LiH, NaH и др.)
5. С серой при нагревании, образуя сульфиды (Na 2 S, K 2 S и др.). Они бесцветны и хорошо растворимы в воде.
6. С фосфором при нагревании, образуя фосфиды (Na 3 P, Li 3 P и др.), очень чувствительны к влаге и воздуху.
7. С углеродом при нагревании карбиды образуют только литий и натрий (Li 2 CO 3 , Na 2 CO 3), тогда как калий, рубидий и цезий не образуют карбидов, они образуют бинарные соединения с графитом (C 8 Rb, C 8 Cs и др).
8. С азотом при обычных условиях реагирует только литий, образуя нитрид Li 3 N, с остальными щелочными металлами реакция возможна только при нагревании.
9. С кислотами реагируют со взрывом, поэтому проведение таких реакций очень опасно. Данные реакции проходят неоднозначно, потому что щелочной металл активно реагирует с водой, образуя щелочь, которая потом нейтрализуются кислотой. Таким образом создается конкуренция между щелочью и кислотой.
10. С аммиаком, образуя амиды — аналоги гидроксидов, но более сильные основания (NaNH 2 — амид натрия, KNH 2 — амид калия и др.).
11. Со спиртами, образуя алкоголяты.
Франций — радиоактивный щелочной металл, один из редчайших и наименее устойчивых среди всех радиоактивных элементов. Его химические свойства изучены недостаточно.
Получение щелочных металлов:
Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
Есть и другие способы получения щелочных металлов:Натрий также можно получить, прокаливая соду с углем в закрытых тиглях:
- Na 2 CO 3 + 2C → 2Na + 3CO.
- 2Li 2 O + Si + 2CaO → 4Li + Ca 2 SiO 4 .
Химические свойства щелочноземельных металлов
К щелочноземельным металлам относятся элементы главной подгруппы II группы: кальций (Ca), стронций (Sr), барий (Ba), радий (Ra). Химическая активность данных элементов растет также, как и у щелочных металлов, т.е. с увеличением вниз по подгруппе.
Химические свойства щелочноземельных металлов:
- Отдавая два валентных электрона, атомы данных химических элементов преобразуются в катионы.
- В соединения проявляют степень окисления +2.
- Заряды ядер атомов на единицу больше, чем у щелочных элементов тех же периодов, что приводит к уменьшению радиуса атомов и увеличению ионизационных потенциалов.
Строение валентных оболочек атомов этих элементов ns 2 .
Взаимодействие щелочноземельных металлов с другими элементами:
1. С кислородом все щелочноземельные металлы, кроме бария образуют оксиды, барий образует пероксид BaO 2 . Из данных металлов берилий и магний, покрытые тонкой защитной оксидной пленкой взаимодействуют с кислородом только при очень высоких t. Основные оксиды щелочноземельных металлов реагируют с водой, за исключением оксида берилия BeO, обладающего амфотерными свойствами. Реакция оксида кальция и воды называется реакцией гашения извести. Если реагентом является CaO образуется негашенная известь, если Ca(OH) 2 , гашенная. Также основные оксиды реагируют с кислотными оксидами и кислотами. К примеру:
- 3CaO + P 2 O 5 → Ca 3 (PO 4) 2 .
2. С водой щелочноземельные металлы и их оксиды образуют гидроксиды — белые кристаллические вещества, которые в сравнении с гидроксидами щелочных металлов хуже растворяются в воде. Гидроксиды щелочноземельных металлов являются щелочами, кроме амфотерного Be(OH) 2 и слабого основания Mg(OH) 2 . Поскольку берилий не реагирует с водой, Be(OH) 2 может быть получен другими способами, например гидролизом нитрида:
- Be 3 N 2 + 6Н 2 О → 3Be(OH) 2 + 2NН 3.
3. С галогенами при обычных условиях реагирую все, кроме бериллия. Последний вступает в реакцию только при высоких t. Образуются галогениды (MgI 2 – иодид магния, CaI 2 – иодид кальция, СаBr 2 – бромид кальция и др.).
4. С водородом реагируют при нагревании все щелочноземельные металлы, кроме берилия. Образуются гидриды (BaH 2 , CaH 2 и др.). Для реагирования магния с водородом помимо высокой t требуется еще и повышенное давление водорода.
5. С серой образуют сульфиды. К примеру:
Сульфиды служат для получения серной кислоты и соответствующих металлов.
6. С азотом образуют нитриды. К примеру:
7. С кислотами образуя соли соответствующей кислоты и водород. К примеру:
- Ве + Н 2 SO 4(разб.) → BeSO 4 + H 2 .
Эти реакции протекают также, как и в случае щелочных металлов.
Получение щелочно-земельных металлов:
Бериллий получают восстановлением фторида:
- BeF 2 + Mg –t о → Be + MgF 2
- 3BaO + 2Al –t о → 3Ba + Al 2 O 3
Химические свойства алюминия
Алюминий – активный, легкий металл, под порядковым номером 13 в таблице. В природе самый распространенный из всех металлов. А из химических элементов занимает третью позицию по распространению. Высокий тепло- и электропроводник. Устойчив к коррозии, поскольку покрывается оксидной пленкой. Температура плавления равна 660 0 С.
Рассмотрим химические свойства и взаимодействие алюминия с другими элементами:
1. Во всех соединениях алюминий находится в степени окисления +3.
2. Практически во всех реакциях проявляет восстановительные свойства.
3. Амфотерный металл, проявляет как кислотные, так и основные свойства.
4. Восстанавливает многие металлы из оксидов. Этот метод получения металлов получил название алюмотермии. Пример получения хрома:
5. Взаимодействует со всеми разбавленными кислотами, образуя соли и выделяя водород. К примеру:
2Al + 6HCl → 2AlCl 3 + 3H 2 ;
2Al + 3H 2 SO 4 → Al 2 (SO 4) 3 + 3H 2 .
В концентрированных HNO 3 и H 2 SO 4 алюминий пассивируется. Благодаря этому, возможно хранить и транспортировать данные кислоты в емкостях, изготовленных из алюминия.
6. Взаимодействует со щелочами, так как они растворяют оксидную пленку.
7. Взаимодействует со всеми неметаллами, кроме водорода. Для проведения реакции с кислородом нужен мелкораздробленный алюминий. Реакция возможна только при высокой t:
- 4Al + 3O 2 → 2Al 2 O 3 .
По своему тепловому эффекту данная реакция относится к экзотермическим. Взаимодействие с серой образует сульфид алюминия Al 2 S 3 , с фосфором фосфид AlP, с азотом нитрид AlN, с углеродом карбид Al 4 C 3 .
8. Взаимодействует с другими металлами, образуя алюминиды (FeAl 3 CuAl 2 , CrAl 7 и др.).
Получение алюминия:Металлический алюминий получают электролизом раствора глинозема Al 2 O 3 в расплавленном криолите Na 2 AlF 6 при 960–970°С.
- 2Al 2 O 3 →
4Al + 3O 2 .
Химические свойства переходных элементов
К переходным относятся элементы побочных подгрупп Периодической таблицы. Рассмотрим химические свойства меди, цинка, хрома и железа.
Химические свойства меди
1. В электрохимическом ряду находится правее Н, поэтому данный металл малоактивен.
2. Слабый восстановитель.
3. В соединениях проявляет степени окисления +1 и +2.
4. Взаимодействует с кислородом при нагревании, образуя:
- оксид меди (I) 2Cu + O 2 → 2CuO (при t 400 0 C)
- или оксид меди (II): 4Cu + O 2 → 2Cu 2 O (при t 200 0 C).
Оксиды обладают основными свойствами. При нагревании в инертной атмосфере Cu 2 O диспропорционируется: Cu 2 O → CuO + Cu . Оксид меди (II) CuO в реакциях со щелочами образует купраты, к примеру: CuO + 2NaOH → Na 2 CuO 2 + H 2 O.
5. Гидроксид меди Си(ОН) 2 амфотерен, основные свойства в нем преобладают. В кислотах он растворяется легко:
- Сu(OH) 2 + 2HNO 3 → Cu(NO 3) 2 + 2H 2 O ,
а в концентрированных растворах щелочей с трудом:
- Сu(OH) 2 + 2NaOH → Na 2 .
6. Взаимодействие меди с серой при различных температурных условиях, также образует два сульфида. При нагревании до 300-400 0 С в вакууме образуется сульфид меди (I):
При комнатной t, растворив серу в сероводороде, можно получить сульфид меди (II):
7. Из галогенов взаимодействует со фтором, хлором и бромом, образуя галогениды (CuF 2 , CuCl 2 , CuBr 2), йодом, образуя йодид меди (I) CuI; не взаимодействует с водородом, азотом, углеродом, кремнием.
8. С кислотами — неокислителями не реагирует, потому как они окисляют только металлы, расположенные до водорода в электрохимическом ряду. Данный химический элемент реагирует с кислотами — окислителями: разбавленной и концентрированной азотной и концентрированной серной:
3Cu + 8HNO 3 (разб) → 3Cu(NO 3) 2 + 2NO + 4H 2 O;
Cu + 4HNO 3(конц) → Cu(NO 3) 2 + 2NO 2 + 2H 2 O;
Cu + 2H 2 SO 4(конц) → CuSO 4 + SO 2 + 2H 2 O.
9. Взаимодействуя с солями, медь вытесняет из их состава металлы, расположенные правее неё в электрохимическом ряду. К примеру,
Здесь мы видим, что медь перешла в раствор, а железо (III) восстановилось до железа (II). Данная реакция имеет важное практическое значение и применяется для удаления меди, напыленной на пластмассу.
Химические свойства цинка
1. Самый активный после щелочноземельных металлов.2. Обладает выраженными восстановительными свойствами и амфотерными свойствами.
3. В соединениях проявляет степень окисления +2.
4. На воздухе покрывается оксидной пленкой ZnO.
5. Взаимодействие с водой возможно при температуре красного каления. В результате образуется оксид цинка и водород:
- Zn + H 2 O → ZnO + H 2 .
6. Взаимодействует с галогенами, образуя галогениды (ZnF 2 — фторид цинка, ZnBr 2 — бромид цинка, ZnI 2 — йодид цинка, ZnCl 2 — хлорид цинка).
7. С фосфором образует фосфиды Zn 3 P 2 и ZnP 2 .
8. С серой халькогенид ZnS.
9. Непосредственно не реагирует с водородом, азотом, углеродом, кремнием и бором.
10. Взаимодействует с кислотами — неокислителями, образуя соли и вытесняя водород. К примеру:
- H 2 SO 4 + Zn → ZnSO 4 + H 2
- Zn + 2HCl → ZnCl 2 + H 2 .
С кислотами — окислителями тоже реагирует: с конц. серной кислотой образует сульфат цинка и сернистый газ:
- Zn + 2H 2 SO 4 → ZnSO 4 + SO 2 + 2H 2 O.
11. Активно реагирует со щелочами, так как цинк — амфотерный металл. С растворами щелочей образует тетрагидроксоцинкаты и выделяя водород:
- Zn + 2NaOH + 2H 2 O → Na 2 + H 2 .
На гранулах цинка, впоследствии реакции, появляются пузырьки газа. С безводными щелочами при сплавлении образует цинкаты и выделяет водород:
- Zn + 2NaOH → Na 2 ZnO 2 +H 2 .
Химические свойства хрома
1. В обычных условиях инертен, при нагревании активен.
2.
3. Образует окрашенные соединения.
4. В соединениях проявляет степени окисления +2 (основный оксид CrO черного цвета), +3 (амфотерный оксид Cr 2 O 3 и гидроксид Cr(OH) 3 зеленого цвета) и +6 (кислотный оксид хрома (VI) CrO 3 и кислоты: хромовая H 2 CrO 4 и двухромовая H 2 Cr 2 O 7 и др.).
5. Со фтором взаимодействует при t 350-400 0 C, образуя фторид хрома (IV):
6. C кислородом, азотом, бором, кремнием, серой, фосфором и галогенами при t 600 0 C:
- соединение с кислородом образует оксид хрома(VI) CrO 3 (тёмно-красные кристаллы),
- соединение с азотом — нитрид хрома CrN (черные кристаллы),
- соединение с бором — борид хрома CrB (желтые кристаллы),
- соединение с кремнием — силицид хрома CrSi,
- соединение с углеродом — карбид хрома Cr 3 C 2 .
7. С водяным паром реагирует, находясь в раскалённом состоянии, образуя оксид хрома (III) и водород:
- 2Cr + 3H 2 O → Cr 2 O 3 + 3H 2 .
8. С растворами щелочей не реагирует, однако медленно реагирует с их расплавами, образуя хроматы:
- 2Cr + 6KOH → 2KCrO 2 + 2K 2 O + 3H 2 .
9. В разбавленных сильных кислотах растворяется, образуя соли. Если реакция проходит на воздухе образуются соли Cr 3+ , например:
- 2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2 .
- Cr + 2HCl → CrCl 2 + H 2 .
10. С концентрированными серной и азотной кислотами, а также с царской водкой, реагирует только при нагревании, т.к. при низких t эти кислоты пассивируют хром. Реакции с кислотами при нагревании выглядят так:
2Сr + 6Н 2 SО 4 (конц) → Сr 2 (SО 4) 3 + 3SО 2 + 6Н 2 О
Сr + 6НNО 3 (конц) → Сr(NО 3) 3 + 3NO 2 + 3Н 2 О
Оксид хрома(II) CrO — твердое вещество черного или красного цвета, не растворяющееся в воде.
Химические свойства:
- Обладает основными и восстанавливающими свойствами.
- При нагревании до 100 0 С на воздухе окисляется до Cr 2 O 3 — оксида хрома (III).
- Возможно восстановление хрома водородом из данного оксида: CrO + Н 2 → Cr + H 2 O или коксом: CrO + С → Cr + СO.
- Реагирует с соляной кислотой, при этом выделяя водород: 2CrO + 6HCl → 2CrCl 3 + H 2 + 2H 2 O.
- Не реагирует со щелочами, разбавленными серной и азотной кислотами.
Оксид хрома (III) Cr 2 O 3 — тугоплавкое вещество, темно-зеленого цвета, нерастворяющееся в воде.
Химические свойства:
- Обладает амфотерными свойствами.
- Как основный оксид взаимодействует с кислотами: Cr 2 O 3 + 6HCl → CrCl 3 + 3H 2 O .
- Как кислотный оксид взаимодействует со щелочами: Cr 2 O 3 + 2КОН → 2КCrО 3 + H 2 O .
- Сильные окислители окисляют Cr 2 O 3 до хромата H 2 CrO 4 .
- Сильные восстановители восстанавливают Cr из Cr 2 O 3 .
Гидроксид хрома(II) Cr(OH) 2 — твердое вещество желтого или коричневого цвета, плохо растворяющееся в воде.
Химические свойства:
- Слабое основание, проявляет основные свойства.
- В присутствии влаги на воздухе окисляется до Cr(OH) 3 — гидроксида хрома (III).
- Реагирует с концентрированными кислотами, образуя соли хрома (II) синего цвета: Cr(OH) 2 + H 2 SO 4 → CrSO 4 + 2H 2 O .
- Не реагирует со щелочами и разбавленными кислотами.
Гидроксид хрома (III) Cr(OH) 3 — вещество серо-зеленого цвета, нерастворяющееся в воде.
Химические свойства:
- Обладает амфотерными свойствами.
- Как основный гидроксид взаимодействует с кислотами: Cr(OH) 3 + 3HCl → CrCl 3 + 3H 2 O .
- Как кислотный гидроксид взаимодействует со щелочами: Cr(OH) 3 + 3NaОН → Na 3 [Cr(OH) 6 ] .
Химические свойства железа
1. Активный металл, обладающий высокой реакционной способностью.
2. Обладает восстановительными свойствами, а также ярко выраженными магнитными свойствами.
3. В соединениях проявляет основные степени окисления +2 (со слабыми окислителями: S, I, HCl, растворами солей), +3 (с сильными окислителями: Br и Cl) и менее характерную +6 (с О и H 2 O ). У слабых окислителей железо принимает степень окисления +2, у более сильных +3. Степени окисления +2 соответствуют чёрный оксид FeO и зелёный гидроксид Fe(OH) 2 , обладающие основными свойствами. Степени окисления +3 соответствуют красно-коричневый оксид Fe 2 O 3 и коричневый гидроксид Fe(OH) 3 , обладающие слабо выраженными амфотерными свойствами. Fe (+2) — слабый восстановитель, а Fe (+3) — чаще слабый окислитель. При изменении окислительно — восстановительных условий, степени окисления железа могут меняться друг с другом.
4. На воздухе при t 200 0 C покрывается оксидной пленкой. В обычных атмосферных условиях легко подвергается коррозии. При пропускании кислорода через расплав железа образуется оксид FeО. При сгорании железа на воздухе образуется оксид Fe 2 О 3 . При сгорании в чистом кислороде образуется оксид — железная окалина:- 3Fe + 2O 2 → Fe 3 O 4 .
5. C галогенами реагирует при нагревании:
- соединение с хлором образует хлорид железа(III) FeCl 3 ,
- соединение с бромом — бромид железа (III) FeBr 3 ,
- соединение с йодом — йодид железа (II,III) Fe 3 I 8 ,
- соединение со фтором — фторид железа (II) FeF 2 , фторид железа(III) FeF 3 .
- соединение с серой образует сульфид железа(II) FeS,
- соединение с азотом — нитрид железа Fe 3 N,
- соединение с фосфором — фосфиды FeP, Fe 2 P и Fe 3 P,
- соединение с кремнием — силицид железа FeSi,
- соединение с углеродом — карбид железа Fe 3 C.
9. С растворами щелочей не реагирует, однако медленно реагирует с расплавами щелочей, являющихся сильными окислителями:
- Fe + KClO 3 + 2KOH → K 2 FeO 4 + KCl + H 2 O.
10. Восстанавливает металлы, расположенные в электрохимическом ряду правее:
- Fe + SnCl 2 → FeCl 2 + Sn.
- 3Fe 2 O 3 + CO → CO 2 + 2Fe 3 O 4 ,
- Fe 3 O 4 + CO → CO 2 + 3FeO,
- FeO + CO → CO 2 + Fe.
Оксид железа (II) FeO — кристаллическое вещество черного цвета (вюстит), не растворяющееся в воде.
Химические свойства:
- Обладает основными свойствами.
- Реагирует с разбавленной соляной кислотой: FeO + 2HCl → FeCl 2 + H 2 O.
- Реагирует с концентрированной азотной кислотой: FeO + 4HNO 3 → Fe(NO 3) 3 + NO 2 + 2H 2 O .
- Не реагирует с водой и солями.
- С водородом при t 350 0 C восстанавливается до чистого металла: FeO +H 2 → Fe + H 2 O .
- Также восстанавливается до чистого металла при соединении с коксом: FeO +C → Fe + CO.
- Получить данный оксид можно различными способами, один из них нагревание Fe при низком давлении О: 2Fe + O 2 → 2FeO .
Оксид железа (III) Fe 2 O 3 — порошок бурового цвета (гематит), нерастворяющееся в воде вещество. Другие названия: окись железа, железный сурик, пищевой краситель E172 и пр.
Химические свойства:
- Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3H 2 O.
- С растворами щелочей не реагирует, реагирует с их расплавами, образуя ферриты: Fe 2 O 3 + 2NaOH → 2NaFeO 2 + H 2 O .
- При нагревании с водородом проявляет окислительные свойства: Fe 2 O 3 + H 2 → 2FeO + H 2 O .
- Fe 2 O 3 + 3KNO 3 + 4KOH → 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
Оксид железа (II, III) Fe 3 O 4 или FeO Fe 2 O 3 — серовато-черное твердое вещество (магнетит, магнитный железняк), нерастворяющееся в воде вещество.
Химические свойства:
- Разлагается при нагревании более 1500 0 С: 2Fe 3 O 4 → 6FeO + O 2 .
- Реагирует с разбавленными кислотами: Fe 3 O 4 + 8HCl → FeCl 2 + 2FeCl 3 + 4H 2 O.
- С растворами щелочей не реагирует, реагирует с их расплавами: Fe 3 O 4 + 14NaOH → Na 3 FeO 3 + 2Na 5 FeO 4 + 7H 2 O .
- При реакции с кислородом окисляется: 4Fe 3 O 4 + O 2 → 6Fe 2 O 3 .
- С водородом при нагревании восстанавливается: Fe 3 O 4 + 4H 2 → 3Fe + 4H 2 O .
- Также восстанавливается при соединении с оксидом углерода: Fe 3 O 4 + 4CO → 3Fe +4CO 2 .
Гидроксид железа(II) Fe(OH) 2 — белое, редко зеленоватое кристаллическое вещество, нерастворяющееся в воде.
Химические свойства:
- Обладает амфотерными свойствами с преобладанием основных.
- Вступает в реакции нейтрализации кислоты-неокислителя, проявляя основные свойства: Fe(OH) 2 + 2HCl → FeCl 2 + 2H 2 O .
- При взаимодействии с азотной или концентрированной серной кислотами проявляет восстановительные свойства, образуя соли железа (III): 2Fe(OH) 2 + 4H 2 SO 4 → Fe 2 (SO 4) 3 + SO 2 + 6H 2 O .
- При нагревании вступает в реакции с концентрированными растворами щелочей: Fe(OH) 2 + 2NaOH → Na 2 .
Гидроксид железа (II I) Fe(OH) 3 — бурое кристаллическое или аморфное вещество, нерастворяющееся в воде.
Химические свойства:
- Обладает слабовыраженными амфотерными свойствами с преобладанием основных.
- Легко взаимодействует с кислотами: Fe(OH) 3 + 3HCl → FeCl 3 + 3H 2 O .
- С концентрированными растворами щелочей образует гексагидроксоферраты (III): Fe(OH) 3 + 3NaOH → Na 3 .
- С расплавами щелочей образует ферраты: 2Fe(OH) 3 + Na 2 CO 3 → 2NaFeO 2 + CO 2 + 3H 2 O .
- В щелочной среде с сильными окислителями проявляет восстановительные свойства: 2Fe(OH) 3 + 3Br 2 + 10KOH → 2K 2 FeO 4 + 6NaBr + 8H 2 O.
щёлочноземельные металлы и, щёлочноземельные металлы химия
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы периодической таблицы элементов: кальций, стронций, барий и радий.
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Простые вещества
- 2.2 Оксиды
- 2.3 Гидроксиды
- 3 Нахождение в природе
- 4 Биологическая роль
- 5 Примечания
Физические свойства
К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств. Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций. Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации, кДж моль−1 | Сродство к электрону, кДж моль−1 | ЭО | Металл. радиус, нм | Ионный радиус, нм | tпл, °C | tкип, °C | ρ, г/см³ | ΔHпл, кДж моль−1 | ΔHкип, кДж моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | 0,19 | 1,57 | 0,169 | 0,034 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | 0,32 | 1,31 | 0,24513 | 0,066 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 0,40 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 1,51 | 0,95 | 0,304 | 0,112 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,134 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | — | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
а Радиоактивные изотопы
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
При проведении реакции с расплавом щелочи при 400-500 °C образуются диоксобериллаты:
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (кроме магния, реакция которого с водой происходит только при внесении раскалённого порошка магния в воду):
Также, кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
Оксиды
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
Гидроксиды
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого до очень сильного, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры). Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры. Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в уранновых рудах. частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры).
Биологическая роль
Магний содержится в тканях животных и растений (хлорофилл), является кофактором многих ферметативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.). Кальций — распространенный макроэлемент в организме растений, животных и человека. организме человека и других позвоночных большая его часть находится в скелете и зубах. костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Стронций может замещать кальций в природных тканях, так как схож с ним по свойствам. организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария и бериллия ядовиты. Радий чрезвычайно радиотоксичен. организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Примечания
- По новой классификации ИЮПАК. По устаревшей классификации относятся к главной подгруппе II группы периодической таблицы.
- Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. — International Union of Pure and Applied Chemistry, 2005. — P. 51.
- Group 2 — Alkaline Earth Metals, Royal Society of Chemistry.
- Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||
щёлочноземельные металлы в, щёлочноземельные металлы и, щёлочноземельные металлы химия, щёлочноземельные металлын
Щелочноземельный металл| Свойства, список и реактивность
Щелочноземельный металл , любой из шести химических элементов, входящих в группу 2 (IIa) периодической таблицы. Элементами являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
таблица МенделееваСовременная версия периодической таблицы элементов (для печати).
Encyclopædia Britannica, Inc.Возникновение, свойства и использование
До XIX века неметаллические, нерастворимые в воде и неизмененные в результате пожара вещества назывались землей.Эти земли, такие как известь (оксид кальция), которые напоминали щелочи (кальцинированная сода и поташ), назывались щелочноземельными. Таким образом, щелочные земли отличались от щелочных и других земель, таких как глинозем и редкоземельные элементы. К началу 1800-х годов стало ясно, что земли, которые раньше считались элементами, на самом деле были оксидами, соединениями металла и кислорода. Металлы, оксиды которых составляют щелочноземельные земли, затем стали известны как щелочноземельные металлы и были отнесены к группе 2 (IIa) периодической таблицы с тех пор, как русский химик Дмитрий Менделеев предложил свою первую таблицу в 1869 году.
Как и в случае щелочных металлов группы 1 (Ia), атомы щелочноземельных металлов легко теряют электроны и становятся положительными ионами (катионами). Поэтому большинство их типичных соединений являются ионными: соли, в которых металл присутствует в виде катиона M 2+ , где M представляет собой любой атом группы 2. Соли бесцветны, если они не содержат окрашенный анион (отрицательный ион). Формулы типичных щелочноземельных соединений, таких как хлорид кальция (CaCl 2 ) и оксид кальция (CaO), можно противопоставить соответствующим соединениям щелочных металлов (которые содержат ионы M + ), хлориду натрия ( NaCl) и оксид натрия (Na 2 O).
Оксиды щелочноземельных металлов являются основными (то есть щелочными, в отличие от кислых). Достаточно устойчивое усиление электроположительного характера наблюдается при переходе от бериллия, самого легкого члена группы, к радию, наиболее тяжелому. В результате этой тенденции оксид бериллия на самом деле является амфотерным, а не основным, тогда как оксид бария является сильно основным. Сами металлы являются очень реактивными восстановителями; то есть они легко отдают электроны другим веществам, которые при этом восстанавливаются.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасЗа исключением радия, все металлы и их соединения в той или иной степени находят коммерческое применение, особенно сплавы магния и различные соединения кальция. Магний и кальций, особенно последний, широко распространены в природе (они входят в число шести наиболее распространенных элементов на Земле) и играют важную роль в геологических и биологических процессах. Радий — редкий элемент, и все его изотопы радиоактивны.Этот металл никогда не производился в промышленных масштабах, и, хотя его соединения часто использовались в первой половине 20-го века для лечения рака, их в значительной степени вытеснили менее дорогие альтернативы.
История
Самым ранним из известных щелочноземельных металлов была известь (лат. calx ), которая теперь известна как оксид кальция; его использовали в древности в составе раствора. Магнезия (название происходит, вероятно, от Магнезии, района Фессалии в Греции), оксид магния, был показан шотландским химиком Джозефом Блэком в 1755 году как щелочноземельный элемент, отличный от извести; он заметил, что магнезия дает растворимый сульфат, тогда как полученный из извести, как известно, нерастворим.В 1774 году шведский химик Карл Вильгельм Шееле, открывший кислород, обнаружил, что минерал под названием тяжелый шпат или барис (по-гречески «тяжелый») содержит новую землю, которая стала известна как барита (оксид бария). Другая земля, стронция (оксид стронция), была идентифицирована лондонскими химиками Уильямом Крукшенком и Адэром Кроуфордом в 1789 году при исследовании минерала (карбоната стронция), обнаруженного в свинцовой шахте в Стронциане в Аргайлшире, Шотландия. Бериллия (оксид бериллия) была извлечена из минерала берилла и признана землей французским химиком-аналитиком Николя-Луи Вокленом в 1798 году.Хотя сначала его путали с глиноземом (оксидом алюминия), потому что оба они растворяются в щелочи, бериллий оказался отличным от других; в отличие от оксида алюминия, он переосаждается при кипячении щелочного раствора в течение некоторого времени. Первоначально бериллия называлась glucina (греч. glykys , «сладкий») из-за ее сладкого вкуса. (Этот этимологический корень сохранился во Франции, где элемент бериллий также известен как глюциний.)
Кристалл аквамаринаКристалл аквамарина, драгоценной формы минерала берилла (силикат бериллия и алюминия).Берилл также является коммерческим источником бериллия.
© Stephan Pietzko / Dreamstime.comМагний, кальций, стронций и барий — элементы, полученные из щелочноземельных металлов — были выделены как нечистые металлы английским химиком сэром Хэмфри Дэви в 1808 году с помощью электролитического метода, который он ранее использовал для выделение щелочных металлов калия и натрия. Позднее щелочноземельные металлы были получены восстановлением их солей свободными щелочными металлами, и именно таким образом (действие калия на хлорид бериллия) бериллий был впервые выделен немецким химиком Фридрихом Велером и французским химиком Антуаном Бюсси. самостоятельно в 1828 г.Радий был открыт в 1898 году по радиоактивности французскими физиками Пьером и Мари Кюри, которые к 1902 году выделили его в виде хлорида радия из урана. Металлический радий был выделен в 1910 году в результате совместной работы Марии Кюри и французского химика Андре-Луи Дебьерна.
Аппарат, использованный Мари и Пьером Кюри для изучения радияАппарат, использованный Мари и Пьером Кюри для исследования отклонения бета-лучей от радия в магнитном поле, 1904 год.Кюри и их помощник Дж. Бемон в 1898 году открыли радиоактивный элемент радий.
© Photos.com/JupiterimagesЩелочноземельные металлы | Encyclopedia.com
CONCEPT
Шесть щелочноземельных металлов — бериллий, магний, кальций, стронций, барий и радий — составляют группу 2 в периодической таблице элементов. Это ставит их рядом с щелочными металлами в Группу 1, и, как следует из их названий, эти два семейства имеют ряд общих характеристик, в первую очередь их высокую реакционную способность.Кроме того, подобно щелочным металлам или любому другому семейству в периодической таблице, не все члены семейства щелочных металлов созданы в равной степени с точки зрения их изобилия на Земле или их полезности для жизни человека. Магний и кальций имеют множество применений, от строительных и других структурных применений до пищевых добавок. Фактически, оба являются важными компонентами метаболизма живых существ, в том числе человеческого тела. Барий и бериллий находят множество специализированных применений в областях от ювелирных изделий до медицины, а стронций в основном используется в фейерверках.С другой стороны, радий редко используется вне лабораторий, во многом потому, что его радиоактивные свойства представляют опасность для жизни человека.
КАК ЭТО РАБОТАЕТ
Определение семейства
Выражение «семейства элементов» относится к группам элементов в периодической таблице, которые разделяют определенные характеристики. К ним относятся (помимо щелочноземельных металлов и щелочных металлов) переходные металлы, галогены, благородные газы, лантаноиды и актиниды. (Все это рассматривается в отдельных эссе в этой книге.) Кроме того, существует несколько более крупных категорий в отношении общих черт, которые часто пересекаются по семейным линиям; таким образом, все элементы классифицируются как металлы, металлоиды и неметаллы. (Они также обсуждаются в отдельных эссе, в которых упоминаются «сироты» или элементы, не принадлежащие ни к одной из упомянутых выше семей.)
Эти группировки, как с точки зрения семьи, так и с точки зрения более широких подразделений, относятся как к внешние наблюдаемые характеристики, а также поведение электронов в атомных структурах элементов.Например, металлы, которые составляют подавляющее большинство элементов периодической таблицы Менделеева, имеют тенденцию быть блестящими, твердыми и пластичными (то есть они могут гнуться, не ломаясь). Многие из них плавятся при довольно высоких температурах, и практически все они плавятся. они испаряются (становятся газами) при высоких температурах. Металлы также образуют ионные связи, самую прочную форму химической связи.
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ ЩЕЛОЧНЫХ МЕТАЛЛОВ.
Что касается семейств, есть определенные наблюдаемые свойства, которые в прошлом побудили химиков сгруппировать щелочноземельные металлы вместе.Эти свойства будут обсуждаться применительно к щелочноземельным металлам, но следует подчеркнуть еще один момент, связанный с разделением элементов на семейства. С прогрессом в понимании, который последовал за открытием электрона в 1897 году, наряду с развитием квантовой теории в начале двадцатого века, химики разработали более фундаментальное определение семейства с точки зрения электронной конфигурации.
Как уже отмечалось, семейство щелочноземельных металлов занимает вторую группу или столбец в периодической таблице.Все элементы в определенной группе, независимо от их очевидных различий, имеют общий образец конфигурации своих валентные электроны — электроны «снаружи» атома, участвующие в химической связи. (Напротив, остовные электроны, которые занимают более низкие энергетические области внутри атома, не играют никакой роли в связывании элементов.)
Все члены семейства щелочноземельных металлов имеют конфигурацию валентных электронов с 2 . Это означает, что два электрона участвуют в химической связи, и что эти электроны движутся по орбитали или диапазону вероятностей, примерно соответствующему сфере.Орбитальная диаграмма s соответствует первому из нескольких подуровней в пределах основного энергетического уровня.
Каким бы ни был номер основного энергетического уровня, который соответствует периоду или строке периодической таблицы, атом имеет такое же количество подуровней. Таким образом, бериллий в периоде 2 имеет два основных энергетических уровня, а его валентные электроны находятся на подуровне 2 s 2 . На другом конце группы находится радий в периоде 7. Хотя радий гораздо сложнее бериллия, с семью энергетическими уровнями вместо двух, тем не менее, он имеет ту же конфигурацию валентных электронов, только на более высоком энергетическом уровне: 7 с. 2 .
ГЕЛИЙ И ЩЕЛОЧНЫЕ МЕТАЛЛЫ.
Если изучить валентные электронные конфигурации элементов периодической таблицы, можно заметить удивительную симметрию и порядок. Все члены группы, хотя их основные уровни энергии различаются, обладают общими характеристиками. их паттерны валентной оболочки. Кроме того, для восьми групп, пронумерованных в версии периодической таблицы для Северной Америки, номер группы соответствует количеству валентных электронов.
Есть только одно исключение: гелий с конфигурацией валентных электронов 1 с 2 обычно помещается в группу 8 с благородными газами.Исходя из этой конфигурации s 2 , может показаться логичным разместить гелий поверх бериллия в семействе щелочноземельных металлов; но есть несколько причин, по которым этого не делают. Во-первых, очевидно, что гелий не металл. Что еще более важно, гелий ведет себя совершенно иначе, чем щелочноземельные металлы.
В то время как гелий, как и остальные благородные газы, очень устойчив к химическим реакциям и образованию связей, щелочноземельные металлы известны своей высокой реакционной способностью, то есть склонностью к образованию или разрыву связей между атомами или молекулами, так что материалы трансформируются.(Аналогичная взаимосвязь существует в группе 1, которая включает водород и щелочные металлы. Все они имеют одинаковую валентную конфигурацию, но водород никогда не входит в семейство щелочных металлов.)
Характеристики щелочноземельных металлов
Как щелочные металлы, щелочноземельные металлы обладают свойствами основания, в отличие от кислоты. Щелочноземельные металлы блестящие, большинство из них белого или серебристого цвета. Как и их «кузены» из семейства щелочных металлов, они светятся характерными цветами при нагревании.Кальций светится оранжевым светом, стронций — очень ярко-красным, а барий — зеленым яблоком. Физически они мягкие, но не такие мягкие, как щелочные металлы, многие из которых можно разрезать ножом.
Еще одно сходство щелочноземельных металлов со щелочными металлами заключается в том, что четыре из них — магний, кальций, стронций и барий — были идентифицированы или выделены в первом десятилетии XIX века английским химиком сэром Хамфри. Дэви (1778-1829). Примерно в то же время Дэви также выделил натрий и калий из семейства щелочных металлов.
РЕАКТИВНОСТЬ.
Щелочноземельные металлы менее реактивны, чем щелочные металлы, но, как и щелочные металлы, они гораздо более реактивны, чем большинство элементов. Опять же, как и их «кузены», они реагируют с водой с образованием газообразного водорода и гидроксида металла, хотя их реакции менее выражены, чем реакции щелочных металлов. Металлический магний в чистом виде горюч, и при контакте с воздухом он горит интенсивным белым светом, соединяясь с кислородом с образованием оксида магния.Точно так же кальций, стронций и барий реагируют с кислородом с образованием оксидов.
Из-за своей высокой реакционной способности щелочноземельные металлы редко появляются сами по себе в природе; скорее, они обычно встречаются с другими элементами в сложной форме, часто в виде карбонатов или сульфатов. Это, опять же, еще одно сходство со щелочными металлами. Но в то время как щелочные металлы имеют тенденцию образовывать катионы 1+ (положительно заряженные атомы), щелочноземельные металлы образуют катионы 2+, то есть катионы с положительным зарядом 2.
ТОЧКИ КИПЕНИЯ И ПЛАВЛЕНИЯ.
Один из способов отличия щелочноземельных металлов от щелочных металлов — это точки плавления и кипения — те температуры, соответственно, при которых твердый металл превращается в жидкость, а жидкий металл — в пар. Для щелочных металлов температуры кипения и плавления уменьшаются с увеличением атомного номера. Однако для щелочноземельных металлов картина не так ясна.
Самые высокие температуры плавления и кипения у бериллия, у которого действительно самый низкий атомный номер.Он плавится при 2348,6 ° F (1287 ° C) и кипит при 4789,8 ° F (2471 ° C). Эти цифры намного выше, чем для лития, щелочного металла в тот же период, что и бериллий, который плавится при температуре 356,9 ° F (180,5 ° C) и кипит при температуре 2457 ° F (1347 ° C).
Магний, второй щелочноземельный металл, плавится при температуре 1202 ° F (650 ° C) и кипит при температуре 1,994 ° F (1090 ° C), что значительно ниже, чем для бериллия. Однако точки плавления и кипения выше для кальция, который составляет треть щелочноземельных металлов, с цифрами 1 547.6 ° F (842 ° C) и 2703,2 ° F (1484 ° C) соответственно. Температуры плавления и кипения неуклонно снижаются по мере повышения уровня энергии через стронций, барий и радий, но эти температуры никогда не бывают ниже, чем для магния.
ИЗОБИЛИЕ.
Из щелочноземельных металлов наиболее распространен кальций. Он занимает пятое место среди элементов земной коры, составляя 3,39% элементарной массы. Он также является пятым по распространенности в организме человека, с долей 1,4%. Магний, который составляет 1.93% земной коры является восьмым по содержанию элементом на Земле. Он занимает седьмое место в организме человека, составляя 0,50% от массы тела.
Барий занимает семнадцатое место среди элементов земной коры, хотя на его долю приходится всего 0,04% массы элемента. Ни он, ни три других щелочных металла не появляются в организме в незначительных количествах: действительно, барий и бериллий ядовиты, а радий настолько радиоактивен, что воздействие на него может быть чрезвычайно вредным.
В земной коре стронций присутствует в количестве 360 частей на миллион (ppm), что на самом деле довольно много по сравнению с рядом элементов.В океане его содержание составляет около 8 промилле. Напротив, содержание бериллия в земной коре измеряется в частях на миллиард (ppb) и оценивается в 1900 ppb. Гораздо более редким является радий, который составляет всего 0,6 частей на триллион земной коры — факт, который сделал его выделение французско-польским физиком и химиком Мари Кюри (1867-1934) еще более впечатляющим.
ПРИМЕНЕНИЕ В РЕАЛЬНОМ ЖИЗНИ
Бериллий
В восемнадцатом веке французский минералог Рене Жюст-Хой (1743–1822) заметил, что и изумруды, и минерал берилл обладают схожими свойствами.Французский химик Луи-Николя Воклен (1763-1829) в 1798 году определил общий элемент: бериллий (Be), имеющий атомный номер 4 и атомную массу 9,01 а.е.м. Прошло около трех десятилетий, прежде чем немецкий химик Фридрих Вёлер (1800–1882) и французский химик Антуан Бюсси (1794–1882), работая независимо, сумели выделить элемент.
Бериллий содержится в основном в изумрудах и аквамаринах — драгоценных камнях, являющихся формами берилла, состоящего из алюмосиликатного соединения бериллия.Хотя он токсичен для человека, бериллий, тем не менее, находит применение в сфере здравоохранения: поскольку он пропускает больше рентгеновских лучей, чем стекло, бериллий часто используется в рентгеновских трубках.
Металлические сплавы, содержащие около 2% бериллия, имеют тенденцию быть особенно прочными, устойчивыми к износу и стабильными при высоких температурах. Например, медно-бериллиевые сплавы применяются в ручных инструментах в отраслях промышленности, где используются легковоспламеняющиеся растворители, поскольку инструменты, изготовленные из этих сплавов, не вызывают искр при ударе друг о друга.Сплавы бериллия и никеля применяются для специализированных электрических соединений, а также для высокотемпературных применений.
Магний
Английский ботаник и врач Неемия Грю (1641-1712) в 1695 году обнаружил сульфат магния в источниках недалеко от английского города Эпсом, графство Суррей. Это соединение, с тех пор называемое «английской солью», давно известно своей лечебной ценностью. Соль Эпсома используется для лечения эклампсии, состояния, которое вызывает судороги у беременных. Это соединение также является сильным слабительным и иногда используется для избавления организма от ядов, таких как родственный элемент магния, барий.
Некоторое время ученые путали оксид магнезии с известью или карбонатом кальция, который на самом деле включает другой щелочноземельный металл. В 1754 году шотландский химик и физик Джозеф Блэк (1728-1799) написал «Эксперименты с магнезией, альбой, негашеной извести и некоторыми другими щелочными веществами», важную работу, в которой он различал магнезию и известь. Дэви в 1808 году объявил магнезию оксидом нового элемента, который он назвал магнием, но прошло около 20 лет, прежде чем Бюсси удалось выделить этот элемент.
Магний (Mg) имеет атомный номер 12 и атомную массу 24,31 а.е.м. Он содержится в основном в таких минералах, как доломит и магнезит, оба из которых являются карбонатами; а в карналлите — хлорид. Силикаты магния включают асбест, тальк или тальк и слюду. Не все формы асбеста содержат магний, но тот факт, что многие из них содержат, только показывает, как химические реакции могут изменять свойства, которыми обладает элемент в отдельности.
ВАЖНЫЙ КОМПОНЕНТ ЗДОРОВЬЯ.
В то время как магний легко воспламеняется, асбест когда-то использовался в больших количествах в качестве антипирена. И хотя асбест был в значительной степени удален из общественных зданий по всей территории Соединенных Штатов из-за сообщений, связывающих воздействие асбеста с раком, магний является важным компонентом здоровья живых организмов. Он играет важную роль в хлорофилле, зеленом пигменте растений, который улавливает энергию солнечного света, и по этой причине он также используется в удобрениях.
В организме человека ионы магния (заряженные атомы) помогают в процессе пищеварения, и многие люди принимают минеральные добавки, содержащие магний, иногда в сочетании с кальцием.Существует также его использование в качестве слабительного, о котором уже упоминалось. Английские соли, как и положено их щелочному или щелочному качеству, чрезвычайно горькие — это вещество, которое человек принимает только в условиях крайней необходимости. С другой стороны, молоко с магнезией — слабительное с гораздо менее неприятным вкусом.
МАГНИЙ УХОДИТ НА ВОЙНУ.
Отличительной чертой химической универсальности магния является то, что этот же элемент, столь важный для сохранения жизни, также широко использовался в войне.Незадолго до Первой мировой войны Германия была ведущим производителем магния во многом благодаря методу электролиза, разработанному немецким химиком Р. В. Бунзеном (1811-1899). Когда Соединенные Штаты начали войну против Германии, американские компании начали производить магний в больших количествах.
Бунзен обнаружил, что порошкообразный магний горит ярким белым пламенем, а на войне магний использовался в осветительных ракетах, трассирующих пулях и зажигательных бомбах, которые воспламеняются и горят при ударе.Яркий свет, образующийся при горении магния, также нашел применение в ряде случаев в мирное время — например, в фейерверках и вспышках, используемых в фотографии.
Магний нашел применение в другой мировой войне. К тому времени, когда нацистские танки вошли в Польшу в 1939 году, немецкий военно-промышленный комплекс начал использовать металл для строительства самолетов и другой военной техники. Америка снова ввела в действие свою собственную машину для военного производства, резко увеличив производство магния до почти 184 000 тонн (166 924 800 кг) в 1943 году.
КОНСТРУКЦИОННЫЕ ПРИМЕНЕНИЯ.
Основное применение магния во время Первой мировой войны было связано с его зажигательными качествами, но во время Второй мировой войны он в основном использовался в качестве конструкционного металла. Он легкий, но прочнее на единицу массы, чем любой другой обычный конструкционный металл. Как металл для строительных машин и другого оборудования, магний по популярности уступает только железу и алюминию (который примерно на 50% плотнее магния).
Автомобильная промышленность — это одна из областей производства, в которой особенно важны структурные свойства магния.По обе стороны Атлантики автопроизводители используют или испытывают детали автомобилей, изготовленные из сплавов магния и других металлов, в первую очередь алюминия. Магний легко превращается в сложные конструкции, что может означать сокращение количества деталей, необходимых для сборки автомобиля, и, следовательно, упрощение процесса сборки.
Среди видов спортивного инвентаря, в котором используются магниевые сплавы, — маски для ловцов бейсбола, лыжи, беговые машины и даже подковы. В различных марках лестниц, портативных инструментов, электронного оборудования, биноклей, фотоаппаратов, мебели и багажа также используются детали из этого легкого и прочного металла.
Кальций
Дэви выделил кальций (Са) с помощью электролиза в 1808 году. Элемент, название которого происходит от латинского calx, или «известь», имеет атомный номер 20 и атомную массу 40,08. . Основными источниками кальция являются известняк и доломит, оба из которых являются карбонатами, а также сульфатный гипс.
В виде известняка и гипса кальций использовался в качестве строительного материала с древних времен и продолжает находить применение в этой области.Известь смешивают с глиной, чтобы сделать цемент, а цемент смешивают с песком и водой, чтобы сделать раствор. Кроме того, при смешивании с песком, гравием и водой из цемента получается бетон. Мрамор, который когда-то использовался для строительства дворцов, а сегодня используется в основном для декоративных элементов, также содержит кальций.
В сталелитейной, стекольной, бумажной и металлургической промышленности используются гашеная известь (гидроксид кальция) и негашеная известь или оксид кальция. Он помогает удалять загрязнения из стали и загрязняющие вещества из дымовых труб, а карбонат кальция в бумаге обеспечивает гладкость и непрозрачность готового продукта.Когда карбид кальция (CaC 2 ) добавляется в воду, образуется легковоспламеняющийся газ ацетилен (C 2 H 2 ), используемый в сварочных горелках. В различных соединениях кальций используется как отбеливатель; материал при производстве удобрений; и как заменитель соли в качестве плавильного агента на обледенелых дорогах.
Пищевая, косметическая и фармацевтическая промышленность используют кальций в составе антацидов, зубной пасты, жевательной резинки и витаминов. В большей степени, чем магний, кальций важен для живых существ и присутствует в листьях, костях, зубах, раковинах и кораллах.В организме человека он помогает свертыванию крови, сокращению мышц и регулированию сердцебиения. Содержащийся в зеленых овощах и молочных продуктах кальций (вместе с добавками кальция) рекомендуется для профилактики остеопороза. Последнее, состояние, связанное с потерей плотности костей, особенно характерно для пожилых женщин, в результате чего кости становятся хрупкими и легко ломаются.
Стронций
Ирландский химик и врач Адэр Кроуфорд (1748-1795) и шотландский химик и хирург Уильям Камберленд Крукшенк (1790-1800) в 1790 году обнаружили то, что Кроуфорд назвал «новым видом земли», недалеко от Стронтиана в Шотландии.Год спустя английский химик Томас Чарльз Хоуп (1766-1844) начал изучать найденную Кроуфордом и Крукшенком руду, которую они назвали стронцией.
В отчетах, составленных в 1792 и 1793 годах, Хоуп объяснила, что стронцию можно отличить от извести или гидроксида кальция на с одной стороны, и барита или гидроксида бария, с другой, в силу его реакции на испытания пламенем. В то время как кальций производил красное пламя, а барий — зеленое, стронция светилась ярко-красным светом, который легко отличить от более темного красного цвета кальция.
И снова Дэви выделил новый элемент с помощью электролиза в 1808 году. Впоследствии он был назван стронцием (Sr), его атомный номер 38 и атомная масса 87,62. Серебристо-белый, он быстро окисляется на воздухе, образуя бледно-желтую оксидную корку на любой свежесрезанной поверхности.
Хотя он имеет свойства, аналогичные свойствам кальция, сравнительная редкость стронция и затраты, связанные с его извлечением, не создают экономических стимулов для использования его вместо гораздо более распространенного родственного элемента.Тем не менее, у стронция есть несколько применений, в первую очередь из-за его яркого малинового пламени. Поэтому его применяют при изготовлении фейерверков, сигнальных ракет и трассирующих пуль, то есть снарядов, излучающих свет при полете по воздуху.
Одно из наиболее спорных «применений» стронция касалось радиоактивного изотопа стронция-90, побочного продукта испытаний ядерного оружия в атмосфере с конца 1940-х годов. Изотоп упал на землю в виде тонкого порошка, покрыл траву, был проглочен коровами и в конечном итоге попал в молоко, которое они производили.Из-за своего сходства с кальцием изотоп попал в зубы и десны детей, которые пили молоко, что вызвало проблемы со здоровьем, которые помогли положить конец атмосферным испытаниям в начале 1960-х годов.
Барий
История бария схожа с историей других щелочноземельных металлов. В восемнадцатом веке химики были убеждены, что оксид бария и оксид кальция представляют собой одно и то же вещество, но в 1774 году шведский химик Карл Вильгельм Шееле (1742-1786) продемонстрировал, что оксид бария представляет собой отдельное соединение.Дэви выделил этот элемент, как и два других щелочноземельных металла, с помощью электролиза в 1808 году.
Барий (Ba) имеет атомную массу 137,27 и атомный номер 56. Он появляется в основном в рудах барита, a сульфат и витерит карбонат. Сульфат бария используется в качестве белого пигмента в красках, а карбонат бария применяется в производстве оптического стекла, керамики, глазури. керамика и специальная посуда. Одно из наиболее важных применений — это смазка для бурового долота, известная как «буровой раствор» или суспензия для бурения нефтяных скважин.Как и ряд родственных ему элементов, барий (в форме нитрата бария) используется в фейерверках и факелах. В моющих средствах для моторных масел для поддержания чистоты двигателей используются оксид бария и гидроксид бария.
Бериллий — не единственный щелочноземельный металл, используемый для получения рентгеновских лучей, и магний не единственный член семейства, применяемый в качестве слабительного. Барий используется в клизмах, а сульфат бария используется для покрытия внутренней оболочки кишечника, чтобы врач мог исследовать пищеварительную систему пациента.(Хотя барий ядовит, но в форме сульфата бария он безопасен для проглатывания, потому что это соединение не растворяется в воде или других жидкостях организма.) Перед рентгенологическим обследованием пациента могут попросить выпить меловую жидкость сульфата бария. который поглощает большую часть излучения, испускаемого рентгеновским аппаратом. Это добавляет контрастности черно-белому рентгеновскому снимку, позволяя врачу поставить более обоснованный диагноз.
Радий
Сегодня радий (Ra; атомный номер 88; атомная масса 226 а.е.м.) мало используется вне исследований; Тем не менее, история его открытия Марией Кюри и ее мужем Пьером (1859–1906), французским физиком, является важной главой не только в истории химии, но и в истории человечества в целом.Вдохновленная открытием радиоактивных свойств урана французским физиком Анри Беккерелем (1852–1908), Мария Кюри увлеклась темой радиоактивности, по которой она написала свою докторскую диссертацию. Задавшись целью найти другие радиоактивные элементы, она и Пьер переработали большое количество урановой обманки, руды, обычно обнаруживаемой на урановых рудниках. В течение года они обнаружили элемент полоний, но были убеждены, что в смоляной обманке присутствовал другой радиоактивный ингредиент, хотя и в гораздо меньших количествах.
Кюри потратили большую часть своих сбережений на покупку тонны руды и начали работу по извлечению достаточного количества предполагаемого Элемента 88 для годной пробы — 0,35 унции (1 г). Практически непрерывно трудясь в течение четырех лет, Кюри — к тому времени утомленные и испытывающие финансовые трудности — наконец произвели необходимое количество радия. Их судьба должна была улучшиться: в 1903 году они разделили Нобелевскую премию по физике с Беккерелем, а в 1911 году Мари получила вторую Нобелевскую премию, на этот раз по химии, за открытия полония и радия.Она — единственный человек в истории, удостоенный Нобелевской премии в двух различных научных категориях.
Поскольку Кюри не смогли запатентовать свой процесс, они не получили прибыли от множества «радиевых центров», которые вскоре возникли, рекламируя недавно открытый элемент как лекарство от рака. На самом деле, как оказалось, опасность, связанная с этим высокорадиоактивным веществом, перевешивала любые преимущества. Таким образом, радий, который когда-то использовался в светящейся краске и на циферблатах часов, был выведен из употребления.Смерть Марии Кюри от лейкемии в 1934 году была вызвана длительным облучением радием и другими элементами.
ГДЕ ПОДРОБНЕЕ
«Щелочноземельные металлы». ChemicalElements.com (веб-сайт).
«Щелочноземельные металлы» (веб-сайт).
Ebbing, Darrell D .; Р.А. Д. Вентворт; и Джеймс П. Бирк. Вводная химия. Бостон: Хоутон Миффлин, 1995.
Керрод, Робин. Материя и материалы. Иллюстрировано Терри Хэдлером. Тарритаун, Нью-Йорк: Benchmark Books, 1996.
Мебейн, Роберт К. и Томас Р. Рыболт. Металлы. Иллюстрировано Анни Матсик. Нью-Йорк: Книги двадцать первого века, 1995.
Oxlade, Chris. Металл. Чикаго, Иллинойс: Библиотека Хайнемана, 2001.
Снедден, Роберт. Материалы. Des Plaines, IL: Heinemann Library, 1999.
«Визуальные элементы: группа 1 — щелочноземельные металлы» (веб-сайт).
КЛЮЧЕВЫЕ УСЛОВИЯ
ЩЕЛОЧНЫЕ ЗЕМЛИ МЕТАЛЛЫ:
Группа 2 периодической таблицы элементов с конфигурациями валентных электронов n с 2 . Шесть щелочноземельных металлов, каждый из которых обладает высокой химической реакционной способностью, — это бериллий, магний, кальций, стронций, барий и радий.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ:
Элементы группы 1 периодической таблицы элементов, за исключением водорода. Все щелочные металлы имеют один валентный электрон на орбитали s1 и обладают высокой реакционной способностью.
КАТИОН:
Положительный ион, который образуется, когда атом теряет один или несколько электронов. Все щелочноземельные металлы имеют тенденцию к образованию катионов 2+ (произносится как KAT-ieunz).
ЭЛЕКТРОЛИЗ:
Использование электрического тока, чтобы вызвать химическую реакцию.
ION:
Атом или группа атомов, которые потеряли или приобрели один или несколько электронов и, таким образом, имеют чистый электрический заряд.
ИЗОТОПЫ:
Атомы, которые имеют равное количество протонов и, следовательно, принадлежат к одному элементу, но различаются количеством нейтронов. Это приводит к разнице масс. Изотопы могут быть стабильными или нестабильными, то есть радиоактивными. Так обстоит дело с изотопами радия, радиоактивного члена семейства щелочноземельных металлов.
ORBITAL:
Шаблон вероятностей относительно положения электрона для анатома в определенном энергетическом состоянии.Все шесть щелочноземельных металлов имеют валентные электроны на орбитали s 2 , которая описывает более или менее сферическую форму.
ПЕРИОДЫ:
Строки периодической системы элементов. Они представляют собой последовательные основные энергетические уровни в атомах задействованных элементов.
ОСНОВНОЙ УРОВЕНЬ ЭНЕРГИИ:
Значение, указывающее расстояние, на которое электрон может уйти от ядра анатома. Это обозначается целым числом, начиная с 1 и двигаясь вверх.Чем выше главный энергетический уровень, тем больше энергия в атоме и тем сложнее структура орбиталей.
РАДИОАКТИВНОСТЬ:
Термин, описывающий явление, при котором определенные материалы подвергаются форме распада, вызванной испусканием частиц высокой энергии. «Разложение» в этом смысле не означает «гниль»; вместо этого радиоактивные изотопы продолжают превращаться в другие изотопы, пока не станут стабильными.
РЕАКЦИОННАЯ СПОСОБНОСТЬ:
Тенденция образования или разрыва связей между атомами или молекулами таким образом, что материалы трансформируются.
SALT:
Вообще говоря, соединение, объединяющее металл и неметалл. Более конкретно, соли (наряду с водой) являются продуктом реакции между кислотой и основанием.
SHELL:
Группа электронов на одном основном уровне энергии.
ПОВТОРНЫЙ УРОВЕНЬ:
Область в пределах основного энергетического уровня, занятая электронами в анатоме. Каким бы ни был номер основного энергетического уровня n , существует n подуровней.На каждом основном энергетическом уровне первым заполняется подуровень, соответствующий орбитальной схеме s , где все щелочноземельные металлы имеют свои валентные электроны.
VALENCE ELECTRONS:
Электроны, занимающие самые высокие энергетические уровни в анатоме и участвующие в химической связи.
Части Периодической таблицы
Группа 2A (или IIA ) периодической таблицы — щелочные земные металлы : бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).Они тяжелее и менее реакционноспособен, чем щелочные металлы Группы 1А. Имя приходит из-за того, что оксиды этих металлов давали основные растворы при растворении в воде, и они оставались твердыми при температурах доступный древним алхимикам. Подобно элементам Группы 1А, щелочноземельные металлы слишком реактивны, чтобы их можно было найти в природе в их элементальная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях самых высоких энергий. ( нс 2 ).Они меньше, чем щелочные металлы того же периода и, следовательно, имеют более высокую энергию ионизации. В большинстве случаев щелочноземельные металлы ионизируются. для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокие температуры плавления, чем щелочные металлы. металлы: бериллий плавится при 1287 ° C, магний при 649 ° C, кальций при 839 ° C, стронций при 768 ° C, барий при 727 ° C и радий при 700 ° C. Они есть более твердые металлы, чем элементы группы 1А, но мягкие и легкие по сравнению со многими переходными металлами.
Соли металлов группы 2А менее растворимы в воде, чем соли металлов Группа 1А из-за более высокой плотности заряда на катионах 2+; тем не менее, многие соли Группы 2А, по крайней мере, умеренно растворимы. Некоторые соли Группы 2A прочно связываются с молекулами воды и кристаллизуются как гидраты ; среди них — английская соль, MgSO 4 7H 2 O и гипс, CaSO 4 2H 2 О.
Бериллий (Be, Z = 4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от греческое слово, обозначающее минерал берилл, beryllo . Он находится в земная кора с концентрацией 2,6 частей на миллион, что делает ее 47-м по величине обильный элемент. Первичные руды бериллия являются бериллами [силикат бериллия-алюминия, Be 3 Al 2 (SiO 3 ) 6 ] и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ]. Бериллы ювелирного качества включают изумруды и аквамарин; зеленый цвет из этих драгоценных камней происходит из следовых количеств хрома.
Из-за своего небольшого размера и высокой плотности заряда бериллий связывает через ковалентную связь вместо ионной связи. Элементаль бериллий очень инертен по отношению к воздуху и воде даже при высоких температуры.
Из бериллия делают окна для рентгеновских трубок (это прозрачен для рентгеновских лучей) и используется в сплавах с другими металлами, такими как медь и никель, для изготовления искробезопасных инструментов и часовых пружин. Бериллий также используется в оболочках для ядерного оружия и в ядерной энергетике. электростанции из-за его способности отражать нейтроны. Бериллий накапливается в костях; длительное воздействие бериллия приводит к воспаление легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z = 12).
Магний — серебристо-белый относительно мягкий металл. Название элемента происходит от Магнезия, район в Фессалии в центральной Греции.Он находится в земная кора с концентрацией 2,3%, что делает ее 7-й по величине обильный элемент. Большое количество магния также присутствует в минералы в мантии Земли. Его получают из морской воды, карналита. [MgKCl 3 6H 2 O], доломит [смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ], и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в автомобилестроение и авиастроение; магниевые сплавы также используются в других легкие устройства, такие как лестницы, фотоаппараты, велосипедные рамы, жесткий диск диски и т. д.Магний окисляется легче, чем железо, и используется в расходных анодах для защиты железных труб и других структуры, которые легко корродируют.
Магний горит на воздухе бриллиантом. белое пламя и используется в фейерверках и зажигательных бомбах. (Это было используется в одноразовых лампах-вспышках, но это использование было вытеснено другими виды освещения.) Магниевые костры ставить очень сложно наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с азот с образованием нитрида магния (Mg 3 N 2 ), и с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде знакомых соединений. Магний оксид MgO используется в огнеупорных кирпичах, которые способны выдерживает высокие температуры в каминах и печах (магний оксид плавится при 2800 ° С). Гептагидрат сульфата магния, MgSO 4 7H 2 O, более известная как английская соль, миорелаксант и легкое слабительное. Гидроксид магния, Mg (OH) 2 , также известное как молоко магнезии, слабительное и антацидное средство. («Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний гидроксид плохо растворяется в воде, он имеет тенденцию к образованию мелового, белого цвета. суспензия, внешне похожая на молоко, но значительно отличающаяся физиологические эффекты.)
Зеленые растения содержат молекулу, называемую хлорофилл, состоящий из плоского кольца атомов углерода и азота с большим открытым пространством посередине, в котором связан ион магния, удерживается на месте атомами азота.В Молекула хлорофилла поглощает солнечный свет, и в процессе фотосинтез, энергия света преобразуется в химическую энергия, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами. (углеводороды, содержащие связи углерод-бром) с образованием магнийорганических соединений реактивы Гриньяра (в честь их первооткрывателя Виктора Гриньяр, лауреат Нобелевской премии по химии 1912 г.).Эти соединения чрезвычайно полезны при формировании новый углерод-углерод связи, и часто используются в синтезе органических соединений. Реагенты Гриньяра, как известно, чувствительны к воде, поэтому необходимо соблюдать осторожность. приняты для обеспечения того, чтобы аппарат, в котором протекает реакция выполняется очень сухо.
Кальций (Ca, Z = 20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от латинское слово «лайм» — calx .Он находится в земная кора с концентрацией 4,1%, что делает ее 5-й по величине обильный элемент. Основными источниками кальция являются кальцит и известняк. [карбонат кальция, CaCO 3 ], ангидрит [кальций сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция, CaSO 4 2H 2 O], и доломит [смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых существа, из раковин морских организмов и кораллов кораллов рифы (в виде кальция карбонат, CaCO 3 ) к костям и зубам наземных существа (в виде гидроксиапатита кристаллы, Ca 3 (PO 4 ) 2 ] 3 Ca (OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве материалы, такие как штукатурка, раствор и цемент. Строительный раствор изготавливается из оксида кальция, CaO, также известного как известь, или негашеная известь. Когда оксид кальция обрабатывается водой, он образует гидроксид кальция, Ca (OH) 2 , или гашеная известь, поглощающая углекислый газ из воздух и постепенно образует карбонат кальция, CaCO 3 . Известь, нагретая водородом в кислороде, горит ярко-белым. свет, который можно сфокусировать в узкий луч, видимый на большом расстояния.Такое освещение использовалось в маяках, в съемку, а в театрах ставить софиты (оставив актера «в в центре внимания »).
Хлорид кальция — это раствор (он поглощает достаточно воды из воздух, который растворяется в растворе) и используется для удаления влаги с воздуха в сырых подвалах. (Потребовался бы более сильный человек что я сопротивляюсь тому, чтобы называть свежеоткрытую коробку хлористого кальция, не вёл себя должным образом как «малолетний расплывающийся организм».»)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда, такой как кальций и магний; эти соли вызывают некоторое количество мыла и моющие средства для выпадения в осадок в виде «мыльной пены»; эти минералы выпадают в осадок со временем образует «накипь» в воде обогреватели и кастрюли. Кальций можно удалить водой смягчители, которые обменивают ионы кальция на ионы натрия, которые имеют 1+ и не выпадают в осадок.
Стронций (Sr, Z = 38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от Стронтиан, город в Шотландии, где был добыт минерал стронтианит. открыли, из которого впервые был выделен стронций. Он находится в земная кора с концентрацией 370 частей на миллион, что делает ее 16-м по величине обильный элемент. Встречается в рудах целестита [стронция сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании дают ярко-красный цвет и по этой причине используется в фейерверках и осветительных ракетах. Радиоактивный стронций-90 (бета-излучатель) образуется при ядерных взрывах; поскольку он химически похож на кальций, он включается в кости у людей, которые подвергаются этому. Стронций-90 — бета-излучатель, и препятствует выработке красных кровяных телец.
Барий (Ba, Z = 56).
Барий — блестящий мягкий металл. Название элемента происходит от греческое слово barys , что означает «тяжелый», в отношении высокая плотность некоторых минералов бария. Он находится в земная кора с концентрацией 500 ppm, что делает ее 14-й по величине обильный элемент. Он содержится в рудах барита [сульфат бария, BaSO 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в 1500-х годов в виде «болонских камней» (ныне известный как барий сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти камни светились как при свете, так и при нагревании. Соли бария при нагревании приобретают зеленый цвет и используются в фейерверк (в виде нитрата бария, Ba (NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так нерастворим в том, что он проходит через тело до всасывания барий может иметь место.Используется при диагностике некоторых проблемы с кишечником в виде «бариевых клизм»: сульфат бария непрозрачен для рентгеновских лучей и может использоваться для рентгена пищеварительной системы. тракт.
Радий (Ra, Z = 88).
Радий — мягкий блестящий радиоактивный металл. Имя элемента произошло от латинского слова «луч» радиуса , так как способность светиться в темноте слабым голубым светом.Он находится в земной коры с концентрацией 0,6 ppt (частей на триллион), что делает ее 84-й элемент по распространенности. Он содержится в следовых количествах в урановые руды, но коммерчески используемый радий легче получить из отработавшее ядерное топливо.
Радий был открыт Пьера и Марии Кюри в 1898 году; они добыли миллиграмм радия из трех тонн урановой руды. Радий производится в радиоактивный распад урана-235, урана-238, тория-232 и плутоний-241.После его открытия и до опасностей радиация были поняты, радий использовался во многих шарлатанских лекарствах и запатентованные лекарства. Радий использовали для изготовления светящихся в темноте часов лица начала 1900-х годов; альфа-частицы, испускаемые радием ударил частицы сульфида цинка, заставив их светиться, но остановился по корпусу часов по стеклу в циферблате. Многие из рабочие, рисовавшие эти циферблаты, заболели или умерли от лучевая болезнь.
Список литературы
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
Джон Эмсли, Природные строительные блоки: Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет Пресс, 2001.
Дэвид Л. Хейзерман, Исследование Химические элементы и их соединения . Нью-Йорк: TAB Книги, 1992.
Группы IIA, IIIA и IVA
Группы IIA, IIIA и IVA
Группа IIA: Щелочноземельные металлы
Элементы группы IIA (Be, Mg, Ca, Sr, Ba и Ra) являются металлы, и все, кроме Be и Mg, являются активными металлами. Эти элементы часто называют щелочноземельных металлов. Термин щелочной отражает тот факт, что многие соединения этих металлов являются основными или щелочной.Термин Земля исторически использовался для описывают тот факт, что многие из этих соединений нерастворимы в вода. Большая часть химии щелочноземельных металлов (группа IIA) можно предсказать по поведению щелочных металлов (Группа IA). Три точки должны быть иметь в виду, однако.
- Щелочноземельные металлы имеют тенденцию терять два электрона на образуют M 2+ ионов (Be 2+ , Mg 2+ , Ca 2+ и т. Д.).
- Эти металлы обладают меньшей реакционной способностью, чем соседние щелочной металл. Магний менее активен, чем натрий; кальций менее активен, чем калий; и так далее.
- Эти металлы становятся более активными по мере того, как мы спускаемся по колонке. Магний более активен, чем бериллий; кальций больше активнее магния; и так далее.
Щелочноземельные металлы реагируют с неметаллами с образованием продукты, ожидаемые от электронных конфигураций элементы.
мг ( с ) + Cl 2 ( г ) MgCl 2 ( с )
3 мг ( с ) + N 2 ( г ) Mg 3 N 2 ( с )
Ca ( с ) + H 2 ( г ) CaH 2 ( с )
Поскольку они не так активны, как щелочные металлы, большинство эти элементы образуют оксиды.
2 мг ( с ) + O 2 ( г ) 2 MgO ( с )
Кальций, стронций и барий также могут образовывать пероксиды.
Ba ( с ) + O 2 ( г ) BaO 2 ( с )
Более активные члены группы IIA (Ca, Sr и Ba) реагируют с водой комнатной температуры. Продукты этих реакций то, что мы могли ожидать. Кальций, например, теряет два электроны с образованием ионов Ca 2+ , когда он реагирует с водой.
Ca Ca 2+ + 2 e —
Эти электроны захватываются молекулами воды с образованием H 2 газа и ионов OH — .
2 H 2 O + 2 e — H 2 + 2 OH —
Объединение двух половин реакции так, чтобы электроны conserved дает следующий результат.
Ca ( с ) + 2 H 2 O ( л ) Ca 2+ ( водн. ) + 2 OH — ( водн. ) + H 2 ( г )
Хотя Mg не реагирует с водой при комнатной температуре, он вступит в реакцию с паром.Продукция этого реакция не может быть водной ионы Mg 2+ и OH — потому что вокруг нет жидкой воды, которая могла бы стабилизировать эти ионы. Продуктами реакции являются газ H 2 и магний. оксид, MgO.
мг ( с ) + H 2 O ( г ) MgO ( с ) + H 2 ( г )
| Практическая задача 2: Магний реагирует с водородом с образованием соединения A , которое представляет собой белое твердое вещество при комнатной температуре.Он также реагирует с соляной кислоты с образованием газа B и водного раствор соединения C . Определите продукты эти реакции и написать сбалансированные уравнения для каждого реакция. Нажмите здесь, чтобы проверить свой ответ на практическую задачу 2 |
Группа IIIA: Химия Алюминий
Элементы группы IIIA (B, Al, Ga, In и Tl) могут быть разделены на три класса.
- Бор — единственный элемент в этой группе, не являющийся металл. Он ведет себя как полуметалл или даже неметалл.
- Алюминий — третий по содержанию элемент в земной коры. Просто он немного менее реактивен, чем активные металлы.
- Остальные три элемента в этой группе являются активными металлами, но они настолько редки, что представляют ограниченный интерес. Общее количество галлия, индия и таллия менее 10 -10 % земной коры.
Таким образом, обсуждение металлов группы IIIA вращается вокруг химический состав алюминия, который можно понять, предположив что металл реагирует с образованием соединений, в которых он степень окисления +3.
2 Al ( s ) + 3 Br 2 ( l ) Al 2 Br 6 ( с )
4 Al ( с ) + 3 O 2 ( г ) 2 Al 2 O 3 ( с )
16 Al ( с ) + 3 S 8 ( с ) 8 Al 2 S 3 ( s )
Алюминий реагирует с концентрированными кислотами с образованием Al 3+ ионы и газ H 2 .
2 Al ( s ) + 6 H + ( водн. ) 2 Al 3+ ( водн. ) + 3 H 2 ( г )
Он также реагирует с концентрированными основаниями с образованием H 2 газ и алюминат-ион, Al (OH) 4 — , в который алюминий находится в степени окисления +3.
2 Al ( с ) + 2 OH — ( водн. ) + 6 H 2 O ( л ) 2 Al (OH) 4 — ( водн. ) + 3 H 2 ( г )
Группа IVA: олово и свинец
Элементы группы IVA можно разделить на три класса:
- углерод, неметалл;
- кремний и германий — полуметаллы; и
- олово и свинец — металлы.Олово и свинец входят в число самые старые известные металлы.
Олово и свинец обладают гораздо меньшей реакционной способностью, чем любая из групп IA, Металлы IIA или IIIA. Согласно аргументу, что элементы стать более металлическим и поэтому более активный по мере того, как мы спускаемся по столбцу таблицы Менделеева, свинца должно быть больше реактивен, чем олово.
Свинец реагирует с воздухом с образованием тонкого покрытия из PbO и / или PbCO 3 , который защищает металл от дальнейшей реакции.
2 Pb ( с ) + O 2 ( г ) 2 PbO ( с )
PbO ( с ) + CO 2 ( г ) PbCO 3 ( с )
В мелком виде свинец пирофорный он воспламеняется в присутствии кислорода.
Олово не реагирует ни с воздухом, ни с водой в помещении температура. При нагревании до белого цвета олово реагирует с воздухом, образуя форма SnO 2 .
Sn ( с ) + O 2 ( г ) SnO 2 ( с )
При высоких температурах он также реагирует с паром с образованием SnO 2 .
Sn ( с ) + 2 H 2 O ( г ) SnO 2 ( с ) + 2 H 2 ( г )
Олово и свинец менее активны, чем алюминий. Ни металла реагирует либо с разбавленной соляной кислотой, либо с разбавленной серной кислотой. кислота при комнатной температуре.Олово при нагревании реагирует с концентрированная соляная кислота или концентрированная серная кислота.
Sn ( с ) + 2 H + ( водн. ) Sn 2+ ( водн. ) + H 2 ( г )
Свинец медленно реагирует с соляной кислотой при комнатной температуре. и концентрированной серной кислотой при температуре выше 200 ° C.
Pb ( с ) + 2 H + ( водн. ) Pb 2+ ( водн. ) + H 2 ( г )
Олово и свинец являются металлами основной группы, которые образуют соединения в более чем одна степень окисления.Как правило, нижняя степень окисления становится более стабильным, когда мы спускаемся вниз по столбцу периодической таблицы. Свинец, например, с большей вероятностью будет обнаружен при окислении +2. состояние чем жесть. Таким образом, пока олово реагирует с кислородом при высоких температуры с образованием SnO 2 , свинец образует PbO. (ПБО 2 не может образоваться в результате прямой реакции между свинцом и кислородом.)
Chem4Kids.com: Элементы и периодическая таблица: Щелочноземельные металлы
Итак, мы только что рассмотрели щелочные металлы в Группе I.Вы найдете щелочноземельных металлов прямо по соседству в Группе II. Это второе по значимости реактивное семейство элементов в периодической таблице. Вы знаете, почему они называются щелочными ? Когда эти соединения смешиваются с растворами, они, вероятно, образуют растворы с pH выше 7. Эти более высокие уровни pH означают, что они определяются как «основные» или «щелочные» растворы.
Кто в семье? К щелочноземельным металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).Как и во всех семьях, эти элементы имеют общие черты. Хотя это семейство не так реактивно, как щелочные металлы, оно умеет очень легко создавать связи. У каждого из них на внешней оболочке по два электрона. Они готовы отдать эти два электрона в электровалентных / ионных связях. Иногда вы увидите их с двумя атомами галогена, как в случае фторида бериллия (BeF 2 ), а иногда они могут образовывать двойную связь, как в случае оксида кальция (CaO). Все дело в том, чтобы отказаться от этих электронов, чтобы получить полноценную внешнюю оболочку.
В конце списка вы найдете радиоактивный радий . Хотя радий больше не встречается в вашем доме, раньше он входил в состав светящихся в темноте красок. Первоначально он был смешан с сульфидом цинка (ZnS). Другие элементы можно найти во многих предметах, включая фейерверки, батарейки, лампы-вспышки и специальные сплавы. Более легкие щелочноземельные металлы, такие как магний и кальций, очень важны в физиологии животных и растений. Все вы знаете, что кальций помогает строить кости.Магний содержится в молекулах хлорофилла .
Не такой уж тяжелый металл — бериллий (видео НАСА)
Щелочноземельные металлы: определение, свойства и характеристики — стенограмма видео и урока
В этом упражнении вы проверите свои знания определения, свойств и характеристик щелочноземельных металлов из урока.
Проезд
Определите, верны ли следующие утверждения.Для этого распечатайте или скопируйте эту страницу на чистый лист и подчеркните или округлите ответ.
1. Щелочноземельные металлы реагируют с другими металлами с образованием ионных соединений посредством химической реакции.
Верно | Ложь
2. Окислительно-восстановительные реакции характеризуются одновременным окислением и восстановлением, при котором электроны переносятся между химическими соединениями.
Верно | Ложь
3. К группе щелочноземельных металлов относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радон (Rn).
Верно | Ложь
4. Жесткая вода — это вода с высоким содержанием минералов, которая в основном состоит из карбонатов кальция и бария.
Верно | Ложь
5. Ионы магния играют решающую роль в обмене веществ и работе мышц.
Верно | Ложь
6. Бериллий — металл серого стального цвета, который содержится в изумрудах.
Верно | Ложь
7. Кальций — это щелочноземельный металл, который в природе встречается в виде карбоната в известняке и в виде силиката во многих породах.
Верно | Ложь
8. Радиоактивный и нестабильный элемент, полученный из урана, известен как стронций.
Верно | Ложь
9. Энергия ионизации — это минимальное количество энергии, необходимое для удаления наиболее слабосвязанного электрона из элемента.
Верно | Ложь
10. Щелочноземельные металлы имеют электрон во внешней оболочке, что делает их очень реактивными.
Верно | Ложь
Ключ ответа
1.Неверно, потому что правильное утверждение: Щелочноземельные металлы реагируют с неметаллами с образованием ионных соединений посредством химической реакции .
2. Верно
3. Неверно, потому что правильное утверждение: Элементами, которые принадлежат к группе щелочноземельных металлов, являются бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий. (Ра) .
4. Неверно, потому что правильное утверждение: Жесткая вода — это вода с высоким содержанием минералов, которая в основном состоит из карбонатов кальция и магния.
5. Верно
6. Верно
7. Верно
8. Неверно, потому что правильное утверждение: Радиоактивный и нестабильный элемент, полученный из урана, известен как радий .
9. Верно
10. Неверно, потому что правильное утверждение: Щелочноземельные металлы имеют два электрона в их внешней оболочке, что делает их очень реактивными .
границ | Роль щелочноземельного металла-катализатора: теоретическое исследование гидроборирования пиридинов
Введение
Как важное производное пиридина дигидропиридин является важным сырьем для синтеза натуральных продуктов.Например, дигидропиридин широко используется для синтеза никотинамидадениндинуклеотида, гипотензивных и противовоспалительных средств (Karrer et al., 1937; Mauzerall and Westheimer, 1955; Bossert et al., 1981; Schramm et al., 1983; Berg et al., 2002). Кроме того, поскольку дигидропиридин может давать два атома водорода, он часто используется в качестве мягкого и эффективного восстановителя с высокой селективностью при каталитическом гидрировании (Adolfsson, 2005; Connon, 2007). Дигидропиридин можно получить деароматизацией пиридина и его производных.Однако применение этой реакции ограничено строгими условиями реакции и нестабильными деароматизированными промежуточными продуктами (Hantzsch, 1881; Stout and Meyers, 1982; Seyferth, 2009; Li Y. Y. et al., 2018). О синтезе этих соединений путем гомогенного катализа сообщалось редко (Harrod et al., 2001; Oshima et al., 2012a, b). В 1998 году исследовательская группа Харрода (Hao et al., 1998) осуществила гидросилилирование пиридина и получила 1,2-дигидропиридиновый продукт с производным титаноцена в качестве катализатора.В 2011 году группа Никонова (Гуцуляк и др., 2011) осуществила гидросилилирование пиридина рутением в качестве катализатора при комнатной температуре и получила смесь 1,2- и 1,4-боргидропиридина. Однако применение этих реакций в синтетической химии сильно ограничено дорогостоящим катализатором на основе переходных металлов (Ярошевский, 2006; Доберейнер, Крабтри, 2010; Осакада, 2011; Хуанг, Ся, 2015; Li et al., 2015; Qi et al. , 2016, 2018; Yang et al., 2016; Yu et al., 2016; Xing et al., 2017; Liu et al., 2018; Луо и др., 2018; Чжу и др., 2018).
Щелочноземельные металлы (Ae), которые находятся в группе IIA периодической таблицы элементов, привлекли широкое внимание из-за их низкой стоимости, доступности и больших запасов в природе (Green et al., 2007). Металлы, такие как магний, кальций, стронций и барий, обычно используются в качестве гомогенных катализаторов. Поскольку конфигурация валентных электронов d 0 в центре двухвалентного катиона (Ae 2+ ) в металлическом катализаторе Ae демонстрирует частичные «лантаноидные» характеристики, аналогичный каталитический цикл может быть построен при гомогенном катализе (Li and Marks, 1996; Westerhausen, 2008; Krieck et al., 2009; Hill et al., 2016; Ma et al., 2016; Rochat et al., 2016; Россин и Перуццини, 2016; Xu et al., 2017a).
За последние несколько десятилетий многие исследовательские группы подготовили ряд органических соединений металлов Ae, которые имеют широкие перспективы применения благодаря их низкой стоимости и токсичности (Arrowsmith et al., 2011; Liu et al., 2012; Intemann et al. , 2014; Schwamm et al., 2014; Hill et al., 2016; Россин, Перуццини, 2016). Одним из наиболее важных приложений является реакция переноса водорода, в которой гидриды металлов Ae обычно используются для переноса атомов водорода, и они проявляют уникальную каталитическую активность (Dunne et al., 2011; Harder et al., 2011; Praneeth et al., 2012; Intemann et al., 2013; Liptrot et al., 2014; Анкер и др., 2015; Weetman et al., 2016). Высокая каталитическая активность гидридов металлов Ae может быть объяснена двумя факторами. Во-первых, атомы водорода в металлогидриде Ae имеют высокую электронную плотность, что означает, что атомы водорода могут легко диссоциировать в форме свободных гидридных анионов, которые проявляют основность по Бренстеду. Во-вторых, гидриды металлов Ae также проявляют кислотность Льюиса из-за двух формальных положительных зарядов, переносимых ионами металлов (Rokob et al., 2013; Анкер и др., 2014; Стефа, 2015; Hill et al., 2016). Например, магниевый катализатор может катализировать реакцию гидроборирования боргидридных соединений (пинакол-боран (HBpin), 9-борабицикло [3.3.1] нонан (9-BBN) и т. Д.) С различными органическими соединениями (сложными эфирами, кетонами, аминами. , пиридины, имины, нитрилы и амиды) для создания новых связей C (гетеро) –B (Barrett et al., 2007; Hill et al., 2010; Arrowsmith et al., 2012; Butera et al., 2014; Schwamm et al., 2014; Lampland et al., 2015; Liptrot et al., 2015; Лю и др., 2017; Чжао и др., 2017; Jiang et al., 2018).
Хилл и его сотрудники (Arrowsmith et al., 2011) впервые сообщили о катализируемом магнием гидроборировании пиридинов в 2011 году. В 2014 году группа Harder’s (Intemann et al., 2014) сообщила о гидроборировании пиридина, катализируемом металлическим магнием Ae и получили 1,2-селективное присоединение 4 в качестве основного продукта (Схема 1). Harder et al. предположил, что гидрид магния 6 действует как катализатор в каталитическом цикле.Основываясь на экспериментальных наблюдениях и наших предыдущих теоретических исследованиях катализа Ae, существует два возможных пути реакции. Сырье пиридин 1 координируется с магнием в активных каталитических частицах 6 с образованием промежуточного соединения 7 (схема 2). Двойная связь C = N в пиридине затем вставляется в связь Mg – H с образованием деароматизированного промежуточного аминогруппы магния 8 , который может координироваться с пинаколбораном 2 с образованием азотно-борного соединения 9 .Наконец, гидрид магния 6 регенерируется переносом гидрида с высвобождением производного 1,2-боргидропиридина 4 . В качестве альтернативы промежуточное соединение 8 может быть изомеризовано путем миграции 1,3-водорода с образованием промежуточного соединения 10 , которое затем координируется с пинаколбораном 2 с образованием азотно-борного комплекса 11 . После соответствующего переноса гидрида получают 1,4-борогидропиридиновый продукт 5 и регенерируют активные частицы гидрида магния 6 .
Схема 1 . Катализируемое магнием гидроборирование пиридинов бораном.
Схема 2 . Вероятный механизм катализируемого магнием гидроборирования пиридинов бораном.
Здесь мы выполнили теоретическое механистическое исследование катализа Ae и определили тенденцию реактивации реакций гидрирования, катализируемых Ae. Реакция гидроборирования пиридина, катализируемая Ae-металлами, описанная группой Harder’s, была использована в качестве темплатной реакции для теоретических расчетов.Расчеты были выполнены на основе теории функционала плотности (DFT), и механизм реакции обсуждается, чтобы лучше понять процесс реакции и обеспечить теоретическое руководство для последующих органических реакций, катализируемых металлами Ae.
Вычислительные методы
Все расчеты DFT были выполнены с помощью программного пакета Gaussian 09 (Frisch et al., 2013). B3-LYP (Lee et al., 1988; Becke, 1993; Stephens et al., 1994; Adamo and Barone, 1999) работает со стандартом 6-31G (d) (Hehre et al., 1972; Francl et al., 1982) (базисный набор SDD Dolg et al., 1987 для атомов стронция) использовался для оптимизации геометрии. Расчеты частоты гармонических колебаний были выполнены для всех стационарных точек, чтобы определить, являются ли они локальными минимумами или переходными структурами, и получить термохимические поправки для энтальпий и свободных энергий. Функционал M11 (Peverati and Truhlar, 2011) с базисным набором 6-311 + G (d) (SDD для атомов стронция) использовался для расчета одноточечных энергий, поскольку ожидается, что эта стратегия обеспечит большую точность с Что касается энергетической информации (Peverati and Truhlar, 2012; Zhao et al., 2012; Ю и Лань, 2013; Cui et al., 2019). Влияние бензола на растворитель учитывалось путем одноточечных расчетов стационарных точек газовой фазы с использованием модели сольватации, основанной на плотности (SMD), которая является непрерывной моделью (Cances et al., 1997; Marenich et al., 2009). ). Приведенные значения свободных энергий представляют собой рассчитанные M11 значения свободных энергий Гиббса в бензольном растворителе на основе геометрии, рассчитанной для B3-LYP, с термодинамическими поправками. Геометрические конфигурации ключевых промежуточных продуктов реакции и переходных состояний были созданы с помощью программного обеспечения CYLview (Legault, 2009).Суммарные энергии для всех рассчитанных структур указаны в дополнительном материале.
Результаты и обсуждение
Механизм гидроборирования пиридина, катализируемый соединениями магний-водород
DFT-расчеты выполнены для гидроборирования пиридинов, катализируемого магнием (схема 2). Мы выбрали β-дииминовый гидрид магния 6 в качестве относительной нулевой точки свободной энергии Гиббса (рис. 1). Пиридин 12 координируется с активными частицами гидрида магния 6 с образованием промежуточного соединения 13 .Этот процесс является экзергоническим на 7,9 ккал / моль, что указывает на то, что гидрид магния может быть стабилизирован в виде кислоты Льюиса соответствующим основанием Льюиса. После активации пиридина частицами гидрида магния двойная связь C = N в пиридине 12 вставляется в связь Mg – H через переходное состояние 14-ts . энергетический барьер этапа введения составляет 29,7 ккал / моль, что указывает на то, что этот этап является этапом, определяющим скорость каталитического цикла. Геометрическая структура переходного состояния 14-ts показана на рисунке 2.Длина образующейся связи C – H составляет 1,58 Å. Длина разрываемой связи Mg – H составляет 1,91 Å. Длина связи C – N в пиридине, участвующем в реакции, составляет 1,40 Å. Приведенные выше данные геометрической структуры показывают, что в этой реакции одновременно происходит образование связи C – H и разрыв связи Mg – H. Промежуточное звено 15 получается, когда происходит двойная вставка C = N. Поскольку ароматичность пиридина в промежуточном соединении 15 разрушается, его относительная энергия равна 9.На 9 ккал / моль выше, чем у промежуточного продукта 13 . Кроме того, мы также рассмотрели другой способ получения промежуточного звена 15 . Когда пинаколборан 2 действует как мостик, атом водорода мигрирует от магния к бору через переходное состояние шестиатомного кольца 20-ts , а затем переходит от бора к ортоуглероду азота с образованием промежуточного соединения 15 . Энергия активации этого процесса составляет 33,5 ккал / моль, что указывает на возможный альтернативный путь образования промежуточного соединения 15 .В промежуточном продукте 15 , поскольку образуется ковалентная связь Mg – N и имеется неподеленная пара электронов на атоме азота, она может координироваться с пинаколбораном 2 с образованием бор-азотного кислотно-основного комплекса Льюиса 17 через низкоэнергетическое переходное состояние 16-ц . Интересно, что в промежуточном продукте 17 также есть две неподеленные пары электронов на каждом атоме кислорода в пинаколборане 2 , поэтому между кислородом и магнием может образовываться координационная связь, повышая стабильность промежуточного соединения 17 .Фрагмент пинаколборана 2 промежуточного соединения 17 активируется аминогруппой, поэтому гидрид может мигрировать от бора к магнию. Теоретические расчеты показывают, что этот процесс протекает через переходное состояние 18-ts со свободной энергией активации всего 5,3 ккал / моль. После этой стадии выделяется 1,2-борогидропиридиновый продукт 19 и регенерируются активные каталитические частицы 6 . Полный каталитический цикл экзотермичен только на 6,2 ккал / моль.Это указывает на слабую термодинамическую движущую силу, которую можно объяснить ароматичностью разрушаемого пиридина. Тем не менее, для запуска реакции образуется стабильная ковалентная связь N – B.
Рисунок 1 . Профиль свободной энергии для катализируемого магнием гидроборирования пиридинов и борана. Относительные свободные энергии (ΔG) в бензоле приведены в ккал / моль.
Рисунок 2 . Геометрия переходных состояний 14-ts , 16-ts и 18-ts .Длины облигаций указаны в Ангстремах.
Механизм гидроборирования пиридина, катализируемый другими металлами Ae
Группа Хардера определила только каталитическую активность соединений магния. После этих результатов Хардер и его сотрудники (Intemann et al., 2015) сообщили о катализируемом кальцием гидросилилировании пиридина, демонстрируя, что бета-декетиминат гидрид кальция способен к более быстрой селективной 1,2-деароматизации в 2015 году. правила периодического закона элементов и наших предыдущих теоретических исследований (Gao et al., 2016; Qi et al., 2017; Xu et al., 2017a, b; Li, Y. et al., 2018) элементы одной основной группы часто имеют схожие химические свойства (Cotton et al., 1988). После исследования механизма гидроборирования пиридина, катализируемого магниевым катализатором, мы выполнили расчеты M11, чтобы предсказать каталитическую активность других металлов Ae в группе. В реакции гидроборирования пиридина стадией, определяющей скорость, считается вставка пиридиновой связи C = N с разрывом связи Mg – H. Следовательно, для этой реакции благоприятна слабая ковалентная связь металл – H.Рассчитанные энергии диссоциации связей (БДЭ) связей Ae – H показаны на рисунке 3. БДЭ Be – H, Mg – H, Ca – H и Sr – H составляют 96,3, 75,5, 64,6 и 62,2 ккал / моль. , соответственно. Следовательно, бериллий, который находится в той же группе, что и магний, имеет малый атомный радиус, большие стерические затруднения, низкие металлические свойства и сильную связь Be – H. Мы полагаем, что гидроборирование не может катализироваться частицами гидрида бериллия. Кроме того, кальций и стронций могут иметь более высокую каталитическую активность, чем магний, из-за слабых ковалентных связей металл-H из-за их большего атомного радиуса и более низкой электроотрицательности.
Рисунок 3 . Значение БДЭ для соответствующих связей Ae – H указано в ккал / моль. Свободная энергия (ΔG) в бензоле дана в ккал / моль.
Мы также рассчитали поверхности потенциальной энергии реакции гидроборирования пиридина, катализируемой гидридом кальция и стронция (рис. 4). На Фигуре 4A активный катализатор на основе гидрида кальция 6a выбран в качестве относительного нуля свободной энергии Гиббса. Во-первых, гидрид кальция 6a координируется с пиридином 12 , давая промежуточное соединение 13a с относительной свободной энергией Гиббса, равной 1.0 ккал / моль. Пиридиновая связь C = N затем вставляется в ковалентную связь Ca – H через переходное состояние 14a-ts . Энергетический барьер этого процесса составляет 17,4 ккал / моль, что указывает на то, что этот этап является этапом, определяющим скорость каталитического цикла. По сравнению с соответствующей реакцией, катализируемой магнием, энергия активации, необходимая для стадии, определяющей скорость, уменьшается на 12,3 ккал / моль. Таким образом, можно сделать вывод, что активность кальциевого катализатора выше, чем у магниевого катализатора.Промежуточное соединение 15a координируется с пинаколбораном 2 через соответствующее низкоэнергетическое переходное состояние 16a-ts с образованием бор-азотного кислотно-основного комплекса Льюиса 17a . Наконец, 1,2-боргидропиридиновый продукт 19 высвобождается путем переноса гидрида с регенерацией активных каталитических частиц 6a . Геометрические структуры 14a-ts , 16a-ts и 18a-ts показаны на рисунке 5. Соответствующие переходные состояния металла Ae имеют аналогичную структуру.
Рисунок 4 . Профиль свободной энергии для катализируемого кальцием (A) или катализируемого стронцием (B) гидроборирования пиридинов и борана. Относительные свободные энергии (ΔG) в бензоле приведены в ккал / моль.
Рисунок 5 . Геометрия переходных состояний 14a-ts , 16a-ts , 18a-ts , 14b-ts , 16b-ts и 18b-ts . Длины облигаций указаны в Ангстремах.
Гидрид стронция 6b может также координироваться с пиридином 12 , давая промежуточное соединение 13b , которое является эндергонным на 2,1 ккал / моль (рис. 4B). Промежуточное соединение 13b нестабильно и склонно к реакции. Энергия активации, необходимая для внедрения связи C = N в связь Sr – H через переходное состояние 14b-ts , составляет 14,4 ккал / моль. Однако промежуточное соединение 17b , образованное путем координации с пинаколбораном 2 , очень стабильно, и его свободная энергия равна 9.На 5 ккал / моль ниже, чем у продукта 1,2-борогидропиридина 19 и регенерированного активного катализатора 6b . Следовательно, полная свободная энергия активации стронциевого катализа этой реакции составляет 23,9 ккал / моль, что на 5,8 ккал / моль ниже, чем для магниевого катализа, но на 5,8 ккал / моль выше, чем для кальциевого катализа. Таким образом, наши теоретические расчеты предсказывают, что каталитическая активность комплексов металлов Ae составляет кальций> стронций> магний.
Заключение
Механизм гидроборирования пиридина, катализируемого рядом металлов Ae, систематически исследовался расчетами методом DFT. Когда в качестве катализатора используется комплекс магния, промежуточный гидрид магния является активным каталитическим веществом для этой реакции. Согласно теоретическим расчетам, механизм этой реакции следующий. Пиридин сначала координируется с атомом магния в активном катализаторе, затем идет двойная связь пиридина C = N, вставляемая в связь Mg – H, что приводит к деароматизации.Промежуточный амино-магний координируется с пинаколбораном, а промежуточный гидрид магния регенерируется переносом гидрида для высвобождения продукта. Каталитическая активность различных металлов Ae в одной и той же группе была предсказана расчетами методом DFT. Тенденция БДЭ Ae – H: Mg – H> Ca – H> Sr – H. Теоретические расчеты показывают, что при использовании кальциевого катализатора свободная энергия активации для внедрения двойной связи C = N в связь Ca – H, которая является определяющей скоростью стадии каталитического цикла, намного ниже.Однако, поскольку бор-азотный кислотно-основной комплекс Льюиса со стронциевым катализатором очень стабилен, кажущаяся свободная энергия активации для стронциевого катализатора выше, чем для кальциевого катализатора, но ниже, чем для магниевого катализатора. Поэтому мы полагаем, что можно использовать более мягкие условия реакции, если в качестве катализатора использовать комплекс кальция или стронция.
Авторские взносы
Работа выполнена при сотрудничестве всех авторов. YyL, RB и YL отвечали за изучение концепции и дизайн проекта.MW и HC провели поиск промежуточных продуктов и переходных состояний, JZ и DX проанализировали данные и построили энергетические профили. YyL, LQ и YL составили и отредактировали рукопись.
Финансирование
Этот проект был поддержан Проектом фундаментальных и передовых исследований Комиссии по науке и технологиям Чунцина (№№ cstc2018jcyjAX0827, cstc2018jcyjAX0824, cstc2017jcyjAX0371), Проектом по созданию платформы совместной инновационной деятельности в области науки и технологий Педагогического университета Чунцина (№2017XJPT01), Проект программы научных и технологических исследований муниципальной комиссии по образованию Чунцина (№ KJQN201801603) и Национального научного фонда Китая (№№ 21822303, 21772020).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fchem.2019.00149/full#supplementary-material
Список литературы
Адамо, К., и Бароне, В. (1999). К надежным методам функционала плотности без регулируемых параметров: модель PBE0. J. Chem. Phys. 110, 6158–6170. DOI: 10.1063 / 1.478522
CrossRef Полный текст | Google Scholar
Анкер, М. Д., Эроусмит, М., Беллхэм, П., Хилл, М. С., Коциок-Кён, Г., Липтрот, Д. Дж. И др. (2014). Селективное восстановление CO 2 до метанольного эквивалента с помощью щелочноземельного катализа, активированного B (C 6 F 5 ) 3 . Chem. Sci. 5, 2826–2830. DOI: 10.1039 / C4SC00885E
CrossRef Полный текст | Google Scholar
Анкер, М. Д., Хилл, М. С., Лоу, Дж. П., и Махон, М. Ф. (2015). Гомологация и восстановительный катализ с использованием щелочноземельного углекислого газа. Angew. Chem. Int. Эд. 54, 10009–10011. DOI: 10.1002 / anie.201505851
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эроусмит М., Хадлингтон Т. Дж., Хилл М. С. и Коциок-Кён Г. (2012). Катализируемое магнием гидроборирование альдегидов и кетонов. Chem. Commun. 48, 4567–4569. DOI: 10.1039 / c2cc30565h
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эроусмит М., Хилл М. С. и Хадлингтон Т. Г. (2011). Коциок-Кён, Уитман, К. Гидроборирование пиридинов, катализируемое магнием. Металлоорганические соединения 30, 5556–5559. DOI: 10.1021 / om2008138
CrossRef Полный текст | Google Scholar
Барретт А.Г., Криммин М.Р.С., Хилл М., Хичкок П.Б. и Прокопиу П.А. (2007).Катализируемое кальцием межмолекулярное гидрофосфирование. Металлоорганические соединения 26, 4076–4079. DOI: 10.1021 / om070083t
CrossRef Полный текст | Google Scholar
Беке А. Д. (1993). Плотно-функциональная термохимия. III. Роль точного обмена. Дж . Chem. Phys. 98, 5648–5652. DOI: 10.1063 / 1.464913
CrossRef Полный текст | Google Scholar
Берг, Дж. М., Тимочко, Дж. Л. и Страйер, Л. (2002). Биохимия, 5-е изд.; W . Филадельфия, Пенсильвания: Х. Фриман.
Боссерт Ф., Мейер Х. и Вехингер Э. (1981). 4-Арилдигидропиридины, новый класс высокоактивных антагонистов кальция. Angew. Chem. Int. Эд. 20, 762–769. DOI: 10.1002 / anie.198107621
CrossRef Полный текст | Google Scholar
Бутера В., Руссо Н. и Сицилия Э. (2014). Высвобождение водорода из диалкиламино-боранов, вызванное комплексами Mg и Ca: анализ механизма реакции методом DFT. Chem.Евро. J. 20, 5967–5976. DOI: 10.1002 / chem.201304329
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cances, E., Mennucci, B., and Tomasi, J. (1997). Новый формализм интегрального уравнения для модели поляризуемого континуума: теоретические основы и приложения к изотропным и анизотропным диэлектрикам. J. Chem. Phys. 107, 3032–3041. DOI: 10.1063 / 1.474659
CrossRef Полный текст | Google Scholar
Коттон, Ф. А., Уилкинсон, Г., Мурильо, К.А., и Бохманн, М. (1988). Высшая неорганическая химия, 6-е изд. Нью-Йорк, Нью-Йорк: издание Wiley-interscience.
Цуй, К. X., Сюй, Д., Дин, Б. В., Цюй, Л. Б., Чжан, Ю. П., и Лан, Ю. (2019). Сравнительное исследование популярных функционалов плотности для расчета энергий связи трехцентровых двухэлектронных связей. J. Comput. Chem. 40, 657–670. DOI: 10.1002 / jcc.25752
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доберейнер, Г.Э. и Крэбтри Р. Х. (2010). Дегидрирование как субстрат-активирующая стратегия в гомогенном катализе переходными металлами. Chem. Ред. 110, 681–703. DOI: 10.1021 / cr2j
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Долг М., Ведиг У., Столл Х. и Пройс Х. (1987). Энергетически скорректированные псевдопотенциалы ab initio для переходных элементов первой строки. J. Chem. Phys. 86, 866–872. DOI: 10.1063 / 1.452288
CrossRef Полный текст | Google Scholar
Данн, Дж.Ф., Нил С. Р., Энгелькемир Дж., Эллерн А. и Садоу А. Д. (2011). Катализируемое трис (оксазолинил) боратомагнием кросс-дегидросоединение органосиланов с аминами, гидразином и аммиаком. J. Am. Chem. Soc. 133, 16782–16785. DOI: 10.1021 / ja207641b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Francl, M. M., Pietro, W. J., Hehre, W. J., Stephen Binkley, Gordon, M. S., DeFrees, D. J., et al. (1982). Самосогласованные методы молекулярных орбиталей. XXIII.Базис поляризационного типа для элементов второго ряда. J. Chem. Phys. 77, 3654–3665. DOI: 10.1063 / 1.444267
CrossRef Полный текст | Google Scholar
Фриш, М. Дж., Тракс, Г. У., Шлегель, Х. Б., Скузерия, Г. Э., Робб, М. А., Чизман, Дж. Р. и др. (2013). Gaussian 09, Revision D.01, Gaussian, Inc. , Wallingford, CT: Полный список авторов приведен в ESI.
Гао Б., Лю С., Лань Ю. и Хуанг Х. (2016). Катализируемое родием циклокарбонилирование кетиминов через активацию связи C-H. Металлоорганические соединения 35, 1480–1487. DOI: 10.1021 / acs.organomet.6b00072
CrossRef Полный текст | Google Scholar
Hantzsch, A. (1881). Конденсационный продукт из альдегидаммоний и кетонартиген Verbindungen. Ber. Dtsch. Chem. Ges. 14, 1637–1638. DOI: 10.1002 / cber.18810140214
CrossRef Полный текст | Google Scholar
Hao, L., Harrod, J. F., Lebuis, A. M., Mu, Y., Shu, R., Samuel, E., et al. (1998). Гомогенное каталитическое гидросилилирование пиридинов. Angew. Chem. Int. Эд. 37, 3126–3129. DOI: 10.1002 / (SICI) 1521-3773 (19981204) 37:22 <3126 :: AID-ANIE3126> 3.0.CO; 2-квартал
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хардер С., Шпильманн Дж., Интеманн Дж. И Бандманн Х. (2011). Хранение водорода в гидриде магния: молекулярный подход. Angew. Chem. Int. Эд. 50, 4156–4160. DOI: 10.1002 / anie.201101153
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харрод, Дж.Ф., Шу, Р. Г., Ву, Х. и Самуэль, Э. (2001). Титаноцен (III) катализирует гомогенное гидросилирование-гидрирование пиридинов. Кан. J. Chem. 79, 1075–1185. DOI: 10.1139 / v00-191
CrossRef Полный текст | Google Scholar
Хере, У. Дж., Дитчфилд, Р. и Попл, Дж. А. (1972). Самосогласованные методы молекулярных орбиталей. XII. дальнейшее расширение базисных наборов гауссовского типа для использования в исследованиях молекулярных орбиталей органических молекул. J. Chem. Phys. 56, 2257–2261.DOI: 10.1063 / 1.1677527
CrossRef Полный текст | Google Scholar
Хилл, М. С., Макдугалл, Д. Дж., И Махон, М. Ф. (2010). Группа 2 способствовала высвобождению водорода из NMe 2 H · BH 3 : промежуточные соединения и катализ. Dalton Trans. 39, 11129–11131. DOI: 10.1039 / c0dt01246g
CrossRef Полный текст | Google Scholar
Хуан Г. П., Ся Ю. З. (2015). Управляемые катализатором разрывы σ-связей C-C в катализируемой галогенидами металлов циклоизомеризации 3-ацилциклопропенов через формальный механизм 1,1-галометаллирования: выводы из квантово-химических расчетов. ACS Catal. 5, 859–868. DOI: 10.1021 / cs501738p
CrossRef Полный текст | Google Scholar
Интеманн, Дж., Бауэр, Х., Пал, Дж., Марон, Л., и Хардер, С. (2015). Гидрид кальция катализирует высокоселективное 1,2-селективное гидросилилирование пиридина. Chem. Евро. J . 21, 11452–11461. DOI: 10.1002 / chem.201501072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Intemann, J., Lutz, M., and Harder, S. (2014). Многоядерные кластеры гидрида магния: селективное восстановление и каталитическое гидроборирование пиридинов. Металлоорганические соединения 33, 5722–5729. DOI: 10.1021 / om500469h
CrossRef Полный текст | Google Scholar
Intemann, J., Spielmann, J., Sirsch, P., and Harder, S. (2013). Четко определенные молекулярные кластеры гидрида магния: соотношение между размером и температурой отщепления водорода. Chem. Евро. J. 19, 8478–8489. DOI: 10.1002 / chem.201300684
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзян, Ю. Ю., Лю, Т. Т., Чжан, Р.X., Xu, Z. Y., Sun, X., и Bi, S. (2018). Механизм и факторы, определяющие скорость образования амидной связи через перенос ацила смешанных карбоксильно-карбаминовых ангидридов: вычислительное исследование. J. Org. Chem. 83: 2676–2685. DOI: 10.1021 / acs.joc.7b03107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каррер П., Рингье Б. Дж., Бючи, Фриче Х. и Зольмссен У. (1937). Modellversuche betreffend die wasserstoffübertragenden Wirkungsgruppen der Cofermente. Helv. Чим. Acta. , 20, 55–71. DOI: 10.1002 / hlca.19370200106
CrossRef Полный текст | Google Scholar
Крик, С., Гёрлс, Х., Ю, Л., Райхер, М., Вестерхаузен, М. (2009). Стабильный «обратный» сэндвич-комплекс с беспрецедентным органокальцием (I): кристаллические структуры [(thf) 2 Mg (Br) -C 6 H 2 -2,4,6-Ph 3 ] и [ (thf) 3 Ca {μ-C 6 H 3 -1,3,5-Ph 3 } Ca (thf) 3 ]. J. Am. Chem. Soc. 131, 2977–2985. DOI: 10.1021 / ja808524y
CrossRef Полный текст | Google Scholar
Лэмпленд, Н. Л., Хови, М., Мукерджи, Д., и Садоу, А. Д. (2015). Катализируемое магнием мягкое восстановление третичных и вторичных амидов до аминов. ACS Catal. 5, 4219–4226. DOI: 10.1021 / acscatal.5b01038
CrossRef Полный текст | Google Scholar
Ли К., Янг В. и Роберт Г. (1988). Развитие формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Phys. Ред. Б. 37, 785–789. DOI: 10.1103 / PhysRevB.37.785
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лего, К. Ю. (2009). CYLView, 1.0b, Университет Шербрук, Канада, доступно в Интернете по адресу: http://www.cylview.org/
Ли Ю., Лю С., Ци З., Ци Х., Ли Х. и Лань Ю. (2015). Механизм разрыва связи N-O в катализируемой родием функционализации связи C-H N-оксидов хинолина с помощью алкинов: компьютерное исследование. Chem.Евро. J. 21, 10131–10137. DOI: 10.1002 / chem.201500290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли Ю., Цзоу Л., Бай Р. и Лан Ю. (2018). Ni (I) –Ni (III) в сравнении с Ni (II) -Ni (IV): изучение механизма каталитического никелевого алкилирования бензамидов алкилгалогенидами. Org. Chem. Фронт. 5, 615–622. DOI: 10.1039 / C7QO00850C
CrossRef Полный текст | Google Scholar
Ли, Ю. В., и Маркс, Т. Дж. (1996). Разнообразные механистические пути и селективности в гидроаминировании, катализируемом органо-F-элементами.Гидроаминирование алкинов и алкенов, катализируемое межмолекулярными лантаноорганическими соединениями. Металлоорганические соединения 15, 3770–3772. DOI: 10.1021 / om960293y
CrossRef Полный текст
Li, Y. Y., Chen, Y., Shan, C.H., Zhang, J., Xu, D. D., Bai, R.P., et al. (2018). Последние достижения в реакциях гидрофункционализации, катализируемых щелочноземельными металлами. Подбородок. J. Org. Chem. 38, 1885–1896. DOI: 10.6023 / cjoc201804031
CrossRef Полный текст
Липтрот, Д. Дж., Хилл, М.С., и Махон, М. Ф. (2014). Доступ к одноэлектронному многообразию: выделение водорода из силанов с помощью магния. Angew. Chem. Int. Эд. 53, 6224–6227. DOI: 10.1002 / anie.201403208
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Липтрот, Д. Дж., Хилл, М. С., Махон, М. Ф., и Уилсон, А. С. (2015). Катализируемое щелочноземельным катализом дегидросцепление аминов и боранов. Angew. Chem. Int. Эд. 54, 13362–13365. DOI: 10.1002 / anie.201505949
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Б., Ройснель, Т., Карпентье, Дж. Ф., Саразин, Ю. (2012). Чем больше, тем лучше: межмолекулярная гидрофункционализация активированных алкенов, катализируемая гетеролептическими щелочноземельными комплексами. Angew. Chem. Int. Эд. 51, 4943–4946. DOI: 10.1002 / anie.201200364
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю С., Ци, Х. Т., Цюй, Л. Б., Бай, Р. П., и Лан, Ю. (2018). Расщепление связи C-H, происходящее на промежуточном соединении Rh (V): теоретическое исследование катализируемого Rh азидирования арена. Catal. Sci. Technol. 8, 1645–1651. DOI: 10.1039 / C7CY02367G
CrossRef Полный текст | Google Scholar
Лю Ю. Х., Тан Ю. Н., Цзян Ю. Ю., Чжан Х. М., Ли П. и Би С. В. (2017). Механизм и происхождение Et 2 Al (OEt) -индуцированная хемоселективность катализируемого никелем трехкомпонентного связывания одного дикетена и двух алкинов. ACS Catal. 7, 1886–1896. DOI: 10.1021 / acscatal.6b03543
CrossRef Полный текст | Google Scholar
Луо, Ю., Лю С., Сюй Д., Цюй Л.-Б., Луо X., Бай Р. и др. (2018). Эффект противоиона и эффект направляющей группы в процессах активации связи C-H, опосредованных Rh: теоретическое исследование. J. Organomet. Chem. 864, 148–153. DOI: 10.1016 / j.jorganchem.2018.03.016
CrossRef Полный текст | Google Scholar
Ма, М. Т., Ван, В. Ф. и Яо, В. В. (2016). Синтез комплексов магния (I) и их применение. Подбородок. J. Org. Chem. 36, 72–82. DOI: 10.6023 / cjoc201507015
CrossRef Полный текст
Маренич, А.В., Крамер, К. Дж., И Трулар, Д. Г. (2009). Универсальная сольватационная модель, основанная на плотности растворенных электронов и на континуальной модели растворителя, определяемой объемной диэлектрической проницаемостью и поверхностным натяжением атомов. J. Phys. Chem. Б. 113, 6378–6396. DOI: 10.1021 / jp810292n
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маузералл Д. и Вестхаймер Ф. (1955). Н. 1-Бензилдигидроникотинамид — модель восстановленного ДПН. J. Am. Chem. Soc. 77, 2261–2264.DOI: 10.1021 / ja01613a070
CrossRef Полный текст | Google Scholar
Осима, К., Омура, Т., и Сугиноме, М. (2012a). Региоселективный синтез 1,2-дигидропиридинов гидроборированием пиридинов, катализируемым родием. J. Am. Chem. Soc. , 134, 3699–3702. DOI: 10.1021 / ja3002953
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Осима К., Омура Т. и Сугиноме М. (2012b). Деароматизирующее превращение пиразинов в производные 1,4-дигидропиразина посредством диборации без переходных металлов, силаборации и гидроборирования. Chem. Commun. 48, 8571–8573. DOI: 10.1039 / c2cc34086k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Певерати Р. и Трухлар Д. Г. (2011). M11-L: локальный функционал плотности, обеспечивающий повышенную точность расчетов электронной структуры в химии и физике. J. Phys. Chem. Lett. 2, 2810–2817. DOI: 10.1021 / jz201170d
CrossRef Полный текст | Google Scholar
Певерати Р. и Трухлар Д. Г. (2012).Выполнение функционалов плотности M11 и M11-L для расчета энергий электронного возбуждения по адиабатической теории функционала плотности, зависящей от времени. Phys. Chem. Chem. Phys. 14, 11363–11370. DOI: 10.1039 / c2cp41295k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Qi, X., Bai, R., Zhu, L., Jin, R., Lei, A., and Lan, Y. (2016). Механизм синергетического соединения алкинов, опосредованного Cu (II) / Cu (I): биядерное 1,2-восстановительное отщепление после точки пересечения с минимальной энергией. J. Org. Chem. 81, 1654–1660. DOI: 10.1021 / acs.joc.5b02797
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ци, X., Ли, Ю., Бай, Р., и Лан, Ю. (2017). Механизм катализируемой родием функционализации C-H: успехи в теоретических исследованиях. В соотв. Chem. Res. 50, 2799–2808. DOI: 10.1021 / acs.accounts.7b00400
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ци, Х. Т., Лю, Х. Ф., Цюй, Л. Б., Лю, К., и Лань, Ю.(2018). Механистический взгляд на катализируемое кобальтом стереодивергентное полугидрирование алкинов: история контроля селективности. J. Catal. 362, 25–34. DOI: 10.1016 / j.jcat.2018.03.016
CrossRef Полный текст | Google Scholar
Рочат Р., Лопес М. Дж., Цуруги Х. и Машима К. (2016). Последние разработки в области гомогенного магнийорганического катализа. Chem. Кот. Chem. 8, 10–20. DOI: 10.1002 / cctc.201500853
CrossRef Полный текст | Google Scholar
Рокоб, Т.А., Бако И., Стирлинг А., Хамза А. и Папай И. (2013). Модели реактивности активации водорода фрустрированными парами Льюиса: синергетический перенос электронов или поляризация электрическим полем? J. Am. Chem. Soc. 135, 4425–4437. DOI: 10.1021 / ja312387q
CrossRef Полный текст | Google Scholar
Россин А., Перуццини М. (2016). Аммиачно-борановое и аминоборановое дегидрирование с участием комплексных гидридов металлов. Chem. Ред. 116, 8848–8872. DOI: 10.1021 / acs.chemrev.6b00043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шрамм М., Томас Г., Товарт Р. и Франковяк Г. (1983). Новые дигидропиридины с положительным инотропным действием за счет активации каналов Ca 2+ . Природа 303, 535–537. DOI: 10.1038 / 303535a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Швам, Р. Дж., Дэй, Б. М., Мэнсфилд, Н. Э., Ноелден, В., Хичкок, П. Б., и Коулз, М.П. (2014). Каталитические реакции образования связи, которым способствуют амидинатные, гуанидинатные и фосфагуанидинатные соединения магния. Dalton Trans. 43, 14302–14314. DOI: 10.1039 / C4DT01097C
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стивенс П. Дж., Девлин Ф. Дж., Чабаловски К. Ф. и Фриш М. Дж. (1994). Ab initio расчет спектров колебательного поглощения и кругового дихроизма с использованием силовых полей функционала плотности. J. Phys.Chem. 98, 11623–11627. DOI: 10.1021 / j100096a001
CrossRef Полный текст | Google Scholar
Стаут, Д. М., и Мейерс, А. И. (1982). Последние достижения в химии дигидропиридинов. Chem. Ред. 82, 223–243. DOI: 10.1021 / cr00048a004
CrossRef Полный текст | Google Scholar
Уитман, К., Анкер, М. Д., Эроусмит, М., Хилл, М. С., Коциок-Кён, Г., Липтрот, Д. Дж. И др. (2016). Гидроборирование нитрила, катализируемое магнием. Chem.Sci. 7, 628–641. DOI: 10.1039 / C5SC03114A
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Син, Ю. Ю., Лю, Дж. Б., Шэн, Х. Х., Сунь, К. З., Хуанг, Ф., и Чен, Д. З. (2017). Растворитель, опосредующий переключение в механизме катализируемых родием (III) реакций карбоаминирования / циклопропанирования между N-еноксифталимидами и алкенами. Inorg. Chem. 56, 5392–5401. DOI: 10.1021 / acs.inorgchem.7b00450
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, Д.Д., Шан, К. Х., Бай, Р. П., и Лан, Ю. (2017b). Механизм гидроборирования карбодиимидов, катализируемого щелочноземельными металлами: теоретическое исследование. Подбородок. J. Org. Chem. 37, 1231–1236. DOI: 10.6023 / cjoc201701033
CrossRef Полный текст | Google Scholar
Xu, D. D., Shan, C.H., Li, Y. Z., Qi, X. T., Luo, X. L., Bai, R.P., et al. (2017a). Энергия диссоциации связи, контролируемая метатезисом σ-связи в катализируемом гидридом щелочноземельного металла дегидросцеплении аминов и боранов: теоретическое исследование. Inorg. Chem. Фронт. 4, 1813–1820. DOI: 10.1039 / C7QI00459A
CrossRef Полный текст | Google Scholar
Янг, Ю. Ф., Хоук, К. Н., и Ву, Ю. Д. (2016). Вычислительное исследование катализа Rh III / Rh V и Rh III / Rh I в катализируемых родием (III) реакциях активации C-H N-феноксиацетамидов с алкинами. J. Am. Chem. Soc. 138, 6861–6868. DOI: 10.1021 / jacs.6b03424
CrossRef Полный текст | Google Scholar
Ярошевский, А.А. (2006). Изобилие химических элементов в земной коре. Geochem. Int. 44, 48–55. DOI: 10.1134 / S0016702006X
CrossRef Полный текст | Google Scholar
Ю. З., Лан Ю. (2013). Механизм катализируемого родием разрыва связи углерод – кремний для синтеза производных бензосилола: компьютерное исследование. J. Org. Chem. 78, 11501–11507. DOI: 10.1021 / jo402070f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ю., З., Qi, X., Li, Y., Liu, S., and Lan, Y. (2016). Механизм, хемоселективность и энантиоселективность катализируемого родием десимметричного синтеза гидробензофуранов: теоретическое исследование. Org. Chem. Фронт. 3, 209–216. DOI: 10.1039 / C5QO00334B
CrossRef Полный текст | Google Scholar
Чжао, Ю., Нг, Х. Т., Певерати, Р., и Трухлар, Д. Г. (2012). База данных эталонных значений энергий диссоциации илидных связей и ее использование для оценки методов электронной структуры. J. Chem. Теория вычисл. 8, 2824–2834. DOI: 10.1021 / ct300457c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао Ю., Цзоу С. Л., Цзян Ю. Ю. и Би С. В. (2017). Теоретическое исследование инициируемого Cl атмосферным окислением метилизопропенилкетона. RSC Adv. 7, 52801–52811. DOI: 10.1039 / C7RA09445K
CrossRef Полный текст | Google Scholar
Zhu, L.
