ХиМиК.ru — ЩЕЛОЧНЫЕ МЕТАЛЛЫ — Химическая энциклопедия
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
ЩЕЛОЧНЫЕ МЕТАЛЛЫ:литий
Li, натрий Na, калий К, рубидий Rb, цезий Cs,
франций Fr. Щелочные металлы, кроме Cs, имеют серебристый металлич. блеск, Cs —
золотисто-желтую окраску. Все щелочные металлы очень мягки, легко режутся (кроме Li), Rb,
Cs и Fr при обычной т-ре почти пастообразны. наиб. твердый из них Li мягче талька
(твердость талька принята за единицу по шкале Мооса). Щелочные металлы кристаллизуются
в кубич. объемноцентрир. решетке с пространств, группой IтЗт,
z = 2. Т-ры плавления щелочных металлов уменьшаются от Li к Cs: 180,54 °С (Li), 97,86 °С
(Na), 63,51 °С (К), 39,32 °С (Rb), 28,44 °С (Cs). Щелочные металлы очень легкие, самый
легкий среди всех известных металлов — Li, он плавает в керосине, a Na и К легче
воды.
Щелочные металлы очень легкие, самый
легкий среди всех известных металлов — Li, он плавает в керосине, a Na и К легче
воды.
Характерное св-во атомов щелочных металлов — легкость
возбуждения у них светового излучения. Оптич. спектры щелочных металлов просты и содержат
очень яркие линии (нм): 610,36 и 670,78 (Li), 589,59 и 588,99 (Na), 766,49
(К), 794,76 и 780,02 (Rb), 894,5 и 852,11 (Cs).
На воздухе все щелочные металлы быстро покрываются темно-серым налетом, состоящим из оксидов, только у Li появляется зеленовато-черная пленка нитрида Li3N. Склонность к окислению на воздухе возрастает от Li к Fr, причем Rb, Cs и Fr окисляются уже с воспламенением. Поэтому щелочные металлы хранят под слоем обезвоженного парафинового или вазелинового масла. С водой щелочные металлы реагируют бурно с образованием щелочей (откуда название) и выделением Н2, при этом Rb и Cs взаимод. даже со льдом при -100 °С. С метанолом и этанолом щелочные металлы дают алкоголяты и Н
Кислород окисляет все щелочные металлы, но если Li превращается только в Li2O, то остальные щелочные металлы- в смеси, в основном М2О2 и МО2, при этом Rb и Cs вспыхивают.
 С N2 реагирует в обычных условиях только Li, превращающийся
в нитрид, для остальных щелочных металлов нитриды неизвестны. Щелочные металлы растворяются в
жидком аммиаке, некоторых алкиламинах и полиэфирах с образованием синих
растворов, обладающих электронной проводимостью (см.
Сольватированный
электрон). При хранении синие аммиачные растворы обесцвечиваются в
результате медленно протекающей реакции: 2M + 2NH32MNH2
+ Н2. Растворы щелочных металлов в жидком аммиаке взаимодействуют с ацетиленом
с образованием ацетиленидов М 2С2. При нагревании
К, Rb и Cs с графитом получают С8МХ, С24МХ,
С36МХ и другие нестехиометрические соединения
в виде медно-красных порошков, самовоспламеняющихся на воздухе и разлагающихся
водой с выделением Н2. Щелочные металлы энергично взаимод. с галогенами
с образованием галогенидов.
С N2 реагирует в обычных условиях только Li, превращающийся
в нитрид, для остальных щелочных металлов нитриды неизвестны. Щелочные металлы растворяются в
жидком аммиаке, некоторых алкиламинах и полиэфирах с образованием синих
растворов, обладающих электронной проводимостью (см.
Сольватированный
электрон). При хранении синие аммиачные растворы обесцвечиваются в
результате медленно протекающей реакции: 2M + 2NH32MNH2
+ Н2. Растворы щелочных металлов в жидком аммиаке взаимодействуют с ацетиленом
с образованием ацетиленидов М 2С2. При нагревании
К, Rb и Cs с графитом получают С8МХ, С24МХ,
С36МХ и другие нестехиометрические соединения
в виде медно-красных порошков, самовоспламеняющихся на воздухе и разлагающихся
водой с выделением Н2. Щелочные металлы энергично взаимод. с галогенами
с образованием галогенидов. При нагревании с S щелочные металлы дают сульфиды, с Н2
— гидриды, с Р -фосфиды. Большинство солей щелочных металлов хорошо растворимо в воде,
малорастворимы — фторид, фосфат и карбонат лития, а также МСlO4,
MMnO4, MReO4, где М = Rb и Cs.
При нагревании с S щелочные металлы дают сульфиды, с Н2
— гидриды, с Р -фосфиды. Большинство солей щелочных металлов хорошо растворимо в воде,
малорастворимы — фторид, фосфат и карбонат лития, а также МСlO4,
MMnO4, MReO4, где М = Rb и Cs.Основной метод получения щелочных металлов — термическое восстановление хлоридов и бромидов магнием, кальцием, кремнием и другими восстановителями в вакууме при 600-800 °С. Выделенные металлы очищают от примесей ректификацией или вакуумной дистилляцией.
Лит.: Плющев В.Е., Степин Б. Д., Химия и технология лития, рубидия и цезия, М., 1970; Натрий, М., 1986; Степин Б.Д., Цветков А. А., Неорганическая химия, М., 1994.
Б. Д. Степин.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Еще по теме:
- Щелочные металлы — Неорганическая химия, Б.
 В.Некрасов
В.Некрасов
Щелочные металлы — Знаешь как
Щелочные металлы это металлы представляют собой группу или столбец, содержащий химические элементы, такие как литий (Li), натрий (Na), рубидий (Rb), калий (K), франций (Fr) и цезий (Cs).
Эта группа находится в s-блоке периодической таблицы, поскольку все щелочные металлы имеют свой периферийный электрон на s-орбитали/
Эта общая электронная конфигурация приводит к принципиально чрезвычайно схожим характеристическим особенностям.
Содержание статьи
- 1 Что такое щелочные металлы
- 1.1 Спектр преломления
- 1.2 Унуненний Ununennium
- 2 Физические свойства щелочных металлов
- 2.1 Плотность щелочных металлов
- 2.2 Ядерные свойства щелочных металлов
- 2.3 Атомный и ионный радиусы
- 2.4 Энергия первой ионизации
- 2.5 Реакционная способность щелочных металлов
- 2.6 Электроотрицательность
- 2.7 Точки плавления и кипения
- 2.
 8 Физические свойства франция
8 Физические свойства франция
- 3 Химические свойства щелочных металлов
- 3.1 Химические свойства лития
- 4 Распространение в природе и получение
- 5 Соединения щелочных металлов
К этой группе относятся литий , натрий , калий , рубидий , цезий , франций . Щелочные металлы имеют на внешнем электронном уровне атома по одному электрону ( s¹ ) , сильно удалённому от ядра , отличаются низкими потенциалами ионизации.
Щелочные металлы, как правило, являются блестящими, мягкими и очень активными металлами при стандартной температуре и давлении и быстро теряют свой самый дальний электрон, образуя катионы с зарядом +1.
Все они могут быть эффективно разрезаны лезвием из-за их мягкой структуры, открывая блестящую поверхность, которая быстро обесцвечивается на воздухе из-за окисления атмосферной влажностью и кислородом (и за счет лития, азота).
Из-за их высокой реакционной способности их следует помещать под масло, чтобы избежать реакции с воздухом, и обычно они содержатся только в щелочах, а не в качестве свободных компонентов.
Цезий, пятый щелочной металл, является наиболее реакционноспособным из значительного числа металлов.
В классификации IUPAC щелочные металлы включают элемент группы 1, за исключением водорода (H), который якобы является компонентом группы 1, однако регулярно не рассматривается как щелочной металл, поскольку он редко демонстрирует поведение, идентичное поведению щелочных металлов.
Все щелочные металлы вступают в реакцию с водой, причем более тяжелые щелочные металлы реагируют более интенсивно, чем более легкие.
Спектр преломленияБольшинство щелочных металлов имеют широкий спектр применения. Одним из наиболее известных применений чистых компонентов является использование рубидия и цезия в ядерных таймерах, из которых ядерные тикеры цезия являются наиболее точным и точным отображением времени.
Типичным использованием соединений натрия является натриевая лампа, которая излучает свет со всей эффективностью. Поваренная соль, или хлорид натрия, использовалась с давних времен.
Натрий и калий также являются основными компонентами, выполняющими основную естественную работу в качестве электролитов, и, несмотря на то, что другие щелочные металлы не являются основными, они также влияют на организм, как полезные, так и вредные.
Атомы их легко отдают электрон , проявляя степень окисления + 1 . Это самые активные металлы , восстановительные свойства выражены у них особенно резко и усиливается с увеличением порядкового номера элемента .
Унуненний UnunenniumИспытания были направлены на то, чтобы попытаться объединить Ununennium (Использование), который, вероятно, станет следующим человеком из группы, однако все они потерпели неудачу.
В любом случае, Ununennium может не быть щелочным металлом из-за релятивистских воздействий, которые, как ожидается, повлияют на свойства соединений сверхтяжелых компонентов.
Независимо от того, окажется ли он щелочным металлом, ожидается, что он будет иметь несколько отличий в физических и синтетических свойствах от его более легких гомологов.
Щелочные металлы мягки , легко режутся ножом , на свежем срезе имеют серебристую окраску ( кроме цезия ) . Все они лёгкие и легкоплавкие металлы с хорошей электропроводностью .
Физические свойства щелочных металлов в целом изменяются линейно при переходе от лития к цезию , т.е с увеличением массы и радиуса атома.
Физические и химические свойства щелочных металлов можно быстро уточнить, установив для них валентные электроны ns1, что приводит к хрупкому удерживанию металла.
Отныне все щелочные металлы являются мягкими и имеют низкую плотность, точки плавления и пузырькования, а также температуры сублимации, испарения и диссоциации.
Все они затвердевают в кубической структуре драгоценного камня, ориентированной на тело, и имеют особые огненные оттенки на том основании, что их внешний электрон всесторонне эффективно возбуждается.
Установка ns1 также приводит к тому, что щелочные металлы имеют огромные ядерные и ионные радиусы, а также высокую теплопроводность и электропроводность.
Все щелочные металлы имеют одинаковую структуру (кубическую по центру тела), и в соответствии с этими линиями плотность-это масса общего числа атомов, которые могут поместиться в определенном объеме.
Основной фактор зависит от объема молекулы и, следовательно, ядерного диапазона, который увеличивается по группе; вдоль этих линий объем атома щелочного металла увеличивается по группе.
Масса атома щелочного металла также возрастает, снижаясь по группе. Таким образом, структура плотности щелочных металлов зависит от их ядерных нагрузок и радиусов ядер.
Если бы были известны значения этих двух факторов, то можно было бы определить пропорции между плотностями щелочных металлов.
Ядерные свойства щелочных металловВсе щелочные металлы имеют нечетные ядерные числа; таким образом, их изотопы должны быть либо нечетно– нечетными (числа протонов и нейтронов нечетные), либо нечетно-четными (число протонов нечетное, однако число нейтронов четное).
Нечетные– нечетные ядра имеют четные массовые числа, в то время как нечетные-четные ядра имеют нечетные массовые числа.
Нечетные– нечетные первичные нуклиды редки в свете того факта, что большинство нечетных ядер чрезвычайно нестабильны при бета– распаде, на том основании, что элементы распада четные-четные, и, следовательно, все более четко связаны из-за воздействия атомного смешения.
Атомный и ионный радиусыЯдерные радиусы щелочных металлов повышаются, снижаясь по группе. Из-за защитного воздействия, когда частица имеет более одной электронной оболочки, каждый электрон испытывает электрическое отвращение от альтернативных электронов так же, как электрическое притяжение от ядра.
В щелочных металлах периферийный электрон просто ощущает чистый заряд +1, поскольку часть атомного заряда (что эквивалентно атомному номеру) отбрасывается внутренними электронами; количество внутренних электронов щелочного металла постоянно на единицу меньше, чем атомный заряд.
Таким образом, первым фактором, влияющим на ядерный диапазон щелочных металлов, является количество электронных оболочек. Поскольку это число увеличивается в группе, ядерный радиус действия также должен уменьшаться в группе.
| Щелочной металл | Структура электронов | Всего Электронов |
| литий (Li) | 2,1 | 3 |
| натрий (Na) | 2,8,1 | 11 |
| калий (К) | 2,8,8,1 | 19 |
| рубидий (Rb) | 2,8,8,8,8,3 | 37 |
| цезий (Cs) | 2,8,8,8,8,8,8,5 | 55 |
| франция (Фр) | 2,8,8,8,8,8,8,8,8,8,8,5 | 87 |
Первая энергия ионизации компонента или частицы-это энергия, необходимая для перемещения наиболее свободно удерживаемого электрона от одного моля парообразных атомов компонента или атомов, чтобы сформировать один моль парообразных частиц с электрическим зарядом +1.
Факторами, влияющими на первичную энергию ионизации, являются атомный заряд, мера защиты внутренними электронами и отделение от наиболее свободно удерживаемого электрона от ядра, которое, несомненно, является внешним электроном в компонентах фундаментальной группы.
Исходные два компонента изменяют жизнеспособный атомный заряд, который ощущает наиболее свободно удерживаемый электрон.
Поскольку периферийный электрон щелочных металлов надежно ощущает эквивалентный вынуждающий атомный заряд (+1), первым фактором, влияющим на основную энергию ионизации, является отделение от самого дальнего электрона до ядра.
Поскольку это разделение поднимается по группе, самый дальний электрон чувствует меньшее притяжение к ядру, и по этим линиям энергия первичной ионизации уменьшается.
Реакционная способность щелочных металловРеакционная способность щелочных металлов повышается по мере снижения группы. Это является следствием сочетания двух факторов: первой энергии ионизации и энергии распыления щелочных металлов.
Поскольку первая энергия ионизации щелочных металлов уменьшается по сравнению с группой, менее требовательно, чтобы периферийный электрон удалялся из атома и участвовал в химических реакциях, следовательно, реакционная способность группы повышалась.
ЭлектроотрицательностьЭлектроотрицательность это химическое свойство, которое отражает тенденцию атома притягивать электроны (или электронную толщину) к себе.
Если бы связь между натрием и хлором в хлориде натрия была ковалентной, пара общих электронов была бы втянута в хлор на том основании, что жизнеспособный атомный заряд внешних электронов составляет +7 в хлоре, но составляет всего +1 в натрии.
Точки плавления и кипенияТемпература плавления вещества это когда оно меняет свое состояние с твердого на жидкое, в то время как температура кипения вещества (в жидком состоянии) — это когда давление пара жидкости равно атмосферному давлению, охватывающему жидкость, и вся жидкость меняет состояние на газ.
Когда металл нагревается до температуры плавления, металлические связи, удерживающие атомы, ослабевают, чтобы молекулы могли перемещаться, и металлические связи в долгосрочной перспективе полностью разрушаются при температуре кипения металла.
Таким образом, падение, температура плавления и кипения щелочных металлов показывают, что качество металлических обязательств щелочных металлов снижается по группе.
Это объясняется тем, что частицы металла удерживаются вместе электромагнитной силой от положительных частиц к делокализованным электронам.
Физические свойства францияОжидается, что франций также продемонстрирует несколько контрастов из-за своего высокого ядерного веса, что позволит его электронам перемещаться со значительной скоростью света и, следовательно, сделает релятивистские воздействия все более заметными.
В отличие от модели уменьшения электроотрицательности и энергий ионизации щелочных металлов, ожидается, что электроотрицательность и энергия ионизации франция будут выше, чем у цезия, из-за релятивистской регулировки электронов 7s; аналогичным образом, считается, что его ядерный размах странно низок.
Следовательно, вопреки ожиданиям, цезий является наиболее восприимчивым из щелочных металлов, а не франций.
Ожидается, что франций также продемонстрирует несколько контрастов из-за своего высокого ядерного веса, что позволит его электронам перемещаться со значительной скоростью света и, следовательно, сделает релятивистские воздействия все более заметными.
В отличие от модели уменьшения электроотрицательности и энергий ионизации щелочных металлов, ожидается, что электроотрицательность и энергия ионизации франция будут выше, чем у цезия, из-за релятивистской регулировки электронов 7s; аналогичным образом.
Считается, что его ядерный размах странно низок. Следовательно, вопреки ожиданиям, цезий является наиболее восприимчивым из щелочных металлов, а не франций.
Химические свойства щелочных металловИх химия перегружена потерей их одиночного валентного электрона на периферийной s-орбитали для получения состояния окисления +1 из-за простоты ионизации этого электрона и высокой энергии второй ионизации.
Большая часть химии наблюдалась только у первых пяти человек из группы. Химия франция не изучена из-за его очень высокого уровня радиоактивности; соответственно, введение его свойств здесь ограничено.
То немногое, что думают о франции, свидетельствует о том, что она исключительно близка по проводимости к цезию, что неудивительно?
Физические свойства франция гораздо более схематичны в свете того факта, что массовая составляющая никогда не наблюдалась; впоследствии любая информация, которую можно найти в тексте, несомненно, является теоретической экстраполяцией.
Они весьма активны в химическом отношении . Восстановительная активность их быстро растёт при переходе от лития к францию вместе с увеличением ионизации потенциалов.
Кислород воздуха ( при обычной температуре ) окисляет по схеме :
4Э + O2 = 2Э2O
Поэтому хранят их под слоем жидких углеводородов ( керосина , бензола ) . Наиболее активные из них — рубидий и цезий — самовоспламеняются на воздухе , остальные загораются при небольшом нагревании .
Однако сгорании щелочных металлов только литий образует нормальный оксид Li2O , натрий образует пероксид Na2O2 , а калий , рубидий и цезий — супероксиды состава Э2O4 .
Другие элементарные окислители ( галогены , сера , фосфор ) также довольно легко окисляют щелочные металлы до галогенов , сульфидов , фосфатов ; все реакции протекают с выделением теплоты.
С азотом при обычной температуре взаимодействует только литий и получается нитрит Li3N . Нагревая щелочные металлы в струе газообразного водорода , получают гидриды :
2Э + H2 = 2ЭH
Причём атомы водорода восстанавливаются до отрицательно заряженных ионов Н⁻.
Имея большое отрицательное значение стандартных электродных потенциалов , щелочные металлы окисляются даже молекулами воды с образованием гидроксидов и выделением свободного водорода :
2Э + 2Н2О = 2ЭОН + Н2↑
Эти реакции экзотермичны , в следствие чего водород и металл обычно воспламеняются .
Химия лития демонстрирует некоторые отличия от химии того, что осталось от группы. Литий и магний имеют диагональные отношения из-за их сопоставимых ядерных радиусов с целью продемонстрировать несколько сходств.
Например, литий образует устойчивый нитрид, свойство, обычное среди всех растворимых редкоземельных металлов (группа магния), однако исключительное среди щелочных металлов.
Кроме того, среди их конкретных групп только литий и магний структурируют металлоорганические соединения с критическим ковалентным характером (например, известь и MgMe2).
Фторид лития-первый галогенид щелочного металла, который неадекватно растворяется в воде, а гидроксид лития-первый гидроксид щелочного металла, который не растворяется.
И наоборот, перхлорат лития и другие щелочи лития с огромными анионами, которые не могут быть захвачены, значительно более устойчивы, чем соединения других щелочных металлов, предположительно в свете того факта, что Li+ обладает высокой энергией сольватации.
Это воздействие также подразумевает, что большинство простых литиевых щелочей обычно образуются в гидратированной структуре на том основании, что безводные структуры удивительно гигроскопичны.
Это позволяет использовать щелочи, такие как хлорид лития и бромид лития, в осушителях и системах принудительного воздуха.
Распространение в природе и получениеБольшинство всех обнаруженных щелочных металлов встречаются в природе в виде их соединений: по обилию наиболее часто встречается натрий, за ним следуют калий, литий, рубидий, цезий и, наконец, франций.
Что необычно из-за его невероятно высокой радиоактивности; франций встречается лишь в мельчайших следах в природе как промежуточное звено в некоторых отдельных частях цепей естественного распада.
Природный натрий и цезий — моноизотопные элементы , у лития и рубидия по два изотопа в природной смеси , а у калия — три , из которых один радиоактивный.
Щелочные металлы легко окисляются , поэтому в природе могут находится только в виде соединений , главным образом : хлоридов , сульфатов , карбонатов , нитратов , горных пород силикатного типа .
Наиболее распространены натрий и калий , содержание каждого из них в литосфере составляет приблизительно 2,6 масс.% , тогда на долю остальных щелочных металлов вместе взятых приходится около 0,014 масс.%.
Щелочные металлы не восстанавливаются из природных соединений углём , оксидом углерода ( II ) и водородом.
Поэтому для получения их в свободном виде прибегают к электролизу расплавленных солей или гидроксидов.
Однако металлический калий получают не электролизом , а пропусканием через хлорид или гидроксид калия паров натрия при 800°C :
KCl + Na = K + NaCl
KOH + Na = K + NaOH
Рубидий и цезий восстанавливаются из хлоридов металлическим кальцием при 700 — 800°C , в вакууме :
Ca + 2RbCl = 2Rb + CaCl2
но цезий высокой чистоты получают в вакууме при 1000°C :
2CsCrO4 + 5Zr = 4Cs + 5ZrO + Cr2O3
Металлический литий восстанавливают из алюмината порошко-образным алюминием и так же в вакууме при 1200°C :
3(2Li2O · Al2O3) + 4Al = 12Li + 5Al2O3
Кроме того , литий получают электролизом расплавленного хлора.
Они образуют главным образом , соединения ионного типа . Их ионы Э на внешнем уровне имеют по 8 электронов ( кроме лития ) , не проявляют окислительных окислительных свойств в химической реакции , восстанавливаются только электролизом , не склонны к комплексообразованию ( кроме лития ) .
Гидриды щелочных металлов ЭН — солеобразные вещества , их ионы Н⁻ проявляют восстановительную активность в реакции с водой и другими оксидами :
ЭН + Н2О = H2↑+ ЭOH
Оксиды щелочных металлов ЭOH — твёрдые кристаллические вещества , сравнительно легкоплавки , хорошо растворяются в воде с выделением теплоты и почти полностью диссоциируют на ионы ; степень диссоциации их растёт от LiOH к CsOH .
Пероксиды ( перекиси ) типа Э2O2 известны для лития и натрия . Твёрдые , термически устойчивые вещества.
Рассматриваются как соли перекиси водорода , которая образуется при действии на них водой ( или кислотами ) :
Э2O2+ 2H2O =H2O2 + 2ЭOH
Супероксиды ( надперекиси ) типа Э2O4 известны для калия , рубидия и цезия. Под действием воды или кислот разлагаются с выделением перекиси водорода и кислорода :
Под действием воды или кислот разлагаются с выделением перекиси водорода и кислорода :
Э2O4 + 2HOH = H2O2 + O2↑+ 2ЭOH
Пероксиды и супероксиды щелочных металлов — сильные окислители , активно иногда со взрывом взаимодействуют с порошкообразным металлом , углём и фосфором , применяются для изготовления запалов .
Соли щелочных металлов ( кроме лития ) хорошо растворимы в воде , летучие соли лития окрашивают бесцветное пламя горелки в коричнево — красный цвет , натрия — в жёлтый , калия — в фиолетовый , что используется в химическом анализе и в пиротехнике .
Соли щелочных металлов и слабых кислот ( угольной , сероводородной и других ) гидролизуются , водные растворы их имеют щелочную реакцию ( pH > 7 ) .
Статья на тему Щелочные металлы
Какой самый легкий металл?
Эта запись была опубликована автором Anne Helmenstine (обновлено )
Литий — самый легкий металл в мире. Здесь он хранится в аргоне, потому что он вступает в реакцию с воздухом. (фото: 2×910)
Назовите самый легкий металл? Большинство металлов тяжелые или плотные, но некоторые металлы могут плавать на воде, а другие почти такие же легкие, как воздух. Узнайте о самом легком элементарном металле и самом легком сплаве.
Самый легкий металл, являющийся элементом
Когда мы говорим о легкости материала, на самом деле мы обсуждаем плотность. Плотность – это количество вещества в единице объема. Чем меньше вещества в пространстве, тем оно легче. Таким образом, самый легкий металлический элемент имеет наименьшую плотность. Самым легким или наименее плотным элементом, который является металлом, является литий. Литий имеет атомный номер 3 в периодической таблице с плотностью 0,534 г/см 3 . Это сравнимо с плотностью древесины сосны. Плотность воды около 1 г/см 3 , значит, литий плавает в воде. Но, как и другие щелочные металлы, литий очень реакционноспособен, поэтому он быстро вступает в реакцию с выделением тепла и образованием гидроксида лития и газообразного водорода. Он также горит на воздухе, поэтому чистый металл хранится под маслом (где он тоже плавает) или в инертной атмосфере.
Он также горит на воздухе, поэтому чистый металл хранится под маслом (где он тоже плавает) или в инертной атмосфере.
В обычных условиях только два других металлических элемента достаточно легкие, чтобы плавать на поверхности воды: калий и натрий. Плотность калия 0,862 г/см 3 , а плотность натрия 0,971 г/см 3 . Литий, калий и натрий — все это щелочные металлы. Причина, по которой они такие легкие, заключается в том, что эти элементы являются первыми атомами в своем периоде в периодической таблице, которые получили дополнительную электронную оболочку. Оболочка делает атомы большими для их массы.
А водород? Он относится к группе щелочных металлов и даже легче лития. Обычно водород ведет себя как неметаллический газ. Однако при определенных условиях водород образует твердый металл с плотностью 0,0763 г/см 3 . Это был бы самый легкий металл, если бы он существовал в природе на Земле!
Легчайший металлический сплав
Металлическая микрорешетка настолько легкая, что головка одуванчика может выдержать ее, не раздавив. (Дэн Литтл, HRL Laboratories)
(Дэн Литтл, HRL Laboratories)Самый легкий металл на Земле — это сплав, а не элемент. Это решетка из никель-фосфорных трубок (микрорешетка), изобретенная исследователями Калифорнийского университета в Ирвине. Плотность микрорешетки 0,0009 г/см 3 или 9 мг/см 3 . При удалении воздуха истинная плотность металлоконструкции составляет всего 2,1 мг/см 3 . Он в сто раз легче пенополистирола и примерно в 1,76 раза тяжелее воздуха при температуре 25 °C. Кусочек сплава может лежать на одуванчике, не сгибая его.
Кусок никель-фосфорного сплава имеет плотность 9,0 г/см 3 . Причина того, что решетка такая легкая, заключается в том, что она состоит из полых трубок в решетке, которая на 99,99% состоит из воздуха и только на 0,01% из металла. Исследователи покрыли шаблон сплавом, а затем вытравили шаблон, оставив полые трубки толщиной всего около 100 нанометров (в тысячу раз тоньше человеческого волоса). Микрорешетки демонстрируют огромные перспективы в качестве теплоизоляторов, звукоизоляторов и виброгасителей.
Ссылки
- Brandes, E.A.; Брук, Г.Б. (редакторы) (1998). Справочник по легким металлам . Баттерворт Хайнеманн. Оксфорд. ISBN 0-7506-3625-4.
- Лиде, Д. Р., изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- Полмер, И. (2006). Легкие сплавы: от традиционных сплавов до нанокристаллов (4-е изд.). Баттерворт Хайнеманн. Оксфорд. ISBN 0-7506-6371-5.
- Шедлер, Т. А.; Якобсен, AJ; Торрентс, А .; Соренсен, А.Е.; Лиан, Дж.; Грир, Дж. Р.; Вальдевит, Л.; Картер, WB (12 октября 2011 г.). «Сверхлегкие металлические микрорешетки». Наука . 334 (6058): 962–5. doi:10.1126/science.1211649
Завершение семейства: LiCN3h5, самый легкий гуанидинат щелочного металла
Питер Клаус
Савинского, и Волкер Л.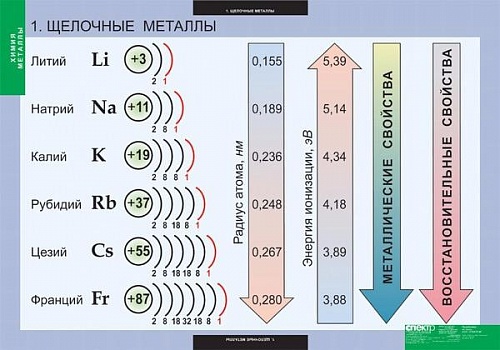 Дерингер и а также
Ричард
Дронсковски* аб
Дерингер и а также
Ричард
Дронсковски* аб
Принадлежности автора
* Соответствующие авторы
и Институт неорганической химии, RWTH Aachen University, Landoltweg 1, 52056 Aachen, Germany
б Юлихско-Аахенский исследовательский альянс (JARA-HPC), 52056 Аахен, Германия
Электронная почта: drons@HAL9000. ac.rwth-aachen.de
ac.rwth-aachen.de
Факс: +49 241 8092642
Аннотация
Недавно сообщалось о семействе гуанидинатов щелочных металлов (M = Na-Cs), представляющих собой полностью азотные аналоги щелочных бикарбонатов и содержащие неуловимый моноанион гуанидината CN


 В.Некрасов
В.Некрасов 8 Физические свойства франция
8 Физические свойства франция