5 самых легких металлов в мире
В нашей сегодняшней статье мы расскажем читателям о самых легких металлах в мире, сплавах на их основе, и о том, какие возможности открывает человеку их применение.
Представьте себе картину: на покрытый пухом одуванчик положен кусочек металлической сетки, при этом воздушное «оперение» цветка даже не деформируется. Это не выдумка и не фантастика, это научная разработка Калифорнийского университета – сверхлегкий сплав под названием микролаттис. Этот материал обладает уникальной для своего веса прочностью. Все дело в особой конструкции. Микролаттис представляет собой сплетение полых трубочек, толщина которых не превышает тысячной доли человеческого волоса. Каждая из этих трубочек – это фосфорно-никелевый сплав, нанесенный на полимерную основу. То есть по сути микролаттис в прямом смысле соткан из воздуха. Благодаря своей легкости и прочности он может применяться в качестве тепло- и звукоизоляционного материала, в роли наполнителя для ударозащитных деталей в автомобиле- и авиастроении.
Самые легкие металлы в мире
Лёгкими называют металлы, которые обладают небольшой плотностью. Это отнюдь не редкое явление. Вещества с такими характеристиками составляют примерно 20 % от массы земной коры. Они активно добываются и широко применяются в промышленности.
Самым лёгким металлом является литий. Кроме наименьшей атомной массы, он обладает и наименьшей плотностью, которая в два раза ниже, чем у воды. После лития идут калий, натрий, алюминий, рубидий, цезий, стронций и т. д. В их число входит и титан, который обладает самой высокой прочностью среди металлов.
Легкостью и прочностью обладает также алюминий. В земной коре он третий по распространённости. Пока люди не научились получать его промышленным путём, металл был дороже золота. Сейчас килограмм алюминия можно купить примерно за 2 доллара. Его применяют как в ракетной технике и военной промышленности, так и для изготовления пищевой фольги и кухонных предметов.
Сферы применения
Легкие металлические конструкции широко применяются во многих проектах по причине минимально затраченного времени на их возведение, а также с экономической точки зрения.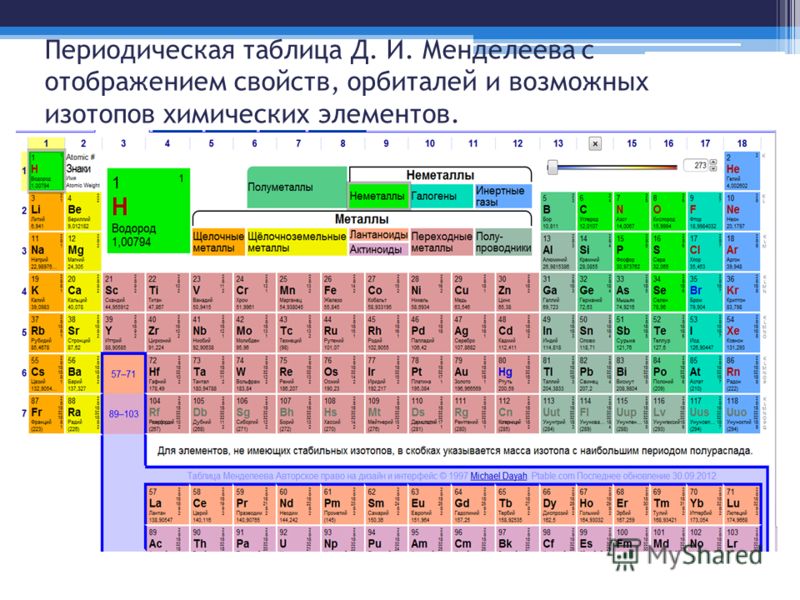 Особенно они востребованы при строительстве:
Особенно они востребованы при строительстве:
- сельскохозяйственных объектов;
- складских сооружений;
- торгово-промышленных зданий;
- помещений офисного типа;
- развлекательных комплексов;
- спортивных стадионов, арен;
- автосервисов, автосалонов;
- холодильного оборудования, цехов;
- ангаров для стоянки самолетов, военной техники;
- медицинских пунктов и лабораторий.
На изготовление и последующий монтаж ЛМК уходит от одного месяца до четырех.
Литий
Литий находится в первой группе периодической таблицы элементов. Он стоит под номером 3, после водорода и гелия, и обладает самой маленькой атомной массой среди всех металлов. Простое вещество – литий, при нормальных условиях имеет серебристо-белый цвет.
Это самый лёгкий щелочной металл с плотностью 0,534 г/см³. Из-за этого он всплывает не только в воде, но и в керосине. Для его хранения обычно используют парафин, газолин, минеральные масла или петролейный эфир. Литий очень мягкий и пластичный, легко режется ножом. Чтобы расплавить этот металл, его нужно нагреть до температуры 180,54 °C. Закипит он только при 1340 °C.
Литий очень мягкий и пластичный, легко режется ножом. Чтобы расплавить этот металл, его нужно нагреть до температуры 180,54 °C. Закипит он только при 1340 °C.
В природе существует только два стабильных изотопа металла: Литий-6 и Литий-7. Кроме них, есть 7 искусственных изотопа и 2 ядерных изомера. Литий является промежуточным продуктом в реакции превращения водорода в гелий, участвуя, таким образом, в процессе образования звёздной энергии.
Реакции с литием
Учитывая его щелочную природу, можно предположить, что он очень активен. Однако металл является самым спокойным представителем своей группы. При нормальной комнатной температуре литий слабо реагирует с кислородом и многими другими веществами. Свой «бурный нрав» он проявляет после нагревания, тогда он вступает в реакцию с кислотами, различными газами и основаниями.
В отличие от других щелочных металлов с водой он реагирует мягко, образуя гидроксид и водород. С сухим воздухом реакции практически нет. Но если он влажный, то литий медленно реагирует с его газами, образуя нитрид, карбонат и гидроксид.
При определённых температурах самый легкий металл активен с аммиаком, этиловым спиртом, галогенами, водородом, углеродом, кремнием, серой.
Литий — не предел легкости металлов
Совсем недавно научный отдел Калифорнийского университета во главе с лабораторией HRL изобрел новый твердый и сверхлегкий металл, который получил название микролаттис. Очень легкая структура нового металла, чья металлическая решетка схожа с обычной губкой, оказалась в сотни раз более легкой, нежели пенопласт. Хотя на вид новое открытие кажется совсем хрупким, но присмотревшись к нему, можно заметить необыкновенное свойство металла выдерживать просто нереальные нагрузки в соответствии с его индексом массы.
Небольшой кусочек металла микролаттиса можно положить на верхушку одуванчика, и он даже не повредит его шапку.
Сплавы лития
Свойства лития повышают отдельные качества металлов, из-за чего его часто используют в сплавах. Полезной является его реакция с окислами, водородом, сульфидами. 3 и отличается наличием парамагнитных свойств, правда, слабых.
3 и отличается наличием парамагнитных свойств, правда, слабых.
Хорошо проводит тепло и электричество, не поддается коррозионному воздействию, зато подвержен механическому, в том числе легко подвергается сгибанию. Сплавы на основе этого легкого металла характеризуются пластичностью, удовлетворительной прочностью и не поддаются коррозии, а также хорошо свариваются.
Алюминий, фото: https://ru.wikipedia.org/
По распространенности в мире алюминий стоит на первом месте среди металлов и на третьем среди химэлементов периодической таблицы, уступая только кислороду и кремнию. Добыча его ведется более чем в 15 странах, лидеры среди которых — Китай, Россия и Канада. Мировые запасы этого элемента в разы превышают текущую потребность в его применении.
Сфера использования алюминия и сплавов на основе этого материала обширна. Это и черная металлургия, и пиротехника, использовался даже для изготовления ювелирных украшений в тот период, когда представлял исключительную ценность из-за неотработанного техпроцесса. В Японии он применяется в таком качестве до сих пор, заменяя иногда серебро в украшениях.
В Японии он применяется в таком качестве до сих пор, заменяя иногда серебро в украшениях.
О посуде и столовых приборах из этого гибкого металла знают все, а вот в качестве конструкционных материалов используют преимущественно алюминиевые сплавы, обладающие требуемыми характеристиками в плане прочности. Также алюминий добавляют в «автоматные стали» для облегчения обработки — благодаря ему достигается четкое открепление от прута детали после завершения обработки.
Нахождение в природе и значение
Самый легкий металл имеет около 30 собственных минералов, но только 5 из них используются в промышленности: пенталит, амблигонит, лепидолит, циннвальдит и сподумен. Кроме того, находится он в солёных озёрах. Всего в земной коре содержится 0,005 % этого металла.
Большие промышленные запасы лития находятся на всех континентах. Его добывают в Бразилии, Австралии, ЮАР, Канаде, США и других странах. После чего применяют его в электронике, металлургии, лазерных материалах, ядерной энергетике и даже медицине. 3 отличается впечатляющей прочностью.
3 отличается впечатляющей прочностью.
Также среди свойств металла, получившего статус самого твердого из используемых, выделяют отличную антикоррозионную устойчивость. Это справедливо и для сплавов, получаемых на основе титана, причем собственные прочностные характеристики последние сохраняют даже при температурах в 300 °C, что делает их незаменимыми в текущий период времени в авиации и ракетостроении.
Титан, фото https://mining-prom.ru/
Получивший название в честь титанов из древнегреческой мифологии металл входит в десятку самых распространенных в природе элементов, месторождения которого открыты на всех континентах, исключая Антарктиду. Причем Россия занимает по концентрации руд с содержанием рассматриваемого элемента второе место в мире после КНР.
Помимо уже упомянутых отраслей, титановые сплавы востребованы в кораблестроении, химической, автомобильной и оборонной промышленности, а также на пищевом производстве и в сельском хозяйстве. Благодаря собственной инертности титан без проблем способен контактировать с тканями живых организмов, не вызывая опасных для здоровья химических реакций, а потому активно используется в медицине, начиная с протезирования и изготовления имплантатов и заканчивая созданием хирургических инструментов.
Токсичность
Несмотря на важную биологическую роль лития в нашем организме, он может быть опасным. Самый легкий металл достаточно токсичен и способен вызывать отравления. При горении он провоцирует раздражение и отёки слизистых оболочек. Если на них попадет кусочек целого металла, произойдёт то же самое.
Литий нельзя брать в руки без перчаток. Взаимодействуя с влагой в воздухе или влагой на коже, он легко вызывает ожог. С расплавленным металлом нужно быть ещё осторожнее, так как его активность повышается в разы. При работе с ним нужно помнить, что это щелочь. Уменьшить его действие на кожу можно обычным уксусом.
В организме литий повышает устойчивость иммунной системы и улучшает работу нервной системы. Но его переизбыток сопровождается головокружением, сонливостью, потерей аппетита. Отравление металлом приводит к снижению либидо, слабости в мышцах, набору веса. При этом может ухудшиться зрение, память и наступить кома. Работать с литием нужно всегда в перчатках, защитном костюме и очках.
Легче легкого
Микролаттис – самый легкий металл, полученный искусственно. Он состоит из воздуха на 99,99 % и намного легче пенопласта. Металл создали ученые Калифорнийского университета, в 2021 году он был признан официально и был занесен в Книгу рекордов.
Секрет необычной легкости заключается в его структуре, напоминающую кости живых организмов. Металл представляет собой ячейки, которые сделаны из никелево-фосфорных трубок. Они пустые внутри, а их толщина в несколько раз уступает человеческому волосу.
Несмотря на легкость, микролаттис способен выдерживать большие нагрузки не хуже естественных металлов. Подобные свойства могут иметь широкое применение, одно из них — это создание искусственных легких.
Что такое алюминий
Лёгкий, прочный, стойкий к коррозии и функциональный – именно это сочетание качеств сделало алюминий главным конструкционным материалом нашего времени. Алюминий есть в домах, в которых мы живем, автомобилях, поездах и самолетах, на которых мы преодолеваем расстояния, в мобильных телефонах и компьютерах, на полках холодильников и в современных интерьерах. А ведь еще 200 лет назад об этом металле мало что было известно.
А ведь еще 200 лет назад об этом металле мало что было известно.
Рубины, сапфиры, изумруды и аквамарин являются минералами алюминия.
Первые два относятся к корундам – это оксид алюминия (Al2O3) в кристаллической форме. Он обладает природной прозрачностью, а по прочности уступает только алмазам. Пуленепробиваемые стекла, иллюминаторы в самолетах, экраны смартфонов производятся именно с применением сапфира.
А один из менее ценных минералов корунда – наждак используется как абразивный материал, в том числе для создания наждачной бумаги.
На сегодняшний день известно почти 300 различных соединений и минералов алюминия – от полевого шпата, являющегося основным породообразующим минералом на Земле, до рубина, сапфира или изумруда, уже не столь распространенных.
Ханс Кристиан Эрстед (1777–1851) – датский физик, почетный член Петербургской академии наук (1830). Родился в городе Рудкёрбинге в семье аптекаря. В 1797 году окончил Копенгагенский университет, в 1806 – стал профессором.
Но каким бы распространенным ни был алюминий, его открытие стало возможным только, когда в распоряжении ученых появился новый инструмент, позволяющий расщеплять сложные вещества на простые, – электрический ток.
И в 1824 году с помощью процесса электролиза датский физик Ханс Кристиан Эрстед получил алюминий. Он был загрязнен примесями калия и ртути, задействованных в химических реакциях, однако это был первый случай получения алюминия.
Используя электролиз, алюминий производят и в наши дни.
Сырьем для производства алюминия сегодня служит еще одна распространенная в природе алюминиевая руда – бокситы. Это глинистая горная порода, состоящая из разнообразных модификаций гидроксида алюминия с примесью оксидов железа, кремния, титана, серы, галлия, хрома, ванадия, карбонатных солей кальция, железа и магния – чуть ли не половины таблицы Менделеева. В среднем из 4-5 тонн бокситов производится 1 тонна алюминия.
Бокситы в 1821 году открыл геолог Пьер Бертье на юге Франции. Порода получила свое название в честь местности Ле-Бо (Les Baux), где была найдена. Около 90% мировых запасов бокситов сосредоточено в странах тропического и субтропического поясов – в Гвинее, Австралии, Вьетнаме, Бразилии, Индии и на Ямайке.
Из бокситов получают глинозем. Это оксид алюминия Al2O3, который имеет форму белого порошка и из которого путем электролиза на алюминиевых заводах производят металл.
Производство алюминия требует огромного количества электроэнергии. Для производства одной тонны металла необходимо около 15 МВт*ч энергии – столько потребляет 100-квартирный дом в течение целого месяца.Поэтому разумнее всего строить алюминиевые заводы поблизости от мощных и возобновляемых источников энергии. Самое оптимальное решение – гидроэлектростанции, представляющие самый мощный из всех видов «зеленой энергетики».
Свойства алюминия
Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами.
В три раза легче железа
Сравним по прочности со сталью
Поддается всем видам механической обработки
Тонкая оксидная пленка защищает от коррозии
Алюминий легко обрабатывается давлением, причем как в горячем, так и в холодном состоянии. Он поддается прокатке, волочению, штамповке. Алюминий не горит, не требует специальной окраски и не токсичен в отличие от пластика.
Очень высока ковкость алюминия: из него можно изготовить листы толщиной всего 4 микрона и тончайшую проволоку.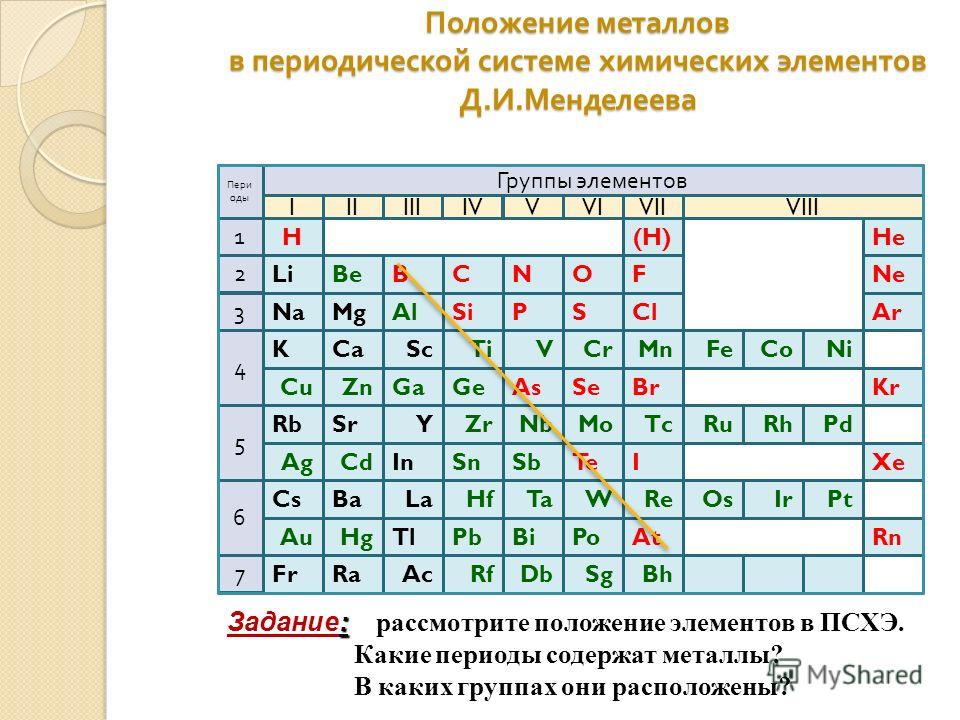 А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
Высокая способность к образованию соединений с различными химическими элементами породила множество сплавов алюминия. Даже незначительная доля примесей существенно меняет характеристики металла и открывает новые сферы для его применения. Например, сочетание алюминия с кремнием и магнием в повседневной жизни можно встретить буквально на дороге – в форме литых колесных дисков, двигателей, в элементах шасси и других частей современного автомобиля. А если добавить в алюминиевый сплав цинк, то, возможно, вы сейчас держите его в руках, ведь именно этот сплав используется при производстве корпусов мобильных телефонов и планшетов. Тем временем ученые продолжают изобретать новые и новые алюминиевые сплавы.
Сегодня существование строительной, автомобильной, авиационной, космической, электротехнической, энергетической, пищевой и других отраслей промышленности невозможно без алюминия. Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Если заменить всю медную проводку в автомобиле
на алюминиево-циркониевую, то его общий
вес уменьшится на 12 кг
По расчетам Международного института алюминия (IAI), в мире накопилось около 400 миллионов тонн алюминия в инфраструктуре, быту, транспорте.
Казалось бы, вышеперечисленный набор характеристик уже сам по себе достаточен для того, чтобы алюминий стал металлом приоритетного выбора в индустрии, однако есть еще одна, не менее значимая характеристика. Использование алюминия может быть бесконечно: этот металл и сплавы из него можно неоднократно переплавлять без утраты механических характеристик. Ученые подсчитали, что 1 кг собранных и сданных в переплавку алюминиевых банок позволяет сэкономить 8 кг боксита, 4 кг различных фторидов и 14 кВт/ч электроэнергии.
Около 75% алюминия, выпущенного за все время существования отрасли, используется до сих пор.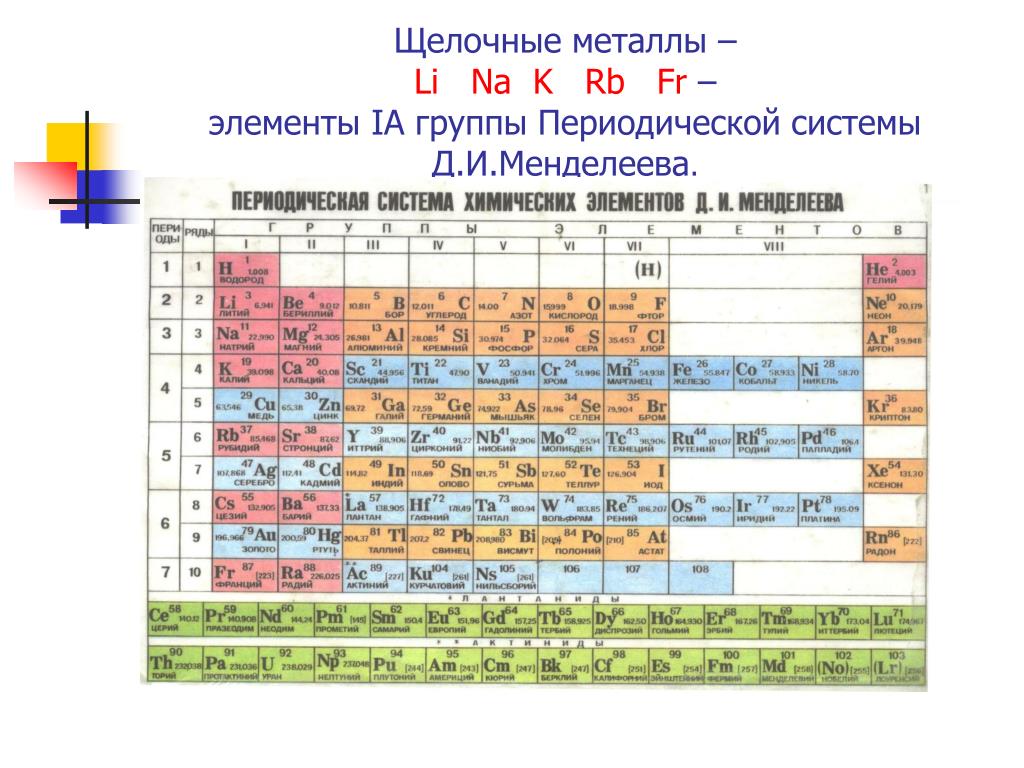
В статье использованы фотоматериалы © Shutterstock и © Rusal.
Путешествие по таблице элементов: от водорода до оганесона
Александр Рулёв,
доктор химических наук,
Иркутский институт химии им. А. Е. Фаворского СО РАН
«Наука и жизнь» №6, 2019
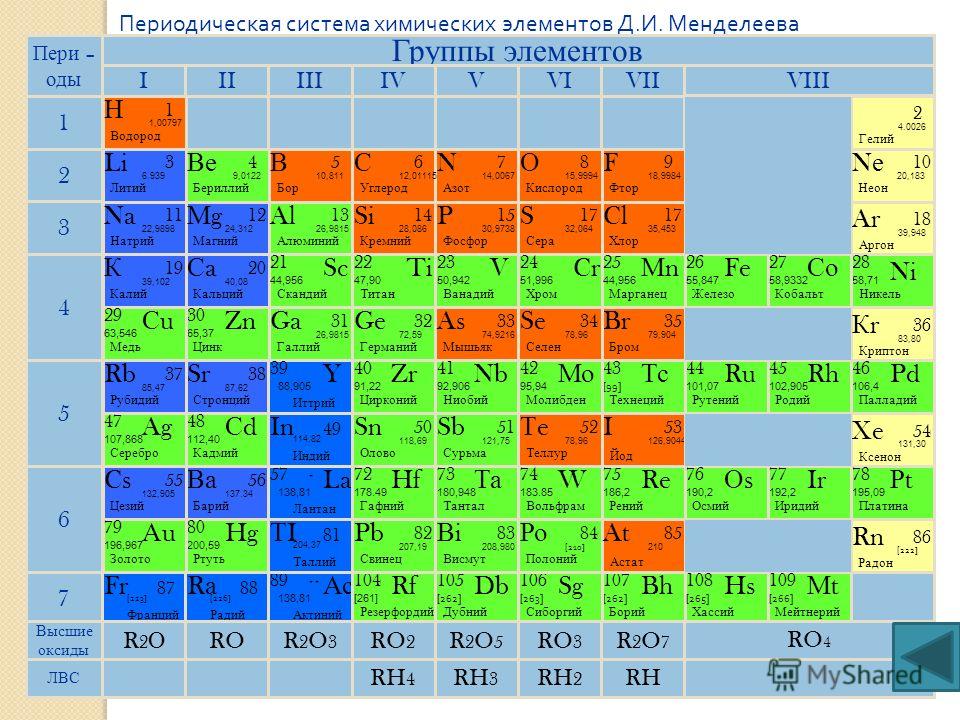
Периодическая таблица химических элементов по праву считается одним из величайших достижений химической науки. Сегодня она насчитывает почти вдвое больше элементов, чем полтора века назад, когда Дмитрий Иванович Менделеев опубликовал свой «Опыт системы элементов, основанный на их атомном весе и химическом сродстве».
Представим себе, что мы смогли проникнуть в наномир и познакомиться с элементами, «населяющими» современную таблицу. В этом случае периодическая система предстала бы в виде высотного здания, имеющего семь «этажей» (периодов), 18 «блок-секций» (групп) которого насчитывают 118 уютных «квартир» (клеток). Некоторые из жильцов — элементы-рекордсмены, многие могут рассказать о себе немало интересного, не без основания претендуя на звание «самый-самый».
В квартире под номером один живёт удивительный элемент — водород H. Он рекордсмен сразу в нескольких номинациях. Это и самый простой, и самый распространённый в природе элемент. На него приходится более 90% всех атомов видимой Вселенной. В обычных условиях он существует в виде самого лёгкого газа: один литр его весит меньше 0,09 г. При охлаждении до −253°С водород переходит в жидкое состояние, превращаясь в самую лёгкую жидкость: десятилитровое ведро такой жидкости весило бы всего 708 г. Водород — единственный химический элемент, все семь братьев-изотопов которого имеют собственные имена. Наиболее известные из них — протий (1H), дейтерий (2H или D) и тритий (3H или T). Имена других тяжёлых изотопов водорода сегодня редко используются. В недрах звёзд водород превращается в гелий. В результате этой реакции выделяется огромное количество энергии, ничтожная часть которой (одна двухмиллиардная!) попадает на Землю. Благодаря этой энергии и существует жизнь на нашей планете, существуем мы.
Сосед водорода, занимающий квартиру номер два, инертный газ гелий He. Несмотря на то что элемент назван в честь греческого бога Солнца, вещество, состоящее из его атомов, — самая холодная жидкость на Земле: его температура кипения (−269°С) лишь на четыре градуса выше абсолютного нуля. Это единственное простое вещество, температура плавления которого неизвестна: даже при абсолютном нуле оно остаётся жидким и переходит в твёрдое состояние лишь при давлении около 25 атм. Гелий — обладатель самого маленького атома: его радиус всего 31 пм (1 пикометр = 1 · 10−12 м). Напротив, самыми «пышными формами» может похвастаться цезий Cs, проживающий в квартире номер 55. Его атомный радиус почти на порядок больше — 298 пм. К тому же цезий — самый мягкий металл, да ещё и редкого светло-золотистого цвета (как правило, все металлы серые). Впрочем, и самый твёрдый металл хром Cr имеет голубовато-серебристый цвет. Способность цезия легко отдавать электрон внешнего энергетического уровня делает его ещё и самым активным металлом.
Самый лёгкий металл расположился этажом ниже под водородом. Это литий Li. Его плотность составляет всего 0,534 г/см3, он почти в два раза легче воды. Самый тяжёлый металл — осмий Os — занимает квартиру номер 76. Изготовленный из него куб с ребром 1 м весил бы 22,59 т. Он на сотые доли процента опережает своего соседа из квартиры 77 (иридий Ir) в борьбе за звание элемента с самой высокой плотностью.
Путешествуя по таблице элементов, мы непременно должны постучаться в дверь с номером шесть. Это апартаменты самого важного для жизни на Земле элемента — углерода C. Не случайно его называют «королём элементов» Периодической таблицы. Именно углерод — основа всех органических соединений: от простеньких молекул углеводородов до сложнейших белковых нитей или двойной спирали ДНК. Этот химический элемент имеет несколько аллотропных модификаций — хорошо знакомые алмаз, графит, графен и фуллерены. Среди последних наиболее знаменит бакминстерфуллерен, известный в мире под именами футболен, бакибол или просто фуллерен.
Две соседние с углеродом квартиры занимают рекордсмены по распространённости. Азот N (элемент номер семь) — самый распространённый элемент в атмосфере (чуть более 78% по объёму). Появившийся в атмосфере нашей планеты около двух миллиардов лет назад кислород (элемент номер восемь) держит пальму первенства по распространённости в литосфере (почти 49% по массе) и гидросфере Земли (86% веса всех океанов), а также в теле человека (около двух третей по массе). Так, в 70-килограммовом представителе вида Homo Sapiens на долю кислорода O приходится почти 45 кг. Согласно данным журнала New Scientist, опубликованным в декабре 2005 года, эмпирическая формула человеческого тела имеет вид:
Так, в 70-килограммовом представителе вида Homo Sapiens на долю кислорода O приходится почти 45 кг. Согласно данным журнала New Scientist, опубликованным в декабре 2005 года, эмпирическая формула человеческого тела имеет вид:
H15750 N310 O6500 C2250 Ca63 P48 K15 S15 Na10 Cl6 Mg3 Fe1.
В ней кислород уступает водороду по количеству атомов, но значительно превосходит его по массе.
Антиподы азота и кислорода занимают квартиры под номерами 85 и 86. Имя первого — астат At (от греческого αστατος — ‘неустойчивый’) — говорит само за себя: все его изотопы — короткоживущие (период полураспада самого устойчивого 210At составляет чуть более восьми часов). Именно поэтому астат самый редкий природный элемент Периодической таблицы. По разным данным, его содержание в земной коре в любой конкретный момент времени не превышает одного грамма. Радон Rn, занимающий 86-ю квартиру, самый редко встречающийся в атмосфере элемент — его содержание в ней всего около 0,0000000000000000001%. При стандартных температуре и давлении радон — самый тяжёлый из газообразных простых веществ: 1 литр его весит 9,73 г.
Радон Rn, занимающий 86-ю квартиру, самый редко встречающийся в атмосфере элемент — его содержание в ней всего около 0,0000000000000000001%. При стандартных температуре и давлении радон — самый тяжёлый из газообразных простых веществ: 1 литр его весит 9,73 г.
Несмотря на то что квартиры двух других элементов расположены на одной площадке (во втором периоде), их хозяева являют собой полную противоположность друг другу. В девятой квартире проживает самый электроотрицательный и самый активный из всех элементов-неметаллов — фтор F. Даже благородные газы — ксенон Xe и криптон Kr — пасуют перед этим химическим монстром. В его атмосфере горит, казалось бы, самое несгораемое вещество — вода. Сила фтора как окислителя настолько велика, что кислород окисляется в его атмосфере, образуя фториды OF2, O2F2 и O3F2! Напротив, сосед фтора, проживающий в десятой квартире, — неон Ne славится своим олимпийским спокойствием и с недавних пор носит титул самого инертного химического элемента.
Квартиру номер 26 занимает один из семи металлов древности. Вероятно, железо Fe — самый первый металл, с которым познакомился человек. Это единственный химический элемент, имя которого по праву запечатлено в названии целой исторической эпохи — железного века. Да и сегодня, в период широкого использования полимеров и искусственных материалов, железо по-прежнему верно служит человеку. По данным Королевского химического общества, его доля среди всех получаемых металлов достигает 90%. Большая часть железа идёт на производство стали.
Чемпион по тугоплавкости при нормальных условиях — вольфрам W — проживает в квартире номер 74. Он начинает плавиться при 3422°С. Вольфрам — обладатель и самой высокой температуры кипения (5555°С), сравнимой с температурой поверхности Солнца. Неподалёку от самого тугоплавкого расположился самый легкоплавкий металл ртуть Hg, находящийся в жидком состоянии при температуре выше −39°С. Это самый загадочный и необыкновенный металл, известный человеку с незапамятных времён. Алхимики рассматривали ртуть как главное действующее начало философского камня. На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
Он начинает плавиться при 3422°С. Вольфрам — обладатель и самой высокой температуры кипения (5555°С), сравнимой с температурой поверхности Солнца. Неподалёку от самого тугоплавкого расположился самый легкоплавкий металл ртуть Hg, находящийся в жидком состоянии при температуре выше −39°С. Это самый загадочный и необыкновенный металл, известный человеку с незапамятных времён. Алхимики рассматривали ртуть как главное действующее начало философского камня. На протяжении тысячелетий ртуть пленяла и продолжает очаровывать людей своей красотой. Не случайно её нередко называют живым серебром (по-латыни — argentum vivum).
А настоящее серебро Ag расположилось в квартире номер 47. Благодаря наивысшей электропроводности и отражательной способности серебро давно с успехом используется в электронике, электротехнике и при изготовлении зеркал. По данным Института серебра ( The Silver Institute, USA), мировой спрос на серебро в 2018 году вырос на 4%, а его добыча достигла почти 30 тысяч тонн.
На земле весь род людской
Чтит один кумир священный,
Он царит над всей Вселенной,
Тот кумир — телец златой!
Вряд ли кому не известна ария Мефистофеля из оперы Шарля Гуно «Фауст». Это всё о нём, о жильце квартиры 79, именуемом золотом Au. Оно самое романтичное и самое кровавое, самое почитаемое и самое презренное, самое желанное и самое проклятое. Получать золото, превращая в него другие металлы, было заветной мечтой алхимиков. Недаром они называли его «царём металлов», обозначая символом Солнца. Причины такой магической притягательной силы золота связаны с его уникальными свойствами: оно химически стойко, обладает удивительной ковкостью (из кусочка золота массой 1 г можно вытянуть тончайшую проволоку длиной почти 3,5 км), имеет привлекательный цвет и практически вечно сохраняет блеск. Никакой другой металл не может сравниться в этом отношении с золотом! Справедливости ради нужно отметить, что золото не столь благородно и при определённых условиях способно реагировать с некоторыми простыми веществами, а также со щелочами, с кислотами или их смесями, например с царской водкой — смесью (3:1 по объёму) концентрированных соляной и азотной кислот.
Бесспорно, золото издревле было и остаётся символом красоты, власти и богатства. Однако самым престижным считается его сосед, занимающий квартиру 78. Серебристо-белая «госпожа» платина Pt входит в элитный клуб благородных металлов, будучи королевой ювелирного дела. По спросу платина опережает даже золото. Это связано с её высокой химической устойчивостью к сильным кислотам и коррозии даже при высоких температурах. Именно поэтому она широко востребована и в научных исследованиях, и в промышленности.
Несмотря на то что серебро, золото и платина — мерила богатства, по стоимости они не идут ни в какое сравнение с некоторыми искусственно полученными металлами. Самым дорогим химическим элементом считается один из изотопов калифорния 252Cf, за один грамм которого придётся выложить 27 миллионов долларов США! Его ежегодное производство составляет около 40 мкг, а общий мировой запас, вероятно, не превышает 8 г. Уникальность калифорния ещё и в том, что он является очень мощным источником нейтронов, что позволяет использовать его в медицине и ядерной физике.
Уникальность калифорния ещё и в том, что он является очень мощным источником нейтронов, что позволяет использовать его в медицине и ядерной физике.
Что за волшебные звуки льются из квартиры номер 51? Здесь живёт известный с глубокой древности самый музыкальный химический элемент — сурьма Sb. В отличие от большинства металлов, сурьма при кристаллизации расплава расширяется. Но любопытна другая её особенность: оказывается, при медленном охлаждении и застывании расплавленная сурьма издаёт восхитительные низкочастотные звуки, напоминающие «пение» тибетских колоколов и чаш или чарующее пение сирен.
Химический элемент менделевий Md с порядковым номером 101, синтезированный в 1955 году в Калифорнийской национальной лаборатории имени Эрнеста Лоуренса в Беркли и названный в честь создателя одного из первых вариантов Периодической таблицы, претендует на шутливое звание самого хулиганистого. Дело в том, что рождения желанного атома ждут месяцами и даже годами, по эмоциональному состоянию оно сродни рождению ребёнка. Поэтому легко понять радость коллектива исследователей во главе с Гленном Сиборгом, которому при бомбардировке изотопа эйнштейния 253Es ядрами гелия удалось получить семнадцать (!) атомов менделевия Md. При этом американские учёные позволили себе такую шутку: счётчик, фиксирующий рождение атома нового элемента, они подсоединили к пожарной сигнализации, которая, естественно, срабатывала каждый раз, как только желаемая частица появлялась в реакторе. Так продолжалось до тех пор, пока пожарная служба не пресекла это «хулиганство».
Поэтому легко понять радость коллектива исследователей во главе с Гленном Сиборгом, которому при бомбардировке изотопа эйнштейния 253Es ядрами гелия удалось получить семнадцать (!) атомов менделевия Md. При этом американские учёные позволили себе такую шутку: счётчик, фиксирующий рождение атома нового элемента, они подсоединили к пожарной сигнализации, которая, естественно, срабатывала каждый раз, как только желаемая частица появлялась в реакторе. Так продолжалось до тех пор, пока пожарная служба не пресекла это «хулиганство».
Завершающий на сегодняшний день седьмой период таблицы элемент, имеющий порядковый номер 118, не только самый тяжёлый (по массе), но, вероятно, и самый скандальный. Дело в том, что его рождение связано с крупным научным скандалом. В мае 1999 года физики всё той же лаборатории в Беркли опубликовали в журнале Physical Review Letters статью, в которой сообщили о получении желанного элемента. Когда их коллегам из Германии и Японии (а затем и в самом Беркли) не удалось воспроизвести результаты, возникли подозрения в достоверности полученных данных. Два года спустя результаты были признаны сфальсифицированными, статья отозвана, а фальсификатор уволен.
Два года спустя результаты были признаны сфальсифицированными, статья отозвана, а фальсификатор уволен.
Успешный синтез нового элемента осуществлён в 2002 и 2005 годах совместно американскими и российскими физиками под руководством Юрия Оганесяна. Три его атома просуществовали менее одной тысячной доли секунды. В ноябре 2016 года новорождённому дано название «оганесон» Og. Так были отмечены заслуги академика Оганесяна в открытии сверхтяжёлых элементов, а оганесон стал вторым (после сиборгия) элементом, названным в честь здравствующего учёного («Наука и жизнь» писала об этом в январе 2017 года, статья «Унуноктий стал оганесоном» ).
Сегодня физики и химики спорят, есть ли граница у периодической системы и сколько химических элементов может она содержать. Мнения разделились: кто-то полагает, что таблица близка к завершению, кто-то надеется, что могут существовать элементы, имеющие порядковые номера 170 и более. Сейчас начинается строительство восьмого этажа. Как знать, скольким новосёлам ещё предстоит обживать новые квартиры!
Самым легким металлом в периодической таблице является .
 .. [AFMC 1988]
a) N Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , включите JS , чтобы это приложение заработало.
.. [AFMC 1988]
a) N Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , включите JS , чтобы это приложение заработало.Получение изображения
Пожалуйста, подождите …
Вопрос:
Решение:
Ответ: (D)
Связанный ответ
Светлый металл в периодическом таблице:
. и ответы
3.0k LIKES
3.0k VIEWS
1.5k SHARES
NaN00+ LIKES
NaN00+ VIEWS
NaN00+ SHARES
3.0k LIKES
3.0k VIEWS
1.5k SHARES
3. 0k LIKES
0k LIKES
3.0 k Просмотр
1,5K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3,0K любят
3,0K Views
1,5K Shares
3,0K Like
1,5K Shares
3,0K Like
1,5K. к АКЦИИ
3,0K Like
3,0K Просмотр
1,5K Акции
3,0K Нравится
3,0K Просмотр
1,5K Shares
3,0K IME
3 3,0K VIVES
1,5KS
3,0K.
NAN00+ просмотр
NAN00+ Акции
3,0K Like
3,0K Просмотр
1,5K Акции
3,0K нравятся
3,0K виды
1. 5K SALE
5K SALE
3,0K 3,0K444 3,014 3,0K 3,0K444 3,0K.1,5K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3,0K Like
3,0K Views
1,5K Shares
3.0K Likes
3.0K Shares
3,0K
3.0K. 3,0K любит
3,0K Просмотры
1,5K Акции
3.0K Like
3,0K Просмотры
1,5K Общие доли
Ответственность
. Вопросы. по характеру и содержанию этих вопросов. Doubtnut не несет ответственности за какие-либо расхождения относительно дублирования контента по этим вопросам.
Подобные вопросы, заданные пользователями
Самый легкий металл в периодической таблице это .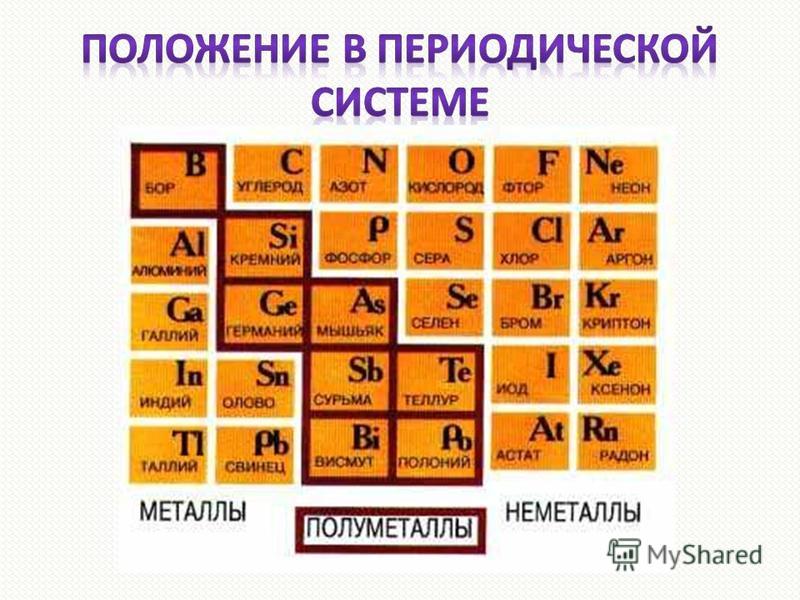 .. [AFMC 1988]
а) На
б) ртутного столба
в) Са
г) Ли
.. [AFMC 1988]
а) На
б) ртутного столба
в) Са
г) Ли
Правильная последовательность щелочных металлов в группе … [AFMC 1992] a) Fr, Na, K, Rb, Cs, Li…
Металлы K, Ca и Li могут быть расположены в порядке убывания их стандартного электродного потенциала a…
Стандартный восстановительный потенциал Li+ / Li , Ba2+/Ba, Na+/Na и Mg2+/Mg равны -3,05, -2,90, -…
Элементом, отвечающим за поддержание тургора, является … …. [BHU 1996] а) К б) На в) Са г) ртутного столба
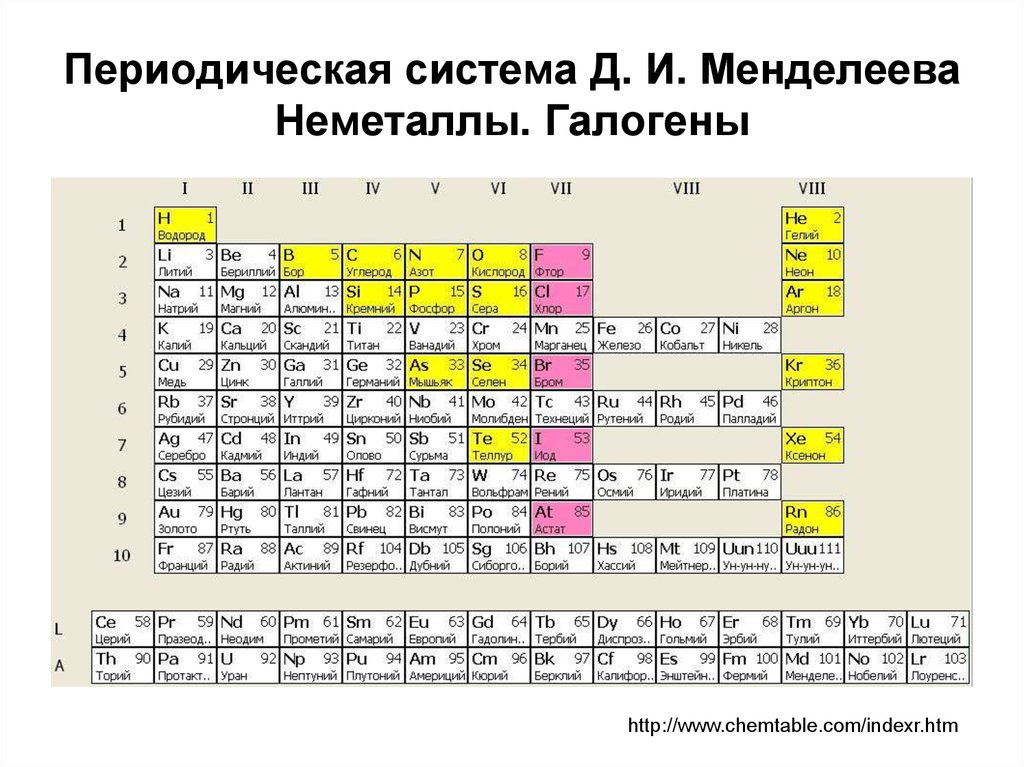
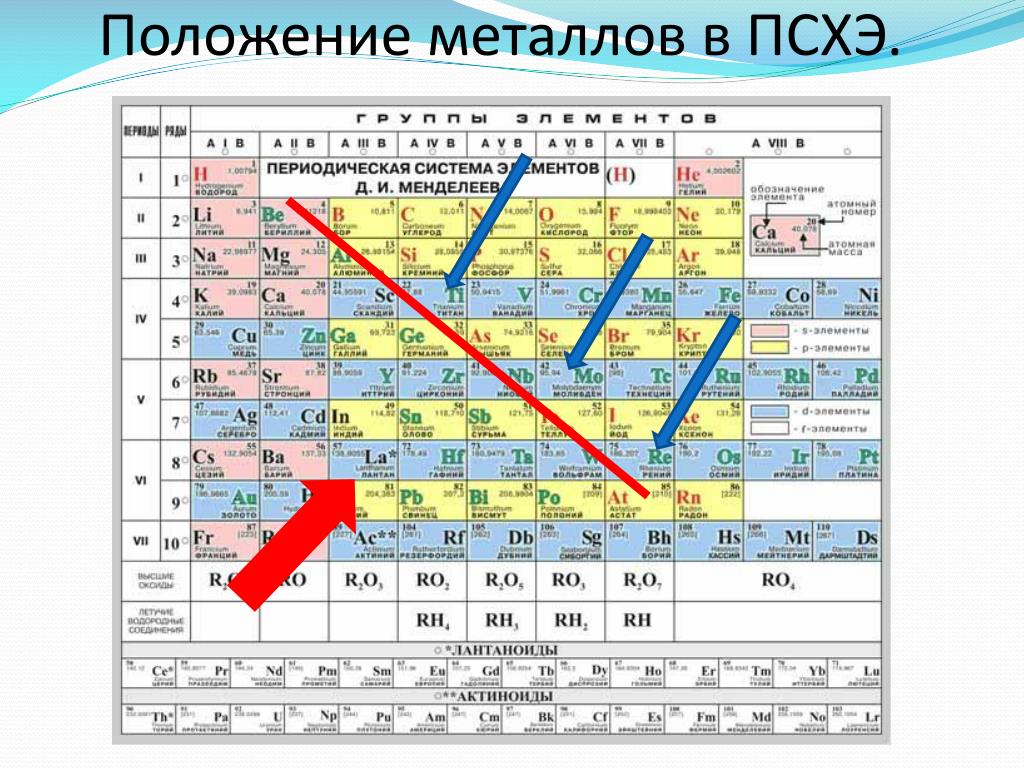
В полной форме таблицы Менделеева все неметаллы помещены в … [EAMCET 1988] а) s-блок …
Какое из следующих веществ реагирует с водой с высокой скоростью’ Какое из следующих веществ реагирует с водой с большой скоростью…
Какая из следующих пар имеет оба члена из одной и той же группы таблицы Менделеева’ Какое из fo. ..
Среди металлов Be, Mg, Ca и Sr группы 2 (или группы IIA) таблицы Менделеева наименее иони. ..
..
Щелочной металл, реагирующий с азотом непосредственно с образованием нитрида, представляет собой … [Roorkee 1992] а) Ли b)…
Щелочной металл, реагирующий с азотом непосредственно с образованием нитрида, представляет собой .. [MP PMT 2000] а) Ли б) …
Какой из следующих металлических порошков используется для превращения трихлорметана в ацетилен путем нагревания t…
Какой из следующих используется в высокотемпературной термометрии? Что из следующего используется в…
Концентрация минералов внутри клетки в порядке убывания …. .. [ Har PMT 1994] а) Са-К-На б) K-…
металлов, принадлежащих к одной и той же группе в таблице Менделеева, это ..[ MP PMT 1998] а) Mg и Na б) Mg an…
На основании положения в электрохимическом ряду металл, не вытесняющий водород …
Набор, представляющий правильный порядок первого потенциала ионизации, равен . .. [ ИИТ 2001]
a) K > Na >…
.. [ ИИТ 2001]
a) K > Na >…
набор, представляющий правильный порядок первого потенциала ионизации, равен ..[ IIT скрининг-тест 2001] а)…
Be2+ изоэлектронен какому из следующих ионов ‘ Be2+ изоэлектронен какому из ионов…
Какое из следующих веществ имеет наибольшую проводимость’ Какое из следующих веществ имеет наибольшую проводимость…
бериллий – Наука в школе
Автор(ы): Joseph W Piergrossi, Montserrat Capellas Espuny
Легкий сверхпрочный металл бериллий – мечта инженера, но у него есть и менее удобные качества.
Бериллий (символ Be), четвертый элементв периодической таблице
Antoine2K/Shutterstock.com
Элемент бериллий, пожалуй, один из самых странных в периодической таблице. Это второй самый легкий металл (по атомной массе) после лития, и он также на удивление неактивен по сравнению со своими элементарными соседями. Бериллий является первым элементом группы 2 и, в отличие от других щелочноземельных металлов (таких как магний, кальций и стронций), не взаимодействует с большинством других веществ. Фактически, этот темно-серый металл был бы одним из самых полезных элементов в периодической таблице, если бы он был более распространен и не был бы так опасен в работе.
Бериллий является первым элементом группы 2 и, в отличие от других щелочноземельных металлов (таких как магний, кальций и стронций), не взаимодействует с большинством других веществ. Фактически, этот темно-серый металл был бы одним из самых полезных элементов в периодической таблице, если бы он был более распространен и не был бы так опасен в работе.
Сплавы и применения
Химическая стабильность бериллия обусловлена его тенденцией к образованию очень тонкого нереакционноспособного оксидного слоя на его поверхности. Это и его низкая плотность являются преимуществами при изготовлении очень прочных, устойчивых к коррозии металлических сплавов, таких как бериллиевая медь. Эти сплавы используются в приложениях с высокими нагрузками, таких как винты вертолетов. Они также используются в качестве альтернативы стали в некоторых инструментах, особенно там, где есть сильные магнитные поля, например, от радиопередатчиков или оборудования для магнитно-резонансной томографии (МРТ) в больницах.
Чистый бериллий также используется в некоторых специальных приложениях, несмотря на его высокую стоимость, из-за его превосходных технических качеств. Помимо легкости и прочности, бериллий имеет высокую температуру плавления и относительно низкое тепловое расширение, поэтому он очень мало меняется при нагревании или при охлаждении до исключительно низких температур, например, в космосе. Эти качества сделали бериллий предпочтительным материалом для многих аэрокосмических применений, в том числе для изготовления деталей спутников и сверхзвуковых самолетов. Космический телескоп Джеймса Уэбба (JWST) — новый космический телескоп, который заменит «Хаббл», — будет иметь зеркала, сделанные из чистого бериллия. Ожидается, что JWST будет запущен в 2021 году, и когда он будет установлен, 18 шестиугольников из бериллия, из которых состоит главное зеркало телескопа, будут охлаждаться до -220°C. Это сделано для того, чтобы свести к минимуму инфракрасное излучение от самого зеркала, которое в противном случае могло бы помешать обнаружению сигнала.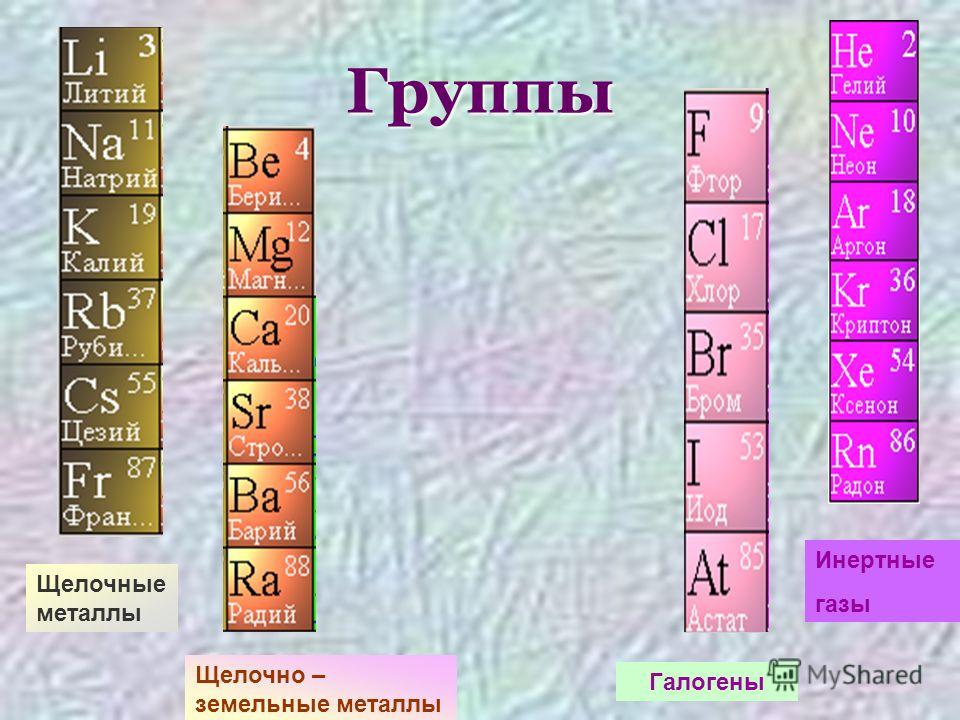
Ball Aerospace/Flickr, CC BY-NC-ND 2.0
Бериллий обладает еще одним особым свойством: в отличие от большинства металлов, рентгеновские лучи могут проходить прямо насквозь Это. Эта прозрачность для рентгеновских лучей связана с небольшим количеством электронов в его атомах: как элемент номер 4 в периодической таблице, он имеет всего четыре электрона в каждом из своих атомов (вместе с четырьмя протонами и обычно пятью нейтронами в ядре). . Электроны взаимодействуют с проходящими рентгеновскими лучами, отклоняя или поглощая их и испуская собственные вторичные рентгеновские лучи. Поскольку бериллий имеет только четыре электрона, рентгеновские лучи могут проноситься мимо его атомов с небольшим шансом вступить в контакт с электронами. Хотя элемент литий — с атомным номером 3 и, следовательно, с еще меньшим количеством электронов — теоретически может создать еще лучшее рентгеновское «окно», он слишком реактивен, чтобы его можно было использовать в каких-либо структурных приложениях, в отличие от бериллия.
Пропускание рентгеновских лучей
Необычное свойство бериллия — прозрачность для рентгеновских лучей означает, что его можно использовать для заключения образцов для анализа с помощью рентгеновских лучей, поскольку лучи могут проходить через корпус без особых помех. Это исключительно полезно в исследовательских учреждениях, которые используют рентгеновские лучи для изучения вещества на атомном уровне, таких как Европейский центр синхротронного излучения (ESRF) w1 и Европейский рентгеновский лазер на свободных электронах (European XFEL) w2 . Когда интенсивные импульсы рентгеновского излучения воздействуют на исследуемые образцы, то, как рентгеновские лучи рассеиваются или поглощаются, дает данные о свойствах и поведении атомов в образце, которые затем ученые могут интерпретировать. В European XFEL тонко сфокусированный рентгеновский луч используется для нацеливания на образцы, такие как отдельные вирусы и биомолекулы. В ESRF луч позволяет ученым очень подробно изучать свойства и молекулярную структуру вещества, что приводит к разработке новых материалов или новому использованию существующих.
В интенсивных источниках рентгеновского излучения, подобных источникам ESRF и European XFEL, некоторые части аппарата необходимо изолировать в условиях герметичного вакуума. Но создание барьеров для потока воздуха затруднило бы путь рентгеновских лучей, если только барьеры не сделаны из бериллия. Бериллий также защищает детекторы рентгеновского излучения от других частиц, которые могут мешать показаниям — например, в спектрометре, используемом для контроля свойств рентгеновских импульсов в европейском XFEL.
Фокусировка с бериллиевыми линзами
Так же, как прозрачное стекло используется для фокусировки видимого света, бериллий используется для изготовления линз, фокусирующих рентгеновские лучи. Когда пучок сфокусирован в точечную точку, в меньшем пространстве находится больше рентгеновских фотонов, что увеличивает эффект взаимодействия рентгеновских лучей с экспериментальными образцами.
Для фокусировки рентгеновских лучей бериллиевые линзы должны быть вогнутыми, т. е. изогнутыми в направлении, противоположном знакомым выпуклым линзам, используемым для фокусировки видимого света. Поскольку преломляющая способность бериллия очень низка, линзы обычно используются в виде пакетов отдельных линз, которые известны как составные преломляющие линзы (CRL). Эти многослойные линзы обеспечивают впечатляющую фокусирующую способность: конечная ширина луча рентгеновского лазера может составлять всего доли микрона (10 -6 м) в поперечнике – примерно в 10 000 раз больше исходного диаметра луча.
е. изогнутыми в направлении, противоположном знакомым выпуклым линзам, используемым для фокусировки видимого света. Поскольку преломляющая способность бериллия очень низка, линзы обычно используются в виде пакетов отдельных линз, которые известны как составные преломляющие линзы (CRL). Эти многослойные линзы обеспечивают впечатляющую фокусирующую способность: конечная ширина луча рентгеновского лазера может составлять всего доли микрона (10 -6 м) в поперечнике – примерно в 10 000 раз больше исходного диаметра луча.
Европейский XFEL
Редкий и опасный
Но наряду с этими исключительными качествами у бериллия есть и неприятная сторона. Во-первых, этого элемента мало: он встречается только в редких минералах, таких как берилл — тип драгоценного камня, в который входят изумруды и аквамарины. Этот дефицит делает бериллий дорогим, поэтому он используется только в случае крайней необходимости. Тем не менее, там, где он используется, он остается: бериллиевые компоненты в рентгеновских исследовательских установках могут прослужить сотни лет, прежде чем их потребуется заменить.
Тем не менее, там, где он используется, он остается: бериллиевые компоненты в рентгеновских исследовательских установках могут прослужить сотни лет, прежде чем их потребуется заменить.
greyloch/Flickr, еще одна задача CC 0 3 9 SA 190. что бериллий общеизвестно токсичен. Вдыхание даже небольшого количества бериллиевой пыли может вызвать бериллиоз — заболевание с постоянными неизлечимыми симптомами, похожее на пневмонию, которое может привести к раку. В результате в ситуациях, когда используется металлический бериллий, необходимо принимать особые меры предосторожности, чтобы предотвратить попадание пыли в окружающую среду. Таким образом, обработка металла затруднена, потому что пыль, образующаяся при обработке бериллия, очень токсична. По этой причине бериллиевые линзы изготавливаются путем заливки расплавленного бериллия в стандартные формы, а не путем шлифования металла до нужной формы.
Итак, хотя бериллий соблазнительно универсален, его редкость и риски, которые он представляет, означают, что его можно рассматривать только для самых избранных и дорогостоящих применений. И всегда необходимо учитывать опасности, присущие этому весьма необычному металлическому элементу.
Благодарность
Авторы хотели бы поблагодарить доктора Питера Залдена, специалиста по приборам Европейского XFEL, за его помощь в предоставлении информации для этой статьи.
Веб-ссылки
- w1. Расположенный в Гренобле, Франция, ESRF является самым интенсивным в мире источником рентгеновского излучения и передовым центром фундаментальных исследований в области науки о конденсированном и живом веществе. Проект «Чрезвычайно блестящий источник», который планируется завершить в 2022 году, станет новым источником, в 100 раз более ярким и когерентным для лучшего понимания материалов.
- w2 — European XFEL — исследовательский центр в районе Гамбурга в Германии.
 Его чрезвычайно интенсивные рентгеновские вспышки используются исследователями со всего мира для изучения структуры и поведения материалов на атомном уровне и в сверхбыстрых временных масштабах.
Его чрезвычайно интенсивные рентгеновские вспышки используются исследователями со всего мира для изучения структуры и поведения материалов на атомном уровне и в сверхбыстрых временных масштабах.
Ресурсы
- Для получения дополнительной информации о бериллии и его использовании посетите веб-сайт Ассоциации науки и техники бериллия (BeST).
- Прочитайте небольшую книгу о бериллии и его применении. Видеть:
- Adair R (2007) Бериллий . Розен Сентрал, Нью-Йорк. ISBN: 1404210032
- Посмотрите видео о бериллии и его использовании, которое включает объяснение бериллиевого «окна» на синхротроне MAX-lab в Швеции, в рамках серии «Периодическая таблица видео» Университета Ноттингема.
- Узнайте больше о космическом телескопе Джеймса Уэбба, созданном совместно НАСА, Европейским космическим агентством (ЕКА) и Канадским космическим агентством. Узнайте больше о главном зеркале из бериллия на сайте НАСА.
- Посмотрите видео от Королевского института Великобритании о бериллии и JWST.

- Прочитайте об открытии нейтрона на сайте Американского физического общества.
- Для получения информации обо всех химических элементах прочитайте эту книгу:
- Gray T (2009) Элементы: визуальное исследование каждого известного атома во Вселенной . Black Dog & Leventhal Publishers, Inc., Нью-Йорк. ISBN: 1603764054
Учреждения
Автор(ы)
Джозеф Пьергросси (Joseph W Piergrossi) — научный писатель из Гамбурга, Германия. Он имеет степень магистра образования Университета Джорджии, США, и научной журналистики Бостонского университета, США. Ранее он работал учителем экологии и физики в США. С 2013 года Джозеф работает научным коммуникатором в European XFEL в Шенефельде, Германия.
Монтсеррат Капеллас Эспуни — старший специалист по научным коммуникациям в ESRF. Она пишет статьи о науке и ее приложениях и участвует в проекте Humans of ESRF, веб-сайте, на котором изображены люди, работающие в ESRF, в честь 30-летия учреждения.
Обзор
В таблице Менделеева есть малоизвестные элементы, которые имеют множество применений. Эта статья может углубить знания учащихся об одном таком металлическом элементе: бериллии.
Прежде чем читать эту статью, учащиеся могут подумать о металлах, которые они знают, и о том, как менялось их применение на протяжении истории. Затем эту статью можно было бы использовать в качестве отправной точки для исследования и обсуждения использования различных редких элементов в нашем обществе. Это также может помочь повысить осведомленность об огромных затратах на их получение и важности переработки.
Возможные вопросы на понимание включают:
- Какой атомный номер у бериллия и какова его позиция в периодической таблице?
- Почему бериллий так отличается от других элементов своей группы?
- Можете ли вы перечислить пять свойств бериллия?
- Можете ли вы подробно описать три применения бериллия?
- Почему бериллий используется только в случае крайней необходимости?
- Можете ли вы объяснить, какую роль бериллий сыграл в открытии нейтрона?
Мирейа Гуэль Серра, учитель химии, школа INS Cassà de la Selva, Испания
Лицензия
CC-BY
Загрузить
Загрузить эту статью в формате PDF
Что такое алюминий
Легкий, прочный и функциональный: эти качества делают алюминий одним из ключевых инженерных материалов нашего времени. Мы можем найти алюминий в домах, в которых живем, в автомобилях, на которых ездим, в поездах и самолетах, которые доставляют нас на большие расстояния, в мобильных телефонах и компьютерах, которыми мы пользуемся каждый день, на полках в наших холодильниках и в современных интерьера, но всего 200 лет назад об этом металле было известно очень мало.
Мы можем найти алюминий в домах, в которых живем, в автомобилях, на которых ездим, в поездах и самолетах, которые доставляют нас на большие расстояния, в мобильных телефонах и компьютерах, которыми мы пользуемся каждый день, на полках в наших холодильниках и в современных интерьера, но всего 200 лет назад об этом металле было известно очень мало.
Такие драгоценные камни, как рубин, сапфир, аквамарин и изумруд, также являются минералами алюминия. Первые два представляют собой корунд, то есть оксид алюминия (Al 2 O 3 ) в кристаллической форме. Он по своей природе прозрачен и по прочности уступает только бриллиантам. Сапфир используется в пуленепробиваемых стеклах, окнах самолетов, устойчивых к царапинам экранах смартфонов. Тем временем один из менее ценных минералов корунда, наждак, используется в качестве абразива, например, в наждачной бумаге.
Сегодня нам известно почти 300 различных соединений алюминия и минералов, содержащих алюминий, от полевого шпата, ключевого исходного минерала на Земле, до рубина, сапфира и изумруда, которые встречаются гораздо реже.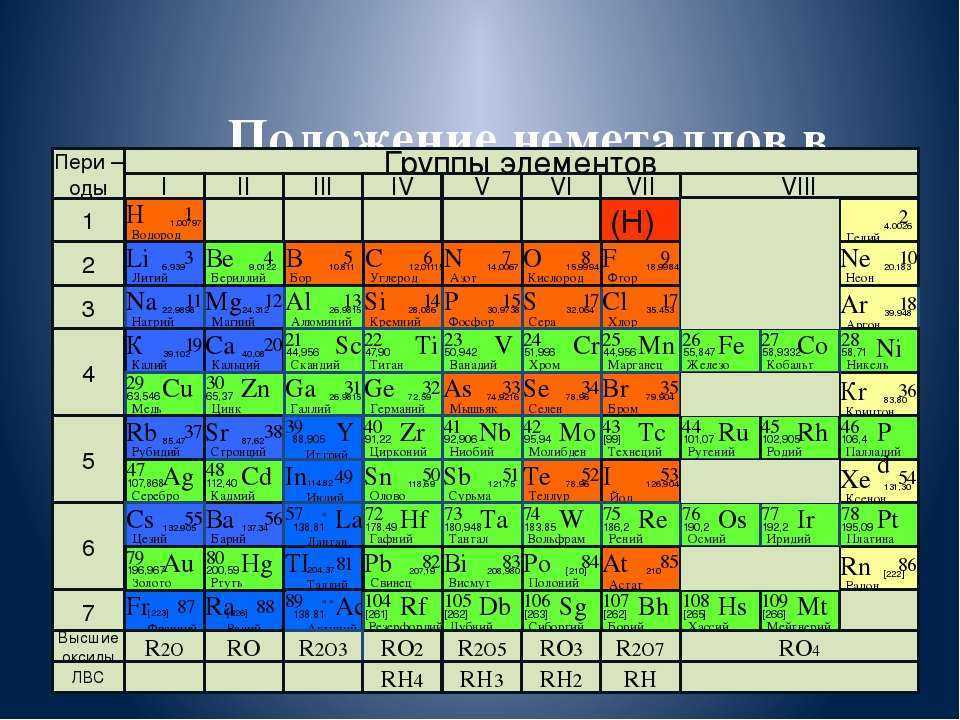
Хамфри Дэви. Британский физик и химик сэр Хамфри Дэви первым получил новый химический элемент с помощью электролиза: ему удалось получить бор из борной кислоты. Он продолжал использовать электролиз, чтобы изолировать еще шесть ранее неизвестных металлов: калий, натрий, барий, кальций, магний и стронций. Именно Дэви доказал существование алюминия, металла, содержащегося в глиноземе, и дал ему название.
Но каким бы распространенным ни был алюминий, он мог бы навсегда остаться скрытым, если бы не электричество. Открытие алюминия стало возможным, когда ученые смогли использовать электричество для расщепления химических соединений на их элементы. В 19 веке датский физик Кристиан Эрстед использовал электролиз для получения алюминия. Электролиз или электролитическое восстановление — это процесс, который и сегодня используется для производства алюминия.
Другой довольно распространенный минерал, боксит, используется сегодня в качестве основного сырья в производстве алюминия. Боксит представляет собой глинистый минерал, состоящий из различных модификаций гидроксида алюминия в смеси с оксидами железа, кремния, титана, серы, галлия, хрома, ванадия, а также сернистыми карбонатами кальция, железа и магния. Другими словами, ваш типичный боксит содержит почти половину таблицы Менделеева. Кстати, из-за текстуры боксита лет сто назад алюминий часто довольно поэтично называли серебром, полученным из глины. В среднем для производства 1 тонны алюминия требуется 4-5 тонн бокситов.
Боксит представляет собой глинистый минерал, состоящий из различных модификаций гидроксида алюминия в смеси с оксидами железа, кремния, титана, серы, галлия, хрома, ванадия, а также сернистыми карбонатами кальция, железа и магния. Другими словами, ваш типичный боксит содержит почти половину таблицы Менделеева. Кстати, из-за текстуры боксита лет сто назад алюминий часто довольно поэтично называли серебром, полученным из глины. В среднем для производства 1 тонны алюминия требуется 4-5 тонн бокситов.
Бокситы были открыты в 1821 году геологом Пьером Бертье на юге Франции. Новые минералы были названы в честь района, в котором они были обнаружены: Les Baux. Около 90% мировых поставок бокситов приходится на тропические и субтропические районы, такие как Гвинея, Австралия, Вьетнам, Бразилия, Индия и Ямайка.
На первой стадии производства алюминия бокситы перерабатываются в глинозем или оксид алюминия Al 2 O 3 . Глинозем выглядит как белый порошок и затем перерабатывается в алюминий на алюминиевых заводах с помощью электролитического восстановления.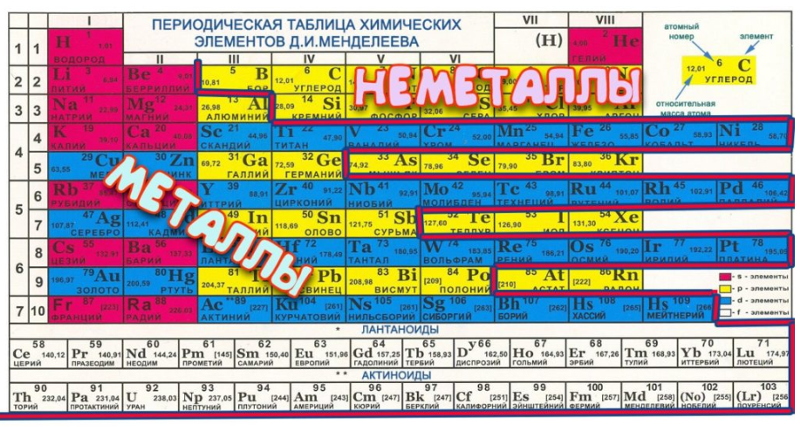
Производство алюминия требует огромного количества электроэнергии, около 15 МВтч на тонну продукции. Это примерно столько, сколько 100-квартирный дом потребляет в месяц. Поэтому лучшее место для алюминиевого завода находится рядом с мощным, желательно возобновляемым источником энергии. Гидроэлектростанции являются лучшим вариантом, поскольку они являются наиболее мощными «зелеными» источниками энергии, доступными сегодня.
Свойства алюминия
Алюминий предлагает редкое сочетание ценных свойств. Это один из самых легких металлов в мире: он почти в три раза легче железа, но при этом очень прочен, чрезвычайно гибок и устойчив к коррозии, поскольку его поверхность всегда покрыта чрезвычайно тонким, но очень прочным слоем оксидной пленки. Он не намагничивается, является отличным проводником электричества и образует сплавы практически со всеми другими металлами.
Три раза легче, чем железо
Почти столько же, сколько сталь
Легко при обработке
Из -за шикарной поверхности
 давление как в жару, так и в холод. Его можно сворачивать, тянуть и штамповать. Алюминий не горит, не требует специальной покраски и в отличие от пластика не токсичен. Он также очень податлив, поэтому из него можно делать листы толщиной всего 4 микрона, а также очень тонкую проволоку. Сверхтонкая фольга, которую можно изготовить из алюминия, в три раза тоньше человеческого волоса. Кроме того, алюминий более экономичен, чем другие металлы и материалы.
давление как в жару, так и в холод. Его можно сворачивать, тянуть и штамповать. Алюминий не горит, не требует специальной покраски и в отличие от пластика не токсичен. Он также очень податлив, поэтому из него можно делать листы толщиной всего 4 микрона, а также очень тонкую проволоку. Сверхтонкая фольга, которую можно изготовить из алюминия, в три раза тоньше человеческого волоса. Кроме того, алюминий более экономичен, чем другие металлы и материалы. Поскольку алюминий легко образует соединения с другими химическими элементами, было разработано огромное разнообразие алюминиевых сплавов. Даже очень небольшое количество примесей может резко изменить свойства металла, что позволит использовать его в новых областях. Например, в обычной жизни алюминий в смеси с кремнием и магнием можно встретить буквально на дороге, т.е. в алюминиевых колесах, в двигателях, шасси и других деталях современных автомобилей. Что касается алюминиево-цинкового сплава, скорее всего, вы держите его в руках прямо сейчас, поскольку именно этот сплав широко используется в производстве мобильных телефонов и планшетных ПК.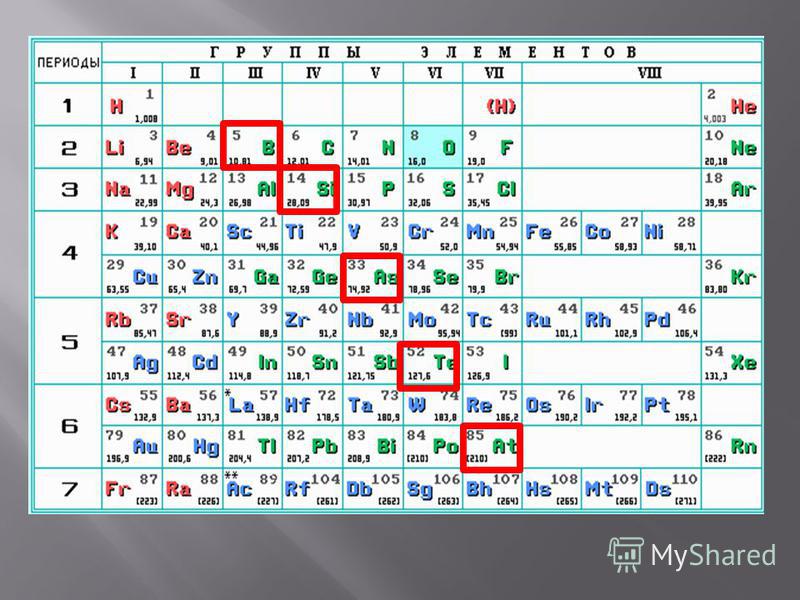 Тем временем ученые продолжают разрабатывать новые алюминиевые сплавы.
Тем временем ученые продолжают разрабатывать новые алюминиевые сплавы.
Современное строительство, автомобилестроение, авиация, энергетика, пищевая и другие отрасли промышленности были бы невозможны без алюминия. Кроме того, алюминий стал символом прогресса: все современные устройства и транспортные средства сделаны из алюминия. (ссылка на раздел «Использование»)
Если бы в автомобиле все медные провода были заменены на алюминиево-циркониевые, вес автомобиля был бы на 12 кг меньше
По оценкам Международного института алюминия (IAI), в настоящее время существует 400 миллионов тонн алюминия используется в инфраструктуре, на транспорте и в быту
Казалось бы, сочетания перечисленных выше качеств уже достаточно, чтобы сделать алюминий лучшим выбором в промышленности, однако есть еще одно не менее важное свойство: алюминий можно использовать повторно снова и снова. И алюминий, и его сплавы можно переплавлять и использовать повторно без ущерба для механических свойств.

 Его чрезвычайно интенсивные рентгеновские вспышки используются исследователями со всего мира для изучения структуры и поведения материалов на атомном уровне и в сверхбыстрых временных масштабах.
Его чрезвычайно интенсивные рентгеновские вспышки используются исследователями со всего мира для изучения структуры и поведения материалов на атомном уровне и в сверхбыстрых временных масштабах.