Какой металл самый легкий?. Физика на каждом шагу
Какой металл самый легкий?. Физика на каждом шагуВикиЧтение
Физика на каждом шагуПерельман Яков Исидорович
Какой металл самый легкий?
Техники называют «легкими» все те металлы, которые легче железа в два и более раз. Самый распространенный легкий металл, применяемый в технике, – алюминий, который легче железа втрое. Еще легковеснее металл магний: он легче алюминия в 1 1/2 раза. В последнее время техника стала пользоваться для изделий сплавом алюминия с магнием, известным под названием «электрон». Этот сплав, по прочности не уступающий стали, легче ее в четыре раза. Самый же легкий из всех металлов – литий – в технике пока еще не применяется. Литий не тяжелее еловой древесины; брошенный в воду, он не тонет.
Если сравнить между собою самый тяжелый и самый легкий металл – иридий и литий, то окажется, что первый весит больше второго в 40 с лишком раз.
Вот удельные веса некоторых легких металлов:
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесЧитайте также
ГЛАВА 1. ТЕБЕ — МАЛО, МНЕ — В САМЫЙ РАЗ
ГЛАВА 1. ТЕБЕ — МАЛО, МНЕ — В САМЫЙ РАЗ Среди множества причин, по которым я выбрала своей профессией физику, было желание сделать что?нибудь долговременное, даже вечное. Если, рассуждала я, мне предстоит вложить столько времени, энергии и энтузиазма в какое?то дело, то
С КАКОЙ ЦЕЛЬЮ ПРОВОДЯТСЯ ИЗМЕРЕНИЯ?
С КАКОЙ ЦЕЛЬЮ ПРОВОДЯТСЯ ИЗМЕРЕНИЯ?
Измерения не могут быть идеальными.
3. Самый большой в мире телескоп-рефрактор
3. Самый большой в мире телескоп-рефрактор Самый большой в мире телескоп-рефрактор установлен в 1897 году в Йеркской обсерватории университета в Чикаго (США). Его диаметр D = 102 сантиметра, а фокусное расстояние — 19,5 метра. Представляете, сколько места ему надо в
Какой металл самый тяжелый?
Какой металл самый тяжелый? В обиходе свинец считается тяжелым металлом. Он тяжелее цинка, олова, железа, меди, но все же его нельзя назвать самым тяжелым металлом. Ртуть, жидкий металл, тяжелее свинца; если бросить в ртуть кусок свинца, он не потонет в ней, а будет держаться
Лёгкие металлы информация о цветных легких металлах, легкий металл — металлургия легких металлов
Лёгкие металлы ,Лёгкие металлы и легкие сплавы металлов.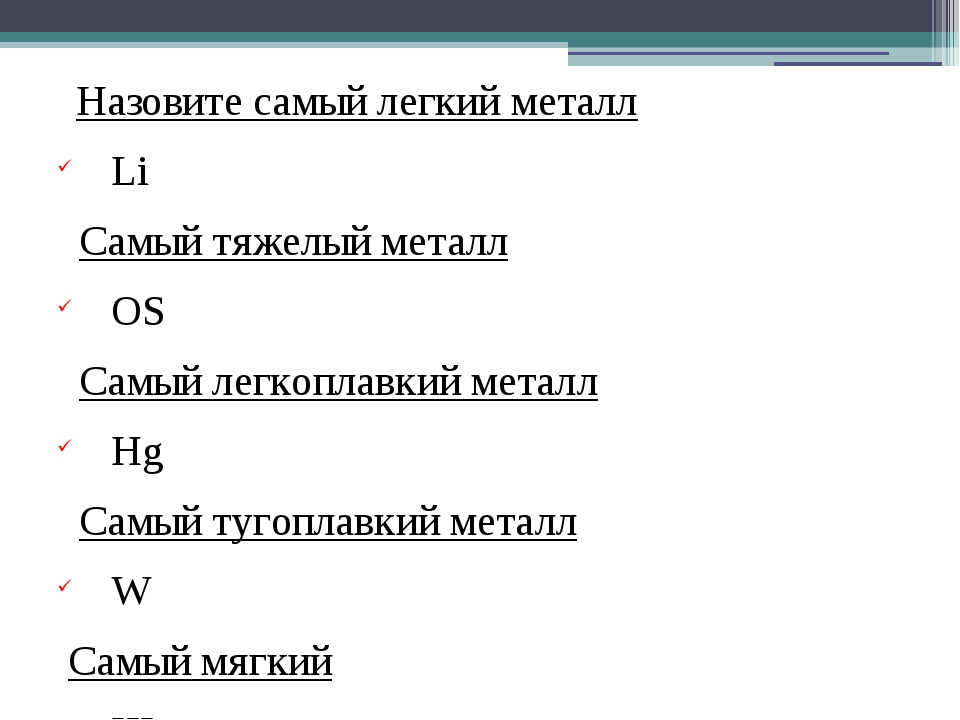
легкие металлы, легкий металл. Металлы платиновой группы (МПГ, Платиновая группа, Платиновые металлы, Платиноиды) — коллективное обозначение шести переходных металлических элементов (рутений, родий, палладий, осмий, иридий, платина), имеющих схожие физические и химические свойства, и, как правило, встречающихся в одних и тех же месторождениях. В связи с этим, имеют схожую историю открытия и изучения, добычу, производство и применение. Металлы платиновой группы являются благородными и драгоценными металлами. В природе, чаще всего встречаются, в полиметаллических (медно-никелевых) рудах, а также в месторождениях золота и платины. Иногда, металлы платиновой группы подразделяют на две триады: рутений, родий и палладий — лёгкие платиновые металлы и платина, иридий и осмий — тяжёлые платиновые металлы.
В Старом Свете платина не была известна, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён Итальянский химик Джилиус Скалигер в 1835 году открыл неразложимость платины и таким образом доказал, что она является независимым химическим элементом.
В 1803 английский учёный Уильям Хайд Волластон открыл палладий и родий.
В 1804 английский учёный С. Теннант открыл иридий и осмий.
В 1808 русский учёный А. Снядицкий, исследуя платиновую руду, привезенную из Южной Америки, извлек новый химический элемент, названный им вестием.
В 1844 профессор Казанского университета К. К. Клаус всесторонне изучил этот элемент и назвал его в честь России рутением.
Все платиновые металлы светло-серые и тугоплавкие, платина и палладий пластичны, осмий и рутений хрупкие. Красивый внешний вид благородных металлов обусловлен их инертностью.
Платиновые металлы обладают высокой каталитической активностью в реакциях гидрирования, что обусловлено высокой растворимостью в них водорода. Палладий способен растворить до 800—900[2] объёмов водорода, платина — до 100.
Все платиновые металлы химически довольно инертны, особенно платина. Они растворяются лишь в «царской водке» с образованием хлоридных комплексов.
Нас находят по запросам:
самый легкий металл
самые легкие металлы
легкие цветные металлы
металлургия легких металлов
легкий серебристо белый металл
легкие и тяжёлые металлы
легкий прочный металл
легкие металлы металлургия
металлургия легких металлов
Какой самый легкий металл в мире?
По плотности металлы подразделяются на легкие и тяжелые.
Самые легкие металлы — у которых плотность менее 5 г/см3: литий, натрий, калий, магний, цезий, кальций, алюминий и барий.
Самый легкий металл — это литий 1л, его плотность составляет 0,534 г/см3. Он даже в воде не тонет. Открыл его в 1817 году химик Арфведсон. Позднее, в 1825 году Г. Дэви вывел лабораторным путем металлический литий.
Краткая характеристика лития
По внешнему виду литий похож на лед и имеет такой же серебристый оттенок. Но в отличие ото льда, литий мягкий и пластичный. Он имеет некоторые особые свойства – поскольку литий активно взаимодействует с окружающей средой, использование его в чистом виде весьма затруднительно. Чаще литий сплавляют с другими металлами, например с натрием.
Но в отличие ото льда, литий мягкий и пластичный. Он имеет некоторые особые свойства – поскольку литий активно взаимодействует с окружающей средой, использование его в чистом виде весьма затруднительно. Чаще литий сплавляют с другими металлами, например с натрием.
Применение:
- Химические источники тока, например литий-ионные аккумуляторы.
- В качестве окислителя, а так же вместе с окислителями в производстве топлива для ракет.
- В изготовлении пиротехники используется нитрат лития.
- В оптике используется фторид лития.
- В силикатной промышленности сплав лития используется в изготовлении стекла (определенного вида).
- В текстильной, фармацевтической, пищевой промышленностях используются некоторые соединения лития.
- В термоядерном оружии литий может заменить тритий.
- Различные сплавы лития могут использоваться в электронике, авиа-космической промышленности и для других целей.
Легкий, но прочный металл – титан. Различные титановые сплавы широко применяются в разных областях промышленности и технологий.
Различные титановые сплавы широко применяются в разных областях промышленности и технологий.
Тяжелые металлы, такие как цинк, олово, медь, свинец, железо, серебро, золото и т.д. – имеют плотность выше 5 г/см3.
А самый тяжелый металл в мире – осмий, плотность которого составляет 22.6 г/см3, далее идет иридий -22.5 – плотность этих металлов в два раза больше, чем у свинца.
Самый легкий и тяжелый металл. Какой металл самый тяжелый? Иридий: открытие, особенности, применение
Физика на каждом шагу Перельман Яков Исидорович
Какой металл самый тяжелый?
В обиходе свинец считается тяжелым металлом. Он тяжелее цинка, олова, железа, меди, но все же его нельзя назвать самым тяжелым металлом. Ртуть, жидкий металл, тяжелее свинца; если бросить в ртуть кусок свинца, он не потонет в ней, а будет держаться на поверхности. Литровую бутылку ртути вы с трудом поднимете одной рукой: она весит без малого 14 кг.
Рекорд же тяжеловесности побивают редкие металлы – иридий и осмий: они почти втрое тяжелее железа и более чем в сто раз тяжелее пробки; понадобилось бы 110 обыкновенных пробок, чтобы уравновесить одну иридиевую или осмиевую пробку таких же размеров.
Приводим для справок удельный вес некоторых металлов:
Данный текст является ознакомительным фрагментом. Из книги автора1911 год «Эрнест Резерфорд… произвел величайшую перемену в нашем взгляде на материю со времен Демокрита».Английский физик АРТУР ЭДДИНГТОН Что волновало ученых? Наступление на атом продолжалось с новой силой.Вспомним «пудинг с изюмом» — модель атома, которую создал
Из книги автораГЛАВА 1. ТЕБЕ — МАЛО, МНЕ — В САМЫЙ РАЗ Среди множества причин, по которым я выбрала своей профессией физику, было желание сделать что?нибудь долговременное, даже вечное. Если, рассуждала я, мне предстоит вложить столько времени, энергии и энтузиазма в какое?то дело, то
Из книги автора3.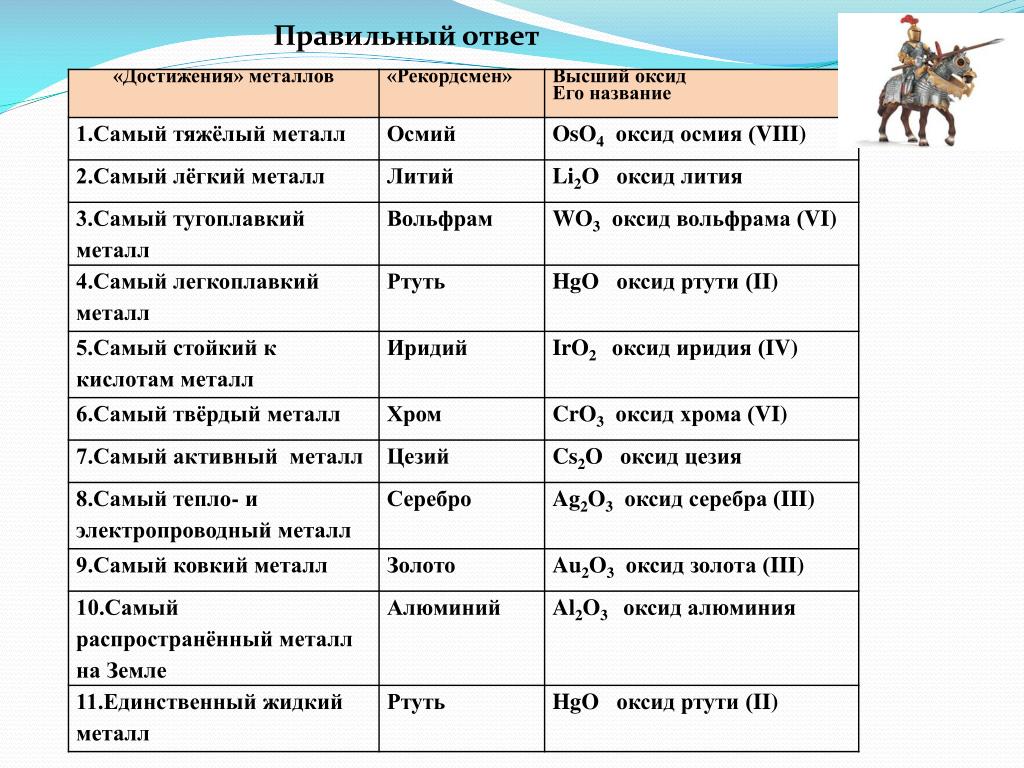 Самый большой в мире телескоп-рефрактор
Самый большой в мире телескоп-рефрактор установлен в 1897 году в Йеркской обсерватории университета в Чикаго (США). Его диаметр D = 102 сантиметра, а фокусное расстояние — 19,5 метра. Представляете, сколько места ему надо в
Самый большой в мире телескоп-рефрактор
Самый большой в мире телескоп-рефрактор установлен в 1897 году в Йеркской обсерватории университета в Чикаго (США). Его диаметр D = 102 сантиметра, а фокусное расстояние — 19,5 метра. Представляете, сколько места ему надо в
Какой металл самый легкий? Техники называют «легкими» все те металлы, которые легче железа в два и более раз. Самый распространенный легкий металл, применяемый в технике, – алюминий, который легче железа втрое. Еще легковеснее металл магний: он легче алюминия в 1 1/2 раза. В
Невероятные факты
Когда речь заходит о ювелирных украшениях многие из нас грезят об ослепительной жемчужине или о бриллиантах, в зависимости от размера своего бумажника. В большинстве случаев, цепочка или оправа, которые держат саму драгоценность, играют роль второй скрипки.
Однако, существует причина, по которой ваш сосед прячет золотые монеты, а отец запирает семейное серебро в сейф. Золото и серебро являются чрезвычайно ценными материалами из-за их редкости, высокого социально-экономического значения, не реакционной способности, способности противостоять коррозии и окислительным силам. Из года в год, даже из месяца в месяц цены на эти металлы колеблются значительно.
Из года в год, даже из месяца в месяц цены на эти металлы колеблются значительно.
Однако, помимо прочего, эти ценные металлы также используются в промышленных целях. К примеру, металлы платиновой группы используются для установки на лабораторное оборудование, стоматологические материалы и электронику. Драгоценные и ценные металлы также служат средством инвестиций. Важно отметить, что условная единица веса драгоценных металлов представляет собой тройскую унцию в размере 1,1 стандартной унции или 0,031 кг.
Давайте же посмотрим на самые ценные металлы в мире и поймем, что делает их такими особенными.
10. Индий
Если бы у драгоценных металлов была бы личность, то индий, вероятно, был бы плаксивым ребенком. Он очень мягкий (в прямом и переносном смысле), цвета индиго внутри (был назван в честь того, что его спектральная линия именно такого цвета) и издает своего рода «крик» при сгибании.
Индий – это редкий металл, который извлекается из цинковых, свинцовых, железных и медных руд. В своей чистой форме индий – это белый металл, который крайне податлив и очень блестящий. Впервые он широко использовался в ходе Второй мировой войны в качестве подшипников на авиационных двигателях. Индий также используется для создания устойчивых к коррозии зеркал, полупроводников, сплавов и электропроводности в различных устройствах.
В своей чистой форме индий – это белый металл, который крайне податлив и очень блестящий. Впервые он широко использовался в ходе Второй мировой войны в качестве подшипников на авиационных двигателях. Индий также используется для создания устойчивых к коррозии зеркал, полупроводников, сплавов и электропроводности в различных устройствах.
В 2009 году средняя цена на индий составляла 500 долларов за килограмм (15 за тройскую унцию), крупнейшими же его производителями считаются Китай, Южная Корея и Япония. С ростом цен на индий все популярней становится его переработка и дальнейшая утилизация.
9. Серебро
Серебро – это один из самых ценных металлов на земле. Этот блестящий белый металл в своей чистой форме является самым лучшим электрическим и термальным проводником, при этом у него самое низкое сопротивление.
Вам, вероятно, известны основные области применения серебра – ювелирные изделия, монеты, фотография, различные схемы, стоматология, батареи. Что касается необычных сфер применения, серебро может использоваться для того, чтобы предотвратить распространение бактерий на поверхности мобильного телефона, убрать неприятный запах из обуви, а также избежать появления плесени на обработанной древесине.
Что касается необычных сфер применения, серебро может использоваться для того, чтобы предотвратить распространение бактерий на поверхности мобильного телефона, убрать неприятный запах из обуви, а также избежать появления плесени на обработанной древесине.
Часто серебро используется в сплавах с медью, золотом и свинцово-цинковыми рудами. Крупнейшими производителями серебра считаются Перу, Китай, Мексика и Чили. Средняя цена на серебро составляет 432 доллара за килограмм (13,40 за тройскую унцию), хотя цены регулярно растут. В связи с большим количеством областей использования, серебро считается одним из самых ценных металлов в мире.
8. Рений
Хотя, возможно, рений не так известен, как золото и платина, серебристый рений – это один из самых плотных металлов, который занимает третье место по высоте точки плавления.
Из-за его подобных свойств, рений, открытый в 1925 году, используется в высокотемпературных газотурбинных двигателях. Этот металл также добавляется в никелевые жароустойчивые сплавы для улучшения сопротивляемости высоким температурам. Другие области применения – термопар, электроматериалы и т.д.
Другие области применения – термопар, электроматериалы и т.д.
Рений – побочный продукт молибдена, который, по существу, является побочным продуктом добычи меди. Чили, Казахстан и США возглавляют список стран, добывающих этот ценный металл. Цены на него значительно варьируются, чего только стоит последний скачок с 2419 долларов за килограмм до 4548 долларов.
7. Палладий
В 1803 году Уильям Хайд Волластон (William Hyde Wollaston) нашел способ отделения палладия от окружающих его платиновых руд. Этот серовато-белый драгоценный металл ценится за свою редкость, пластичность, устойчивость к высоким температурам, а также из-за способности поглощать большое количество водорода при комнатной температуре.
Палладий, названный в честь греческой богини Паллады, является одним из членов группы драгоценных металлов. Его ценные свойства пользуются высоким спросом, поэтому он используется в различных отраслях промышленности: производители автомобилей полагаются на него при изготовлении каталитических нейтрализаторов, которые регулируют уровень выбросов; ювелиры используют его для создания сплавов белого золота; производители электроники обрабатывают им покрытия своих устройств, поскольку палладий обладает хорошими проводящими функциями.
Хотя за последнее время цены на палладий подскочили, однако, средняя цена составляет 8483 доллара за килограмм (263 за тройскую унцию). Почти половина палладия изготавливается в России, далее следуют Южная Африка, США, Канада и другие страны.
6. Осмий
Осмий один из самых плотных элементов на земле, он голубовато-серебристого цвета и был открыт в 1803 году Смитсоном Теннантом (Smithson Tennant). Он также обнаружил и иридий (№5 в нашем списке). До настоящего времени не разрешен спор о том, какой из этих металлов более тяжелый (осмий или иридий).
Редко встречаемый осмий, как правило, находят в рудах других металлов платиновой группы, добывается он в некоторых регионах России, Северной и Южной Америки. Цена на него в среднем составляет 12700 долларов за килограмм.
Этот очень твердый металл имеет крайне высокую температуру плавления, поэтому обращаться с ним не так-то легко. По большей части осмий используется для упрочнения сплавов из платины в электрических контактах, волокнах и в других целях. Стоит отметить, что существуют опасности, связанные с обработкой осмия, поскольку он выделяет токсичные оксиды, которые могут спровоцировать появление раздражения на коже и повредить глаза.
Стоит отметить, что существуют опасности, связанные с обработкой осмия, поскольку он выделяет токсичные оксиды, которые могут спровоцировать появление раздражения на коже и повредить глаза.
5. Иридий
Этот металл, безусловно, является самым экстремальным членом платиновой группы. Он белого цвета, обладает удивительно высокой температурой плавления, является одним из самых плотных элементов и самым устойчивым к коррозии металлом. Вода, воздух, кислоты не имеют никакого реального воздействия на иридий.
Из-за подобных его свойств, он крайне сложно добывается и еще сложнее обрабатывается. Большую его часть поставляет Южная Африка, добывается он из платиновых руд и выступает в качестве побочного продукта добычи никеля. Средняя его цена за килограмм – 13548 долларов. Его уникальные черты позволяют этому твердому металлу вносить свой вклад в достижения в области медицины, электроники, автомобилестроения. Даже ювелиры пытаются использовать иридий в некоторых своих эксклюзивных творениях.
4. Рутений
Рутений, яркий серый металл, был открыт в 1844 году русским ученым Карлом Карловичем Клаусом. Этот член платиновой группы сохраняет многие характеристики своих «коллег», в том числе твердость, редкость и устойчивость к воздействию внешних элементов. При этом, плавится рутений при температуре 800 градусов Цельсия.
Рутений находится в аналогичных рудах платиновой группы в регионах России, Северной и Южной Америки, Канады. Цены на этот металл варьируются, в среднем он стоит 13548 долларов за килограмм (420 за тройскую унцию).
После сложного процесса химической обработки, металл может быть выделен и использован в различных целях. Его добавляют в сплав платины и палладия в целях повышения твердости (в ювелирных украшениях) и для лучшего сопротивления (с агрессивными компонентами, особенно с титаном). Рутений также стал весьма популярным в области электроники, как способ повышения эффективности электрических контактов.
3. Золото
Золото всегда было заветным товаром, оно заманивало всех – от египтян, которые украшали им древние гробы до золотоискателей 19 века, которые обследовали каждый кусочек побережья Калифорнии в поисках самородков.
Из-за его всеобщей желательности, прочности и пластичности, золото остается одним из самых популярных металлов, в том числе и для инвестиций. Средняя цена на золото в 2009 году составляла 30645 долларов за килограмм (950 за унцию), однако всего за год цена подскочила до 40290 долларов.
Крупнейшие шахты по добыче золота расположены в Южной Африке, США, Австралии и Китае. Обычно золото отделяется от окружающих его пород и минералов при помощи панорамирования, после чего оно становится готовым к различным химическим реакциям и плавке.
Помимо использования в ювелирных изделиях, его также применяют и в промышленности. Благодаря его проводимости, оно часто становится частью различных электроприборов, а его отражающая поверхность позволяет использовать его в защищающих от излучения щитах и для производства офисных окон.
2. Платина
Средняя цена на этот ослепительный серебристый металл составляет 38290 долларов за килограмм. Добываемая в большей степени в Южной Африке, России и Канаде, платина сделала себе имя благодаря своей гибкости, плотности и неагрессивным свойствам. Кроме того, как и палладий, платина может поглощать большое количество водорода.
Кроме того, как и палладий, платина может поглощать большое количество водорода.
Этот ценный металл стал широко применяться в ювелирной промышленности за его блестящий вид и хорошее сопротивление. Также платина используется в таких областях, как стоматология, аэронавтика и в производстве оружия.
1. Родий
Родий является одним из ценнейших металлов в мире. Этот блестящий, серебристого цвета металл обладает замечательными отражательными свойствами, именно поэтому его используют в производстве фар, зеркал и в финальной обработке ювелирных изделий.
Кроме того, родий очень ценен в автомобильной промышленности. Однако, за свою высокую температуру плавления, способность противостоять коррозии родий является важным элементом и в других отраслях промышленности. Этот чрезвычайно редкий и ценный металл добывается только в некоторых регионах. Около 60 процентов родия поставляет Южная Африка, далее следует Россия. Хотя на протяжении многих лет цена на этот металл снижается, он по-прежнему остается самым дорогим из существующих в настоящее время ценных металлов – средняя его цена составляет 46516 долларов за килограмм.
Осмий VS Иридий
Споры о том, какой из двух элементов таблицы Менделеева является более тяжелым, до сих пор не стихают. За это право состязаются два самых тяжелых элемента таблицы — Осмий (76) и Иридий (77). Плотность обоих элементов приблизительно равна 22,6 г/см 3 .
В отличие от явного лидера, среди лёгких металлов — с тяжелыми не всё так просто. Потому рассмотрим оба этих металла.
Иридий
Больше двух столетий прошло с тех пор, как появились первые сведения о платине – белом металле из Южной Америки. Долгое время люди были уверены, что это чистый металл, так же, как золото. Только в самом начале XIX в. Волластон сумел выделить из самородной платины палладий и родий, а в 1804 г. Теннант, изучая черный осадок, оставшийся после растворения самородной платины в царской водке, нашел в нем еще два элемента. Один из них он назвал осмием, а второй – иридием. Соли этого элемента в разных условиях окрашивались в различные цвета. Это свойство и было положено в основу названия: по-гречески слово ιρις, значит «радуга».
Русский химик
В 1841 г. известный русский химик профессор Карл Карлович Клаус занялся исследованием так называемых платиновых остатков, т.е. нерастворимого осадка, остающегося после обработки сырой платины царской водкой. «При самом начале работы, – писал Клаус, – я был удивлен богатством моего остатка, ибо извлек из него, кроме 10% платины, немалое количество иридия, родия, осмия, несколько палладия и смесь различных металлов особенного содержания»…
Клаус сообщил горному начальству о богатстве остатков. Власти заинтересовались открытием казанского ученого, которое сулило значительные выгоды. Из платины в то время чеканили монету, и получение драгоценного металла из остатков казалось очень перспективным. Через год Петербургский монетный двор выделил Клаусу полпуда остатков. Но они оказались бедными платиной, и ученый решил провести на них исследование, «интересное для науки».
«Два года, – писал Клаус, – занимался я постоянно этим трудным, продолжительным и даже вредным для здоровья исследованием» и в 1845 г. опубликовал работу «Химическое исследование остатков уральской платиновой руды и металла рутения». Это было первое систематическое исследование свойств аналогов платины. В нем впервые были описаны и химические свойства иридия.
опубликовал работу «Химическое исследование остатков уральской платиновой руды и металла рутения». Это было первое систематическое исследование свойств аналогов платины. В нем впервые были описаны и химические свойства иридия.
Клаус отмечал, что иридием он занимался больше, чем другими металлами платиновой группы. В главе об иридии он обратил внимание на неточности, допущенные Берцелиусом при определении основных констант этого элемента, и объяснил эти неточности тем, что маститый ученый работал с иридием, содержащим примесь рутения, тогда еще не известного химикам и открытого лишь в ходе «химического исследования остатков уральской платиновой руды и металла рутения».
Какой же он, иридий?
Атомная масса элемента №77 равна 192,2. В таблице Менделеева он находится между осмием и платиной. И в природе он встречается главным образом в виде осмистого иридия – частого спутника самородной платины. Самородного иридия в природе нет.
Иридий – серебристо-белый металл, очень твердый, тяжелый и прочный. По данным фирмы «Интернейшнл Никель и Ко», это самый тяжелый элемент: его плотность 22,65 г/см 3 , а плотность его постоянного спутника – осмия, второго по тяжести 22,61 г/см 3 . Правда, большинство исследователей придерживаются иной точки зрения: они считают, что иридий все-таки немного легче осмия.
По данным фирмы «Интернейшнл Никель и Ко», это самый тяжелый элемент: его плотность 22,65 г/см 3 , а плотность его постоянного спутника – осмия, второго по тяжести 22,61 г/см 3 . Правда, большинство исследователей придерживаются иной точки зрения: они считают, что иридий все-таки немного легче осмия.
Естественное свойство иридия (он же платиноид!) – высокая коррозионная стойкость. На него не действуют кислоты ни при нормальной, ни при повышенной температуре. Даже знаменитой царской водке монолитный иридий «не по зубам». Только расплавленные щелочи и перекись натрия вызывают окисление элемента №77.
Иридий стоек к действию галогенов. Он реагирует с ними с большим трудом и только при повышенной температуре. Хлор образует с иридием четыре хлорида: IrCl, IrCl 2 , IrCl 3 и IrCl 4 . Треххлористый иридий получается легче всего из порошка иридия, помещенного в струю хлора при 600°C. Единственное галоидное соединение, в котором иридий шестивалентен, – это фторид IrF 6 . Тонкоизмельченный иридий окисляется при 1000°C и в струе кислорода, причем в зависимости от условий могут получаться несколько соединений разного состава.
Как и все металлы платиновой группы, иридий образует комплексные соли. Среди них есть и соли с комплексными катионами, например Cl 3 и соли с комплексными анионами, например K 3 · 3H 2 O. Как комплексообразователь иридий похож на своих соседей по таблице Менделеева.
Чистый иридий получают из самородного осмистого иридия и из остатков платиновых руд (после того как из них извлечены платина, осмий, палладий и рутений). О технологии получения иридия распространяться не будем, отослав читателя к статьям «Родий», «Осмий» и «Платина».
Иридий получают в виде порошка, который затем прессуют в полуфабрикаты и сплавляют или же порошок переплавляют в электрических печах в атмосфере аргона. Чистый иридий в горячем состоянии можно ковать, однако при обычной температуре он хрупок и не поддается никакой обработке.
Иридий в деле
Из чистого иридия делают тигли для лабораторных целей и мундштуки для выдувания тугоплавкого стекла. Можно, конечно, использовать иридий и в качестве покрытия. Однако здесь встречаются трудности. Обычным электролитическим способом иридий на другой металл наносится с трудом, и покрытие получается довольно рыхлое. Наилучшим электролитом был бы комплексный гексахлорид иридия, однако он неустойчив в водном растворе, и даже в этом случае качество покрытия оставляет желать лучшего.
Однако здесь встречаются трудности. Обычным электролитическим способом иридий на другой металл наносится с трудом, и покрытие получается довольно рыхлое. Наилучшим электролитом был бы комплексный гексахлорид иридия, однако он неустойчив в водном растворе, и даже в этом случае качество покрытия оставляет желать лучшего.
Разработан метод получения иридиевых покрытий электролитическим путем из расплавленных цианидов калия и натрия при 600°C. В этом случае образуется плотное покрытие толщиной до 0,08 мм.
Менее трудоемко получение иридиевых покрытий методом плакирования. На основной металл укладывают тонкий слой металла-покрытия, а затем этот «бутерброд» идет под горячий пресс. Таким образом получают вольфрамовую и молибденовую проволоку с иридиевым покрытием. Заготовку из молибдена или вольфрама вставляют в иридиевую трубку и проковывают в горячем состоянии, а затем волочат до нужной толщины при 500…600°C. Эту проволоку используют для изготовления управляющих сеток в электронных лампах.
Можно наносить иридиевые покрытия на металлы и керамику химическим способом. Для этого получают раствор комплексной соли иридия, например с фенолом или каким-либо другим органическим веществом. Такой раствор наносят на поверхность изделия, которое затем нагревают до 350…400°C в контролируемой атмосфере, т.е. в атмосфере с регулируемым окислительно-восстановительным потенциалом. Органика в этих условиях улетучивается, или выгорает, а слой иридия остается на изделии.
Но покрытия – не главное применение иридия. Этот металл улучшает механические и физико-химические свойства других металлов. Обычно его используют, чтобы повысить их прочность и твердость. Добавка 10% иридия к относительно мягкой платине повышает ее твердость и предел прочности почти втрое. Если же количество иридия в сплаве увеличить до 30%, твердость сплава возрастет ненамного, но зато предел прочности увеличится еще вдвое – до 99 кг/мм 2 . Поскольку такие сплавы обладают исключительной коррозионной стойкостью, из них делают жаростойкие тигли, выдерживающие сильный нагрев в агрессивных средах. В таких тиглях выращивают, в частности, кристаллы для лазерной техники. Платино-иридиевые сплавы привлекают и ювелиров – украшения из этих сплавов красивы и почти не изнашиваются. Из платино-иридиевого сплава делают также эталоны, иногда – хирургический инструмент.
В таких тиглях выращивают, в частности, кристаллы для лазерной техники. Платино-иридиевые сплавы привлекают и ювелиров – украшения из этих сплавов красивы и почти не изнашиваются. Из платино-иридиевого сплава делают также эталоны, иногда – хирургический инструмент.
Спдавы иридия
В будущем сплавы иридия с платиной могут приобрести особое значение в так называемой слаботочной технике как идеальный материал для контактов. Каждый раз, когда происходит замыкание и размыкание обычного медного контакта, возникает искра; в результате поверхность меди довольно быстро окисляется. В контакторах для сильных токов, например для электродвигателей, это явление не очень вредит работе: поверхность контактов время от времени зачищают наждачной бумагой, и контактор вновь готов к работе. Но, когда мы имеем дело со слаботочной аппаратурой, например в технике связи, тонкий слой окиси меди весьма сильно влияет на всю систему, затрудняет прохождение тока через контакт. А именно в этих устройствах частота включений бывает особенно большой – достаточно вспомнить АТС (автоматические телефонные станции). Вот здесь-то и придут на помощь необгорающие платино-иридиевые контакты – они могут работать практически вечно! Жаль только, что эти сплавы очень дороги и пока их недостаточно.
Вот здесь-то и придут на помощь необгорающие платино-иридиевые контакты – они могут работать практически вечно! Жаль только, что эти сплавы очень дороги и пока их недостаточно.
Иридий добавляют не только к платине. Небольшие добавки элемента №77 к вольфраму и молибдену увеличивают прочность этих металлов при высокой температуре. Мизерная добавка иридия к титану (0,1%) резко повышает его и без того значительную стойкость к действию кислот. То же относится и к хрому. Термопары, состоящие из иридия и сплава иридия с родием (40% родия), надежно работают при высокой температуре в окислительной атмосфере. Из сплава иридия с осмием делают напайки для перьев авторучек и компасные иглы.
Резюмируя, можно сказать, что металлический иридий применяют главным образом из-за его постоянства – постоянны размеры изделий из металла, его физические и химические свойства, причем, если можно так выразиться, постоянны на высшем уровне.
Запасы на Земле
Как и другие металлы VIII группы, иридий может быть использован в химической промышленности в качестве катализатора. Иридиево-никелевые катализаторы иногда применяют для получения пропилена из ацетилена и метана. Иридий входил в состав платиновых катализаторов реакции образования окислов азота (в процессе получения азотной кислоты). Один из окислов иридия, IrO 2 , пытались применять в фарфоровой промышленности в качестве черной краски. Но слишком уж дорога эта краска…
Иридиево-никелевые катализаторы иногда применяют для получения пропилена из ацетилена и метана. Иридий входил в состав платиновых катализаторов реакции образования окислов азота (в процессе получения азотной кислоты). Один из окислов иридия, IrO 2 , пытались применять в фарфоровой промышленности в качестве черной краски. Но слишком уж дорога эта краска…
Запасы иридия на Земле невелики, его содержание в земной коре исчисляется миллионными долями процента. Невелико и производство этого элемента – не больше тонны в год. Во всем мире!
В связи с этим трудно предположить, что со временем в судьбе иридия наступят разительные перемены – он навсегда останется редким и дорогим металлом. Но там, где его применяют, он служит безотказно, и в этой уникальной надежности залог того, что наука и промышленность будущего без иридия не обойдутся.
Иридиевый сторож
Во многих химических и металлургических производствах, например в доменном, очень важно знать уровень твердых материалов в агрегатах. Обычно для такого контроля используют громоздкие зонды, подвешиваемые на специальных зондовых лебедках. В последние годы зонды стали заменять малогабаритными контейнерами с искусственным радиоактивным изотопом – иридием-192. Ядра 192 Ir испускают гамма-лучи высокой энергии; период полураспада изотопа равен 74,4 суток. Часть гамма-лучей поглощается шихтой, и приемники излучения фиксируют ослабление потока. Последнее пропорционально расстоянию, которое проходят лучи в шихте. Иридий-192 с успехом применяют и для контроля сварных швов; с его помощью па фотопленке четко фиксируются все непроваренные места и инородные включения. Гамма-дефектоскопы с иридием-192 используют также для контроля качества изделий из стали и алюминиевых сплавов.
Обычно для такого контроля используют громоздкие зонды, подвешиваемые на специальных зондовых лебедках. В последние годы зонды стали заменять малогабаритными контейнерами с искусственным радиоактивным изотопом – иридием-192. Ядра 192 Ir испускают гамма-лучи высокой энергии; период полураспада изотопа равен 74,4 суток. Часть гамма-лучей поглощается шихтой, и приемники излучения фиксируют ослабление потока. Последнее пропорционально расстоянию, которое проходят лучи в шихте. Иридий-192 с успехом применяют и для контроля сварных швов; с его помощью па фотопленке четко фиксируются все непроваренные места и инородные включения. Гамма-дефектоскопы с иридием-192 используют также для контроля качества изделий из стали и алюминиевых сплавов.
Эффект Мёссбауэра
В 1958 г. молодой физик из ФРГ Рудольф Мёссбауэр сделал открытие, обратившее на себя внимание всех физиков мира. Открытый Мёссбауэром эффект позволил с поразительной точностью измерять очень слабые ядерные явления. Через три года после открытия, в 1961 г. , Мёссбауэр получил за свою работу Нобелевскую премию. Впервые этот эффект обнаружен на ядрах изотопа иридий-192.
, Мёссбауэр получил за свою работу Нобелевскую премию. Впервые этот эффект обнаружен на ядрах изотопа иридий-192.
Сердце бьется активнее
Одно из наиболее интересных применений платино-иридиевых сплавов за последние годы – изготовление из них электрических стимуляторов сердечной деятельности. В сердце больного стенокардией вживляют электроды с платино-иридиевыми зажимами. Электроды соединены с приемником, который тоже находится в теле больного. Генератор же с кольцевой антенной находится снаружи, например в кармане больного. Кольцевая антенна крепится на теле напротив приемника. Когда больной чувствует, что наступает приступ стенокардии, он включает генератор. В кольцевую антенну поступают импульсы, которые передаются в приемник, а от него – на платино-придиевые электроды. Электроды, передавая импульсы на нервы, заставляют сердце биться активнее. Сейчас в СССР многие станции скорой помощи оборудованы подобными генераторами. В случае остановки сердца делают надрез ключичной вены, вводят в нее соединенный с генератором электрод, включают генератор, и через несколько минут сердце вновь начинает работать.
Изотопы – стабильные и нестабильные
В предыдущих заметках довольно много говорилось о радиоизотопе иридий-192, применяемом в многочисленных приборах и даже причастном к важному научному открытию. Но, кроме иридия-192, у этого элемента есть еще 14 радиоактивных изотопов с массовыми числами от 182 до 198. Самый тяжелый изотоп в то же время – самый короткоживущий, его период полураспада меньше минуты. Изотоп иридий-183 интересен лишь тем, что его период полураспада – ровно один час. Стабильных же изотопов у иридия всего два. На долю более тяжелого – иридия-193 в природной смеси приходится 62,7%. Доля легкого иридия-191 соответственно 37,3%.
Полезные хлориридаты
Хлориридатами называют комплексные хлориды четырехвалентного иридия; общая их формула Me 2 . Благодаря хлориридатам можно в принципе уверенно разделять соединения таких похожих элементов, как натрий и калий. Хлориридат натрия растворим в воде, а хлориридат калия – практически нерастворим. Но для такой операции хлориридаты слишком дороги, так как дорог исходный иридий. Это не значит однако, что хлориридаты вообще бесполезны. Способность иридия образовывать эти соединения используют для выделения элемента №77 из смеси платиновых металлов.
Это не значит однако, что хлориридаты вообще бесполезны. Способность иридия образовывать эти соединения используют для выделения элемента №77 из смеси платиновых металлов.
Если с точки зрения практики элемент №76 среди прочих платиновых металлов выглядит достаточно заурядно, то с точки зрения классической химии (подчеркиваем, классической неорганической химии, а не химии комплексных соединений) этот элемент весьма знаменателен.
Прежде всего, для него, в отличие от большинства элементов VIII группы, характерна валентность 8+, и он образует с кислородом устойчивую четырехокись OsO 4 . Это своеобразное соединение, и, видимо, не случайно элемент №76 получил название, в основу которого положено одно из характерных свойств его четырехокиси.
Осмий обнаруживают по запаху
Подобное утверждение может показаться парадоксальным: ведь речь идет не о галогене, а о платиновом металле…
История открытия четырех из пяти платиноидов связана с именами двух английских ученых, двух современников. Уильям Волластон в 1803…1804 гг. открыл палладий и родий, а другой англичанин, Смитсон Теннант (1761…1815), в 1804 г. – иридий и осмий. Но если Волластон оба «свои» элемента нашел в той части сырой платины, которая растворялась в царской водке, то Теннанту повезло при работе с нерастворимым остатком: как оказалось, он представлял собой естественный природный сплав иридия с осмием.
Уильям Волластон в 1803…1804 гг. открыл палладий и родий, а другой англичанин, Смитсон Теннант (1761…1815), в 1804 г. – иридий и осмий. Но если Волластон оба «свои» элемента нашел в той части сырой платины, которая растворялась в царской водке, то Теннанту повезло при работе с нерастворимым остатком: как оказалось, он представлял собой естественный природный сплав иридия с осмием.
Тот же остаток исследовали и три известных французских химика – Колле-Дескоти, Фуркруа и Воклен. Они начали свои исследования даже раньше Теннанта. Как и он, они наблюдали выделение черного дыма при растворении сырой платины. Как и он, они, сплавив нерастворимый остаток с едким кали, сумели получить соединения, которые все-таки удавалось растворить. Фуркруа и Воклен были настолько убеждены, что в нерастворимом остатке сырой платины есть новый элемент, что заранее дали ему имя – птен – от греческого πτηνος – крылатый. Но только Теннанту удалось разделить этот остаток и доказать существование двух новых элементов – иридия и осмия.
Название элемента №76 происходит от греческого слова οσμη, что означает «запах». Неприятный раздражающий запах, похожий одновременно на запахи хлора и чеснока, появлялся, когда растворяли продукт сплавления осмиридия со щелочью. Носителем этого запаха оказался осмиевый ангидрид, или четырехокись осмия OsO 4 . Позже выяснилось, что так же скверно, хотя и значительно слабее, может пахнуть и сам осмий. Тонкоизмельченный, он постепенно окисляется на воздухе, превращаясь в OsO 4 …
Осмий металлический
Осмий – оловянно-белый металл с серовато-голубым оттенком. Это самый тяжелый из всех металлов (его плотность 22,6 г/см 3) и один из самых твердых. Тем не менее осмиевую губку можно растереть в порошок, поскольку он хрупок. Плавится осмий при температуре около 3000°C, а температура его кипения до сих пор точно не определена. Полагают, что она лежит где-то около 5500°C.
Большая твердость осмия (7,0 по шкале Мооса), пожалуй, то из его физических свойств, которое используют наиболее широко. Осмий вводят в состав твердых сплавов, обладающих наивысшей износостойкостью. У дорогих авторучек напайку на кончик пера делают из сплавов осмия с другими платиновыми металлами или с вольфрамом и кобальтом. Из подобных же сплавов делают небольшие детали точных измерительных приборов, подверженные износу. Небольшие – потому что осмий мало распространен (5·10 –6 % веса земной коры), рассеян и дорог. Этим же объясняется ограниченное применение осмия в промышленности. Он идет лишь туда, где при малых затратах металла можно получить большой эффект. Например, в химическую промышленность, которая пытается использовать осмий как катализатор. В реакциях гидрогенизации органических веществ осмиевые катализаторы даже эффективнее платиновых.
Осмий вводят в состав твердых сплавов, обладающих наивысшей износостойкостью. У дорогих авторучек напайку на кончик пера делают из сплавов осмия с другими платиновыми металлами или с вольфрамом и кобальтом. Из подобных же сплавов делают небольшие детали точных измерительных приборов, подверженные износу. Небольшие – потому что осмий мало распространен (5·10 –6 % веса земной коры), рассеян и дорог. Этим же объясняется ограниченное применение осмия в промышленности. Он идет лишь туда, где при малых затратах металла можно получить большой эффект. Например, в химическую промышленность, которая пытается использовать осмий как катализатор. В реакциях гидрогенизации органических веществ осмиевые катализаторы даже эффективнее платиновых.
Несколько слов о положении осмия среди прочих платиновых металлов. Внешне он мало от них отличается, но именно у осмия самые высокие температуры плавления и кипения среди всех металлов этой группы, именно он наиболее тяжел. Его же можно считать наименее «благородным» из платиноидов, поскольку кислородом воздуха он окисляется уже при комнатной температуре (в мелкораздробленном состоянии). А еще осмий – самый дорогой из всех платиновых металлов. Если в 1966 г. платина ценилась на мировом рынке в 4,3 раза дороже, чем золото, а иридий – в 5,3, то аналогичный коэффициент для осмия был равен 7,5.
А еще осмий – самый дорогой из всех платиновых металлов. Если в 1966 г. платина ценилась на мировом рынке в 4,3 раза дороже, чем золото, а иридий – в 5,3, то аналогичный коэффициент для осмия был равен 7,5.
Как и прочие платиновые металлы, осмий проявляет несколько валентностей: 0, 2+, 3+, 4+, 6+ и 8 +. Чаще всего можно встретить соединения четырех- и шестивалентного осмия. Но при взаимодействии с кислородом он проявляет валентность 8+.
Как и прочие платиновые металлы, осмий – хороший комплексообразователь, и химия соединений осмия не менее разнообразна, чем, скажем, химия палладия или рутения.
Ангидрид и другие
Несомненно, самым важным соединением осмия остается его четырехокись OsO 4 , пли осмиевый ангидрид. Как и элементарный осмий, OsO 4 обладает каталитическими свойствами; OsO 4 применяют при синтезе важнейшего современного лекарственного препарата – кортизона. При микроскопических исследованиях животных и растительных тканей четырехокись осмия используют как окрашивающий препарат.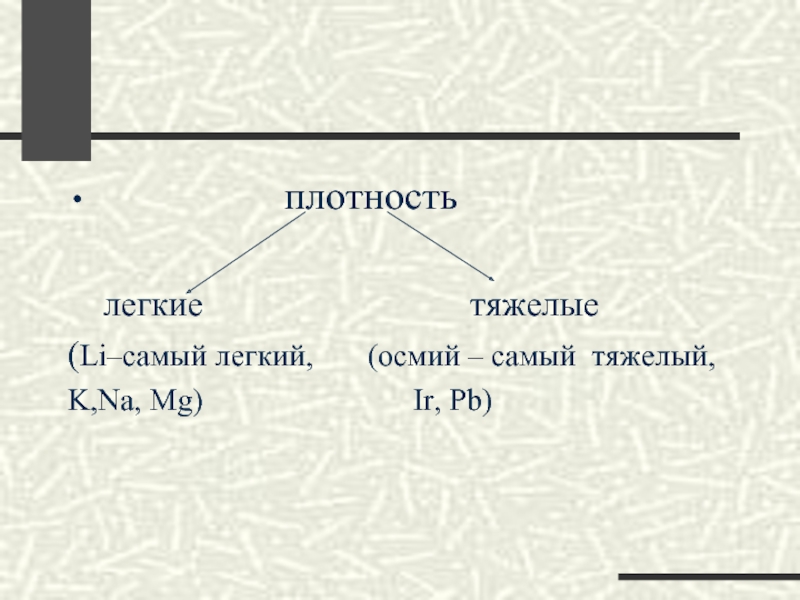 OsO 4 очень ядовит, он сильно раздражает кожу, слизистые оболочки и особенно вреден для глаз. Любая работа с этим полезным веществом требует чрезвычайной осторожности.
OsO 4 очень ядовит, он сильно раздражает кожу, слизистые оболочки и особенно вреден для глаз. Любая работа с этим полезным веществом требует чрезвычайной осторожности.
Внешне чистая четырехокись осмия выглядит достаточно обычно – бледно-желтые кристаллы, растворимые в воде и четыреххлористом углероде. При температуре около 40°C (есть две модификации OsO 4 с близкими точками плавления) они плавятся, а при 130°C четырехокись осмия закипает.
Другой окисел осмия – OsO 2 – нерастворимый в воде черный порошок – практического значения не имеет. Также не нашли пока практического применения и другие известные соединения элемента №76 – его хлориды и фториды, иодиды и оксихлориды, сульфид OsS 2 и теллурид OsTe 2 – черные вещества со структурой пирита, а также многочисленные комплексы и большинство сплавов осмия. Исключение составляют лишь некоторые сплавы элемента №76 с другими платиновыми металлами, вольфрамом и кобальтом. Главный их потребитель – приборостроение.
Как получают осмий
Самородный осмий в природе не найден. Он всегда связан в минералах с другим металлом платиновой группы – иридием. Существует целая группа минералов осмистого иридия. Самый распространенный из них – невьянскит, природный сплав этих двух металлов. Иридия в нем больше, поэтому невьянскит часто называют просто осмистым иридием. Зато другой минерал – сысертскит – называют иридистым осмием – в нем больше осмия… Оба эти минерала – тяжелые, с металлическим блеском, и это не удивительно – таков их состав. И само собой разумеется, все минералы группы осмистого иридия очень редки.
Он всегда связан в минералах с другим металлом платиновой группы – иридием. Существует целая группа минералов осмистого иридия. Самый распространенный из них – невьянскит, природный сплав этих двух металлов. Иридия в нем больше, поэтому невьянскит часто называют просто осмистым иридием. Зато другой минерал – сысертскит – называют иридистым осмием – в нем больше осмия… Оба эти минерала – тяжелые, с металлическим блеском, и это не удивительно – таков их состав. И само собой разумеется, все минералы группы осмистого иридия очень редки.
Иногда эти минералы встречаются самостоятельно, чаще же осмистый иридий входит в состав самородной сырой платины. Основные запасы этих минералов сосредоточены в СССР (Сибирь, Урал), США (Аляска, Калифорния), Колумбии, Канаде, странах Южной Африки.
Естественно, что добывают осмий совместно с платиной, но аффинаж осмия существенно отличается от способов выделения других платиновых металлов. Все их, кроме рутения, осаждают из растворов, осмий же получают отгонкой его относительно летучей четырехокиси.
Но прежде чем отгонять OsO 4 , нужно отделить от платины осмистый иридий, а затем разделить иридий и осмий.
Когда платину растворяют в царской водке, минералы группы осмистого иридия остаются в осадке: даже этот из всех растворителей растворитель не может одолеть эти устойчивейшие природные сплавы. Чтобы перевести их в раствор, осадок сплавляют с восьмикратным количеством цинка – этот сплав сравнительно просто превратить в порошок. Порошок спекают с перекисью бария BaO 3 , а затем полученную массу обрабатывают смесью азотной и соляной кислот непосредственно в перегонном аппарате – для отгонки OsO 4 .
Ее улавливают щелочным раствором и получают соль состава Na 2 OsO 4 . Раствор этой соли обрабатывают гипосульфитом, после чего осмий осаждают хлористым аммонием в виде соли Фреми Cl 2 . Осадок промывают, фильтруют, а затем прокаливают в восстановительном пламени. Так получают пока еще недостаточно чистый губчатый осмий.
Затем его очищают, обрабатывая кислотами (HF и HCl), и довосстанавливают в электропечи в струе водорода. После охлаждения получают металл чистотой до 99,9% O 3 .
После охлаждения получают металл чистотой до 99,9% O 3 .
Такова классическая схема получения осмия – металла, который применяют пока крайне ограниченно, металла очень дорогого, но достаточно полезного.
Чем больше, тем… больше
Природный осмий состоит из семи стабильных изотопов с массовыми числами 184, 186…190 и 192. Любопытная закономерность: чем больше массовое число изотопа осмия, тем больше он распространен. Доля самого легкого изотопа, осмия-184, – 0,018%, а самого тяжелого, осмия-192, – 41%. Из искусственных радиоактивных изотопов элемента №76 самый долгоживущий – осмий-194 с периодом полураспада около 700 дней.
Карбонилы осмия
В последние годы химиков и металлургов все больше интересуют карбонилы – соединения металлов с СО, в которых металлы формально нульвалентны. Карбонил никеля уже довольно широко применяется в металлургии, и это позволяет надеяться, что и другие подобные соединения со временем смогут облегчить получение тех или иных ценных материалов. Для осмия сейчас известны два карбонила. Пентакарбонил Os(CO) 5 – в обычных условиях бесцветная жидкость (температура плавления – 15°C). Получают его при 300°C и 300 атм. из четырехокиси осмия и угарного газа. При обычных температуре и давлении Os(CO) 5 постепенно переходит в другой карбонил состава Os 3 (CO) 12 – желтое кристаллическое вещество, плавящееся при 224°C. Интересно строение этого вещества: три атома осмия образуют равносторонний треугольник с гранями длиной 2,88 Ǻ, а к каждой вершине этого треугольника присоединены по четыре молекулы СО.
Для осмия сейчас известны два карбонила. Пентакарбонил Os(CO) 5 – в обычных условиях бесцветная жидкость (температура плавления – 15°C). Получают его при 300°C и 300 атм. из четырехокиси осмия и угарного газа. При обычных температуре и давлении Os(CO) 5 постепенно переходит в другой карбонил состава Os 3 (CO) 12 – желтое кристаллическое вещество, плавящееся при 224°C. Интересно строение этого вещества: три атома осмия образуют равносторонний треугольник с гранями длиной 2,88 Ǻ, а к каждой вершине этого треугольника присоединены по четыре молекулы СО.
Фториды спорные и бесспорные
«Фториды OsF 4 , OsF 6 , OsF 8 образуются из элементов при 250…300°C… OsF 8 – самый летучий из всех фторидов осмия, т. кип. 47,5°»… Эта цитата взята из III тома «Краткой химической энциклопедии», выпущенного в 1964 г. Но в III томе «Основ общей химии» Б.В. Некрасова, вышедшем в 1970 г., существование октафторида осмия OsF 8 отвергается. Цитируем: «В 1913 г. были впервые получены два летучих фторида осмия, описанные как OsF 6 и OsF 8 . Так и считалось до 1958 г., когда выяснилось, что в действительности они отвечают формулам OsF 5 и OsF 6 . Таким образом, 45 лет фигурировавший в научной литературе OsF 8 на самом деле никогда не существовал. Подобные случаи «закрытия» ранее описанных соединений встречаются не так уж редко».
Так и считалось до 1958 г., когда выяснилось, что в действительности они отвечают формулам OsF 5 и OsF 6 . Таким образом, 45 лет фигурировавший в научной литературе OsF 8 на самом деле никогда не существовал. Подобные случаи «закрытия» ранее описанных соединений встречаются не так уж редко».
Заметим, что и элементы тоже иногда приходится «закрывать»… Остается добавить, что, помимо упомянутых в «Краткой химической энциклопедии», был получен еще один фторид осмия – нестойкий OsF 7 . Это бледно-желтое вещество при температуре выше –100°C распадается на OsF 6 и элементарный фтор.
По материалам n-t.ru
Если вы думаете, что самый тяжелый металл на Земле — это ртуть, то вы ошибаетесь! Дело в том, что на сей день есть два главных кандидата на эту «должность»: Осмий (Os), имеющий атомную массу 76, а также иридий (Ir), обладающий атомным весом 77. Оба металла относятся к группе платиноидов, а потому (что вполне логично) имеют крайне высокую плотность. Говоря откровенно, сложно сказать, какой самый тяжелый металл: учитывая все погрешности, можно считать, что их масса разнится на тысячные доли.
Иридий
Если говорить об иридии, то этот замечательный металл был обнаружен еще в далеком 1803 году. Принадлежит это великое открытие англичанину по имени Смитсон Теннат. Несложно понять, что впервые следы этого металла сей талантливый химик обнаружил как раз в полиметаллической руде, содержащей свинец, платину, серебро… а также иридий. Само название этого вещества, которое претендует на звание «самый тяжелый металл в мире» можно перевести с древнегреческого наречия как «радуга».
Где содержится иридий
Нужно сказать, что находка эта была бы уникальной даже для нашего времени, так как в земной коре иридия содержатся ничтожно малые доли, тогда как намного чаще его находят в местах падения метеоритов. Но ученые говорят, что сей самый тяжелый металл мог бы быть распространен на поверхности нашей планеты в куда больших объемах, если бы не его атомарная масса. Считается, что во время зарождения Земли большая его часть попросту «уплыла» в направлении земного ядра, продавливая мягкую на то время породу своей массой.
Особенности иридия
Особенность сего тяжелого металла в том, что он невероятно сложно поддается любой обработке и обладает впечатляющей химической инертностью. Даже если опустить кусок иридия в знаменитую «царскую водку», то он не обратит на это ни малейшего внимания! Изотоп иридия «192m2» широко распространен в промышленности. Особенно широко этот самый тяжелый металл используется палеонтологами, которые используют его для определения найденных в толще земли артефактов искусственного происхождения.
Осмий
Кстати, осмий был открыт в 1804 году, то есть ровно на год позже открытия иридия. Как и в предыдущем случае, был обнаружен в полиметаллической руде. Обнаружили его случайно: в растворе царской водки и руды остался какой-то осадок, которого там быть не могло. Осмий, ничем в том не отличаясь от своего «собрата», практически невозможно подвергнуть механической обработке. Он также часто встречается в метеоритах, но и на самой земле его немало: есть довольно крупные месторождения в нашей стране и в США, а наиболее крупная его добыча ведется в ЮАР. Этот самый тяжелый металл чаще всего применяют в производстве ламп накаливания и иных приборов, в которых необходимы тугоплавкие материалы. Из-за исключительной прочности используется он и для производства лучших хирургических инструментов.
Этот самый тяжелый металл чаще всего применяют в производстве ламп накаливания и иных приборов, в которых необходимы тугоплавкие материалы. Из-за исключительной прочности используется он и для производства лучших хирургических инструментов.
Использование осмия
Чаще всего в промышленности и науке используется изотоп осмия 187. Его часто применяют для определения возраста метеоритов железной природы. Кстати, в отличие от «натурального» осмия единственное его месторождение есть в Казахстане, причем из-за его редкости один грамм данного вещества стоит более десятка тысяч долларов.
В настоящее время уже известно 126 химических элементов. Но самыми тяжелыми среди них принято считать Осмий (Os) и Иридий (Ir). Оба эти элемента являются переходными металлами и принадлежат к группе платины. Их порядковые номера в Периодической системе И.П. Менделеева 76 и 77 соответственно. Являясь очень твердыми, оба металла по плотности можно сравнить между собой. Это обусловлено тем, что значения плотности были выведены чисто теоретически (22,562 г/см³ (Ir) и 22,587 г/см³ (Os)). А при подобных вычислениях всегда существует погрешность (± 0,009 г/см³ для обоих расчетов).
А при подобных вычислениях всегда существует погрешность (± 0,009 г/см³ для обоих расчетов).
История открытия
Открытие этих элементов связано с именем английского ученого С. Теннанта. В 1803г. он изучал свойства платины. И при проведении реакции этого металла на смесь кислот («царскую водку») был выделен нерастворимый осадок, состоявший из примесей. Изучая эту субстанцию, С. Теннант и выделил новые элементы, названные им «иридий» и «осмий».
Название «иридий» («радуга») элемент получил за то, что у его солей встречались разнообразные расцветки. А «осмий» («запах») был так назван благодаря резкому, близкому к озону, запаху оксида осмия OsO4.
Свойства
Как осмий, так и иридий практически не поддаются обработке. Имеют очень высокую температуру плавления. В компактной форме они не вступают в реакции с активными средами, такими как кислоты, щелочи или смеси кислот. Эти свойства наблюдаются у осмия при температурах до 100°C, а у иридия – до 400°C.
Распространение
Наиболее часто добываемая форма этих элементов — осмистый иридий. Этот сплав в основном встречается в местах разработки природной платины и золота. Еще одним местом, где часто находят иридий и осмий, являются железные метеориты. Осмий без иридия в природе практически не встречается. Тогда как иридий находят в сочетаниях с другими металлами. Например, в соединениях с рутением или родием. Однако при этом иридий остается одним из самых нераспространенных химических элементов на нашей планете. Его промышленная добыча в мире не превышает 3 тонн в год.
На данный момент регионы, являющиеся основными источниками добычи иридия и осмия считаются Калифорния, Аляска (США), Сибирь (Россия), Бушвельд (ЮАР), Австралия, Новая Гвинея, Канада.
Фото самых тяжелых металлов
Видео самых тяжелых металлов
Самый тяжелый металл | Рекорды мира
В настоящее время уже известно 126 химических элементов. Но самыми тяжелыми среди них принято считать Осмий (Os) и Иридий (Ir). Оба эти элемента являются переходными металлами и принадлежат к группе платины. Их порядковые номера в Периодической системе И.П. Менделеева 76 и 77 соответственно. Являясь очень твердыми, оба металла по плотности можно сравнить между собой. Это обусловлено тем, что значения плотности были выведены чисто теоретически (22,562 г/см³ (Ir) и 22,587 г/см³ (Os)). А при подобных вычислениях всегда существует погрешность (± 0,009 г/см³ для обоих расчетов).
Оба эти элемента являются переходными металлами и принадлежат к группе платины. Их порядковые номера в Периодической системе И.П. Менделеева 76 и 77 соответственно. Являясь очень твердыми, оба металла по плотности можно сравнить между собой. Это обусловлено тем, что значения плотности были выведены чисто теоретически (22,562 г/см³ (Ir) и 22,587 г/см³ (Os)). А при подобных вычислениях всегда существует погрешность (± 0,009 г/см³ для обоих расчетов).
История открытия
Открытие этих элементов связано с именем английского ученого С. Теннанта. В 1803г. он изучал свойства платины. И при проведении реакции этого металла на смесь кислот («царскую водку») был выделен нерастворимый осадок, состоявший из примесей. Изучая эту субстанцию, С. Теннант и выделил новые элементы, названные им «иридий» и «осмий».
Название «иридий» («радуга») элемент получил за то, что у его солей встречались разнообразные расцветки. А «осмий» («запах») был так назван благодаря резкому, близкому к озону, запаху оксида осмия OsO4.
Свойства
Как осмий, так и иридий практически не поддаются обработке. Имеют очень высокую температуру плавления. В компактной форме они не вступают в реакции с активными средами, такими как кислоты, щелочи или смеси кислот. Эти свойства наблюдаются у осмия при температурах до 100°C, а у иридия – до 400°C.
Распространение
Наиболее часто добываемая форма этих элементов — осмистый иридий. Этот сплав в основном встречается в местах разработки природной платины и золота. Еще одним местом, где часто находят иридий и осмий, являются железные метеориты. Осмий без иридия в природе практически не встречается. Тогда как иридий находят в сочетаниях с другими металлами. Например, в соединениях с рутением или родием. Однако при этом иридий остается одним из самых нераспространенных химических элементов на нашей планете. Его промышленная добыча в мире не превышает 3 тонн в год.
На данный момент регионы, являющиеся основными источниками добычи иридия и осмия считаются Калифорния, Аляска (США), Сибирь (Россия), Бушвельд (ЮАР), Австралия, Новая Гвинея, Канада.
Фото самых тяжелых металлов
Видео самых тяжелых металлов
Возможно, вам понравятся следующие статьи
Еще интересные рекорды:
Металлы тяжелые — Справочник химика 21
Металлургию делят на ч е р н у ю (получение железа и его сплавов) и цветную (получение цветных металлов). Цветная металлургия занимается получением легких (алюминий, магний, титан, щелочные металлы), тяжелых (медь, свинец, цинк, олово) и благородных (золото, серебро, платиновая группа) металлов. Современная металлургия получает более 75 металлов и много- [c.142] Плотность металлов изменяется в широких пределах. Самый легкий из них (литий) имеет плотность 0,53 г/см , самый тяжелый (осмий) —22,5 г/см . Почти все металлы тяжелее воды. Металлы, имеющие плотность менее 3 г/см , называют легкими, а имеющие плотность 8—10 г/см и более — тяжелыми. К первым относятся, например, магиий и алюминий, ко вторым — серебро, свинец, ртуть. [c.166]
Почти все металлы тяжелее воды. Металлы, имеющие плотность менее 3 г/см , называют легкими, а имеющие плотность 8—10 г/см и более — тяжелыми. К первым относятся, например, магиий и алюминий, ко вторым — серебро, свинец, ртуть. [c.166]
Свинец — темно-серый мягкий металл, тяжелый, с невысокой температурой плавления и типичной для металлов электрической проводимостью. [c.275]
Металлам присущи характерные признаки, проявляющиеся, как правило, одновременно. Почти все металлы тяжелее воды, твердые вещества в компактном состоянии. Им присущ так называемый металлический блеск. Большинство из них — серые или белые, но медь, цезий и золото — красного или желтого цвета В высокодисперсном состоянии металлы обычно имеют черный цвет и не блестят. [c.318]
Актиноиды — металлы тяжелые. Плотность их возрастает от тория к нептунию, а затем падает. Металлы с порядковыми номерами 97 и выше в чистом виде еще не получены. [c.63]
[c.63]
Графит и дизельное топливо Сульфированная жирная кислота Жирная кислота Спирт с длинной цепью Мыло тяжелого металла Тяжелый алкилат Нефтяной сульфонат Детергент марки X для бурового раствора Детергент марки раствора Детергент марки раствора Силикат [c.336]
Р. используют, наряду с указанными выше областями применения, при получении азота и кислорода из воздуха (см. Воздуха разделение), ряда чистых металлов, тяжелой воды, в пром-сти орг. синтеза и др. В лаб. практике применяют в осн. те же, что и в пром-сти, способы Р., проводимой в [c.235]
Накопление тяжелых металлов Тяжелые металлы в воде, в донных отложениях, а также в гидробионтах Методы спектрального анализа [c.453]
Серебристо-белый металл тяжелый, низкоплавкий, мягкий, ковкий. Во влажном воздухе покрывается устойчивой оксидной пленкой. Не реагирует со щелочами. Восстановитель реагирует с водяным паром, сильными кислотами, [c. 305]
305]
Серебристо-белый металл тяжелый, мягкий, радиоактивный. Реакционноспособный реагирует с кислородом, на воздухе покрывается оксидной пленкой. Сильный восстановитель реагирует с водой, разбавленными кислотами. Ион f в растворе бесцветен, заметно гидролизуется. Синтезирован (наиболее устойчивый изотоп С0 бомбардировкой кюрия нейтронами в ядерном реакторе. Выделен в виде СГгОз. Получение — восстановление СГгОз литием при нагревании. [c.350]
Новый металл, тяжелый и тугоплавкий, внешне был похож на платину На него не действовали кислоты (кроме азотной), но он химически растворялся в пероксиде водорода Загораясь на воздухе, порошкообраз ный металл превращался в летучий оксид состава МдО Какой это ме талл [c.214]
Тяжелые металлы. Тяжелые металлы часто поступают в водные экосистемы с промышленными сточными водами и осадками кислых шахтных сточных вод. В лабораторных исследованиях, рассматривающих влияние па водоросли и простейших ряда металлов (цинк, медь, кадмий, литий, хром, ртуть, никель, свинец), получены цепные, хотя и разноречивые, результаты. [c.218]
[c.218]
Простые вещества. Физические и химические свойства. В компактном состоянии все платиноиды представляют собой серебристо-белые металлы, по внешнему виду напоминающие серебро. Эти металлы мономорфны и образуют плотноупакованные кристаллические структуры с к.ч. 12. При этом элементы первой вертикальной диады (Ей, Оз) кристаллизуются в ГПУ-структуре, а остальные формируют ГЦК-решетку. Первая триада относится к так называемым легким платиноидам. Металлы второй триады называются тяжелыми платиноидами. Они являются самыми плотными из всех металлов. Тяжелые платиноиды имеют более высокие температуры плавления, чем легкие. Наиболее пластичны металлы последней вертикальной диады (Р[c.497]
Особое внимание уделяется синтезу, изучению и применению новых экстрагентов. При этом преследуется несколько целей. Главная — нахождение очень избирательных соединений, однако решаются и задачи подбора групповых экстрагентов, например на платиновые металлы, тяжелые металлы, содержащиеся в объектах окружающей среды, и т. д. В случае возмож- [c.7]
д. В случае возмож- [c.7]
Если в электродиализной установке, в которой протекает раствор, содержащий хлориды, сульфаты, щелочные металлы, тяжелые металлы и щелочноземельные элементы, для промывки электродов выбран чистый сульфат натрия, то высокоселективные мембраны, играющие роль ловушек, должны быть размещены следующим образом, начиная с анодного конца установки (рис. 6.24) вначале устанавливается анионитовая мембрана 1, которая служит ловушкой для всех катионов за ней следует катионитовая мембрана, или [c.237]
На производственных базах монтажных управлений и на монтажных площадках правка и гибка металла тяжелого профиля производятся специальными винтовыми или клиновыми скобами. [c.72]
На заводах по изготовлению металлоконструкций и нестандартного оборудования для разделки листа, как правило, применяются специальные резательные машины, и только резка металла тяжелого профиля производится вручную с применением ряда приспособлений и шаблонов. [c.85]
[c.85]
Непонятные изменения веса веществ при горении, как выяснилось, связаны с появлением или исчезновением газов во время горения. Хотя существование газов было установлено очень давно и еще за век до Ван Гельмонта (см. гл. 1) началось медленное накопление знаний о газах, даже во времена Шталя химики, принимая -сам факт существования газов, фактически не обращали на них икакого внимания. Размышляя над причинами изменения веса веществ в процессе горения, исследователи принимали в расчет только твердые тела и жидкости. Понятно, что зола легче дерева, так как при горении дерева выделяются пары. Но что это за пары, ян кто из химиков сказать не мог. Ржавый металл тяжелее исходного еталла. Может быть, при ржавлении металл получает что-то из воздуха Ответа не было. [c.39]
Серебристо-белый металл тяжелый, мягкий, пластичный, радиоактивный. Во влажном воздухе покрывается оксидной пленкой. Пассивируется в холодной воде, концентрированных серной и азотной кислотах.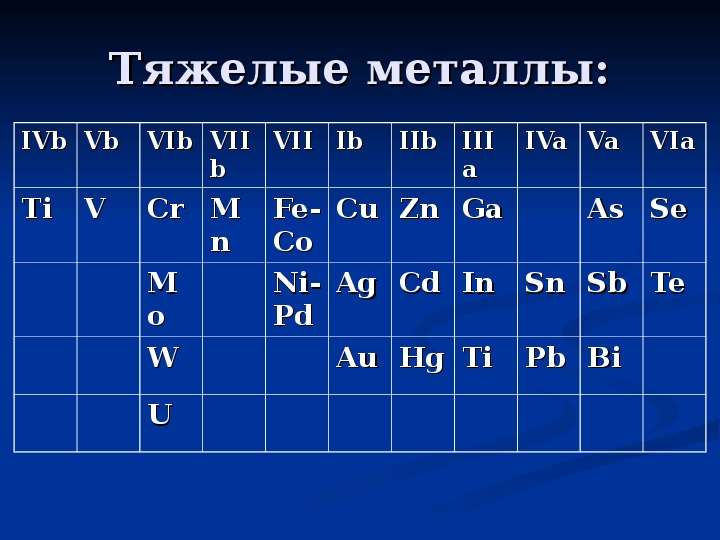 Не реагирует со щелочами, гщфатом аммиака. Сильный восстановитель реагирует с горячей водой, хлороводородной кислотой, разбавленными серной и азотной кислотами. Сильными окислителями переводится в оксокатионы. Катион Np имеет темно-красную окраску, катион Np — желто-зеленую. Синтезирован (наиболее устойчивый изотоп Np) бомбардировкой нейтронами урана в ядерном реакторе. Выделен в виде NpFj и Npp4. Получение — восстановление кальцием или барием этих фторидов при нагревании. [c.346]
Не реагирует со щелочами, гщфатом аммиака. Сильный восстановитель реагирует с горячей водой, хлороводородной кислотой, разбавленными серной и азотной кислотами. Сильными окислителями переводится в оксокатионы. Катион Np имеет темно-красную окраску, катион Np — желто-зеленую. Синтезирован (наиболее устойчивый изотоп Np) бомбардировкой нейтронами урана в ядерном реакторе. Выделен в виде NpFj и Npp4. Получение — восстановление кальцием или барием этих фторидов при нагревании. [c.346]
Триплетные состояния интенсивно тушатся кислородом, ионами переходных металлов, тяжелыми атомами, акцепторами и донорами электронов. При рассмотрении тушения триплетных молекул следует различать статическое и динамическое тушение. При статическом тушении триплетных состояний наблюдается уменьшение концентрации триплетных молекул без изменения их времени жизни. Явление статического тушения связано с существованием комплекса между возбужденной молекулой и тушителем. Такой комплекс может образовываться как в основном состоянии, так и в синглетном возбужденном состоянии. При сильном уменьшении вероятности интеркомбинационной конверсии в комплексе по срав- [c.166]
При сильном уменьшении вероятности интеркомбинационной конверсии в комплексе по срав- [c.166]
Серебристо-белый металл тяжелый, мягкий, радиоактивный (наиболее устойчивый изотоп Ри). Во влажном воздухе покрывается оксидной пленкой. Пассивируется в холодной воде, концентрированной серной кислоте, азотной кислоте. Не реагирует со щелочами, пцфатом аммнака. Сильный восстановитель реагирует с горячей водой, хлороводородной кислотой, разбавленной серной кислотой. Сильными окислителями переводится в оксокатионы. Катион Ри имеет сине-фиолетовую окраску, катпон Ри — желто-коричневую. Синтезирован бомбардировкой нейтронами урана в ядерном реакторе. Выделен в виде РиРз и Рир4. Получение — восстановление кальцием или литием этих фторидов при нагревании. [c.347]
Триплетные состояния интенсивно тушатся кислородом, ионами переходных металлов, тяжелыми атомами, акцепторами и донорами электрона. При рассмотрении тушения триплетных молекул следует различать статическое и динамическое тушение. При статическом тушении триплетных состояний наблюдается уменьшение концентрации триплетных молекул без изменения их времени жизни. Явление статического тушения связано с образованием комплекса между возбужденной молекулой и тушителем. Такой комплекс может образовываться как в основном, так и в син-глетно-возбужденном состоянии. При сильном уменьшении вероятности интеркомбинационной конверсии в комплексе по сравнению со свободной молекулой наблюдается уменьшение выхода триплетных молекул. Динамическое тушение триплетных молекул обусловлено взаимодействием триплетной молекулы с тушителем при соударении. При динамическом тушении происходит уменьшение времени жизни триплетных моле- [c.293]
При статическом тушении триплетных состояний наблюдается уменьшение концентрации триплетных молекул без изменения их времени жизни. Явление статического тушения связано с образованием комплекса между возбужденной молекулой и тушителем. Такой комплекс может образовываться как в основном, так и в син-глетно-возбужденном состоянии. При сильном уменьшении вероятности интеркомбинационной конверсии в комплексе по сравнению со свободной молекулой наблюдается уменьшение выхода триплетных молекул. Динамическое тушение триплетных молекул обусловлено взаимодействием триплетной молекулы с тушителем при соударении. При динамическом тушении происходит уменьшение времени жизни триплетных моле- [c.293]
Все кислые соли сероводородной кислоты — гидросульфиды, например ЫаНЗ, Са(Н8)г — хорошо растворимы в воде. Нормальные соли — сульфиды растворяются в воде по-разному. Растворимыми являются сульфиды щелочных и щелочно-земельных металлов, а также сульфид аммония (ЫН2)28. Сульфиды остальных металлов в воде не растворимы, а сульфиды меди, свинца, серебра, ртути и некоторых других металлов (тяжелых) не растворяются даже в кислотах (кроме азотной кислоты). [c.365]
[c.365]
Свойства. С.-металл синевато-серого цвета, кристаллизуется в гранецентрир. кубич. решетке типа Си, а = = 0,49389 нм, 2 = 4, пространств, группа РтЗт. С.- один из легкоплавких металлов, тяжелый цветной металл т. пл. 327,50 С, т. кип. 1751 °С плотн., г/см 11,3415 (20 °С), 10,686 (327,6 С), 10,536 (450 °С), 10,302 (650 °С), 10,078 (850 °С) С° 26,65 Дж/(моль-К) 4,81 кДж/моль, [c.300]
Серебристо-белый металл тяжелый, мягкий, радиоактивный. Реакционноспособный реагирует с кислородом, во влажном воздухе покрывается оксидной пленкой. Сильный восстановитель реагирует с горячей водой, разбавленными кислотами. Сильными окислителями переводится в оксокатионы. Ион Ат в разбавленном растворе имеет розовую окраску, заметно гидролизуется. Синтезирован (наиболее устойчивый изотоп Ат) бомбардировкой нейтронами плутония в ядерном реакторе. Выделен в виде АтРз. Получение — восстановление АтРз барием при нагревании. [c.348]
Методы первой группы представляют собой наиболее общий путь получения восстановлением безйодных галогенидов кальцием. Лучший из них— восстановление 10%-ным избытком кальция в танталовых тиглях в атмосфере аргона хлоридов Ьа, Се, Рг, N(1, 0(1 (нагревание в течение 15 мин. при 1350—1400° С) или ( ридов остальных элементов (нагревание в течение 5 мин. при 1550°С) [816, 828, 1256, 1845, 1849]. Это дает возможность получить сразу слиток редкоземельного металла с высоким выходом, что особенно важно при переработке небольших количеств материала. Получение металлов тяжелых элементов восстановлением хлоридов приводит к образованию губчатого продукта, переработка которого в монолитный металл является источником введения дополнительного количества примесей. Температура реакции в данном случае недостаточна для плавления редкоземельных металлов. Увеличение же температуры ведет к сильному испарению самих хлоридов. Поэтому замена хлоридов менее летучими фторидами позволила вести процесс при более высокой температуре с образованием компактных металлов. [c.22]
Лучший из них— восстановление 10%-ным избытком кальция в танталовых тиглях в атмосфере аргона хлоридов Ьа, Се, Рг, N(1, 0(1 (нагревание в течение 15 мин. при 1350—1400° С) или ( ридов остальных элементов (нагревание в течение 5 мин. при 1550°С) [816, 828, 1256, 1845, 1849]. Это дает возможность получить сразу слиток редкоземельного металла с высоким выходом, что особенно важно при переработке небольших количеств материала. Получение металлов тяжелых элементов восстановлением хлоридов приводит к образованию губчатого продукта, переработка которого в монолитный металл является источником введения дополнительного количества примесей. Температура реакции в данном случае недостаточна для плавления редкоземельных металлов. Увеличение же температуры ведет к сильному испарению самих хлоридов. Поэтому замена хлоридов менее летучими фторидами позволила вести процесс при более высокой температуре с образованием компактных металлов. [c.22]
Главными недостатками вагонных реторт всех типов явля ются низкий коэффициент использования их емкости, не дости гающий даже 50 %, небольшая производительность единицы объема, значительные затраты металла, тяжелые условия работы при перегрузке реторт [c. 65]
65]
На рис. 11 представлены схемы кювет для исследования адсорбции при низких температурах. Кювета, использованная Шеппардом и Йейтсом (1956) и приведенная на рис. И, а, изготовлена из металла. Тяжелый медный блок i, в котором имеется цилиндрический образец из пористого стекла, присоединен к охлаждающему сосуду Дьюара. Кювета может разбираться с разъединением конического шлифа 3 для введения образца. Через охлаждающие рубашки 4 циркулирует вода для предотвращения образования льда на кювете при проведении эксперимента при низкой температуре. Кювета присоединена к вакуумной системе через трубу 2, которую используют также для напуска адсорбирующихся газов. К кювете прикрепляются окошки из Na l. [c.51]
Сейчас технеций получают из осколков деления урана-235 в ядерных реакторах. Правда, выделить его из массы осколков непросто. На килограмм осколков приходится около 10 г элемента № 43. В основном это изотоп технС ций-99, период полураспада которого равен 212 тысячам лет. Благодаря накоплению технеция в реакторах удалось определить свойства этого элемента, получить его в чистом виде, исследовать довольно многие его соединения. В них технеций проявляет валентность 2+, 3+ и 7+- Так же, как и рений, технеций — металл тяжелый (плотность 11,5 г/см ), тугоплавкий (температура плавления2140°С), химически стойкий. [c.235]
Благодаря накоплению технеция в реакторах удалось определить свойства этого элемента, получить его в чистом виде, исследовать довольно многие его соединения. В них технеций проявляет валентность 2+, 3+ и 7+- Так же, как и рений, технеций — металл тяжелый (плотность 11,5 г/см ), тугоплавкий (температура плавления2140°С), химически стойкий. [c.235]
Эти три металла дают, как магний, окислы RO, образую щие мало энергически основания, и, как Mg, они летучи Летучесть их возрастает с атомным весом. Магний перего няется при белокалильном жаре, цинк при температуре 930″ кадмий около 770°, а ртуть около 357°. Окислы их RO восстанов ляются легче магнезии, всех легче HgO. Свойства их солей RX (растворимость, способность образовать двойные и основные соли и многие другие качества) во многом такие же, как у MgX . С возрастанием атомного веса возрастает трудность окисления, непрочность соединений, плотность металла и соединений, редкость в природе и множество других свойств. Особенности, сравнительно Mg, ожидаются уже потому, что Zn, d и Hg суть металлы тяжелые. [c.100]
Особенности, сравнительно Mg, ожидаются уже потому, что Zn, d и Hg суть металлы тяжелые. [c.100]
Химический тренажер. Ч.1 (1986) — [ c.8 ]
Аналитическая химия промышленных сточных вод (1984) — [ c.97 , c.100 ]
Введение в химическую экологию (1978) — [ c.35 , c.150 , c.153 , c.207 , c.208 ]
Общая химия и неорганическая химия издание 5 (1952) — [ c.311 ]
Санитарно химический анализ загрязняющих веществ в окружающей среде (1989) — [ c.0 ]
Неорганическая химия (1950) — [
c. 244
]
244
]
Экологическая биотехнология (1990) — [ c.0 ]
Общая химия Издание 4 (1965) — [ c.169 ]
Основы общей химической технологии (1963) — [ c.23 ]
Эволюция без отбора Автоэволюция формы и функции (1981) — [ c.276 , c.277 ]
Эволюция без отбора (1981) — [ c.276 , c.277 ]
| Лист, Плита, Лента (полоса), Шина Круг, проволока Шестигранник Квадрат Труба круглая, втулка Труба профильная Уголок Швеллер Тавр Двутавр | -Выберите-АлюминийМедьЛатуньБронзаОловоСвинецЦинкНикелевые сплавыМедно-никелевые сплавыНихромНержавеющие сталиСталь А5, А5Е, А6, А7, АД0, АД00 Д16 АМц, АМцС, ММ АД31 АД1 АМг6 АМг5 АМг3 АМг2 М1, М2, М3 Л90 Л85 Л80 Л70 ЛС59-1 Л68 Л63 БрОЦ4-3 БрОФ7-0,2 БрОФ6,5-0,15 БрАЖН10-4-4 БрХ1 БрБ2 БрКМц3-1 БрАМц9-2 БрАЖМц10-3-1,5 БрОЦС5-5-5 БрАЖ9-4 О1 С0, С1, С2 Ц0, Ц1 НМц2,5 НМц5 НК0,2 Алюмель НМцАК2-2-1 Монель НМЖМц28-2,5-1,5 Хромель Т НХ9,5 Куниаль Б МНА6-1,5 Нейзильбер МНЦ15-20 Куниаль А МНА6-1,5 Константан МНМц40-1,5 Копель МНМц43-0,5 Мельхиор МН19 Манганин МНМц3-12 МНЖ5-1 Х15Н60 Х20Н80 12Х18Н10Т, 12Х18Н12Т, 12Х18Н9 04Х18Н10Т, 08Х18Н12Б 08Х13, 08Х17Т, 08Х20Н14С2 08Х22Н6Т, 15Х25Т 08Х18Н10, 08Х18Н10Т 08Х18Н12Т 10Х17Н13М2Т 10Х23Н18 12Х13, 12Х17 Ст3, Ст5, Ст10, Ст20 | Длина (м) b — Ширина (мм) c — Толщина (мм) Длина (м) b — Диаметр (мм) Длина (м) b — Сечение (мм) Длина (м) b — Сечение (мм) Длина (м) b — Толщина стенки (мм) c — Диаметр (мм) Длина (м) b — Толщина стенки (мм) c — Ширина (мм) d — Высота (мм) Длина (м) b — Толщина стенки (мм) c — Высота полки1 (мм) d — Высота полки2 (мм) Длина (м) b — Толщина стенки (мм) c — Ширина (мм) d — Высота (мм) Длина (м) b — Толщина стенки (мм) c — Ширина (мм) d — Высота (мм) e — Толщина перемычки (мм) Длина (м) b — Толщина стенки (мм) c — Ширина (мм) d — Высота (мм) e — Толщина перемычки (мм) |
Какой металл самый легкий?
Вы можете думать о металлах как о тяжелых или плотных. Это верно для большинства металлов, но некоторые из них легче воды, а некоторые почти такие же легкие, как воздух. Взглянем на самый легкий металл в мире.
Это верно для большинства металлов, но некоторые из них легче воды, а некоторые почти такие же легкие, как воздух. Взглянем на самый легкий металл в мире.
Легчайшие элементарные металлы
Самым легким или наименее плотным металлом, который является чистым элементом, является литий, который имеет плотность 0,534 г / см 3 . Это делает литий почти вдвое плотнее воды, поэтому, если бы литий не был таким реактивным, кусок металла плавал бы на воде.
Два других металлических элемента менее плотны, чем вода. Калий имеет плотность 0,862 г / см 3 , а натрий имеет плотность 0,971 г / см 3 . Все остальные металлы в таблице Менделеева плотнее воды.
Хотя литий, калий и натрий достаточно легкие, чтобы плавать на воде, они также обладают высокой реакционной способностью. При помещении в воду они горят или взрываются.
Водород — самый легкий элемент, потому что он состоит просто из одного протона, а иногда и из нейтрона (дейтерия). При определенных условиях он образует твердый металл, имеющий плотность 0,0763 г / см 3 . Это делает водород наименее плотным металлом, но он обычно не считается претендентом на звание «самый легкий», потому что в природе он не существует как металл на Земле.
При определенных условиях он образует твердый металл, имеющий плотность 0,0763 г / см 3 . Это делает водород наименее плотным металлом, но он обычно не считается претендентом на звание «самый легкий», потому что в природе он не существует как металл на Земле.
Легчайший металлический сплав
Хотя элементарные металлы могут быть легче воды, они тяжелее некоторых сплавов. Самый легкий металл — это решетка из никель-фосфорных трубок (Microlattice), разработанная исследователями из Калифорнийского университета в Ирвине.Эта металлическая микрорешетка в 100 раз легче, чем кусок пенополистирола (например, пенополистирола). Одна известная фотография показывает решетку, покоящуюся на одуванчике, который пустил семена.
Несмотря на то, что сплав состоит из металлов с обычной плотностью (никель и фосфор), материал очень легкий. Это связано с тем, что сплав имеет ячеистую структуру, состоящую на 99,9% из открытого воздушного пространства. Матрица состоит из полых металлических трубок, каждая толщиной около 100 нанометров или примерно в тысячу раз тоньше человеческого волоса. Расположение трубок придает сплаву внешний вид, похожий на пружину матрасного ящика. Хотя конструкция в основном представляет собой открытое пространство, она очень прочная из-за того, как может распределять вес. Софи Спэнг, одна из ученых-исследователей, которые помогли разработать Microlattice, сравнивает сплав с человеческими костями. Кости крепкие и легкие, потому что они в основном полые, а не твердые.
Расположение трубок придает сплаву внешний вид, похожий на пружину матрасного ящика. Хотя конструкция в основном представляет собой открытое пространство, она очень прочная из-за того, как может распределять вес. Софи Спэнг, одна из ученых-исследователей, которые помогли разработать Microlattice, сравнивает сплав с человеческими костями. Кости крепкие и легкие, потому что они в основном полые, а не твердые.
Список 10 самых тяжелых металлов (плотность и атомный вес) — Вес вещей
Делиться — это забота!
Периодическая таблица Менделеева содержит множество различных элементов.3
Некоторые из этих рейтингов могут вас удивить. Такой как, действительно ли свинец не входит в десятку самых плотных металлов? Это не. Но это один из самых тяжелых. Давайте поговорим о плотности, атомном весе и о том, как разные металлы равняются.
Плотность в зависимости от атомного веса
При обсуждении тяжелых металлов есть два
различные факторы, которые могут показаться довольно похожими, плотность и атомный вес. Это разные размеры и измеряются в разных единицах измерения.3)
Это разные размеры и измеряются в разных единицах измерения.3)
Плотность металла влияет на то, как разные металлы взаимодействуют в разных ситуациях. Для Например, многие типы металлов утонут в воде, потому что металл имеет более высокую плотность, чем у воды. И некоторые металлы, такие как калий, действительно будут плавать в вода, потому что они менее плотные, чем вода.
Атомный вес составляет определяется как средняя масса атомов элемента. Единицами атомного веса являются безразмерный и основан на одной двенадцатой (0,0833) веса углерода-12 атом в основном состоянии.
Другими словами, атом углерода-12 имеет значение
12 атомных единиц массы. Атомный вес более известен как относительный
атомной массы, чтобы избежать путаницы, потому что атомная масса не то же самое, что и атомная
весить т. Вес подразумевает силу, действующую внутри гравитационного
поле, которое затем измеряется в единицах силы, таких как ньютоны.
Теперь, когда мы различали эти два свойства, давайте взглянем на 10 металлов с самыми высокими показателями каждый.
10 самых плотных металлов:
10.3
Ртуть — металл в жидкой форме в помещении температура, которую часто называют ртутью из-за ее серебристо-белого цвета.
Ртуть очень тяжелая. Весит в 13,6 раза больше воды в равных объемах. Для сравнения: железо, камень и свинец может плавать на его поверхности.
Этот металл наиболее широко используется в барометры, термометры и другие научные инструменты; это очень полезно в проводке электричества. А пары ртути используются:
- Уличные фонари
- Рекламные вывески
- Люминесцентные лампы.3
Ярко-желтый всем знаком металл, но в чистом виде он будет выглядеть слегка красновато-желтым. Несмотря на его плотность, он мягкий и податливый.
Золото используется во многих ювелирных изделиях из-за мягкость в чистом виде. Часто он сплавлен с другими металлами, чтобы изменить пластичность и твердость.
 Одно из наиболее важных применений золота —
электроника; золото создает нержавеющие электрические соединители в электрических
устройства, такие как компьютеры.
Одно из наиболее важных применений золота —
электроника; золото создает нержавеющие электрические соединители в электрических
устройства, такие как компьютеры.6.3
Плутоний — это металлический актинид, имеющий серебристо-серый цвет, который тускнеет и тускнеет при воздействии кислород.
Изотоп плутоний-238 выделяет много тепловая энергия и имеет низкий уровень гамма-лучей и нейтронных лучей. Этот изотоп является альфа-излучателем. Он сочетает в себе низкое проникновение с высокой энергией, что означает, что он не требует особой защиты.
Будучи способным производить столько тепла, он может также производят много электроэнергии. Период полураспада этого изотопа составляет около 87.3
Очень плотный, пластичный, податливый, драгоценный, инертные переходные металлы, которые выглядят серебристо-белыми. Платина используется во всех виды процессов:
- Устройства контроля выбросов транспортных средств.
- Ювелирные изделия
- Химическое производство
- Электрооборудование
- Жесткие диски
Платина очень устойчива к износу, и очень крутой со всех сторон.
 Все устройства, приборы и украшения, которые он использовал.
у них впечатляющая продолжительность жизни.3
Все устройства, приборы и украшения, которые он использовал.
у них впечатляющая продолжительность жизни.3Осмий, как и иридий, является твердым хрупким переходный металл, который выглядит голубовато-белым. Этот элемент самый плотный, будучи редко встречается в платиновых рудах, это довольно дефицитный элемент.
Осмий очень редко используется в чистом виде. из-за его токсичности и чрезвычайно летучести. Осмий очень часто входит в состав устройства и машины, которые должны выдерживать большой износ.
Некоторые другие специальные инструменты, в которых они используются являются:
- Повороты инструмента
- Перьевые ручки
- Электрические контакты
- Советы по стилю фотографии
10 самых тяжелых металлов
10.Меркурий 200,59 u
Меркурий очень тяжелый, вместе с высоким плотность. Он используется в качестве основного взрывчатого вещества и используется в патронах огнестрельное оружие.
Вес в основном играет роль ртути.
 находится в жидком состоянии, потому что на нем могут плавать многие вещи. Френель
линзы маяков в прошлом ставили поверх ванн с ртутью, чтобы
что они могли плавать и вращаться. По сути, это действовало как подшипник.
находится в жидком состоянии, потому что на нем могут плавать многие вещи. Френель
линзы маяков в прошлом ставили поверх ванн с ртутью, чтобы
что они могли плавать и вращаться. По сути, это действовало как подшипник.9. Свинец 207,2 и
Очень тяжелый металл, который все же плотнее, чем много других материалов.Свинец мягкий и податливый, серебристый и легкий. оттенки синего при первой стрижке. Свинец становится тускло-серым, когда подвергается воздействию воздуха.
Свинец много лет использовался в качестве пуль во время Средние века, потому что он был дешевым и имел низкую температуру плавления, что позволяло более быстрое литье с меньшим количеством оборудования. В настоящее время его используют в балластных килях на парусники. Плотность позволяет использовать небольшой объем, при этом обеспечивая воду. сопротивление.
8. Астатин 210 u
Пожалуй, самый редкий металл природного происхождения. в земной коре этот металлоид окутан тайной.Один из основных исследования, которые продолжаются для астатина-211, касаются его возможностей в ядерная медицина.
 Однако это требует быстрой работы, потому что его период полураспада равен
всего 7,2 часа.
Однако это требует быстрой работы, потому что его период полураспада равен
всего 7,2 часа.Свинец также очень популярен в строительстве. Используется как кровельный материал в виде свинцовых листов для изготовления гидроизоляции, облицовка и водостоки.
7. Франций 223 u
Другой радиоактивный элемент, который также классифицируется как щелочной металл. Франций очень редок и крайне нестабилен, что делает его очень трудным для коммерческого использования.Франций использовался для поиска для лечения рака, но оказалось, что это непрактично.
Франций можно синтезировать, выделять и очень легко охлаждается, что делает его отличным объектом для изучения спектроскопии эксперименты.
6. Радий 226 u
Щелочноземельный металл, который выглядит серебристо-белый в чистом виде, но черный под воздействием кислорода.
Во многих случаях радий используется радиоактивные свойства. В промышленной радиографии радий играет решающую роль. источник излучения.
5. Актиний 227 u
Обычно считается первым переходным металлом. в 7 периоде актиний — серебристо-белый мягкий радиоактивный металл. Этот металл очень быстро реагирует на влагу и кислород, образуя белый налет который предотвращает дальнейшее окисление
Актиний очень редок и дорог с очень высокий уровень радиоактивности; с учетом этих факторов у него нет множество промышленных приложений. Исследования и исследования — вот где он чаще всего используется для альфа-терапии и лечения рака.
4. Протактиний 231.0359 u
Плотный актинидный металл, который появляется серебристо-серый и очень быстро реагирует на кислород, неорганические кислоты и водяной пар.
Перемещение между торием и ураном на периодической таблицы Менделеева, но в ней по-прежнему нет промышленных или коммерческих Приложения. Протактиниум в настоящее время используется только для исследований.
3. Торий 232.037 u
Очень серебристый металл, который кажется серебристым, пока становится черным при контакте с воздухом.Это создает диоксид тория на внешний слой, который становится твердым и податливым. Уровни радиоактивности тория намного слабее других радиоактивных металлов.
Многие применения тория связаны с его диоксид кроме самого металла. Этот диоксид особенный, потому что он очень высокая температура плавления, поэтому он может оставаться твердым в огне и увеличивать яркость пламени.
2. Уран 238.028 u
Уран очень похож на плутоний по своим показателям. плотности, атомного веса и их использования.Атомные электростанции работают на уран; используемое топливо обогащено ураном примерно на 3%.
1. Плутоний 244 u
Плутоний не только очень плотный, но и также очень высокий атомный вес. Плутоний, как и уран-235, можно использовать для двигать подводные лодки и авианосцы.
Совместное использование — это забота!
Что самое тяжелое во Вселенной?
Когда вы думаете о «тяжелых» вещах, на ум приходят школьные ранцы, сумки и сумки для покупок. Каждый день в торговом центре можно услышать: «Что здесь, свинцовые гири?» когда сумки передаются назначенному тяжелоатлету.
Свинец — это прочный металл, который часто используется в качестве груза и грузила. Причина, по которой он тяжелый с точки зрения массы на единицу объема (или представьте, что это на чайную ложку), заключается в том, что атомы свинца расположены очень близко, что делает его плотным материалом.
Черная дыра, пожирающая нейтронную звезду. Изображение: НАСА / ВикимедиаНо выражение «он упал, как свинцовый шар», вероятно, следует заменить на «осмиевый шар». Осмий — один из самых тяжелых материалов на Земле, его вес в два раза превышает вес свинца на чайную ложку.
Осмий — химический элемент в составе металлов платиновой группы; его часто используют в качестве сплавов в электрических контактах и перьях перьевых ручек.
За пределами Земли самое тяжелое и самое плотное вещество в известной вселенной должно быть внутри нейтронной звезды, говорит доцент Эндрю Мелатос из школы физики Мельбурнского университета.
Обнаружен: звуковой прикус на миллиард лет
Подробнее
«Чайная ложка нейтронной звезды будет весить около миллиарда тонн», — говорит доцент Мелатос.
Согласно веб-сайту НАСА, это примерно то же самое, что и гора Эверест.
Рождение нейтронной звезды — это, по сути, коллапс гигантской сгоревшей звезды, Солнца, которое в 10-100 раз больше нашего Солнца. «Когда гигантское солнце выгорает, оно расходует все свое топливо. Тогда гравитация настолько сильна, что схлопывается сама по себе.
«Давление настолько велико, что взрывается впечатляющей сверхновой, извергающей повсюду газ. На несколько секунд он затмевает другие 100 миллиардов звезд в нашей галактике.
«То, что осталось, — это плотно упакованный шар нейтронов — нейтронная звезда — диаметром около 30 км, размером примерно с Мельбурн, но с массой гигантского солнца, упакованной в него, поэтому он безумно плотный».
На гравитационной волне
Подробнее
Высокая плотность нейтронных звезд означает, что у них сильная гравитация, и позволяет изучать гравитационные волны, предоставляя ключи к разгадке структуры пространства и времени, как это было предсказано Эйнштейном в 1916 году. «Не паникуйте, наше солнце не выгорит еще пять миллиардов лет», — говорит он.
«Наше Солнце — маленькая звезда. Она не станет нейтронной звездой, но сожжет весь водород и гелий и станет красным гигантом. В этот момент наше Солнце поглотит окружающие планеты, включая Землю, ядерная реакция продолжит преобразовывать гелий в углерод, и оно будет похоже на гигантский алмаз размером с Землю, после чего его называют белым карликом ».
Итак, массивные звезды становятся нейтронными звездами — самыми тяжелыми объектами во Вселенной — а еще более массивные звезды становятся черными дырами.
Изображение баннера: Pixabay
Самые легкие металлы: наука и технологии от лития до кальция
Авторы XI
Предисловие к серии XV
Предисловие к тому XVII
ЧАСТЬ 1: ИСТОРИЯ ВОПРОСА 1
Взаимоотношения между легчайшими металлами 3
и
Николас К. Бойд и Тимоти П. Hanusa Production 23000 Burrenceium
Стивен ФриманРаспространение магнезиальных минералов и производство магниевых химикатов и металлов 35
Марк А.ShandВозникновение и производство алюминия 47
Halvor KvandeСтатус стратегического металла 57
Дебора А. КрамерУстойчивость ресурсов 67
Дэвид А.Химия в низком окислительном состоянии 73
Майкл С. ХиллЯМР в растворе легких металлов основной группы 91
Тимоти П. ХанусаТвердотельный ЯМР легких металлов основной группы 117
Роберт У.Schurko and Michael J. JaroszewiczКатион-π-взаимодействия 173
Йи Ан и Стивен Э. УиллерИонные каналы и ионофоры 185
Питер Дж. КрэггБериллий
Современная токсикология металлов 6. Теренс М. ЦивикЧАСТЬ 3: ПРИЛОЖЕНИЯ 211
Переосмысление реакции Гриньяра 213
Свен Крик и Маттиас ВестерхаузенАриллитий и гетариллитий: поколение
236 D. и реакционная способностьW. SlocumКомплексы магния и кальция в гомогенном катализе 255
Merle ArrowsmithКатализ на основе алюминия 281
Марк Р. МейсонЛитий-ионные батареи: основы и безопасность 303 Isidor345
Литий-ионные батареи и не только: будущие задачи дизайна 315
Юн Хва и Элтон Дж. КэрнсСинтез материалов для хранения водорода под высоким давлением 335
Хироюки Сайто, Сигеюки Такаги, Кацутоши Аоки и Шин- ОримоОбработка и применение прозрачной керамики 343
Лин Бинг Конг, Ичжун Хуанг, Чжили Донг, Тяньшу Чжан, Вэньсю Цюэ, Цзянь Чжан, Динъюань Тан и Шон ЛиСверхпроводники световых элементов 371
Андреас Херманн 9000 -размерный катализ с улучшенной наноструктурой 387
Sibo Wang, Zheng Ren, Yanbing Guo and P u-Xian GaoФармакология лития 417
Philip G.Яничак и Брэдли Р. КатлерСолнечная энергия и фотоэлектрическая энергия 427
Арнульф Джагер-ВальдауАббревиатуры и акронимы 437
Индекс 441
Исторический Классификация элементов
Наше обсуждение подразумевает, что расположение элементов в периодической таблице зависит от знания электронной конфигурации. Это предположение неверно. В конце восемнадцатого и начале девятнадцатого веков были обнаружены многие элементы и описаны их свойства; те элементы со схожими свойствами были сгруппированы в семейства, а семейства организованы в периодической таблице.На рисунке 5.12 показано расположение этих семейств в периодической таблице.
РИСУНОК 5.12 Периодическая таблица Менделеева, показывающая расположение характерных, переходных и внутренних переходных элементов.
A. Семейства элементов
Одно семейство элементов — это щелочные металлы: литий, натрий, калий, рубидий, цезий и франций. Эти элементы, находящиеся в столбце 1 периодической таблицы, имеют один валентный электрон.Все они мягкие, серебристо-серые твердые тела с явно металлическим блеском. Все они очень реактивны, и их реакции с водой бурные. Эти элементы не встречаются в природе в свободном виде, но встречаются в сочетании с другими элементами, часто с хлором. Наиболее распространенным из этих соединений является хлорид натрия (поваренная соль). Хлорид натрия, NaCl, делает морскую воду соленой; он также встречается в огромных подземных месторождениях (соляных шахтах).Щелочноземельные металлы, еще одно семейство, входят в столбец 2 периодической таблицы.Их атомы имеют два валентных электрона. Эти металлы тверже и прочнее щелочных металлов. Они тоже встречаются в сочетании с другими элементами. Хотя все щелочноземельные металлы имеют одинаковую химическую активность, они имеют более широкий диапазон реакционной способности, чем щелочные металлы. На бериллий и магний вода не влияет, кальций медленно реагирует с кипящей водой, а барий бурно реагирует с холодной водой. Элементы группы 7 с семью валентными электронами известны как галогены.Химически эти элементы очень похожи; физически они менее похожи. Самый легкий галоген, фтор, представляет собой бледно-желтый газ; йод — блестящее черное твердое вещество. Самый тяжелый галоген, астат, встречается довольно редко и содержится в урановых рудах. Общее количество астата в земной коре, вероятно, менее 1 г. Самый долгоживущий изотоп этого элемента, астат-210, имеет период полураспада всего 8,3 часа. Некоторые характерные свойства галогенов показаны в таблице 5.6. Обратите внимание, как эти свойства меняются с увеличением атомного номера.
Элементы в столбце 8 — благородные газы. Отзыв из главы 3 видно, что все эти элементы являются одноатомными газами и встречаются в свободном и несвязанном виде. Все они необычайно инертны, настолько, что были известны раньше. как «инертные газы». Лишь в 1960 году кому-либо из них было показано участие в химическом производстве. реакции. Даже сейчас известно, что только криптон и ксенон образуют химические соединения. с другими элементами.
Элементы в других столбцах таблицы не демонстрируют поразительного сходства свойств.Эти столбцы пересекает ступенчатая линия, отделяющая металлы от неметаллов, поэтому неметаллы находятся наверху, а металлы — внизу. Например, группу 4 возглавляет неметаллический углерод, а наиболее тяжелым членом является свинец, типичный металл. Группа 5 начинается с неметаллического азота и заканчивается металлическим висмутом.
Б. Историческое развитие эпохи Стол
К середине девятнадцатого века ученые знали атомные веса всех известных в то время элементов и заметили, что эти веса увеличиваются с 1 а.е.м. (водород) до более 200 а.е.м. (свинец).Были предприняты попытки найти систематическое расположение всех элементов, которое поместило бы их в порядке увеличения атомного веса и в группы с аналогичными свойствами. Такое устройство, получившее название периодической таблицы, было задумано в 1869 году Юлием Лотаром Мейером (1830–1395) в Германии и Дмитрием Менделеевым. (1834-1907) в России. Менделееву обычно придают наибольшую заслугу в создании периодической таблицы, потому что он не только описал порядок известных элементов, но также использовал это расположение для предсказания существования других элементов, еще не обнаруженных.Расположение элементов Менделеева показано на рис. 5.13. Он напоминает сегодняшнюю таблицу Менделеева, но в ней меньше столбцов и другая общая форма. Наша нынешняя группа 8 отсутствует, потому что благородные газы еще не были обнаружены. Более короткие столбцы блока d отсутствуют; вместо этого переходные элементы размещаются как подгруппы в длинных столбцах. Тем не менее таблица Менделеева является предком нашей периодической таблицы.
РИСУНОК 5.13 Периодическая таблица Менделеева (1871 г.). Формулы оксида и гидрида элемента определили, в каком столбце он будет находиться. Обратите внимание на пустые места, которые заполняются позже, когда были обнаружены новые элементы. Указанные атомные веса приняты в 1871 году; многие с тех пор были изменены. Создавая эту таблицу, Менделеев наиболее внимательно следил за своей целью поместить аналогичные элементы в один столбец. Эта цель привела к двум важным результатам.Во-первых, если элементы не совпадают, оставались пробелы и предсказывались свойства для элементов, которые еще не были обнаружены. Германий, один из тех, для которых оставалось свободное место, был обнаружен в 1886 году с использованием предсказанных свойств Менделеева в качестве ориентира. Во-вторых, если два соседних элемента были близки по атомному весу и не соответствовали своим столбцам при размещении в последовательном порядке, порядок был обратным. Йод и теллур — два таких элемента. Хотя теллур имеет более высокий атомный вес, очевидно, что это не галоген, а йод; Таким образом, теллур был помещен в группу 6, а йод — в группу 7.
Расположение элементов Менделеевым сохранялось примерно до 1912 года в качестве иллюстрации его утверждения периодического закона: свойства элементов являются периодическими функциями их атомных весов. В 1912 г. Г. Дж. Мозли. (1887-1915), ученик Резерфорда, присвоил каждому элементу атомный номер, равный заряду его ядра, и показал, что этот заряд увеличивается на один от одного элемента к другому. Работа Мозли предложила переформулировать периодический закон следующим образом: свойства элементов являются периодическими функциями их атомных номеров.Эта переформулировка решила проблему теллура и йода, а также другие подобные проблемы. Он признал, что атомные веса основаны на распределении изотопов и что реальное различие между элементами — это разница в количестве протонов в их атомах. Периодическая таблица, которую мы используем сегодня, получила широкое распространение в 1940-х годах, когда была признана важность электронной конфигурации в предсказании свойств. Сегодня мы используем таблицу как сводку знаний об элементах, тогда как таблица Менделеева считалась интересным, но не особенно полезным артефактом.
Исследователи создают один из самых прочных и легких материалов из известных | MIT News
Команда исследователей из Массачусетского технологического института разработала один из самых прочных из известных известных материалов путем сжатия и сплавления чешуек графена, двумерной формы углерода. Новый материал, имеющий форму губки с плотностью всего 5 процентов, может иметь прочность в 10 раз больше, чем сталь.
В своей двумерной форме графен считается самым прочным из всех известных материалов.Но исследователям до сих пор было трудно преобразовать эту двумерную прочность в полезные трехмерные материалы.
Новые данные показывают, что решающий аспект новых трехмерных форм больше связан с их необычной геометрической конфигурацией, чем с самим материалом, что предполагает, что аналогичные прочные и легкие материалы могут быть изготовлены из различных материалов путем создания аналогичные геометрические особенности.
Результаты опубликованы сегодня в журнале Science Advances , в статье Маркуса Бюлера, главы Департамента гражданской и экологической инженерии Массачусетского технологического института (CEE) и профессора инженерии McAfee; Чжао Цинь, ученый-исследователь из ЦВЕ; Ган Сеоб Чон, аспирант; и Мин Чжон Кан Мэн ’16, недавний выпускник.
Другие группы высказали предположение о возможности создания таких легких структур, но лабораторные эксперименты до сих пор не соответствовали прогнозам, а некоторые результаты показали, что прочность на несколько порядков меньше, чем ожидалось. Команда Массачусетского технологического института решила разгадать загадку, проанализировав поведение материала вплоть до уровня отдельных атомов в структуре. Они смогли создать математическую основу, которая очень близко соответствует экспериментальным наблюдениям.
Двумерные материалы — в основном плоские листы толщиной всего в один атом, но могут быть бесконечно большими в других измерениях — обладают исключительной прочностью, а также уникальными электрическими свойствами. Но из-за их необычайной тонкости «они не очень полезны для изготовления трехмерных материалов, которые можно было бы использовать в транспортных средствах, зданиях или устройствах», — говорит Бюлер. «Что мы сделали, так это воплотили в жизнь желание преобразовать эти двухмерные материалы в трехмерные структуры».
Команде удалось сжать маленькие чешуйки графена, используя сочетание тепла и давления.В результате этого процесса образовалась прочная, стабильная структура, форма которой напоминает формы некоторых кораллов и микроскопических существ, называемых диатомовыми водорослями. Эти формы, которые имеют огромную площадь поверхности, пропорциональную их объему, оказались чрезвычайно прочными. «Как только мы создали эти трехмерные структуры, мы захотели увидеть, каков предел — какой самый прочный материал, который мы можем произвести», — говорит Цинь. Для этого они создали множество трехмерных моделей, а затем подвергли их различным испытаниям. При компьютерном моделировании, имитирующем условия нагружения при испытаниях на растяжение и сжатие, выполненных в машине для нагружения растяжением, «один из наших образцов имеет 5-процентную плотность стали, но в 10 раз больше прочности», — говорит Цинь.
Бюлер говорит, что то, что происходит с их трехмерным графеновым материалом, который состоит из искривленных поверхностей при деформации, похоже на то, что происходит с листами бумаги. Бумага имеет небольшую прочность по длине и ширине и легко мнется. Но когда ему придана определенная форма, например, свернуть в трубу, внезапно прочность по длине трубы становится намного больше и может выдерживать значительный вес. Точно так же геометрическое расположение чешуек графена после обработки естественным образом образует очень прочную конфигурацию.
Новые конфигурации были сделаны в лаборатории с использованием многоматериального трехмерного принтера с высоким разрешением. Они прошли механические испытания на прочность при растяжении и сжатии, а их механический отклик под нагрузкой был смоделирован с использованием теоретических моделей группы. Результаты экспериментов и моделирования точно совпали.
Новые, более точные результаты, основанные на атомистическом вычислительном моделировании, выполненном командой MIT, исключили возможность, предложенную ранее другими группами: что можно было бы сделать трехмерные графеновые структуры настолько легкими, что они на самом деле были бы легче, чем воздух, и может быть использован как прочная замена гелию в воздушных шарах.Однако текущая работа показывает, что при такой низкой плотности материал не будет иметь достаточной прочности и разрушится под давлением окружающего воздуха.
Но, по словам исследователей, со временем может появиться и множество других возможных применений материала, которые требуют сочетания чрезвычайной прочности и легкости. «Вы можете использовать настоящий графеновый материал или геометрию, которую мы обнаружили с другими материалами, такими как полимеры или металлы», — говорит Бюлер, чтобы получить аналогичные преимущества прочности в сочетании с преимуществами в стоимости, методах обработки или других свойствах материала (например, прозрачность или электропроводность).
«Вы можете заменить сам материал чем угодно», — говорит Бюлер. «Геометрия является доминирующим фактором. Это то, что может быть применено ко многим вещам «.
Необычные геометрические формы, которые графен естественным образом формирует под действием тепла и давления, выглядят как шар Нерфа — круглые, но с дырочками. Эти формы, известные как гироиды, настолько сложны, что «фактически изготовить их с использованием обычных методов производства, вероятно, невозможно», — говорит Бюлер. В целях тестирования команда использовала трехмерные модели конструкции, увеличенные в тысячи раз от их естественного размера.
Для фактического синтеза, по словам исследователей, одна из возможностей состоит в том, чтобы использовать полимерные или металлические частицы в качестве шаблонов, покрыть их графеном путем химического осаждения паров перед обработкой нагреванием и давлением, а затем химически или физически удалить полимерную или металлическую фазы, чтобы Трехмерный графен в форме гироида. Для этого вычислительная модель, представленная в текущем исследовании, дает рекомендации по оценке механического качества выходных данных синтеза.
По их мнению, та же геометрия может быть применена даже к крупномасштабным конструкционным материалам.Например, бетон для такой конструкции, как мост, может быть изготовлен с такой пористой геометрией, обеспечивающей сопоставимую прочность при небольшом весе. Дополнительным преимуществом такого подхода является обеспечение хорошей изоляции из-за большого количества замкнутого воздушного пространства внутри него.
Поскольку форма пронизана очень крошечными порами, материал может также найти применение в некоторых системах фильтрации, как для воды, так и для химической обработки. По словам исследователей, математические описания, полученные этой группой, могут облегчить разработку множества приложений.
«Это вдохновляющее исследование механики трехмерной сборки графена», — говорит Хуацзянь Гао, профессор инженерии в Университете Брауна, который не принимал участия в этой работе. «Комбинация компьютерного моделирования с экспериментами на основе трехмерной печати, использованная в этой статье, является мощным новым подходом в инженерных исследованиях. «Впечатляет то, что законы масштабирования, первоначально выведенные из моделирования в наномасштабе, вновь появляются в экспериментах на макроуровне с помощью трехмерной печати», — говорит он.
Эта работа, по словам Гао, «показывает многообещающее направление объединения прочности двухмерных материалов и мощи материального архитектурного дизайна.”
Исследование было поддержано Управлением военно-морских исследований, Междисциплинарной университетской исследовательской инициативой Министерства обороны и Североамериканским центром исследований перспективных материалов BASF.
ВЧ — Легчайшие металлы
Первые семь металлов в периодической таблице — это литий, бериллий, натрий, магний, алюминий, калий и кальций, вместе известные как «легчайшие металлы». Растущее использование этих семи элементов все сильнее вовлекает их в важнейшие области технологий 21 века, включая накопление энергии, катализ и различные применения нанонауки.
В этом томе дается исчерпывающий обзор основ и последних достижений науки и техники в области легчайших металлов. В первых главах книги описываются основные физические и химические свойства металлов, их наличие и вопросы долгосрочной доступности. В книге рассматривается широкий спектр химических свойств, включая химию с низкой степенью окисления, металлоорганические соединения, металл-центрированную ЯМР-спектроскопию и взаимодействия катион-пи. Представлены текущие и новые применения металлов, включая технологию литий-ионных аккумуляторов, химию хранения водорода, сверхпроводящие материалы, прозрачную керамику, наноусиленный катализ и исследования фотосинтеза и фотоэлектрохимических элементов.
Содержание этой книги будет добавлено в Интернете в Энциклопедию неорганической и биоинорганической химии: http://www.wileyonlinelibrary.com/ref/eibc
Авторы XI СерияПредисловие XV
Предисловие к тому XVII
ЧАСТЬ 1: ИСТОРИЯ 1
Взаимосвязи между легчайшими металлами 3
Николас К. Бойд и Тимоти П. ХанусаВозникновение и образование бериллия 2 9000 Фриман 23
магнезиальных минералов и производства магния и металлов 35
Марка А.ShandВозникновение и производство алюминия 47
Halvor KvandeСтатус стратегического металла 57
Дебора А. КрамерУстойчивость ресурсов 67
Дэвид А. ЭтвудЧАСТЬ 2: ОСНОВЫ 71
Состояние с низким уровнем окисления Майкл S. Hill
ЯМР в растворе легких металлов основной группы 91
Тимоти П. ХанусаТвердотельный ЯМР легких металлов основной группы 117
Роберт В. Шурко и Майкл Дж.ЯрошевичКатион-пи-взаимодействия 173
Йи Ан и Стивен Э. УилерИонные каналы и ионофоры 185
Питер Дж. КрэггБериллий-металлическая токсикология: текущая перспектива 205
Теренс М. СивикПРИЛОЖЕНИЯ ЧАСТЬ 3:
Переосмысление реакции Гриньяра 213
Свен Крик и Маттиас ВестерхаузенАриллитий и гететариллитий: образование и реакционная способность 231
DW SlocumКомплексы магния и кальция в гомогенном катализе на основе алюминия 25552
Arrows 9 -000 Мерле3Mason
Марлит 9 -000 МерлеизЛитий-ионные батареи: основы и безопасность 303
Isidor BuchmannЛитий-ионные батареи и не только: будущие задачи проектирования 315
Юн Хва и Элтон Дж. КэрнсСинтез материалов для хранения водорода под высоким давлением 335
Хироюки Сайто , Шигеюки Такаги, Кацутоши Аоки и Син-ичи ОримоОбработка и применение прозрачной керамики 343
Лин Бинг Конг, Ичжун Хуанг, Чжили Дун, Тяньшу Чжан, Вэньсю Цюэ, Цзян Чжан, Динъюань Лайти Шон Ли
Сверхпроводники 371
Андреас ХерманнОдномерный катализ, усиленный наноструктурами 387
Сибо Ван, Чжэн Рен, Янбин Го и Пу-Сянь ГаоФармакология лития 417
Филип Г.

 Одно из наиболее важных применений золота —
электроника; золото создает нержавеющие электрические соединители в электрических
устройства, такие как компьютеры.
Одно из наиболее важных применений золота —
электроника; золото создает нержавеющие электрические соединители в электрических
устройства, такие как компьютеры. находится в жидком состоянии, потому что на нем могут плавать многие вещи. Френель
линзы маяков в прошлом ставили поверх ванн с ртутью, чтобы
что они могли плавать и вращаться. По сути, это действовало как подшипник.
находится в жидком состоянии, потому что на нем могут плавать многие вещи. Френель
линзы маяков в прошлом ставили поверх ванн с ртутью, чтобы
что они могли плавать и вращаться. По сути, это действовало как подшипник. Однако это требует быстрой работы, потому что его период полураспада равен
всего 7,2 часа.
Однако это требует быстрой работы, потому что его период полураспада равен
всего 7,2 часа.