Вольфрам | Plansee
Вольфрам применяется везде, где приходится работать с высокой температурой. Ведь по жаропрочности с ним не сравнится ни один другой металл! У вольфрама из всех металлов самая высокая температура плавления и, соответственно, самая высокая рабочая температура. Он также отличается исключительно низким коэффициентом теплового расширения и высоким уровнем стабильности формы. Вольфрам практически неразрушим. Из этого материала мы изготавливаем, например, компоненты для высокотемпературных печей, ламп, медицинской техники и систем нанесения тонких покрытий.
| Атомный номер | 74 |
| Номер CAS | 7440-33-7 |
| Атомная масса | 183,84 [г/моль] |
| Точка плавления | 3420 °C |
| Точка кипения | 5555 °C |
| Плотность при 20 °C | 19,25 [г/см3] |
| Кристаллическая структура | |
| Коэффициент линейного теплового расширения при 20 °C | 4,4 × 10-6 [м/(мК)] |
| Теплопроводность при 20 °C | 164 [Вт/(мК)] |
| Удельная теплоемкость при 20 °C | 0,13 [Дж/(гК)] |
| Электропроводность при 20 °C | 18,2 × 106 [См/м] |
| Удельное электрическое сопротивление при 20 °C | 0,055 [(Ом·мм2)/м] |
Ассортимент материалов
Чистый вольфрам или сплав?Качеству нашей продукции можно доверять. При производстве вольфрамовых изделий методом порошковой металлургии мы собственными силами выполняем весь технологический процесс — от подготовки металлического порошка до выпуска конечного продукта. В качестве сырья используется только чистейший оксид вольфрама. Так мы гарантируем исключительную чистоту материала. Мы гарантируем степень чистоты вольфрама 99,97 % (чистота металла без молибдена). Остаток преимущественно составляют следующие элементы:
При производстве вольфрамовых изделий методом порошковой металлургии мы собственными силами выполняем весь технологический процесс — от подготовки металлического порошка до выпуска конечного продукта. В качестве сырья используется только чистейший оксид вольфрама. Так мы гарантируем исключительную чистоту материала. Мы гарантируем степень чистоты вольфрама 99,97 % (чистота металла без молибдена). Остаток преимущественно составляют следующие элементы:
| Элемент | Типичное макс. значение [мкг/г] |
Гарантированное макс. значение [мкг/г] |
| Al | 1 | 15 |
| Cr | 3 | 20 |
| Cu | 1 |
10 |
| Fe | 8 |
30 |
| K | 1 |
10 |
| Mo | 12 | 100 |
| Ni |
2 |
20 |
| Si | 1 |
20 |
| C | 6 |
30 |
| H | 0 | 5 |
| N | 1 |
5 |
| O | 2 |
20 |
| Cd | 1 | 5 |
| Hg | 0 | 1 |
| Pb | 1 |
5 |
Присутствие Сr (VI) и органических примесей исключено в принципе из-за процесса производства (многократная термообработка при температуре выше 1000 °C в атмосфере Н2)
| Материал | Химический состав (масс. %) %) |
|
| W (чистый) | > 99,97 % W |
|
| W-UHP (высокой чистоты) | > 99,9999 % W | |
| WK65 |
60–65 мкг/г K | |
| WVM | 30–70 мкг/г K | |
| WVMW | 15–40 мкг/г K | |
| WL | WL05 WL10 WL15 WL20 |
0,5 % La2O3 1,0 % La2O3 1,5 % La2O3 2,0 % La2O3 |
| WC20 | 2,0 % CeO2 | |
| WRe |
WRe05 WRe26 |
5,0 % Re 26,0 % Re |
| WCu* | 10–40 % Cu | |
| Тяжелые сплавы высокой плотности на основе вольфрама* |
Densimet® Inermet® Denal® |
1,5–10 % Ni, Fe, Mo 5–10 % Ni, Cu 2,5–10 % Ni, Fe, Co |
* Подробную информацию о наших металломатричных композитах на основе вольфрама можно найти на странице материалов W-MMC.
Мы оптимизируем свойства вольфрам в зависимости от планируемого применения. За счет различных легирующих добавок можно регулировать следующие характеристики:
- физические свойства (температура плавления, плотность, электропроводность, теплопроводность, тепловое расширение, работа выхода электронов и др.)
- механические свойства (прочность, ползучесть, пластичность и др.)
- химические свойства (коррозионная стойкость, пригодность к обработке травлением)
- обрабатываемость (механическая обработка, поведение при деформации, свариваемость)
- рекристаллизационные свойства (температура рекристаллизации)
Но это еще не все! Используя особые технологии производства, мы можем изменять и другие свойства вольфрама в широком диапазоне. Результат: вольфрамовые сплавы с различным набором свойств, максимально адаптированные к требованиям конкретной области применения.
WK65 (вольфрам-калий)
Мы добавляем в вольфрам 60–65 мкг/г калия и используем получаемый материал для производства проволоки с вытянутой многослойной микроструктурой.
 Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM.
Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM.WVM (вольфрам для вакуумной металлизации)
Сплав WVM состоит практически из чистого вольфрама, легированного минимальным количеством калия. Мы выпускаем WVM преимущественно в форме прутков и проволоки, которые идут на изготовление спиралей испарителей, нитей накала и компонентов оборудования для эпитаксии. Также выпускается листовой WVM, из которого изготавливают лодочки испарителей. Благодаря легированию специальными присадками и продуманной термомеханической обработке материал получает многослойную «штапельную» микроструктуру, которая обеспечивает повышенную стабильность формы при высокой температуре.
WVMW (WVM-вольфрам)
Материалы WVMW и S-WVMW были разработаны специально для изготовления анодов диаметром более 15 мм в короткодуговых лампах.
 Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике.
Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике.WL (вольфрам – оксид лантана)
Мы добавляем в наш вольфрам 0,5, 1,0, 1,5 или 2 масс. % оксида лантана (La2O3), чтобы повысить его сопротивление ползучести и температуру рекристаллизации. Наш материал WL также легче поддается механической обработке благодаря равномерному распределению частиц оксида в его структуре. Работа выхода электронов у WL значительно ниже, чем у чистого вольфрама. По этой причине WL широко используется для изготовления источников ионов и электродов ламп.
WC20 (вольфрам – оксид церия)
Композит WC20 применяется для изготовления сварочных электродов.

WRe (вольфрам-рений)
Для обеспечения большей пластичности и более низкой температуры перехода из хрупкого в вязкое состояние мы легируем вольфрам рением. Помимо прочего, вольфрам-рений имеет более высокую температуру рекристаллизации и более высокое сопротивление ползучести. Мы используем WRe в стандартных составах — WRe05 и WRe26 — в качестве материала для термоэлементов, которые должны выдерживать температуру более 2000 °C. Этот материал также используется в аэрокосмической промышленности.
Свойства
Хорош во всех отношениях. Свойства вольфрамаВольфрам относится к группе тугоплавких металлов, то есть металлов, температура плавления которых выше, чем у платины (1772 °C).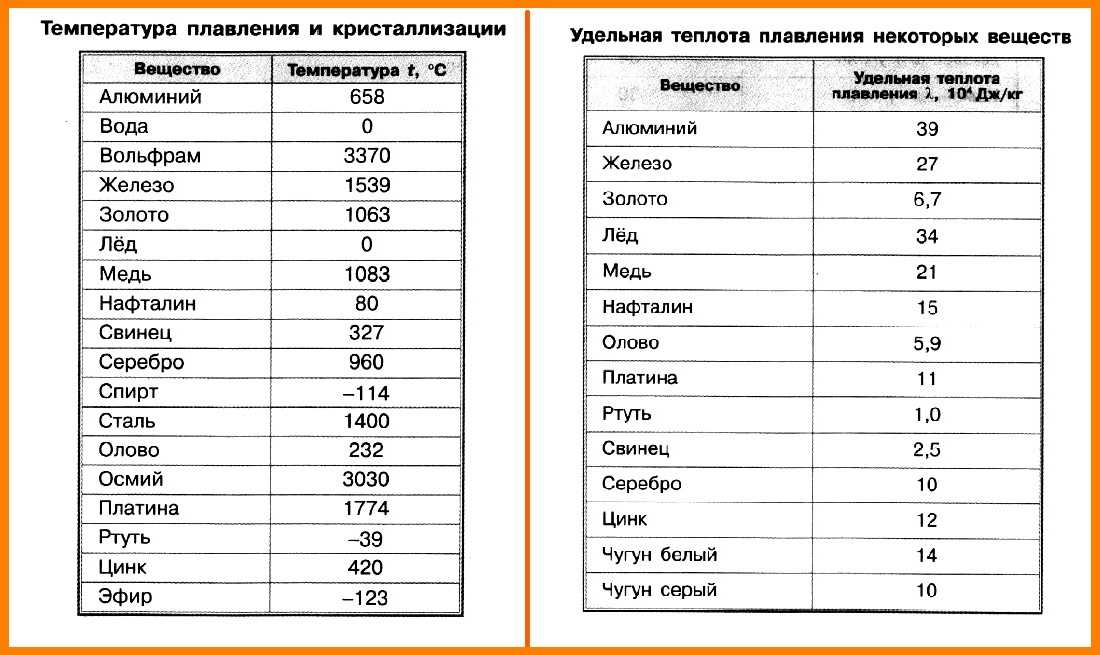 В тугоплавких металлах энергия связи между отдельными атомами особенно высока. Такие металлы отличаются высокой температурой плавления и одновременно низким давлением пара, хорошей жаропрочностью, а в случае вольфрамо-медных композитов — еще и высоким модулем упругости. Для них также характерны низкий коэффициент теплового расширения и относительно высокая плотность.
В тугоплавких металлах энергия связи между отдельными атомами особенно высока. Такие металлы отличаются высокой температурой плавления и одновременно низким давлением пара, хорошей жаропрочностью, а в случае вольфрамо-медных композитов — еще и высоким модулем упругости. Для них также характерны низкий коэффициент теплового расширения и относительно высокая плотность.
Вольфрам имеет самую высокую температуру плавления среди всех металлов, а также чрезвычайно высокий модуль упругости. В целом его свойства аналогичны молибдену. Оба металла относятся к одной группе в периодической системе химических элементов. Однако некоторые свойства вольфрама более ярко выражены по сравнению с молибденом. Благодаря превосходным термическим свойствам вольфрам легко выдерживает самые высокие температуры.
Чтобы придать выпускаемому вольфраму и его сплавам нужные свойства, мы используем разные виды и количества легирующих элементов и соответствующим образом настраиваем технологический процесс.
Мы используем преимущественно легированные вольфрамовые материалы. Например, в WVM и WК65 добавляется небольшое количество калия. Калий положительно влияет на механические свойства материала, особенно при высоких температурах. Добавлением La2O3 можно не только улучшить обрабатываемость сплава, но и, что особенно важно, снизить работу выхода электронов, что позволит использовать вольфрам для изготовления катодов.
Например, в WVM и WК65 добавляется небольшое количество калия. Калий положительно влияет на механические свойства материала, особенно при высоких температурах. Добавлением La2O3 можно не только улучшить обрабатываемость сплава, но и, что особенно важно, снизить работу выхода электронов, что позволит использовать вольфрам для изготовления катодов.
Рений мы добавляем, чтобы повысить пластичность вольфрама. Медь же улучшает электропроводность материала. Благодаря хорошей обрабатываемости наши тяжелые сплавы подходят также для производства изделий сложной геометрии. Они могут использоваться, например, в качестве материала для экранирующих пластин или амортизирующих и абсорбирующих компонентов.
Какими физическими свойствами обладает вольфрам?
Вольфрам обладает самой высокой точкой плавления среди всех тугоплавких металлов, довольно низким коэффициентом теплового расширения и относительно высокой плотностью.
 Нельзя также не отметить хорошую электропроводность и превосходную теплопроводность этого металла. Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже.
Нельзя также не отметить хорошую электропроводность и превосходную теплопроводность этого металла. Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже.Физические свойства вольфрама также зависят от температуры. Ниже приведены сравнительные графики основных характеристик материала.
На графике (вверху справа, в виде синей полосы разброса) показаны значения коэффициента эмиссии вольфрама в зависимости от температуры (взяты из публикаций и научных трудов). Значения коэффициента эмиссии, определенные экспериментально на образцах Plansee в стандартном состоянии поставки, находятся в верхней части полосы разброса.
Какими механическими свойствами обладает вольфрам?
Мы регулируем чистоту материала, определяем вид и количество легирующих компонентов и изменяем микроструктуру вольфрама путем особой термомеханической обработки, сочетающей в себе термообработку и формование.
 В результате получаем оптимальные материалы с нужным набором механических свойств для конкретных задач. Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести.
В результате получаем оптимальные материалы с нужным набором механических свойств для конкретных задач. Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести.Как и молибден, вольфрам имеет кубическую объемноцентрированную кристаллическую решетку и, следовательно, такой же характерный переход из хрупкого в вязкое состояние. Температуру перехода из хрупкого в вязкое состояние можно снизить путем деформации и легирования. Прочность возрастает с увеличением степени деформации. Однако, в отличие от других металлов, пластичность при этом также увеличивается. Для улучшения пластичности в вольфрам чаще всего добавляют рений.
ЛегированиеЛегирование пришло к нам из латинского языка (ligare — «связывать») через немецкий (legieren — «сплавлять»).
В металлургии под легированием понимается введение одного или нескольких легирующих элементов, содержание которых часто измеряется в микрограммах. Также часто используется термин «микролегирование». Содержание добавок при таком легировании достигает нескольких сотен микрограммов. Количество добавок часто измеряют в миллионных долях, обозначаемых как «ppm». Термин ppm происходит от английского parts per million, что означает «частей на миллион», т.е. 10-6.
Если вы планируете использовать вольфрам при высоких температурах, следует учитывать его температуру рекристаллизации. Ведь при повышении степени рекристаллизации снижается не только его прочность, но и пластичность. Легирование мелкими частицами оксида (например, оксида лантана или оксида церия) повышает температуру рекристаллизации и сопротивление ползучести вольфрама. Чем сильнее давление деформации, тем ощутимее действие оксидов, структура которых при термомеханической обработке становится еще более мелкозернистой.

В таблице приведена температура рекристаллизации наших вольфрамовых материалов при различной степени деформации.
Материал Температура [°C] при 100 % рекристаллизации (длительность отжига — 1 час) Степень деформации = 90 % Степень деформации = 99,99 % W (чистый) 1350 — WVM — 2000 WL10 1500 2500 WL15 1550 2600 WRe05 1700 — WRe26 1750 — При работе с вольфрамом необходимо тонкое чутье. Формование без обработки резанием, такое как гибка или отбортовка, должно осуществляться при температуре выше точки перехода из хрупкого в вязкое состояние. У вольфрама эта температура выше, чем у молибдена. Чем толще обрабатываемый лист, тем больше должна быть температура предварительного нагрева.
 Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать.
Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать.Какими химическими свойствами обладает вольфрам?
При относительной влажности ниже 60 % вольфрам устойчив к коррозии. В более влажном воздухе на нем образуются цветные налеты, но менее выраженные, чем у молибдена. Стеклянные расплавы, водород, азот, инертные газы, металлические расплавы и оксидные керамические расплавы воздействуют на вольфрам незначительно, даже при очень высоких температурах, если они не содержат дополнительных окислителей.

В таблице ниже приведены антикоррозионные свойства вольфрама. Если не указано иное, эти данные относятся к чистым растворам, не содержащих воздуха или азота. Инородные химически активные вещества даже в незначительных концентрациях могут сильно влиять на стойкость к коррозии. У вас есть вопросы по такой сложной проблеме, как коррозия? К вашим услугам наш опыт и собственная лаборатория по исследованию коррозии.
СРЕДА УСТОЙЧИВ (+), НЕУСТОЙЧИВ (-) ПРИМЕЧАНИЕ Вода Холодная и теплая вода < 80 °C + Горячая вода > 80 °C, деаэрированная + Пар до 700 °C + Кислоты Плавиковая кислота, HF + < 100 °C Соляная кислота, HCI + Фосфорная кислота, H3PO4 + < 270 °C Серная кислота, H2SO4 + < 70 %, < 190 °C Азотная кислота, HNO3 + Царская водка, HNO3 + 3 HCl + < 30 °C Органические кислоты + Щелочи Раствор аммиака, NH4OH + Гидроксид калия, KOH + < 50 %, < 100 °C Гидроксид натрия, NaOH + < 50 %, < 100 °C Галогены Фтор, F2 — Хлор, Cl2 + < 250 °C Бром, Br2 + < 450 °C Йод, I2 + < 450 °C Неметаллы Бор, B + < 1200 °C Углерод, C + < 1200 °C Кремний, Si + < 900 °C Фосфор, P + < 800 °C Сера, S + < 500 °C Газы* Аммиак, NH3 + < 1000 °C Монооксид углерода (окись углерода), CO + < 1400 °C Диоксид углерода (углекислый газ), CO2 + < 1200 °C Углеводороды + < 1200 °C Воздух и кислород, O2 + < 500 °C Инертные газы (He, Ar, N2) + Водород, H2 + Водяной пар + < 700 °C * Особое значение имеет точка росы газа.  Влажность может привести к окислению.
Влажность может привести к окислению.Плавление Стекловарение* + < 1700 °C Алюминий, Al + < 700 °C Бериллий, Be — Висмут, Bi + < 1400 °C Цезий, Cs + < 1200 °C Церий, Ce + < 800 °C Медь, Cu + < 1300 °C Европий, Eu + < 800 °C Галлий, Ga + < 1000 °C Золото, Au + < 1100 °C Железо, Fe — Свинец, Pb + < 1100 °C Литий, Li + < 1600 °C Магний, Mg + < 1000 °C Ртуть, Hg + < 600 °C Никель, Ni — Плутоний, Pu + < 700 °C Калий, K + < 1200 °C Рубидий, Rb + < 1200 °C Самарий, Sm + < 800 °C Скандий, Sc + < 1400 °C Серебро, Ag + Натрий, Na + < 600 °C Олово, Sn + < 980 °C Уран, U + < 900 °C Цинк, Zn + < 750 °C Материалы для печестроения Оксид алюминия, Al2O3 + < 1900 °C Оксид бериллия, BeO + < 2000 °C Графит, C + < 1200 °C Магнезит, MgCO3 + < 1600 °C Оксид магния, MgO + < 1600 °C Карбид кремния, SiC + < 1300 °C Оксид циркония, ZrO2 + < 1900 °C Коррозионная стойкость вольфрама
| W |
WK65 |
WVM |
WL | |
| Содержание легирующих элементов (в массовых процентах) |
99,97 % Вт | 60–65 мкг/г K | 30–70 мкг/г K |
0,5 % La2O3 1,0 % La2O3 1,5 % La2O3 2,0 % La2O3 |
| Теплопроводность | ∼ | ∼ | ∼ | ∼ |
| Стойкость к высоким температурам / сопротивление ползучести |
∼ | ++ | ++ + |
+ |
| Температура рекристаллизации | ∼ | ++ | ++ | + |
| Мелкозернистость | ∼ | + | + | + |
| Пластичность |
∼ | + | + | + |
| Обрабатываемость/деформируемость |
∼ | + | + | ++ |
| Работа выхода электронов | ∼ | ∼ | ∼ | — |
∼ на уровне чистого W + выше, чем у чистого W ++ значительно выше, чем у чистого W — ниже, чем у чистого W — значительно ниже, чем у чистого W
| WC20 | WRe | WCu | |
| Содержание легирующих элементов (в массовых процентах) |
2 % CeO2 | 5 % / 26 % Re | 10–40 % Cu |
| Теплопроводность | ∼ | — |
+ |
| Стойкость к высоким температурам / сопротивление ползучести |
+ | + | — |
| Температура рекристаллизации | + | + | |
| Мелкозернистость | + | ∼ | |
| Пластичность |
+ | ++ | ++ |
| Обрабатываемость/деформируемость |
++ | + | ++ |
| Работа выхода электронов | + |
∼ на уровне чистого W + выше, чем у чистого W ++ значительно выше, чем у чистого W — ниже, чем у чистого W — значительно ниже, чем у чистого W
Особенности и область применения
Показатели качества
Благодаря уникальным свойствам вольфрам находит особое применение в промышленности. Ниже представлены три примера его использования.
Ниже представлены три примера его использования.
Отличное сопротивление ползучести и высокая чистота
Из нашего вольфрама получаются отличные тигли для плавления и отверждения в отрасли выращивания кристаллов сапфира. Высокая чистота материала предотвращает загрязнение кристаллов, а хорошее сопротивление ползучести гарантирует постоянство формы. Даже самые высокие температуры не влияют на результат процесса.
Исключительная чистота материала и хорошая электропроводность
Самый низкий коэффициент теплового расширения среди всех металлов и хорошая электропроводность делают вольфрам идеальным материалом для тонких покрытий. Хорошая электропроводность и низкая степень диффузии в соседние слои делают вольфрам незаменимым в тонкопленочных транзисторах, например тех, которые используются в экранах TFT-LCD.
 Разумеется, материал высочайшей чистоты для покрытий в виде мишеней для напыления можно приобрести у нас. Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов.
Разумеется, материал высочайшей чистоты для покрытий в виде мишеней для напыления можно приобрести у нас. Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов.Длительный срок службы и самая высокая температура плавления
Благодаря длительному сроку службы при самых высоких температурах наши вольфрамовые тигли и стержни оправок легко выдерживают даже воздействие расплавленного кварцевого стекла. Использование вольфрама высокой степени чистоты позволяет избежать образования пузырьков и обесцвечивания кварцевого расплава.
Добыча
Естественные месторождения и переработка рудыВольфрам был впервые обнаружен в Средние века в Рудных горах (на границе между Саксонией и Богемией) в процессе восстановления олова. Однако в то время он считался нежелательным сопутствующим элементом. Вольфрамовая руда способствовала образованию шлака в процессе восстановления олова и тем самым снижала выход олова из руды. Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу». В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу». В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
В природе вольфрамовая руда в основном встречается в виде вольфрамита ((Fe/Mn)WO4) и шеелита (CaWO4). Крупнейшие месторождения вольфрама находятся в Китае, России и США. В Австрии также есть шеелит, он добывается в Миттерзилле в районе Фельбертауэрн.
В зависимости от месторождения вольфрамовые руды содержат от 0,3 до 2,5 массового процента WO3. Путем дробления, шлифовки, флотации и обжига можно увеличить содержание WO3 примерно до 60 %. Оставшиеся примеси устраняются путем гидролиза раствором едкого натра. Полученный вольфрамат натрия превращают в паравольфрамат аммония (APW) в процессе ионообменной экстракции.
Путем дробления, шлифовки, флотации и обжига можно увеличить содержание WO3 примерно до 60 %. Оставшиеся примеси устраняются путем гидролиза раствором едкого натра. Полученный вольфрамат натрия превращают в паравольфрамат аммония (APW) в процессе ионообменной экстракции.
Восстановление производится в водородной атмосфере при температуре от 500 до 1000 °C:
| WO3+ 3H2 › W + 3H2O |
Наша аффилированная компания GTP специализируется на переработке, извлечении и восстановлении паравольфрамата аммония (APW). GTP поставляет нам металлический вольфрам высокой чистоты и стабильно высокого качества.
На страницу GTPЗакупки в соответствии с RMAP
Часть поставляемого на рынки вольфрама происходит из так называемых «конфликтных источников», то есть добывается в зонах военных конфликтов: прежде всего в Демократической Республике Конго (ДРК) и соседних странах. Мы осознаем свою ответственность перед обществом и принципиально не используем сырье, которое может быть связано с такими конфликтами.
Мы осознаем свою ответственность перед обществом и принципиально не используем сырье, которое может быть связано с такими конфликтами.
По собственной инициативе мы подтверждаем безупречное происхождение нашего вольфрама особым сертификатом. В этом документе в соответствии с инициативой RMI (Responsible Minerals Initiative), ранее известной как CFSP, подтверждается использование вольфрамового сырья из этически благонадежных источников. Аудиторский комитет RBA и GeSI подтвердил, что зарегистрированная в Тованде компания Global Tungsten & Powders (GTP) — часть Plansee Group — закупает вольфрам в соответствии с требованиями RMAP. Для клиентов Plansee этот сертификат также является независимым доказательством того, что Plansee Group получает вольфрам из бесконфликтных источников.
Подробнее о принципе устойчивостиПроизводственный процесс
Как все это делается? Методами порошковой металлургии!Что такое порошковая металлургия? В настоящее время, как известно, большинство промышленных металлов и сплавов, таких как сталь, алюминий и медь, получают в виде черновых отливок с использованием литейных форм.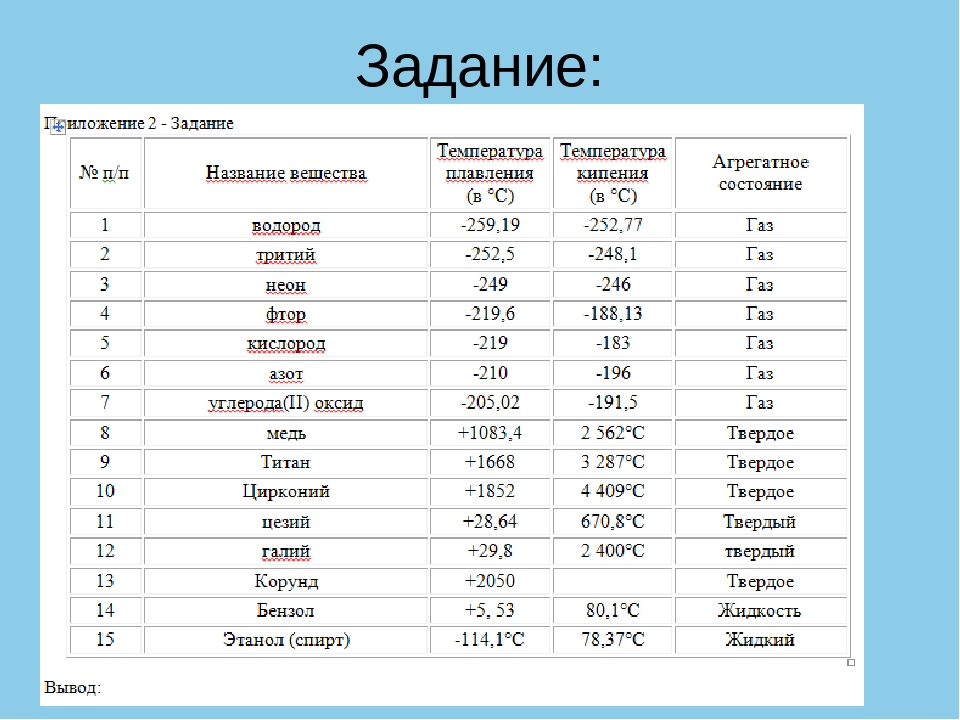 В порошковой металлургии плавление не применяется: изделия создаются путем прессования металлических порошков и последующей термической обработки (спекания) ниже температуры плавления материала. Три важные составляющие порошковой металлургии — металлический порошок, прессование, спекание. Все эти составляющие находятся под нашим полным контролем, и мы можем оптимизировать их собственными силами.
В порошковой металлургии плавление не применяется: изделия создаются путем прессования металлических порошков и последующей термической обработки (спекания) ниже температуры плавления материала. Три важные составляющие порошковой металлургии — металлический порошок, прессование, спекание. Все эти составляющие находятся под нашим полным контролем, и мы можем оптимизировать их собственными силами.
Почему мы выбрали порошковую металлургию? Порошковая металлургия позволяет получать материалы с температурой плавления более 2000 °C. Производство будет экономически выгодным даже при выпуске небольших объемов продукции. Порошковые смеси с индивидуально подобранным составом позволяют получать исключительно однородные материалы с регулируемыми свойствами.
Вольфрамовый порошок смешивается с легирующими присадками (если таковые предусмотрены) и подвергается холодному изостатическому прессованию с давлением до 2000 бар. Полученная прессовка спекается в специальных печах при температуре выше 2000 °C. При этом формируется особая микроструктура и значительно увеличивается плотность материала. Особые свойства (высокую жаропрочность и твердость либо специальные характеристики текучести) нашим материалам придают верно подобранные методы формования, такие как ковка, прокатка, волочение. Идеальная согласованность всех этапов производства — вот секрет высочайшего качества нашей продукции, непревзойденной чистоты материалов и полного соответствия самым жестким стандартам.
При этом формируется особая микроструктура и значительно увеличивается плотность материала. Особые свойства (высокую жаропрочность и твердость либо специальные характеристики текучести) нашим материалам придают верно подобранные методы формования, такие как ковка, прокатка, волочение. Идеальная согласованность всех этапов производства — вот секрет высочайшего качества нашей продукции, непревзойденной чистоты материалов и полного соответствия самым жестким стандартам.
Восстановление
Смешивание, плавление
Прессование
Спекание
Формовка
Термообработка
Механическая обработка
Контроль качества
Повторное использование
ОксидMolymet (Чили) — крупнейшая в мире компания по переработке молибденовых рудных концентратов и наш основной поставщик триоксида молибдена.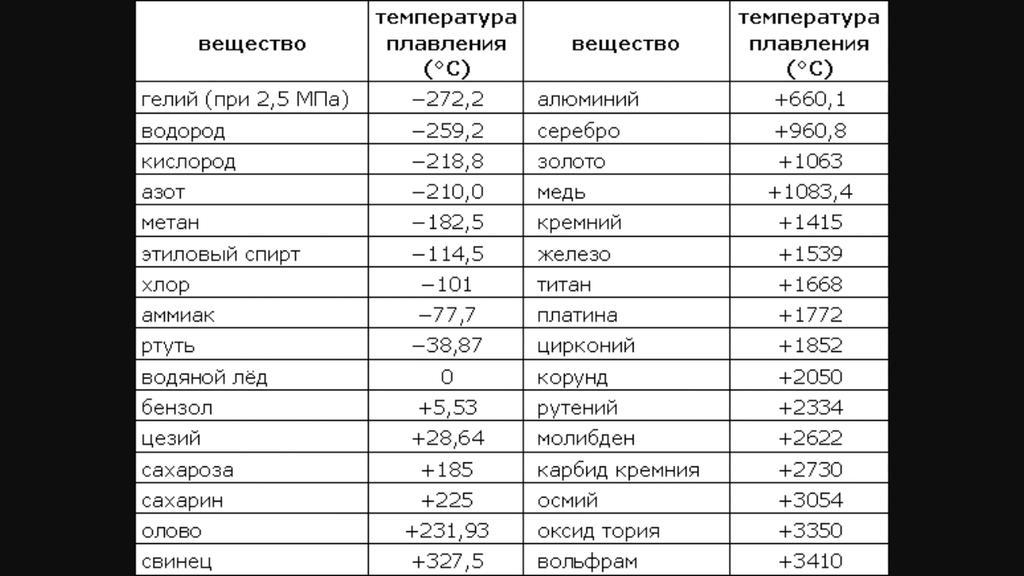 Plansee Group является акционером Molymet с долей участия 21,15 %. Global Tungsten & Powders (США) — подразделение Plansee Group и наш основной поставщик вольфрамового порошка.
Plansee Group является акционером Molymet с долей участия 21,15 %. Global Tungsten & Powders (США) — подразделение Plansee Group и наш основной поставщик вольфрамового порошка.
Ассортимент продукции
| Материал | Листы и пластины [толщина] | Прутки [диаметр] | Проволока [диаметр] |
| W | 0,025–20 мм | 0,3–90 мм | 0,025–1,50 мм |
| W-UHP | На заказ | ||
| WK65 | 0,010–1,50 мм | ||
| WVM | 0,05–5 мм | 0,3–12,99 мм | 0,050–1,50 мм |
| WVMW | 13–45 мм | ||
| WL05/WL10/WL15 | На заказ | 0,3–90 мм | |
| WC20 | На заказ | ||
| WRe05/WRe26 | На заказ | 0,4–1,50 мм |
Если у вас остались вопросы по перечисленным выше размерам или вы хотите приобрести полуфабрикаты из других материалов, например WCu или INERMET®, свяжитесь с нами.
Интернет-магазин
Здесь вы можете легко и быстро заказать листовой и полосовой металл, прутки, проволоку, а также другую продукцию из вольфрама и вольфрамовых сплавов, любых размеров.
Загрузки
Требуется дополнительная информация о вольфраме и его сплавах? Все необходимые сведения можно найти в технических паспортах наших продуктов.
Вопросы и ответы
Ответы на часто задаваемые вопросы о вольфраме
Является ли вольфрам металлом?
Вольфрам — это тугоплавкий (жаростойкий) металл, который относится к группе переходных металлов. Его химический символ — латинская буква «W», а атомный номер — 74. Тугоплавкими называют металлы, температура плавления которых выше, чем у платины (1772 °C).
Какими свойствами обладает вольфрам?
Ни один металл не сравнится с вольфрамом по жаропрочности.
 У вольфрама самая высокая точка плавления среди металлов, и он не разрушается даже при очень высоких температурах. Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью.
У вольфрама самая высокая точка плавления среди металлов, и он не разрушается даже при очень высоких температурах. Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью.Где применяется вольфрам?
Благодаря уникальным механическим и химическим свойствам вольфрам отлично подходит для применения в сложных средах с целым спектром жестких требований. Из этого материала мы изготавливаем, например, компоненты для высокотемпературных печей, ламп, медицинской техники и систем нанесения тонких покрытий.
Откуда произошло название «вольфрам»?
Вольфрам был впервые обнаружен в Средние века в Рудных горах (на границе между Саксонией и Богемией) в процессе восстановления олова.
 Однако в то время он считался нежелательным сопутствующим элементом. Вольфрамовая руда способствовала образованию шлака в процессе восстановления олова и тем самым снижала выход олова из руды. Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу». В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
Однако в то время он считался нежелательным сопутствующим элементом. Вольфрамовая руда способствовала образованию шлака в процессе восстановления олова и тем самым снижала выход олова из руды. Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу». В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.Где добывают вольфрам?
В природе вольфрамовая руда в основном встречается в виде вольфрамита ((Fe/Mn)WO4) и шеелита (CaWO4).
 Крупнейшие месторождения вольфрама находятся в Китае, России и США. В Австрии также есть шеелит, он добывается в Миттерзилле в районе Фельбертауэрн.
Крупнейшие месторождения вольфрама находятся в Китае, России и США. В Австрии также есть шеелит, он добывается в Миттерзилле в районе Фельбертауэрн.
Другие материалы
4295.94
Mo
Molybdän
73180.95
Ta
Tantal
W-MMC
Metal Matrix Composites
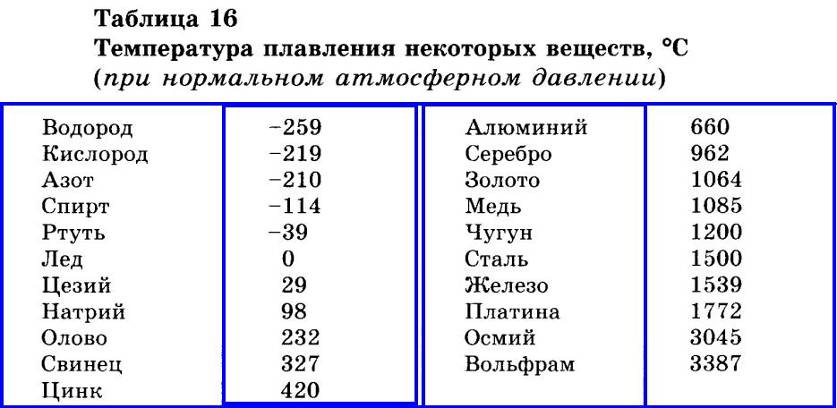
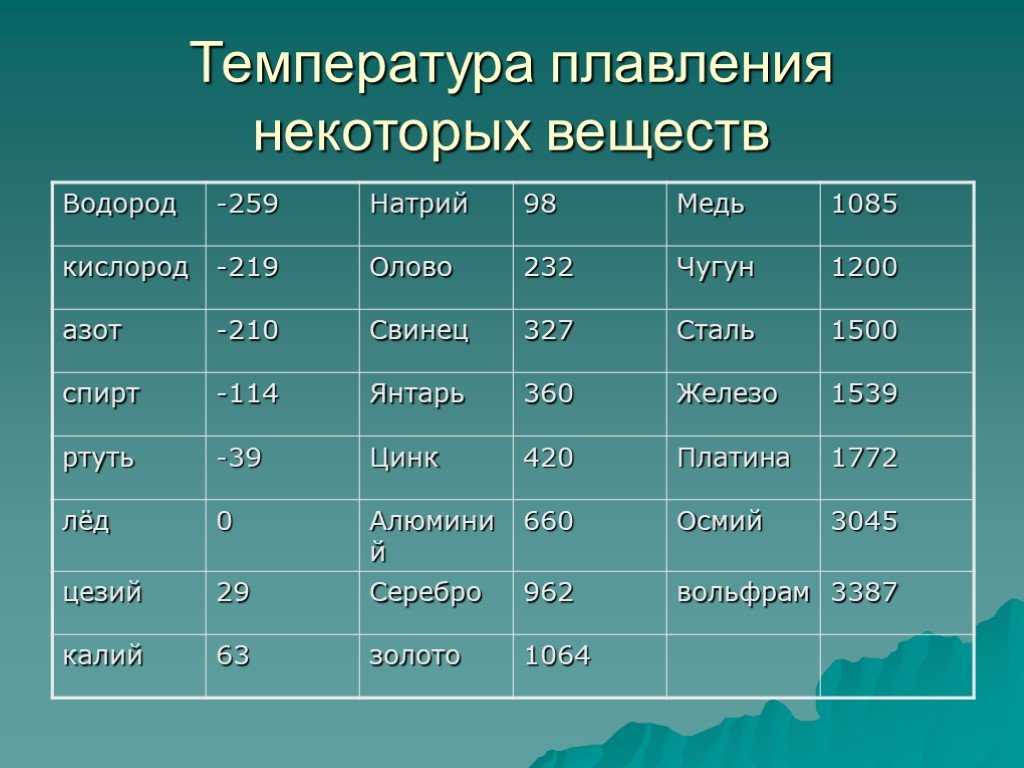
таблица по возрастанию в градусах, самая высокая температура плавления
Plazmen.ru » Сварка
Автор Валерий Шилков На чтение 6 мин Просмотров 19.6к.
Металлы и сплавы — это незаменимая основа для литейного и ювелирного производства, ковки и многих других сфер. Что бы ни делал человек из металла (какой бы это ни был процесс), для правильной работы ему нужно знать, при какой температуре плавится тот или иной металл. Мы подробно рассмотрим процесс плавления, его отличие от кипения, а также сравним температуры в таблицах.
Содержание
Таблица температур плавления
Узнать какая нужна температура для плавления металлов, поможет таблица по возрастанию температурных показателей.
| Элемент или соединение | Необходимый температурный режим |
|---|---|
| Литий | +18°С |
| Калий | +63,6°С |
| Индий | +156,6°С |
| Олово | +232°С |
| Таллий | +304°С |
| Кадмий | +321°С |
| Свинец | +327°С |
| Цинк | +420°С |
| Элемент либо сплав | Температурный режим |
|---|---|
| Магний | +650°С |
| Алюминий | +660°С |
| Барий | +727°С |
| Серебро | +960°С |
| Золото | +1063°С |
| Марганец | +1246°С |
| Медь | +1083°С |
| Никель | +1455°С |
| Кобальт | +1495°С |
| Железо | +1539°С |
| Дюрали | +650°С |
| Латуни | +950…1050°С |
| Чугун | +1100…1300°С |
| Углеродистые стали | +1300…1500°С |
| Нихром | +1400°С |

| Наименование элемента | Температурный режим |
|---|---|
| Титан | +1680°С |
| Платина | +1769,3°С |
| Хром | +1907°С |
| Цирконий | +1855°С |
| Ванадий | +1910°С |
| Иридий | +2447°С |
| Молибден | +2623°С |
| Тантал | +3017°С |
| Вольфрам | +3420°С |
Что такое температура плавления
Каждый металл имеет неповторимые свойства, и в этот список входит температура плавления. При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
Плавление и кипение – это не одно и то же. Точкой перехода вещества из твердого состояния в жидкое, зачастую называют температуру плавления металла. В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
При кипении объем теряется, молекулы между собой очень слабо взаимодействуют, движутся хаотично в разных направлениях, совершают отрыв от поверхности. Температура кипения – это процесс, при котором давление металлического пара приравнивается к давлению внешней среды.
Для того, чтобы упростить разницу между критическими точками нагрева мы подготовили для вас простую таблицу:
| Свойство | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав переходит в расплав, разрушается кристаллическая структура, проходит зернистость | Переходит в состояние газа, некоторые молекулы могут улетать за пределы расплава |
| Фазовый переход | Равновесие между твердым состоянием и жидким | Равновесие давления между парами металла и воздухом |
| Влияние внешнего давления | Нет изменений | Изменения есть, температура уменьшается при разряжении |
При какой температуре плавится
Металлические элементы, какими бы они ни были — плавятся почти один в один. Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь — сера, а извлечь ее допустимо лишь в жидком виде.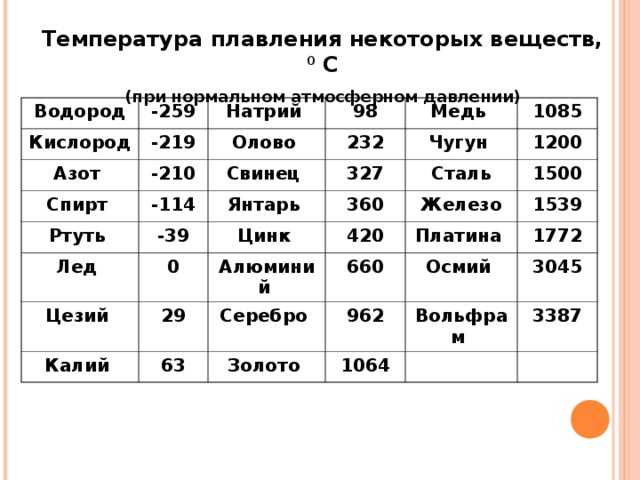
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый — температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый — температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Важно! Показатели плавления такого металла, как чугун – на 400 градусов ниже, по сравнению со сталью. Это значительно снижает затраты энергии при обработке.
Плавление стали
Плавления стали при температуре 1400 °CСталь — это сплав железа с примесью углерода. Её главная польза — прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму.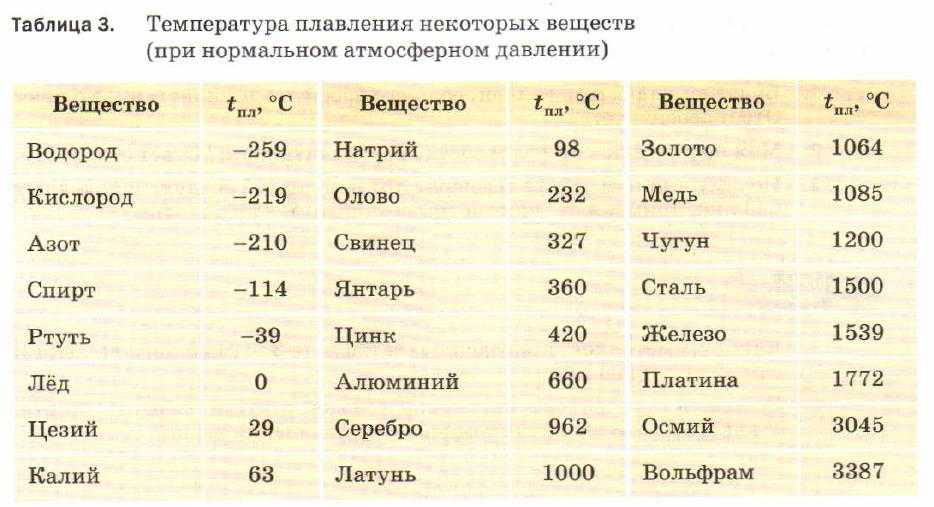 Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Справка! Сталь плавится при 1400 °C.
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
От чего зависит температура плавления
Для разных веществ температура, при которой полностью перестраивается структура до жидкого состояния – разная. Если взять во внимание металлы и сплавы, то стоит подметить такие моменты:
- В чистом виде не часто можно встретить металлы. Температура напрямую зависит от его состава. В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
- Бывают сплавы, которые благодаря своему химическому составу могут переходить в жидкое состояние при температуре свыше ста пятидесяти градусов.
 Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Термообработка, в большинстве случаев, почти не изменяет устойчивость к нагреву. Единственно верным способом увеличения устойчивости к нагреванию можно назвать внесение изменений в химический состав, для этого и проводят легирование стали.
У какого металла самая высокая температура плавления
Вольфрам – самый тугоплавкий металл, 3422 °C (6170 °F).Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Примечание! Технически, чистый металл при температуре выше 400 °C становится очень пластичным. Демонстрирует химическую инертность, неохотно вступает в реакции с другими элементами. В природе встречается в виде таких сложных минералов, как: гюбнерит, шеелит, ферберит и вольфрамит.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям. По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
Оцените автора
У какого вещества температура плавления самая высокая
Для улучшения свойств вольфрама (тугоплавкости, устойчивости к коррозии, износостойкости) в него добавляют легирующие металлы.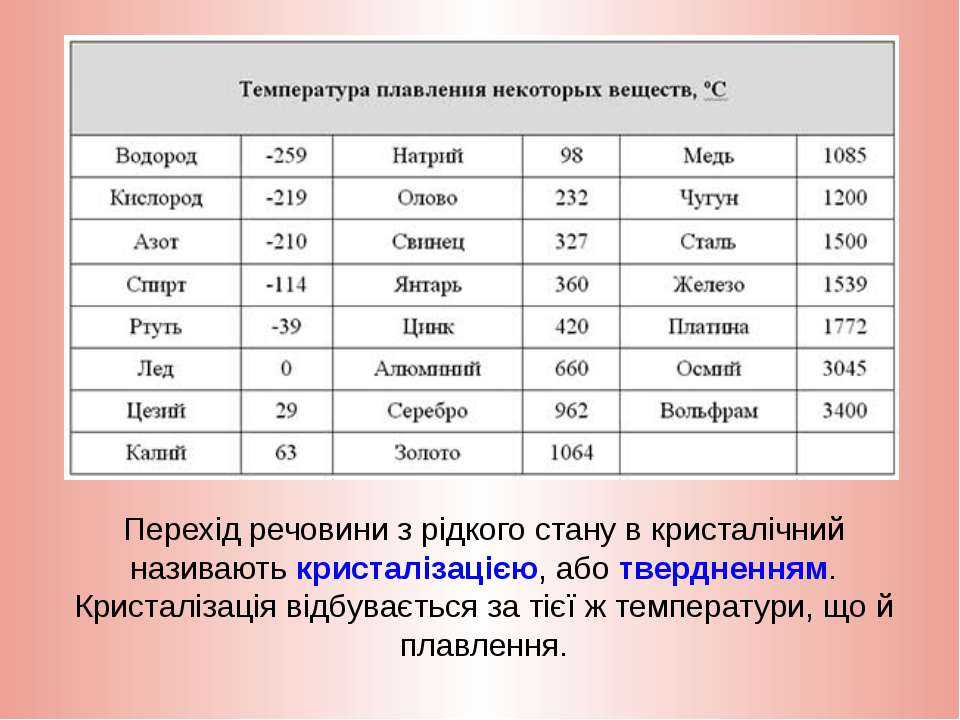 Например, рений и торий.
Например, рений и торий.
Металл используется для производства нитей накаливания для осветительных и сушильных ламп. Его добавляют в сварочные электроды, элементы электронных ламп и рентгеновских трубок. Также применяется при производстве элементов ракет, в реактивных двигателях, артиллерийских снарядах.
Чтобы изменить свойства того или иного металла, его сплавляют с другими веществами. Так, он может не только приобрести большую плотность, прочность, но и снизить или повысить температуру плавления.
Сплав может состоять из двух или больше химических элементов, но хотя бы один из них должен быть металлом. Такие «смеси» очень часто используют в промышленности, ведь они позволяют получить именно те качества материалов, которые необходимы.
Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорций и состава вторых. Для получения легкоплавких сплавов чаще всего используют свинец, ртуть, таллий, олово, кадмий, индий. Те, в составе которых находится ртуть, называются амальгамами.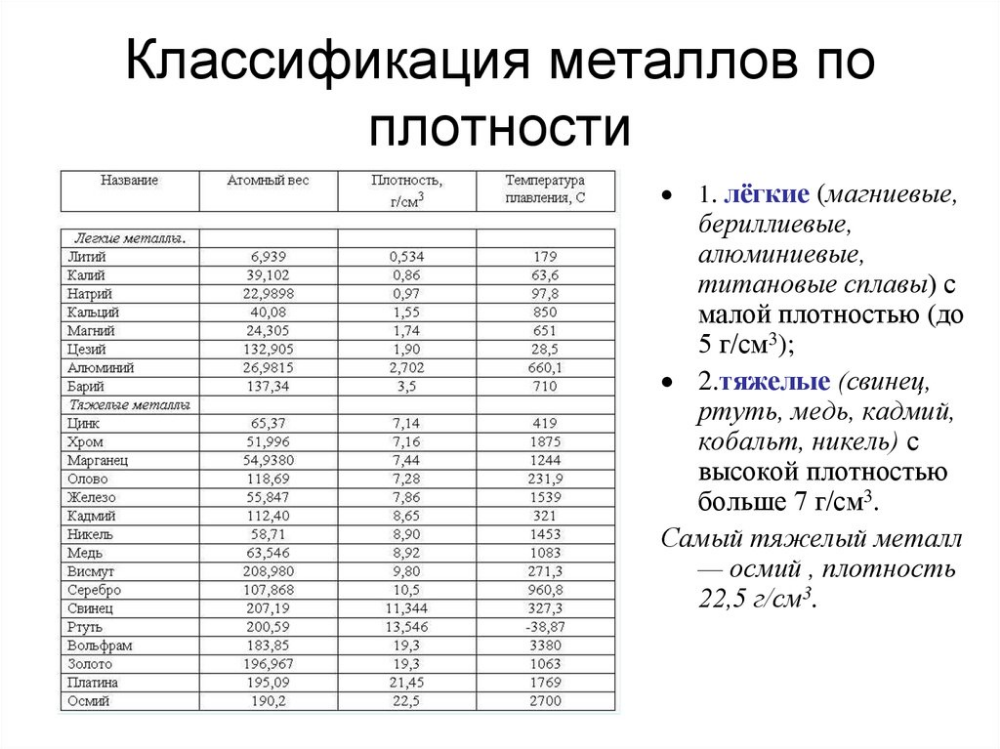 Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия – при минус 61°C. Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия – при минус 61°C. Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Самым сильным стабильным окислителем
, является комплекс дифторида криптона и пентафторида сурьмы. Из-за сильного окисляющего действия (окисляет все элементы в высшие степени окисления, в том числе кислород и азот воздуха) для него очень трудно измерить электродный потенциал. Единственный растворитель, который реагирует с ним достаточно медленно – безводный фтористый водород.
Самым плотным веществом
, является осмий. Его плотность составляет 22,5 г/см 3 .
Самый легкий металл
– это литий. Его плотность составляет 0,543 г/см 3 .
Самый дорогой металл
– это калифорний. Его стоимость в настоящее время составляет 6 500 000 долларов за 1 грамм.
Самый распространенный элемент в земной коре
– это кислород.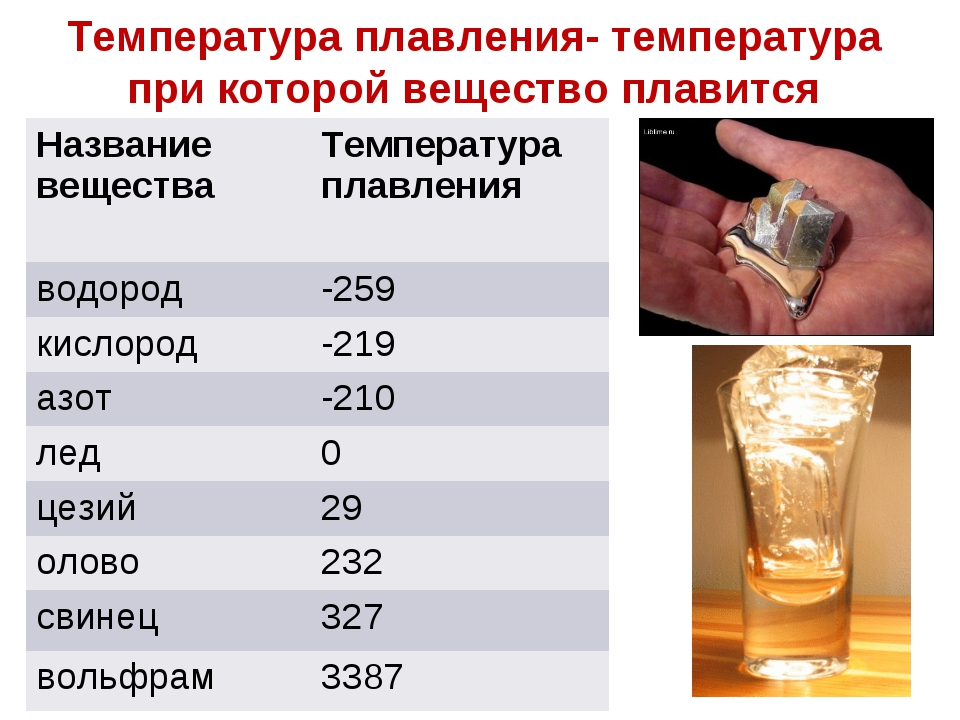 Его содержание составляет 49% от массы земной коры.
Его содержание составляет 49% от массы земной коры.
Самый редкий элемент в земной коре
– это астат. Его содержание во всей земной коре, по оценкам специалистов составляет всего 0,16 грамм.
Самым горючим веществом
, является, по-видимому, мелкий порошок циркония. Для того чтоб он не мог гореть, необходимо поместить его в атмосферу инертного газа на пластину из материала, не содержащего неметаллов.
Веществом с наименьшей температурой кипения
, является гелий. Его температура кипения равна -269 градусов по Цельсию. Гелий – единственное вещество, не имеющее температуры плавления при обычном давлении. Даже при абсолютном нуле он остается жидким. Жидкий гелий широко используется в криогенной технике.
Самый тугоплавкий металл
– это вольфрам. Его температура плавления составляет +3420 градусов по Цельсию. Из него изготовляют нити накаливания для электрических лампочек.
Самый тугоплавкий материал
– это сплав карбидов гафния и тантала (1:1).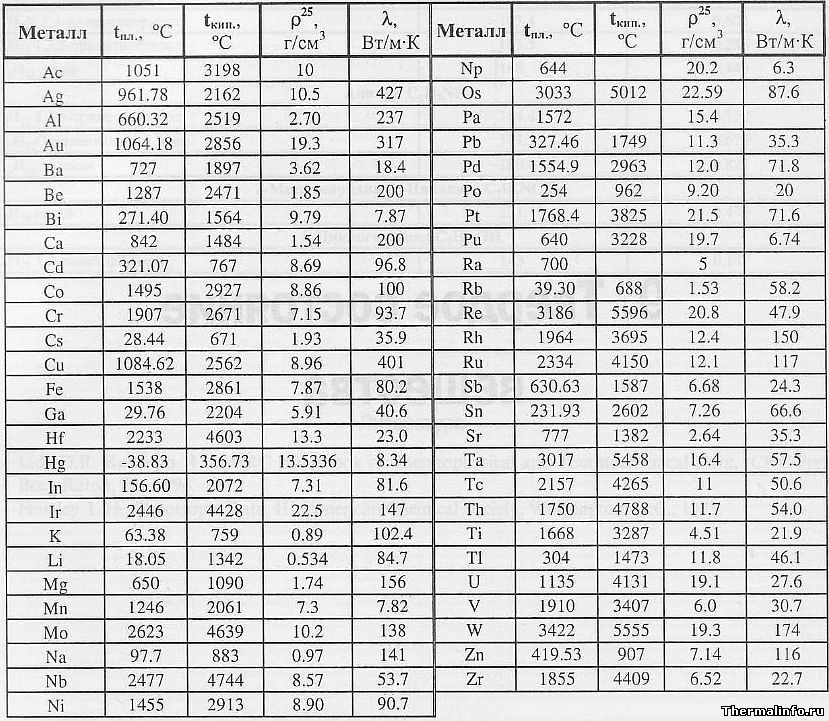 Он имеет температуру плавления +4215 С.
Он имеет температуру плавления +4215 С.
Самым легкоплавким металлом
, является ртуть. Ее температура плавления равна -38,87 градусов по Цельсию. Она же является
самой тяжелой жидкостью
, ее плотность составляет 13,54 г/см 3 .
Самую высокую растворимость в воде среди твердых веществ
имеет трихлорид сурьмы. Его растворимость при +25 С составляет 9880 грамм на литр.
Самым легким газом
, является водород. Масса 1 литра составляет всего 0,08988 грамм.
Самым тяжелым газом при комнатной температуре
, является гексафторид вольфрама (т. кип. +17 С). Его масса составляет 12,9 г/л, т.е. в нем могут плавать некоторые виды пенопласта.
Самым стойким к кислотам металлом
, является иридий. До сих пор не известно ни одной кислоты или их смеси, в которых он бы растворялся.
Самый широкий диапазон концентрационных пределов взрываемости
имеет сероуглерод. Взрываться могут все смеси паров сероуглерода с воздухом содержащие от 1 до 50 объемных процентов сероуглерода.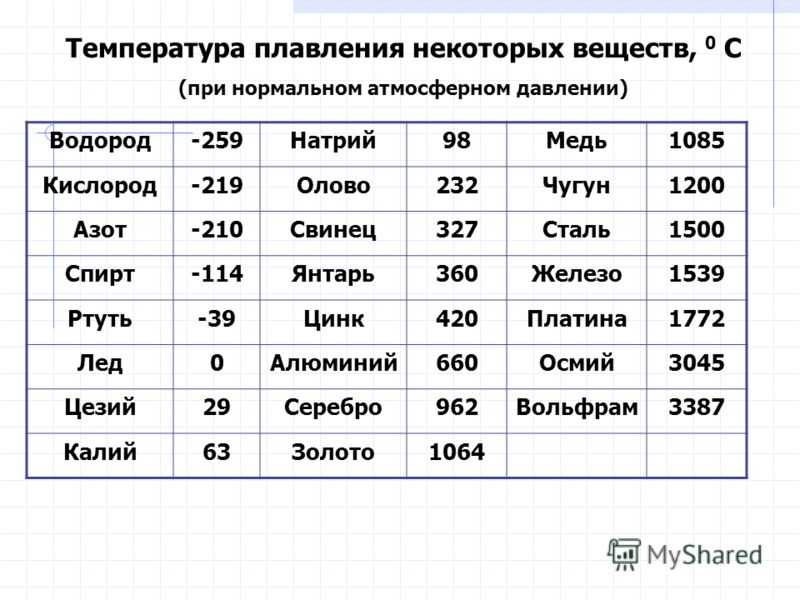
Самой сильной стабильной кислотой
является раствор пентафторида сурьмы во фтористом водороде. В зависимости от концентрации пентафторида сурьмы эта кислота может иметь показатель Гаммета до -40.
Самым необычным анионом в соли
является электрон. Он входит в состав электрида 18-краун-6 комплекса натрия.
Рекорды для органических веществ
Самым горьким веществом
, является денатония сахаринат. Его получили случайно, во время исследования денатония бензоата. Сочетание последнего с натриевой солью сахарина дало вещество в 5 раз более горькое, чем предыдущий рекордсмен (денатония бензоат). В настоящее время оба этих вещества используются для денатурации спирта и других непищевых продуктов.
Самым сильным ядом
, является ботулинический токсин типа А. Его летальная доза для мышей (ЛД50, внутрибрюшинно) составляет 0,000026 мкг/кг веса. Это белок с молекулярной массой 150 000, продуцируемый бактерией Clostridium botulinum.
Самым нетоксичным органическим веществом
, является метан. При увеличении его концентрации интоксикация возникает из-за недостатка кислорода, а не в результате отравления.
Самый сильный адсорбент
, был получен в 1974 году из производного крахмала, акриламида и акриловой кислоты. Это вещество способно удерживать воду, масса которой в 1300 раз превосходит его собственную.
Самыми зловонными соединениями
, являются этилселенол и бутилмеркаптан. Концентрация которую человек может обнаружить по запаху так мала, что до сих пор нет методов позволяющих ее точно определить. По оценкам величина ее составляет 2 нанограмма на кубометр воздуха.
Самым сильным галлюциногенным веществом
, является диэтиламид l-лизергиновой кислоты. Доза всего в 100 микрограмм вызывает галлюцинации продолжающиеся около суток.
Читать также: Шлифовочный диск по бетону на болгарку
Самым сладким веществом
, является N-(N-циклонониламино(4-цианофенилимино)метил)-2-аминоуксусная кислота. Это вещество в 200 000 раз превосходит по сладости 2% раствор сахарозы, но из-за своей токсичности, применения в качестве подсластителя, по видимому не найдет. Из промышленных веществ самым сладким является талин, который в 3 500 – 6 000 раз слаще сахарозы.
Это вещество в 200 000 раз превосходит по сладости 2% раствор сахарозы, но из-за своей токсичности, применения в качестве подсластителя, по видимому не найдет. Из промышленных веществ самым сладким является талин, который в 3 500 – 6 000 раз слаще сахарозы.
Самым медленным ферментом
, является нитрогеназа, катализирующая усвоение клубеньковыми бактериями атмосферного азота. Полный цикл превращения одной молекулы азота в 2 иона аммония занимает полторы секунды.
Самое длинное химическое название, опубликованное в литературе,
содержало 1578 букв и знаков и описывало синтетический аналог цепочки нуклеотидов.
Самым сильным наркотическим анальгетиком
является, по-видимому, вещество, синтезированное в Канаде в 80-х годах. Его эффективная анальгетическая доза для мышей (подкожное введение) составляет всего 3,7 нанограмма на килограмм веса, то есть он в 500 раз сильнее эторфина.
Органическим веществом с самым большим содержанием азота
является бис(диазотетразолил)гидразин.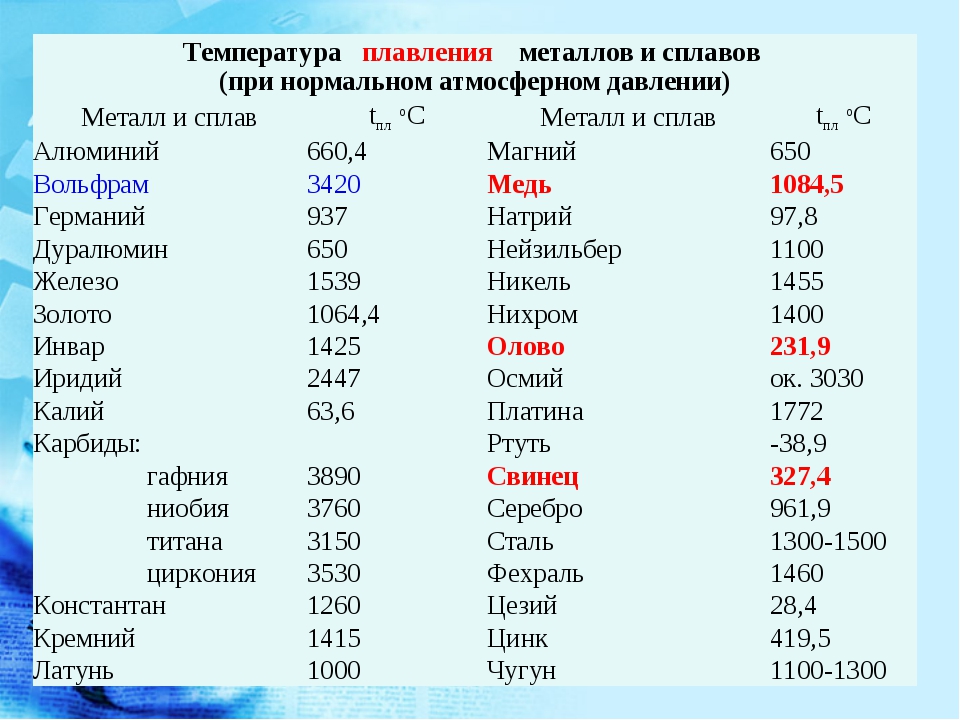 Он содержит 87,5% азота. Это взрывчатое вещество черезвычайно чувствительно к удару, трению и теплу.
Он содержит 87,5% азота. Это взрывчатое вещество черезвычайно чувствительно к удару, трению и теплу.
Веществом с самой большой молекулярной массой
является гемоцианин улитки (переносит кислород). Его молекулярная масса составляет 918 000 000 дальтон, что больше молекулярной массы даже ДНК.
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
точек плавления металлов | OnlineMetals.com®
Температура плавления металлов | OnlineMetals.com®Сэкономьте до 60% на Выберите лист/плиту из углеродистой стали Сегодня!
- Дом
- Температура плавления металлов
Один из наиболее часто задаваемых вопросов касается температуры плавления металлов. В зависимости от проекта или конечного использования температура плавления может иметь огромное влияние на результат. Если вы пытаетесь расплавить металл или подвергаете металл воздействию высоких температур, вам нужно знать температуру плавления конкретного материала, который вы используете.
В зависимости от проекта или конечного использования температура плавления может иметь огромное влияние на результат. Если вы пытаетесь расплавить металл или подвергаете металл воздействию высоких температур, вам нужно знать температуру плавления конкретного материала, который вы используете.
Температура плавления сплавов железа и температура плавления стали возникают при более высоких температурах, около 2200-2500 градусов по Фаренгейту (°F) / 1205-1370 градусов по Цельсию (°C). Температура плавления медных сплавов (включая бронзу, чистую медь и латунь) ниже, чем у железа, и колеблется в пределах 1675-1981°F / 913-1082°C. Металлы, легированные алюминием, и температура плавления алюминия имеют более низкий температурный диапазон, чем медные сплавы. Чистый алюминий плавится при температуре около 1218 ° F / 659 ° C, но сплавление с другими элементами может повысить ее. В приведенной ниже таблице указаны наиболее распространенные металлы, представленные в нашем каталоге, такие как температура плавления нержавеющей стали и точка плавления титана!
- Общие точки плавления металлов
- Какой металл имеет самую низкую температуру плавления
- Какой металл имеет самую высокую температуру плавления
- Видео-руководство по точкам плавления
- Полный список всех металлов и температур их плавления
Стандартные металлы с температурой плавления
В этой таблице температур плавления указаны наиболее распространенные металлы, используемые в производстве, в порядке их температур плавления, и они чаще используются из-за таких факторов, как прочность и коррозионная стойкость.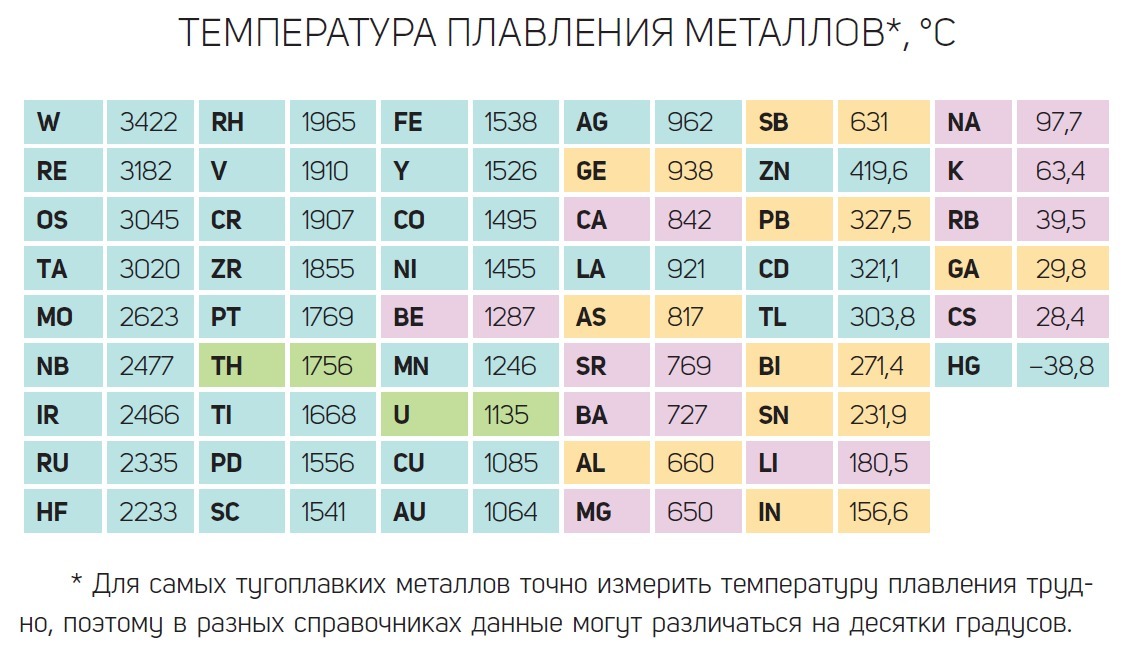 Просканируйте ниже, чтобы узнать температуры плавления популярных металлов, которые вы можете приобрести в Online Metals сегодня.
Просканируйте ниже, чтобы узнать температуры плавления популярных металлов, которые вы можете приобрести в Online Metals сегодня.
Алюминий
Латунь, желтая
1660-1710
905-932
Бронза
Brass, Red
1810-1880
990-1025
Copper
Cast Iron
2060-2200
1127-1204
Carbon Steel
2500-2800
1371-1593
Nickel
Кованое железо
2700-2900
1482-1593
Нержавеющая сталь
Титан
Ниже приведена более полная таблица металлов с температурами плавления в градусах Фаренгейта и Цельсия. Мы не возим все эти металлы, но предоставляем их в качестве справочной информации.
Какой металл имеет самую низкую температуру плавления?
При более низких предельных температурах плавления находится ртуть (и алюминиевые сплавы для более часто используемых металлов). У ртути самая низкая температура плавления составляет -38 ° F / -39 ° C, в то время как алюминиевые сплавы плавятся при 865–1240 ° F / 463–671 ° C.
Какой металл имеет самую высокую температуру плавления?
Ближе к верхнему пределу температур плавления находится вольфрам (и титан для более часто используемых металлов). Вольфрам имеет самую высокую температуру плавления при чрезвычайно высокой температуре 6,150 ° F / 3,39.9 °C, а титан плавится при 3040 °F / 1670 °C.
Guide to Melting Points Video
Shop the Products
Mercury
Phosphorus
Selenium
Babbitt
Bismuth
Cadmium
Magnesium Alloys
660-1200
349-649
Алюминиевые сплавы
865-1240
463-671
Алюминиевая бронза
1190-1215
600-655
Magnesium
Aluminium
Beryllium Copper
1587-1750
865-955
Manganese Bronze
1590-1630
865-890
Silver, Sterling
Admiralty Brass
1650-1720
900-940
Латунь, желтый
1660-1710
905-932
Бронза
Серебро, чистый
Латунь, красный
1810-1880
990-1019
9000 2 1810-1880990-1019
9000 2 1810-18800002 CopperIron, Cast
2060-2200
1127-1204
Iron, Ductile
Manganese
Beryllium
Monel
2370-2460
1300-1350
Hastelloy
2410-2460
1320-1350
Steel, Carbon
2500-2800
1371-1540
Inconel
2540-2600
1390-1425
Incoloy
2540-2600
1390-1425
Silicon
Nickel
Iron, Wrought
2700-2900
1482-1593
Cobalt
Steel, Stainless
Palladium
Titanium
Thorium
Platinum
Chromium
Rhodium
Ниобий (Колумбий)
Молибден
Тантал
Рений
Вольфрам
Какой материал имеет самую высокую температуру плавления? (с картинками)
`;
На этот вопрос сложно ответить, потому что все время создаются новые материалы и сплавы, и материал с самой высокой температурой плавления теперь может меняться по мере синтеза новых соединений. В настоящее время рекордсменом является карбид тантала-гафния (Ta4HfC5), тугоплавкое соединение с температурой плавления 4488 К (4215 °С, 7619°F). Смешивая различные металлы для создания сплавов, можно достичь еще более высоких температур плавления. Материалы с такими исключительными физическими свойствами иногда называют суперсплавами.
В настоящее время рекордсменом является карбид тантала-гафния (Ta4HfC5), тугоплавкое соединение с температурой плавления 4488 К (4215 °С, 7619°F). Смешивая различные металлы для создания сплавов, можно достичь еще более высоких температур плавления. Материалы с такими исключительными физическими свойствами иногда называют суперсплавами.
Химический элемент с самой высокой температурой плавления — углерод при 4300–4700 К (4027–4427 ° C, 7280–8000 ° F). Второй по величине температурой плавления химических элементов является вольфрам при 3695 К (3422 ° C, 6192 ° F), поэтому он используется в качестве нити накала для лампочек. Иногда вольфрам называют элементом с самой высокой температурой плавления, потому что углерод на самом деле не плавится при атмосферном давлении, а скорее возгоняется (переходит непосредственно из твердого состояния в газообразное) при 4000 К (3727 ° C, 6740 ° F).
Иногда вольфрам называют элементом с самой высокой температурой плавления, потому что углерод на самом деле не плавится при атмосферном давлении, а скорее возгоняется (переходит непосредственно из твердого состояния в газообразное) при 4000 К (3727 ° C, 6740 ° F).
Когда для оборудования требуются очень высокие температуры плавления, иногда используется керамика. Одним из примеров является проект «Плутон» в 19 веке.50-х годов, когда американские ученые попытались создать баллистическую ракету с ядерной энергетической установкой с неэкранированным реактором гигаваттного уровня.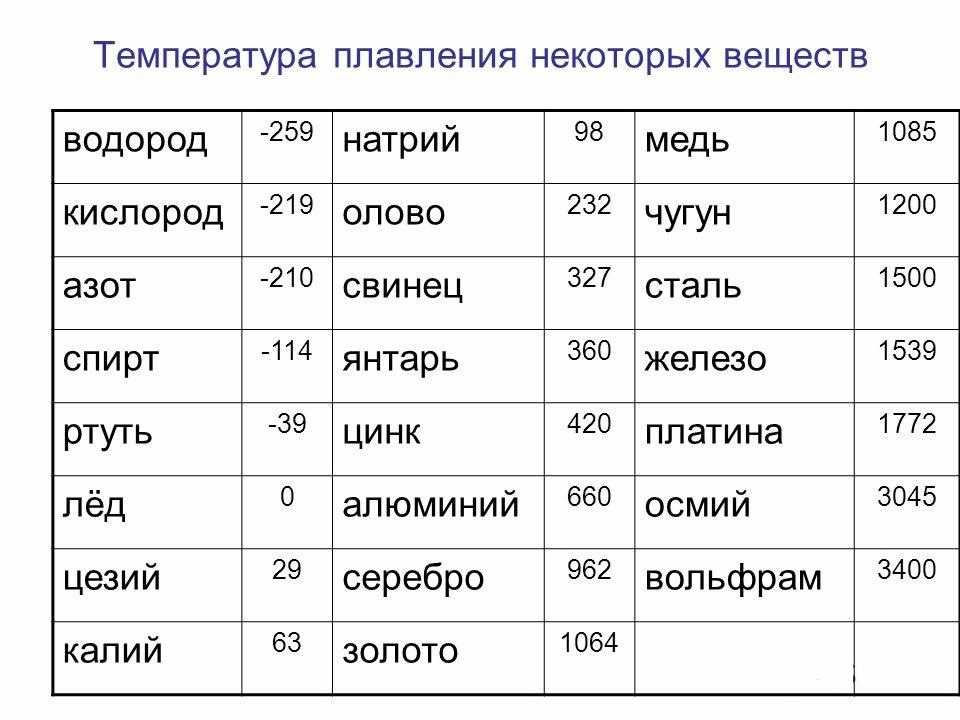 Реактор производил такое огромное количество тепла, что потребовалось керамическое шасси и компоненты.
Реактор производил такое огромное количество тепла, что потребовалось керамическое шасси и компоненты.
При экстремальных давлениях температура плавления увеличивается. Внутреннее железное ядро Земли, например, имеет температуру примерно от 5000 до 6000 °C (>9000 °F), но оно твердое, потому что давление там примерно в 3 миллиона раз больше, чем на поверхности. И наоборот, при снижении давления снижается и температура плавления. На поверхности Марса давление настолько низкое, что любая жидкая вода испарится почти сразу. Вот почему мы наблюдали свидетельства создания на Марсе небольших временных источников, но не постоянных водоемов.
Майкл — давний участник AllTheScience, специализирующийся на темах, связанных с палеонтологией, физика, биология, астрономия, химия и футуризм. Помимо того, что он заядлый блоггер, Майкл особенно увлечен исследованиями стволовых клеток, регенеративной медициной и терапией продления жизни. Он также работал на Фонд Мафусаила, Институт искусственного интеллекта сингулярности и Фонд спасательных шлюпок.
Михаил Анисимов Майкл — давний участник AllTheScience, специализирующийся на темах, связанных с палеонтологией,
физика, биология, астрономия, химия и футуризм. Помимо того, что он заядлый блоггер, Майкл особенно
увлечен исследованиями стволовых клеток, регенеративной медициной и терапией продления жизни. Он также работал на
Фонд Мафусаила, Институт искусственного интеллекта сингулярности и Фонд спасательных шлюпок.
Помимо того, что он заядлый блоггер, Майкл особенно
увлечен исследованиями стволовых клеток, регенеративной медициной и терапией продления жизни. Он также работал на
Фонд Мафусаила, Институт искусственного интеллекта сингулярности и Фонд спасательных шлюпок.
Химические элементы периодической таблицы, отсортированные по температуре плавления
- Главная
- Периодическая таблица
- Химические элементы, перечисленные по температуре плавления
Элементы периодической таблицы, отсортированные по температуре плавления
Нажмите на название любого элемента, чтобы узнать о дополнительных химических свойствах, данных об окружающей среде или влиянии на здоровье.
Этот список содержит 118 химических элементов.

 Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM.
Такая микроструктура придает материалу превосходные высокотемпературные свойства, например хорошее сопротивление ползучести и стабильность формы. При использовании специальных технологий производства материал WK65 может выдерживать больше нагрузок, чем WVM. Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике.
Для обоих композитов мы применяем практически чистый вольфрам с небольшой добавкой калия. S-WVMW идеально подходит для стержней диаметром больше 30 мм. Специальные технологии производства, которые мы используем для изготовления S-WVMW, позволяют добиваться высокой плотности материала в стержневом сердечнике.
 Нельзя также не отметить хорошую электропроводность и превосходную теплопроводность этого металла. Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже.
Нельзя также не отметить хорошую электропроводность и превосходную теплопроводность этого металла. Все эти свойства выражены в вольфраме гораздо сильнее, чем в молибдене. В периодической системе химических элементов вольфрам отнесен к той же группе, что и молибден, но располагается на период ниже. В результате получаем оптимальные материалы с нужным набором механических свойств для конкретных задач. Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести.
В результате получаем оптимальные материалы с нужным набором механических свойств для конкретных задач. Вольфрам по своим механическим свойствам сходен с молибденом. Как и в случае с молибденом, эти свойства зависят от температуры испытания. Вольфрам имеет самую высокую температуру плавления среди всех металлов: 3420 °C. Высокая теплостойкость и высокий модуль упругости обуславливают хорошее сопротивление ползучести.

 Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать.
Для резки и штамповки температура предварительного нагрева должна быть выше, чем для отбортовки. Вольфрам с трудом поддается машинной обработке. А вот наши сплавы вольфрама с оксидом лантана обрабатывать легче. Тем не менее уровень износа инструмента при этом также очень высок, что может привести к выщерблению. Если у вас остались вопросы по механической обработке тугоплавких металлов, наши опытные специалисты всегда готовы вас проконсультировать.
 Влажность может привести к окислению.
Влажность может привести к окислению. Разумеется, материал высочайшей чистоты для покрытий в виде мишеней для напыления можно приобрести у нас. Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов.
Разумеется, материал высочайшей чистоты для покрытий в виде мишеней для напыления можно приобрести у нас. Ни у одного из других производителей вы не найдете вольфрамовые мишени в таком широком диапазоне форматов. У вольфрама самая высокая точка плавления среди металлов, и он не разрушается даже при очень высоких температурах. Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью.
У вольфрама самая высокая точка плавления среди металлов, и он не разрушается даже при очень высоких температурах. Вольфрам также отличается исключительно низким коэффициентом теплового расширения, высоким уровнем стабильности формы и хорошей электропроводностью.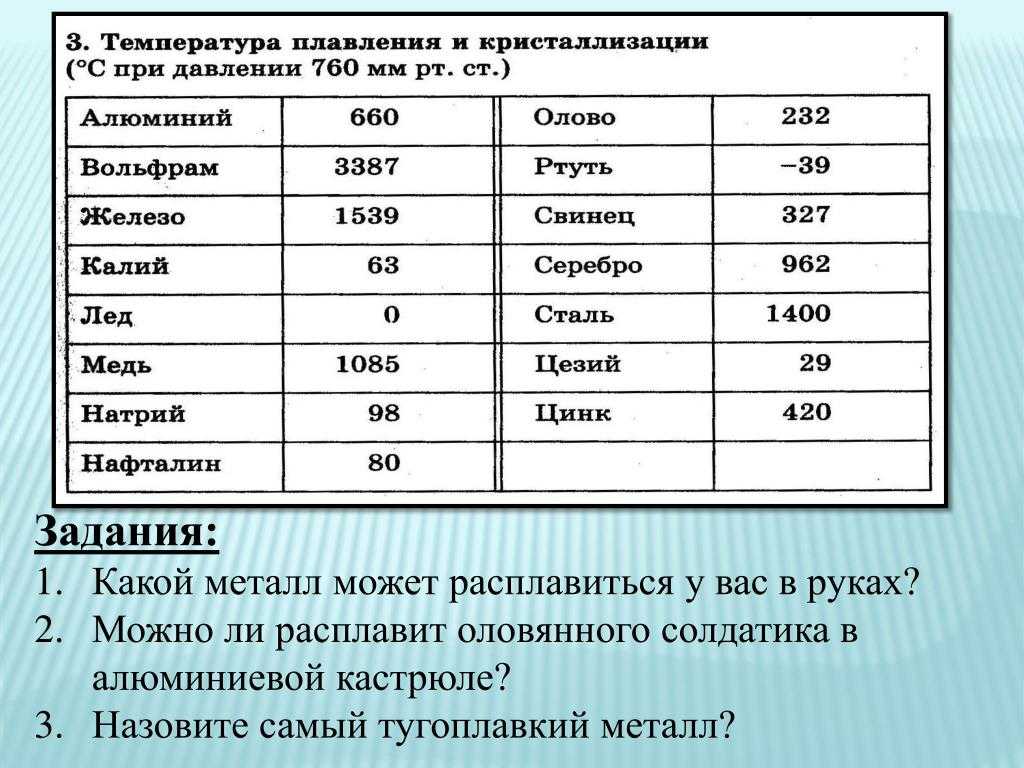 Однако в то время он считался нежелательным сопутствующим элементом. Вольфрамовая руда способствовала образованию шлака в процессе восстановления олова и тем самым снижала выход олова из руды. Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу». В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.
Однако в то время он считался нежелательным сопутствующим элементом. Вольфрамовая руда способствовала образованию шлака в процессе восстановления олова и тем самым снижала выход олова из руды. Название металла произошло от немецкого Wolf Rahm — волчья слюна, поскольку считалось, что его руда «пожирает олово, как волк съедает овцу». В 1752 году химик Аксель Фредрик Кронштедт открыл тяжелый металл, который назвал Tung Sten, что в переводе с шведского означает «тяжелый камень». Лишь спустя 30 лет Карлу Вильгельму Шееле удалось получить вольфрамовую кислоту из руды. И всего спустя два года ассистенты Шееле — братья Хуан Хосе и Фаусто де Элюар — восстановили триоксид вольфрама, получив чистый вольфрам. Сегодня именно эти два брата считаются настоящими открывателями вольфрама. Название wolframium и соответствующий химический знак W были предложены Йёнсом Якобом Берцелиусом.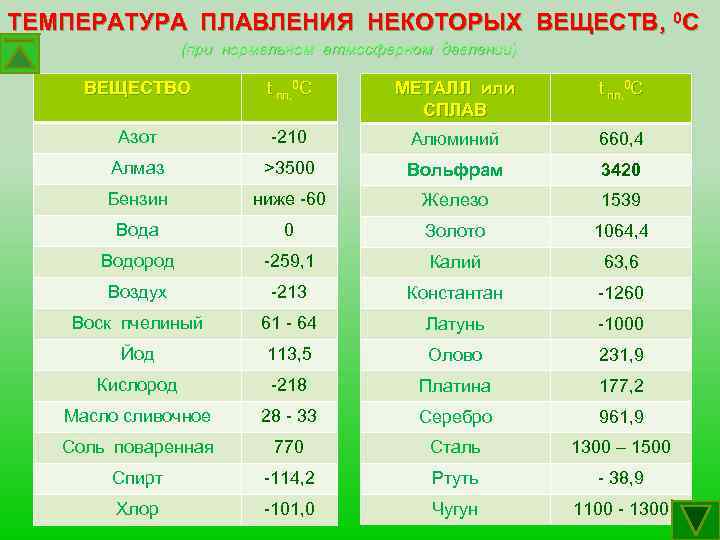 Крупнейшие месторождения вольфрама находятся в Китае, России и США. В Австрии также есть шеелит, он добывается в Миттерзилле в районе Фельбертауэрн.
Крупнейшие месторождения вольфрама находятся в Китае, России и США. В Австрии также есть шеелит, он добывается в Миттерзилле в районе Фельбертауэрн. Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование. — ATOMIC
— ATOMIC 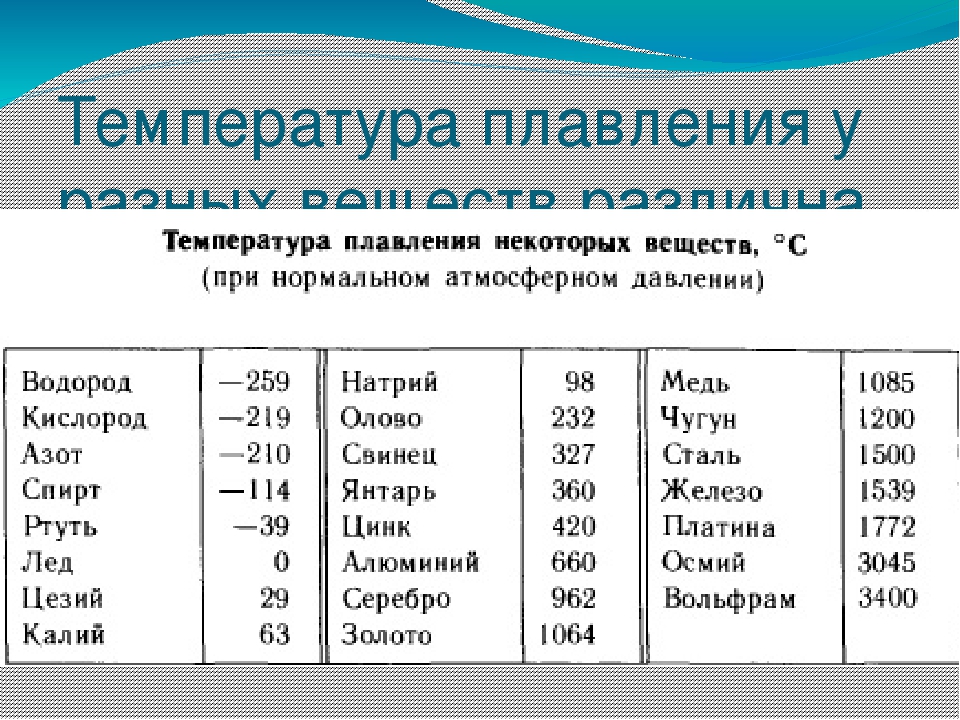 0005
0005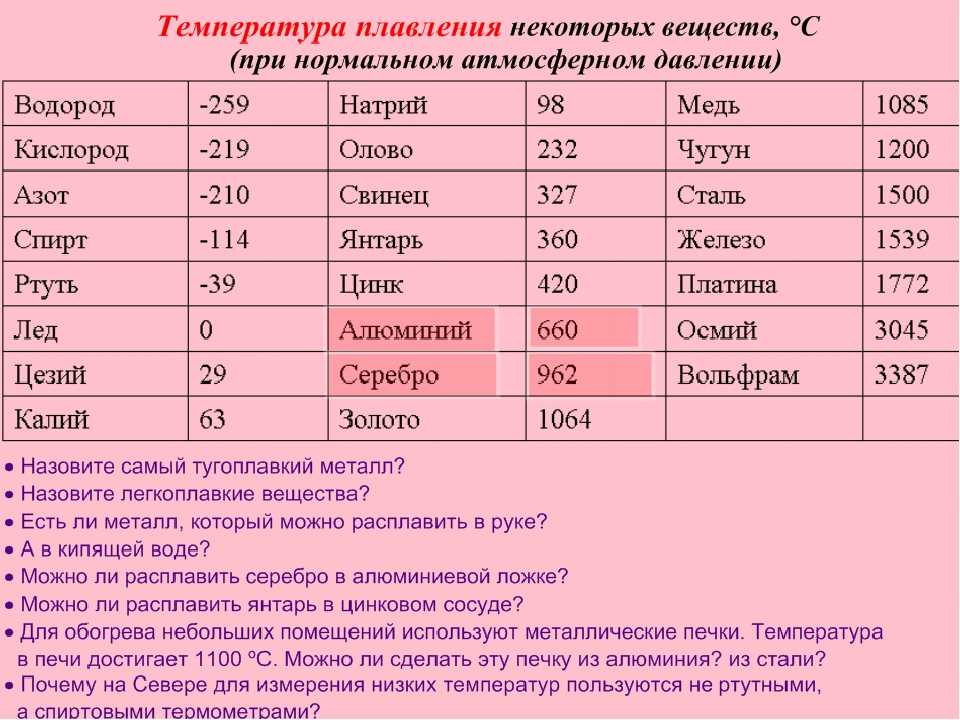
 0005
0005 8
8