Температура плавления разных металлов в таблице
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422Со, самая низкая — у ртути: элемент плавится уже при — 39Со. Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
- Легкоплавкие: им необходимо не более 600Со.
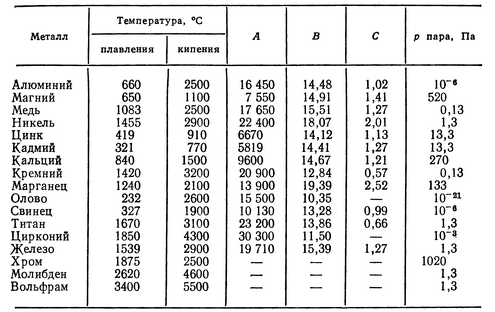 Это цинк, свинец, виснут, олово.
Это цинк, свинец, виснут, олово. - Среднеплавкие: температура плавления колеблется от 600Со до 1600Со. Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
- Тугоплавкие: требуется температура свыше 1600Со, чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С
о )| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Олово | Sn | 232 Со | 2600 Со |
| Свинец | Pb | 327 Со | 1750 Со |
| Цинк | Zn | 420 Со | 907 Со |
| Калий | K | 63,6 Со | 759 Со |
| Натрий | Na | 97,8 Со | 883 Со |
| Ртуть | Hg | — 38,9 Со | 356.73 Со |
| Цезий | Cs | 28,4 Со | 667.5 Со |
| Висмут | Bi | 271,4 Со | 1564 Со |
| Палладий | Pd | 327,5 Со | 1749 Со |
| Полоний | Po | 254 Со | 962 Со |
| Кадмий | Cd | 321,07 Со | 767 Со |
| Рубидий | Rb | 39,3 Со | 688 Со |
| Галлий | Ga | 29,76 Со | 2204 Со |
| Индий | In | 156,6 Со | 2072 Со |
| Таллий | Tl | 304 Со | 1473 Со |
| Литий | Li | 18,05 Со | 1342 Со |
Таблица среднеплавких металлов и сплавов (от 600С
о до 1600С о )| Название элемента | Латинское обозначение | Температураы | |
| Плавления | Кипения | ||
| Алюминий | Al | 660 Со | 2519 Со |
| Германий | Ge | 937 Со | 2830 Со |
| Магний | Mg | 650 Со | 1100 Со |
| Серебро | Ag | 960 Со | 2180 Со |
| Золото | Au | 1063 Со | 2660 Со |
| Медь | Cu | 1083 Со | 2580 Со |
| Железо | Fe | 1539 Со | 2900 Со |
| Кремний | Si | 1415 Со | 2350 Со |
| Никель | Ni | 1455 Со | 2913 Со |
| Барий | Ba | 727 Со | 1897 Со |
| Бериллий | Be | 1287 Со | 2471 Со |
| Нептуний | Np | 644 Со | 3901,85 Со |
| Протактиний | Pa | 1572 Со | 4027 Со |
| Плутоний | Pu | 640 Со | 3228 Со |
| Актиний | Ac | 1051 Со | 3198 Со |
| Кальций | Ca | 842 Со | 1484 Со |
| Радий | Ra | 700 Со | 1736,85 Со |
| Кобальт | Co | 1495 Со | 2927 Со |
| Сурьма | Sb | 630,63 Со | 1587 Со |
| Стронций | Sr | 777 Со | 1382 Со |
| Уран | U | 1135 Со | 4131 Со |
| Марганец | Mn | 1246 Со | 2061 Со |
| Константин | 1260 Со | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 Со | |
| Инвар | Сплав никеля и железа | 1425 Со | |
| Латунь | Сплав меди и цинка | 1000 Со | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 Со | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 Со | |
| Сталь | Сплав железа и углерода | 1300 Со — 1500 Со | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 Со | |
| Чугун | Сплав железа и углерода | 1100 Со — 1300 Со | |
Таблица тугоплавких металлов и сплавов (свыше 1600С
о )| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 Со | 5555 Со |
| Титан | Ti | 1680 Со | 3300 Со |
| Иридий | Ir | 2447 Со | 4428 Со |
| Осмий | Os | 3054 Со | 5012 Со |
| Платина | Pt | 1769,3 Со | 3825 Со |
| Рений | Re | 3186 Со | 5596 Со |
| Хром | Cr | 1907 Со | 2671 Со |
| Родий | Rh | 1964 Со | 3695 Со |
| Рутений | Ru | 2334 Со | 4150 Со |
| Гафний | Hf | 2233 Со | 4603 Со |
| Тантал | Ta | 3017 Со | 5458 Со |
| Технеций | Tc | 2157 Со | 4265 Со |
| Торий | Th | 1750 Со | 4788 Со |
| Ванадий | V | 1910 Со | 3407 Со |
| Цирконий | Zr | 1855 Со | 4409 Со |
| Ниобий | Nb | 2477 Со | 4744 Со |
| Молибден | Mo | 2623 Со | 4639 Со |
| Карбиды гафния | 3890 Со | ||
| Карбиды ниобия | 3760 Со | ||
| Карбиды титана | 3150 Со | ||
| Карбиды циркония | 3530 Со | ||
Самый тугоплавкий металл на земле
Любознательных людей наверняка интересует вопрос, какой металл самый тугоплавкий? Прежде чем дать на него ответ, стоит разобраться с сами понятием тугоплавкости. Все известные науки металлы имеют разную температуру плавления в связи с различной степенью устойчивости связей между атомами в кристаллической решетке. Чем слабее эта связь, тем меньшая температура требуется, чтобы ее разорвать.
Все известные науки металлы имеют разную температуру плавления в связи с различной степенью устойчивости связей между атомами в кристаллической решетке. Чем слабее эта связь, тем меньшая температура требуется, чтобы ее разорвать.
Самые тугоплавкие металлы в мире используются в чистом виде или в составе сплавов для производства деталей, которые работают в экстремальных термических условиях. Они позволяют эффективно противостоять высоким температурам и значительно продляют эксплуатационный период агрегатов. Но стойкость металлов данной группы к термическому воздействию заставляет металлургов прибегать к нестандартным методам их производства.
Какой металл самый тугоплавкий?
Самый тугоплавкий металл на Земле был открыт в 1781 году шведским ученым Карлом Вильгельмом Шееле. Новый материал получил название вольфрам. Шееле удалось синтезировать триокись вольфрама путем растворения руды в азотной кислоте. Чистый металл был выделен двумя годами позже испанскими химиками Фаусто Фермином и Хуаном Хосе де Элюар. Новый элемент не сразу получил признание и был взят на вооружение промышленниками. Дело в том, что технологии того времени не позволяли обрабатывать столь тугоплавкое вещество, поэтому большинство современников не придали особого значения научному открытию.
Вольфрам был оценен гораздо позже. На сегодняшний день его сплавы используются при производстве термостойких деталей для различных отраслей промышленности. Нить накаливания в газоразрядных бытовых лампах также изготавливается из вольфрама. Также он применяется в аэрокосмической промышленности для производства ракетных сопел, используется в качестве многоразовых электродов в газодуговой сварке. Кроме тугоплавкости вольфрам также обладает высокой плотностью, что позволяет использовать его для изготовления высококачественных клюшек для гольфа.
Соединения вольфрама с неметаллами также широко применяется в промышленности. Так сульфид используется в качестве термостойкой смазки, способной переносить температуры до 500 градусов по Цельсию, карбид служит для изготовления резцов, абразивных дисков и сверл, способных обрабатывать самые твердые вещества и переносить высокие температуры нагрева. Рассмотрим, наконец, промышленное получение вольфрама. Самый тугоплавкий металл имеет температуру плавления 3422 градуса по Цельсию.
Так сульфид используется в качестве термостойкой смазки, способной переносить температуры до 500 градусов по Цельсию, карбид служит для изготовления резцов, абразивных дисков и сверл, способных обрабатывать самые твердые вещества и переносить высокие температуры нагрева. Рассмотрим, наконец, промышленное получение вольфрама. Самый тугоплавкий металл имеет температуру плавления 3422 градуса по Цельсию.
Как получают вольфрам?
В природе чистый вольфрам не встречается. Он входит в состав горных пород в виде триоксида, а также вольфрамитов железа, марганца и кальция, реже меди или свинца. По оценкам ученых содержание вольфрама в земной коре в среднем составляет 1,3 грамма на одну тонну. Это достаточно редкий элемент по сравнению с другими видами металлов. Содержание вольфрама в руде после добычи обычно не превышает 2%. Поэтому добытое сырье отправляется на обогатительные фабрики, где методом магнитной или электростатической сепарации массовая доля металла доводится до отметки 55-60%.
Процесс его получения разделяется на технологические этапы. На первом этапе выделяют чистый триоксид из добытой руды. Для этого используют метод термического разложения. При температурах от 500 до 800 градусов по Цельсию все лишние элементы расплавляются, а тугоплавкий вольфрам в виде оксида легко можно собрать из расплава. На выходе получается сырье с содержанием оксида шестивалентного вольфрама на уровне 99%.
Полученное соединение тщательно измельчают и проводят восстановительную реакцию в присутствии водорода при температуре 700 градусов по Цельсию. Это позволяет выделить чистый металл в виде порошка. Далее его спрессовывают под высоким давлением и спекают в водородной среде при температурах 1200-1300 градусов по Цельсию. После этого полученная масса отправляется в электрическую плавильную печь, где под воздействием тока нагревается до температуры свыше 3000 градусов. Так вольфрам переходит в расплавленное состояние.
Для окончательной очистки от примесей и получения монокристаллической структурной решетки используется метод зонной плавки. Он подразумевает, что в определенный момент времени расплавленной находится только некоторая зона из общей площади металла. Постепенно двигаясь, эта зона перераспределяет примеси, в результате чего в конечном итоге они скапливаются в одном месте и их легко можно удалить из структуры сплава.
Готовый вольфрам поступает на склад в виде штабиков или слитков, предназначенных для последующего производства нужной продукции. Для получения сплавов вольфрама все составные элементы измельчают и смешивают в виде порошка в необходимых пропорциях. Далее производится спекание и плавка в электрической печи.
Таблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении
| Металл или сплав | tпл. С |
|---|---|
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Германий | 937 |
| Дуралюмин | ~650 |
| Железо | 1539 |
| Золото | 1064?4 |
| Инвар | 1425 |
| Иридий | 2447 |
| Калий | 63,6 |
| Карбиды гафния | 3890 |
| ниобия | 3760 |
| титана | 3150 |
| циркония | 3530 |
| Константин | ~1260 |
| Кремний | 1415 |
| Латунь | ~1000 |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Нейзильбер | ~1100 |
| Никель | 1455 |
| Нихром | ~1400 |
| Олово | 231,9 |
| Осмий | 3030 |
| Платина | 17772 |
| Ртуть | — 38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Фехраль | ~1460 |
| Цезий | 28,4 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
Вернуться в раздел аналитики
Запись опубликована автором admin в рубрике Полезные материалы. Добавьте в закладки постоянную ссылку.
Добавьте в закладки постоянную ссылку.Температура кипения и плавления металлов, температура плавления стали
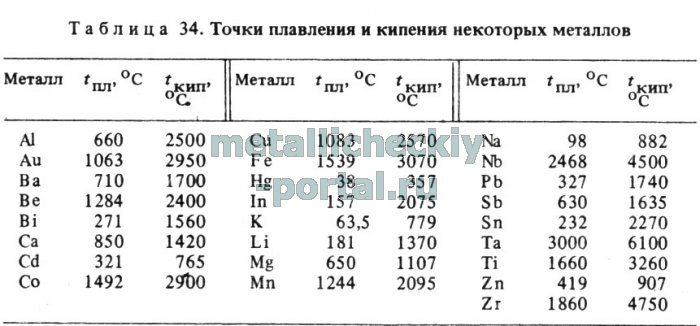
Температура кипения и плавления металлов
В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.

Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см3, то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | tпл, °С | Сталь | tпл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
Источники:
- Волков А.
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. - Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
Ученые создали самый тугоплавкий материал — Наука
ТАСС, 19 мая. Ученые синтезировали керамический материал с температурой плавления более 4 тыс. °С. Это делает его самым тугоплавким из известных науке материалов, пишет пресс-служба НИТУ «МИСиС».
Подобный материал, как пишет пресс-служба, можно использовать при изготовлении носовых обтекателей ракет и тех частей реактивных двигателей и крыльев самолетов, на которые ложатся особенно сложные тепловые и механические нагрузки. Это особенно важно при разработке космических кораблей и систем, которые могут многократно летать в космос и садиться на Землю.
«При выходе и повторном входе в атмосферу на поверхности и кромке крыльев воздушно-космических кораблей могут наблюдаться температуры порядка 2–4 тыс. °С. Поэтому возник вопрос о разработке новых материалов, способных работать при столь высоких температурах», – сказал один из авторов работы, сотрудник НИТУ «МИСиС» Дмитрий Московских.
Московских и его коллеги сделали большой шаг в сторону решения этой проблемы. Тугоплавкость материала, который они создали, превосходит все известные соединения такого рода, а также другие известные вещества. При этом он отличается высокой механической прочностью.
Материал представляет собой соединение гафния с углеродом и азотом. Его существование еще в 2015 году предсказали американские химики из Брауновского университета. Их расчеты указали, что тугоплавкость этого материала должна достигать 4415 кельвинов, превосходя в этом отношении карбид тантала-гафния(TaHfC).
Новые рекорды тугоплавкости
Российские исследователи и их коллеги из Университета Нотр-Дам (США) проверили это предсказание на практике. Они придумали, как получать большие количества этого соединения, чтобы можно было оценить его тугоплавкость и механические свойства.
Они придумали, как получать большие количества этого соединения, чтобы можно было оценить его тугоплавкость и механические свойства.
Для этого ученые перемололи в специальной мельнице порошки из гафния и углерода, после чего поставили получившуюся смесь в специальную печь, которая была заполнена чистым азотом. Вставив в порошок электроды из вольфрама и пропустив через них ток, материаловеды запустили реакцию образования карбонитрида гафния, поддерживая четко выверенную температуру и давление внутри печи.
Просветив полученный порошок рентгеновским илучением, химики убедились в том, что они получили чистый карбонитрид гафния (HfCN), механические свойства которого совпадали с тем, что предсказывали теоретики в 2015 году. После этого Московских и его коллеги сравнили созданный ими материал с еще одним тугоплавким веществом, карбидом гафния (HfC).
Для этого ученые спрессовали порошок из того и другого вещества в тонкий лист и поместили их внутрь графитовых пластин, подключенных к мощному источнику тока. Эти опыты показали, что новый материал был более тугоплавок, чем его предшественник. Однако точную температуру его плавления ученые измерить не смогли. Пока можно только сказать, что она больше 4 тыс. °С (4273 кельвинов).
В дальнейшем, как отмечают ученые, они планируют измерить точную температуру плавления этого материала с помощью методов высокотемпературной пирометрии. Вдобавок они хотят проверить, как карбонитрид гафния ведет себя в гиперзвуковых условиях. Это важно для в аэрокосмической промышленности.
Температура плавления самого тугоплавкого металла
Рекорды для неорганических веществ
Самым сильным стабильным окислителем, является комплекс дифторида криптона и пентафторида сурьмы. Из-за сильного окисляющего действия (окисляет все элементы в высшие степени окисления, в том числе кислород и азот воздуха) для него очень трудно измерить электродный потенциал. Единственный растворитель, который реагирует с ним достаточно медленно – безводный фтористый водород.
Самым плотным веществом, является осмий. Его плотность составляет 22,5 г/см 3 .
Самый легкий металл – это литий. Его плотность составляет 0,543 г/см 3 .
Самый дорогой металл – это калифорний. Его стоимость в настоящее время составляет 6 500 000 долларов за 1 грамм.
Самый распространенный элемент в земной коре – это кислород. Его содержание составляет 49% от массы земной коры.
Самый редкий элемент в земной коре – это астат. Его содержание во всей земной коре, по оценкам специалистов составляет всего 0,16 грамм.
Самым горючим веществом, является, по-видимому, мелкий порошок циркония. Для того чтоб он не мог гореть, необходимо поместить его в атмосферу инертного газа на пластину из материала, не содержащего неметаллов.
Веществом с наименьшей температурой кипения, является гелий. Его температура кипения равна -269 градусов по Цельсию. Гелий – единственное вещество, не имеющее температуры плавления при обычном давлении. Даже при абсолютном нуле он остается жидким. Жидкий гелий широко используется в криогенной технике.
Самый тугоплавкий металл – это вольфрам. Его температура плавления составляет +3420 градусов по Цельсию. Из него изготовляют нити накаливания для электрических лампочек.
Самый тугоплавкий материал – это сплав карбидов гафния и тантала (1:1). Он имеет температуру плавления +4215 С.
Самым легкоплавким металлом, является ртуть. Ее температура плавления равна -38,87 градусов по Цельсию. Она же является самой тяжелой жидкостью, ее плотность составляет 13,54 г/см 3 .
Самую высокую растворимость в воде среди твердых веществ имеет трихлорид сурьмы. Его растворимость при +25 С составляет 9880 грамм на литр.
Самым легким газом, является водород. Масса 1 литра составляет всего 0,08988 грамм.
Самым тяжелым газом при комнатной температуре, является гексафторид вольфрама (т. кип. +17 С). Его масса составляет 12,9 г/л, т.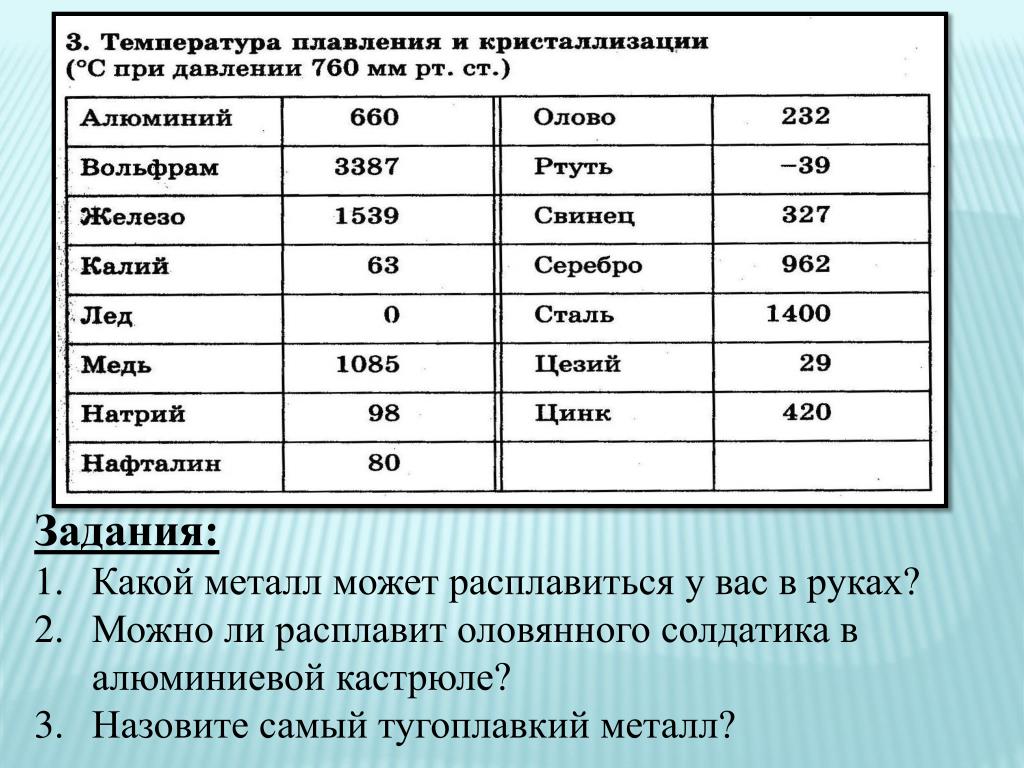 е. в нем могут плавать некоторые виды пенопласта.
е. в нем могут плавать некоторые виды пенопласта.
Самым стойким к кислотам металлом, является иридий. До сих пор не известно ни одной кислоты или их смеси, в которых он бы растворялся.
Самый широкий диапазон концентрационных пределов взрываемости имеет сероуглерод. Взрываться могут все смеси паров сероуглерода с воздухом содержащие от 1 до 50 объемных процентов сероуглерода.
Самой сильной стабильной кислотой является раствор пентафторида сурьмы во фтористом водороде. В зависимости от концентрации пентафторида сурьмы эта кислота может иметь показатель Гаммета до -40.
Самым необычным анионом в соли является электрон. Он входит в состав электрида 18-краун-6 комплекса натрия.
Рекорды для органических веществ
Самым горьким веществом, является денатония сахаринат. Его получили случайно, во время исследования денатония бензоата. Сочетание последнего с натриевой солью сахарина дало вещество в 5 раз более горькое, чем предыдущий рекордсмен (денатония бензоат). В настоящее время оба этих вещества используются для денатурации спирта и других непищевых продуктов.
Самым сильным ядом, является ботулинический токсин типа А. Его летальная доза для мышей (ЛД50, внутрибрюшинно) составляет 0,000026 мкг/кг веса. Это белок с молекулярной массой 150 000, продуцируемый бактерией Clostridium botulinum.
Самым нетоксичным органическим веществом, является метан. При увеличении его концентрации интоксикация возникает из-за недостатка кислорода, а не в результате отравления.
Самый сильный адсорбент, был получен в 1974 году из производного крахмала, акриламида и акриловой кислоты. Это вещество способно удерживать воду, масса которой в 1300 раз превосходит его собственную.
Самыми зловонными соединениями, являются этилселенол и бутилмеркаптан. Концентрация которую человек может обнаружить по запаху так мала, что до сих пор нет методов позволяющих ее точно определить. По оценкам величина ее составляет 2 нанограмма на кубометр воздуха.
Самым сильным галлюциногенным веществом, является диэтиламид l-лизергиновой кислоты. Доза всего в 100 микрограмм вызывает галлюцинации продолжающиеся около суток.
Самым сладким веществом, является N-(N-циклонониламино(4-цианофенилимино)метил)-2-аминоуксусная кислота. Это вещество в 200 000 раз превосходит по сладости 2% раствор сахарозы, но из-за своей токсичности, применения в качестве подсластителя, по видимому не найдет. Из промышленных веществ самым сладким является талин, который в 3 500 – 6 000 раз слаще сахарозы.
Самым медленным ферментом, является нитрогеназа, катализирующая усвоение клубеньковыми бактериями атмосферного азота. Полный цикл превращения одной молекулы азота в 2 иона аммония занимает полторы секунды.
Самое длинное химическое название, опубликованное в литературе, содержало 1578 букв и знаков и описывало синтетический аналог цепочки нуклеотидов.
Самым сильным наркотическим анальгетиком является, по-видимому, вещество, синтезированное в Канаде в 80-х годах. Его эффективная анальгетическая доза для мышей (подкожное введение) составляет всего 3,7 нанограмма на килограмм веса, то есть он в 500 раз сильнее эторфина.
Органическим веществом с самым большим содержанием азота является бис(диазотетразолил)гидразин. Он содержит 87,5% азота. Это взрывчатое вещество черезвычайно чувствительно к удару, трению и теплу.
Веществом с самой большой молекулярной массой является гемоцианин улитки (переносит кислород). Его молекулярная масса составляет 918 000 000 дальтон, что больше молекулярной массы даже ДНК.
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Тугоплавкие металлы были выделены в отдельный класс благодаря объединяющему их свойству — высокой температуре плавления. Она выше, чем у железа, которая равна 1539 °C. Поэтому металлы данной группы и получили такое название. Они принадлежат к числу так называемых редкоземельных элементов. Так, например, по распространённости в земной коре ниобий и тантал составляют 3%, а цирконий только 2%.
По температурному показателю плавления кроме перечисленных, к ним относятся металлы, так называемой платиновой группы. Ещё их называют благородными или драгоценными.
Определённая схожесть строения атома обусловила схожесть их свойств. На основании этого можно обобщить некоторые черты проявления таких металлов в земной коре и определиться с технологией их добычи, производства и переработки.
Свойства тугоплавких металлов
За счёт того, что они расположены в соседних группах периодической таблицы, физические свойства у тугоплавких металлов достаточно близкие:
- Плотность металла колеблется в интервале от 6100 до 10000 кг/м 3 .
 По этому показателю выделяется только вольфрам. У него он равен 19000 кг/м 3 .
По этому показателю выделяется только вольфрам. У него он равен 19000 кг/м 3 . - Температура плавления. Она превышает температуру плавления железа и колеблется от 1950 °С у ванадия до 3395 °С у вольфрама.
- Удельная теплоёмкость у них незначительно отличается друг от друга и находится в пределах от 200 до 400 Дж/(кг-град).
- Коэффициент теплопроводности сильно меняется от элемента к элементу. Если у ванадия он равен 31 Вт/(м-град), то у вольфрама он достигает величины в 188 Вт/(м-град).
Физические свойства тугоплавких металлов
Химические свойства также достаточно схожие:
- Очень похожее строение атома.
- Обладают высокой химической активностью. Это свойство определяет основные трудности при сохранении стабильности их соединений.
- Прочность межатомных связей определяет высокую температуру плавления. Это обстоятельство объясняет высокую механическую прочность, твёрдость и электрические характеристики (в частности сопротивление).
- Проявляют хорошую устойчивость при воздействии различных кислот.
К основным недостаткам тугоплавких металлов относятся:
- Низкая коррозийная стойкость. Процесс окисления происходит достаточно быстро. Его разделяют на две последовательные стадии. Непосредственное взаимодействие металла с кислородом окружающего воздуха, что приводит к образованию оксидной плёнки. На второй стадии происходит процесс диффузии (проникновения) атомов кислорода через образовавшуюся оксидную плёнку.
- Трудности со свариваемостью тугоплавких металлов. Это вызвано высокой химической активностью к окружающему воздуху при высоких температурах, хрупкостью при насыщении различными примесями. Кроме того, трудно определить точку перегрева и практически невозможно контролировать повышение предела текучести.
- Трудности их получения использования в чистом виде без примесей.
- Необходимость применения специальных покрытий от быстрого окисления. Для сплавов, основу которых составляет вольфрам и молибден, разработаны силицидные покрытия.
- Трудности, связанные с механической обработкой. Для качественной обработки их сначала необходимо нагреть.
Производство тугоплавких металлов
Все способы производства тугоплавких металлов основаны на методиках так называемой порошковой металлургии. Сам процесс происходит в несколько этапов:
- На начальном этапе получают порошок металла.
- Затем методами химического восстановления (обычно аммонийных солей или оксидов) выделяют требуемый металл. Такое выделение получается в результате воздействия на порошок водорода.
- На завершающем этапе получают химическое соединение, называемое гексафторидом соответствующего металла, и уже из него сам металл.
Применение тугоплавких металлов
Начиная со второй половины двадцатого века тугоплавкие металлы стали применяться во многих отраслях промышленного производства. Порошки тугоплавких металлов используются для производства первичной продукции. Тугоплавкие металлы вырабатывают в виде проволоки, слитков, арматуры, прокатного металла и фольги.
Отдельное место такие металлы занимают в технологии выращивания лейкосапфиров. Они относятся к классу монокристаллов и называются искусственными рубинами.
Изделия из тугоплавких металлов входят в состав бытовых и промышленных электрических приборов, огнеупорных конструкций, деталей для двигателей авиационной и космической техники. Особое место занимают тугоплавкие металлы при производстве деталей сложной конфигурации.
Вольфрам
Этот металл открыли в далёком 1781 г. Его температура плавления равна 3380 °С. Поэтому он на сегодняшний день является самым тугоплавким металлом. Получают вольфрам из специального порошка, подвергая его химической обработке. Этот процесс основан на прессовании с последующим спеканием при высоких температурах. Далее его подвергают ковке и волочению на станках. Это связано с его наибольшей тугоплавкостью. Так получают волокнистую структуру (проволоку). Она достаточно прочная и практически не ломается. На конечном этапе его раскатывают в виде тонких нитей или гибкой ленты. Для проведения механической обработки необходимо создать защитную среду из инертного газа. В этой среде температура должна превышать 400 °С. При температуре окружающей среды он приобретает свойства парамагнетика. Ему присущи следующие недостатки:
На конечном этапе его раскатывают в виде тонких нитей или гибкой ленты. Для проведения механической обработки необходимо создать защитную среду из инертного газа. В этой среде температура должна превышать 400 °С. При температуре окружающей среды он приобретает свойства парамагнетика. Ему присущи следующие недостатки:
- сложность в создании условий для механической обработки;
- быстрое образование на поверхности оксидных плёнок. Если в контакте имеются серосодержащие вещества, образуются сульфидные плёнки;
- создание хорошего электрического контакта между несколькими деталями возможно только при создании большого давление.
Для улучшения свойств вольфрама (тугоплавкости, устойчивости к коррозии, износостойкости) в него добавляют легирующие металлы. Например, рений и торий.
Металл используется для производства нитей накаливания для осветительных и сушильных ламп. Его добавляют в сварочные электроды, элементы электронных ламп и рентгеновских трубок. Также применяется при производстве элементов ракет, в реактивных двигателях, артиллерийских снарядах.
Молибден
По внешнему виду и характеристикам очень похож на вольфрам. Главным отличием является то, что его удельный вес почти в два раза меньше. Его получают аналогичным образом. Он широко применяется в радиоэлектронной промышленности, для изготовления различных испарителей в вакуумной технике, разрывных электрических контактов. Как и вольфрам, он является парамагнетиком. Для изготовления электродов стекловаренных (стеклоплавильных) печей он просто незаменим.
Ниобий
Температура плавления ниобия составляет 2741 °С. По своим химическим, физическим и механическим свойствам очень напоминает тантал. Он достаточно пластичен. Обладает хорошей свариваемостью и высокой теплопроводностью даже без дополнительного нагрева. Как и все остальные металлы его получают из порошка. Конечные заготовки из ниобия – проволока, лента, труба.
Сам металл и его сплавы демонстрируют эффект сверхпроводимости. Его широко применяют для изготовления анодов, экранных и антидинатронных сеток в электровакуумных приборах. Благодаря хорошей пористости, его успешно применяют в качестве газопоглотителей. В микроэлектронике он идёт на изготовление резисторов в микросхемах.
Ниобий хорошо себя проявил в качестве легирующей добавки. Используется при создании различных жаростойких конструкций, агрегатов работающих в агрессивных и радиоактивных средах. Из сплава стали и ниобия изготавливают некоторые элементы реактивных двигателей. Благодаря его свойству не взаимодействовать с радиоактивными веществами при высоких температурах, например, с ураном, применяется при изготовлении оболочек для урановых элементов, отводящих тепло в реакторах.
Тантал
Внешне имеет светло-серый цвет с небольшим голубоватым оттенком. Температура плавления близка к 3000 °С. Хорошо поддается основным видам обработки. Его можно ковать, прокатывать, производить волочение для изготовления проволоки. Эти операции не требуют значительного нагрева. Для удобства дальнейшего использования тантал изготавливают в форме фольги и тонких листов. Повышение температуры вызывает активное взаимодействие со всеми газами, кроме инертных – с ними никаких реакций не наблюдается.
Из тантала производят внутренние элементы генераторных ламп (магнетронов и клистронов). Он активно используется при производстве пластин в электролитических конденсаторах. Очень удобен для изготовления пленочных резисторов. Активно применяется для изготовления так называемых лодочек в испарителях, в которых осуществляется термическое напыление различных материалов на тонкие пленки.
Ввиду ряда своих уникальных качеств, считается незаменимым в ядерной, аэрокосмической и радиоэлектронной промышленности.
Рений
Был открыт позже всех из перечисленных ранее металлов. Он полностью оправдывает свое название «редкоземельный металл», потому что находится в небольших количествах в составе руды других металлов, таких как платина или медь. В основном его используют как легирующую добавку. Полученные сплавы приобретают хорошие характеристики прочности и ковкости. Это один из самых дорогих металлов, поэтому его применение приводит к резкому увеличению цены всего оборудования. Те не менее, его применяют в качестве катализатора.
В основном его используют как легирующую добавку. Полученные сплавы приобретают хорошие характеристики прочности и ковкости. Это один из самых дорогих металлов, поэтому его применение приводит к резкому увеличению цены всего оборудования. Те не менее, его применяют в качестве катализатора.
Хром — уникальный металл. Широко применяется в промышленности благодаря своим замечательным свойствам: прочности, устойчивости к внешним воздействиям (нагреву и коррозии), пластичности. Достаточно твердый, но хрупкий металл. Имеет серо-стальной цвет. Весь необходимый хром извлекают из руды двух видов хромита железа или окиси хрома.
Основными его свойствами являются:
- Даже при нормальной температуре обладает почти идеальным антиферромагнитным упорядочением. Это придаёт ему отличные магнитные свойства.
- По-разному реагирует на воздействие водорода и азота. В первом случае сохраняет свою прочность. Во втором, становится хрупким и полностью теряет все свои пластические свойства.
- Обладает высокой устойчивостью против коррозии. Это происходит благодаря тому, что при взаимодействии с кислородом на поверхности образуется тонкая защитная плёнка. Она служит для защиты от дальнейшей коррозии.
Он используется в металлургической, химической, строительной индустриях. Хром, как легирующая добавка, обязательно используется для производства различных марок нержавеющей стали. Особое место занимает при изготовлении такого материала как нихром. Этот материал способен выдерживать очень высокие температуры. Поэтому его используют в различных нагревательных элементах. Хромом активно покрывают поверхности различных деталей (металла, дерева, кожи). Это процесс осуществляется с помощью гальваники.
Токсичность некоторых солей хрома используют для сохранения древесины от повреждения, вредного воздействия грибков и плесени. Они также хорошо отпугивают муравьёв, термитов, насекомых разрушителей деревянных конструкций. Солями хрома обрабатывают кожу. Хром применяется при изготовлении различных красителей.
Хром применяется при изготовлении различных красителей.
Благодаря высокой теплостойкости его используют как огнеупорный материал для доменных печей. Каталитические свойства соединений хрома успешно используют при переработке углеводородов. Его добавляют при производстве магнитных лент наивысшего качества. Именно он обеспечивает низкий коэффициент шума и широкую полосу пропускания.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
таблица по возрастанию в градусах, самая высокая температура плавления
plazmen.ru » Сварка » Какова температура плавления железа
Металлы и сплавы — это незаменимая основа для литейного и ювелирного производства, ковки и многих других сфер. Что бы ни делал человек из металла (какой бы это ни был процесс), для правильной работы ему нужно знать, при какой температуре плавится тот или иной металл. Мы подробно рассмотрим процесс плавления, его отличие от кипения, а также сравним температуры в таблицах.
Процесс плавления металлов.
Что такое температура плавления
Каждый металл имеет неповторимые свойства, и в этот список входит температура плавления. При плавке металл уходит из одного состояния в другое, а именно из твёрдого превращается в жидкое. Чтобы сплавить металл, нужно приблизить к нему тепло и нагреть до необходимой температуры – этот процесс и называется температурой плавления. В момент, когда температура доходит до нужной отметки, он ещё может пребывать в твёрдом состоянии. Если продолжать воздействие – металл или сплав начнет плавиться.
Плавление и кипение – это не одно и то же. Точкой перехода вещества из твердого состояния в жидкое, зачастую называют температуру плавления металла. В расплавленном состоянии у молекул нет определенного расположения, но притяжение сдерживает их рядом, в жидком виде кристаллическое тело оставляет объем, но форма теряется.
При кипении объем теряется, молекулы между собой очень слабо взаимодействуют, движутся хаотично в разных направлениях, совершают отрыв от поверхности. Температура кипения – это процесс, при котором давление металлического пара приравнивается к давлению внешней среды.
Для того, чтобы упростить разницу между критическими точками нагрева мы подготовили для вас простую таблицу:
| Свойство | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав переходит в расплав, разрушается кристаллическая структура, проходит зернистость | Переходит в состояние газа, некоторые молекулы могут улетать за пределы расплава |
| Фазовый переход | Равновесие между твердым состоянием и жидким | Равновесие давления между парами металла и воздухом |
| Влияние внешнего давления | Нет изменений | Изменения есть, температура уменьшается при разряжении |
При какой температуре плавится
Металлические элементы, какими бы они ни были — плавятся почти один в один. Этот процесс происходит при нагреве. Оно может быть, как внешнее, так и внутреннее. Первое проходит в печи, а для второго используют резистивный нагрев, пропуская электричество либо индукционный нагрев. Воздействие выходит практически схожее. При нагреве, увеличивается амплитуда колебаний молекул. Образуются структурные дефекты решётки, которые сопровождаются обрывом межатомных связей. Под процессом разрушения решётки и скоплением подобных дефектов и подразумевается плавление.
У разных веществ разные температуры плавления. Теоретически, металлы делят на:
- Легкоплавкие – достаточно температуры до 600 градусов Цельсия, для получения жидкого вещества.
- Среднеплавкие – необходима температура от 600 до 1600 ⁰С.
- Тугоплавкие – это металлы, для плавления которых требуется температура выше 1600 ⁰С.
Плавление железа
Температура плавления железа достаточно высока. Для технически чистого элемента требуется температура +1539 °C. В этом веществе имеется примесь — сера, а извлечь ее допустимо лишь в жидком виде.
Без примесей чистый материал можно получить при электролизе солей металла.
Плавление чугуна
Чугун – это лучший металл для плавки. Высокий показатель жидкотекучести и низкий показатель усадки дают возможность эффективнее пользоваться им при литье. Далее рассмотрим показатели температуры кипения чугуна в градусах Цельсия:
- Серый — температурный режим может достигать отметки 1260 градусов. При заливке в формы температура может подниматься до 1400.
- Белый — температура достигает отметки 1350 градусов. В формы заливается при показателе 1450.
Важно! Показатели плавления такого металла, как чугун – на 400 градусов ниже, по сравнению со сталью. Это значительно снижает затраты энергии при обработке.
Плавление стали
Плавления стали при температуре 1400 °C
Сталь — это сплав железа с примесью углерода. Её главная польза — прочность, поскольку это вещество способно на протяжении длительного времени сохранять свой объем и форму. Связано это с тем, что частицы находятся в положении равновесия. Таким образом силы притяжения и отталкивания между частицами равны.
Справка! Сталь плавится при 1400 градусах по Цельсию.
Плавление алюминия и меди
Температура плавления алюминия равна 660 градусам, это означает то, что расплавить его можно в домашних условиях.
Чистой меди – 1083 градусов, а для медных сплавов составляет от 930 до 1140 градусов.
От чего зависит температура плавления
Для разных веществ температура, при которой полностью перестраивается структура до жидкого состояния – разная. Если взять во внимание металлы и сплавы, то стоит подметить такие моменты:
- В чистом виде не часто можно встретить металлы. Температура напрямую зависит от его состава. В качестве примера укажем олово, к которому могут добавлять другие вещества (например, серебро). Примеси позволяют делать материал более либо менее устойчивым к нагреву.
- Бывают сплавы, которые благодаря своему химическому составу могут переходить в жидкое состояние при температуре свыше ста пятидесяти градусов. Также бывают сплавы, которые могут «держаться» при нагреве до трех тысяч градусов и выше. С учетом того, что при изменении кристаллической решетки меняются физические и механические качества, а условия эксплуатации могут определяться температурой нагрева. Стоит отметить, что точка плавления металла — важное свойство вещества. Пример этому – авиационное оборудование.
Термообработка, в большинстве случаев, почти не изменяет устойчивость к нагреву. Единственно верным способом увеличения устойчивости к нагреванию можно назвать внесение изменений в химический состав, для этого и проводят легирование стали.
Таблица температур плавления
Узнать какая нужна температура для плавления металлов, поможет таблица по возрастанию температурных показателей.
| Элемент или соединение | Необходимый температурный режим |
|---|---|
| Литий | +18°С |
| Калий | +63,6°С |
| Индий | +156,6°С |
| Олово | +232°С |
| Таллий | +304°С |
| Кадмий | +321°С |
| Свинец | +327°С |
| Цинк | +420°С |
Таблица плавления среднеплавких металлов и сплавов.
| Элемент либо сплав | Температурный режим |
|---|---|
| Магний | +650°С |
| Алюминий | +660°С |
| Барий | +727°С |
| Серебро | +960°С |
| Золото | +1063°С |
| Марганец | +1246°С |
| Медь | +1083°С |
| Никель | +1455°С |
| Кобальт | +1495°С |
| Железо | +1539°С |
| Дюрали | +650°С |
| Латуни | +950…1050°С |
| Чугун | +1100…1300°С |
| Углеродистые стали | +1300…1500°С |
| Нихром | +1400°С |
Таблица плавления тугоплавких металлов и сплавов.
| Наименование элемента | Температурный режим |
|---|---|
| Титан | +1680°С |
| Платина | +1769,3°С |
| Хром | +1907°С |
| Цирконий | +1855°С |
| Ванадий | +1910°С |
| Иридий | +2447°С |
| Молибден | +2623°С |
| Тантал | +3017°С |
| Вольфрам | +3420°С |
У какого металла самая высокая температура плавления
Вольфрам – самый тугоплавкий металл, 3422 °C (6170 °F).
Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Примечание! Технически, чистый металл при температуре выше четырехсот градусов по Цельсию становится очень пластичным. Демонстрирует химическую инертность, неохотно вступает в реакции с другими элементами. В природе встречается в виде таких сложных минералов, как: гюбнерит, шеелит, ферберит и вольфрамит.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям. По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
Металлы с высокой температурой плавления
Точка плавления вещества — это температура, при которой оно переходит из твердого состояния в жидкое. Металлы обладают высокой температурой плавления, поскольку они существуют в твердой кристаллической форме. Металлы с высокой температурой плавления имеют сильные межмолекулярные силы между атомами. Силы электростатического притяжения между ионами металлов и свободными электронами создают прочные металлические связи с более прочными связями, что приводит к более высоким температурам плавления.
Огнеупорные металлы
Есть два принятых определения тугоплавких металлов.Один утверждает, что металл должен иметь температуру плавления выше 2200 ° C, а другой утверждает, что все металлы с температурой плавления выше 1850 ° C считаются тугоплавкими металлами. В более широком смысле следующие 14 металлов классифицируются как тугоплавкие.
Металл | Точка плавления | Приложения |
Вольфрам (Вт) | 3420 ° С | Лампы накаливания, электроды сварочные, нагревательные элементы для печей |
Рений (Re) | 3180 ° С | Детали реактивных двигателей, легирование, нити для печей, рентгеновские аппараты |
Тантал (Ta) | 2966 ° С | Лопатки турбин двигателей, медицинские приборы, военные, полупроводники |
Молибден (Мо) | 2620 ° С | Покрытия, солнечные элементы, инструментальная и быстрорежущая сталь |
Ниобий (Nb) | 2468 ° С | Сверхпроводники, легирование стали, инструментальные стали, натриевые лампы |
Хром (Cr) | 1907 ° С | Легирование, покрытие, катализатор |
Гафний (Hf) | 2227 ° С | Управляющие стержни ядерных реакторов, легирование, микропроцессоры |
Иридий (Ir) | 2454 ° С | Отвердитель, легирование (особенно осмием), наконечники ручки, подшипники компаса |
Осмий (Os) | 3050 ° С | Легирование, иглы, наконечники ручек |
Родий (Rh) | 1960 ° С | Легирование, катализатор, украшения |
Рутений (Ру) | 2310 ° С | Солнечные элементы, легированные (особенно платиной и палладием), ювелирные изделия |
Титан (Ti) | 1668 ° С | Легирование, самолеты, корабли, гребные валы, теплообменники |
Ванадий (В) | 1910 ° С | Легирование (особенно сталью и титаном) |
Цирконий (Zr) | 1855 ° С | Реакторы ядерные, магниты (легированные ниобием), химическая промышленность |
Тугоплавкие металлы имеют узкоспециализированное применение, например, в осветительных приборах, инструментах, смазочных материалах и стержнях ядерной реакции.Их нельзя формовать, их можно обрабатывать только методом порошковой металлургии.
Лютеций, Лоуренсий и Протактиний также имеют высокие температуры плавления. Но они очень радиоактивны или имеют очень ограниченное применение и обычно не используются.
Для сравнения: температура плавления стали обычно находится в диапазоне 1370-1510 ° C (в зависимости от конкретного сплава). Сталь, конечно, не тугоплавкий металл, а сплав на основе железа, который иногда легируют тугоплавкими металлами, указанными выше.
Другие распространенные металлы с высокой температурой плавления
Следующие четыре металла являются наиболее часто используемыми металлами с высокими температурами плавления, но ниже 1850 ° C, и как таковые не считаются тугоплавкими металлами:
Палладий (Pd)
Палладий — блестящий серебристо-белый металл, плавящийся при 1555 ° C и имеющий плотность 12,02 г / см. 3 . Металл очень устойчив к коррозии на воздухе, но может потускнеть на влажном воздухе, содержащем серу. Он не имеет биологической роли и не токсичен.
Металл образуется как побочный продукт при переработке медных и никелевых руд. Он чрезвычайно пластичен и легко превращается в тонкий лист, используемый в декоративных целях или в качестве украшений.
Чаще всего используется при производстве автомобильных каталитических нейтрализаторов. Он также широко используется для обесцвечивания золота при изготовлении украшений из белого золота. Другие популярные применения включают стоматологию, керамические конденсаторы, изготовление электрических контактов и хирургических инструментов.
Скандий (Sc)
Скандий — серебристо-белый металл, плавящийся при 1541 ° C и имеющий плотность 3,0 г / см. 3 . Это мягкий металл, который медленно меняет цвет на желтоватый или розоватый под воздействием воздуха из-за образования оксида скандия (Sc 2 O 3 ) на поверхности. Его биологическая роль неизвестна, но предполагается, что он является канцерогеном.
Скандий — главный элемент торвейтита, очень собираемого минерала, обнаруженного в Скандинавии. Скандий считается редкоземельным элементом, поскольку он имеет аналогичные химические свойства с другими редкоземельными элементами и содержится в тех же рудах.
Скандий увеличивает температуру рекристаллизации алюминия до более чем 600 ° C. Это намного выше температурного диапазона термообрабатываемых алюминиевых сплавов. Это мощный легирующий элемент, который значительно улучшает механические и физические характеристики алюминиевого сплава. Эти сплавы набирают популярность в авиационной и транспортной отраслях.
Железо (Fe)
Железо — серебристо-серый металл, плавящийся при 1535 ° C и имеющий плотность 7,87 г / см. 3 .Это пластичный мягкий металл, который относительно хорошо проводит тепло и электричество. В чистом виде он обладает высокой реакционной способностью и легко окисляется на воздухе с образованием красно-коричневых оксидов железа или ржавчины. Он известен своей биологической ролью и жизненно важен для функционирования живых организмов. Считается нетоксичным.
Железо получают путем плавки / восстановления железной руды (гематита и магнетита) в чушковый чугун, содержащий большое количество углерода и других примесей, в доменных печах при температуре около 2000 ° C с последующим удалением этих примесей.
Железо (вместе с его сплавами) — самый распространенный промышленный металл в мире. Большая часть производимого чугуна используется для производства различных марок стали. Добавление никеля, хрома, ванадия и вольфрама улучшает коррозионную стойкость, а добавление 3-5 мас.% Углерода создает недорогой сплав для труб и других неструктурных применений.
Иттрий (Y)
Иттрий — серебристо-белый металл, плавящийся при 1525 ° C и имеющий плотность 4,47 г / см 3 . Он в меру мягкий и пластичный.Он не имеет известной биологической роли, но может быть очень токсичным для людей и животных.
Металл получают восстановлением фторида иттрия кальциево-магниевым сплавом в дуговой печи при 1600 ° C, достаточном для плавления иттрия.
Иттрий часто используется в качестве легирующего элемента для повышения прочности алюминиевых и магниевых сплавов. Его оксид используется в качестве добавки к стеклу объектива камеры, чтобы сделать его термостойким и ударопрочным.
Вот! Новый рекорд наивысшей точки плавления в мире
При таком уровне нагрева это вещество побьет давнего чемпиона по температуре плавления — карбид тантала-гафния, температура плавления которого в 1930 году была обнаружена на уровне 7128 градусов (извините приятель, у тебя был хороший пробег).
История продолжается под рекламой
Теперь осталось создать вещество, а затем попытаться расплавить его в лаборатории — очень, очень жаркой лаборатории. Исследовательская группа будет работать с Калифорнийским университетом в Дэвисе, у которого есть необходимое оборудование, чтобы опробовать его.
Исследование является довольно хорошей иллюстрацией того, как наши компьютеры становятся все быстрее и лучше при выполнении действительно сложных вычислений — но есть еще одна причина, по которой ученые любят делать подобные прогнозы, прежде чем они будут фактически продемонстрированы в лаборатории.
История продолжается под рекламой
«Вы всегда можете задним числом« предсказать »что-то, — сказал Аксель ван де Валле, автор исследования и профессор Университета Брауна. «Это не совсем дикая догадка».
На данный момент неясно, какое практическое применение может иметь это соединение с такой высокой температурой плавления. Есть много других свойств, таких как способность противостоять окислению, которые необходимо изучить. Тем не менее, ученые говорят, что их работа может быть использована в качестве защитного барьера для газовых турбин или создания тепловых экранов на самолетах.
Тепло — это то, как мы описываем, как быстро движутся отдельные молекулы в веществе, а точка плавления — это когда у этих молекул достаточно энергии, чтобы оторваться от своей твердой формы и превратиться в жидкость.
История продолжается под рекламой
На другом конце спектра находится углерод, элемент, который лучше всего сохраняет твердость (вот почему большинство соединений с чрезвычайно высокими температурами плавления содержат какой-то углерод). Если нагреть кусок углерода до 6588 градусов при обычном давлении, он просто испарится, как сухой лед, потому что давления недостаточно, чтобы сделать его жидким — это называется сублимацией.Нам потребуется давление в 10 раз больше обычного земной атмосферы и 6 422 градуса, чтобы перевести углерод в жидкое состояние.
Точки плавления металлов | Metal Supermarkets
Металлы известны своей способностью противостоять экстремальным условиям. Тяжелые нагрузки, непрерывная езда на велосипеде, сильные удары, едкая среда и даже высокие температуры. Печи, двигатели внутреннего сгорания, реактивные двигатели, форсунки зажигания, высокоскоростное оборудование и выхлопные системы постоянно подвергаются воздействию температур, которые могут вызвать плавление некоторых типов металлов.При выборе металла для высокотемпературного применения необходимо оценить несколько различных температурных точек, и одна из наиболее важных температур, которую необходимо знать, — это температура плавления металла.
Что такое температура плавления металлов?
Температура плавления металла, более известная с научной точки зрения как точка плавления, — это температура, при которой металл начинает превращаться из твердой фазы в жидкую фазу. При температуре плавления твердая фаза и жидкая фаза металла находятся в равновесии.Как только эта температура будет достигнута, к металлу можно будет непрерывно подводить тепло, однако это не приведет к повышению общей температуры. Когда металл полностью перейдет в жидкую фазу, дополнительное тепло снова продолжит повышать температуру металла.
Почему важна температура плавления металла?
Есть много важных температур, которых достигает металл, когда он нагревается либо в процессе обработки металла, либо в результате нанесения, но температура плавления металла является одной из самых важных.
Одна из причин, по которой температура плавления так важна, заключается в отказе компонентов, который может произойти, когда металл достигнет своей температуры плавления. Разрушение металла может произойти до точки плавления, но когда металл достигает температуры плавления и становится жидкостью, он больше не будет служить своему назначению. Например, если компонент печи начинает плавиться, печь больше не будет работать, если компонент достаточно важен. Если топливная форсунка реактивного двигателя расплавится, отверстия засорятся, и двигатель станет бесполезным.Важно отметить, что другие типы разрушения металла, такие как трещины, вызванные ползучестью, могут произойти задолго до достижения температуры плавления, и необходимо заранее изучить влияние различных температур, которым будет подвергаться металл.
Другая причина того, почему температура плавления металла так важна, заключается в том, что металлы наиболее пластичны, когда они находятся в жидком состоянии. Металлы нагреваются до температуры плавления для многих различных производственных процессов. Плавка, сварка плавлением и литье требуют, чтобы металлы были жидкими.При выполнении производственного процесса, в котором металл будет плавиться, важно знать температуру, при которой это произойдет, чтобы можно было выбрать подходящие материалы для используемого оборудования. Например, сварочный пистолет должен выдерживать внешнее тепло от электрической дуги и расплавленного металла. Оборудование для литья, такое как штампы, должно иметь более высокую температуру плавления, чем отливаемый металл.
Температуры плавления обычных металлов
Это температуры плавления обычных металлов:
- Алюминий: 660 ° C (1220 ° F)
- Латунь: 930 ° C (1710 ° F)
- Алюминиевая бронза *: 1027-1038 ° C (1881-1900 ° F)
- Хром: 1860 ° C (3380 ° F)
- Медь: 1084 ° C (1983 ° F)
- Золото: 1063 ° C (1945 ° F)
- Инконель *: 1390-1425 ° C (2540-2600 ° F)
- Чугун: 1204 ° C (2200 ° F)
- Свинец: 328 ° C (622 ° F)
- Молибден: 2620 ° C (4748 ° F)
- Никель: 1453 ° C (2647 ° F)
- Платина: 1770 ° C (3218 ° F)
- Серебро: 961 ° C (1762 ° F)
- Углеродистая сталь *: 1425-1540 ° C (2597-2800 ° F)
- Нержавеющая сталь *: 1375-1530 ° C (2500-2785 ° F)
- Титан: 1670 ° C (3038 ° F)
- Вольфрам: 3400 ° C (6152 ° F)
- Цинк: 420 ° C (787 ° F)
* Сплавы содержат более одного элемента, поэтому их температура плавления — это диапазон, который зависит от состава сплава.
Metal Supermarkets — крупнейший в мире поставщик мелкосерийного металла с более чем 90 обычными магазинами в США, Канаде и Великобритании. Мы эксперты по металлу и обеспечиваем качественное обслуживание клиентов и продукцию с 1985 года.
В Metal Supermarkets мы поставляем широкий ассортимент металлов для различных областей применения. В нашем ассортименте: нержавеющая сталь, легированная сталь, оцинкованная сталь, инструментальная сталь, алюминий, латунь, бронза и медь.
Наша горячекатаная и холоднокатаная сталь доступна в широком диапазоне форм, включая пруток, трубы, листы и пластины.Мы можем разрезать металл в точном соответствии с вашими требованиями.
Посетите одно из наших 90+ офисов в Северной Америке сегодня.
Металл с высокой температурой плавления
Металл с высокой температурой плавления | 10 лучших металлов с высокой температурой плавления
Просмотры сообщений: 3 852
Многие знают, что металл с самой низкой температурой плавления — это ртуть, единственный металл, который находится в жидком состоянии при комнатной температуре.Но когда дело доходит до металла с высокой температурой плавления , вероятно, не многие люди знают ответ. По этой причине мы составили этот список металлов с высокими температурами плавления — топ-10.
Металл с высокой температурой плавления
Металл с высокой температурой плавления — верх 1. Вольфрам (Вт)Вольфрам — тугоплавкий металл с самой высокой температурой плавления (3420 ° C) . Наиболее важным преимуществом вольфрама как тугоплавкого металла является то, что он обладает хорошей жаропрочностью и хорошей коррозионной стойкостью к расплавленному щелочному металлу и пару.Только когда температура вольфрама превышает 1000 ℃, происходит улетучивание оксидов и образование оксидов в жидкой фазе.
Однако он также имеет недостаток, заключающийся в том, что его трудно обрабатывать пластически при комнатной температуре. Тугоплавкие металлы, представленные вольфрамом, широко используются в металлургии, химической промышленности, электронике, производстве источников света и механической промышленности.
Вольфрам
Металл с высокой температурой плавления — Верх 2. Рений (Re)Рений — это серебристо-белый металл со второй по величине точкой плавления ( 3180 ° C ) после вольфрама и самой высокой температурой кипения.Промышленный рений обычно представляет собой порошок и может быть спрессован или спечен в твердое тело высокой плотности в вакууме или водороде с плотностью более 90% металлического состояния.
Металлы рения при отжиге обладают высокой пластичностью, их можно сгибать и скатывать. Блоки из рения устойчивы к щелочам, серной кислоте, соляной кислоте, разбавленной азотной кислоте (неконцентрированной азотной кислоте) и царской водке при стандартной температуре и давлении.
Рений
Мировое годовое производство рения колеблется от 40 до 50 тонн, в основном в Чили, США, Перу и Польше.Около 70% мирового рения используется для изготовления деталей из суперсплавов для реактивных двигателей. Еще одно важное применение рения — это платино-рениевые катализаторы, которые можно использовать для производства бессвинцового высокооктанового бензина.
Металл с высокой температурой плавления — Верхняя часть 3. Тантал (Ta)Тантал занимает третье место в нашем списке металлов с высокими температурами плавления. Он имеет температуру плавления 2966 ° C .
Тантал можно втянуть в тонкую фольгу из-за его умеренной твердости и пластичности.Тантал имеет очень маленький коэффициент теплового расширения. Тантал обладает прекрасными химическими свойствами и обладает высокой устойчивостью к коррозии. Он не реагирует на соляную кислоту, концентрированную азотную кислоту и «царскую водку» ни в холодных, ни в горячих условиях.
Тантал
Тантал может быть использован для изготовления испарительных сосудов, а также электродов, выпрямителей и электролитических конденсаторов для электронных ламп. В медицине тантал используется для изготовления тонких срезов или нитей для восстановления поврежденных тканей.
Тантал используется в конденсаторах для военной техники. Половина производимого в мире тантала используется для производства танталовых конденсаторов. Американское агентство оборонной логистики, крупнейший владелец этого металла, однажды выкупило треть мирового танталового порошка.
Металл с высокой температурой плавления — верх 4. Молибден (Мо)Молибден , как и вольфрам, является тугоплавким металлом. Он занимает 4-е место 4 в нашем списке металлов с высокими температурами плавления.Его температура плавления 2620 ° C .
Молибден в основном используется в черной металлургии. Добавление молибдена к нержавеющей стали может улучшить коррозионную стойкость стали. Добавление молибдена в чугун может улучшить его прочность и износостойкость.
Молибден
Суперсплав на основе никеля, содержащий 18% молибдена , имеет характеристики высокой температуры плавления, низкой плотности и небольшого коэффициента теплового расширения. Молибден широко используется в электронных устройствах, таких как электронные лампы, транзисторы и выпрямители.
Металл с высокой температурой плавления — Верх 5. Ниобий (Nb)С температурой плавления 2468 ° C , ниобий занимает 5-е место в нашем списке металлов с высокими температурами плавления.
Ниобий — редкий серебристо-серый, мягкий и ковкий металл с высокой температурой плавления . Ниобий при комнатной температуре не реагирует с воздухом.Ниобий можно сочетать с серой, азотом и углеродом непосредственно при высоких температурах. Ниобий не реагирует с неорганическими кислотами или основаниями, и он не растворяется в царской водке, но он растворим в плавиковой кислоте.
Ниобий
Содержание ниобия в коре составляет 20 PP M, а распределение ресурсов ниобия относительно концентрированное. Благодаря хорошей сверхпроводимости, высокой температуре плавления, коррозионной стойкости и износостойкости ниобий широко используется в стали, сверхпроводящих материалах, аэрокосмической промышленности, атомной энергии и других областях.
Металл с высокой температурой плавления — верх 6. Иридий (Ir)Иридий занимает 6-е место среди в нашем списке металлов с высокими температурами плавления . Его температура плавления 2454 ° C .
Иридий был открыт в 1803 году в нерастворимых примесях платины. Главный первооткрыватель Смитсон Теннант назвал его иридием в честь Ирис из-за того, что в нем много солей разного цвета.
Иридий
Иридий химически устойчив.Иридий — самый устойчивый к коррозии металл. Иридий химически устойчив к кислотам и не растворяется в них. В горячей царской водке медленно растворяется только губчатый иридий.
Поскольку иридий очень устойчив к коррозии и высоким температурам, он очень подходит в качестве добавки к сплавам. Некоторые из давно используемых деталей в авиационных двигателях сделаны из сплава иридия.
Металл с высокой температурой плавления — верхний слой 7. Гафний (Hf)Гафний — еще один металл с высокой температурой плавления, который заслуживает места в нашем списке.I имеет температуру плавления 2227 ° C .
Гафний — блестящий серебристо-серый переходный металл. Гафний не взаимодействует с разбавленной соляной кислотой, разбавленной серной кислотой и сильным щелочным раствором, но может растворяться в плавиковой кислоте и царской водке.
Название элемента происходит от латинского названия города Копенгаген. В 1925 году шведский химик Хервиси и голландский физик Костер получили чистую соль гафния, а затем восстановили ее металлическим натрием, чтобы получить чистый металлический гафний.
Гафний
Основное применение гафния — создание регулирующих стержней для ядерных реакторов. Чистый гафний обладает пластичностью, простотой обработки, стойкостью к высоким температурам и коррозионной стойкостью, что является важным материалом в атомной энергетике.
Металл с высокой температурой плавления — верх 8. Родий (Rh)Родий занимает 8-е место в нашем списке металлов с высокими температурами плавления. Температура плавления этого тугоплавкого металла составляет 1960 ° C .
Родий — серебристо-белый твердый металл с высокой отражательной способностью. Металлы родия обычно не образуют оксидов; расплавленный родий поглощает кислород, но кислород выделяется во время затвердевания. Родий нерастворим в большинстве кислот, полностью не растворим в азотной кислоте и слабо растворим в царской водке.
Родий
Родий имеет высокую температуру плавления, высокую прочность, стабильные электротермические свойства, хорошую коррозионную стойкость, стойкость к высокотемпературному окислению и хорошую каталитическую активность.Поэтому родий широко используется в очистке выхлопных газов автомобилей, химической, аэрокосмической, стекловолоконной, электронной и электротехнической промышленности и других областях, известных как «промышленный витамин ».
Металл с высокой температурой плавления — верхняя часть 9. Хром (Cr)Хром занимает 8-е место в нашем списке металлов с высокими температурами плавления. Это серебристо-белый блестящий металл с температурой плавления 1907 ° C .
Чистый хром пластичен, а хром, содержащий примеси, тверд и хрупок.Плотность хрома 7,20 г / см3 . Этот тугоплавкий металл нерастворим в воде, но растворим в сильных щелочных растворах. Хром обладает высокой коррозионной стойкостью и очень медленно окисляется на воздухе даже при сильной жаре. Следовательно, хромирование других металлов может защитить металл.
Хром
Содержание хрома в коре 0,01% , занимая 17 место . Свободного хрома в природе не существует, основная руда, содержащая хром, — хромит.Хром широко используется в металлургии, химической промышленности, производстве чугуна, огнеупоров, высокоточной технологии производства и других областях.
Металл с высокой температурой плавления — верхняя часть 10. Титан (Ti)Наш список не будет полным без титана . Этот тугоплавкий металл имеет высокую температуру плавления 1668 ° C . Титан — серебристо-белый переходный металл, который отличается легким весом, высокой прочностью, металлическим блеском и устойчивостью к влажной хлорной коррозии.
Однако титан нельзя использовать в сухом газообразном хлоре. Даже если температура в сухом газообразном хлоре ниже 0 ℃, произойдет бурная химическая реакция с образованием тетрахлорида титана, а затем разложение с образованием дихлорида титана или даже сгорание. Только когда содержание воды в газообразном хлоре превышает 0,5%, титан может быть в нем надежно стабилен.
Титан
Титан может быть сплавлен с другими элементами, такими как железо, алюминий, ванадий или молибден, с образованием высокопрочных легких сплавов.Он имеет широкий спектр приложений, включая аэрокосмическую, военную, автомобильную, сельскохозяйственную, пищевую, медицинскую, кухонную, спортивную, ювелирные изделия и мобильные телефоны.
ЗаключениеБлагодарим вас за чтение нашего списка металлов с высокой температурой плавления , и мы надеемся, что он будет вам полезен. Если вы хотите узнать больше о металле с высокой температурой плавления , вы можете посетить Advanced Refractory Metals для получения дополнительной информации. мы поставляем высококачественные тугоплавкие металлы для удовлетворения потребностей наших клиентов в исследованиях, разработках и производстве.
Справочник по точкам плавления элементов— Angstrom Sciences
Справочник по точкам плавления элементов — Angstrom SciencesПерейти к навигации
| Обозначения | Точка плавления | Имя | # | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0,95 К | -272,05 ° С | -458 ° F | Гелий | He | 2 | |||||
| 14.025 К | -258,975 ° С | -434 ° F | Водород | H | 1 | |||||
| 24,553 К | -248,447 ° С | -415,205 ° F | Неон | Ne | 10 | |||||
| 50,35 К | -222,65 ° С | -368,77 ° F | Кислород | O | 8 | |||||
| 53,48 К | — 219,52 ° С | -363,14 ° F | Фтор | F | 9 | |||||
| 63.14 К | -209,86 ° С | -345,75 ° F | Азот | N | 7 | |||||
| 83.81 К | -189,19 ° С | -308,54 ° F | Аргон | Ar | 18 | |||||
| 115.78 К | -157,22 ° С | -251 ° F | Криптон | Кр | 36 | |||||
| 161,3 К | -111,7 ° С | -169,1 ° F | Ксенон | Xe | 54 | |||||
| 172.16 К | -100,84 ° С | -149,51 ° F | Хлор | Класс | 17 | |||||
| 202 К | -71 ° С | -96 ° F | Радон | Rn | 86 | |||||
| 234,28 К | -38,72 ° С | -37,7 ° F | Меркурий | Hg | 80 | |||||
| 265.9 К | -7,1 ° С | 19,2 ° F | Бром | руб. | 35 | |||||
| 300 К | 27 ° С | 81 ° F | Франций | Fr | 87 | |||||
| 301.55 К | 28,55 ° С | 83,39 ° F | Цезий | CS | 55 | |||||
| 302,9 К | 29,9 ° С | 85,8 ° F | Галлий | Ga | 31 | |||||
| 312.64 К | 39,64 ° С | 103,35 ° F | Рубидий | руб. | 37 | |||||
| 317,3 К | 44,3 ° С | 111,7 ° F | фосфор | -P | 15 | Вячеслав Сибирский.35 К63,35 ° С | 146,03 ° F | Калий | К | 19 |
| 371 К | 98 ° С | 208 ° F | Натрий | Na | 11 | |||||
| 386,7 К | 113,5 ° С | 236,3 ° F | Йод | I | 53 | |||||
| 388,36 К | 115,36 ° С | 239,65 ° F | Сера | S | 16 | |||||
| 429.76 К | 156,76 ° С | 314,17 ° F | Индий | В | 49 | |||||
| 453,7 К | 180,7 ° С | 357,3 ° F | Литий | Li | 3 | |||||
| 494 К | 221 ° С | 430 ° F | Селен | SE | 34 | |||||
| 505,06 К | 232,06 ° С | 449,71 ° F | Олово | Sn | 50 | |||||
| 527 К | 254 ° С | 489 ° F | Полоний | Po | 84 | |||||
| 544.52 К | 271,52 ° С | 520,74 ° F | Висмут | Bi | 83 | |||||
| 575 К | 302 ° С | 576 ° F | Астатин | по адресу | 85 | |||||
| 577 К | 304 ° С | 579 ° F | Таллий | Tl | 81 | |||||
| 594,18 К | 321,18 ° С | 610,12 ° F | Кадмий | Кд | 48 | |||||
| 600.6 К | 327,6 ° С | 621.7 ° F | Свинец | Пб | 82 | |||||
| 692,73 К | 419,73 ° С | 787,51 ° F | Цинк | Zn | 30 | |||||
| 722.65 К | 449,65 ° С | 841,37 ° F | Теллур | Te | 52 | |||||
| 903.9 К | 630,9 ° С | 1167,6 ° F | Сурьма | Сб | 51 | |||||
| 913 К | 640 ° С | 1184 ° F | Плутоний | Pu | 94 | |||||
| 913 К | 640 ° С | 1184 ° F | Нептуний | Np | 93 | |||||
| 922 К | 649 ° С | 1200 ° F | Магний | мг | 12 | |||||
| 933.25 К | 660,25 ° С | 1220,45 ° F | Алюминий | Al | 13 | |||||
| 973 К | 700 ° С | 1292 ° F | Радий | Ra | 88 | |||||
| 1002 К | 729 ° С | 1344 ° F | Барий | Ba | 56 | |||||
| 1042 К | 769 ° С | 1416 ° F | Стронций | Sr | 38 | |||||
| 1071 К | 798 ° С | 1468 ° F | Церий | CE | 58 | |||||
| 1081 К | 808 ° С | 1486 ° F | Мышьяк | как | 33 | |||||
| 1095 К | 822 ° С | 1512 ° F | Европий | Eu | 63 | |||||
| 1097 К | 824 ° С | 1515 ° F | Иттербий | Yb | 70 | |||||
| 1112 К | 839 ° С | 1542 ° F | Кальций | Ca | 20 | |||||
| 1133 К | 860 ° С | 1580 ° F | Эйнштейний | Es | 99 | |||||
| 1173 К | 900 ° С | 1652 ° F | Калифорний | Cf | 98 | |||||
| 1193 К | 920 ° С | 1688 ° F | Лантан | La | 57 | |||||
| 1204 К | 931 ° С | 1708 ° F | Прометий | вечера | 61 | |||||
| 1204 К | 931 ° С | 1708 ° F | Празеодим | Пр | 59 | |||||
| 1210.4 К | 937,4 ° С | 1719,3 ° F | Германий | Ge | 32 | |||||
| 1234 К | 961 ° С | 1762 ° F | Серебро | Ag | 47 | |||||
| 1259 К | 986 ° С | 1807 ° F | Берклий | B K | 97 | |||||
| 1267 К | 994 ° С | 1821 ° F | Америций | Am | 95 | |||||
| 1289 К | 1016 ° С | 1861 ° F | Неодим | Nd | 60 | |||||
| 1323 К | 1050 ° С | 1922 ° F | Актиний | Ac | 89 | |||||
| 1337.58 К | 1064,58 ° С | 1948,24 ° F | Золото | Au | 79 | |||||
| 1340 К | 1067 ° С | 1953 ° F | Кюрий | см | 96 | |||||
| 1345 К | 1072 ° С | 1962 ° F | Самарий | см | 62 | |||||
| 1357,6 К | 1084,6 ° С | 1984,3 ° F | Медь | Cu | 29 | |||||
| 1405 К | 1132 ° С | 2070 ° F | Уран | U | 92 | |||||
| 1517 К | 1244 ° С | 2271 ° F | Марганец | Mn | 25 | |||||
| 1551 К | 1278 ° С | 2332 ° F | Бериллий | Be | 4 | |||||
| 1585 К | 1312 ° С | 2394 ° F | Гадолиний | Gd | 64 | |||||
| 1630 К | 1357 ° С | 2475 ° F | Тербий | Тб | 65 | |||||
| 1683 К | 1410 ° С | 2570 ° F | Кремний | Si | 14 | |||||
| 1685 К | 1412 ° С | 2574 ° F | Диспрозий | Dy | 66 | |||||
| 1726 К | 1453 ° С | 2647 ° F | Никель | Ni | 28 | |||||
| 1743 К | 1470 ° С | 2678 ° F | Гольмий | Ho | 67 | |||||
| 1768 К | 1495 ° С | 2723 ° F | Кобальт | Co | 27 | |||||
| 1795 К | 1522 ° С | 2772 ° F | Эрбий | Er | 68 | |||||
| 1799 К | 1526 ° С | 2779 ° F | Иттрий | Y | 39 | |||||
| 1808 К | 1535 ° С | 2795 ° F | Утюг | Fe | 26 | |||||
| 1812 К | 1539 ° С | 2802 ° F | Скандий | SC | 21 | |||||
| 1818 К | 1545 ° С | 2813 ° F | Тулий | ТМ | 69 | |||||
| 1825 К | 1552 ° С | 2826 ° F | Палладий | Pd | 46 | |||||
| 1933 К | 1660 ° С | 3020 ° F | Титан | Ti | 22 | |||||
| 1936 К | 1663 ° С | 3025 ° F | Лютеций | Лю | 71 | |||||
| 2028 К | 1755 ° С | 3191 ° F | Торий | Чт | 90 | |||||
| 2045 К | 1772 ° С | 3222 ° F | Платина | Pt | 78 | |||||
| 2113 К | 1600 ° С | 2912 ° F | Протактиний | Па | 91 | |||||
| 2125 К | 1852 ° С | 3366 ° F | Цирконий | Zr | 40 | |||||
| 2130 К | 1857 ° С | 3375 ° F | Хром | Cr | 24 | |||||
| 2175 К | 1902 ° С | 3456 ° F | Ванадий | В | 23 | |||||
| 2239 К | 1966 ° С | 3571 ° F | Родий | Rh | 45 | |||||
| 2473 К | 2200 ° С | 3992 ° F | Технеций | TC | 43 | |||||
| 2500 К | 2227 ° С | 4041 ° F | Гафний | HF | 72 | |||||
| 2523 К | 2250 ° С | 4082 ° F | Рутений | Ру | 44 | |||||
| 2573 К | 2300 ° С | 4172 ° F | Бор | B | 5 | |||||
| 2716 К | 2443 ° С | 4429 ° F | Иридий | Ir | 77 | |||||
| 2741 К | 2468 ° С | 4474 ° F | Ниобий | Nb | 41 | |||||
| 2890 К | 2617 ° С | 4743 ° F | Молибден | Пн | 42 | |||||
| 3269 К | 2996 ° С | 5425 ° F | Тантал | Ta | 73 | |||||
| 3300 К | 3027 ° С | 5481 ° F | Осмий | Os | 76 | |||||
| 3453 К | 3180 ° С | 5756 ° F | Рений | Re | 75 | |||||
| 3680 К | 3407 ° С | 6165 ° F | Вольфрам | Вт | 74 | |||||
| 3773 К | 3500 ° С | 6332 ° F | Углерод | C | 6 |
ресурсов ювелира — точки плавления
Удельный вес металла или сплава — это просто вес одного кубического сантиметра в граммах.Когда удобнее работать в тройских весах, количество унций на кубический дюйм любого металла или сплава можно найти, умножив его удельный вес на константу 0,52686.
| Точка плавления и масса различных металлов и сплавов | |||||
| Металл | Символ | Температура плавления ºF | Температура плавления ºC | Удельная Плотность | Вес в тройках унций / Cu In |
| Алюминий | Al | 1220 | 660 | 2.70 | 1,423 |
| Сурьма | Сб | 1167 | 630 | 6,62 | 3,448 |
| Бериллий | Be | 2340 | 1280 | 1,82 | 0,959 |
| висмут | Bi | 520 | 271 | 9.80 | 5,163 |
| кадмий | Кд | 610 | 321 | 8,65 | 4.557 |
| Углерод | C | – | – | 2,22 | 1,170 |
| Хром | Cr | 3430 | 1890 | 7.19 | 3,788 |
| Кобальт | Co | 2070 | 1132,2 | 8,9 | 4,689 |
| Медь | Cu | 1981 | 1083 | 8,96 | 4,719 |
| Золото, 24K чистое | Au | 1945 | 1063 | 19.32 | 10,180 |
| Иридий | Ir | 4449 | 2454 | 22,50 | 11,849 |
| Утюг | Fe | 2802 | 1539 | 7,87 | 4,145 |
| Свинец | Пб | 621 | 327 | 11.34 | 5,973 |
| Магний | мг | 1202 | 650 | 1,75 | 0,917 |
| Марганец | Mn | 2273 | 1245 | 7,43 | 3,914 |
| Молибден | Пн | 4760 | 2625 | 10.20 | 5,347 |
| Никель | Ni | 2651 | 1455 | 8,90 | 4,691 |
| Осмий | Os | 4892 | 2700 | 22,50 | 11,854 |
| Палладий | Pd | 2831 | 1555 | 12.00 | 6.322 |
| фосфор | -P | 111 | 44 | 1,82 | 0,959 |
| Платина, Чистая | Pt | 3224 | 1773 | 21,45 | 11.301 |
| 15% Irid Plat | – | 3310 | 1821 | 21.59 | 11.301 |
| 10% Irid Plat | – | 3250 | 1788 | 21,54 | 11,349 |
| 5% Irid Plat | – | 3235 | 1779 | 21,50 | 11,325 |
| Родий | Rh | 3571 | 1966 | 12.44 | 6.553 |
| Рутений | Ру | 4500 | 2500 | 12,20 | 6,428 |
| Кремний | Si | 2605 | 1430 | 2,33 | 1,247 |
| Серебро, Чистое | Ag | 1761 | 961 | 10.49 | 5,525 |
| Серебро, Стерлинг | – | 1640 | 893 | 10,36 | 5,457 |
| Серебро, Монета | – | 1615 | 879 | 10,31 | 5,430 |
| Олово | Sn | 450 | 232 | 7.30 | 3,846 |
| цинк | Zn | 787 | 419 | 7,10 | 3,7758 |
Точка плавления металлов
Знание точек плавления различных металлов важно для производителей и сварщиков. Металлы плавятся постепенно, так как металл поглощает тепло.Задолго до того, как кусок металла достигнет полной точки плавления, он может начать размягчаться и деформироваться. Для простоты мы обычно классифицируем точку плавления металла как точку, в которой он стал полностью жидким (называемый ликвидусом).
При соединении металлов с очень разными температурами плавления, таких как медь и сталь, пайка может быть лучшим выбором, чем сварка. При пайке используется кислородно-ацетиленовая горелка для нагрева присадочного металла, обычно латунного сплава, который имеет более низкую температуру плавления, чем две металлические части.По мере плавления наполнитель втягивается в шов, а затем затвердевает при охлаждении. Две соединяемые детали никогда не достигают точки плавления, а это означает, что соединение непостоянно.
Сварка и пайка
Сварка — это процесс соединения двух частей металла путем нагрева обеих частей до их точки плавления, создавая ванну жидкого расплава, в которой их молекулы полностью смешиваются. В ванну расплава часто добавляют третий металлический наполнитель. Когда расплавленный металл охлаждается и затвердевает, две части полностью соединяются неразрывной связью.Знание того, какие металлы можно сваривать, и выбор лучших металлов для сварки может частично зависеть от их точек плавления — если они сильно различаются, одна из секций будет плавиться быстрее, чем другая. Это может вызвать взрыв или другие механические неисправности.
При соединении металлов с очень разными температурами плавления, таких как медь и сталь, пайка может быть лучшим выбором, чем сварка. При пайке используется кислородно-ацетиленовая горелка для нагрева присадочного металла, обычно латунного сплава, который имеет более низкую температуру плавления, чем две металлические части.По мере плавления наполнитель втягивается в шов, а затем затвердевает при охлаждении. Две соединяемые детали никогда не достигают точки плавления, а это означает, что соединение непостоянно.
Следующий список температур плавления обычных металлов и их сплавов варьируется от минимальной до максимальной (обратите внимание, что температура плавления будет варьироваться в зависимости от точного состава сплава):
Свинец имеет одну из самых низких температур плавления среди всех металлов при 621 F (327 C).
Алюминий имеет относительно низкую температуру плавления 1218 F (659 C).Когда к алюминию добавляются легирующие металлы, его температура плавления может варьироваться от примерно 848 до 1230 F (от 453 до 666 ° C). Добавление алюминия к другим металлам также снижает их температуру плавления.
Бронза : 1675 F (913 C). Подшипниковая бронза содержит в основном медь, а также свинец и цинк, что снижает ее температуру плавления до 1790 F (977 C). Кремниевая бронза — это латунный сплав с низким содержанием свинца, который обычно состоит из 96% меди и небольшого процента кремния. Его температура плавления 1880 F (1025 C).
Латунь : 1700 F (927 C) Латунь — это сплав меди.
Медь : 1981 F (1083 C)
Чугун : 2200 F (1204 C)
Сталь : 2500 F (1371 C)
Нержавеющая сталь : 2750 F (1510 C)
Никель : 2646 F (1452 C)
Кованое железо: 2700 F (1482 C)
Железо : 2800 F (1538 C)
Вольфрам имеет чрезвычайно высокую температуру плавления 6150 F (3399 C), поэтому он используется для сварки TIG электродов.
