Пропан взаимодействует с кислородом в реакции горения при сварочных работах
Физико-технические особенности сварочных газов
Нефтеуглеводороды, в частности, пропан, бутан и их смеси, ацетилен, а также водород нашли широкое применение в различных сферах производства в качестве основных и вспомогательных соединений. Различные газы успешно используются как в качестве источников тепловой энергии, так и хладагентов. Одним из направлений их применения является сварочное дело и резка металла. Выбор газа в основном зависит от требуемой температуры сгорания.
Пропан и пропан-бутановые смеси
Углеводородные газы из группы алканов используются в тех случаях, когда нет необходимости в слишком высокой температуре газопламенной обработки: сварка тонкой стали и легкоплавких металлов, кислородная резка, пайка припоями и др. Пропан и бутан – это неядовитые и достаточно инертные газы, получаемые в качестве побочных продуктов при переработке нефти. При определенных условиях они взаимодействуют с кислородом, азотной кислотой и диоксидом азота, галогенами. При низкой температуре (-42 °С для пропана, -0,5 °С для бутана) и высоком давлении переходят в жидкое состояние.
При низкой температуре (-42 °С для пропана, -0,5 °С для бутана) и высоком давлении переходят в жидкое состояние.
Чаще всего используются пропан-бутановые смеси в соотношении 3:7 соответственно. Они обладают повышенной теплотворной способностью, а тепловая мощь сгорания в кислороде эффективнее, чем у ацетилена, но из-за небольшой скорости, с которой распространяется пламя, температура пламени меньше. В случае утечки газы скапливаются внизу помещения и могут, что может привести к образованию взрывоопасных концентраций.
Ацетилен
Ацетилен относится к ненасыщенным углеводородам, чем обусловлена его химическая активность. Соединение вступает в многочисленные реакции присоединения, цикломеризации, димеризации, окисления. Отличается резким запахом. Температура сжижения около -82 °С. При его сгорании требуется больше кислорода, чем для пропана и бутана. Для ацетилена свойственна высокая интенсивность горения, которая снижается при наличии в нем побочных веществ.
Водород
В промышленности газ получают различными способами: железопаровым, электролизом, конверсией. В зависимости концентрация чистого вещества находится в пределах 95 – 99,8 об. %. Температура сжижения -252 °С. Используется при кислородной разделительной резке в присутствии воды, сварке свинца, безокислительной пайке стали.
В зависимости концентрация чистого вещества находится в пределах 95 – 99,8 об. %. Температура сжижения -252 °С. Используется при кислородной разделительной резке в присутствии воды, сварке свинца, безокислительной пайке стали.
Технические характеристики газов: сравнительная таблица
|
Параметр |
Пропан-бутановая смесь |
Ацетилен |
Водород |
|
Плотность при температуре 20 °С и давлении 0,1 МПа, кг/м3 |
|
1,091 |
0,084 |
|
Температура воспламенения в кислороде, °С |
500 |
240-630 |
510 |
|
Низшая теплотворная способность, кДж/м3 |
88800 |
52800 |
10800 |
|
Скорость распространения пламени в смеси с кислородом, м/с |
4,5 |
13,5 |
— |
Меры безопасности
В связи с большой взрывоопасностью сварочных газов предъявляются особые требования к условиям и помещениям проведения работ, хранению газовых баллонов. Особое внимание уделяется отсутствию источников возникновения пламени, искры, легковоспламеняющихся веществ. Помещения оборудуются специальными осветительными приборами, системами вентиляции и кондиционирования. Сварочные работы проводятся в присутствии более двух человек при обязательном оформлении наряда-допуска.
Особое внимание уделяется отсутствию источников возникновения пламени, искры, легковоспламеняющихся веществ. Помещения оборудуются специальными осветительными приборами, системами вентиляции и кондиционирования. Сварочные работы проводятся в присутствии более двух человек при обязательном оформлении наряда-допуска.
Каталог технических газов от нашей компании
Кислород
Углекислота
Ацетилен
Азот
Аргон
Гелий
Пропан
Сварочная смесь
ХИМИЯ 10 КЛАСС Еремина и др. Тестовые задания к главе 2.
 РЕШЕБНИК ОТВЕТЫ ГДЗ » Крутые решение для вас от GDZ.cool
РЕШЕБНИК ОТВЕТЫ ГДЗ » Крутые решение для вас от GDZ.coolХИМИЯ 10 КЛАСС Еремина и др. Тестовые задания к главе 2. РЕШЕБНИК ОТВЕТЫ ГДЗ
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Пропан взаимодействует с
1) бромоводородом
2) водородом
3) бромом CH3―CH2―CH
⟶ CH3―CHBr―CH3 + HBr
4) гидроксидом натрия
Задание 2
Алканы вступают в реакции
1) гидратации
2) гидрирования
3) галогенирования CH4 + 4Cl2 ⟶ CCl4 + 4HCl
4) гидрогалогенирования
Задание 3
В отличие от пропана, бутан способен вступать в реакцию
1) с хлором
2) с азотной кислотой
3) сгорания
4) изомеризации CH3―CH2―CH2―CH3 t,Al2O3⟶ CH3―CH(CH3)―CH3
Задание 4
В отличие от пропана, пропен способен вступать в реакцию с
1) хлором
2) водным раствором перманганата калия Качественная реакция на кратные связи (обесцвечивание раствора перманганата калия).
3) кислородом
4) азотной кислотой
Задание 5
В отличие от бензола, толуол способен вступать в реакцию с
1) хлором
2) раствором перманганата калия (подкисленным) C6H5―CH3 [O]⟶ C6H5―COOH образуется бензойная кислота
3) кислородом
4) азотной кислотой
Задание 6
В реакцию замещения с хлором может вступить
1) толуол C6H5―CH3 + Cl2 свет⟶ C6H5―CH2Cl + HCl
2) этилен
3) ацетилен
4) бутадиен-1,3
Задание 7
Установите молекулярную формулу алкена, если известно, что 3,0 г его способны присоединить 1,2 л (н у.) хлороводорода.
1) C2H4
2) C3H6
3) C4H8
Дано: m(CnH2n)=3 г, V(HCl)=1,2 л
Найти: формулу CnH2n
Решение
n(HCl)=V(HCl)/Vm=1,2 л : 22,4 л=0,0536 моль
CnH2n + HCl ⟶ CnH2n+1Cl
По уравнению реакции n(CnH2n)/1=n(HCl)/1, поэтому n(CnH2n)=n(HCl)=0,0536 моль
M(CnH2n)=m(CnH2n)/n(CnH2n)=3 г : 0,0536 моль=56 г/моль, поэтому Mr(CnH2n)=56
По определению Mr(CnH2n)=n•Ar(C)+2n•Ar(H)=12•n+2n=14n.

Решаем уравнение: 14n=56, n=56:14, n=4, следовательно, молекулярная формула алкена C4H8.
Задание 8
В реакцию присоединения с бромом может вступить
2) пропан
3) циклогексан
4) бутан
Задание 9
Толуол можно получить в одну стадию из
1) ацетилена
2) гексана
3) гептана СH3―(CH2)5―CH3 t, Cr2O3⟶ C6H5―CH3 + 4H2
4) циклогексана
Задание 10
В реакцию присоединения с хлороводородом вступает
1) ацетилен HC≡CH + HCl ⟶ CH2=CHCl
2) пропан
3) бензол
4) циклогексан
Задание 11
Уксусная кислота образуется при окислении
1) этилена
2) этана
3) толуола
4) бутена-2 CH3―CH=CH―CH3 [O], KMnO₄⟶ 2CH3―COOH
Задание 12
С бромом в темноте и без катализатора реагирует

2) метан
3) циклогексан
4) толуол
Задание 13
В реакцию с раствором перманганата калия вступает
1) пропен Качественная реакция на кратные связи (обесцвечивание раствора перманганата калия).
2) гексан
3) бензол
4) циклогексан
Задание 14
Спирт образуется при взаимодействии с водой
1) пропана
2) дипропилового эфира
3) этилена CH2=CH2 + H2O H₂SO₄⟶ C2H5OH
4) пропина
Задание 15
В реакцию замещения с бромом при освещении вступает
1) циклогексан
2) бензол C6H6 + 3Br2свет⟶ C6H6Br6 1,2,3,4,5,6-гексабромциклогексан
4) ацетилен
Задание 16
Пропен образуется при отщеплении воды от
1) пропанола-1 CH3―CH2―CH2―OH H₂SO₄, t⟶ CH2=CH―CH3 + H2O
2) пропаналя
3) глицерина
4) пропандиола-1,2
Задание 17
И с бензолом, и с толуолом реагирует
1) HCl
2) KMnO4
3) HNO3
4) Br2 на свету
C6H6 + 3Br2свет⟶ C6H6Br6 1,2,3,4,5,6―гексабромциклогексан
C6H5―CH3 + Br2 свет⟶ C6H5―CH2Br + HBr
Задание 18
И с этиленом, и с ацетиленом реагирует
1) Na
2) NaOH
3) HNO3
4) H2O
CH2=CH2 + H2O кат.
CH≡CH + H2O Hg²⁺,H⁺⟶ CH3―CH=O
Задание 19
Изомером бутина-1 является
1) бутен-1
2) бутан
3) циклобутан
4) бутадиен-1,3 Одинаковая молекулярная формула C4H6
Задание 20
Изомером циклобутана является
1) бутан
2) бутен-1 Одинаковая молекулярная формула C4H8
3) бутин-2
4) бутадиен-1,3
Задание 21
Бромная вода взаимодействует с обоими углеводородами
1) пропаном и бутаном
2) бензолом и толуолом
3) пропеном и пропином Качественная реакция на кратные (= и ≡) связи
4) этаном и этиленом
Задание 22
Воду в определённых условиях могут присоединить оба углеводорода
1) этилен и бутадиен-1,3 Непредельные углеводороды
3) бензол и циклогексан
4) пентан и пентен-2
Задание 23
При полном сгорании углеводорода образовалось 27 г воды и 33,6 л (н. у.) углекислого газа. Относительная плотность углеводорода по неону равна 2,1. Установите его молекулярную формулу.
у.) углекислого газа. Относительная плотность углеводорода по неону равна 2,1. Установите его молекулярную формулу.
1) C2H4
2) C3H6
3) C3H8
4) CH4
Дано: DNe(CxHy)=2,1, V(CO2)=33,6 л, m(H2O)=27 г
Найти: формулу CxHy
Решение
n(H2O)=m(H2O)/M(H2O)=27 г : 18 г/моль=1,5 моль
n(CO2)=V(CO2)/Vm=33,6 л : 22,4 л/моль=1,5 моль
При полном сгорании углеводорода все атомы углерода переходят в молекулы углекислого газа, а все атомы водорода ― в молекулы воды.
n(H)=2•n(H2O)=2 • 1,5 моль=3 моль
Соотношение атомов углерода и водорода х:у=n(C):n(H)=1,5:3=1:2, следовательно, простейшая формула углеводорода CH2.
Находим истинную формулу.
M(CH2)=Ar(C)+2•Ar(H)=12+2•1=14 г/моль
M(CxHy)=M(Ne)•DNe(CxHy)=20 г/моль •2,1=42 г/моль
M(CxHy):M(CH2)=42:14=3, то есть индексы углерода и водорода в простейшей формуле надо увеличить в 3 раза, поэтому истинная формула С3Н6.

Задание 24
При ароматизации гептана образовалось 150 л паров толуола. Чему равен объём полученного при этом водорода?
1) 37,5 л
2) 150 л
3) 450 л
4) 600 л
Дано: V(C6H5―CH3)=150 л
Найти: V(H2)-?
Решение
СH3―(CH2)5―CH3 t, Cr2O3⟶ C6H5―CH3 + 4H2↑
По уравнению реакции V(C6H5―CH3)/1=V(H2)/4, отсюда
V(H2)=4•V(C6H5―CH3)=4 • 150 л=600 л
Ответ: V(H2)=600 л
Задание 25
При полном сгорании пропана образовалось 30 л углекислого газа. Сколько литров пропана израсходовано? Объёмы газов измерены при одинаковых условиях.
1) 10
2) 30
3) 90
4) 120
Дано: V(CO2)=30 л
Найти: V(C3H8)-?
Решение
C3H8+ 5O2 ⟶ 3CO2 + 4H2O
По уравнению реакции V(C3H8)/1=V(CO2)/3, отсюда
V(C3H8)=V(CO2):3=30 л :3=10 л
Ответ: V(C3H8)=10 л
Задание 26
Сколько литров углекислого газа образуется при полном сгорании 40 л бутана? Объёмы газов измерены при одинаковых условиях.
1) 10
2) 40
3) 160
4) 200
Дано: V(C4H10)=40 л
Найти: V(CO2)-?
Решение
2C4H10+ 13O2 ⟶ 8CO2 + 10H2O
По уравнению реакции V(C4H10)/2=V(CO2)/8, отсюда
V(CO2)=8•V(CO2):4=8•40 л:2=160 л
Ответ: V(CO2)=160 л
Задание 27
Углеводороды образуются при нагревании спиртов с
1) NaOH
2) HNO3
3) H2SO4
4) KMnO4
C2H5OH H₂SO₄, t⟶ CH2=CH2 + H2O
Задание 28
Бензол вступает в реакцию замещения с
1) HNO3
2) H2
3) Cl2 (на свету)
4) HCl
C6H6 + HNO3 H₂SO₄⟶ C6H5―NO2 + H2O
Задание 29
Толуол вступает в реакцию замещения с
1) Cl2 (на свету)
2) O2
3) H2
4) KMnO4
C6H5―CH3 + Cl2 свет⟶ C6H5―CH2Cl + HCl
Задание 30
Установите соответствие между названием углеводорода и общей формулой гомологического ряда, к которому он принадлежит.
| НАЗВАНИЕ УГЛЕВОДОРОДА | ОБЩАЯ ФОРМУЛА |
| А) толуол Б) ацетилен В) бутадиен-1,3 Г) 2-метилгептан | 1) CnH2n+2 2) CnH2n 3) CnH2n-2 4) CnH2n-4 5) CnH2n-6 |
Задание 31
В схеме превращений C2H5OH H₂SO₄⟶ X
⟶ Y конечное вещество Y – это
1) C2H5Br
2) C2H4Br2
3) C2H2Br4
4) C2Br6
C2H5OH
⟶ C2H4 + H2O
C2H4 + Br2 ⟶ C2H4Br2
Задание 32
В схеме превращений C2H2 ⟶ X ⟶ C6H5NO2 промежуточное вещество X – это
1) C6H6
2) C6H14
3) C6H5CH3
4) C2H5NO2
3C2H2 t, C⟶ C6H6
C6H6 + HNO3 H₂SO₄⟶ C6H5NO2
Задание 33
В схеме превращений C2H6 ⟶ Х ⟶ CH3―CH=O промежуточное вещество X – это
1) C2H2
2) CH4
3) C6H6
4) C2H5Cl
C2H6 t⟶ C2H2 + 2H2↑
C2H2 + H2O Hg²⁺, H⁺⟶ CH3―CH=O
Другие задания смотри здесь. ..
..
Пропанол-1, структурная формула, химические, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
химические свойства, строение, получение, применение
Пропан — это органическое соединение, третий представитель алканов в гомологическом ряду. При комнатной температуре он представляет собой газ без цвета и запаха. Химическая формула пропана — C3H8. Пожаро- и взрывоопасен. Обладает небольшой токсичностью. Он оказывает слабое воздействие на нервную систему и обладает наркотическими свойствами.
Строение
Пропан — это предельный углеводород, состоящий из трех атомов углерода. По этой причине он имеет изогнутую форму, но из-за постоянного вращения вокруг осей связей существует несколько молекулярных конформаций. Связи в молекуле ковалентные: С-С неполярные, C-H слабополярные. Из-за этого их сложно разорвать, а вещество довольно трудно вступает в химические реакции. Это и задает все химические свойства пропана. Изомеров у него нет. Молярная масса пропана — 44,1 г/моль.
Способы получения
В промышленности пропан почти не синтезируют искусственно. Его выделяют из природного газа и нефти с помощью перегонки. Для этого существуют специальные производственные установки.
В лаборатории пропан можно получить следующими химическими реакциями:
- Гидрирование пропена. Данная реакция идет только при повышении температуры и при наличии катализатора (Ni, Pt, Pd).
- Восстановление галогенидов алканов. Для разных галогенидов применяются разные реагенты и условия.
- Синтез Вюрца. Его суть в том, что две молекулы галогенаклкана связываются в одну, реагируя с щелочным металлом.
- Декарбоксилирование масляной кислоты и ее солей.
Физические свойства пропана
Как уже упоминалось, пропан — это газ без цвета и запаха. Он не растворяется в воде и других полярных растворителях. Зато растворяется в некоторых органических веществах (метанол, ацетон и другие). При — 42,1 °C сжижается, а при − 188 °C становится твердым. Огнеопасен, так как образует с воздухом легковоспламеняющиеся и взрывоопасные смеси.
Огнеопасен, так как образует с воздухом легковоспламеняющиеся и взрывоопасные смеси.
Химические свойства пропана
Они представляют собой типичные свойства алканов.
- Каталитическое дегидрирование. Осуществляется при 575 °C с использованием катализатора оксида хрома (III) или оксида алюминия.
- Галогенирование. Для хлорирования и бромирования нужно ультрафиолетовое излучение или повышенная температура. Хлор преимущественно замещает крайний атом водорода, хотя в некоторых молекулах происходит замещение среднего. Повышение температуры может привести к увеличению доли выхода 2-хлорпропана. Хлорпропан может галогенироваться и дальше с образованием дихлорпропана, трихлорпропана и так далее.
Механизм реакций галогенирования — цепной. Под действием света или высокой температуры молекула галогена распадается на радикалы. Они вступают во взаимодействие с пропаном, отнимая у него атом водорода. В результате этого образуется свободный пропил. Он взаимодействует с молекулой галогена, вновь разбивая ее на радикалы.
Бромирование происходит по такому же механизму. Йодирование можно осуществлять только специальными йодсодержащими реагентами, так как пропан не взаимодействует с чистым йодом. При взаимодействии с фтором происходит взрыв, образуется полизамещенное производное пропана.
Нитрование может осуществятся разбавленной азотной кислотой (реакция Коновалова) или оксидом азота (IV) при повышенной температуре (130-150 °C).
Сульфоокисление и сульфохлорирование осуществляется при УФ-свете.
Реакция горения пропана: C3H8+ 5O2 → 3CO2 + 4H2O.
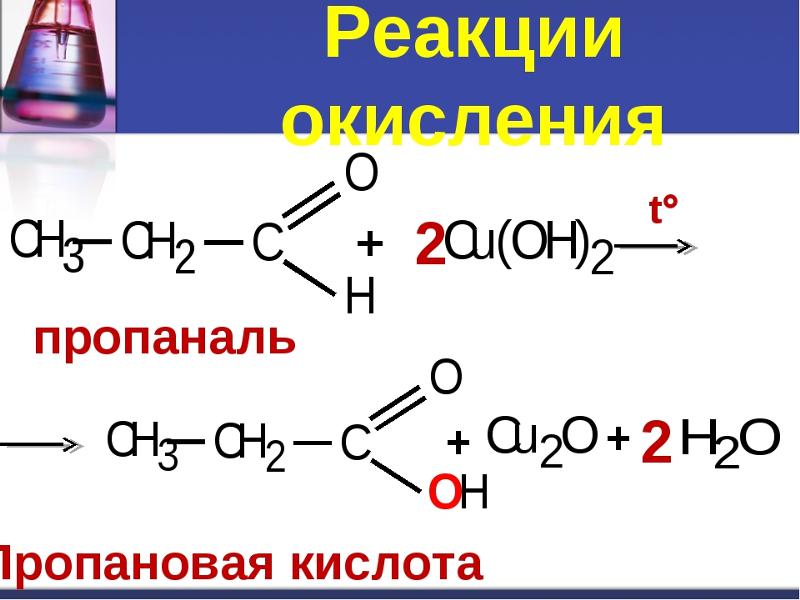
Можно провести и более мягкое окисление, используя определенные катализаторы. Реакция горения пропана будет другой. В этом случае получают пропанол, пропаналь или пропионовую кислоту. В качестве окислителей, кроме кислорода, могут использоваться перекиси (чаще всего перекись водорода), оксиды переходных металлов, соединения хрома (VI) и марганца (VII).
Пропан реагирует с серой с образованием изопропилсульфида. Для этого в качестве катализаторов используется тетрабромэтан и бромид алюминия. Реакция идет при 20 °C в течение двух часов. Выход реакции составляет 60 %.
Для этого в качестве катализаторов используется тетрабромэтан и бромид алюминия. Реакция идет при 20 °C в течение двух часов. Выход реакции составляет 60 %.
С теми же катализаторами может реагировать с оксидом углерода (I) с образованием изопропилового эфира 2-метилпропановой кислоты. Реакционная смесь после реакции должна быть обработана изопропанолом. Итак, мы рассмотрели химические свойства пропана.
Применение
Из-за хорошей горючести пропан находит применение в быту и промышленности как топливо. Он может быть использован также в качестве горючего для автомобилей. Пропан горит с температурой почти 2000° C, поэтому его используют для сварки и резки металла. Пропановыми горелками разогревают битум и асфальт в дорожном строительстве. Но зачастую на рынке используется не чистый пропан, а его смесь с бутаном (пропан-бутан).
Как ни странно, но нашел он применение и в пищевой промышленности как добавка Е944. Благодаря своим химическим свойствам пропан используется там в качестве растворителя ароматизаторов, а также для обработки масел.
Смесь пропана и изобутана используется как хладагент R-290a. Он более эффективен, чем старые хладагенты, и также является экологически чистым, так как не разрушает озоновый слой.
Большое применение пропан нашел в органическом синтезе. Его используют для получения полипропилена и различного рода растворителей. В нефтепереработке его используют для деасфальтизации, то есть уменьшения доли тяжелых молекул в битумной смеси. Это необходимо для вторичного использования старого асфальта.
Что такое пропан. Химия пропана: технологии преобразования газа
Содержание
- Пропан, формула, газ, характеристики:
- Строение
- Физические свойства
- Плотность пропана C3H8 при различной температуре
- Плотность газообразного пропана
- Плотность сжиженного пропана
- Химические свойства
- Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование пропана
- Окисление пропана
- 3.1. Полное окисление – горение
- Дегидрирование пропана – способ получения пропилена
- Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- Пропан-бутановая смесь
- Характеристика и свойства газовой смеси пропан-бутан
- Нахождение в природе и методы получения
- Применение
- Топливо
- Химия и пищевая промышленность
- Хладагент
- Отличие пропана от метана
- Хранение и перевозка пропана
- Требования безопасности
Пропан, формула, газ, характеристики:
Пропан (лат. propanum) – органическое вещество класса алканов, состоящий из трех атомов углерода и восьми атомов водорода.
propanum) – органическое вещество класса алканов, состоящий из трех атомов углерода и восьми атомов водорода.
Химическая формула пропана C3H8, рациональная формула Ch4Ch3Ch4. Изомеров не имеет.
Пропан – бесцветный газ, без вкуса и запаха. Однако в пропан, используемый в качестве технического газа, могут добавляться одоранты – вещества, имеющие резкий неприятный запах для предупреждения его утечки.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов., в т.ч. сланцевой нефти.
Также содержится в сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Не растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Пропан по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Строение
Пропан — это предельный углеводород, состоящий из трех атомов углерода. По этой причине он имеет изогнутую форму, но из-за постоянного вращения вокруг осей связей существует несколько молекулярных конформаций. Связи в молекуле ковалентные: С-С неполярные, C-H слабополярные. Из-за этого их сложно разорвать, а вещество довольно трудно вступает в химические реакции. Это и задает все химические свойства пропана. Изомеров у него нет. Молярная масса пропана — 44,1 г/моль.
Физические свойства
Бесцветный газ без запаха[4]. Очень мало растворим в воде. Точка кипения −42,1 °C. Точка замерзания −188 °C. Образует с воздухом взрывоопасные смеси при концентрации паров от 1,7 до 10,9 %. Критическая температура пропана Tкр = 370 К, критическое давление Pкр = 4,27 МПа, критический удельный объём Vкр = 0,00444 м3/кг[5] Плотность сжиженного пропана при 298 K — 0,493 т/м3.
- Плотность газовой фазы при нормальных условиях = 2,019 кг/м3.
- Плотность газовой фазы при температуре 15°С = 1,900 кг/м3.
- Удельная теплота сгорания = 48 МДж/кг.
Плотность пропана C3H8 при различной температуре
- Представлены таблицы значений плотности пропана C3H8 при различных температурах и давлении.
- В первой таблице рассмотрена плотность пропана в газообразном состоянии при положительной и отрицательной температуре (от -33 до 407°С) и нормальном атмосферном давлении.
- Во второй таблице приведена плотность сжиженного пропана, находящегося в сжатом состоянии, при давлении от 20 до 200 бар и температуре 20…100°С.
Плотность газообразного пропана
Плотность газа пропана при нормальных условиях имеет значение 1,985 кг/м3. Пропан, как и другие газы с молярной массой более 29-ти, тяжелее воздуха. Он занимает третье место после метана и этана по молярной массе среди углеводородов с брутто-формулой Cnh3n+2.
Плотность пропана в газообразном состоянии при увеличении его температуры снижается. При нагревании этот газ увеличивается в объеме, что при постоянной массе приводит к снижению его плотности. Например, при росте температуры с 7 до 407°С плотность газа пропана снижается в почти в 2,5 раза — с 1,958 до 0,791 кг/м3.
Плотность пропана газообразного
t, °С
ρ, кг/м3
t, °С
ρ, кг/м3
t, °С
ρ, кг/м3
| -33 | 2,317 | 87 | 1,506 | 207 | 1,124 |
| -23 | 2,214 | 97 | 1,464 | 217 | 1,1 |
| -13 | 2,121 | 107 | 1,425 | 227 | 1,078 |
| -3 | 2,036 | 117 | 1,387 | 247 | 1,036 |
| 7 | 1,958 | 127 | 1,352 | 267 | 0,998 |
| 17 | 1,886 | 137 | 1,318 | 287 | 0,962 |
| 27 | 1,82 | 147 | 1,287 | 307 | 0,928 |
| 37 | 1,758 | 157 | 1,256 | 327 | 0,897 |
| 47 | 1,701 | 167 | 1,227 | 347 | 0,868 |
| 57 | 1,647 | 177 | 1,2 | 367 | 0,841 |
| 67 | 1,597 | 187 | 1,173 | 387 | 0,815 |
| 77 | 1,55 | 197 | 1,148 | 407 | 0,791 |
Плотность сжиженного пропана
Плотность сжиженного пропана значительно больше, чем газообразного. При комнатной температуре она лишь немногим меньше плотности некоторых жидких углеводородных топлив и почти в два раза меньше плотности воды. Например, при температуре 20°С и давлении 20 бар (19,74 атм.) плотность пропана сжиженного составляет величину 510,7 кг/м3.
При комнатной температуре она лишь немногим меньше плотности некоторых жидких углеводородных топлив и почти в два раза меньше плотности воды. Например, при температуре 20°С и давлении 20 бар (19,74 атм.) плотность пропана сжиженного составляет величину 510,7 кг/м3.
При увеличении давления при постоянной температуре плотность пропана в жидком состоянии увеличивается. При нагревании сжиженного пропана при постоянном давлении его плотность снижается — пропан становиться менее плотным.
Зависимость изменения плотности жидкого пропана от давления менее существенна, чем от температуры. При росте давления в 10 раз (с 20 до 200 бар) его плотность увеличивается всего на 6…10%. Причем, это увеличение тем больше, чем выше температура жидкого пропана.
Плотность пропана сжиженного в кг/м3 ↓ P, бар / t, °С →
20
40
60
80
100
| 20 | 510,7 | 476,9 | — | — | — |
| 40 | 515,2 | 483,3 | 445,8 | 393,5 | — |
| 60 | 518,9 | 489,7 | 456 | 412,7 | 347,6 |
| 80 | 523 | 495,3 | 464,7 | 427,7 | 381,2 |
| 100 | 526,9 | 500,5 | 472,4 | 439,8 | 401,1 |
| 120 | 530,2 | 505,1 | 479,2 | 449,6 | 416 |
| 140 | 533,6 | 509,4 | 485 | 458,1 | 427,5 |
| 160 | 536,8 | 513,3 | 490,2 | 464,9 | 436,7 |
| 180 | 539,7 | 517,1 | 495 | 471 | 444,4 |
| 200 | 542,6 | 520,6 | 499,2 | 476,2 | 450,9 |
Химические свойства
Аналогичны свойствам других представителей ряда алканов (горение, дегидрирование, галогенирование, нитрирование, крегинг).
Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Пропан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании пропана образуется смесь хлорпроизводных.
| Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
| Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом. С третичный–Н > С вторичный–Н > С первичный–Н |
| Например, при бромировании пропана преимущественно образуется 2-бромпропан: |
Хлорпропан может взаимодействовать с хлором и дальше с образованием дихлорпропана, трихлорпропана, тетрахлорпропана и т. д.
д.
1.2. Нитрование пропана
Пропан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в пропане замещается на нитрогруппу NO2.
| Например. При нитровании пропана образуется преимущественно 2-нитропропан: |
Окисление пропана
Пропан
– слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Пропан горит с образованием углекислого газа и воды. Реакция горения пропана сопровождается выделением большого количества теплоты.
2C3H6 + 9O2 → 6CO2 + 6h3O + Q
Уравнение сгорания алканов в общем виде:
Cnh3n+2 + (3n+1)/2O2 → nCO2 + (n+1)h3O + Q
При горении пропана в недостатке кислорода может образоваться угарный газ СО или сажа С.
Дегидрирование пропана – способ получения пропилена
Дегидрирование пропана как промышленный способ получения пропилена используется с 1990 года. В процессе дегидрирования практически отсутствуют побочные продукты.
В процессе дегидрирования практически отсутствуют побочные продукты.
В соответствии с данной технологией пропан (и небольшое количество водорода для снижения коксообразования) подают в реактор с неподвижным либо движущимся слоем катализатора при температуре 510-700 ºС при атмосферном давлении. Катализатором служит платина, нанесенная на активированный оксид алюминия, содержащий 20% хрома. При любой конструкции реактора необходима постоянная регенерация катализатора для сохранения его активности. Выходящий из реактора поток поступает в стандартные колонны для разделения. Непрореагировавший пропан и некоторое количество водорода возвращаются в процесс, смешиваясь со свежей порцией сырья. Оставшийся продукт содержит примерно 85% пропилена, 4% водорода, а также легкие и тяжелые отходящие газы.
Применение данной технологии оправдано при высоком спросе на пропилен, превышающем спрос на этилен. Отсутствие побочных продуктов избавляет от дополнительных усилий по их реализации. Одним из ключевых моментов для производства пропилена дегидрированием пропана является разница цен пропилена и пропана. Если разница будет недостаточной, то может оказаться, что производимый пропилен будет стоить дороже, чем по рыночным расценкам. Однако нельзя сказать, что процесс дегидрирования используется лишь при наличии источника достаточно дешевого пропана. Фактически, большинство заводов по дегидрированию пропана расположено в местах, где существует особая потребность в пропилене, а не там, где есть дешевый пропан. В то время как большая часть пропилена производится при переработке нефти и ее продуктов, получение пропилена дегидрированием пропана позволяет получать сырье, которое не связано напрямую с ценами на нефть.
Если разница будет недостаточной, то может оказаться, что производимый пропилен будет стоить дороже, чем по рыночным расценкам. Однако нельзя сказать, что процесс дегидрирования используется лишь при наличии источника достаточно дешевого пропана. Фактически, большинство заводов по дегидрированию пропана расположено в местах, где существует особая потребность в пропилене, а не там, где есть дешевый пропан. В то время как большая часть пропилена производится при переработке нефти и ее продуктов, получение пропилена дегидрированием пропана позволяет получать сырье, которое не связано напрямую с ценами на нефть.
Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH→R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии бутаноата натрия с гидроксидом натрия при сплавлении образуются пропан и карбонат натрия:
Ch4–Ch3–Ch3–COONa + NaOH→Ch4–Ch3–Ch4 + Na2CO3
Пропан-бутановая смесь
Она имеет много преимуществ перед другими видами топлива, в том числе природным газом:
- высокий КПД;
- легкий возврат к газообразному состоянию;
- хорошие испарение и сжигание при окружающей температуре.
Пропан в полной мере отвечает этим качествам, а вот бутаны несколько хуже испаряются при понижении температуры до -40°С. Исправить этот недостаток помогают добавки, лучшая из которых — это пропан.
Пропан-бутановую смесь применяют для отопления и приготовления пищи, при газовой сварке металлов и их резке, как топливо для транспортных средств и для химического синтеза.
Характеристика и свойства газовой смеси пропан-бутан
Монтаж системы СНГ на автомобиль требует опыта и ответственности.
Выполнение операций без надлежащей осторожности из-за некомпетентности, небрежности или несоблюдения действующих нормативов, может привести к чрезвычайно ОПАСНЫМ ситуациям.
Следовательно важно, чтобы монтажник был знаком со свойствами СНГ, хорошо знал все комплектующие системы и следовательно мог правильно выполнить их монтаж и техническое обслужиавние.
Сжиженный нефтяной газ (СНГ)
Так называют коммерческую смесь пропан-бутана, получаемую после переработки сырой нефти, из побочных нефтепродуктов или из природного газа. Характеристики, приведенные в таблице 1.1, показывают физико-химические свойства пропана и бутана.
| Газ | Пропан | Бутан |
| Химическая формула | C3 H8 | C4 h20 |
| Молекулярный вес | 44 | 58 |
| Удельный вес | 0,510 кг/л | 0,580 кг/л |
| Точка кипения | -43 °C | -0,5 °C |
| Миним. теплотворная спосбность | 11070 Ккал/кг | 10920 Ккал/кг |
| Температура зажигания °C | 510 °C на воздухе | 490 °C на воздухе |
| Пределы зажигания в % от объема | 2,1 – 9,5 | 1,5 – 8,5 |
| Скорость зажигания в см/сек | 32 на воздухе | 32 на воздухе |
таб 1. 1– Физико-химические свойства 1– Физико-химические свойства |
Основные характеристики
Одной из основных характеристик, отличающих СНГ, и следовательно определяющих его применение, является насыщение пара, соответствующее давлению газообразной фазы, находящейся в равновесии с жидкой фазой в закрытом баллоне. то есть как насыщение испарений бутана при 0 градусах будет равно 0.
005 бар, а при 15 градусах – 0.8 бар, в то время как насыщение испарений пропана будет соответственно 4 бара и примерно 6,5 бар. Это определяет значительные перепады давления смеси при изменении процентного соотношения бутана и пропана.
Давление повышается также при повышении температуры и следовательно приводит к сильным изменениям объема СНГ в жидком состоянии.
Следовательно если баллон полностью заправлен СНГ в сжиженном состоянии, и температура продолжает подниматься, происходит резкое повышение давления, которое может привести к аварийному сбросу давления через мультиклапан .
Категорически запрещается полностью заправлять баллон сжиженным СНГ. Еще одной важной характеристикой, отличающей эти два газа (бутан и пропан), является точка их кипения, то есть температура, при которой газ переходит из жидкого состояния в газообразное.
В то время как пропан при температуре –43°C больше не переходит в газообразное состояние и остается в жидком, для бутана это происходит при температуре 0°C .
По этой причине в условиях особо холодного климата необходимо использовать смеси, содержащие повышенный процент пропана, который способствует переходу СНГ в газообразное состояние.
Использование СНГ в качестве топлива для автомобилей
СНГ дает высококачественную энергию и используется в жилищной сфере, в промышленности, в ремесленной и сельскохозяйственной отраслях, а также в автомобильной промышленности. Так как СНГ является эффективной заменой бензина и дизельного топлива, любопытно провести сравнение этих продуктов и проанализировать их характеристики (табл.
1.2).
| ХАРАКТЕРИСТИКА | ПРОПАН | БУТАН | БЕНЗИН | ДИЗЕЛЬ |
| Плотность 15°C (кг/л) | 0,508 | 0,584 | 0,73 – 0,78 | 0,81-0,85 |
| Напряжение пара при 37,8°C (бар) | 12,1 | 2,6 | 0,5 – 0,9 | 0,003 |
| Точка кипения (°C) | – 43 | – 0,5 | 30 – 225 | 150-560 |
| Октановое число по исследовательскому методу R.O.N. | 111 | 103 | 96 – 98 | – |
| Октановое число по моторному методу M.O.N. | 97 | 89 | 85 – 87 | – |
| Миним. теплотворная способность (МДж/кг) | 46,1 | 45,46 | 44,03 | 42,4 |
| Миним. теплотворная способность (МДж/л) | 23,4 | 26,5 | 32,3 | 35,6 |
| Стехиометрическая смесь (кг/кг) | 15,8 | 15,6 | 14,7 | – |
Теплотворная способность стехиом. смеси (КДж/м3) смеси (КДж/м3) | 3414 | 3446 | 3482 | – |
| Табл. 1.2 – Характеристики основных типов топлива. |
Из анализа данных, приведенных в таблице, видно, что диапазон кипения бензина и дизеля выше температуры окружающей среды, в то время как СНГ кипит при более низкой температуре. Это значит, что бензин и дизель остаются в жидком состоянии в бензобаке при атмосферном давлении, в то время как СНГ должен подвергнуться воздействию определенного давления.
Это давление, как следует из таблицы 1.2, является довольно низким (несколько бар). Даже если теоретически для бензина точка кипения выше температуры окружающей среды, он также подвержен испарению, поэтому в современных автомобилях он содержится в герметичных бензобаках. Из анализа значений октанового числа по исследовательскому методу (R.O.N.) и значений октанового числа по моторному методу (M.O.N.) видно, что антидетонационная способность СНГ значительно выше по сравнению с бензином Супер-98. Теплотворная способность СНГ по сравнению с дизелем и бензином является более высокой.
Теплотворная способность СНГ по сравнению с дизелем и бензином является более высокой.
В случае дизеля и бензина, их расход автомобилем, по отношению к кг/массы, более низкий по сравнению с СНГ; если сравнить расход по отношению к объему, результат получается противоположным по причине иного удельного веса.
Нахождение в природе и методы получения
Основные природные источники пропана — это нефтяные и газовые месторождения. Он содержится в природном газе (от 0,1 до 11,0%) и в попутных нефтяных газах. Довольно много бутана получают в процессе ректификации нефти — разделении ее на фракции, основываясь на температурах кипения ее компонентов. Из химических способов переработки нефти наибольшее значение имеет каталитический крекинг, в процессе которого происходит разрыв цепи высокомолекулярных алканов. При этом пропана образуется порядка 16-20% от всех газообразных продуктов этого процесса:
СΗ3-СΗ2-СΗ2-СΗ2-СΗ2-СΗ2-СΗ2-СΗ3 ―> СΗ3-СΗ2-СΗ3 + СΗ2=СΗ-СΗ2-СΗ2-СΗ3
Большие количества пропана образуются при гидрогенизации разных видов угля и каменноугольной смолы, они достигают 80% от объема всех образующихся газов.
Также широко распространено получение пропана по методу Фишера-Тропша, который основан на взаимодействии СО и Н2 в присутствии различных катализаторов при повышенных температуре и давлении:
nCO + (2n + 1)Η2 ―> CnΗ2n+2 + nΗ2O
3CO + 7Η2 ―> C3Η8 + 3Η2O
Промышленные объемы бутана также выделяют при нефтегазовой переработке физическими и химическими методами.
Применение
Топливо
- При выполнении газопламенных работ на заводах и предприятиях:
- в заготовительном производстве;
- для резки металлолома;
- для сварки неответственных металлоконструкций.
- При кровельных работах.
- Для обогрева производственных помещений в строительстве.
- Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах).
- Для газовых плит, водогрейных колонок в пищевой промышленности.
- В быту
- при приготовлении пищи в домашних и походных условиях;
- для подогрева воды;
- для сезонного обогрева отдалённых помещений — частных домов, отелей, ферм;
- для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.

- В последнее время широко используется в качестве автомобильного топлива, так как дешевле и экологически безопаснее бензина.
Хранится и перевозится в металлических баллонах ярко-красного цвета (не путать с коричневыми баллонами для гелия)
Химия и пищевая промышленность
В химической промышленности используется при получении мономеров для производства полипропилена.
Является исходным сырьём для производства растворителей.
Используется как пропеллент.
В пищевой промышленности пропан зарегистрирован в качестве пищевой добавки E944.
Хладагент
Смесь из осушенного чистого пропана (R-290a) (коммерческое обозначение для описания изобутаново-пропановых смесей) с изобутаном (R-600a) не разрушает озонового слоя и обладает низким коэффициентом парникового потенциала (GWP). Смесь подходит для функционального замещения устаревших хладагентов (R-12, R-22, R-134a) в традиционных стационарных холодильных установках и систем кондиционирования воздуха (с обязательной сменой типа компрессорного масла).
Отличие пропана от метана
Среди отличительных особенностей пропана стоит отметить:
- более высокая эффективность при сгорании, благодаря чему он намного эффективнее метана во время проведения сварочных работ;
- высокая инертность газа, что позволяет ему более активно вступать в разнообразные химические реакции;
- пропан безопаснее метана и отличается наличием наркотического действия;
- при транспортировке пропана не нужно использовать какое-то специальное оборудование, достаточно обычных стальных баллонов.
Кроме этого, пропан является более дешевым и легче заправляется.
Хранение и перевозка пропана
Пропан транспортируется и хранится в баллонах красного цвета с надписью «Пропан» ГОСТ 15860-84 , либо в специальных цистернах.
Требования безопасности
Пропан — взрывоопасный газ. С воздухом образует взрывоопасную смесь. Однако, при правильной эксплуатации практически безвреден.
Источники
- https://master-pmg.
 ru/oborudovanie/molekula-propana.html
ru/oborudovanie/molekula-propana.html - https://FB.ru/article/406909/propan-himicheskie-svoystva-stroenie-poluchenie-primenenie
- https://student-madi.ru/fizika/formula-propana-v-himii.html
- https://pressadv.ru/metally-svarka/formula-propana.html
- https://td-np.ru/himiya_propana-html/
- https://progipertoniju.ru/temperatura-kipeniya-propana-v-zavisimosti-ot-davleniya.html
- https://technogaz21.ru/gazy/propan/
- https://oilyug.ru/benzin/plamya.html
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
Химическая формула пропана — Наука и Техника
Строение молекулы
Каждая молекула пропана состоит из трех атомов углерода, связанных друг с другом простыми одинарными связями, и восьми атомов водорода. Он имеет молекулярную формулу С3Н8. Связи С-С в пропане являются ковалентными неполярными, а вот в паре С-Н углерод немного более электроотрицателен и слегка оттягивает на себя общую электронную пару, а значит, связь ковалентная полярная. Молекула имеет зигзагообразное строение из-за того, что атомы углерода находятся в состоянии sp3-гибридизации. Но, как правило, говорят, что молекула линейная.
Молекула имеет зигзагообразное строение из-за того, что атомы углерода находятся в состоянии sp3-гибридизации. Но, как правило, говорят, что молекула линейная.
В составе молекулы бутана четыре атома углерода С4Н10, и он имеет два изомера: н-бутан (имеет линейное строение) и изобутан (имеет разветвленное строение). Зачастую, они не разделяются после получения, а существуют в виде смеси.
Физические свойства
Пропан — это газ без цвета и какого-либо запаха. В воде растворяется очень плохо, зато хорошо в хлороформе и простом диэтиловом эфире. Плавится при температуре tпл = -188 °С, а закипает при tкип = -42 °С. Взрывоопасным становится при достижении его концентрации в воздухе выше 2%.
Физические свойства пропана и бутана очень близки. Оба бутана также имеют газообразное состояние при нормальных условиях и не имеют запаха. Практически не растворяются в воде, но хорошо взаимодействуют с органическими растворителями.
В промышленности также имеют важное значение следующие характеристики этих углеводородов:
- Плотность (отношение массы к объему тела).
 Плотность жидких пропан-бутановых смесей во многом определяется составом углеводородов и температурой. С ростом температуры происходит объемное расширение, и плотность жидкости уменьшается. С ростом давления объем жидкости пропана и бутана сжимается.
Плотность жидких пропан-бутановых смесей во многом определяется составом углеводородов и температурой. С ростом температуры происходит объемное расширение, и плотность жидкости уменьшается. С ростом давления объем жидкости пропана и бутана сжимается. - Вязкость (способность веществ в газообразном или жидком состоянии сопротивляться сдвигающим усилиям). Определяется силами сцепления молекул в веществах. Вязкость жидкой смеси пропана с бутаном зависит от температуры (с ее ростом вязкость уменьшается), а вот изменение давления на эту характеристику влияет незначительно. Газы же с ростом температуры увеличивают свою вязкость.
Пропан представляет собой трехуглеродный алкан с молекулярной формулой C3H8. Это газ при стандартной температуре и давлении, но сжимаемый к переносимой жидкости. Побочный продукт переработки природного газа и нефтепереработки, он обычно используется в качестве топлива. Пропан является одной из групп сжиженных нефтяных газов (LP газов). Другие включают бутан, пропилен, бутадиен, бутилен, изобутилен и их смеси.
| свойства | |
| Химическая формула | C 3 H 8 |
| Молярная масса | 44,10 г · моль -1 |
| Внешность | Бесцветный газ |
| запах | непахнущий |
| плотность | 2,0098 кг / м 3 (при 0 ° С, 101,3 кПа) |
| Температура плавления | -187,7oC; -305,8oC; 85,5 К |
| Точка кипения | -42,25 до -42,04oC; -44,05 до -43,67 ° F; 230,90 до 231,11 K |
| Растворимость в воде | 47 мг / л (при 0 ° С) |
| log P | 2,236 |
| Давление газа | 853,16 кПа (при 21,1 ° C (70,0 ° F)) |
| Закон Генри константа ( k H ) | 15 нмоль Па -1 кг -1 |
| Конъюгатная кислота | Propanium |
| Магнитная восприимчивость (χ) | -40,5 · 10 -6 см 3 / моль |
| термохимия | |
| Теплоемкость ( C ) | 73,60 JK -1 моль -1 |
| Энтальпия Std образование (Δ f H o 298 ) | -105,2- 10,4,2 кДж. Моль -1 Моль -1 |
| Энтальпия Std сжигание (Δ c H o 298 ) | -2,2197-2,2187 МДж моль -1 |
| опасности | |
| Паспорт безопасности | |
| Пиктограммы GHS | |
| Сигнальное слово GHS | ОПАСНОСТЬ |
| Отчеты о рисках СГС | h320 |
| Меры предосторожности СГС | P210 |
| точка возгорания | -104 ° C (-155 ° F; 169 K) |
| самовоспламенения температура | 470oC (878oF, 743 K) |
| Пределы взрывоопасности | 2.37-9.5% |
| Пределы воздействия на здоровье человека (NIOSH): | |
| PEL (допустимый) | TWA 1000 ч / млн (1800 мг / м 3 ) |
| REL (рекомендуется) | TWA 1000 ч / млн (1800 мг / м 3 ) |
| IDLH (непосредственная опасность) | 2100 м.д. |
история Пропан был обнаружен французским химиком Марцелином Бертело в 1857 году. Сначала он был идентифицирован как летучий компонент в бензине Уолтером О. Снеллинг из Американского бюро шахт в 1910 году. Хотя это соединение было известно задолго до этого, работа Снеллинга была началом промышленности пропана в Соединенных Штатах.Волатильность этих более легких углеводородов заставляла их быть известными как «дикие» из-за высокого давления паров нерафинированного бензина. 31 марта 1912 года The New York Times сообщила о работе Снеллинга с сжиженным газом, заявив, что «стальная бутылка будет содержать достаточно газа, чтобы зажечь обычный дом в течение трех недель».
Снеллинг из Американского бюро шахт в 1910 году. Хотя это соединение было известно задолго до этого, работа Снеллинга была началом промышленности пропана в Соединенных Штатах.Волатильность этих более легких углеводородов заставляла их быть известными как «дикие» из-за высокого давления паров нерафинированного бензина. 31 марта 1912 года The New York Times сообщила о работе Снеллинга с сжиженным газом, заявив, что «стальная бутылка будет содержать достаточно газа, чтобы зажечь обычный дом в течение трех недель».
Именно в это время Снеллинг в сотрудничестве с Фрэнком П. Петерсоном, Честер Керром и Артуром Керром создал способы сжижения газообразных газов при очистке природного бензина. Вместе они создали American Gasol Co., первого коммерческого маркетолога пропана. Снеллинг произвел относительно чистый пропан к 1911 году, а 25 марта 1913 года его метод обработки и получения газообразных газов был опубликован патент № 1 056 845.Отдельный способ получения LP-газа через сжатие был создан Фрэнком Петерсоном и его патент, предоставленный 2 июля 1912 года.
В 1920-е годы наблюдалось увеличение производства сжиженного газа, с первым годом зарегистрированной добычи на 223 000 галлонов США (840 м3) в 1922 году. В 1927 году ежегодное производство LP-газа достигло 1 млн. Галлонов США (3800 м3), а к 1935 году годовой объем продаж LP-газа достиг 56 миллионов галлонов США (210 000 м3). Основные события в промышленности в 1930-х годах включали введение автомобильного транспорта железнодорожных цистерн, газификацию газа и строительство местных заправочных заводов.1945 год ознаменовал собой первый год, когда годовые объемы продаж LP газа достигли миллиарда галлонов. К 1947 году 62% всех домов в США были оснащены либо природным газом, либо пропаном для приготовления пищи.
В 1950 году Чикагским управлением по транзиту было заказано 1000 автобусов с пропанами, а к 1958 году продажи в США достигли 7 миллиардов галлонов США (26 000 000 м3) в год. В 2004 году, как сообщалось, она увеличилась на 8 млрд. Долл. США до 10 млрд. Долл. США, причем в США ежегодно используется более 15 млрд. Галлонов (57 млн. М3) пропана
Галлонов (57 млн. М3) пропана
«Проп-» корень, найденный в «пропане» и названия других соединений с трехуглеродными цепями, был получен из «пропионовой кислоты», которая, в свою очередь, была названа в честь греческих слов protos (в первую очередь) и пиона (жир).
источники Пропан производится в качестве побочного продукта двух других процессов: переработки природного газа и переработки нефти. Переработка природного газа включает удаление бутана, пропана и больших количеств этана из сырого газа, чтобы предотвратить конденсацию этих летучих веществ в трубопроводах природного газа. Кроме того, нефтеперерабатывающие заводы производят некоторый пропан в качестве побочного продукта крекинга нефти в бензин или мазут.
Поставка пропана не может быть легко отрегулирована для удовлетворения повышенного спроса из-за побочного характера производства пропана. Около 90% пропан США производится внутри страны. Соединенные Штаты импортируют около 10% потребляемого пропана каждый год, причем около 70% из них поступает из Канады по трубопроводам и железным дорогам. Оставшиеся 30% импортируемого пропана поступают в Соединенные Штаты из других источников через океанский транспорт.
Оставшиеся 30% импортируемого пропана поступают в Соединенные Штаты из других источников через океанский транспорт.
После того, как он отделен от сырой нефти, североамериканский пропан хранится в огромных соляных пещерах. Примерами этого являются Форт Саскачеван, Альберта; Мон-Бельвье, штат Техас; и Конвей, штат Канзас. Эти соляные пещеры были выдолблены в 1940-х годах, и они могут хранить 80 000 000 баррелей (13 000 000 м3) или более пропана. Когда необходим пропан, большая часть его отгружается по трубопроводам в другие районы Соединенных Штатов. Североамериканский стандартный класс автомобильного использования пропана рассчитан на HD 5. Класс HD 5 имеет максимум 5 процентов бутана, но пропана, продаваемого в Европе, имеет максимально допустимое количество бутана 30 процентов, то есть это не то же топливо, что и HD 5. Сжиженный нефтяной газ, используемый в качестве автомобильного топлива и горючего газа в Азии и Австралии, также имеет очень высокое содержание бутана. Пропан также отправляется грузовиком, судном, баржей и железной дорогой во многие районы США.
Пропан также может быть получен как биотопливо.
Свойства и реакции Пропан подвергается реакциям горения аналогично другим алканам. В присутствии избыточного кислорода пропан горит, образуя воду и углекислый газ.
Если для полного сгорания недостаточно кислорода или слишком много кислорода, происходит неполное сгорание, позволяющее также образовывать монооксид углерода и / или сажу (углерод): Полное сгорание пропана дает около 50 МДж / кг тепла. Сжигание пропана намного чище, чем неэтилированное сжигание бензина, и более чистое, чем сжигание природного газа, из-за чрезвычайно высокого содержания водорода в пропане.Пропан горит горячее, чем домашнее отопление или дизельное топливо из-за очень высокого содержания водорода. Природный газ, известный как метан, отгруженный в ваш дом или офис, не имеет высокого содержания водорода в пропане, используемого в Северной Америке.Наличие связей С-С плюс множественные связи пропилена и бутилена создают органические выхлопы, помимо двуокиси углерода и водяного пара при типичном горении. Эти связи также вызывают пропан с видимым пламенем.
Эти связи также вызывают пропан с видимым пламенем.
Энергетическое содержание Энтальпия сжигания пропанового газа, когда все продукты возвращаются в стандартное состояние, например, когда вода возвращается в свое жидкое состояние при стандартной температуре (известная как более высокая теплотворная способность), составляет (2219,2 ± 0,5) кДж / моль или (50,33 ± 0,01) ) МДж / кг. Энтальпия сжигания пропанового газа, когда продукты не возвращаются в стандартное состояние, например, когда горячие газы, включая выход водяного пара из дымовой трубы (известный как более низкая теплотворная способность), составляют -2043,455 кДж / моль. Более низкое тепловое значение представляет собой количество тепла, доступного от сжигания вещества, в котором продукты сгорания выбрасываются в атмосферу. Например, тепло от камина, когда дымоход открыт.Пропан, используемый в Северной Америке для использования в качестве топлива для автомобилей и вилочных погрузчиков, оценивается как класс HD 5 и имеет октановый показатель 104,5 R + M. R означает исследовательский октан, а M означает моторный октан.Оба R + M должны быть добавлены вместе, чтобы получить среднее значение этих двух разных лабораторных тестов. ЭГ: метанол составляет 99 октанов, а этанол — 99,5 октана. Для сравнения, природный газ СПГ рассчитан на 120 октанов, поэтому используйте двигатели с коэффициентом сжатия от 15 до одного и получайте удовольствие.
R означает исследовательский октан, а M означает моторный октан.Оба R + M должны быть добавлены вместе, чтобы получить среднее значение этих двух разных лабораторных тестов. ЭГ: метанол составляет 99 октанов, а этанол — 99,5 октана. Для сравнения, природный газ СПГ рассчитан на 120 октанов, поэтому используйте двигатели с коэффициентом сжатия от 15 до одного и получайте удовольствие.
плотность Плотность жидкого пропана при 25 ° C (77 ° F) составляет 0,493 г / см3, что эквивалентно 4,11 фунта на американский жидкий галлон или 493 г / л. Пропан расширяется на 1,5% за 10 ° F.Таким образом, жидкий пропан имеет плотность приблизительно 4,2 фунта на галлон (504 г / л) при 60 ° F (15,6 ° C).
Пользы Пропан является популярным выбором для барбекю и переносных печей, потому что низкая температура кипения -42 ° C (-44 ° F) заставляет его испаряться, как только он освобождается из контейнера под давлением. Поэтому не требуется карбюратор или другое испаряющее устройство; достаточно простого дозатора. Пропан выделяет некоторые локомотивные дизельные двигатели в качестве топлива, добавляемого в турбонагнетатель, чтобы обеспечить гораздо лучшее сгорание, автобусы, вилочные погрузчики, такси, лодочные моторы и машины для шлифовки льда и используется для нагрева и приготовления пищи в транспортных средствах отдыха и кемпингах.
Пропан выделяет некоторые локомотивные дизельные двигатели в качестве топлива, добавляемого в турбонагнетатель, чтобы обеспечить гораздо лучшее сгорание, автобусы, вилочные погрузчики, такси, лодочные моторы и машины для шлифовки льда и используется для нагрева и приготовления пищи в транспортных средствах отдыха и кемпингах.
Так как он легко транспортируется, он является популярным топливом для домашнего отопления и резервного электрогенерации в малонаселенных районах, где нет газопроводов.Многие грузовики большой грузоподъемности используют пропан в качестве повышения, где его добавляют через турбокомпрессор, чтобы смешивать с капельками дизельного топлива.Очень высокое содержание водорода в пропановых капельках помогает дизельному топливу сгорать более горячим и, следовательно, более полным. Это означает больше крутящего момента, большей мощности и более чистого выхлопа. Для 7-литрового дизельного двигателя с дизельным двигателем средней грузоподъемности средний расход топлива увеличивается на 20-33% при использовании системы повышения пропан. Это дешевле, потому что пропан намного дешевле, чем дизельное топливо. Более длинное расстояние, которое может путешествовать по пересеченной местности, может переместиться на полную загрузку топлива, комбинированного дизельного топлива и пропана, означает, что он может соблюдать свои федеральные часы работы с двумя меньшими остановками топлива по всей стране.
Это дешевле, потому что пропан намного дешевле, чем дизельное топливо. Более длинное расстояние, которое может путешествовать по пересеченной местности, может переместиться на полную загрузку топлива, комбинированного дизельного топлива и пропана, означает, что он может соблюдать свои федеральные часы работы с двумя меньшими остановками топлива по всей стране.
Дальнобойщики, соревнования по вытягиванию тракторов и фермеры используют систему повышения пропан в течение более 40 лет в Северной Америке. Международные суда могут использовать пропановые пары, которые испаряются от океанских судов, которые транспортируют СНГ, потому что, когда солнце прогревает пропан во время рейса, они захватывают испаряющийся пропановый газ и подают его в систему впуска воздуха дизельных двигателей кораблей. Это уменьшает расход топлива бункера и помогает выхлопным газам уменьшать загрязнение. Это очень важно для 2021 года, поскольку существует международное соглашение о том, чтобы использовать либо пропан, либо природный газ СПГ в качестве обязательной добавки к бункерному топливу (очень тяжелая нефть) для всех судов, отправляющихся в океаны, начиная с 2020 года.
Стальной пропан-цилиндр 20 фунтов (9,1 кг). Этот цилиндр оснащен клапаном предотвращения переполнения (OPD), о чем свидетельствует трилобулярный маховичок. Пропан обычно хранится и транспортируется в стальных баллонах в виде жидкости с паровым пространством над жидкостью. Давление пара в цилиндре зависит от температуры. Когда газообразный пропан набирается с высокой скоростью, скрытая теплота испарения, необходимая для создания газа, заставит бутылку остыть. (Вот почему вода часто конденсируется по бокам бутылки, а затем замерзает). Кроме того, легкие высокооктановые соединения испаряются перед более тяжелыми низкооктановыми. Таким образом, свойства зажигания изменяются, когда цилиндр опустошается. По этим причинам жидкость часто выводится с помощью погружной трубки. Пропан используется в качестве топлива в печах для нагрева, в кулинарии, в качестве источника энергии для водонагревателей, сушилок для белья, барбекю, переносных печей и автомобилей.
Коммерчески доступное «пропановое» топливо или СНГ не является чистым. Как правило, в Соединенных Штатах и Канаде это прежде всего пропан (по меньшей мере 90%), а остальные, главным образом, этан, пропилен, бутан и одоранты, включая этилмеркаптан. Это стандарт HD-5, (Максимальное допустимое содержание пропилена в тяжелых условиях — 5% и не более 5% бутанов и этана), определяемое Американским обществом испытаний и материалов стандартом 1835 для двигателей внутреннего сгорания. Однако не все продукты с маркировкой «LPG» соответствуют этому стандарту. Например, в Мексике газ, обозначенный как «СНГ», может состоять из 60% пропана и 40% бутана. «Точная пропорция этой комбинации зависит от страны, в зависимости от международных цен, от наличия компонентов и, особенно, от климатических условий, которые благоприятствуют СНГ с более высоким содержанием бутана в более теплых регионах и пропаном в холодных зонах».
Как правило, в Соединенных Штатах и Канаде это прежде всего пропан (по меньшей мере 90%), а остальные, главным образом, этан, пропилен, бутан и одоранты, включая этилмеркаптан. Это стандарт HD-5, (Максимальное допустимое содержание пропилена в тяжелых условиях — 5% и не более 5% бутанов и этана), определяемое Американским обществом испытаний и материалов стандартом 1835 для двигателей внутреннего сгорания. Однако не все продукты с маркировкой «LPG» соответствуют этому стандарту. Например, в Мексике газ, обозначенный как «СНГ», может состоять из 60% пропана и 40% бутана. «Точная пропорция этой комбинации зависит от страны, в зависимости от международных цен, от наличия компонентов и, особенно, от климатических условий, которые благоприятствуют СНГ с более высоким содержанием бутана в более теплых регионах и пропаном в холодных зонах».
Внутреннее и промышленное топливо Использование пропана быстро растет в неиндустриализированных районах мира. Пропан заменил многие старые традиционные источники топлива.
В промышленности Северной Америки, использующих пропан, входят производители стекла, кирпичные печи, птицефабрики и другие отрасли промышленности, которым требуется переносная теплота.
В сельских районах Северной Америки, а также в северной Австралии пропан используется для обогрева животноводческих помещений, зерносушилок и других теплотехнических устройств. При использовании для обогрева или сушки зерна он обычно хранится в большом, постоянно установленном цилиндре, который подзаряжается пропан-доставкой. По состоянию на 2014 год 6,2 млн. Американских домашних хозяйств использовали пропан в качестве основного топлива для отопления.
В Северной Америке местные грузовые автомобили со средним размером цилиндра 3000 галлонов США (11 000 литров) заполняют большие цилиндры, которые постоянно установлены на объекте, или другие служебные грузовики обменивают пустые цилиндры пропана с заполненными цилиндрами. Большие тракторные прицепы со средним размером цилиндра 10 000 галлонов США (38 000 л) транспортируют пропан из трубопровода или нефтеперерабатывающего завода на местный объемный завод. Бобтейл и транспорт не уникальны для североамериканского рынка, хотя практика не так распространена в других местах, и транспортные средства обычно называются танкерами. Во многих странах пропан поставляется потребителям через небольшие или средние отдельные цилиндры, а пустые цилиндры удаляются для заправки в центральном месте.
Бобтейл и транспорт не уникальны для североамериканского рынка, хотя практика не так распространена в других местах, и транспортные средства обычно называются танкерами. Во многих странах пропан поставляется потребителям через небольшие или средние отдельные цилиндры, а пустые цилиндры удаляются для заправки в центральном месте.
Пропен (также называемый пропилен) может быть загрязнителем коммерческого пропана.Пропан, содержащий слишком много пропена, не подходит для большинства транспортных средств. HD-5 — это спецификация, которая устанавливает максимальную концентрацию 5% пропена в пропане. Спецификации пропана и других газообразных углеводородов установлены в ASTM D-1835. Все пропановые топлива включают одорант, почти всегда этантиол, так что люди могут легко запахнуть газом в случае утечки. Пропан как HD-5 изначально предназначался для использования в качестве топлива для транспортных средств.HD-5 в настоящее время используется во всех применениях пропана.
холодильный Пропан также играет важную роль в обеспечении охлаждения вне сети, как источника энергии для холодильника для абсорбции газа и обычно используется для кемпинга и прогулочных транспортных средств. Кроме того, в качестве циркулирующего хладагента в надлежащим образом сконструированном компрессорном холодильном оборудовании можно использовать смеси чистого, сухого «изопропана» (R-290a) (смеси изобутана и пропана) и изобутана (R-600a). По сравнению с фторуглеродами пропан имеет незначительный потенциал истощения озона и очень низкий потенциал глобального потепления (имеющий значение всего в 3,3 раза больше ГВП диоксида углерода) и может служить в качестве функциональной замены для R-12, R-22, R-134a , и другие хлорфторуглеродные или гидрофторуглеродные хладагенты в обычных стационарных системах охлаждения и кондиционирования воздуха. Поскольку его эффект глобального потепления намного меньше, чем текущие хладагенты, пропан был выбран в качестве одного из пяти заменяемых хладагентов, одобренных EPA в 2015 году, для использования в системах, специально предназначенных для его воспламеняемости.
Кроме того, в качестве циркулирующего хладагента в надлежащим образом сконструированном компрессорном холодильном оборудовании можно использовать смеси чистого, сухого «изопропана» (R-290a) (смеси изобутана и пропана) и изобутана (R-600a). По сравнению с фторуглеродами пропан имеет незначительный потенциал истощения озона и очень низкий потенциал глобального потепления (имеющий значение всего в 3,3 раза больше ГВП диоксида углерода) и может служить в качестве функциональной замены для R-12, R-22, R-134a , и другие хлорфторуглеродные или гидрофторуглеродные хладагенты в обычных стационарных системах охлаждения и кондиционирования воздуха. Поскольку его эффект глобального потепления намного меньше, чем текущие хладагенты, пропан был выбран в качестве одного из пяти заменяемых хладагентов, одобренных EPA в 2015 году, для использования в системах, специально предназначенных для его воспламеняемости.
В автомобилях Такая замена широко запрещена или обескуражена в системах кондиционирования автомобильных транспортных средств на том основании, что использование легковоспламеняющихся углеводородов в системах, изначально предназначенных для перевозки негорючего хладагента, представляет значительный риск возгорания или взрыва.
Поставщики и сторонники углеводородных хладагентов выступают против таких запретов на том основании, что таких инцидентов было очень мало по сравнению с количеством систем кондиционирования воздуха, заполненных углеводородами.
Моторное топливо Пропан также все чаще используется для автомобильных топлив. В США более 190 000 автомобилей на дороге используют пропан, а более 450 000 погрузчиков используют его для питания. Это третье по популярности автомобильное топливо в мире, за бензином и дизельным топливом. В других частях мира пропан, используемый в транспортных средствах, известен как автогаз. В 2007 году около 13 миллионов автомобилей во всем мире используют автогазы.
Преимуществом пропана в автомобилях является его жидкое состояние при умеренном давлении. Это позволяет быстро набирать время, экономичную конструкцию топливного цилиндра и диапазоны цен, как правило, чуть более половины объема бензина. Между тем, он заметно чище (как при обработке, так и при сжигании), приводит к меньшему износу двигателя (из-за углеродистых отложений) без разбавления моторного масла (часто расширяя интервалы замены масла), и до недавнего времени относительная сделка в Северной Америке , Уровень октана относительно пропана относительно высок на уровне 110. В Соединенных Штатах инфраструктура заправки пропана является наиболее развитым из всех альтернативных видов топлива. Многие переоборудованные транспортные средства имеют резервы для долива от «барбекю». Целевые автомобили часто используются в коммерческих автопарках и имеют частные заправочные станции. Дальнейшая экономия для операторов топливных автомобилей пропана, особенно на флотах, заключается в том, что хищение намного сложнее, чем с бензином или дизельным топливом.
В Соединенных Штатах инфраструктура заправки пропана является наиболее развитым из всех альтернативных видов топлива. Многие переоборудованные транспортные средства имеют резервы для долива от «барбекю». Целевые автомобили часто используются в коммерческих автопарках и имеют частные заправочные станции. Дальнейшая экономия для операторов топливных автомобилей пропана, особенно на флотах, заключается в том, что хищение намного сложнее, чем с бензином или дизельным топливом.
Пропан также используется в качестве топлива для небольших двигателей, особенно тех, которые используются в закрытых помещениях или в помещениях с недостаточным свежим воздухом и вентиляцией для увода более токсичных выхлопов двигателя, работающего на бензине или дизельном топливе. Совсем недавно появились продукты для ухода за газонами, такие как струнные триммеры, газонокосилки и листовые воздуходувки, предназначенные для использования на открытом воздухе, но подпитываемые пропаном, чтобы уменьшить загрязнение воздуха.
Самодельные взрывные устройства Пропан и пропан-цилиндры использовались в качестве самодельных взрывных устройств при нападениях и попытках нападений на школы и террористические цели, такие как резня средней школы Колумбины, бомбардировка школы в Бриндизи в 2012 году, кризис заложников штаб-квартиры Discovery Communications и бомбы в автомобильных бомбах.
Другие виды использования Пропан является основным воспламеняющимся газом в паяльниках для пайки. Пропан используется в качестве исходного сырья для производства базовых нефтехимических продуктов при паровом крекинге. Пропан является основным топливом для воздушных шаров. Он используется в полупроводниковом производстве для осаждения карбида кремния. Пропан обычно используется в тематических парках и в киноиндустрии как недорогое высокоэнергетическое топливо для взрывов и других специальных эффектов. Пропан используется в качестве пропеллента, опираясь на расширение газа для запуска снаряда. Он не зажигает газ. Использование сжиженного газа дает больше выстрелов на цилиндр по сравнению со сжатым газом. Пропан используется в качестве пропеллента для многих бытовых аэрозольных аэрозолей, включая кремы для бритья и освежители воздуха. Пропан является перспективным сырьем для производства пропилена и акриловой кислоты. опасности Пропан — простой асфикс. В отличие от природного газа пропан плотнее воздуха. Он может накапливаться в низких пространствах и вблизи пола. При злоупотреблении в качестве ингалятора он может вызывать гипоксию (недостаток кислорода), пневмонию, сердечную недостаточность или остановку сердца. Пропан обладает низкой токсичностью, поскольку он не усваивается и не является биологически активным. Обычно при хранении под давлением при комнатной температуре пропан и его смеси будут испаряться при атмосферном давлении и охлаждать значительно ниже точки замерзания воды. Холодный газ, который кажется белым из-за конденсации влаги из воздуха, может вызвать обморожение.
Пропан используется в качестве пропеллента для многих бытовых аэрозольных аэрозолей, включая кремы для бритья и освежители воздуха. Пропан является перспективным сырьем для производства пропилена и акриловой кислоты. опасности Пропан — простой асфикс. В отличие от природного газа пропан плотнее воздуха. Он может накапливаться в низких пространствах и вблизи пола. При злоупотреблении в качестве ингалятора он может вызывать гипоксию (недостаток кислорода), пневмонию, сердечную недостаточность или остановку сердца. Пропан обладает низкой токсичностью, поскольку он не усваивается и не является биологически активным. Обычно при хранении под давлением при комнатной температуре пропан и его смеси будут испаряться при атмосферном давлении и охлаждать значительно ниже точки замерзания воды. Холодный газ, который кажется белым из-за конденсации влаги из воздуха, может вызвать обморожение.
Пропан плотнее воздуха. Если происходит утечка в топливной системе пропана, газ будет иметь тенденцию к погружению в любую замкнутую зону и, таким образом, создает опасность взрыва и пожара. Типичным сценарием является протекающий цилиндр, хранящийся в подвале; пропан протекает через пол до контрольного света на печи или водонагревателя и приводит к взрыву или пожару. Это свойство делает пропан вообще непригодным в качестве топлива для лодок.
Типичным сценарием является протекающий цилиндр, хранящийся в подвале; пропан протекает через пол до контрольного света на печи или водонагревателя и приводит к взрыву или пожару. Это свойство делает пропан вообще непригодным в качестве топлива для лодок.
Одна опасность, связанная с хранением и транспортировкой пропана, известна как взрыв BLEVE или взрывчатая пара в кипящей жидкости. Взрыв «Кингман» включал железнодорожный автоцистерну в Кингмане, штат Аризона, в 1973 году во время передачи пропана. Пожар и последующие взрывы привели к 12 смертельным исходам и многочисленным травмам.
Сравнение с природным газом Пропан приобретается и хранится в жидкой форме (СНГ), и, следовательно, топливная энергия может храниться в относительно небольшом пространстве. Сжатый природный газ (CNG), в основном метан, является другим газом, используемым в качестве топлива, но он не может быть сжижен при сжатии при нормальных температурах, так как они значительно превышают его критическую температуру. В качестве газа требуется очень высокое давление для хранения полезных количеств. Это создает опасность того, что в случае аварии, как и в случае любого баллона с сжатым газом (например, баллон CO2, используемого для концессии соды), баллон с СПГ может взрываться с большой силой или течь достаточно быстро, чтобы стать самоходной ракетой. Поэтому СПГ намного менее эффективна для хранения из-за большого объема цилиндра. Альтернативным способом хранения природного газа является криогенная жидкость в изолированном контейнере в качестве сжиженного природного газа (СПГ). Эта форма хранения находится под низким давлением и примерно в 3,5 раза эффективнее, чем хранение в виде СПГ. В отличие от пропана, если произойдет разлив, СПГ испарится и рассеется безвредно, потому что он легче воздуха. Пропан гораздо чаще используется для топлива, чем природный газ, потому что требуемое оборудование стоит меньше. Пропан требует всего 1220 килопаскалей (177 фунтов на квадратный дюйм) давления, чтобы поддерживать его при 37,8 ° C (100 ° F).
В качестве газа требуется очень высокое давление для хранения полезных количеств. Это создает опасность того, что в случае аварии, как и в случае любого баллона с сжатым газом (например, баллон CO2, используемого для концессии соды), баллон с СПГ может взрываться с большой силой или течь достаточно быстро, чтобы стать самоходной ракетой. Поэтому СПГ намного менее эффективна для хранения из-за большого объема цилиндра. Альтернативным способом хранения природного газа является криогенная жидкость в изолированном контейнере в качестве сжиженного природного газа (СПГ). Эта форма хранения находится под низким давлением и примерно в 3,5 раза эффективнее, чем хранение в виде СПГ. В отличие от пропана, если произойдет разлив, СПГ испарится и рассеется безвредно, потому что он легче воздуха. Пропан гораздо чаще используется для топлива, чем природный газ, потому что требуемое оборудование стоит меньше. Пропан требует всего 1220 килопаскалей (177 фунтов на квадратный дюйм) давления, чтобы поддерживать его при 37,8 ° C (100 ° F).
Розничная стоимость
Соединенные Штаты По состоянию на октябрь 2013 года розничная стоимость пропана составляла приблизительно 2,37 долл. США за галлон, или примерно 25,95 долл. США за 1 млн БТЕ. Это означает, что заполнение 500-галлонного пропанового резервуара, в котором обычно потребляют пропан в качестве основного источника энергии, составляет 948 долл. США (80% от 500 галлонов или 400 галлонов), что на 7,5% больше, чем зима 2012-2013 гг. сезон средняя цена в США. Однако расходы на пропан на галлон значительно меняются от одного государства к другому: Управление энергетической информации (EIA) приводит к среднему значению 2,995 доллара США за галлон на восточном побережье в октябре 2013 года, тогда как показатель для Среднего Запада составлял 1,860 долларов за тот же период.
По состоянию на декабрь 2015 года расходы на пропан были примерно 1,97 долл. США за галлон. Это означает, что заполнение 500-галлонного пропанового резервуара до 80% -ной емкости стоит 788 долл. США, что на 16,9% меньше или на 160 долл. Меньше от котировки в ноябре 2013 года в этом разделе. Аналогичные региональные различия в ценах присутствуют с показателем EIA в декабре 2015 года для Восточного побережья в 2,67 доллара за галлон, а на Среднем Западе — 1,43 доллара за галлон.
США, что на 16,9% меньше или на 160 долл. Меньше от котировки в ноябре 2013 года в этом разделе. Аналогичные региональные различия в ценах присутствуют с показателем EIA в декабре 2015 года для Восточного побережья в 2,67 доллара за галлон, а на Среднем Западе — 1,43 доллара за галлон.
По состоянию на август 2021 года средняя цена на пропан в США составляла приблизительно 2,48 долл. США за галлон. Оптовые цены на пропан в США всегда падают летом, так как большинство домов не требуют для отопления дома. Оптовые цены на пропан летом 2021 года составляли от 86 центов до 96 центов за галлон США, в зависимости от нагрузки на грузовые или железнодорожные вагоны. Ежедневные цены на пропан размещаются на веб-сайте Barrons dot com по рыночным данным и по курсам наличных денег каждый день около 9 вечера для оптовой торговли пропаном в этот день. Цена на отопление дома в два раза выше этой цены, поэтому по цене 95 центов за галлон, это означает, что цена на дом будет стоить 1,90 доллара за галлон, если вы закажете 500 галлонов за раз. Цены на Среднем Западе всегда дешевле, чем в Калифорнии. Цены на доставку на дом всегда растут в конце августа или в первые дни сентября, когда люди начинают заказывать свои домашние танки для заполнения.
Цены на Среднем Западе всегда дешевле, чем в Калифорнии. Цены на доставку на дом всегда растут в конце августа или в первые дни сентября, когда люди начинают заказывать свои домашние танки для заполнения.
Поделиться ссылкой:
- Нажмите, чтобы поделиться на Twitter (Открывается в новом окне)
- Нажмите здесь, чтобы поделиться контентом на Facebook. (Открывается в новом окне)
- Нажмите, чтобы поделиться записями на Pinterest (Открывается в новом окне)
- Нажмите, чтобы поделиться записями на Tumblr (Открывается в новом окне)
- Нажмите, чтобы поделиться на LinkedIn (Открывается в новом окне)
- Нажмите, чтобы поделиться в WhatsApp (Открывается в новом окне)
- Нажмите, чтобы поделиться в Skype (Открывается в новом окне)
- Нажмите, чтобы поделиться в Telegram (Открывается в новом окне)
- Нажмите, чтобы поделиться на Reddit (Открывается в новом окне)
- Нажмите, чтобы поделиться записями на Pocket (Открывается в новом окне)
Tags: Aerosol propellants Alkanes Alternative fuel vehicles Binary compounds of hydrogen Fuel gas Industrial gases Natural gas Propane
Нахождение в природе и методы получения
Основные природные источники пропана — это нефтяные и газовые месторождения. Он содержится в природном газе (от 0,1 до 11,0%) и в попутных нефтяных газах. Довольно много бутана получают в процессе ректификации нефти — разделении ее на фракции, основываясь на температурах кипения ее компонентов. Из химических способов переработки нефти наибольшее значение имеет каталитический крекинг, в процессе которого происходит разрыв цепи высокомолекулярных алканов. При этом пропана образуется порядка 16-20% от всех газообразных продуктов этого процесса:
Он содержится в природном газе (от 0,1 до 11,0%) и в попутных нефтяных газах. Довольно много бутана получают в процессе ректификации нефти — разделении ее на фракции, основываясь на температурах кипения ее компонентов. Из химических способов переработки нефти наибольшее значение имеет каталитический крекинг, в процессе которого происходит разрыв цепи высокомолекулярных алканов. При этом пропана образуется порядка 16-20% от всех газообразных продуктов этого процесса:
СΗ3-СΗ2-СΗ2-СΗ2-СΗ2-СΗ2-СΗ2-СΗ3 ―> СΗ3-СΗ2-СΗ3 + СΗ2=СΗ-СΗ2-СΗ2-СΗ3
Большие количества пропана образуются при гидрогенизации разных видов угля и каменноугольной смолы, они достигают 80% от объема всех образующихся газов.
Также широко распространено получение пропана по методу Фишера-Тропша, который основан на взаимодействии СО и Н2 в присутствии различных катализаторов при повышенных температуре и давлении:
nCO + (2n + 1)Η2 ―> CnΗ2n+2 + nΗ2O
3CO + 7Η2 ―> C3Η8 + 3Η2O
Промышленные объемы бутана также выделяют при нефтегазовой переработке физическими и химическими методами.
Химические свойства
От особенностей строения молекул зависят физические и химические свойства пропана и бутана. Поскольку они являются насыщенными соединениями, для них не характерны реакции присоединения.
1. Реакции замещения. Под действием ультрафиолета легко происходит замещение водорода на атомы хлора:
СН3-СН2-СН3 + Cl2 ―> СН3-СН (Cl)-СН3 + HCl
При нагревании с раствором азотной кислоты, происходит замена атома Н на группу NO2:
СΗ3-СΗ2-СΗ3 + ΗNO3 ―> СΗ3-СΗ (NO2)-СΗ3 + h3О
2. Реакции отщепления. При нагревании в присутствии никеля или палладия происходит отщепление двух атомов водорода с образованием в молекуле кратной связи:
СΗ3-СΗ2-СΗ3 ―> СΗ3-СΗ=СΗ2 + Η2
3. Реакции разложения. При нагревании вещества до температуры порядка 1000 °С происходит процесс пиролиза, который сопровождается разрывом всех имеющихся в молекуле химических связей:
С3Н8 ―> 3С + 4h3
4. Реакции горения. Эти углеводороды горят не коптящим пламенем с выделением большого количества теплоты. Что такое пропан знают многие хозяйки, которые пользуются газовыми плитами. В ходе реакции образуются углекислый газ и парообразная вода:
Что такое пропан знают многие хозяйки, которые пользуются газовыми плитами. В ходе реакции образуются углекислый газ и парообразная вода:
С3Н8 + 5O2―> 3СО2 + 4h3О
Сгорание пропана в условиях недостатка кислорода приводит к появлению сажи и образованию молекул угарного газа:
2С3Н8 + 7O2―> 6СО + 8h3О
С3Н8 + 2O2―> 3С + 4h3О
Применение
Пропан активно применяется как топливо, поскольку при его горении выделяется 2202 кДж/моль теплоты, это очень высокий показатель. В процессе окисления из пропана получают многие вещества, необходимые для химического синтеза, например, спирты, ацетон, карбоновые кислоты. Он необходим для получения нитропропанов, используемых, как растворители.
В качестве пропеллента применяется в пищевой сфере, имеет код E944. В смеси с изобутаном используется в качестве современного хладагента, не наносящего вред окружающей среде.
Отличие пропана от метана
Среди отличительных особенностей пропана стоит отметить:
- более высокая эффективность при сгорании, благодаря чему он намного эффективнее метана во время проведения сварочных работ;
- высокая инертность газа, что позволяет ему более активно вступать в разнообразные химические реакции;
- пропан безопаснее метана и отличается наличием наркотического действия;
- при транспортировке пропана не нужно использовать какое-то специальное оборудование, достаточно обычных стальных баллонов.

Кроме этого, пропан является более дешевым и легче заправляется.
Пропан-бутановая смесь
Она имеет много преимуществ перед другими видами топлива, в том числе природным газом:
- высокий КПД;
- легкий возврат к газообразному состоянию;
- хорошие испарение и сжигание при окружающей температуре.
Пропан в полной мере отвечает этим качествам, а вот бутаны несколько хуже испаряются при понижении температуры до -40°С. Исправить этот недостаток помогают добавки, лучшая из которых — это пропан.
Пропан-бутановую смесь применяют для отопления и приготовления пищи, при газовой сварке металлов и их резке, как топливо для транспортных средств и для химического синтеза.
Правила безопасности
Сжиженный пропан с воздухом образует взрывоопасную смесь при содержании 2,3-9,5 %. Нельзя использовать источники открытого огня в помещении, в котором пахнет газом. Предельно допустимое содержание пропана в воздухе рабочей зоны – до 300 мг/м3. Газ тяжелее воздуха, поэтому может оседать и скапливаться в плохо проветриваемых местах. При попадании сжиженного углеводорода на кожу образуется обморожение, напоминающее ожог.
Газ тяжелее воздуха, поэтому может оседать и скапливаться в плохо проветриваемых местах. При попадании сжиженного углеводорода на кожу образуется обморожение, напоминающее ожог.
Пропан оказывает на организм человека наркотическое действие. При вдыхании паров сначала наблюдается головокружение, затем состояние опьянения, а при длительном нахождении в атмосфере – потеря сознания. Газ при вдыхании быстро накапливается в организме и быстро выводится через легкие, не аккумулируясь во внутренних органах.
Похожие статьи
- Плюсы использования газовых установок с пропаном
- Газовые баллоны для мобильных пунктов питания
- Какой газовый баллон выбрать?
Что такое газообразный пропан — применение, свойства и многое другое
- администратор
- Последнее обновление: 27 июля 2021 г.
Пропан используется в домах, на предприятиях, в промышленности и сельском хозяйстве, главным образом для отопления помещений, нагрева воды и приготовления пищи.
 Пропан обычно используется в сельской местности, где нет ретикулированного природного газа. К пропановым приборам относятся обогреватели, печи, водонагреватели, варочные панели, печи, сушилки для белья и нагреватели для бассейнов. Пропан также используется в качестве топлива для двигателей внутреннего сгорания.
Пропан обычно используется в сельской местности, где нет ретикулированного природного газа. К пропановым приборам относятся обогреватели, печи, водонагреватели, варочные панели, печи, сушилки для белья и нагреватели для бассейнов. Пропан также используется в качестве топлива для двигателей внутреннего сгорания.Пропан, используемый в качестве топлива для двигателей внутреннего сгорания, включает автомобили, вилочные погрузчики, автобусы, ирригационные насосы и транспортные средства. Пропан называется автогазом, когда используется в качестве автомобильного топлива. По мере развития технологий постоянно появляются новые области применения пропана.
Пропан, обычно используемый в качестве топлива, является побочным продуктом переработки сырой нефти и природного газа. Пропан относится к категории сжиженных нефтяных газов – LPG.
Газ пропан, также называемый сжиженным нефтяным газом, доступен практически везде. Что делает пропан, так это в первую очередь выступает в качестве источника топлива.
 Пропан обогревает наши дома и дает нам горячий душ, готовит еду, питает наши барбекю и заправляет наши автомобили.
Пропан обогревает наши дома и дает нам горячий душ, готовит еду, питает наши барбекю и заправляет наши автомобили.Пропан также используется в бизнесе и сельском хозяйстве для самых разных целей.
Газ пропан
Газ пропан является одним из газов, который соответствует определению СНГ – сжиженного нефтяного газа. Пропан — это легковоспламеняющийся углеводородный газ, который сжижается под давлением и обычно используется в качестве топлива для отопления, приготовления пищи, горячего водоснабжения и транспортных средств. Пропан также может использоваться в качестве хладагентов, аэрозольных пропеллентов и нефтехимического сырья.
Газообразный пропан можно сжимать в жидкость при относительно низком давлении. Пропан обычно хранится в виде жидкости в стальных емкостях, начиная от небольших газовых баллонов для барбекю и заканчивая большими газовыми баллонами и резервуарами для хранения сжиженного нефтяного газа.
Пропан получают в результате переработки природного газа и нефтепереработки.
Существует ряд других газов, подпадающих под маркировку «СНГ», включая бутан (н-бутан) и изобутан (изобутан), а также смеси этих газов и также называемые сжиженными природными газами – НГЛ.
Физические свойства пропана
Таблица свойств пропана
Свойства пропана | |
| Недвижимость | Пропан |
| Химическая формула | С 3 Н 8 |
| Энергосодержание: МДж/м 3 | 95,8 |
| Содержание энергии: МДж/кг | 49,58 |
| Содержание энергии: МДж/л | 25,3 |
| Температура кипения: Cº | -42 |
| Давление при 21ºC: кПа | 858,7 |
| Температура пламени: Cº | 1967 |
| Расширение: м 3 /л | 0,270 |
| Объем газа: м 3 /кг | 0,540 |
| Относительная плотность: H 2 O | 0,51 |
| Относительная плотность: воздух | 1,53 |
| кг на л | 0,51 |
| л на кг | 1,96 |
| Удельный вес при 25ºC | 1,55 |
| Плотность при 15ºC: кг/м 3 | 1,899 |
Примечание. Некоторые числа округлены.
Некоторые числа округлены.
Откуда берется пропан?
Пропан — это удивительный транспортабельный газ, который поставляется в баллоне, но что такое пропан, откуда он берется и как он работает? Пропан поступает из скважин природного газа и нефтяных скважин.
Пропан – это ископаемое топливо, которое не встречается отдельно. Пропан встречается в природе в сочетании с другими углеводородами.
Затем пропан получают в результате процессов переработки природного газа и переработки сырой нефти. Он изолируется, сжижается за счет повышения давления и хранится в сосудах под давлением для удобства хранения, транспортировки и распределения.
Как производится пропан?
Пропан производится при переработке природного газа и нефти. Его отделяют от необработанного природного газа с помощью охлаждения.
Пропан извлекается из нагретой сырой нефти с использованием дистилляционной колонны.
Затем он подвергается герметизации и хранится в виде жидкости в баллонах и резервуарах.
Как из природного газа получают пропан?
Пропан не столько производится из природного газа, сколько отделяется от природного газа.
Важно понимать, что «сырой природный газ», когда он выходит из газовой скважины, содержит другие газы (включая пропан) и примеси, которые необходимо перерабатывать для получения почти чистого газа метана, который мы называем «очищенным газом». природный газ» или просто «природный газ».
Пропан отделяется от потока сырого природного газа с помощью «отпарных установок», которые буквально выделяют пропан из потока сырого природного газа.
Кто и для каких целей использует пропан
Гостиницы, рестораны и т. д. используют пропан для отопления, приготовления пищи и горячего водоснабжения. Куриные фермы используют пропан, чтобы согреть цыплят. Фермеры используют пропан для прополки пламенем, сушки урожая и ирригационных насосов. Мастерские по ремонту кузовов автомобилей используют пропан для духовки, чтобы вылечить окрашенные автомобили. Производители холодильного оборудования используют пропан в качестве хладагента. Многие компании используют пропан в качестве топлива для котлов для множества целей. И список использования пропана можно продолжать и продолжать.
Производители холодильного оборудования используют пропан в качестве хладагента. Многие компании используют пропан в качестве топлива для котлов для множества целей. И список использования пропана можно продолжать и продолжать.
Для чего используется пропан – Обычное применение пропана
Пропан используется в повседневной жизни, включая отопление дома, приготовление пищи, водонагреватели, газовые камины и сушку одежды. Домашнее ежедневное использование на открытом воздухе включает обогреватели для патио, обогреватели для бассейнов, резервные генераторы и топливо для барбекю. Для некоторых людей это также включает автомобильное топливо для автомобилей и транспортных средств, работающих на сжиженном газе. Системы газового отопления на пропане обеспечивают мгновенное тепло и доступны в обогревателях дымовых газов и переносных газовых обогревателях.
Пропан также используется для сотен, если не тысяч применений. Кроме того, пропан используется в качестве пропеллента, хладагента, автомобильного топлива и нефтехимического сырья.
Пропан используется большинством людей в домашних условиях, в автомобилях или в бизнесе.
Пропан используется в свободное время, включая караваны, лодки, транспортные средства для отдыха, воздушные шары и кемпинги.
Пропан также используется в качестве топлива для многих коммерческих и сельскохозяйственных тепловых установок, включая коммерческие котлы.
Бизнес и промышленность используют пропан для множества процессов, включая паровые котлы, печи для обжига, печи и вилочные погрузчики.
Сушка урожая и продукции, отопление теплиц, горячая вода для молочных заводов, ирригационные насосы и обогрев вольеров для животных — это лишь некоторые из областей применения пропана в сельском хозяйстве.
Транспорт также широко использует пропан, отдельно или в смеси с бутаном, для питания различных типов транспортных средств.
Существует также множество других применений пропана, включая производство электроэнергии и индустрию гостеприимства.
Почему пропан используется в качестве топлива
Пропан используется в качестве топлива из-за его портативности и высокой плотности энергии. Кроме того, для сжижения требуется лишь умеренное давление, поддерживая практический вес сосуда. Так, пропан используется в качестве топлива на транспорте и в районах, где нет газораспределения.
Кроме того, для сжижения требуется лишь умеренное давление, поддерживая практический вес сосуда. Так, пропан используется в качестве топлива на транспорте и в районах, где нет газораспределения.
7 Важные факты о пропане
1. Пропан — это сжиженный нефтяной газ, но не весь сжиженный нефтяной газ — это пропан. LPG — это аббревиатура от сжиженного нефтяного газа.
2. Пропан – это легковоспламеняющийся углеводородный газ, который сжижается под давлением и обычно используется в качестве топлива.
3. Пропан получают в результате переработки природного газа и нефтепереработки.
4. Пропан — это сжиженный нефтяной газ, но не весь сжиженный нефтяной газ — это пропан. Пропан, наряду с рядом газов, подпадает под маркировку «СНГ». Другие газы включают бутан (н-бутан) и изобутан (изобутан), а также смеси трех газов СНГ.
5. Газообразный пропан можно сжимать в жидкость при относительно низком давлении.
6. Пропан часто используется в качестве топлива для отопления, приготовления пищи, горячего водоснабжения и транспортных средств.
7. Пропан обычно хранится в жидком виде в стальных емкостях, начиная от небольших газовых баллонов для барбекю и заканчивая большими газовыми баллонами и резервуарами для хранения. (показаны газовые баллоны по 45 кг)
Пропан имеет много названий
В Австралии у пропана много названий.
Его также называют сжиженным нефтяным газом, сжиженным нефтяным газом, сжиженным нефтяным газом, газом для барбекю или автогазом.
В США его называют просто Пропан.
В Великобритании его называют пропаном или сжиженным нефтяным газом.
Как работает пропан?
Пропан хранится под давлением в виде жидкости в газовом баллоне.
Он снова превращается в пар, когда вы сбрасываете давление в газовом баллоне, включая прибор.
Почти все виды использования пропана связаны с использованием паров газа, а не сжиженного газа.
Из чего сделан пропан? Состав пропана – Структура пропана
Пропан имеет структуру газообразного углеводорода с 3 атомами углерода и 8 атомами водорода в молекуле пропана. Химическая формула пропана C 3 H 8 . (Показана модель структуры молекулы пропана)
Химическая формула пропана C 3 H 8 . (Показана модель структуры молекулы пропана)
Пропан не производится и не производится, он встречается в природе в сочетании с другими углеводородами.
Пропан производится или «производится» в процессе переработки природного газа и нефтепереработки.
Оба процесса начинаются с бурения нефтяных скважин.
Пропан не встречается в природе отдельно.
Переработка пропана включает отделение и сбор газа от его нефтяной основы и других сжиженных природных газов (ШФЛУ).
После очистки сжиженный нефтяной газ хранится и распределяется в виде жидкости под давлением до момента использования, после чего он утилизируется либо в виде жидкости, либо в виде газа (пара).
Системы газового отопления на пропане для дома
Системы газового отопления на пропане для дома — это энергоэффективный способ сохранить тепло и уют. Системы газового отопления хорошо подходят для больших жилых помещений, поэтому нет лучшего способа обеспечить уютное тепло в каждом уголке вашего дома, чем газовое отопление. Системы отопления на пропане являются синонимом быстрого обогрева дома и настоящего тепла.
Системы отопления на пропане являются синонимом быстрого обогрева дома и настоящего тепла.
Подтипы систем газового отопления на пропане для продажи включают лучистые, конвекторы, лучистые-конвекторы, дымоходные лучистые, отдельно стоящие камины, каминные топки, встроенные каминные газовые обогреватели и электрические дымовые газовые обогреватели для дома.
Среди широкого ассортимента систем газового отопления на пропане вы найдете модель, которая идеально подойдет для вашего дома.
Что такое баллон с пропаном?
Резервуары для пропана обычно представляют собой стальные сосуды для хранения обычных сжиженных нефтяных газов, пропана или бутана. Дома и малые предприятия обычно используют либо 45-килограммовые газовые баллоны, либо 9-килограммовые.Размеры баллонов для сжиженного газа 0 кг или 210 кг. Пропановые баллоны для барбекю выпускаются в размерах газовых баллонов по 9 кг и 4 кг. Пользователи больших объемов имеют большие размеры баллона с пропаном.
Баллоны с пропаном также могут называться «Газовые баллоны с пропаном», «Газовые баллоны», «Газовые баллоны со сжиженным нефтяным газом» или просто «Газовые баллоны».
Газовые баллоны с пропаном содержат жидкость и газ, так как пропан сжижается при относительно низком давлении.
Баллон с пропаном считается баллоном низкого давления по сравнению с баллоном высокого давления при использовании КПГ.
Размеры и объем баллона с пропаном варьируются в зависимости от области применения и спроса. Небольшой газовый баллон с пропаном можно носить с собой, так как он используется в кемпинге.
Можно ли закопать баллон с пропаном?
Да, вы можете закопать баллон с пропаном, если он предназначен для захоронения. Заглубленный баллон с пропаном нуждается в антикоррозионном покрытии и катодной защите. Подземные баллоны с пропаном наполняются автоцистерной из шланга.
Закапыванием баллона с пропаном должна заниматься опытная профессиональная компания на минимальном и максимальном расстоянии от вашего дома или офиса. Заглубленный баллон с пропаном также должен находиться на безопасном расстоянии от любого источника воспламенения.
Заглубленный баллон с пропаном также должен находиться на безопасном расстоянии от любого источника воспламенения.
Требования к расстоянию для установки пропановых баллонов – Правила установки пропановых баллонов в жилых помещениях
Правила для жилых пропановых баллонов и требования к расстоянию от пропановых баллонов важны для безопасной установки. Требования к расстоянию установки могут варьироваться в зависимости от размера баллона с пропаном. Типичное минимальное расстояние составляет 10 футов или 3 метра, включая источники воспламенения и проемы зданий во всех направлениях.
Регуляторы давления газа пропана – Что такое регулятор давления пропана?
Регулятор пропана используется для контроля давления газа пропана, подаваемого в прибор из газовых баллонов с пропаном. Регуляторы давления газа пропана автоматически модулируют газ высокого давления до максимально заданного предела.
Давление внутри газового баллона может составлять 800-900 кПа, которое обычно регулируется до 2,75 кПа.
Регуляторы давления пропанового газа для баллонов со сжиженным нефтяным газом обычно предварительно настроены на заводе на стандартное рабочее давление 2,75 кПа для приборов.
Регулятор пропана также может называться регулятором газа для приготовления пищи при использовании с кухонными приборами.
Является ли пропан взрывоопасным веществом? Как и может ли взорваться баллон с пропаном? Взрыв баллона с пропаном
Взрыв баллона с пропаном или баллона с пропаном не происходит с какой-либо частотой. Взрыв или взрыв баллона с пропаном (газовым баллоном) на самом деле происходит довольно редко. Газовые баллоны могут быть взрывоопасными, но не легко и не часто. Даже попытка умышленно создать взрыв баллона с пропаном очень сложна.
Пропан взрывоопасен при определенных обстоятельствах. Пропан может быть взрывоопасен, если он находится в пределах воспламеняемости от 2,15% до 9,6% от общего количества смеси пропан/воздух. Чтобы пропан был взрывоопасным, он также должен собираться в замкнутом пространстве, чтобы произошел взрыв.
Температура кипения пропана
Вода закипает при 100°C, превращаясь в газ (пар).
Пропан, напротив, кипит при -42°C, превращаясь в пар.
Пропан остается жидким, потому что находится под давлением в газовом баллоне.
Жидкость очень похожа на воду.
В естественном состоянии бесцветен и не имеет запаха.
Отдушка добавлена для безопасности
В естественном состоянии пропан представляет собой газ без запаха.
Характерный запах, который у людей ассоциируется с пропаном, на самом деле добавлен к нему в качестве меры безопасности.
Без добавления отдушки вытекающий газ может собираться незаметно.
Избегайте прямого контакта – холодные ожоги
Всегда следует соблюдать осторожность, чтобы избежать прямого воздействия, так как жидкий пропан достаточно холодный, чтобы вызвать серьезные холодные ожоги на открытых участках кожи.
Удельный вес пропана – плотность
В отличие от воды, 1 килограмм пропана НЕ равен 1 литру пропана.
Плотность или удельный вес пропана примерно вдвое меньше, чем у воды, т.е. 0,51.
1 кг пропана имеет объем 1,96 л.
И наоборот, 1 л пропана весит 0,51 кг.
1 фунт пропана при 60ºF имеет объем 0,24 галлона США.
И наоборот, 1 галлон пропана США при температуре 60ºF весит всего 4,23 фунта вместо 8,34 фунта, если бы это была вода.
Газообразное расширение пропана
Пропан расширяется в 270 раз больше объема при переходе из жидкого состояния в газообразное.
Итак, 1 л жидкого сжиженного нефтяного газа равен 270 л газообразного пропана.
Поскольку в кубическом метре 1000 л (M 3 ), 1 л жидкого пропана расширяется до 0,27 м 3 .
1 галлон США жидкого пропана равен 36,38 футов 3 газообразного пропана
Энергетическая ценность пропана
Пропан содержит примерно 25 МДж на литр.
Также конвертируется в 6,9 кВтч.
Подробнее содержание энергии пропана Факты:
1 Галлон пропана США = 91 502 БТУ @ 60ºF
1FT 3 GAS PROPAN BTU
1 ватт = 3,41214 BTU/ч
Формула горения
В присутствии достаточного количества кислорода пропан сгорает с образованием водяного пара и углекислого газа, а также тепла.
Пропан + кислород → углекислый газ + вода + тепло
(C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O + тепло) 90 неполное 023
Если недостаточно кислорода, происходит сгорание при полном сгорании , моноксид углерода и углекислый газ.
Температура пламени пропана
Пламя пропана горит при температуре 1980ºC (3596ºF).
Когда он горит правильно, пламя синее.
Желтое или красное пламя обычно указывает на неполное сгорание.
Пределы воспламеняемости
Нижний и верхний пределы воспламеняемости представляют собой процентное содержание пропана в смеси пропан/воздух.
Это означает, что от 2,15% до 9,6% всей смеси пропан/воздух должен составлять пропан, чтобы смесь была горючей.
Температура вспышки пропана
Температура вспышки пропана составляет -104ºC (-155,2ºF).
Это минимальная температура, при которой пропан сгорает сам по себе после воспламенения.
Ниже этой температуры он перестанет гореть сам по себе.
Однако при наличии источника постоянного воспламенения он будет гореть при температуре ниже -104°C.
Рассеяние
Газообразный пропан тяжелее воздуха и будет опускаться и собираться в самой нижней точке.
Если пропан выпустить наружу, он быстро рассеется при малейшем движении воздуха.
И наоборот, если пропан выпускается в герметичную конструкцию без движения воздуха, газообразный пропан будет собираться на полу и подниматься вертикально по мере того, как в конструкцию будет поступать больше пропана.
Использование паров пропана (газа) в сравнении с использованием жидкости
Пропан может поставляться в жидком или парообразном виде.
Отличие заключается в извлечении из цилиндра или сосуда, в котором он поставляется.
В большинстве случаев применения пропана используется пар.
Такие приборы, как водонагреватели, комнатные обогреватели и плиты, используют пар.
Если в горелки этих приборов подается жидкий пропан, результатом может стать пожар или аналогичная угроза безопасности.
Вот почему баллоны с пропаном всегда следует держать в вертикальном положении, чтобы выходил только пар.
Просмотреть больше блогов о сжиженном нефтяном газе
Комментарии, вопросы или отзывы?
Пожалуйста, напишите нам по адресу: [email protected]
Информация в этой статье получена из различных источников и считается верной на момент публикации. Однако информация может быть не безошибочной и применимой не во всех обстоятельствах.
Пропан : Ответы по охране труда
Ответы по охране труда Информационные бюллетени
Легко читаемые информационные бюллетени с вопросами и ответами, охватывающие широкий спектр тем по охране труда и технике безопасности, от опасностей до заболеваний, эргономики и продвижения по службе. ПОДРОБНЕЕ >
Загрузите бесплатное приложение OSH Answers
Поиск по всем информационным бюллетеням:
Поиск
Введите слово, фразу или задайте вопрос
ПОМОЩЬ
Каковы другие названия или идентифицирующая информация для пропана?
Регистрационный номер CAS : 74-98-6
Другие названия: Диметилметан, н-пропан, пропилгидрид, сжиженный пропан
Основное применение: Топливо, хладагент, аэрозольный пропеллент, растворитель.
Внешний вид: Бесцветный газ.
Запах: Без запаха в естественном состоянии; поэтому имеет ПЛОХИЕ предупреждающие свойства. Отдушка, такая как меркаптан (запах тухлых яиц), используется в большинстве случаев.
ПРИМЕЧАНИЕ. Оборудование, содержащее пропан, может быть загрязнено природным радиоактивным материалом (НОРМ) в виде свинца 210.
Канадский TDG : UN1978
Что такое классификация WHMIS 1988?
А — сжатый газ; B1 — Горючий газ
Класс A
Класс B1
Что нужно знать о пропане в чрезвычайной ситуации?
Аварийный обзор: Бесцветный газ. Без запаха или с добавлением отдушки. ЧРЕЗВЫЧАЙНО ОГНЕОПАСНЫЙ ГАЗ. Возможны дистанционное воспламенение и обратный отсчет. ОПАСНОСТЬ В ЗАМКНУТОМ ПРОСТРАНСТВЕ. Может накапливаться в опасных количествах в низинах, особенно в замкнутых пространствах. СЖАТЫЙ ГАЗ. Содержит газ под давлением. Может взорваться при нагревании. Удушающий. Высокие концентрации могут вытеснять кислород из воздуха и вызывать удушье. Может вызвать обморожение.
СЖАТЫЙ ГАЗ. Содержит газ под давлением. Может взорваться при нагревании. Удушающий. Высокие концентрации могут вытеснять кислород из воздуха и вызывать удушье. Может вызвать обморожение.
Каково потенциальное воздействие пропана на здоровье?
Основные пути воздействия: Вдыхание.
- Вдыхание: Низкие концентрации не опасны. Высокая концентрация может вытеснять кислород в воздухе. Если для дыхания доступно меньше кислорода, могут возникнуть такие симптомы, как учащенное дыхание, учащенное сердцебиение, неуклюжесть, эмоциональные расстройства и усталость. Когда кислорода становится меньше, могут возникнуть тошнота и рвота, коллапс, судороги, кома и смерть. Симптомы возникают быстрее при физической нагрузке. Недостаток кислорода может привести к необратимому повреждению органов, включая мозг и сердце. В высоких концентрациях: может нанести вред нервной системе. Симптомы могут включать головную боль, тошноту, головокружение, сонливость и спутанность сознания.
 Может вызвать нерегулярное сердцебиение.
Может вызвать нерегулярное сердцебиение. - Контакт с кожей: Не раздражает. Прямой контакт со сжиженным газом может вызвать охлаждение или заморозку кожи (обморожение). Симптомы легкого обморожения включают онемение, покалывание и зуд. Симптомы более тяжелого обморожения включают ощущение жжения и скованность. Кожа может стать восково-белой или желтой. В тяжелых случаях могут развиваться волдыри, отмирание тканей и инфекция.
- Контакт с глазами: Не раздражает. Прямой контакт со сжиженным газом может заморозить глаза. Это может привести к необратимому повреждению глаз или слепоте.
- Проглатывание: Нерелевантный путь воздействия (газ).
- Последствия длительного (хронического) воздействия: Не вреден.
- Канцерогенность: Не является канцерогеном.
Международное агентство по изучению рака (IARC): Специально не оценивался.
Американская конференция государственных специалистов по промышленной гигиене (ACGIH): специально не назначена.
- Тератогенность/эмбриотоксичность: Неизвестно о вреде для будущего ребенка.
- Токсичность для репродуктивной системы: Опасность для репродуктивной системы не установлена.
- Мутагенность: Не известно, что это мутаген.
Каковы меры первой помощи при пропане?
Вдыхание: Принять меры предосторожности для предотвращения пожара (например, удалить источники возгорания). В случае нехватки кислорода: примите меры предосторожности для обеспечения собственной безопасности перед попыткой спасения (например, наденьте соответствующее защитное снаряжение). Вынести пострадавшего на свежий воздух. Сохраняйте состояние покоя в удобном для дыхания положении. Если дыхание затруднено, обученный персонал должен дать экстренную подачу кислорода. Если сердце остановилось, обученный персонал должен начать сердечно-легочную реанимацию (СЛР) или автоматическую наружную дефибрилляцию (АНД). Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Контакт с кожей: Неприменимо (газ). Сжиженный газ: быстро удалить пострадавшего от источника заражения. НЕ пытайтесь согреть пораженный участок на месте. НЕ трите область и не применяйте прямое тепло. Аккуратно снимите одежду или украшения, которые могут ограничивать кровообращение. Аккуратно разрежьте одежду, которая прилипает к коже, и снимите оставшуюся часть одежды. Неплотно накройте пораженный участок стерильной повязкой. НЕ позволяйте пострадавшему пить алкоголь или курить. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Контакт с глазами: Неприменимо (газ). Сжиженный газ: вывести пострадавшего на свежий воздух. Немедленно и на короткое время смойте теплой, слегка проточной водой. НЕ пытайтесь согреть. Закройте оба глаза стерильной повязкой. НЕ позволяйте пострадавшему пить алкоголь или курить. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
Проглатывание: Неприменимо (газ).
Первая помощь Комментарии: Некоторые из рекомендуемых здесь процедур первой помощи требуют продвинутого обучения оказанию первой помощи. Все процедуры оказания первой помощи должны периодически проверяться врачом, знакомым с химическим веществом и условиями его использования на рабочем месте.
Что такое пожароопасность и средства пожаротушения для пропана?
Воспламеняющиеся свойства: ЧРЕЗВЫЧАЙНО ОГНЕОПАСНЫЙ ГАЗ. Легко может загореться. Легко образует взрывоопасную смесь с воздухом при комнатной температуре.
Подходящие средства пожаротушения: Сухой химический порошок и пена высокой кратности. Следует проконсультироваться с производителями пены для получения рекомендаций относительно типов пены и нормы внесения.
Неподходящие средства пожаротушения: ЗАПРЕЩАЕТСЯ использовать двуокись углерода, пены с низкой кратностью и прямое нанесение воды на сжиженный газ.
Конкретные виды опасности, исходящие от химического вещества: Газ или пар могут перемещаться на значительное расстояние к источнику воспламенения и вспыхивать обратно в место утечки или открытый контейнер. Газ или пар могут скапливаться в опасных количествах в низинах, особенно в замкнутых пространствах, что может представлять опасность для здоровья. Может вытеснять кислород в воздухе, вызывая удушье. Прямое добавление воды к сжиженному газу вызовет мгновенное испарение, приводящее к взрыву (немедленному или отложенному), известному как «взрыв расширяющегося пара кипящей жидкости (BLEVE)». Тепло от огня может вызвать быстрое повышение давления внутри баллонов. Это может привести к взрывному разрыву и внезапному выбросу большого количества газа. Цилиндр может взлететь. При пожаре могут образовываться следующие опасные вещества: очень токсичный угарный газ, двуокись углерода.
Каковы опасности стабильности и реакционной способности пропана?
- Химическая стабильность: Обычно стабилен.
- Условия, которых следует избегать: Открытый огонь, искры, статический разряд, тепло и другие источники воспламенения.
- Несовместимые материалы: Повышенный риск возгорания и взрыва при контакте с: окислителями (например, пероксидами), галогенами (например, хлором). Не вызывает коррозии: алюминиевых сплавов, углеродистой стали.
- Опасные продукты разложения: Не известны.
- Возможность опасных реакций: Неизвестно.
Каковы меры по предотвращению аварийного выброса пропана?
Индивидуальные меры предосторожности: Немедленно покинуть зону. Изолируйте опасную зону. Не допускайте ненужного и незащищенного персонала. Эвакуируйте места с подветренной стороны. Устраните все источники воспламенения. Используйте заземленное взрывозащищенное оборудование. Возможны дистанционное воспламенение и обратный отсчет. Контролируйте зону на наличие легковоспламеняющейся или взрывоопасной атмосферы. Перед входом, особенно в закрытые помещения, проверьте атмосферу с помощью соответствующего монитора. Тест на достаточный уровень кислорода.
Устраните все источники воспламенения. Используйте заземленное взрывозащищенное оборудование. Возможны дистанционное воспламенение и обратный отсчет. Контролируйте зону на наличие легковоспламеняющейся или взрывоопасной атмосферы. Перед входом, особенно в закрытые помещения, проверьте атмосферу с помощью соответствующего монитора. Тест на достаточный уровень кислорода.
Методы локализации и очистки: Если возможно, поверните протекающий контейнер так, чтобы вышел газ, а не сжиженный газ. Обратитесь в аварийные службы и к производителю/поставщику за консультацией.
Дополнительная информация: Обратитесь за помощью к поставщику, в местные пожарные и аварийно-спасательные службы. При необходимости сообщайте о разливах местным органам здравоохранения, безопасности и охраны окружающей среды.
Какие методы обращения и хранения следует использовать при работе с пропаном?
Обращение: Устраните источники тепла и воспламенения, такие как искры, открытый огонь, горячие поверхности и статический разряд. Разместите таблички «Не курить». Используйте только там, где есть достаточная вентиляция. Немедленно сообщайте об утечках, разливах или отказах предохранительного оборудования (например, системы вентиляции). В случае разлива или утечки немедленно покиньте помещение. Никогда не работайте с системой под давлением. Используйте трубопроводы и оборудование, предназначенные для высоких давлений и низких температур. Изолируйте и продуйте все оборудование, трубопроводы или сосуды перед техническим обслуживанием или ремонтом.
Разместите таблички «Не курить». Используйте только там, где есть достаточная вентиляция. Немедленно сообщайте об утечках, разливах или отказах предохранительного оборудования (например, системы вентиляции). В случае разлива или утечки немедленно покиньте помещение. Никогда не работайте с системой под давлением. Используйте трубопроводы и оборудование, предназначенные для высоких давлений и низких температур. Изолируйте и продуйте все оборудование, трубопроводы или сосуды перед техническим обслуживанием или ремонтом.
ПРИМЕЧАНИЕ. Оборудование, содержащее пропан, может быть загрязнено радиоактивным материалом природного происхождения (НОРМ) в виде свинца 210. Если НОРМ присутствует, при открытии, очистке или ремонте следует принять меры предосторожности для предотвращения вдыхания, контакта с кожей и приема внутрь. работы на внутренних поверхностях этого оборудования.
Хранение: Хранить в прохладном, хорошо вентилируемом месте, вдали от прямых солнечных лучей и источников тепла и возгорания. Утвержденная, пожаробезопасная зона. Отдельно от несовместимых материалов. (например, кислород, газы хлора) На первом этаже или предпочтительно в изолированном, отдельно стоящем здании. Очистить от горючих и легковоспламеняющихся материалов (например, старых тряпок, картона). Электрически соедините и заземлите контейнеры. Зажимы заземления должны касаться голого металла. Всегда закрепляйте (например, цепью) цилиндры в вертикальном положении на стене, стойке или другой прочной конструкции. Избегайте объемного хранения в помещении.
Утвержденная, пожаробезопасная зона. Отдельно от несовместимых материалов. (например, кислород, газы хлора) На первом этаже или предпочтительно в изолированном, отдельно стоящем здании. Очистить от горючих и легковоспламеняющихся материалов (например, старых тряпок, картона). Электрически соедините и заземлите контейнеры. Зажимы заземления должны касаться голого металла. Всегда закрепляйте (например, цепью) цилиндры в вертикальном положении на стене, стойке или другой прочной конструкции. Избегайте объемного хранения в помещении.
Какой предел воздействия пропана рекомендован Американской конференцией государственных специалистов по промышленной гигиене (ACGIH®)?
ACGIH® TLV® — TWA: Простое удушающее средство*; Опасность взрыва**
Руководство по воздействию Комментарии: Нет конкретного TLV® = пороговое предельное значение. TWA = взвешенное по времени среднее значение.
*Требуется минимальное содержание кислорода.
**Пропан является легковоспламеняющимся удушающим веществом, или выбросы выше ПДК могут приближаться к 10% от нижнего предела взрываемости.
ПРИМЕЧАНИЕ. Во многих (но не во всех) юрисдикциях Канады пределы воздействия аналогичны ACGIH® TLVs®. Поскольку законодательство зависит от юрисдикции, обратитесь в местную юрисдикцию для получения точной информации. Список доступен в Ответах по охране труда о государственных департаментах охраны труда и техники безопасности Канады.
Список актов и правил, регулирующих пределы воздействия химических и биологических агентов, доступен на нашем веб-сайте. Обратите внимание, что, хотя вы можете ознакомиться со списком законодательных актов бесплатно, для просмотра фактической документации вам потребуется подписка.
Что такое инженерный контроль для пропана?
Технические средства контроля: Общей вентиляции обычно достаточно. Не допускайте скопления продукта в воздухе в рабочих или складских помещениях или в замкнутых пространствах. Для крупномасштабного использования этого продукта: используйте строгие меры контроля, такие как ограждение процесса, чтобы предотвратить попадание продукта на рабочее место. Используйте искробезопасные системы вентиляции, утвержденное взрывозащищенное оборудование и искробезопасные электрические системы в местах, где используется и хранится данное изделие. Используйте оборудование для обнаружения утечек и возгорания, а также автоматическую систему пожаротушения. Обеспечьте аварийный душ в рабочей зоне, если существует опасность контакта или разбрызгивания.
Используйте искробезопасные системы вентиляции, утвержденное взрывозащищенное оборудование и искробезопасные электрические системы в местах, где используется и хранится данное изделие. Используйте оборудование для обнаружения утечек и возгорания, а также автоматическую систему пожаротушения. Обеспечьте аварийный душ в рабочей зоне, если существует опасность контакта или разбрызгивания.
Какие средства индивидуальной защиты (СИЗ) необходимы при работе с пропаном?
Защита глаз/лица: Не требуется, если продукт используется по назначению.
Защита кожи: Защищайте открытые участки кожи с помощью изолирующих перчаток, подходящих для низких температур, с длинными рукавами, защитного фартука и брюк, надеваемых поверх ботинок или обуви. При работе с баллонами надевайте соответствующую защиту для ног. Подходящие материалы включают: нитриловый каучук, неопреновый каучук. ЗАПРЕЩАЕТСЯ использовать следующие материалы: поливинилхлорид. Рекомендации НЕ действительны для очень тонких перчаток из неопренового каучука и нитрилового каучука (0,3 мм или меньше).
Рекомендации НЕ действительны для очень тонких перчаток из неопренового каучука и нитрилового каучука (0,3 мм или меньше).
Средства защиты органов дыхания:
До 2100 ppm:
(APF = 10) Любой респиратор с подачей воздуха
(APF = 50) Любой автономный дыхательный аппарат с полнолицевой маской
APF = присвоенный коэффициент защиты
3
Рекомендации относятся только к респираторам, одобренным Национальным институтом безопасности и гигиены труда (NIOSH). Дополнительную информацию см. в Карманном справочнике NIOSH по химическим опасностям.Последнее обновление документа: 7 февраля 2020 г.
Добавьте значок на свой веб-сайт или в интранет, чтобы ваши сотрудники могли быстро найти ответы на свои вопросы по охране труда и технике безопасности.
Что нового
Ознакомьтесь с нашим списком «Что нового», чтобы узнать, что было добавлено или изменено.
Нужна дополнительная помощь?
Свяжитесь с нашей информационной линией безопасности
905-572-2981
Бесплатный номер 1-800-668-4284
(в Канаде и США)
Расскажите нам, что вы думаете
Как мы можем сделать наши услуги более полезными для вас? Свяжитесь с нами, чтобы сообщить нам.
Сопутствующие товары и услуги
Вас также могут заинтересовать следующие сопутствующие товары и услуги от CCOHS:
Отказ от ответственности
Несмотря на то, что предпринимаются все усилия для обеспечения точности, актуальности и полноты информации, CCOHS не гарантирует, не гарантирует, не заявляет и не ручается за правильность, точность или актуальность предоставленной информации. CCOHS не несет ответственности за любые убытки, претензии или требования, возникающие прямо или косвенно в результате любого использования или доверия к информации.
© Copyright 1997-2022 Canadian Center for Occupational Health & Safety
Комбинация восстановления CO2 с окислительным дегидрированием пропана на биметаллических катализаторах
Реферат
Неотъемлемая изменчивость и недостатки совместного производства пропилена на установках парового крекинга вызвали обеспокоенность по поводу глобального дефицита производства пропилена и побудили промышленность разрабатывать более целенаправленные пропиленовые технологии. Окислительное дегидрирование пропана CO 2 (CO 2 -ODHP) потенциально может заполнить этот пробел при потреблении парниковых газов. Неблагородные FeNi и благородные NiPt катализаторы, нанесенные на CeO 2 , были идентифицированы как многообещающие катализаторы для CO 2 -ODHP и сухого риформинга, соответственно, в исследованиях проточного реактора, проведенных при 823 K. измерения показали степени окисления металлов в условиях реакции, а расчеты теории функционала плотности использовались для определения наиболее благоприятных путей реакции для двух типов катализаторов.
Введение
Пропилен является одним из самых разнообразных нефтехимических строительных материалов, используемых для производства многих химических веществ (например, полипропилена, оксида пропилена и акрилонитрила). Ожидается, что совместного производства пропилена из установок парового и псевдоожиженного крекинга будет недостаточно для удовлетворения быстро растущего спроса 1 . Следовательно, существует потребность в разработке экономичных целевых технологий производства дополнительного количества пропилена. Прямое дегидрирование пропана (DDP) термодинамически ограничено и является сильно эндотермическим (Δ Н° р = 29,70 ккал/моль), для значительного выхода пропилена требуются температуры, которые могут превышать 973 K 2 . В принципе, введение CO 2 в качестве мягкого окислителя в исходное сырье изменяет путь дегидрирования путем окисления извлеченного водорода из алкана и, следовательно, высвобождения тепла реакции, что снижает рабочие температуры 2,3 . Присутствие CO 2 также может повысить равновесную конверсию пропана за счет потребления H 2 через обратную реакцию конверсии водяного газа (RWGS), как видно из термодинамических расчетов на рис. 1a. Кроме того, в отличие от обычного окислительного дегидрирования молекулярным кислородом, CO 2 как мягкий окислитель подавляет чрезмерное окисление и, таким образом, сводит к минимуму образование оксидов углерода. Реакции пропана и CO 2 также потенциально могут использовать два недоиспользуемых реагента 4,5,6 для производства пропилена, а также для уменьшения вредного воздействия CO 2 выбросы 7,8 .
Присутствие CO 2 также может повысить равновесную конверсию пропана за счет потребления H 2 через обратную реакцию конверсии водяного газа (RWGS), как видно из термодинамических расчетов на рис. 1a. Кроме того, в отличие от обычного окислительного дегидрирования молекулярным кислородом, CO 2 как мягкий окислитель подавляет чрезмерное окисление и, таким образом, сводит к минимуму образование оксидов углерода. Реакции пропана и CO 2 также потенциально могут использовать два недоиспользуемых реагента 4,5,6 для производства пропилена, а также для уменьшения вредного воздействия CO 2 выбросы 7,8 .
Графики термодинамического равновесия. Равновесные расчеты были выполнены с помощью программного обеспечения HSC Chemistry 8, в котором используется алгоритм минимизации свободной энергии Гиббса. a C 3 H 8 равновесная конверсия CO 2 -ODHP и прямое дегидрирование пропана; b количества продуктов для CO 2 +C 3 H 8 системы и c конверсии пропана, этана и метана сухим риформингом; все относительно температуры при 1 атм
Полноразмерное изображение
Реакции CO 2 с пропаном могут происходить через два различных пути: окислительная дегидридация (CO 2 +C 3 H 8 → C 3 H 700588+CO H 700588+CO CO 700588++CO CO 7 +CO 7 8+CO 7 +CO . + H 2 O) и сухой риформинг (3CO 2 + C 3 H 8 → 6CO + 4H 2 ). Две реакции должны протекать одновременно при температурах около 823 К и выше со значительными превращениями (рис. 1б), что позволяет образовывать как продукты дегидрирования (пропилен), так и продукты риформинга (синтез-газ). Окислительное дегидрирование пропана CO 2 (CO 2 -ODHP) может достигать равновесной конверсии 33% по сравнению с 17% для DDP при 823 K. При той же температуре реакции, как видно на рис. 1c, CO 2 равновесная конверсия для сухой риформинг пропана (ДРП) может достигать до 98% при температуре на 150 К ниже, чем при сухом риформинге метана (СУП). Это, в свою очередь, уменьшит дезактивацию катализатора из-за закоксовывания и фазовых превращений, вызванных относительно высокими температурами, обычно используемыми в DRM 9.,10 . Кроме того, в системе CO 2 +C 3 H 8 непрореагировавший CO 2 может удалять поверхностный углерод по реакции Будуара (CO 2 + C s ) при низких температурах 7 as 2CO K со средними показателями 11,12 .
+ H 2 O) и сухой риформинг (3CO 2 + C 3 H 8 → 6CO + 4H 2 ). Две реакции должны протекать одновременно при температурах около 823 К и выше со значительными превращениями (рис. 1б), что позволяет образовывать как продукты дегидрирования (пропилен), так и продукты риформинга (синтез-газ). Окислительное дегидрирование пропана CO 2 (CO 2 -ODHP) может достигать равновесной конверсии 33% по сравнению с 17% для DDP при 823 K. При той же температуре реакции, как видно на рис. 1c, CO 2 равновесная конверсия для сухой риформинг пропана (ДРП) может достигать до 98% при температуре на 150 К ниже, чем при сухом риформинге метана (СУП). Это, в свою очередь, уменьшит дезактивацию катализатора из-за закоксовывания и фазовых превращений, вызванных относительно высокими температурами, обычно используемыми в DRM 9.,10 . Кроме того, в системе CO 2 +C 3 H 8 непрореагировавший CO 2 может удалять поверхностный углерод по реакции Будуара (CO 2 + C s ) при низких температурах 7 as 2CO K со средними показателями 11,12 . Таким образом, представляет большой интерес идентификация катализаторов, которые могут либо селективно разрывать связь С-Н с образованием пропилена, либо связи С-С с образованием синтез-газа (CO + H 2 ).
Таким образом, представляет большой интерес идентификация катализаторов, которые могут либо селективно разрывать связь С-Н с образованием пропилена, либо связи С-С с образованием синтез-газа (CO + H 2 ).
Предыдущая работа в CO 2 -ODH в первую очередь ориентирован на нанесенные хромовые катализаторы 13,14,15 из-за их способности существовать в нескольких степенях окисления 16 , но применение ограничено из-за короткого жизненного цикла и высокой токсичности хрома 17 . Ni в основном используется для сухого риформинга, но дезактивация катализатора из-за сильного закоксовывания все еще остается проблемой 18,19,20 . Чтобы уменьшить коксообразование, катализаторы из драгоценных металлов (например, Rh, Re, Ru) также были исследованы на Al 9 с большой площадью поверхности.0057 2 О 3 21,22 . Однако крупномасштабная каталитическая конверсия CO 2 в ценные продукты потребует разработки рентабельных, селективных и устойчивых к закоксовыванию каталитических систем. Несмотря на то, что существуют исследования, в которых исследуются CO 2 -ODHP или DRP по отдельности, тщательное исследование с использованием биметаллических катализаторов на носителе в диапазоне температур, позволяющем реализовать оба пути, все еще отсутствует. Церий (CeO 2 ) является хорошим выбором оксидной подложки, поскольку он обладает способностью накапливать / выделять кислород и, таким образом, может вызывать прямой разрыв связи C–O CO 9.0057 2 , а также обеспечивает наличие кислорода в решетке для тушения кокса 9,23,24,25 .
Несмотря на то, что существуют исследования, в которых исследуются CO 2 -ODHP или DRP по отдельности, тщательное исследование с использованием биметаллических катализаторов на носителе в диапазоне температур, позволяющем реализовать оба пути, все еще отсутствует. Церий (CeO 2 ) является хорошим выбором оксидной подложки, поскольку он обладает способностью накапливать / выделять кислород и, таким образом, может вызывать прямой разрыв связи C–O CO 9.0057 2 , а также обеспечивает наличие кислорода в решетке для тушения кокса 9,23,24,25 .
В настоящей работе исследуются биметаллические катализаторы на основе оксида церия, неблагородные металлы Fe 3 Ni, а также Fe 3 Pt и Ni 3 Pt на основе драгоценных металлов, которые активны при 823 K. Исследования в стационарном проточном реакторе показывают, что Fe 3 Ni проявляет многообещающую селективность по отношению к пропилену через путь CO 2 -ODHP, тогда как Ni 3 Pt активна для DRP с высокой селективностью по отношению к CO. Расчеты энергии теории функционала плотности для разрывов связей C–H и C–C для двух катализаторов согласуются с экспериментальными результатами.
Расчеты энергии теории функционала плотности для разрывов связей C–H и C–C для двух катализаторов согласуются с экспериментальными результатами.
Результаты
Каталитическая оценка с кинетикой и моделями дезактивации
Исследования в проточном реакторе с одновременным измерением активности CO 2 -ODHP и DRP приведены в таблице 1 вместе со значениями хемосорбции CO. Все катализаторы были синтезированы путем импрегнирования металлов по начальной влажности на коммерчески доступный CeO 9 .0057 2 (35–45 м 2 /г, Sigma Aldrich). Дополнительные сведения см. в разделе «Методы» или в разделе «Дополнительные методы». Результаты конверсии и селективности по продукту после времени работы для всех катализаторов показаны на дополнительном рисунке 1. Монометаллический катализатор Ni 1 демонстрирует 12%–87% C 3 H 6 и селективность риформинга соответственно с минимальной продукты крекинга (углеводороды CH 4 и C 2 ), а Fe 3 9Монометаллический катализатор 0058 не активен ни в одной из реакций. Однако биметаллическая система Fe 3 Ni в стационарном состоянии демонстрирует образование пропилена в реакции CO 2 -ODHP, что соответствует селективности 58,2% C 3 H 6 . Различия между выходами пропилена на основе C 3 H 8 , представленные в дополнительной таблице 1, для Fe 3 Ni (выход 1,6% C 3 H 6 ) и соответствующих монометаллов (C 3 H 6 (выход 0,4% по сравнению с Ni и 0,2% по сравнению с Fe) указывают на наличие синергетического эффекта от образования биметаллического катализатора Fe 3 Ni.
Однако биметаллическая система Fe 3 Ni в стационарном состоянии демонстрирует образование пропилена в реакции CO 2 -ODHP, что соответствует селективности 58,2% C 3 H 6 . Различия между выходами пропилена на основе C 3 H 8 , представленные в дополнительной таблице 1, для Fe 3 Ni (выход 1,6% C 3 H 6 ) и соответствующих монометаллов (C 3 H 6 (выход 0,4% по сравнению с Ni и 0,2% по сравнению с Fe) указывают на наличие синергетического эффекта от образования биметаллического катализатора Fe 3 Ni.
Полный размер Таблица
Обмен NI в FE 3 NI Catalyst с предварительным металлом Pt (FE 3 8888888 -й. ) примерно вдвое снижает активность, снижает селективность в отношении C 3 H 6 до 32% и нестабилен по сравнению с Fe 3 Ni (дополнительный рисунок 2). Другой биметаллический катализатор из драгоценного металла, Ni 3 Pt, в основном выполняет реакцию DRP с конверсией CO 2 39%, надежной селективностью по отношению к CO 88% при сопоставимых конверсиях реагентов (дополнительная таблица 2) и является более стабильным по сравнению с монометаллический Ni 3 (дополнительный рисунок 3). Таким образом, при соединении Ni с неблагородным Fe в соотношении 1:3 можно достичь более высокой активности дегидрирования и получить пропилен. Напротив, когда Ni сплавляется с драгоценным металлом Pt, активность риформинга повышается по сравнению с монометаллическим Ni 9.0057 3 . Дальнейший анализ, такой как сравнение катализаторов CeO 2 на носителе Ni 3 Pt с катализаторами Ni 3 Fe и Fe 3 Ni, а также селективность по CO после графиков конверсии CO 2 , можно найти в дополнительных примечаниях 1 и 2 соответственно.
Другой биметаллический катализатор из драгоценного металла, Ni 3 Pt, в основном выполняет реакцию DRP с конверсией CO 2 39%, надежной селективностью по отношению к CO 88% при сопоставимых конверсиях реагентов (дополнительная таблица 2) и является более стабильным по сравнению с монометаллический Ni 3 (дополнительный рисунок 3). Таким образом, при соединении Ni с неблагородным Fe в соотношении 1:3 можно достичь более высокой активности дегидрирования и получить пропилен. Напротив, когда Ni сплавляется с драгоценным металлом Pt, активность риформинга повышается по сравнению с монометаллическим Ni 9.0057 3 . Дальнейший анализ, такой как сравнение катализаторов CeO 2 на носителе Ni 3 Pt с катализаторами Ni 3 Fe и Fe 3 Ni, а также селективность по CO после графиков конверсии CO 2 , можно найти в дополнительных примечаниях 1 и 2 соответственно.
Кинетические исследования влияния парциального давления реагента и температуры реакции на активность Fe 3 Ni и Ni 3 Pt были проведены для дальнейшей оценки различий между двумя типами катализаторов. Кажущаяся энергия активации была получена путем измерения производительности в диапазоне температур 803–843 K.0057 3 Ni, барьер активации окислительного дегидрирования пропана CO 2 составил 115 кДж моль −1 , а барьер активации риформинга над Ni 3 Pt составил 119 кДж моль −6 , Графики типа Аррениуса и дополнительные значения доступны на дополнительном рисунке 4 и в дополнительной таблице 3 соответственно. Как видно на рис. 2а, скорость расхода реагента C 3 H 8 для катализатора Fe 3 Ni CO 2 -ODHP изначально не зависела от увеличения парциального давления CO 2 , но при достижении соотношения C 3 H 8 :CO 2 1:1 скорость начала снижаться. С другой стороны, на катализатор риформинга оказывало положительное влияние парциальное давление CO 2 до вышеупомянутого соотношения 1:6. Увеличение парциального давления C 3 H 8 привело к аналогичным тенденциям и показано на дополнительном рисунке 5.
Кажущаяся энергия активации была получена путем измерения производительности в диапазоне температур 803–843 K.0057 3 Ni, барьер активации окислительного дегидрирования пропана CO 2 составил 115 кДж моль −1 , а барьер активации риформинга над Ni 3 Pt составил 119 кДж моль −6 , Графики типа Аррениуса и дополнительные значения доступны на дополнительном рисунке 4 и в дополнительной таблице 3 соответственно. Как видно на рис. 2а, скорость расхода реагента C 3 H 8 для катализатора Fe 3 Ni CO 2 -ODHP изначально не зависела от увеличения парциального давления CO 2 , но при достижении соотношения C 3 H 8 :CO 2 1:1 скорость начала снижаться. С другой стороны, на катализатор риформинга оказывало положительное влияние парциальное давление CO 2 до вышеупомянутого соотношения 1:6. Увеличение парциального давления C 3 H 8 привело к аналогичным тенденциям и показано на дополнительном рисунке 5. Скорость снижения означает, что для одного реагента доступно меньше каталитических центров, когда другой находится в избытке, что указывает на конкурентную адсорбцию адсорбаты и/или поверхностные интермедиаты. В частности, скорости обоих реагентов снижаются при высоком парциальном давлении пропана, что свидетельствует о том, что по мере развития реакции промежуточные продукты из пропана блокируют участки поверхности и приводят к потере активности.
Скорость снижения означает, что для одного реагента доступно меньше каталитических центров, когда другой находится в избытке, что указывает на конкурентную адсорбцию адсорбаты и/или поверхностные интермедиаты. В частности, скорости обоих реагентов снижаются при высоком парциальном давлении пропана, что свидетельствует о том, что по мере развития реакции промежуточные продукты из пропана блокируют участки поверхности и приводят к потере активности.
Влияние парциального давления CO 2 на скорость производства пропана. Графики для a Fe 3 Ni и b Ni 3 Pt. Общее давление в системе составляет 1 атм. , соответственно. Результаты ТГА показывают, что Fe 3 Ni-катализатор теряет менее половины процента своей первоначальной массы, поэтому маловероятно, что основной путь дезактивации связан с закоксовыванием. ЭДС отработанного образца Fe 3 Ni показывает небольшие области с более высоким содержанием Ni и, в меньшей степени, области с более высоким содержанием Fe. Однако измерения XRD на месте не выявляют явного образования агломераций во время реакции, а отсутствие пиков дифракции металлов предполагает, что частицы металла, скорее всего, имеют размер менее 2 нм (дополнительный рисунок 8). Ни 3 Платиновый катализатор теряет около 8% своей первоначальной массы, но не проявляет признаков спекания. Однако закоксовывание катализатора Ni 3 Pt при сравнимой конверсии пропана с Fe 3 Ni незначительно.
Однако измерения XRD на месте не выявляют явного образования агломераций во время реакции, а отсутствие пиков дифракции металлов предполагает, что частицы металла, скорее всего, имеют размер менее 2 нм (дополнительный рисунок 8). Ни 3 Платиновый катализатор теряет около 8% своей первоначальной массы, но не проявляет признаков спекания. Однако закоксовывание катализатора Ni 3 Pt при сравнимой конверсии пропана с Fe 3 Ni незначительно.
Степени окисления с помощью XANES in situ
Измерения рентгеновской абсорбционной спектроскопии ближнего края (XANES) in situ были проведены для определения локального окружения металлов в условиях реакции, как показано на рис. 3. Доступны дополнительные сведения. в дополнительном примечании 3. Данные XANES показали, что в условиях реакции Ni 9Катализатор 0057 3 Pt состоял из металлической Pt (дополнительный рис. 9), а катализаторы Fe 3 Ni и Ni 3 Pt состояли из металлического никеля (рис. 3a). С другой стороны, Fe в катализаторе Fe 3 Ni находится в окисленной форме. Расширенная тонкая структура рентгеновского поглощения (EXAFS), подходящая для Fe 3 Ni, предполагает наличие внедренного кислорода через связи Fe – O – Fe, а также связи Fe – O (дополнительная таблица 4). Теофанидис и др. и Ким и др. изучали DRM на катализаторах Ni-Fe с более высокой загрузкой (8 % масс. Ni-5 % масс. Fe и 8,8% масс. Ni-2,1 % масс. Fe соответственно), нанесенных на алюминат магния, и они также наблюдали окисление железа в условиях in situ. условиях, но в степени окисления 2+ 26,27 . Для катализатора Ni 3 Pt подгонка EXAFS показывает, что координационное число связей Pt–Pt и Pt–Ni составляет 3,4 и 6,4 соответственно, что подтверждает образование биметаллической связи Pt–Ni.
3a). С другой стороны, Fe в катализаторе Fe 3 Ni находится в окисленной форме. Расширенная тонкая структура рентгеновского поглощения (EXAFS), подходящая для Fe 3 Ni, предполагает наличие внедренного кислорода через связи Fe – O – Fe, а также связи Fe – O (дополнительная таблица 4). Теофанидис и др. и Ким и др. изучали DRM на катализаторах Ni-Fe с более высокой загрузкой (8 % масс. Ni-5 % масс. Fe и 8,8% масс. Ni-2,1 % масс. Fe соответственно), нанесенных на алюминат магния, и они также наблюдали окисление железа в условиях in situ. условиях, но в степени окисления 2+ 26,27 . Для катализатора Ni 3 Pt подгонка EXAFS показывает, что координационное число связей Pt–Pt и Pt–Ni составляет 3,4 и 6,4 соответственно, что подтверждает образование биметаллической связи Pt–Ni.
Спектры XANES in situ. a Ni и b Fe K грани всех биметаллических катализаторов с соответствующими ссылками. На вставках показано более детальное сравнение Fe 3 Ni с модельными соединениями
На вставках показано более детальное сравнение Fe 3 Ni с модельными соединениями
Изображение в натуральную величину
Пути реакций и расчеты DFT
Расчеты теории функционала плотности (DFT) были выполнены на поверхностях Fe 3 Ni (111) и Pt (Pt) (111) с концевыми группами (дополнительный рисунок 10). ) для дальнейшего понимания потенциальных путей реакции окислительного разрыва связи C–H и C–C пропана с образованием *CH 3 CHCH 2 +H 2 O(g) и *CH 3 CH 2 +*CO+H 2 O(г) соответственно. В этих расчетах поверхности сначала модифицируются атомами *O, предполагая, что *CO 2 диссоциирует с образованием *CO + *O. Оптимизированные геометрии DFT на дополнительном рисунке 11 показывают, что промежуточные продукты * CH 3 CH 2 CH 2 O, * CH 3 CH 2 CHO и * H 2 O взаимодействуют с поверхностями. через атомы кислорода, тогда как другие интермедиаты *CH 3 CH 2 CH 2 , *CH 3 CHCH 2 , *CH 3 CH 2 , *CH 3 CH 2 , и *CO взаимодействуют с поверхностями атомы углерода. Отмечено, что хотя конфигурации связывания интермедиатов сходны на обеих поверхностях, все интермедиаты сильнее связываются с Fe 9 с концевыми группами.0057 3 Ni(111), чем на Pt-Ni с концевой платиной 3 Pt(111) (дополнительные таблицы 5 и 6). Рассчитанные DFT энергии связи затем использовались для расчета изменения энергии окислительного разрыва связи C–H и C–C пропана. Для Fe 3 Ni(111) с концевыми группами на рис. 4а показано, что путь окислительного разрыва связи C–H лежит ниже по энергии, чем путь разрыва связи C–C. Напротив, как показано на рис. 4b для Pt-терминированного Ni 3 Pt(111), путь разрыва связи C–C лежит ниже по энергии, чем путь для связи C–H.
через атомы кислорода, тогда как другие интермедиаты *CH 3 CH 2 CH 2 , *CH 3 CHCH 2 , *CH 3 CH 2 , *CH 3 CH 2 , и *CO взаимодействуют с поверхностями атомы углерода. Отмечено, что хотя конфигурации связывания интермедиатов сходны на обеих поверхностях, все интермедиаты сильнее связываются с Fe 9 с концевыми группами.0057 3 Ni(111), чем на Pt-Ni с концевой платиной 3 Pt(111) (дополнительные таблицы 5 и 6). Рассчитанные DFT энергии связи затем использовались для расчета изменения энергии окислительного разрыва связи C–H и C–C пропана. Для Fe 3 Ni(111) с концевыми группами на рис. 4а показано, что путь окислительного разрыва связи C–H лежит ниже по энергии, чем путь разрыва связи C–C. Напротив, как показано на рис. 4b для Pt-терминированного Ni 3 Pt(111), путь разрыва связи C–C лежит ниже по энергии, чем путь для связи C–H.
 4
4 DFT рассчитал энергетические профили для путей окислительного разрыва связи C–H и C–C. a Bulk Fe 3 Ni(111) поверхность, b Ni с концевыми платиновыми контактами 3 Pt(111) поверхность и c FeO/Ni(111) интерфейс, а также оптимизированная геометрия d CH 3 CH 2 CH 2 O и e CH 3 CH 2 CH 2 на FeO/Ni Полноразмерное изображение(111) 023 В целом результаты ТФП показывают, что путь разрыва связи C–C является предпочтительным для Ni 3 Pt(111), в то время как Fe 3 Ni(111) с концевым объемом благоприятствует пути разрыва связи C–H. Кинетически это также имеет место на основе сравнения энергий активации (дополнительная таблица 7). Согласно расчетам DFT, на Pt-терминированном Ni 3 Pt(111) реакция внедрения *О 2  a = 1,33 эВ). Напротив, на Fe 3 Ni(111) с концевыми группами реакция окислительного дегидрирования ( ∆E = 0,29 эВ и E A = 1,02 эВ) более благоприятен, чем реакция введения *O ( ∆E = 0,43 эВ и E A = 3,30 эВ). Эти предсказания DFT согласуются с экспериментальными наблюдениями, предполагая, что поверхность Fe 3 Ni(111) с объемными окончаниями способствует окислительному разрыву связи C–H пропана с образованием *CH 3 CHCH 2 , в то время как Pt -концевая-Ni 3 Поверхность Pt(111) способствует разрыву связи C-C пропана с образованием *CO.
a = 1,33 эВ). Напротив, на Fe 3 Ni(111) с концевыми группами реакция окислительного дегидрирования ( ∆E = 0,29 эВ и E A = 1,02 эВ) более благоприятен, чем реакция введения *O ( ∆E = 0,43 эВ и E A = 3,30 эВ). Эти предсказания DFT согласуются с экспериментальными наблюдениями, предполагая, что поверхность Fe 3 Ni(111) с объемными окончаниями способствует окислительному разрыву связи C–H пропана с образованием *CH 3 CHCH 2 , в то время как Pt -концевая-Ni 3 Поверхность Pt(111) способствует разрыву связи C-C пропана с образованием *CO.
Для учета потенциальных межфазных активных центров FeO–Ni на основе экспериментального наблюдения in situ окисленного Fe в катализаторе Fe 3 Ni были проведены дальнейшие расчеты DFT для исследования путей окислительного C–H и C Разрыв связи –C пропана на границе раздела FeO/Ni(111). Для FeO x кластеров, поддерживаемых Ni (111), оба кластера Fe 6 O 9 и Fe 3 O 3 на трехслойных поверхностях 7 × 7 Ni(111) и 5 × 5 Ni(111) (дополнительный рисунок . 12) были учтены. Кислородсодержащие соединения (*O, *CO, *CH 3 CH 2 CH 2 O, *CH 3 CH 2 CHO и *CH 3 CH 2 CO) предпочитают адсорбировать на межфазных участках, тогда как 7 3 905 x 905 *C Х у видов (*CH 3 CH 2 CH 2 , *CH 3 CHCH 2 и *CH 3 CH 2 , и *CH 3 CH 2 ) на наиболее благоприятных сайтах адсорбции Ni1S 8 и дополнительный рис. 13). Энергетическая диаграмма на рис. 4c, рассчитанная на основе полученных методом DFT энергий связи потенциальных промежуточных соединений, показывает, что первые этапы окислительного расщепления связей C–C и C–H являются конкурентными. Следующий шаг для формирования *CH 3 CHCH 2 имеет нисходящую энергию по пути окислительного разрыва связи C–H; Напротив, последующие этапы являются восходящими по энергии на пути окислительного разрыва связи C – C.
12) были учтены. Кислородсодержащие соединения (*O, *CO, *CH 3 CH 2 CH 2 O, *CH 3 CH 2 CHO и *CH 3 CH 2 CO) предпочитают адсорбировать на межфазных участках, тогда как 7 3 905 x 905 *C Х у видов (*CH 3 CH 2 CH 2 , *CH 3 CHCH 2 и *CH 3 CH 2 , и *CH 3 CH 2 ) на наиболее благоприятных сайтах адсорбции Ni1S 8 и дополнительный рис. 13). Энергетическая диаграмма на рис. 4c, рассчитанная на основе полученных методом DFT энергий связи потенциальных промежуточных соединений, показывает, что первые этапы окислительного расщепления связей C–C и C–H являются конкурентными. Следующий шаг для формирования *CH 3 CHCH 2 имеет нисходящую энергию по пути окислительного разрыва связи C–H; Напротив, последующие этапы являются восходящими по энергии на пути окислительного разрыва связи C – C. Опять же, такие термодинамические прогнозы полностью подтверждаются расчетами E a , показывающими, что реакция окислительного дегидрирования ( ∆E = –0,40 эВ и E a 0,29) весьма благоприятна для *e= 0,29 Реакция внедрения O ( ∆E = 0,01 эВ и E a = 2,13 эВ) на поверхности Fe 3 O 3 /Ni(111). Это указывает на то, что путь окислительного дегидрирования должен быть более благоприятным, чем реформинг, что согласуется с экспериментальными наблюдениями.
Опять же, такие термодинамические прогнозы полностью подтверждаются расчетами E a , показывающими, что реакция окислительного дегидрирования ( ∆E = –0,40 эВ и E a 0,29) весьма благоприятна для *e= 0,29 Реакция внедрения O ( ∆E = 0,01 эВ и E a = 2,13 эВ) на поверхности Fe 3 O 3 /Ni(111). Это указывает на то, что путь окислительного дегидрирования должен быть более благоприятным, чем реформинг, что согласуется с экспериментальными наблюдениями.
Наконец, ожидается, что на трех исследованных поверхностях десорбция *CO будет легким процессом из-за вклада энтропии при 823 K. вставки, реакции разрыва связей C-H и C-C с образованием CO и H 2 . Виды *O на Pt-концевом Ni 3 Pt(111) реагируют с *C x Х у для формирования *C x Х у Интермедиат O, который способствует разрыву связи C – C. Напротив, ожидается, что более стабильный *O на Fe 3 Ni(111) с концевыми группами и интерфейс FeO/Ni(111) останутся на поверхности, что способствует селективному разрыву связи C–H пропана до производят пропилен.
Напротив, ожидается, что более стабильный *O на Fe 3 Ni(111) с концевыми группами и интерфейс FeO/Ni(111) останутся на поверхности, что способствует селективному разрыву связи C–H пропана до производят пропилен.
Обсуждение
В целом, окислительное дегидрирование пропана с помощью CO 2 может объединить два малоиспользуемых 4,5,6 реагента для получения пропилена или синтез-газа. Для системы CO 2 + C 3 H 8 идентифицированы два типа биметаллических катализаторов. Результаты расчета DFT показывают, что объемная поверхность Fe 3 Ni(111) и граница раздела FeO/Ni(111) должны способствовать разрыву связи C–H для CO 2 -ODHP путь, тогда как Pt-терминированная поверхность Ni 3 Pt(111) должна благоприятствовать расщеплению связи C–C для пути DRP. Результаты проточного реактора согласуются с расчетами DFT, поскольку было замечено, что катализатор Fe 3 Ni является селективным для производства пропилена, в то время как катализатор Ni 3 Pt показывает хорошую активность и селективность по СО. Степени окисления различных металлов, полученные с помощью измерений XANES in situ, показывают, что Fe 3 Ni состоит из окисленного Fe и металлического Ni. Будущие усилия должны быть направлены на повышение выхода пропилена за счет открытия более стабильных и селективных каталитических материалов.
Степени окисления различных металлов, полученные с помощью измерений XANES in situ, показывают, что Fe 3 Ni состоит из окисленного Fe и металлического Ni. Будущие усилия должны быть направлены на повышение выхода пропилена за счет открытия более стабильных и селективных каталитических материалов.
Методы
Расчеты по теории функционала плотности
Спин-поляризованные 28,29 расчеты по теории функционала плотности (DFT) были выполнены как попытка выяснить возможные пути разрыва связи C–C и C–H пропана над Fe 3 Ni(111), Ni 3 Поверхности Pt(111) и интерфейс FeO/Ni(111) с использованием Венского пакета моделирования Ab Initio (VASP), код 30,31 . Волновые потенциалы, дополненные проектором, использовались для описания остовных электронов в приближении обобщенного градиента (GGA) 32,33 с использованием функционала PW91 34 . Одноэлектронные волновые функции Кона-Шэма были расширены с использованием базиса плоских волн с отсечкой кинетической энергии 400 эВ. Зона Бриллюэна была отобрана с использованием сетки k-точек 3 × 3 × 1 по схеме Монкхорста-Пака 35 . Положения ионов оптимизировали до тех пор, пока сила Хеллмана-Фейнмана на каждом ионе не стала меньше 0,02 эВ/Å. Переходное состояние химической реакции было обнаружено с использованием метода скользящей эластичной ленты с восхождением по изображению (CI-NEB), реализованного в VASP 9.0065 36 . Энергия активации ( E a ) химической реакции определяется как разность энергий между начальным и переходным состояниями, а энергия реакции (Δ E ) определяется как разница энергий между начальным и конечным состояниями.
Зона Бриллюэна была отобрана с использованием сетки k-точек 3 × 3 × 1 по схеме Монкхорста-Пака 35 . Положения ионов оптимизировали до тех пор, пока сила Хеллмана-Фейнмана на каждом ионе не стала меньше 0,02 эВ/Å. Переходное состояние химической реакции было обнаружено с использованием метода скользящей эластичной ленты с восхождением по изображению (CI-NEB), реализованного в VASP 9.0065 36 . Энергия активации ( E a ) химической реакции определяется как разность энергий между начальным и переходным состояниями, а энергия реакции (Δ E ) определяется как разница энергий между начальным и конечным состояниями.
Подготовка катализатора и исследования в проточном реакторе
Катализаторы, оцениваемые в этом исследовании, были синтезированы путем импрегнирования металлов по начальной влажности на коммерчески доступный CeO 2 (35–45 м 2 /г, Sigma-Aldrich). Эксперименты с проточным реактором проводились при атмосферном давлении с использованием 1/4-дюймового кварцевого U-образного реактора. Все катализаторы восстанавливали при 723 К в течение 1 часа в потоке 1:1 H 2 /Ar (всего 40 мл/мин). Затем температуру повышали и поддерживали при 823 К в присутствии 1:1:2 CO 2 , C 3 H 8 и Ar в течение 12 часов. Эксперименты с кажущимся активационным барьером и порядком реакции проводились при немного отличающихся условиях реакции, чтобы обеспечить работу в истинном собственном кинетическом режиме и свести к минимуму эффекты переноса. Измерения XANES проводились с использованием специальной микроканальной ячейки in situ, содержащей ~ 200 мг катализатора (60–80 меш), и 4-канального вихревого флуоресцентного детектора.
Все катализаторы восстанавливали при 723 К в течение 1 часа в потоке 1:1 H 2 /Ar (всего 40 мл/мин). Затем температуру повышали и поддерживали при 823 К в присутствии 1:1:2 CO 2 , C 3 H 8 и Ar в течение 12 часов. Эксперименты с кажущимся активационным барьером и порядком реакции проводились при немного отличающихся условиях реакции, чтобы обеспечить работу в истинном собственном кинетическом режиме и свести к минимуму эффекты переноса. Измерения XANES проводились с использованием специальной микроканальной ячейки in situ, содержащей ~ 200 мг катализатора (60–80 меш), и 4-канального вихревого флуоресцентного детектора.
Доступность данных
Данные, подтверждающие результаты этого исследования, можно получить у соответствующего автора по запросу.
Ссылки
Плоткин Дж. С. Пропиленовая брешь: как ее заполнить? http://www.acs.org/content/acs//en/pressroom/cutting-edge-chemistry/the-пропилен-гэп-как-может-ит-быть-заполнен.

Ван, С. и Чжу, З. Х. Каталитическая конверсия алканов в олефины путем окислительного дегидрирования диоксидом углерода — обзор. Energy Fuels 18 , 1126–1139 (2004).
КАС Статья Google ученый
Ансари, М.Б. и Парк, С.-Э. Использование диоксида углерода как мягкого окислителя и промотора в катализе. Энергетика Окружающая среда. науч. 5 , 9419–9437 (2012).
КАС Статья Google ученый
Сенти, Г., Ператонер, С. и Якуаньелло, Г. в КО 2 : Ценный источник углерода (ред. Де Фалько, М., Якуаньелло, Г. и Сенти, Г.) Ch. 2 (Спрингер-Верлаг, Лондон, 2013 г.).
Слоан, М. и Вильчевски, В. Обзор рынка пропана. http://www.afdc.energy.gov/uploads/publication/2016_propane_market_outlook_1_.
 pdf (2013 г.).
pdf (2013 г.).Слоан М. Обзор рынка пропана. http://www.afdc.energy.gov/uploads/publication/2013_propane_market_outlook.pdf (2016 г.).
Годдард П. Б., Инь Дж., Гриффис С. М. и Чжан С. Экстремальное повышение уровня моря вдоль северо-восточного побережья Северной Америки в 2009–2010 гг. Нац. Коммуна . 6 , 6346 (2015).
Пачаури Р.К. и др. (ред.) Изменение климата: Обобщающий отчет. Вклад рабочих групп I, II и III в Пятый оценочный доклад Межправительственной группы экспертов по изменению климата (IPCC, 2014).
Пакхар Д. и Спайви Дж. Обзор сухого (CO 2 ) риформинга метана на катализаторах из благородных металлов. Хим. соц. Ред. 43 , 7813–7837 (2014).
КАС Статья пабмед Google ученый
Тан П.
 , Чжу К., Ву З. и Ма Д. Активация метана: прошлое и будущее. Энергетика Окружающая среда. науч. 7 , 2580–2591 (2014).
, Чжу К., Ву З. и Ма Д. Активация метана: прошлое и будущее. Энергетика Окружающая среда. науч. 7 , 2580–2591 (2014).КАС Статья Google ученый
Осаки Т. и Мори Т. Кинетика обратной реакции Будуара на никелевых катализаторах на носителе. Реагировать. Кинет. Катал. лат. 89 , 333–339 (2006).
КАС Статья Google ученый
Lim, J.Y., McGregor, J., Sederman, A.J. & Dennis, J.S. Роль реакций Будуара и конверсии водяного газа в метанировании CO или CO 2 над Ni/g–Al 2 O 3 катализатор. Хим. англ. науч. 152 , 754–766 (2016).
КАС Статья Google ученый
Baek, J., Yun, H.J., Yun, D., Choi, Y. & Yi, J. Получение высокодисперсных катализаторов на основе оксида хрома, нанесенных на мезопористый диоксид кремния, для окислительного дегидрирования пропана с использованием CO 2 : понимание природы каталитически активных центров хрома.
 ACS Катал. 2 , 1893–1903 (2012).
ACS Катал. 2 , 1893–1903 (2012).КАС Статья Google ученый
Talati, A., Haghighi, M. & Rahmani, F. Окислительное дегидрирование этана в этилен диоксидом углерода над Cr/TiO 2 –ZrO 2 нанокатализатор: влияние активной фазы и состава носителя на свойства и производительность. Доп. Порошковая технология. 27 , 1195–1206 (2016).
КАС Статья Google ученый
Takahara, I., Chang, W.-C., Mimura, N. & Saito, M. Стимуляция эффектов CO 2 на дегидрирование пропана на SiO 2 — Cr 2 O 3 Катализатор. Катал. Сегодня 45 , 55–59 (1998).
КАС Статья Google ученый
Asghari, E., Haghighi, M. & Rahmani, F. CO 2 окислительное дегидрирование этана в этилен на нанокатализаторе Cr/MCM-41, синтезированном гидротермальными методами/методами пропитки: влияние содержания хрома на каталитические свойства и производительность.
 Дж. Мол. Катал. Хим. 418–419 , 115–124 (2016).
Дж. Мол. Катал. Хим. 418–419 , 115–124 (2016).Артикул Google ученый
Farrauto, RJ & Bartholomew, CH Fundamentals of Industrial Catalitic Processes 2nd edn (Wiley-AIChE, Hoboken, NJ, 2005).
Раберг Л. и др. Сухой риформинг пропана в синтез-газ на катализаторах на основе никеля: влияние носителя и рабочих параметров на активность и стабильность катализатора. Дж. Катал. 249 , 250–260 (2007).
КАС Статья Google ученый
Сиахваши А. и Адесина А. А. Кинетическое исследование риформинга пропана CO 2 на биметаллическом катализаторе Mo-Ni/Al 2 O 3 . Индивидуальный инж. хим. Рез. 52 , 15377–15386 (2013).
КАС Статья Google ученый
«>Solymosi, F., Tolmacsov, P. & Kedves, K. CO 2 риформинг пропана на Rh. J. Катал. 216 , 377–385 (2003).
КАС Статья Google ученый
Солимози Ф., Толмацов П. и Закар Т. С. Сухой риформинг пропана на Re-катализаторе на носителе. J. Катал. 233 , 51–59 (2005).
КАС Статья Google ученый
Сенти Г. и Ператонер С. Возможности и перспективы химической переработки углекислого газа в топливо. Катал. Сегодня 148 , 191–205 (2009).
КАС Статья Google ученый
«>Ян Б. и др. Сухой риформинг этана и бутана с CO 2 на биметаллических катализаторах PtNi/CeO 2 . ACS Катал. 6 , 7283–7292 (2016).
КАС Статья Google ученый
Теофанидис, С. А., Гальвита, В. В., Поэльман, Х. и Марин, Г. Б. Fe-Ni катализатор сухого риформинга с улучшенной углеродостойкостью: роль Fe. ACS Катал. 5 , 3028–3039 (2015).
КАС Статья Google ученый
Ким, С. М. и др. Кооперативность и динамика повышают эффективность катализаторов сухого риформинга NiFe.
 Дж. Ам. хим. соц. 139 , 1937–1949 (2017).
Дж. Ам. хим. соц. 139 , 1937–1949 (2017).КАС Статья пабмед Google ученый
Хохенберг П. и Кон В. Неоднородный электронный газ. Физ. Ред. 136 , B864–B871 (1964).
ОБЪЯВЛЕНИЯ MathSciNet Статья Google ученый
Кон, В. и Шэм, Л. Дж. Самосогласованные уравнения, включая эффекты обмена и корреляции. Физ. Ред. 140 , A1133–A1138 (1965).
ОБЪЯВЛЕНИЯ MathSciNet Статья Google ученый
Крессе, Г. и Фуртмюллер, Дж. Эффективность вычислений полной энергии ab-initio для металлов и полупроводников с использованием базисного набора плоских волн. Вычисл. Матер. науч. 6 , 15–50 (1996).
КАС Статья Google ученый
«>Кресс, Г. и Жубер, Д. От ультрамягких псевдопотенциалов к проекторному методу дополненной волны. Физ. Ред. B 59 , 1758–1775 (1999).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Blöchl, P. E. Метод дополненной волны проектора. Физ. B 50 , 17953–17979 (1994).
ОБЪЯВЛЕНИЯ Статья Google ученый
Пердью, Дж. П. и Ван, Ю. Точное и простое аналитическое представление энергии корреляции электрон-газ. Физ. Ред. B 45 , 13244–13249 (1992).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
«>Хенкельман, Г., Уберуага, Б. П. и Йонссон, Х. Метод лазающего образа с подталкиванием эластичной ленты для поиска седловых точек и путей с минимальной энергией. J. Chem. физ. 113 , 9901–9904 (2000).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Olafsen, A. et al. Конверсия легких алканов CO 2 в синтез-газ на катализаторах на основе никеля. Катал. Сегодня 115 , 179–185 (2006).
КАС Статья Google ученый
Валенсуэла, Р. Х., Буэно, Г., Кортес Корберан, В., Сюй, Ю. и Чен, С. Селективное оксидное гидрирование этана с помощью CO 2 на катализаторах на основе CeO 2 . Катал. Сегодня 61 , 43–48 (2000).
КАС Статья Google ученый
Кресс, Г. и Хафнер, Дж. Молекулярная динамика Ab initio для переходных металлов с открытой оболочкой. Физ. B 48 , 13115–13118 (1993).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Pack, J.D. & Monkhorst, H.J. Специальные точки для интегрирования зоны Бриллюэна. Физ. B 13 , 5188–5192 (1976).
ОБЪЯВЛЕНИЯ MathSciNet Статья Google ученый
Скачать ссылки
Благодарности
Работа поддерживается Министерством энергетики США (DOE) по контракту № DE-SC0012704. Измерения XAS in situ проводились на линии 2–2 луча Стэнфордского источника синхротронного излучения (SSRL) в Национальной ускорительной лаборатории SLAC (DE-AC02–76SF00515) и на линии 9-BM усовершенствованного источника фотонов (APS) в Аргоннская национальная лаборатория (DE-AC02-06Ch21357). Расчеты DFT были выполнены с использованием вычислительных ресурсов в Центре функциональных наноматериалов в BNL, пользовательском центре Министерства энергетики США, и в Национальном научно-вычислительном центре энергетических исследований (NERSC), пользовательском центре Министерства энергетики США, при поддержке Управления. науки Министерства энергетики по контракту DE-AC02-05Ch21231. НАПРИМЕР. признает стипендиальную программу Национального научного фонда США: DGE-16-44869.
Расчеты DFT были выполнены с использованием вычислительных ресурсов в Центре функциональных наноматериалов в BNL, пользовательском центре Министерства энергетики США, и в Национальном научно-вычислительном центре энергетических исследований (NERSC), пользовательском центре Министерства энергетики США, при поддержке Управления. науки Министерства энергетики по контракту DE-AC02-05Ch21231. НАПРИМЕР. признает стипендиальную программу Национального научного фонда США: DGE-16-44869.
Информация об авторе
Авторы и организации
Факультет химического машиностроения, Колумбийский университет, Нью-Йорк, штат Нью-Йорк, 10027, США
Элейн Гомес и Цзингуан Г. Чен
3 Департамент национальной безопасности, Брохокхэнри , NY, 11973, USA
Shyam Kattel, Binhang Yan, Siyu Yao, Ping Liu & Jingguang G. Chen
Авторы
- Elaine Gomez
Посмотреть публикации авторов
Вы также можете искать этого автора в PubMed Google Scholar
- Shyam Kattel
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Binhang Yan
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Siyu Yao
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Ping Liu
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jingguang G.
 Chen
ChenПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
E.G. провел все эксперименты с проточным реактором и проанализировал результаты. С.К. и П.Л. выполнил вычисления ДПФ. ПО. и С.Ю. помогал Э.Г. на линиях луча для сбора данных XAS на месте, а также для выполнения анализа данных. НАПРИМЕР. и J.G.C. подготовили рукопись, а другие авторы внесли комментарии/дополнения.
Автор, ответственный за переписку
Переписка с Цзингуан Г. Чен.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и принадлежности к организациям.
Дополнительный электронный материал
(DOCX 8938 kb)
Файл рецензирования (PDF 2247 КБ)
Права и разрешения
Открытый доступ носителя или формата, при условии, что вы укажете первоначальных авторов и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Дополнительная литература
Тройной платино-кобальт-индиевый наносплав на церии как высокоэффективный катализатор окислительного дегидрирования пропана с использованием СО2
- Фейлун Син
- Юки Накая
- Шинья Фурукава
Природный катализ (2022)
Ход исследований окислительного дегидрирования пропана в пропилен CO2 на металлических катализаторах, не содержащих Cr
- Чжун-Ю Ван
- Чжэнь-Хонг Хэ
- Чжао-Тие Лю
Редкие металлы (2022)
Атомарно диспергированные ионные центры Pb в гелях с квантовыми точками PbCdSe улучшают восприятие NO2 при комнатной температуре
- Синь Гэн
- Шувей Ли
- Лонг Ло
Nature Communications (2021)
Чистое сокращение выбросов CO2 за счет реакций его термокаталитического и электрокаталитического превращения в стандартных и гибридных процессах.

- Брайан М. Тэкетт
- Элейн Гомес
- Цзингуан Г. Чен
Природный катализ (2019)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Что такое сжигание пропана? (с картинками)
`;
Эндрю Кирмайер
Воспламенение пропана происходит при контакте с кислородом. Пропан — это углеводород, называемый алканом, который при сгорании обычно образует воду и углекислый газ. Возгорание происходит, когда пропан становится легковоспламеняющимся; обычно для этого требуется искра, если только воздух не достаточно горячий. Температура должна быть не менее 920°F (около 433°C), чтобы он мог спонтанно загореться, а после воспламенения пропан может гореть при температуре до -156°F (около -104°C). При контакте с воздухом пропан обычно должен составлять от 2% до 9%..6% смеси сгорает.
Если уровень кислорода низкий, пропан может воспламениться, но произойдет неполное сгорание. Образуются вода и углекислый газ, а также окись углерода, которая может быть ядовитой для человека. Хотя при сгорании пропана обычно выделяется много тепла, этот процесс может производить меньше отходов, чем сжигание бензина. Молекулярные связи пропилена и бутилена в пропане делают пламя видимым.
Образуются вода и углекислый газ, а также окись углерода, которая может быть ядовитой для человека. Хотя при сгорании пропана обычно выделяется много тепла, этот процесс может производить меньше отходов, чем сжигание бензина. Молекулярные связи пропилена и бутилена в пропане делают пламя видимым.
Сгорание пропана может происходить без искры, если воздух достаточно горячий. Если температура достигает 3,595 ° F (около 1979 ° C), однако воспламенение пропана маловероятно, и пламя пропана обычно перестает гореть. Правильное хранение важно, потому что пропан обычно тяжелее воздуха. Он опустится в низкую область, и горение пропана может быть вызвано, если газ вступит в контакт с запальником или другим источником воспламенения.
Он опустится в низкую область, и горение пропана может быть вызвано, если газ вступит в контакт с запальником или другим источником воспламенения.
Часто хранящийся в небольших контейнерах под давлением, пропан обычно испаряется при попадании в воздух. Грили для барбекю могут использовать пропан, чтобы поддерживать пламя, поэтому горение контролируется. Алкан иногда используется в двигателях внутреннего сгорания автобусов, поездов, а также в промышленном оборудовании, таком как вилочные погрузчики. Транспортные средства для отдыха, печи и различные виды обогревателей также могут использовать пропан. В легковых автомобилях 21 века также иногда используется пропан, который может быть чище бензина и может оставлять меньше отложений в двигателе.
В легковых автомобилях 21 века также иногда используется пропан, который может быть чище бензина и может оставлять меньше отложений в двигателе.
Несмотря на использование в двигателях, пропан для питания систем кондиционирования воздуха, предназначенных для работы с хладагентами, может быть опасен. Однако сжигание пропана часто необходимо для нефтехимического производства, производства полупроводников, питания аттракционов в тематических парках и заправки воздушных шаров. Помимо того, что он полезен во многих приложениях, он также относительно недорог и безопасен при правильном использовании. Пропан также не токсичен, но может вызвать удушье, если его вдохнуть намеренно.
Пропан также не токсичен, но может вызвать удушье, если его вдохнуть намеренно.
Домашний
Что такое пропан? Пропан – горючий природный углеводородный газ, способный вступать в реакцию с кислородом и использоваться в качестве топлива. Топливо — это вещества, которые реагируют с кислородом с выделением полезной энергии, состоящей в основном из тепла и света. (4)
(4)
Объяснение процесса сжигания пропана:
1- Во-первых, углерод в углеводороде пропана окисляется кислородом с образованием двуокиси углерода. (4)
2- Затем водород окисляется с образованием водяного пара. (4)
Реакцию можно обобщить следующими химическими и словесными уравнениями:
C3H8 (г) + 5O2 (г) = 3CO2 (г)+ 4h3O (г) + энергия
пропан + кислород = диоксид углерода + вода + энергия
[ Посмотрите видео 1 в нижней части страницы, чтобы получить краткое визуальное объяснение этого процесса. :
- Бесцветный (1)
- Без запаха (1)
- Нетоксичный (1)
- Температура кипения: -42 oC (1)
(2)
- Легковоспламеняющийся (9)
- Температура плавления: -188 oC (1)
- Жидкая форма легче воды. (1)
- Хранится в виде жидкости, плотность которой в 270 раз выше плотности газа.
 Хранение жидкости до тех пор, пока не понадобится газ, может облегчить проблемы с транспортировкой и хранением, с которыми сталкиваются некоторые другие газораспределители. Небольшое количество жидкости может произвести большое количество полезного газа. (3)
Хранение жидкости до тех пор, пока не понадобится газ, может облегчить проблемы с транспортировкой и хранением, с которыми сталкиваются некоторые другие газораспределители. Небольшое количество жидкости может произвести большое количество полезного газа. (3) - Пропан является жидкостью только в сжатом виде. Когда он выпущен, он немедленно испаряется и рассеивается в воздухе, избегая разливов. (3)
Химические свойства пропана:
- Состоит из 3 атомов углерода и 8 атомов водорода.
- Быстро сгорает с кислородом при воспламенении с выделением тепла, воды и углекислого газа.
- При полном сгорании образуются нетоксичные продукты вода и двуокись углерода.
- Неполное сгорание приводит к образованию ядовитого монооксида углерода и углерода (сажистого остатка) в дополнение к диоксиду углерода, воде и теплу.
- Неполное сгорание происходит только тогда, когда подача кислорода недостаточна или избыточна.
 (6)
(6) - Неполное сгорание газообразного пропана можно легко определить по частицам углерода, обычно называемым сажей.
[ Посмотрите видео 3 внизу страницы, чтобы увидеть, как пропан сгорает с кислородом ]
Чем полезно сжигание пропана?
Как он используется?
Газообразный пропан становится пригодным для использования путем сжатия в резервуарах и других емкостях в форме пара или газа, которые затем подключаются к приборам и другим пропановым установкам, требующим коммунальных услуг, которые вырабатываются в результате быстрой реакции этого газа с кислородом. (6)
Экономическое использование:
Газообразный пропан обычно используется в качестве источника тепла и замены более вредных газов, таких как метан и электричество, которые потребляют гораздо больше энергии и денег, чем пропан. (5) 9
Компании-поставщики пропана также получают большую прибыль благодаря популярности пропана как более чистого топлива.
Преимущества сжигания пропана:
Многие люди решают использовать пропан в качестве альтернативы другим неэкологичным видам топлива, поскольку он производит меньше парниковых газов, чем другие виды топлива. Преимущества реакции включают:
- Газовые выбросы реакции горения не так вредны для окружающей среды, как другие процессы сжигания топлива. (6)
- Согласно предыдущим исследованиям, использование пропана в качестве топлива может уменьшить смог, образующийся в выхлопных газах, максимум на 70%. (6)
- Пары или газ пропана не представляют опасности при случайном вдыхании. (6)
- Пропан не наносит вреда почве или воде, если он пролит, в отличие от нефти, пролитое масло может повлиять на дикую жизнь и природу на десятилетия вперед. (6)
- Пропан не загрязняет воздух. (6)
- Пропан имеет очень небольшой углеродный след, но очень эффективен. (7)
Чем вредно сжигание пропана?
Возможность причинения вреда:
Вред для окружающей среды и риск для здоровья:
Несмотря на всю славу использования пропана в качестве альтернативного топлива, в каждой ситуации есть свои плюсы и минусы. Идеальное горение пропана состоит из 4 частей пропана и 96 частей воздуха. Если подача пропана и воздуха находится в диапазоне 2,2 частей пропана и 97,8 частей воздуха и 9,6 частей пропана и 90,4 частей воздуха, произведенная реакция горения не будет иметь желаемого результата и может привести к перерасходу топлива или его израсходованию. (6)
Идеальное горение пропана состоит из 4 частей пропана и 96 частей воздуха. Если подача пропана и воздуха находится в диапазоне 2,2 частей пропана и 97,8 частей воздуха и 9,6 частей пропана и 90,4 частей воздуха, произведенная реакция горения не будет иметь желаемого результата и может привести к перерасходу топлива или его израсходованию. (6)
Если соотношение пропана к кислороду ниже 4 частей кислорода на 96 частей воздуха, неполное сгорание проявляется в виде пламени, которое, кажется, отрывается от горелки и потенциально может погаснуть.
Но если отношение пропана к кислороду выше идеального 4 к 96, неполное сгорание проявляется не в подъеме пламени, а скорее в возгорании богатого горения, которое можно легко распознать по необычно большому размеру пламени и аномальный, чрезмерно желтый цвет пламени. (6)
Результат этой реакции неполного сгорания может включать выбросы угарного газа, который является токсичным газом и ведущим ядовитым убийцей. Вдобавок к силе и ужасу этого газа, угарный газ бесцветен, в основном безвкусен и не имеет запаха; Есть 2 способа узнать, заражен ли ваш дом или район угарным газом: (6)
- Детектор угарного газа, который издает пронзительный крик, когда в этом районе присутствует угарный газ, сигнализируя тем, кто живет в доме что эвакуация должна состояться.
 (6)
(6) - Увядание или внезапная смерть растений. Угарный газ так же воздействует на другие живые существа, как и на человека. (6)
[Посмотрите видео 2 внизу страницы, чтобы лучше понять разницу между процессом полного и неполного сгорания]
{ См. изображение 1, чтобы понять, как увядают растения, подвергшиеся воздействию угарного газа}
Хранение Опасности пропана:
- Утечка и воздействие огня могут привести к взрыву. (8)
- Пропан тяжелее воздуха; поэтому в случае разлива пропан осядет на землю и скапливается там, потенциально вызывая пожар. (8)
- Когда бак подвергается сильному нагреву, в нем может возрасти давление, и он взорвется. (9)
Утилизация Опасности пропана:
Использованные баллоны с пропаном необходимо утилизировать соответствующим образом, поскольку в предположительно пустом баллоне могут остаться остатки пропана. Неправильная утилизация резервуара может привести к пожару. (9)
Неправильная утилизация резервуара может привести к пожару. (9)
Опасные методы утилизации баллонов с пропаном, которых следует избегать:
- Вскрытие баллона с помощью горелки (9)
- Выбрасывание баллона в мусорный контейнер (9)
[ Для безопасной утилизации необходимо связаться с компанией-поставщиком ]
История
В Питтсбурге в 1910 году владелец автомобиля пожаловался доктору Уолтеру Снеллингу на то, что он купил полгаллона бензина, но к тому времени он получил домой половина суммы уже испарилась. Мужчина утверждал, что его обманули. (10) Затем доктор Снеллинг взялся за расследование этой тайны, наполнив кувшин бензином и закупорив его. Во время транспортировки кувшина доктор Снеллинг заметил, что пробка постоянно вылетает. Это простое наблюдение привело затем к открытию пропана. (13)
С 1912 по 1920 год пропан находился на пике своего развития, и использование этого газа в качестве топлива становилось все более и более распространенным среди людей. Первый автомобиль, работающий на пропане, был запущен в 1913 году; в 1915 г. пропан использовался в фонариках, а в 1920 г. пропана, наконец, стало достаточно, чтобы его можно было использовать для бытовых приборов и коммунальных услуг такого рода. (10) Доктор Снеллинг также обнаружил, что баллона, наполненного пропаном, может быть достаточно, чтобы осветить дом. на 3 недели! (11)
Первый автомобиль, работающий на пропане, был запущен в 1913 году; в 1915 г. пропан использовался в фонариках, а в 1920 г. пропана, наконец, стало достаточно, чтобы его можно было использовать для бытовых приборов и коммунальных услуг такого рода. (10) Доктор Снеллинг также обнаружил, что баллона, наполненного пропаном, может быть достаточно, чтобы осветить дом. на 3 недели! (11)
Интересные факты
- При утечке пропана не запускается; пропан рассеивается и испаряется, образуя плотный газ или пар. (19)
- Пропан является третьим по популярности топливом для автомобилей. (20)
- Использование пропана для производства предметов первой необходимости может сэкономить до половины денег, потраченных на электроприборы и другие коммунальные услуги. (20)
Видео 1: Краткое, наглядное объяснение того, что такое горение появления горения пропана. (15) | youtube.com/embed/Qoh5NqEW0yA?wmode=opaque» frameborder=»0″ allowfullscreen=»»> |
Видео 2: Молекулярный состав горения газа пропана. (14) |
Видео 3: Реакция газообразного пропана с кислородом при различных обстоятельствах. (16) |
Изображение 1: Увядшие растения после воздействия ядовитого угарного газа. (17)
Изображение 2: Молекулярный состав продуктов сгорания пропана. (18)
Ссылки
1. Общие свойства пропана. Лети со мной на Луну; 2014 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www. brisbanehotairballooning.com.au/faqs/education/110-propane.html
brisbanehotairballooning.com.au/faqs/education/110-propane.html
2. О пропане и СНГ. Пропановые углеводы. Авторские права; 2002–2014 [по состоянию на 14 ноября 2014 г.] Доступно с:
https://www.propanecarbs.com/propane.html
3. Как производятся продукты. Пропан. Адвамег, Инк; 2014 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www.madehow.com/Volume-3/Propane.htm
4. GCSE Bitesize. Использование углеродного топлива. Би-би-си; 2014 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www.bbc.co.uk/schools/gcsebitesize/science/ocr_gateway/carbon_chemistry/carbon_fuelsrev2.shtml
5. Daniels Propane, LLC. Пропановые системы и приборы для повседневного комфорта. Портленд: CT LIC; [по состоянию на 14 ноября 2014 г.] Доступно с:
http://www.danielspropane.com/propaneuses.html
6. Пропан 101. Экологически безопасный газ пропан. Авторские права; 2007–2011 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www. propane101.com/propanegreenenergyfuel.htm
propane101.com/propanegreenenergyfuel.htm
7. Канадская ассоциация производителей пропана. Экологические преимущества. ЭРАК; 2014 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www.propane.ca/en/about-propane/environmental-benefits
8. Claims Canada. Опасности пропана. Группа деловой информации; 2014 [по состоянию на 14 ноября 2014 г.] Доступно с:
http://www.claimscanada.ca/issues/article.aspx?aid=1000224990&er=NA
9. Адвокаты и расчеты. Недавний взрыв пропана. Интернет-правовые СМИ; 2001–2014 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www.lawyersandsettlements.com/lawsuit/propane-explosions.html#.VGZfw_TF-wE
10. Jackson Electric Cooperative. История пропана. Техас: Джексон Электрик Кооператив, Инк.; 2001–2007 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://jecec.com/JEC%20Web%20Page/index.htm
11. Базл. Факты о пропане. 2014 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www. buzzle.com/articles/facts-about-propane.html
buzzle.com/articles/facts-about-propane.html
12. Innovation Maison. Лес Энерджи. Galement la maison.bbc; 2008 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www.innovation-maison.com/Nouvel-article
13. Stonekor. Открытие пропана. ООО «Стоункор»; 2013 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://stonekor.com/passion-propane-equipment/
14. Youtube. Полное и неполное сгорание пропана.wmv. Ютуб, ООО. 2012 [по состоянию на 14 ноября 2014 г.] Доступно с:
https://www.youtube.com/watch?v=4Ekf71bApl4
15. Ютуб. Горение пропана (реакция и уравнение). Ютуб, ООО. 2013 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
https://www.youtube.com/watch?v=Qoh5NqEW0yA
16. Youtube.Make My LabWoRx Победитель Эрик Карлсон сжигает пропан! Ютуб, ООО. 2011 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
https://www.youtube.com/watch?v=VzGFpS7A9W0
17. USDA. Восточная лесная смотровая площадка. 2014 [по состоянию на 14 ноября 2014 г.] Доступно с:
2014 [по состоянию на 14 ноября 2014 г.] Доступно с:
http://www.fs.fed.us/wildflowers/index.shtml
18. Старкский кампус Кентского государственного университета. Уравновешивание химических уравнений. Кларк Эрли; 2008 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www.personal.kent.edu/~cearley/gen50/balance/balance.htm
19. Dassel’s. Факты о пропане, пропан — чистое топливо. Dassel’s Petroleum, Inc. 2009 [по состоянию на 14 ноября 2014 г.] Доступно по адресу:
http://www.dassels.com/propane-facts-propane-is-a-clean-fuel/
20. DeClerk LP gas. Пять забавных фактов о пропане. ДеКлерк сжиженный газ. 2013 [по состоянию на 14 ноября 2014 г.] Доступно с:
http://www.declerklpgas.com/2011/01/five-fun-facts-about-propane/
Опасности, связанные с пропаном – общие причины и действия после взрыва газа и пожара
Автор: Kalamazoo юрист по травмам, Стив Уэстон
Термин «природный газ» на самом деле охватывает несколько типов газов, включая пропан, бутан, этанол и метан. Пропан отделяют от этих других газов и продают для бытового и коммерческого использования. Он не имеет запаха и цвета и требует добавления отдушки, чтобы люди могли обнаружить его в случае утечки газа. Пропан находится под давлением в жидком состоянии для хранения и транспортировки и поэтому называется «сжиженным пропаном» или LP. Из-за этого давления даже небольшой выброс сжиженного пропана создаст серьезную опасность воспламенения или взрыва. В то время как природный газ широко используется в качестве экономичного способа обогрева домов и предприятий, а также в целях отдыха на открытом воздухе, существует множество опасностей пропана. И, к сожалению, эти опасности могут привести к серьезным ожогам, которые могут повлиять на всю оставшуюся жизнь пострадавшего.
Пропан отделяют от этих других газов и продают для бытового и коммерческого использования. Он не имеет запаха и цвета и требует добавления отдушки, чтобы люди могли обнаружить его в случае утечки газа. Пропан находится под давлением в жидком состоянии для хранения и транспортировки и поэтому называется «сжиженным пропаном» или LP. Из-за этого давления даже небольшой выброс сжиженного пропана создаст серьезную опасность воспламенения или взрыва. В то время как природный газ широко используется в качестве экономичного способа обогрева домов и предприятий, а также в целях отдыха на открытом воздухе, существует множество опасностей пропана. И, к сожалению, эти опасности могут привести к серьезным ожогам, которые могут повлиять на всю оставшуюся жизнь пострадавшего.
Безопасен ли пропан для моего дома?
Хотя сжиженный газ является чистым источником топлива для дома, его использование сопряжено с рядом неотъемлемых рисков. LP обычно используется в сельской местности и хранится под давлением в резервуаре на 500 галлонов. С помощью нескольких внешних регуляторов сжиженный пропан сбрасывается из баллона в дом, чтобы его можно было использовать в небольших бытовых приборах. Хотя использование сжиженного нефтяного газа может быть относительно безопасным, существует несколько опасностей, связанных с использованием пропана и сжиженного нефтяного газа, включая, помимо прочего, следующие:
С помощью нескольких внешних регуляторов сжиженный пропан сбрасывается из баллона в дом, чтобы его можно было использовать в небольших бытовых приборах. Хотя использование сжиженного нефтяного газа может быть относительно безопасным, существует несколько опасностей, связанных с использованием пропана и сжиженного нефтяного газа, включая, помимо прочего, следующие:
- Хранение больших количеств сжиженного пропана под высоким давлением в резервуаре для хранения вне дома рядом с домом.
- Необходимость в периодическом прекращении подачи сжиженного нефтяного газа из резервуара в дом по служебным заявкам или заявкам на отсутствие газа, что требует тщательной проверки на герметичность и испытания под давлением перед повторным вводом системы в эксплуатацию.
- Транспортировка и доставка значительных объемов сжиженного нефтяного газа в наружные жилые резервуары для хранения.
- Риск дисфункции или отказа регулятора из-за возраста, повреждения, замерзания или коррозии, что может привести к небезопасному давлению, превышающему то, с которым без утечек могут работать бытовые приборы.

Правила обращения с пропаном и меры безопасности
Поскольку сжиженный газ хранится под давлением в сжиженном состоянии, даже небольшая утечка может привести к значительному взрыву газа и возгоранию. Из-за неотъемлемых рисков, связанных с его доставкой, хранением и использованием, сжиженный пропан регулируется почти повсеместно принятыми стандартами и нормами безопасности в Соединенных Штатах.
Два основных кодекса и стандарта безопасности в США регулируются Национальной ассоциацией противопожарной защиты (NFPA) и известны как NFPA 54 — Национальный кодекс топливного газа и NFPA 58 — Кодекс сжиженного нефтяного газа. Штат Мичиган принял оба этих кодекса. Эти два кодекса регулируют практически каждый аспект хранения, доставки, установки, нагнетания давления, обслуживания, испытаний и использования систем сжиженного нефтяного газа.
Оба кодекса также предоставляют надлежащие методы и шаги для проведения надлежащей проверки безопасности. Это важные правила безопасности, потому что несоблюдение правил проверки герметичности и проверки давления, когда это необходимо, приводит к риску необнаруженных утечек и отказов системы, которые могут привести и приводят к катастрофическим результатам.
На протяжении многих десятилетий наша фирма неоднократно представляла интересы людей, выживших после ожогов, пострадавших в результате взрыва газа в жилых помещениях и пожара, вызванного тем, что испытания на утечку и давление либо никогда не проводились, либо проводились ненадлежащим образом.
Распространенные причины взрывов пропанового газа
По нашему опыту работы со случаями взрыва сжиженного нефтяного газа в жилых помещениях, наиболее распространенной причиной взрывов, пожаров, серьезных травм и смерти является то, что система сжиженного газа была введена в эксплуатацию без надлежащего давления и/или испытание на утечку. Практически в каждом таком случае правильно проведенное тестирование выявило бы проблему, а взрывов и пожаров, ранений и смертей можно было бы вообще избежать.
Несмотря на то, что сжиженный нефтяной газ смешивают с одорантом для придания отчетливого запаха тухлых яиц, домовладелец часто не знает об имеющейся утечке газа из-за:
- Если утечка происходит в части трубопровода, частично или полностью засыпанной землей.

- Когда утечка происходит в незанятом и редко используемом подвале под домом.
- Там, где вентиляция закрывает одорант.
- В случаях небольшой или постепенной утечки, приводящей к обонятельной усталости, т. е. способность продавать отдушку со временем снижается или исчезает.
Детекторы газа в доме имеют решающее значение по вышеуказанным причинам.
Меры предосторожности при использовании небольших баллонов с пропаном
Пропан используется не только в 500-галлонных баллонах для отопления домов; вы, вероятно, видели или использовали маленькие пропановые баллоны весом двадцать фунтов для обогревателей, грилей и других развлекательных целей. Эти баллоны или канистры с пропаном также сопряжены с присущими им рисками. Переполнение и ошибки при транспортировке — две наиболее распространенные причины взрыва 20-фунтовых баллонов с пропаном.
Переполнение часто происходит из-за чрезмерной зависимости от автоматических устройств, которые должны прекратить наполнение, когда цилиндр заполнен. Однако это не всегда работает по разным причинам, в том числе из-за неправильного использования сотрудников. При переполнении, даже незначительном, клапан давления на баллоне откроется, выпуская газ. Как указывалось ранее, даже небольшая утечка сжиженного нефтяного газа внутри замкнутого пространства, такого как, например, салон автомобиля, может привести к скоплению газа, достигающему взрывоопасности.
Однако это не всегда работает по разным причинам, в том числе из-за неправильного использования сотрудников. При переполнении, даже незначительном, клапан давления на баллоне откроется, выпуская газ. Как указывалось ранее, даже небольшая утечка сжиженного нефтяного газа внутри замкнутого пространства, такого как, например, салон автомобиля, может привести к скоплению газа, достигающему взрывоопасности.
При транспортировке небольших баллонов с пропаном крайне важно, чтобы они оставались в вертикальном положении во время транспортировки. Лежание на боку или опрокидывание на бок может привести к утечке газа. Ранее мы представляли семью, чья четырехлетняя дочь была пассажиром на заднем сиденье автомобиля. Сотрудник газовой компании положил на бок небольшой баллон с пропаном, из-за чего он протекал и заполнил багажник. Небольшая искра от двигателя подъема антенны багажника привела к воспламенению газа, в результате чего ребенок на заднем сиденье получил серьезные ожоги.
К сожалению, это не редкость. Не забывайте всегда перевозить небольшие баллоны с пропаном в вертикальном положении и закреплять их таким образом, чтобы они не опрокинулись во время транспортировки.
Не забывайте всегда перевозить небольшие баллоны с пропаном в вертикальном положении и закреплять их таким образом, чтобы они не опрокинулись во время транспортировки.
Что делать после взрыва пропана и пожара
Мы очень надеемся, что больше не будет серьезных травм и смертей в результате взрывов и пожаров сжиженного нефтяного газа. Однако, когда они происходят, защита прав пострадавшего лица на получение компенсации за свои травмы имеет важное значение. Расследование происхождения и причин пожара начнется практически сразу после взрыва газа и пожара:
- Откуда произошел взрыв?
- Что послужило причиной взрыва?
- Как произошел взрыв или пожар?
Адвокат и автор ожоговых травм Стив Уэстон
Лица, получившие ранения в результате взрыва пропана, должны как можно скорее после несчастного случая обратиться за квалифицированной юридической помощью. Опытные адвокаты по несчастным случаям с ожогами будут иметь доступ к опытно обученным источникам возгорания и вызовут экспертов, которые будут усердно работать от вашего имени, чтобы ответить на предыдущие вопросы.


 1.2).
1.2).
 ru/oborudovanie/molekula-propana.html
ru/oborudovanie/molekula-propana.html Плотность жидких пропан-бутановых смесей во многом определяется составом углеводородов и температурой. С ростом температуры происходит объемное расширение, и плотность жидкости уменьшается. С ростом давления объем жидкости пропана и бутана сжимается.
Плотность жидких пропан-бутановых смесей во многом определяется составом углеводородов и температурой. С ростом температуры происходит объемное расширение, и плотность жидкости уменьшается. С ростом давления объем жидкости пропана и бутана сжимается.