Физико-технические особенности сварочных газов | НВПХ
Нефтеуглеводороды, в частности, пропан, бутан и их смеси, ацетилен, а также водород нашли широкое применение в различных сферах производства в качестве основных и вспомогательных соединений. Различные газы успешно используются как в качестве источников тепловой энергии, так и хладагентов. Одним из направлений их применения является сварочное дело и резка металла. Выбор газа в основном зависит от требуемой температуры сгорания.
Пропан и пропан-бутановые смеси
Углеводородные газы из группы алканов используются в тех случаях, когда нет необходимости в слишком высокой температуре газопламенной обработки: сварка тонкой стали и легкоплавких металлов, кислородная резка, пайка припоями и др. Пропан и бутан – это неядовитые и достаточно инертные газы, получаемые в качестве побочных продуктов при переработке нефти. При определенных условиях они взаимодействуют с кислородом, азотной кислотой и диоксидом азота, галогенами. При низкой температуре (-42 °С для пропана, -0,5 °С для бутана) и высоком давлении переходят в жидкое состояние.
При низкой температуре (-42 °С для пропана, -0,5 °С для бутана) и высоком давлении переходят в жидкое состояние.
Чаще всего используются пропан-бутановые смеси в соотношении 3:7 соответственно. Они обладают повышенной теплотворной способностью, а тепловая мощь сгорания в кислороде эффективнее, чем у ацетилена, но из-за небольшой скорости, с которой распространяется пламя, температура пламени меньше. В случае утечки газы скапливаются внизу помещения и могут, что может привести к образованию взрывоопасных концентраций.
Ацетилен
Ацетилен относится к ненасыщенным углеводородам, чем обусловлена его химическая активность. Соединение вступает в многочисленные реакции присоединения, цикломеризации, димеризации, окисления. Отличается резким запахом. Температура сжижения около -82 °С. При его сгорании требуется больше кислорода, чем для пропана и бутана. Для ацетилена свойственна высокая интенсивность горения, которая снижается при наличии в нем побочных веществ.
Водород
В промышленности газ получают различными способами: железопаровым, электролизом, конверсией. В зависимости концентрация чистого вещества находится в пределах 95 – 99,8 об. %. Температура сжижения -252 °С. Используется при кислородной разделительной резке в присутствии воды, сварке свинца, безокислительной пайке стали.
В зависимости концентрация чистого вещества находится в пределах 95 – 99,8 об. %. Температура сжижения -252 °С. Используется при кислородной разделительной резке в присутствии воды, сварке свинца, безокислительной пайке стали.
Технические характеристики газов: сравнительная таблица
|
Параметр |
Пропан-бутановая смесь |
Ацетилен |
Водород |
|---|---|---|---|
|
Плотность при температуре 20 °С и давлении 0,1 МПа, кг/м3 |
2,21 |
1,091 |
0,084 |
|
Температура воспламенения в кислороде, °С |
500 |
240-630 |
510 |
|
Низшая теплотворная способность, кДж/м3 |
88800 |
52800 |
10800 |
|
Скорость распространения пламени в смеси с кислородом, м/с |
4,5 |
13,5 |
— |
Меры безопасности
В связи с большой взрывоопасностью сварочных газов предъявляются особые требования к условиям и помещениям проведения работ, хранению газовых баллонов. Особое внимание уделяется отсутствию источников возникновения пламени, искры, легковоспламеняющихся веществ. Помещения оборудуются специальными осветительными приборами, системами вентиляции и кондиционирования. Сварочные работы проводятся в присутствии более двух человек при обязательном оформлении наряда-допуска.
Особое внимание уделяется отсутствию источников возникновения пламени, искры, легковоспламеняющихся веществ. Помещения оборудуются специальными осветительными приборами, системами вентиляции и кондиционирования. Сварочные работы проводятся в присутствии более двух человек при обязательном оформлении наряда-допуска.
Стоимость технических газов
Кислород технический
400
Углекислота, двуокиси углерода
3 500
Ацетилена технический
7 500
Азот, газ в баллонах
2 600
Аргон, газ в баллонах
2 500
Гелий, газ в баллонах
17 000
Пропан, газ в баллонах
1 500
Сварочная смесь
2 700
Газоанализатор пропан
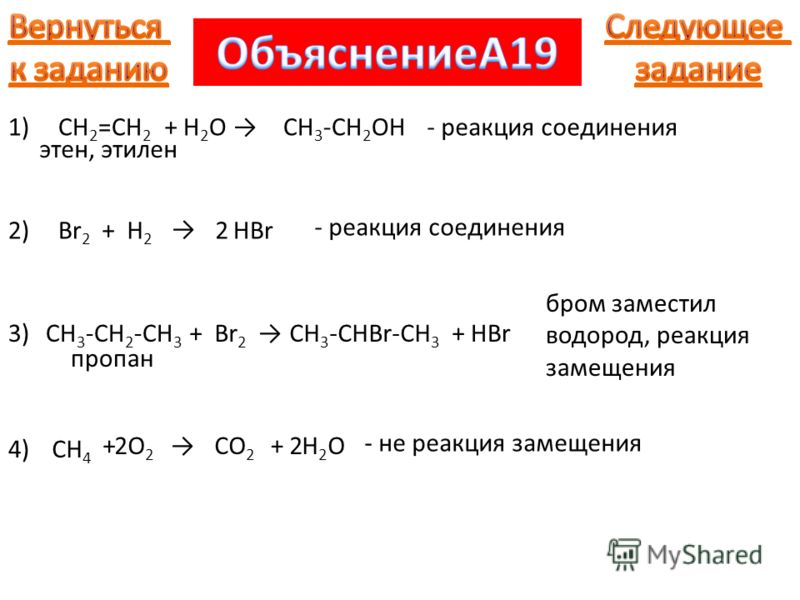
 Способен оказывать слабовыраженное наркотическое воздействие. В небольшом количестве содержится в природном газе, образуется в процессе нефтепереработки – каталитического крекинга, может быть выделен из попутного (жирного) природного газа или в виде побочного продукта химических производств.
Способен оказывать слабовыраженное наркотическое воздействие. В небольшом количестве содержится в природном газе, образуется в процессе нефтепереработки – каталитического крекинга, может быть выделен из попутного (жирного) природного газа или в виде побочного продукта химических производств. Химические свойства
Невысокая химическая активность пропана обусловлена, характерной для алканов, прочностью внутримолекулярных связей – неполярной между атомами углерода и малополярной связи углерода с водородом. При обычных условиях пропан не реагирует с концентрированными кислотами, расплавами и концентрированными растворами щелочей, со всеми галогенами, кроме фтора, щелочными металлами, перманганатом и дихроматом калия в кислой среде.
Этому углеводороду свойственно химическое взаимодействие с участием радикалов, например, процесс галогенирования начинается с превращения нейтральных атомов галогена в радикалы под воздействием температуры или ультрафиолетового излучения. Радикалы отрывают атом водорода от молекулы пропана, превращая его в свободный пропил, который, в свою очередь, увеличивает количество радикалов галогена. Такая цепная реакция заканчивается замещением атомов водорода галогенами. Кроме галогенирования, для пропана характерны реакции нитрирования, дегидрирования в присутствии катализаторов и окисления.
Радикалы отрывают атом водорода от молекулы пропана, превращая его в свободный пропил, который, в свою очередь, увеличивает количество радикалов галогена. Такая цепная реакция заканчивается замещением атомов водорода галогенами. Кроме галогенирования, для пропана характерны реакции нитрирования, дегидрирования в присутствии катализаторов и окисления.
Физические характеристики
В нормальных условиях при температуре 20°C пропан находится в газообразном состоянии, его температура плавления составляет -187,6°C, кипит углеводород при -42,1°C. Молярная масса соединения равна 44,1 г/моль, плотность газообразной фазы при давлении 1 атм – 1,8641 кг/м3, плотность в жидком состоянии – 510 кг/м
Смесь пропана с воздухом в концентрации от 2,1 до 9,5% является взрывоопасной, при достижении температуры в 466°C начинается процесс самовоспламенения. Углеводород не растворяется в полярных растворителях, в том числе и в воде, но легко переходит в раствор при применении неполярных жидкостей органического происхождения – бензол, метанол, ацетон и т. д.
д.
Применение
Пропан широко востребован в качестве топлива, в том числе как горючее для автотранспорта, красные газовые баллоны со сжиженной смесью пропана и бутана хорошо известны в тех регионах, где недоступен магистральный газ. Высокая температура горения около 2000°C, позволяет применять пропан в газовых резаках и горелках для сварочных работ по металлу.
В пищевой индустрии химические особенности пропана используются для обработки масел и растворения ароматизаторов, его наличие в пищевых продуктах обозначается, как добавка E944. В смеси с изобутаном осушенный пропан представляет собой экологичный хладагент с минимальным отрицательным воздействием на озоновый слой. Пропан играет важнейшую роль в производстве органических материалов – полипропилена и растворителей, также он эффективен в качестве пропеллента аэрозольных емкостей.
Пропан считается малоопасным соединением и относится 4 классу по вредному влиянию на организм, тем не менее превышение НКПР могут вызвать серьезные последствия для здоровья, вплоть до летального исхода.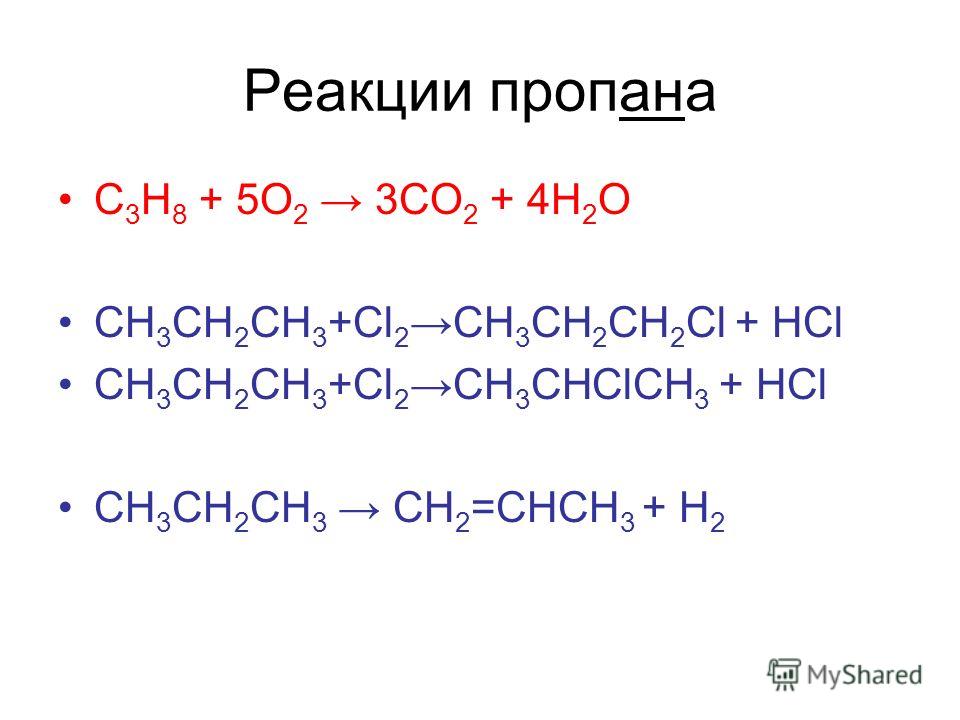 В легкой форме газ вызывает наркотическое опьянение, при большой концентрации смерть наступает после нескольких вздохов.
В легкой форме газ вызывает наркотическое опьянение, при большой концентрации смерть наступает после нескольких вздохов.
Для контроля производственной зоны, компания ИНКРАМ предлагает:
— многоблочные стационарные системы непрерывного действия СКВА-01М с детекторами пропана ГР1.0
— газоанализатор пропана АРП1.0
Молекула гексана
Для просмотра молекулы пропана в 3D —>>в 3D с Jsmol
A трехуглеродный алкан, пропан иногда полученный из других нефтепродуктов во время добычи нефти или природных переработка газа. Пропан имеет химическое Формула: C 3 H 8
Когда
обычно продается в качестве топлива, он также известен как сжиженная нефть
газа (СНГ или сжиженный газ) и представляет собой смесь пропана с меньшим
количества пропилена, бутана и бутилена,
плюс одорант этилмеркаптан, чтобы обеспечить обычно без запаха
пропан нюхать.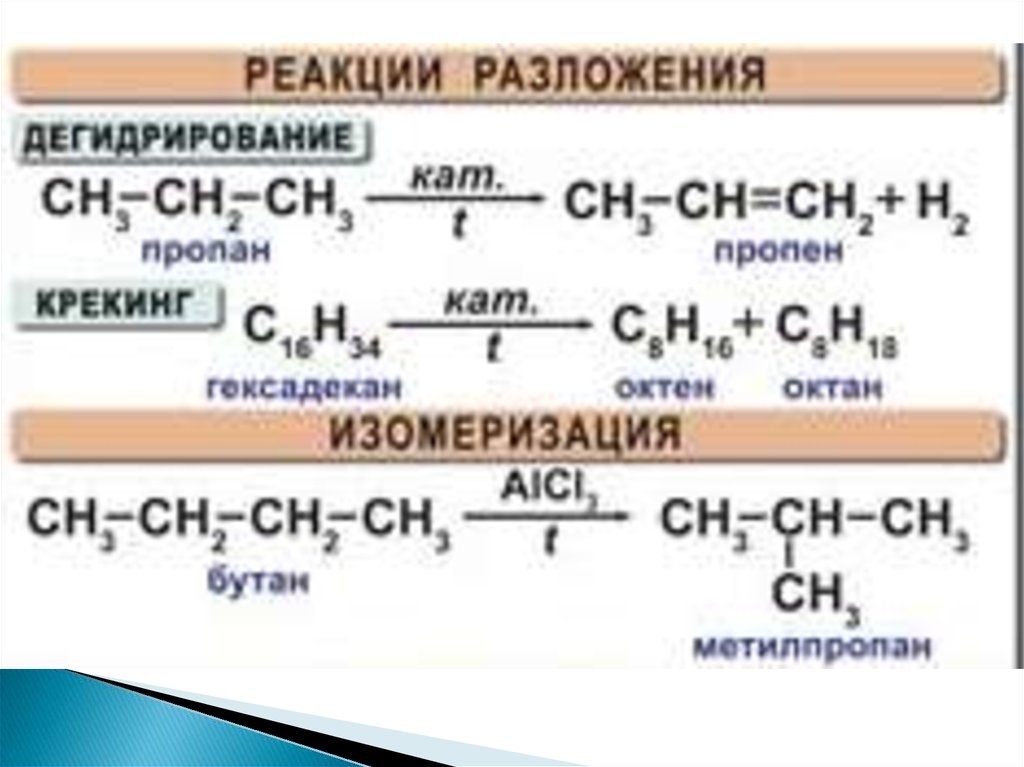
Свойства и реакции
Пропан подвергается реакциям горения аналогичным образом к другим алканам. В присутствии избытка кислорода пропан сгорает с образованием воды и углекислого газа.
- C 3 H
Когда недостаточно кислорода для полного сгорания,
пропан сгорает с образованием воды и углерода
монооксид.
- 2 C 3 H 8 + 7 O 2 † 6C О + 8 Н 2 О + тепло
В отличие от природного газа пропан тяжелее воздуха (в 1,5 раза плотнее). В сыром виде пропан тонет и скапливается на пол. Жидкий пропан превращается в пар при атмосферном давление и выглядит белым из-за конденсации влаги из воздух.
При правильном сгорании пропан выделяет около 2500 БТЕ на кубический фут газа (91600 БТЕ на галлон жидкости). полная теплота сгорания одного нормального кубометра пропана составляет около 50 мегаджоулей (€13,8 кВтч) или 101 МДж/м3. в единицах СИ.
Пропан нетоксичен; однако при злоупотреблении в качестве ингалятора
это представляет небольшой риск удушья из-за кислородного голодания.
Также необходимо отметить, что товарный продукт содержит углеводороды. кроме пропана, что может увеличить риск. Пропан и его смеси
может вызвать легкое обморожение при быстром расширении.
кроме пропана, что может увеличить риск. Пропан и его смеси
может вызвать легкое обморожение при быстром расширении.
Сгорание пропана намного чище бензина, однако не такой чистый, как природный газ. Наличие связей С-С, плюс множественные связи пропилена и бутилена создают органические выхлопы помимо углекислого газа и водяного пара во время типичного горение. Эти связи также вызывают горение пропана с видимое пламя.
См. также:
Метан Этанол Этан Метанол Бутан Декан Гексан Октан Пропан Пентан
Ссылки
1- Молекула пропана — PubChem
2- Центр данных по альтернативным видам топлива — пропан
КАКИЕ КУЛИНАРНЫЕ ШКОЛЫ В АМЕРИКЕ ЛУЧШИЕ?
——
КОЛЛЕДЖИ С ПРОГРАММАМИ ПИЩЕВОЙ НАУКИ
Пропан — Энергетическое образование
Энергетическое образованиеМеню навигации 9013 1 ИСТОЧНИКИ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕИНДЕКС
Поиск
Рис. 1. Модель заполнения пространства молекулой пропана. Черные сферы представляют собой углерод, а белые сферы представляют собой водород [1]
1. Модель заполнения пространства молекулой пропана. Черные сферы представляют собой углерод, а белые сферы представляют собой водород [1] Пропан — это алкан с химической формулой C 3 H 8 . Как тип углеводорода, он может подвергаться горению углеводородов с выделением тепла. Пропан является одним из углеводородных компонентов сырого природного газа, который является одним из видов ископаемого топлива. [2] Пропан обычно удаляют из природного газа перед отправкой потребителям, но он также продается отдельно как отдельное топливо.
Рис. 2. Стандартный резервуар для хранения пропана. [3]При потреблении пропан обычно находится в газообразном состоянии. Однако обычно он хранится в виде сжиженного газа пропана в резервуарах, подобных показанному на рисунке 2. Пропан имеет одну из самых высоких плотностей энергии (50,3 МДж/кг) среди всех углеводородов, уступая только метану. [4]
Пропан — это углеводород, обычно используемый в бытовых условиях.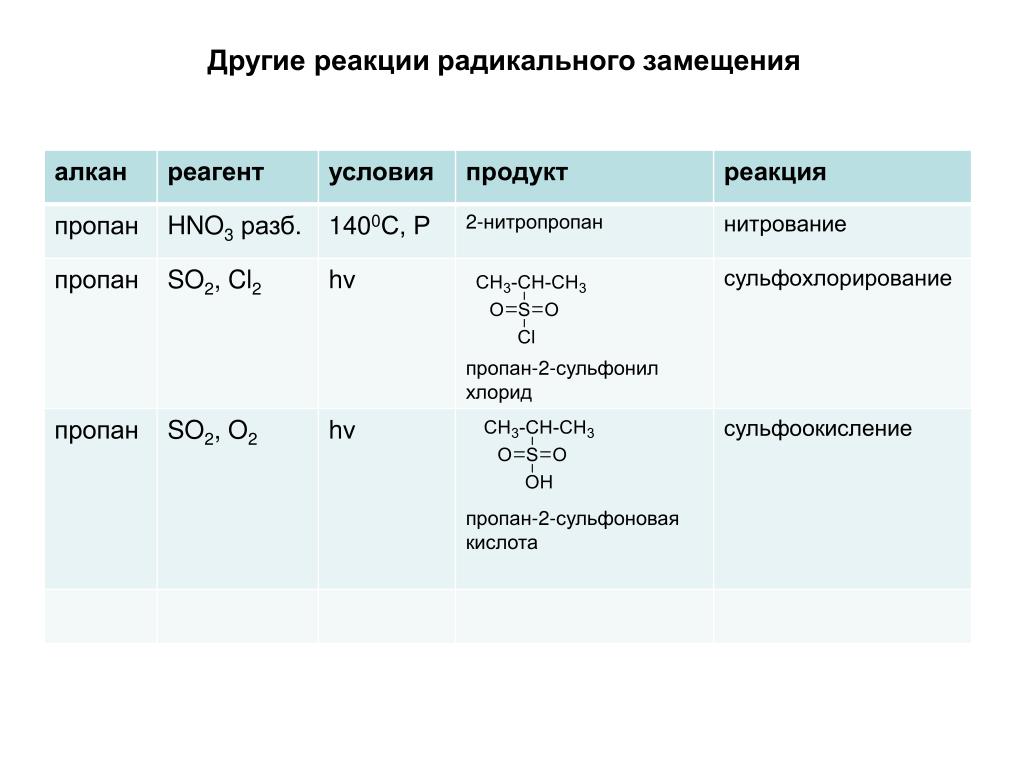 Обычно это наблюдается в таких приборах, как барбекю, обогреватели для патио и походные печи.
Обычно это наблюдается в таких приборах, как барбекю, обогреватели для патио и походные печи.
Свойства
Ниже приведена таблица некоторых основных свойств пропана.
| Химическая формула | C 3 H 8 |
| Молекулярная масса | 44,1 г/моль |
| Плотность энергии | 50,3 МДж/кг [4] |
| Температура плавления | -190 o C [5] |
| Температура кипения | -42 o C [5] |
Реакция горения
Пропан высвобождает свою химическую энергию при сгорании углеводородов. Ниже представлена анимация горения углеводородов, показывающая результирующую реакцию, происходящую при соединении пропана с кислородом.
Реакция горения углеводородов высвобождает тепловую энергию и является примером экзотермической реакции.