Барий и его соединения незаменимы в промышленности и медицине
Барий — серебристый мягкий и хрупкий металл, простой элемент таблицы  Менделеева. Металл очень активный, поэтому в чистом виде не встречается, только в составе минералов. Промышленной добыче подлежат барит и витерит. Относится к группе щелочноземельных, химически активных металлов. Легко взаимодействует с неконцентрированными кислотами, галогенами, водородом, аммиаком, фосфором. Горюч на воздухе при небольшом нагревании. Чистое вещество можно хранить, только изолировав от воздуха, например, под слоем керосина или парафина.
Менделеева. Металл очень активный, поэтому в чистом виде не встречается, только в составе минералов. Промышленной добыче подлежат барит и витерит. Относится к группе щелочноземельных, химически активных металлов. Легко взаимодействует с неконцентрированными кислотами, галогенами, водородом, аммиаком, фосфором. Горюч на воздухе при небольшом нагревании. Чистое вещество можно хранить, только изолировав от воздуха, например, под слоем керосина или парафина.
Растворимые соединения бария (хлорид, перхлорат, нитрид, нитрат, хлорат) очень ядовиты, вызывают тяжелые отравления и смерть, если не оказана своевременная помощь. В качестве антидота используют сульфаты магния или натрия в растворах (для промывания желудка, питье, внутривенно), которые переводят токсичные соли в безопасные нерастворимые.
Это интересно
Советская станция «Луна-1» в 1959-м году распылила пары бария, которые были ионизированы солнцем и превратились в плазменное облако, имитирующее комету. Зарубежные ученые распыляли мелкодисперсный порошок бария для изучения магнитного поля земли и уникального явления — полярного сияния.
Применение
— Сплав бария с алюминием используется для поглощения газов в вакуумных электронных приборах. Никелевый сплав используется в радиолампах, в свечах зажигания карбюраторов. При выплавке свинца и меди добавка Ba помогает связать примеси. Добавление бария в типографские свинцовые сплавы увеличивает их твердость. Ввод реактива в металлические теплоносители позволяет уменьшить их коррозионное воздействие на трубопроводы.
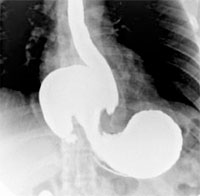 — Барий сернокислый (сульфат бария) входит в состав белой краски, как наполнитель резин, керамики, лаков и красок; применяется при изготовлении дорогой плотной бумаги, буровых растворов, свинцово-кислотных аккумуляторов. Соединение хорошо поглощает рентгеновские и гамма-лучи, применяется в медицине как контрастный раствор при рентгеноскопии ЖКТ. В атомной энергетике входит в состав баритобетона для строительства атомных объектов, так как стены из баритобетона способны поглощать радиацию.
— Барий сернокислый (сульфат бария) входит в состав белой краски, как наполнитель резин, керамики, лаков и красок; применяется при изготовлении дорогой плотной бумаги, буровых растворов, свинцово-кислотных аккумуляторов. Соединение хорошо поглощает рентгеновские и гамма-лучи, применяется в медицине как контрастный раствор при рентгеноскопии ЖКТ. В атомной энергетике входит в состав баритобетона для строительства атомных объектов, так как стены из баритобетона способны поглощать радиацию. — Титанат бария — сегнетоэлектрик, применяемый в производстве пьезоизлучателей, пьезомикрофонов, керамических конденсаторов.
— Оксид бария необходим для емких аккумуляторов, катодов в лучевых мониторах, телевизорах. В атомной энергетике входит в состав стекла, которым покрывают урановые стержни.
— Карбонат применяется при выплавке стекол, в составе эмалей и глазурей, как яд для грызунов.
— Сульфид используется при дублении шкур, в производстве сероводорода, как составная часть люминофоров, белой краски.
— Пероксид, хлорат, нитрат применяются в пиротехнике. Хлорат и нитрат дают

— Хлористый барий применяют для получения сверхчистых алюминия и магния; пигментов и красителей; керамики; для закалки стали; для травли грызунов; в кожевенной индустрии. С помощью хромата бария химическим методом получают O2 и h3; на его основе изготавливают желтые красители и пигменты.
— Фторид бария входит в состав электролита фторионных аккумуляторов; из его монокристаллов изготавливают оптические призмы и линзы.
— Тетрацианоплатинат применяется для покрытия светящихся экранов при работе с радиоактивным излучением (реактив флюоресцирует под воздействием радиации).
— Тиосульфат — пигмент жемчужного цвета, подходит для имитации перламутра.
— Перхлорат бария — популярный осушитель.
— Соединения бария используются при получении радия из урановой руды.
В магазине химических реактивов и оборудования «ПраймКемикалсГрупп» можно с доставкой и по выгодным ценам купить сернокислый, хлористый, азотнокислый барий и гидроокись бария. В продаже широко представлены различные реактивы и лабораторная посуда.
Барий — это… Что такое Барий?
| Внешний вид простого вещества | |
|---|---|
| Мягкий, слегка вязкий серебристо-белый металл | |
| Свойства атома | |
| Имя, символ, номер | Барий / Barium (Ba), 56 |
| Атомная масса (молярная масса) | 137,327 а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 6s2 |
| Радиус атома | 222 пм |
| Химические свойства | |
| Ковалентный радиус | 198 пм |
| Радиус иона | (+2e) 134 пм |
| Электроотрицательность | 0,89 (шкала Полинга) |
| Электродный потенциал | -2,906 |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 502,5 (5,21) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 3,5 г/см³ |
| Температура плавления | 1 002 K |
| Температура кипения | 1 910 K |
| Теплота плавления | 7,66 кДж/моль |
| Теплота испарения | 142,0 кДж/моль |
| Молярная теплоёмкость | 28,1[1] Дж/(K·моль) |
| Молярный объём | 39,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая |
| Параметры решётки | 5,020 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) (18.4) Вт/(м·К) |
Ба́рий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий (CAS-номер: 7440-39-3) — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
История
Барий был открыт в виде оксида BaO в 1774 г. Карлом Шееле и Юханом Ганом[2]. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый», так как его оксид (BaO) был охарактеризован, как имеющий необычно высокую для таких веществ плотность.
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Природный барий состоит из смеси семи стабильных изотопов:
Получение
Основное сырье для получения бария — баритовый концентрат (80-95 % BaSO4), который в свою очередь получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
Металлический барий получают из оксида восстановлением алюминием в вакууме при 1200—1250 °C:
Очищают барий перегонкой в вакууме или зонной плавкой.
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объемно-центрированной решеткой (параметр а = 0,501 нм), выше устойчив β-Ba.
Твердость по минералогической шкале 1,25.[3]
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксид бария BaO и нитрид бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который в свою очередь с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
С жидким аммиаком дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углем.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[4].
Соединения бария окрашивают пламя в желто-зеленый цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространенных типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
Применение соединений бария в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твердый неправильный пульс, судороги, позже возможны и параличи, синюха лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжелого отравления смерть наступает внезапно или в течение одних суток. Тяжелые отравления наступают при приеме внутрь 0,2 — 0,5 г солей бария, смертельная доза 0,8 — 0,9 г.
Для оказании первой помощи необходимо промыть желудок 1%-ным раствором сульфата натрия или магния. Клизмы из 10%-ных растворов тех же солей. Приём внутрь раствора тех же солей (20,0 ч. соли на 150,0 ч. воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10-20 мл 3%-ного раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
См. также
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 241. — 623 с. — 100 000 экз.
- ↑ Барий. // Популярная библиотека химических элементов. — М.: Издательство «Наука», 1977.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
Ссылки
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
 |
Барий — Википедия
| Внешний вид простого вещества | |
|---|---|
 Мягкий, вязкий серебристо-белый металл | |
| Свойства атома | |
| Название, символ, номер | Барий / Barium (Ba), 56 |
| Атомная масса (молярная масса) | 137,327(7)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 6s2 |
| Радиус атома | 222 пм |
| Химические свойства | |
| Ковалентный радиус | 198 пм |
| Радиус иона | (+2e) 134 пм |
| Электроотрицательность | 0,89 (шкала Полинга) |
| Электродный потенциал | -2,906 |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 502,5 (5,21) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 3,5 г/см³ |
| Температура плавления | 1 002 K |
| Температура кипения | 1 910 K |
| Уд. теплота плавления | 7,66 кДж/моль |
| Уд. теплота испарения | 142,0 кДж/моль |
| Молярная теплоёмкость | 28,1[2] Дж/(K·моль) |
| Молярный объём | 39,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 5,020 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) (18.4) Вт/(м·К) |
| Номер CAS | 7440-39-3 |
Ба́рий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
История
Барий был открыт в виде оксида BaO в 1774 г. Карлом Шееле и Юханом Ганом[3]. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый».
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Природный барий состоит из смеси семи стабильных изотопов: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba. Последний является самым распространённым (71,66 %). Известны и радиоактивные изотопы бария, наиболее важным из которых является 140Ba. Он образуется при делении ядер урана, тория и плутония.
Получение
Основное сырьё для получения бария — баритовый концентрат (80-95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
- B a S O 4 + 4 C → B a S + 4 C O {\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}}
- B a S O 4 + 2 C H 4 → B a S + 2 C + 4 H 2 O {\displaystyle {\mathsf {BaSO_{4}+2CH_{4}\rightarrow BaS+2C+4H_{2}O}}}
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
- B a S + 2 H 2 O → B a ( O H ) 2 + H 2 S ↑ {\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}}
- B a S + H 2 O + C O 2 → B a C O 3 + H 2 S ↑ {\displaystyle {\mathsf {BaS+H_{2}O+CO_{2}\rightarrow BaCO_{3}+H_{2}S\uparrow }}}
- B a C O 3 → B a O + C O 2 {\displaystyle {\mathsf {BaCO_{3}\rightarrow BaO+CO_{2}}}}
Получают металлический барий электролизом безводного расплава хлорида бария:
- B a C l 2 → B a + C l 2 {\displaystyle {\mathsf {BaCl_{2}\rightarrow Ba+Cl_{2}}}}
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объёмно-центрированной решёткой (а = 0,501 нм), выше устойчив β-Ba[источник не указан 1712 дней].
Твёрдость по шкале Мооса 1,25[4].
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
- B a + 2 H 2 O → B a ( O H ) 2 + H 2 ↑ {\displaystyle {\mathsf {Ba+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}\uparrow }}}
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах[5].
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который, в свою очередь, с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
- 6 B a + 2 N H 3 → 3 B a H 2 + B a 3 N 2 {\displaystyle {\mathsf {6Ba+2NH_{3}\rightarrow 3BaH_{2}+Ba_{3}N_{2}}}}
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
- B a 3 N 2 + 2 C O → B a ( C N ) 2 + 2 B a O {\displaystyle {\mathsf {Ba_{3}N_{2}+2CO\rightarrow Ba(CN)_{2}+2BaO}}}
С жидким аммиаком дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
- [ B a ( N H 3 ) 6 ] → B a ( N H 2 ) 2 + 4 N H 3 + H 2 {\displaystyle {\mathsf {[Ba(NH_{3})_{6}]\rightarrow Ba(NH_{2})_{2}+4NH_{3}+H_{2}}}}
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углем.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[6].
Соединения бария окрашивают пламя в желто-зелёный цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
- Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
- Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
- Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
- Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
- Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
- Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
- Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
- Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
- Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
- Применение в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, фторид, иодид, бромид, сульфид, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твёрдый неправильный пульс, судороги, позже возможны и параличи, синюшность лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжёлого отравления смерть наступает внезапно или в течение одних суток. Тяжёлые отравления наступают при приёме внутрь 0,2 — 0,5 г солей бария, смертельная доза 0,8 — 0,9 г.
Для оказании первой помощи необходимо промыть желудок 1%-ным раствором сульфата натрия или магния. Клизмы из 10%-ных растворов тех же солей. Приём внутрь раствора тех же солей (20,0 ч. соли на 150,0 ч. воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10—20 мл 3%-ного раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 241. — 623 с. — 100 000 экз.
- ↑ Барий. // Популярная библиотека химических элементов. — М.: Издательство «Наука», 1977.
- ↑ Поваренных А. С. Твёрдость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Аналитическая химия бария. — Москва : Наука, 1977.
Литература
Ссылки
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
Барий — Знаешь как
Что такое барий
Содержание статьи
(Barium; от греч.тяжелый), Ва — хим. элемент II группы периодической системы элементов; ат. н. 56, ат. м. 137,34. Серебристо-белый металл. В соединениях проявляет степень окисления +2. Природный барий состоит из семи стабильных изотопов, среди к-рых преобладает изотоп 138Ва (71,66%). Барий в виде окиси открыл в 1774 швед, химик К. Шееле.
Металлический барий получил в 1808 англ. химик Г. Дэви. Содержание бария в земной коре — 5 X 10 % В свободном состоянии в природе не встречается. Из минералов пром. значение имеют барит и менее распространенный витерит. Важнейшие неорганические соединения: окись BaO, перекись BaO2 , гидроокись Ва (ОН)2,карбонат ВаС03, сульфат BaS04 и хлорид ВаСl2. Кристаллическая решетка Бария кубическая объемноцентрированная с периодом а = 5,019 А;плотность 3,76 г/см3; tпл 710° С; tкип 1637 -1640° С; температурный коэфф линейного расширения (т-ра 0 — 100° С) 1,9 · 10 град ; удельная теплоемкость 0,068 кал/г · град; удельное электрическое сопротивление 6 · 10-5 ом · см, твердость по Бринеллю 4,2, по шкале Мооса 2. По хим. св-вам сходен с кальцием, стронцием и радием. На воздухе быстро окисляется. При нагревании на воздухе легко воспламеняется и сгорает. Энергично разлагает воду. С водородом образует гидрид ВаН2. При нагревании соединяется непосредственно с азотом, серой и галогенами. Основным сырьем для получения бария и его соединений служит барит, к-рый восстанавливают углем в пламенных печах.
Образующийся растворимый сульфид бария перерабатывают на др. соли металла. Металлический барий получают термическим восстановлением его окиси порошком алюминия при т-ре 1100— 1200° С Процесс ведут в электровакуумных аппаратах периодического действия, где последовательно проходят восстановление, отгонка, конденсация и отливка металла в слиток.
Технический продукт содержит 96—98% металла. Двойной перегонкой в вакууме при т-ре 900° С содержание примесей снижают до 1 X 10—4%. Сплавы бария получают электролизом расплава смеси хлоридов. Практическое применение металлического бария невелико. Барий и его сплавы с магнием и алюминием используют для поглощения остаточных газов в технике высокого вакуума (см. Геттеры). Б. вводят в некоторые антифрикционные материалы. Сплавы свинец — барий вытесняют полиграфические сплавы свинец — сурьма. Сплавы бария с никелем применяют для изготовления электродов запальных свечей двигателей и в радиолампах. Сульфат BaS04 применяют как белый пигмент, а также в произ-ве линолеума и бумаги. Титанат BaTi03 — один из важнейших сегнетоэлектри-ческих материалов. Окись ВаО используют при изготовлении стекла, эмалей и термокатализаторов. Перекись Ва02 служит для получения перекиси водорода, для отбеливания тканей, ее используют также в качестве катализатора крекинг-процесса, как один из компонентов запальных смесей в алюмотермии и пиротехнике.
Фторид BaF2 применяется при изготовлении эмалей и оптических стекол. Цирконат BaZr03 — высококачественный огнеупорный материал. Рентгеновское и радиоактивное излучение возбуждает желто-зеленую флуоресценцию комплексной соли Ва [Pt (CN)4], на чем основано применение спец. экранов, покрытых этой солью. Соединения Б. хороню поглощают рентгеновские лучи и гамма-излучение, вследствие чего их вводят в состав защитных материалов в рентгеновских установках и ядерных реакторах. Окрашенные соли Б. являются пигментами: хромат ВаСrO4 — желтый, манганат ВаМnO4 — зеленый. Растворимые соли бария ядовиты.
Характеристика элемента
Свойства бария наиболее близки к свойствам щелочных металлов. Структура атома бария такова, что первый потенциал ионизации (5,21 эВ ) расположен между значениями для лития и натрия. Однако ион Ва+ пока не обнаружен, так как при реакциях удаляются от атома сразу же два электрона с 6s² — орбитали . Суммарный потенциал ионизации (I1+ I2) невелик и равен 9,95 эВ . Образующийся Ва²⁺-ион (Rион= 1.29 А) поляризует анионы слабо, поэтому в соединениях бария связи ионного типа, а его комплексные ионы неустойчивы.
Барий это
Барий немного тверже свинца и мягче цинка. В свободном виде имеет серебристо-белый блеск, но на воздухе блеск теряется, появляется сначала коричневато-желтая, а затем серая пленка —смесь оксида, пероксида и нитрида: ВаО, ВаO2 и Ва3N2 . Образование всех трех веществ идет с выделением значительного количества теплоты. Наиболее устойчив пероксид бария ВаО2 , образующийся из оксида при нагревании до 500°С, но около 800°С ВаO2 разлагается на оксид и кислород, что ранее применялось для получения кислорода из воздуха. Пероксид стронция SrО2 получается значительно труднее и менее устойчив, чем ВаО2. Действием кислорода пол давлением и при повышенной температуре на пероксиды могут быть получены супероксиды типа ВаО4. Взаимодействие металлов НЛ-подгруппы с водородом идет при нагревании, при этом возникают твердые гидриды ионного типа: CaН2, Srh3, ВаН2 . Бария химически активнее кальция и стронция и реагирует с неметаллами более энергично. Уже при обычной температуре он реагирует с оксидом углерода (IV):
5Ва + 2CO2 = BaC2 + 4BaO
При высокой температуре Ва восстанавливает оксид углерода (II):
Ва + СО = ВаО + С
Ba + 2C = BaC2
Оксид бария ВаО с водой дает щелочь (баритовая вода):
ВаО + Н2О = Ва(ОН)2
а пероксид бария ВаО2 служит для получения пероксида водорода но обратимой реакции :
BaO2 + 2h3O ⇄ Ва (ОН)2 + Н2O
Равновесие легко смещается вправо даже под действием таких кислот, как угольная:
Ва (OH)2 + CO2 = ВаСО3↓ + h3O
Получение и использование
Барий довольно распространенный элемент. Входит в состав многих труднорастворимых минералов.
Главные его природные соединения: интерит ВаСОз и тяжелый шпат. Получение барня осуществляется электролизом расплавленного хлорида. При этом учитывается, что , ВаСl2 ядовит. Металл неустойчив на воздухе, поэтому его хранят под слоем керосина. Из соединений бария самым ценным является титанат бария — один из важнейших сегнетоэлектриков . Для медицины интересен сульфат бария . Благодаря способности сильно поглощать рентгеновские
лучи эта соль («бариева каша») попользуется в рентгеноскопии желудочно-кишечного тракта. BaSO4 нерастворим ни в воде, ни в слабой соляной кислоте (содержащейся в желудочном соке) и благодаря своей низкой растворимости нашел применение в рентгенологии . Устойчивость его к действию кислот, оснований и его белый цвет обусловливают применение для изготовления кислотостойких замазок и эмалей. Карбонаты, сульфаты, фториды и средние фосфаты бария труднорастворимы в воде, что используется в аналитической химии.Лит.: Дымчишин Д. А. Производство бариевых солей. Л.
Вы читаете, статья на тему барий
Барий — Википедия. Что такое Барий
| Внешний вид простого вещества | |
|---|---|
 Мягкий, вязкий серебристо-белый металл | |
| Свойства атома | |
| Название, символ, номер | Барий / Barium (Ba), 56 |
| Атомная масса (молярная масса) | 137,327(7)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 6s2 |
| Радиус атома | 222 пм |
| Химические свойства | |
| Ковалентный радиус | 198 пм |
| Радиус иона | (+2e) 134 пм |
| Электроотрицательность | 0,89 (шкала Полинга) |
| Электродный потенциал | -2,906 |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 502,5 (5,21) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 3,5 г/см³ |
| Температура плавления | 1 002 K |
| Температура кипения | 1 910 K |
| Уд. теплота плавления | 7,66 кДж/моль |
| Уд. теплота испарения | 142,0 кДж/моль |
| Молярная теплоёмкость | 28,1[2] Дж/(K·моль) |
| Молярный объём | 39,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 5,020 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) (18.4) Вт/(м·К) |
| Номер CAS | 7440-39-3 |
Ба́рий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
История
Барий был открыт в виде оксида BaO в 1774 г. Карлом Шееле и Юханом Ганом[3]. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый».
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Природный барий состоит из смеси семи стабильных изотопов: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba. Последний является самым распространённым (71,66 %). Известны и радиоактивные изотопы бария, наиболее важным из которых является 140Ba. Он образуется при делении ядер урана, тория и плутония.
Получение
Основное сырьё для получения бария — баритовый концентрат (80-95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
- B a S O 4 + 4 C → B a S + 4 C O {\displaystyle {\mathsf {BaSO_{4}+4C\rightarrow BaS+4CO}}}
- B a S O 4 + 2 C H 4 → B a S + 2 C + 4 H 2 O {\displaystyle {\mathsf {BaSO_{4}+2CH_{4}\rightarrow BaS+2C+4H_{2}O}}}
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
- B a S + 2 H 2 O → B a ( O H ) 2 + H 2 S ↑ {\displaystyle {\mathsf {BaS+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}S\uparrow }}}
- B a S + H 2 O + C O 2 → B a C O 3 + H 2 S ↑ {\displaystyle {\mathsf {BaS+H_{2}O+CO_{2}\rightarrow BaCO_{3}+H_{2}S\uparrow }}}
- B a C O 3 → B a O + C O 2 {\displaystyle {\mathsf {BaCO_{3}\rightarrow BaO+CO_{2}}}}
Получают металлический барий электролизом безводного расплава хлорида бария:
- B a C l 2 → B a + C l 2 {\displaystyle {\mathsf {BaCl_{2}\rightarrow Ba+Cl_{2}}}}
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объёмно-центрированной решёткой (а = 0,501 нм), выше устойчив β-Ba[источник не указан 1704 дня].
Твёрдость по шкале Мооса 1,25[4].
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
- B a + 2 H 2 O → B a ( O H ) 2 + H 2 ↑ {\displaystyle {\mathsf {Ba+2H_{2}O\rightarrow Ba(OH)_{2}+H_{2}\uparrow }}}
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах[5].
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который, в свою очередь, с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
- 6 B a + 2 N H 3 → 3 B a H 2 + B a 3 N 2 {\displaystyle {\mathsf {6Ba+2NH_{3}\rightarrow 3BaH_{2}+Ba_{3}N_{2}}}}
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
- B a 3 N 2 + 2 C O → B a ( C N ) 2 + 2 B a O {\displaystyle {\mathsf {Ba_{3}N_{2}+2CO\rightarrow Ba(CN)_{2}+2BaO}}}
С жидким аммиаком дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
- [ B a ( N H 3 ) 6 ] → B a ( N H 2 ) 2 + 4 N H 3 + H 2 {\displaystyle {\mathsf {[Ba(NH_{3})_{6}]\rightarrow Ba(NH_{2})_{2}+4NH_{3}+H_{2}}}}
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углем.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[6].
Соединения бария окрашивают пламя в желто-зелёный цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
- Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
- Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
- Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
- Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
- Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
- Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
- Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
- Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
- Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
- Применение в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, фторид, иодид, бромид, сульфид, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твёрдый неправильный пульс, судороги, позже возможны и параличи, синюшность лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжёлого отравления смерть наступает внезапно или в течение одних суток. Тяжёлые отравления наступают при приёме внутрь 0,2 — 0,5 г солей бария, смертельная доза 0,8 — 0,9 г.
Для оказании первой помощи необходимо промыть желудок 1%-ным раствором сульфата натрия или магния. Клизмы из 10%-ных растворов тех же солей. Приём внутрь раствора тех же солей (20,0 ч. соли на 150,0 ч. воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10—20 мл 3%-ного раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 241. — 623 с. — 100 000 экз.
- ↑ Барий. // Популярная библиотека химических элементов. — М.: Издательство «Наука», 1977.
- ↑ Поваренных А. С. Твёрдость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Аналитическая химия бария. — Москва : Наука, 1977.
Литература
Ссылки
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
Хлорид бария — соль, широко использующаяся в промышленности и аналитике
Барий хлористый — неорганическое вещество, которое  можно рассматривать как соль соляной кислоты. С точки зрения химии — бинарное соединение. Синоним названия — хлорид бария. Формула BaCl2. Получают реактив термохимическим способом из концентрата природного барита.
можно рассматривать как соль соляной кислоты. С точки зрения химии — бинарное соединение. Синоним названия — хлорид бария. Формула BaCl2. Получают реактив термохимическим способом из концентрата природного барита.
Свойства
Тонкозернистый порошок белого или сероватого цвета с мелкими бесцветными кристалликами. Водорастворим, слабо растворим в спирте и спиртовых растворах, не растворим в эфирах. Из водных растворов выкристаллизовываются бесцветные кристаллогидраты с одной или двумя молекулами воды. Реактив огне- и взрывобезопасен. Проявляет диамагнитные свойства.
Химически достаточно активная соль. Реагирует с другими солями в водных растворах, если в результате получается нерастворимое соединение, выпадающее в осадок. Это свойство используется в аналитике для обнаружения сульфат-ионов. Хим. реактив способен образовывать двойные соли, эвтектические смеси, а с бромидом бария — твердые растворы.
Меры предосторожности
Барий хлористый безводный и его кристаллогидраты крайне токсичны. Отравление приводит к необратимым последствиям для головного мозга и серьезному поражению почек, селезенки, желудочного тракта, параличу и потере зрения. Попадание реактива с пылью оказывает негативное воздействие на органы дыхания. Опасно также попадание пыли или раствора в глаза или на кожу.
При проглатывании следует сразу же вызвать врача и промыть желудок 1%-ным раствором сернокислого натрия или магния. Если порошкообразный реактив рассыпан, его нельзя заливать водой. Его следует изолировать, засыпать песком и потом утилизировать.
Работать с хлористым барием следует в спец. одежде, респираторе, резиновых перчатках и защитных очках. Помещение должно быть оборудовано вентиляцией, а места возможного сильного запыления — локальным укрытием и дополнительной местной вентиляцией. В лабораториях для работы с хлоридом бария используют вытяжной шкаф.
Хранят реактив в полиэтиленовых мешках, в сухом помещении, строго следят за тем, чтобы он не контактировал с водой. Перевозят любым крытым транспортом, кроме самолета.
При нагревании BaCl2 разлагается с выделением химически активного хлороводорода, поэтому пожарные должны быть извещены, если в зоне пожара оказались значительные количества реактива.
Применение
- В химпроме для получения солей бария и реактивов
 на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень.
на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень. - Входит в состав электролитов, использующихся при электролитическом получении химически чистого магния и алюминия.
- Часть смесей, применяющихся для закалки сталей режущих марок.
- В технологии горячего прессования в металлургии.
- В сталелитейном производстве — для цианирования (насыщения верхнего слоя металлической поверхности углеродом и азотом).
- Для обработки кож с целью их осветления и утяжеления.
- Входит в состав массы, из которой изготавливают керамические изделия.
- В аналитической химии — для обнаружения в растворах присутствия серной кислоты или сульфатов (выпадает белый осадок).
- Для уничтожения насекомых-вредителей растений в сельском хозяйстве.
барий — это… Что такое барий?
БА́РИЙ -я; м. [лат. Barium от греч. barys — тяжёлый].
1. Химический элемент (Ba), мягкий серебристо-белый химически активный металл (применяется в технике, промышленности, медицине).
2. Разг. О сернокислой соли этого элемента (принимается внутрь в качестве контрастного вещества при рентгенологическом обследовании желудка, кишечника и т.п.). Выпить стакан бария.
◁ Ба́риевый, -ая, -ое (1 зн.). Б-ые соли. Б. катод.
БА́РИЙ (лат. Baryum), Ва (читается «барий»), химический элемент с атомным номером 56, атомная масса 137,327. Расположен в шестом периоде в группе IIА периодической системы. Относится к щелочноземельным элементам. Природный барий состоит из семи стабильных изотопов с массовыми числами 130 (0,101%), 132 (0,097%), 134 (2,42%), 135 (6,59%), 136 (7,81%), 137 (11,32%) и 138 (71,66%). Конфигурация внешнего электронного слоя 6s2. Степень окисления +2 (валентность II). Радиус атома 0,221 нм, радиус иона Ва2+ 0,138 нм. Энергии последовательной ионизации равны 5,212, 10,004 и 35,844 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 0,9.История открытия
Название элемента происходит от греческого «барис» — тяжелый. В 1602 один болонский ремесленник обратил внимание на тяжелый минерал барит (см. БАРИТ) BaSO4 (плотность 4,50 кг/дм3). В 1774 швед К. Шееле (см. ШЕЕЛЕ Карл Вильгельм), прокаливая барит, получил оксид ВаО. Только в 1808 англичанин Г. Дэви (см. ДЭВИ Гемфри) использовал электролиз для восстановления активных металлов из расплавов их солей.
Распространенность в природе
Содержание в земной коре 0,065%. Важнейшие минералы — барит и витерит (см. ВИТЕРИТ) ВаСО3.
Получение
Основное сырье для получения бария и его соединений — баритовый концентрат (80—95% BaSO4). Его нагревают в насыщенном растворе соды Na2CO3:
BaSO4 + Na2CO3 = ВаCO3 + Na2SO4
Осадок растворимого в кислотах карбоната бария перерабатывают далее.
Основной промышленный метод получения металлического бария — восстановление его порошком алюминия (см. АЛЮМИНИЙ) при 1000—1200 °C:
4ВаО + 2Аl = 3Ва + ВаOАl2О3
Восстановлением барита каменным углем или коксом при нагревании получают BaS:
BaSO4 + 4С = BaS + 4СО
Образующийся растворимый в воде сульфид бария, перерабатывают на другие соединения бария, Ba(OH)2, ВаCO3, Ва(NO3)2.
Физические и химические свойства
Барий — серебристо-белый ковкий металл, кристаллическая решетка — кубическая, объемно центрированная, а = 0,501 нм. При температуре 375 °C переходит в b-модификацию. Температура плавления 727 °C, кипения 1637 °C, плотность 3,780 г/см3. Стандартный электродный потенциал Ва2+/Ва равен –2,906 В.
Имеет высокую химическую активность. Интенсивно окисляется на воздухе, образуя пленку, содержащую оксид бария ВаО, пероксид ВаО2.
Энергично реагирует с водой:
Ва + 2Н2О = Ва(ОН)2 + Н2
При нагревании взаимодействует с азотом (см. АЗОТ) с образованием нитрида Ва3N2:
Ba + N2= Ba3N2
В токе водорода (см. ВОДОРОД) при нагревании барий образует гидрид ВаН2. С углеродом барий образует карбид ВаС2. С галогенами (см. ГАЛОГЕНЫ) барий образует галогениды:
Ва + Сl2 = ВаСl2,
Возможно взаимодействие с серой (см. СЕРА) и другими неметаллами.
BaO — основный оксид. Он реагирует с водой с образованием гидроксида бария:
ВаО + Н2О = Ва(ОН)2
При взаимодействии с кислотными оксидами BaO образует соли:
ВаО +СО2 = ВаСО3
Основный гидроксид Ва(ОН)2 немного растворим в воде, обладает щелочными свойствами.
Ионы Ва2+ бесцветны. Хлорид, бромид, иодид, нитрат бария хорошо растворимы в воде. Нерастворимы карбонат, сульфат, средний ортофосфат бария. Сульфат бария BaSO4 нерастворим в воде и кислотах. Поэтому образование белого творожистого осадка BaSO4 является качественной реакцией на ионы Ва2+ и сульфат-ионы.
BaSO4 растворяется в горячем растворе концентрированной Н2SO4, образуя кислый сульфат:
BaSO4 +Н2SO4 = 2Ba(НSO4)2
Ионы Ва2+ окрашивают пламя в желто-зеленый цвет.
Применение
Сплав Ba с Al — основа геттеров (газопоглотителей). BaSO4 — компонент белых красок, его добавляют при выделке некоторых сортов бумаги, используют при выплавке алюминия, в медицине — для рентгеновского обследования.
Соединения бария используют в стеклопроизводстве, при изготовлении сигнальных ракет.
Титанат бария BaTiO3 — компонент пьезоэлементов, малогабаритных конденсаторов, используется в лазерной технике.
Физиологическое действие
Соединения бария токсичны, ПДК в воздухе 0,5 мг/м3.
Почему нитрат бария не реагирует с серной кислотой?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
Как нитрат бария и карбонат натрия реагируют в водном растворе?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra
- тригонометрия и алгебра
- Статистика
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
Образец карбоната бария массой 211 г реагирует с раствором азотной кислоты с образованием нитрата бария, диоксида углерода и воды. Если кислоты присутствует в избытке, какая масса и объем углекислого газа на СТП будет образовываться?
Наука
- Анатомия и физиология
- астрономия
- астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- физика
математический
- Алгебра
- Исчисление
- Геометрия
- Prealgebra

 на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень.
на основе бария; пигментов, в том числе таких популярных как баритовый желтый и касселева зелень.