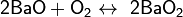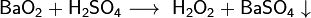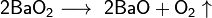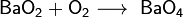Оксид бария, характеристика, свойства и получение, химические реакции.
Оксид бария – неорганическое вещество, имеет химическую формулу BaO.
Краткая характеристика оксида бария
Физические свойства оксида бария
Получение оксида бария
Химические свойства оксида бария
Химические реакции оксида бария
Применение и использование оксида бария
Краткая характеристика оксида бария:
Оксид бария – неорганическое вещество, не имеющее цвета.
Так как валентность бария равна двум, то оксид бария содержит один атом кислорода и один атом бария.
Химическая формула оксида бария BaO.
В воде не растворяется, а реагирует с ней.
Физические свойства оксида бария:
| Наименование параметра: | Значение: |
| Химическая формула | BaO |
| Синонимы и названия иностранном языке | |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | без цвета |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5720 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,72 |
| Температура кипения, °C | 2000 |
| Температура плавления, °C | 1920 |
| Молярная масса, г/моль | 153,3394 |
* Примечание:
— нет данных.
Получение оксида бария:
Оксид бария получают в результате следующих химических реакций:
- 1. сжиганием бария в кислороде:
2Ba + О2 → 2BaО.
- 2. путем термического разложения гидроксида бария:
Ba(OH)2 → BaO + H2О (t = 780-800 oC).
- 3. путем термического разложения карбоната бария:
BaCO3 → BaO + CO2 (t = 1000-1450 oC).
- 4. путем термического разложения нитрата бария:
2Ba(NO3)2 → 2BaO + 4NO2 + O2 (t = 620-670 oC).
Химические свойства оксида бария. Химические реакции оксида бария:
Оксид бария относится к основным оксидам.
Химические свойства оксида бария аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида бария с бериллием:
BaO + Be → Ba + BeO (t = 270 oC).
В результате реакции образуется барий и оксид бериллия. Таким образом, барий восстанавливается из оксида бария бериллием при температуре 270
2. реакция оксида бария с алюминием:
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 oC),
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 oC),
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 oC).
В результате реакции в первом случае образуется барий и оксид алюминия. Таким образом, барий восстанавливается из оксида бария алюминием при температуре 1200 oC.
Во втором и третьем случаях образуется барий и соль – алюминат бария.
3. реакция оксида бария с кремнием:
3BaO + Si → 2Ba + BaSiO3 (t = 1200 oC).
В результате реакции образуется соль – силикат бария и барий.
4. реакция оксида бария с кислородом:
BaO + O2 → 2BaO2 (t = 500 oC).
В результате реакции образуется пероксид бария.5. реакция оксида бария с водой:
BaO + H2O → Ba(OH)2.
В результате реакции образуется гидроксид бария.
6. реакция оксида бария с оксидом цинка:
BaO + ZnO → BaZnO2 (t = 1100 oC).
В результате реакции образуется cоль – цинкат бария.
7. реакция оксида бария с оксидом титана:
BaO + TiO2 → BaTiO3.
В результате реакции образуется соль – метатитанат бария.
8. реакция оксида бария с оксидом кадмия:
BaO + CdO → BaCdO2 (t = 1100 oC).
В результате реакции образуется оксид бария-кадмия.
9. реакция оксида бария с оксидом меди:
BaO + Cu2O → BaCu2O2 (t = 500-600 oC).
В результате реакции образуется оксид бария-меди.
10.
BaO + GeO2 → BaGeO3 (t = 1200 oC).
В результате реакции образуется соль – метагерманат бария.
11. реакция оксида бария с оксидом гафния:
BaO + HfO2 → BaHfO3 (t = 1800-2200 oC).
В результате реакции образуется оксид гафния-бария.
12. реакция оксида бария с оксидом марганца:
BaO + MnO → BaMnO2 (t = 1800 oC),
8BaO + MnO2 → Ba8MnO10 (t = 800 oC).
В результате реакции образуется в первом случае оксид бария-марганца, во втором – оксид марганца-октабария.
13. реакция оксида бария с оксидом никеля:
BaO + NiO → BaNiO2 (t = 1200 oC).
В результате реакции образуется оксид никеля-бария.
14. реакция оксида бария с оксидом циркония:
BaO + ZrO2 → BaZrO3 (t = 1800-2200 oC).В результате реакции образуется оксид циркония-бария (цирконат бария).
15. реакция оксида бария с оксидом олова:
BaO + SnO → BaSnO2 (t = 1000 oC).
В результате реакции образуется оксид олова-бария.
16. реакция оксида бария с оксидом ванадия:
2BaО + VО2 → Ba2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат бария.
17. реакция оксида бария с оксидом углерода:
BaO + CO2 → BaCO3.
В результате реакции образуется соль – карбонат бария.
18. реакция оксида бария с оксидом серы:
BaO + SO3 → BaSO4.
В результате реакции образуется соль – сульфат бария.
19. реакция оксида бария с плавиковой кислотой:
BaO + 2HF → BaF2 + H2O.
В результате химической реакции получается соль – фторид бария и вода.
20. реакция оксида бария с азотной кислотой:
BaO + 2HNO3 → 2Ba(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат бария и вода.
21. реакция оксида бария с ортофосфорной кислотой:
3BaO + 2H3PO4 → Ba3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат бария и вода.
Аналогично проходят реакции оксида бария и с другими кислотами.
22. реакция оксида бария с бромистым водородом (бромоводородом):
BaO + 2HBr → BaBr2 + H2O.
В результате химической реакции получается соль – бромид бария и вода.
23. реакция оксида бария с йодоводородом:
BaO + 2HI → BaI2 + H2O.
В результате химической реакции получается соль – йодид бария и вода.
Применение и использование оксида бария:
Оксид бария применяется в качестве покрытия различных приборов, а также наполнителя, компонента и катализатора в химической промышленности и в производстве стекла.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид бария реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида бария
реакции с оксидом бария
Коэффициент востребованности 3 733
Краткая характеристика:
– неорганическое вещество, не имеющее цвета.
Так как валентность равна двум, то содержит один атом кислорода и один атом .
Химическая формула а
В воде не растворяется, а реагирует с ней.
Физические свойства:
| Наименование параметра: | Значение: |
| Химическая формула | BaO |
| Синонимы и названия иностранном языке | barium oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | без цвета |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5720 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,72 |
| Температура кипения, °C | 2000 |
| Температура плавления, °C | 1920 |
| Молярная масса, г/моль | 153,3394 |
* Примечание:
— нет данных.
Получение:
получают в результате следующих химических реакций:
- 1. сжиганием в кислороде:
2Ba + О2 → 2BaО.
- 2. путем термического разложения гидра :
Ba(OH)2 → BaO + H2О (t = 780-800 oC).
- 3. путем термического разложения карбоната :
BaCO3 → BaO + CO2 (t = 1000-1450 oC).
- 4. путем термического разложения нитрата :
2Ba(NO3)2 → 2BaO + 4NO2 + O2 (t = 620-670 oC).
Химические свойства а . Химические реакции:
относится к основным ам.
Химические свойства а аналогичны свойствам основных ов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция а с бериллием:
BaO + Be → Ba + BeO (t = 270 oC).
В результате реакции образуется барий и бериллия. Таким образом, барий восстанавливается из а бериллием при температуре 270 oC.
2. реакция а с алюминием:
3BaO + 2Al → 3Ba + Al2O3 (t = 1200 oC),
2Al + 4BaO → Ba(AlO2)2 + 3Ba (t = 1100-1200 oC),
2Al + 4BaO → BaAl2O4 + 3Ba (t = 1100-1200 oC).
В результате реакции в первом случае образуется барий и алюминия. Таким образом, барий восстанавливается из а алюминием при температуре 1200 oC.
Во втором и третьем случаях образуется барий и соль — алюминат .
3. реакция а с кремнием:
3BaO + Si → 2Ba + BaSiO3 (t = 1200 oC).
В результате реакции образуется соль – силикат и барий.
4. реакция а с кислородом:
BaO + O2 → 2BaO2 (t = 500 oC).
В результате реакции образуется пер .
5. реакция а с водой:
BaO + H2O → Ba(OH)2.
В результате реакции образуется гидр .
6. реакция а с ом цинка:
BaO + ZnO → BaZnO2 (t = 1100 oC).
В результате реакции образуется cоль – цинкат .
7. реакция а с ом титана:
BaO + TiO2 → BaTiO3.
В результате реакции образуется соль – метатитанат .
8. реакция а с ом кадмия:
BaO + CdO → BaCdO2 (t = 1100 oC).
В результате реакции образуется -кадмия.
9. реакция а с ом меди:
BaO + Cu2O → BaCu2O2 (t = 500-600 oC).
В результате реакции образуется -меди.
10. реакция а с ом германия:
BaO + GeO2 → BaGeO3 (t = 1200 oC).
В результате реакции образуется соль – метагерманат .
11. реакция а с ом гафния:
BaO + HfO2 → BaHfO3 (t = 1800-2200 oC).
В результате реакции образуется гафния-.
12. реакция а с ом марганца:
BaO + MnO → BaMnO2 (t = 1800 oC),
8BaO + MnO2 → Ba8MnO10 (t = 800 oC).
В результате реакции образуется в первом случае -марганца, во втором — марганца-окта.
13. реакция а с ом никеля:
BaO + NiO → BaNiO2 (t = 1200 oC).
В результате реакции образуется никеля-.
14. реакция а с ом циркония:
BaO + ZrO2 → BaZrO3 (t = 1800-2200 oC).
В результате реакции образуется циркония- (цирконат ).
15. реакция а с ом олова:
BaO + SnO → BaSnO2 (t = 1000 oC).
В результате реакции образуется олова-.
16. реакция а с ом ванадия:
2BaО + VО2 → Ba2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат .
17. реакция а с ом углерода:
BaO + CO2 → BaCO3.
В результате реакции образуется соль – карбонат .
18. реакция а с ом серы:
BaO + SO3 → BaSO4.
В результате реакции образуется соль – сульфат .
19. реакция а с плавиковой кислотой:
BaO + 2HF → BaF2 + H2O.
В результате химической реакции получается соль – фторид и вода.
20. реакция а с азотной кислотой:
BaO + 2HNO3 → 2Ba(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат и вода.
21. реакция а с ортофосфорной кислотой:
3BaO + 2H3PO4 → Ba3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат и вода.
Аналогично проходят реакции а и с другими кислотами.
22. реакция а с бромистым водородом (бромоводородом):
BaO + 2HBr → BaBr2 + H2O.
В результате химической реакции получается соль – бромид и вода.
23. реакция а с йодоводородом:
BaO + 2HI → BaI2 + H2O.
В результате химической реакции получается соль – йодид и вода.
Применение и использование:
применяется в качестве покрытия различных приборов, а также наполнителя, компонента и катализатора в химической промышленности и в производстве стекла.
Источник публикации
Читайте такжеОксид бария — Википедия
Материал из Википедии — свободной энциклопедии
Оксид бария — соединение бария с кислородом, имеющее химическую формулу BaO. Является основным оксидом. При стандартных условиях представляет собой бесцветные кристаллы с кубической решёткой[1].
Получение
1. Взаимодействие металлического бария с кислородом:
2 B a + O 2 ⟶ 2 B a O {\displaystyle {\mathsf {2Ba+\ O_{2}\longrightarrow 2\ BaO}}}
В этом случае наряду с оксидом бария образуется пероксид бария:
B a + O 2 ⟶ B a O 2 {\displaystyle {\mathsf {Ba+\ O_{2}\longrightarrow \ BaO_{2}}}}
2. Разложение карбоната бария при нагревании:
B a C O 3 ⟶ B a O + C O 2 ↑ {\displaystyle {\mathsf {BaCO_{3}\longrightarrow \ BaO+\ CO_{2}\uparrow }}}
3. Разложение нитрата бария при нагревании. 2Ba(NO3)2 = 2BaO + 4NO2 + O2
Химические свойства
1. Энергичное взаимодействие с водой с образованием щёлочи и выделением тепла:
B a O + H 2 O ⟶ B a ( O H ) 2 {\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
2. Взаимодействие с кислотными оксидами с образованием соли:
B a O + C O 2 ⟶ B a C O 3 {\displaystyle {\mathsf {BaO+\ CO_{2}\longrightarrow \ BaCO_{3}}}}
B a O + S O 3 ⟶ B a S O 4 ↓ {\displaystyle {\mathsf {BaO+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow }}}
3. Взаимодействие с кислотами с образованием соли и воды:
B a O + 2 H C l ⟶ B a C l 2 + H 2 O {\displaystyle {\mathsf {BaO+2\ HCl\longrightarrow \ BaCl_{2}+\ H_{2}O}}}
B a O + H 2 S O 4 ⟶ B a S O 4 ↓ + H 2 O {\displaystyle {\mathsf {BaO+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
4. Взаимодействие с кислородом при температуре около 600 °C с образованием пероксида:
2 B a O + O 2 ⟶ 2 B a O 2 {\displaystyle {\mathsf {2BaO+O_{2}\longrightarrow \ 2BaO_{2}}}}
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием[3].
Применение
Поскольку работа выхода оксида бария низка, то при невысокой стоимости и технологичности он давно и широко применяется для покрытия катодов различных электронно-вакуумных приборов, телевизионных, осциллографических трубках и др.
Также используется для производства некоторых видов стекла, например, оптического.
В некоторых реакциях используется как катализатор.
Яркость поверхности, покрытой оксидом бария или оксидом магния, принимается за единицу при измерениях коэффициента яркости других поверхностей.
Примечания
Оксид бария — Википедия Переиздание // WIKI 2
Оксид бария — бинарное неорганическое химическое соединение бария с кислородом, имеющее химическую формулу BaO. Является основным оксидом. При стандартных условиях представляет собой бесцветные кристаллы с кубической решёткой[1]. Ядовит.
Получение
1. Взаимодействие металлического бария с кислородом:
2 B a + O 2 ⟶ 2 B a O {\displaystyle {\mathsf {2Ba+\ O_{2}\longrightarrow 2\ BaO}}}
В этом случае наряду с оксидом бария образуется пероксид бария:
B a + O 2 ⟶ B a O 2 {\displaystyle {\mathsf {Ba+\ O_{2}\longrightarrow \ BaO_{2}}}}
2. Разложение карбоната бария при нагревании:
B a C O 3 ⟶ B a O + C O 2 ↑ {\displaystyle {\mathsf {BaCO_{3}\longrightarrow \ BaO+\ CO_{2}\uparrow }}}
3. Разложение нитрата бария при нагревании. 2Ba(NO3)2 = 2BaO + 4NO2 + O2
Химические свойства
1. Энергичное взаимодействие с водой с образованием щёлочи и выделением тепла:
B a O + H 2 O ⟶ B a ( O H ) 2 {\displaystyle {\mathsf {BaO+\ H_{2}O\longrightarrow \ Ba(OH)_{2}}}}
2. Взаимодействие с кислотными оксидами с образованием соли:
B a O + C O 2 ⟶ B a C O 3 {\displaystyle {\mathsf {BaO+\ CO_{2}\longrightarrow \ BaCO_{3}}}}
B a O + S O 3 ⟶ B a S O 4 ↓ {\displaystyle {\mathsf {BaO+\ SO_{3}\longrightarrow \ BaSO_{4}\downarrow }}}
3. Взаимодействие с кислотами с образованием соли и воды:
B a O + 2 H C l ⟶ B a C l 2 + H 2 O {\displaystyle {\mathsf {BaO+2\ HCl\longrightarrow \ BaCl_{2}+\ H_{2}O}}}
B a O + H 2 S O 4 ⟶ B a S O 4 ↓ + H 2 O {\displaystyle {\mathsf {BaO+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +\ H_{2}O}}}
4. Взаимодействие с кислородом при температуре около 600 °C с образованием пероксида:
2 B a O + O 2 ⟶ 2 B a O 2 {\displaystyle {\mathsf {2BaO+O_{2}\longrightarrow \ 2BaO_{2}}}}
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием[5].
Применение
Поскольку работа выхода электронов из оксида бария низка, то при невысокой стоимости и технологичности он давно и широко применяется как один из компонентов покрытия катодов различных электровакуумных приборов, телевизионных, осциллографических трубках и др. Например, смесь для катодов «Radio Mix No. 3» от фирмы «J. T. Baker Chemical Co.» состоит на 57,3 % из карбоната бария, который при нагревании в вакууме разлагается до оксида бария[6][7].
Также используется для производства некоторых видов стекла, например, оптического.
В некоторых реакциях окись бария используется как катализатор.
Яркость поверхности, покрытой оксидом бария или оксидом магния, принимается за единицу при измерениях коэффициента яркости других поверхностей.
Физиологическое значение
Вещество токсично. ПДК 0,7 мг/л. При попадании на кожу и слизистые оболочки глаз в большом количестве оксид бария может вызывать химические ожоги; пожаро- и взрывобезопасен.
Имеются данные, что оксид бария может обладать щелочными свойствами.
ЛД50 для крыс при внутрижелудочном введении составляет 146 мг/кг.
Примечания
- ↑ [www.xumuk.ru/encyklopedia/471.html Описание оксида бария на XuMuK.Ru]
- ↑ [www.xumuk.ru/spravochnik/378.html Оксид бария на XuMuK.Ru]
- ↑ name=www.safework.ru_Оксид бария
- ↑ name=www.safework.ru_Барий
- ↑ Фрумина Н. С., Горюнова Н. Н., Еременко С. Н. Аналитическая химия бария — Москва: Наука, 1977. — 200 с
- ↑ https://patents.google.com/patent/US5422542A/en
- ↑ Варламов В.А., Шехмейстер Е.И. Сборочные операции в электровакуумном производстве // М.: Высшая школа, 1974. — 360 с. С.316-317
 Эта страница в последний раз была отредактирована 23 июля 2020 в 18:08.
Эта страница в последний раз была отредактирована 23 июля 2020 в 18:08.Оксид бария
Оксид бария известен в качестве соединения бария и кислорода. В письменном обозначении в составе химических формул оксид бария обозначается, как ВаО. В ряде химических реакций выступает оксидом основного вида. Допустим и элементарный визуальный анализ вещества в соответствии со стандартными условиями, где ВаО представлен в виде бесцветных кристаллов с кубической по форме решеткой.
Оксид бария входит в число элементов, относящихся к подгруппе IV, то есть к неорганическим основаниям, представленным оксидами, гидроксидами и пероксидами металлов. Любое из оснований данного вида представляет собой соединение, где явно выражено наличие гидроксильного радикала (OH). Такие основания реагируют с кислотой, вследствие чего характерно образование солей.
Сырье, в основном используемое при получении бария, применяется в виде барита или, что реже, витерита. Реакция получения оксида бария – это реакция восстановления минералов при помощи каменного угля, кокса либо газа природного происхождения. Собственно именно в результате взаимодействия данных веществ и происходит стабильное получение сульфида и оксида бария.
Основные уравнения реакций оксида бария
• Реакция взаимодействия металлического бария и кислорода, в результате которой происходит образование оксида бария: 2Ва + О2 → 2ВаО. В подобном типе реакции обеспечивается получение не только оксида, но и пероксида бария: Ва + О2 → ВаО2;
• Реакция разложения карбоната бария при условии обязательного нагревания, где получение оксида бария сопровождается выделением углекислого газа: ВаСО3 → ВаО + СО2↑. Существует обратная реакция оксида бария и оксида углерода (IV) при условиях комнатной температуры;
• Реакция разложения нитрата бария при условиях нагревания, где полученными веществами являются оксид бария, оксид азота и кислород: 2Ba(NO3)2 → 2BaO + 4NO2 + O2;
• Реакция гидроксида бария и оксида серы (IV): Ва(НО)2 + 2SО2 → Ва(НSО3)2, где результатом взаимодействия веществ становится образование (Ва(НSО3)2).
Получение металлического бария возможно и с проведением реакции восстановления. Главное, какой оксид использовать в реакции дополнительно. Например, наиболее яркая реакция — это химическая реакция с участием оксида алюминия:
3ВаО + 2Аl → 3Ва + Аl2О3
Кроме этого, гарантированное получение бария обеспечивается посредством электролиза смеси хлорида бария и кальция в расплавленном состоянии.
Степень растворимости Ва
Растворимость оксида бария определяется по реакции данного вещества с водой. В этом случае, исходя из данных уравнения по взаимодействию:
ВаО + Н2О = Ва(ОН)2,
где оксид бария — это оксид основного типа.
Следовательно такому оксиду будет соответствовать основание — Ва(ОН)2. Сверяя полученные данные с таблицей растворимости веществ нетрудно определить, что данный вид оснований относится к растворимым и подтверждает тот факт, что реакция вполне осуществима.
Природные источники вещества
По содержанию в природных источниках различается несколько возможных:
- • Земная кора, где масса вещества составляет 0, 05 %;
- • Морская вода, где средняя величина содержания бария составляет 0,02 мг/литр.
Области применения оксидов основного типа
Любое их химических соединений данной группы широко применяется в различных отраслях современной промышленности. В соответствии с краткой классификацией веществ, можно определить следующее разграничение использования оксидов (калия, магния, бария, алюминия):
- • Оксид калия. Широко применяется в производстве удобрений минерального типа, используемых аграрном хозяйстве;
- • Оксид натрия. Незаменим в химической промышленности для получения гидроксида натрия;
- • Оксид бария. Применим в качестве катализатора в осуществлении химических реакций;
- • Оксид магния. Область применения – пищевая промышленность (в виде добавки Е530).
Определение химических свойств вещества на практике
• Ярко протекает реакция взаимодействия оксида бария и воды, вследствие чего отмечается образование щелочи с параллельным выделением тепла: ВаО + Н2О → Ва(ОН)2.
• Взаимодействует оксид бария и с кислотными оксидами, в результате чего характерно образование солей: ВаО + СО2 → ВаСО3, ВаО + SО3 → Ва SО4↓, где оксид бария вступает в реакцию с триоксидом серы;
• Реакция взаимодействия ВаО с кислотами, где обеспечивается итоговое образование солей и воды: ВаО + Н2Сl → ВаСl2 + Н2О, ВаО + Н2SО4 → Ва SО4↓ + Н2О. В течение подобной реакции между оксидом бария и серной кислотой (в разбавленном виде) результатом становится образование сульфата бария и воды.
Также стоит обратить внимание на реакцию оксида бария с соляной кислотой: ВаО + 2НСl (при обязательном условии разбавленного состояния) → ВаСl2 + Н2О, где результатом реакции обеспечено образование хлорида бария BaCl2 и воды h3O.
Описание физических свойств ВаО
Существует в твердом состоянии. Непосредственно сам барий отличается характерным серебристо – белым оттенком, достаточно пластичен, по причине чего относится к ковким металлам.
- • Величина молярной массы оксида бария, гр/моль: 153, 3394;
- • По плотности вещество характеризуется следующими показателями, при условии температурного режима в 20 °C: 5, 72;
- • Растворимость в воде, то есть показатель Кs, при условии температуры в 20° С = 1, 5 г/100 г;
Особенности гидроксида и пероксида бария
Гидроксид бария обозначается, как Ba(OH). Применяется в виде кристаллообразных пластин белого цвета, либо в состоянии раствора, более известного как баритовая вода. Популярен в стекольном производстве, например для создания и разработки непроницаемого стекла для рентгеновских установок. Также используется в производстве керамических изделий, в процессах по очистке воды и в производстве гидроксида калия.
Пероксид бария, обозначаемый, как BaO, получается путем нагревания оксида бария в воздушном пространстве с характерным отсутствием диоксида углерода.
Применение
Выход ВаО достаточно низок, соответственно, учитывая его невысокую стоимость, он пользуется повышенным спросом в работах по покрытию катодов, входящих в электронно-вакуумные приборы, на элементах телевизионных устройства и осциллографических трубок. Известны и иные сферы активного применения:
- • Производство антикоррозионных материалов;
- • Товары из категории сегнето- и пьезо- электрики;
- • Изготовление оптических приборов, таких, как призмы, линзы и прочие;
- • Пиротехнические изделия с целью окрашивания пламени заряда в зеленый цвет;
- • Отрасль атомно-водородной и ядерной энергетики;
- • В составе фторионных аккумуляторных батарей, как электролитный компонент;
- • При разработке и производстве медицинского оборудования.
Хранение
Условия соответствующего хранения ВаО подразумевают полное отсутствие любых легко возгораемых веществ. Также исключены в близком хранении и нахождении восстанавливающие агенты, металлы в порошкообразном состоянии. Категорически запрещается параллельное нахождение любых продуктов питания и сельскохозяйственных животных кормов.
Особые обозначения на упаковке
Полностью исключена одновременная транспортировка с пищевыми продуктами, косметической продукцией, животными кормами и любыми водными организмами. Весь транспортируемый материал должен быть помечен следующими символами:
- • Хn, обозначающий раздражающее действие отмеченных веществ;
- • R, с числовым значением 20/22, что говорит об опасности при вдохе и в случае проглатывания;
- • S, с числовым значением 17, что предписывает ранение вещества в максимальной отдаленности от горюче – смазочных материалов;
- • S, с числовым значением 28, указывающем на незамедлительное промывание, в случае попадания ВаО на поверхность кожных покровов.
Варианты фасовки подразумевают распределение вещества по упаковкам в 1, 20 – 25, 100, 500 и 1000 килограммовые упаковки, которыми служат банки из стекла, мешки из полипропилена, пакеты из полиэтилена. На фасовке любого веса обязателен к указанию класс степени опасности: 5.1. Существует понятие вторичной опасности, означаемой 6.1.
Влияние ВаО на организм человека
Симптоматика отравлений барием как правило выражена в следующем: повышенное слюнотечение, жжение во рту, дискомфорт в пищеводе. Период отравления сопровождается явно выраженными болями в области желудка, тошнотой, рвотой, острыми коликами. При тяжелом отравлении вероятен смертельный исход, наступающий в течение 24 часов. Смертельная доза составляет порядка 0,8 граммов.
При использовании любых соединений бария стоит помнить о том, что изучение его недостаточно, а к жизненно важным микроэлементам он не относится. Вещество характеризуется как высокотоксичное, так что при любом виде контакта рекомендовано соблюдать все меры предосторожности и СИЗ.
получение и применение :: SYL.ru
Многообразие окружающего мира не перестает удивлять человечество. Исследователи открывают перед нами новые горизонты, основываясь на полученных результатах предыдущего поколения. В этом смысле химия – наука, которая не может быть полностью изученной, современные технологические решения находят наиболее оптимальные и необходимые области применения для уже познанных человечеством элементов. XIX век стал временем открытий, XXI – периодом более эффективного их использования. Например, оксид бария, — вещество, изученное многосторонне, но кто знает, какие новые технологии будут связаны с ним в будущем.
Барий
Щелочноземельный металл, который входит в состав земной коры привлек внимание химиков в XVIII веке. Первое упоминание об этом элементе связано с его кислородным соединением – оксидом бария. Он имеет очень высокую для своего вида плотность, поэтому получил название «тяжелый», которое в дальнейшем стало названием самого элемента. Металл химически активен, поэтому для его получения в чистом виде необходимо провести ряд реакций в присутствии катализатора. Наиболее распространенным в природе минералом, содержащим барий, является его сульфат BaSO4 (тяжелый шпат барит) и BaCO3 (витерит). Именно с данными соединениями связан процесс получения такого вещества, как оксид бария. В дальнейшем оно используется для выделения металла в чистом виде и имеет собственные направления применения.

Важнейшие соединения
Как и все типичные металлы, барий вступает в химическую реакцию с кислородом, при этом полученное вещество зависит от условий процесса и катализатора. Например, простая реакция окиси с водой дает возможность образовывать Ba(OH)2 — гидроксид бария. Оксид бария получают из нитрата. Типичны соединения со всеми галогенами: BaF2, BaCI2, BaI2, BaS, BaBr2. Образование нитратов, сульфидов, сульфатов, происходит за счет взаимодействия минералов с соответствующими кислотными растворами. На сегодняшний день все важнейшие соединения бария находят свое применение. Но исключить новые открытия в сферы использования данного вещества нельзя, с ростом технологичности приборов его значение будет только возрастать как на промышленном, так и на бытовом уровне.

Оксиды
Бинарная связь химического элемента с кислородом наиболее распространенная форма вещества в природе. При этом оксиды образуют металлы и неметаллы. Именно характеристика элемента при взаимодействии с кислородом стала основой формирования периодической системы Менделеева Д. И. Для металлургической отрасли наиболее приемлемым способом выделения вещества является процесс его получения из оксида. Предварительно металлическая природная руда (соли металлов) подвергается различным химическим воздействиям, направленным на получение окиси. Как правило, данный процесс сопровождается нагреванием до необходимой температуры. Исключением не является и оксид бария. Формула полученного вещества имеет вид: BaO. Оксиды можно получить и другими способами. Например, из гидроксидов, солей и самих оксидов более высокой степени окисления.
Оксид бария
Прежде всего необходимо отметить, что все соединения данного металла токсичны (исключение составляет сульфат), поэтому требуется соблюдать элементарные правила безопасности при работе. Это касается многих химических элементов. Другое название – барит безводный — не следует путать с сульфатом, который является природным минералом. В нормальных (стандартных) условиях белые кристаллы или порошок, иногда бесцветные с типичной решеткой кубического вида, являются соединением металла с кислородом и называются оксид бария. Формула вещества — BaO. Техническая модификация оксида может иметь серый цвет, который ему придает уголь, не полностью выведенный из состава.

Физические свойства
Типичное агрегатное состояние оксида твердое, плотность 5,72 (200С), молярная масса – 153,34 г/моль. Соединение имеет достаточно высокую теплопроводность 4,8-7,8 Вт/(мК)(80-1100К), и тугоплавкость температура кипения – 20000С, плавления – 19200С. Оксид бария был открыт в 1774 году Шееле Карлом Вильгельмом.
Получение
Существует несколько способов выделения такого вещества, как оксид бария. Применяются они в соответствии с поставленной целью и количеством получаемого вещества. Для лабораторных и промышленных условий подходят все способы, поэтому как получить оксид бария выбирает производитель. Применяемые методы:
- Кальцинированием предварительно осажденного нитрата бария, которое происходи с выделением чистого кислорода. 2Ba(NO3)2 = 2BaO + 4NO2 + O2.
- Реакция взаимодействия с кислородом металлического бария. 2Ba + O2 = 2BaO. Катализатором служит температура 500-6000С, в этом случае не исключено получение пероксида. 2Ba + O2 = 2BaO2. При дальнейшем нагревании до 7000С вещество распадается на свободный кислород и оксид бария.
- Для процесса разложения карбоната бария на оксид и углекислый газ необходимо воздействие высокой температуры. BaCO3 = BaO + CO2. Для получения более чистого конечного вещества необходимо удалить излишки углекислорода.
Химические свойства
Большинство бинарных соединений металла с кислородом проявляют основные свойства. Уравнение оксида бария (формула ВаО) показывает, что данное вещество относится именно к таким окислам. При этом данное соединение является солеобразующим. Типичные химические взаимодействия происходят со следующими классами веществ:
- Взаимодействие с водой происходит достаточно бурно, с выделением тепла и образование щелочного раствора. BaO + H2O = Ba(OH)2.
- С кислородом оксид взаимодействует при наличии катализатора (высокая температура 600-5000С), результатом является пероксид, разлагаемый в дальнейшем на составные части для выделения чистого металла или оксида. При этом необходимо увеличить нагрев до 7000С. 2Ba + O2 = 2BaO2.
- Как типичный основной оксид бария взаимодействует с кислотами, в результате химической реакции получается вода и соответствующая соль. BaO + H2SO4 = H2O + BaSO4 или BaO + 2HCI = H2O + BaCI2.
- Кислотные оксиды вступают в реакцию с BaO, результатом взаимодействия являются соли. BaO + CO2 = BaCO3 или BaO + SO3 = BaSO4.
- Для высвобождения чистого бария оксид прокаливают с металлами, которые забирают выделяемый кислород. В качестве таковых выступают кремний, алюминий, цинк или магний.
Применение
Барий и его соединения дают очень мощную яркость цвета при покрытии поверхности других веществ. Поэтому оксиды марганца и бария служат единицами измерения коэффициента яркости. Используется для получения зеленого цвета в пиротехнике, при декоративной отделке в составе глазурей и эмалей. Достаточно низкая стоимость обработки и получения, высокий уровень выделения тепла дает возможность использования окисла в качестве катализатора при проведении химических реакций. В частности, данное вещество применяется для выделения чистого металла (Ва), получения гидроксида и пероксида. Производство керамики, используемой при наиболее низких температурах (жидкий азот), происходит с участием оксида бария. В процесс синтеза включаются редкоземельные металлы и окись меди. Достаточно широк спектр применения вещества в приборостроении. Оксид бария используется для покрытия осциллографических и телевизионных трубок, различных видов катодов, электронновакуумных изделий. Служит в качестве активной массы для мощных аккумуляторов медноокисного вида. Оксид бария является одним из основных элементов в составе стекла, которое имеет достаточно специфичное направление применения, используется для покрытия поверхности стержней из урана. Для создания оптических стекол данное вещество так же незаменимо.
Ba2O Ba2O2
BaO BaO2
BaO
Оксид бария BaO – бесцветные кристаллы, т. пл. 20170С, ∆Нобр0 = — 548 кДж/моль.
В свободном состоянии барий может быть получен накаливанием окисла с металлическим алюминием в высоком вакууме по реакции
3BaO + 2Al = Al2O3 + 3Ba
BaO + C = BaC2 + …
При растворении BaO в воде образуется сильное основание Ba(OH)2. Раствор Ba(OH)2 («баритовая вода») применяется для открытия CO2.
На воздухе барий покрывается пленкой, наряду с нормальным окислом BaO частично содержащей также перекись BaO2 и нитрид Ba3N2. При незначительном нагревании на воздухе барий воспламеняется. Он загорается и в обычных условиях уже при простом раздавливании.
Получают BaO термическим разложением BaCO3 при 700-9000С или BaO2 при 500-6000С.
Прокаливанием BaO в парах бария получают нестехиометрические оксиды – голубые кристаллы. Нестехиометрические оксиды – компоненты твердых растворов (вместе с SrO и CaO), являющихся материалами оксидных катодов электронно-лучевых трубок, видиконов, фотоэлектрических преобразователей тока и др. электронно-вакуумных устройств. BaO является активной частью подавляющего большинства термоэмиссионных катодов.
BaO2
BaO2 – бесцветные кристаллы, ∆Нобр0 = — 623 кДж/моль.
Перекись бария используется при получении перекиси водорода
BaO2 + 2H2O = H2O2 + Ba(OH)2
Известны реакции
BaO2 + HgCl2 = BaCl2+ Hg + O2
BaO2 + 2ClO2 = Ba(ClO2)2 + O2
Образование перекиси бария по этой реакции сильно ускоряется следами водяного пара.
2BaO + O2 = 2BaO2
Дальнейшее нагревание ведет, наоборот, к распаду BaO2 на окись бария и кислород
2BaO2 = 2BaO + O2
Поэтому сжигание металлического бария сопровождается образованием только его окиси.
Технически BaO2 получают нагреванием BaO в токе воздуха до 5000С.
BaO2 – источник чистого кислорода, компонент пиротехнических составов, отбеливатель для тканей, бумаги.
Оксид бария — соединение бария с кислородом, имеющее химическую формулу BaO. Является основным оксидом. При стандартных условиях представляет собой бесцветные кристаллы с кубической решёткой [1].
Получение
1. Взаимодействие металлического бария с кислородом:
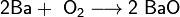
В этом случае наряду с оксидом бария образуется пероксид бария:
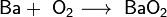
2. Разложение карбоната бария при нагревании:
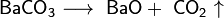
3. Разложение нитрата бария.
Химические свойства
1. Энергичное взаимодействие с водой с образованием щёлочи и выделением тепла:
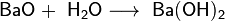
2. Взаимодействие с кислотными оксидами с образованием соли:
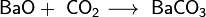
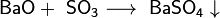
3. Взаимодействие с кислотами с образованием соли и воды:
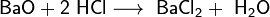

4. Взаимодействие с кислородом при температуре около 600 °C с образованием пероксида:
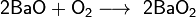
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием [3].
Применение
Поскольку работа выхода оксида бария низка, то при невысокой стоимости и технологичности он давно и широко применяется для покрытия катодов различных электронно-вакуумных приборов, телевизионных, осциллографических трубках и др.
Также используется для производства некоторых видов стекла, например, оптического.
В некоторых реакциях используется как катализатор.
Яркость поверхности, покрытой оксидом бария или оксидом магния, принимается за единицу при измерениях коэффициента яркости других поверхностей.
Пероксид бария — химическое соединение бария с кислородом, имеющее химическую формулу BaO2.
Физические свойства
Соединение представляет собой белый или темно-серый порошок, плохо растворимый в воде [2]. С водой образует кристаллогидраты BaO2•8H2O и BaO2•H2O.
Получение
- Нагревание оксида бария BaO в среде кислорода при 500 °C:

- Сильное прокаливание Ba(NO3)2, BaCO3 или Ba(OH)2 в токе воздуха в присутствии следов воды[2].
- Осаждение из водных растворов солей концентрированным пероксидом водорода в щелочной среде:

Химические свойства
- Взаимодействует с концентрированной серной кислотой, образуя сульфат бария, озон и воду:
BaO2 + H2SO4(конц.) → BaSO4 + H2O + O3
- При нагревании свыше 500 °C разлагается:
- При нагревании в избытке кислорода под высоким давлением получают надпероксид бария BaO4 — неустойчивое (разл. свыше 50 °C) жёлтое вещество[2], которое легко разлагается в воде с выделением кислорода:
- При нагревании с озоном в атмосфере фреона образуется озонид бария BaO6.
Результаты поиска:
Результаты поиска:
правил карточных игр: Бао Хуан
Эта страница основана на информации Ши Джи, Джеймса Камминга и Лео Хонга.
Введение
Эта китайская альпинистская игра для пяти игроков, как говорят, возникла в провинции Шаньдун, и в начале 21-го века она стала популярной во многих северных районах Китая и в Интернете. Băo huáng (保皇) означает «защищать императора», и игру также часто называют dìwáng (帝王), что означает «император».В каждой сделке два игрока, император и его покровитель евнух ( xiao baozi : 小 孢子), играют против команды из трех человек, фермеров или людей ( пинг мин: 平民). Император и евнух — держатели определенных карт. Хотя император известен с самого начала, его защитник остается скрытым до тех пор, пока карта не будет разыграна.
Как и во всех альпинистских играх, цель состоит в том, чтобы избавиться от своих карт (и помочь своим партнерам в этом), разыгрывая их по отдельности или в комбинациях, где каждая игра должна побеждать предыдущую игру.
Существует много вариантов этой игры. Версия, описанная в основном отчете, довольно широко распространена, и ее играют, например, в Rizhao (日照) в провинции Шаньдун. Альтернативные правила, о которых я знаю, приведены в разделе вариантов. Я был бы рад услышать от любого, кто знает больше об этих или других версиях этой игры.
Игроки и карты

 В игре пять игроков и используется колода из 168 карт. Это может быть сделано из четырех стандартных 52-карточных колод, из которых удалены 3, 4 и 5 плюс четыре красных джокера и четыре черных джокера.Костюмы не имеют значения в этой игре, и карты ранжируются от высокого к низкому:
В игре пять игроков и используется колода из 168 карт. Это может быть сделано из четырех стандартных 52-карточных колод, из которых удалены 3, 4 и 5 плюс четыре красных джокера и четыре черных джокера.Костюмы не имеют значения в этой игре, и карты ранжируются от высокого к низкому:
Красный джокер , Черный джокер, 2, A, K, Q, J, 10, 9, 8, 7, 6.
Один красный джокер и один черный джокер отмечены спереди, и держателями этих двух карт будут император и евнух, соответственно. Хотя можно использовать стандартные англо-американские карты, игра достаточно популярна, так что для этой игры можно получить специальные колоды из 168 карт с уже напечатанными картами императора и евнуха.
Сделка и игра обычно против часовой стрелки.
Сделки и партнерства
Карты перемешиваются и складываются лицевой стороной вниз. Как и в большинстве китайских игр, они не распространяются одним игроком. Вместо этого игроки берут свои собственные карты из верхней части колоды, по одной карте за раз, пока не будут взяты все карты. Игрок справа от перетасованного игрока режет карты, а следующий справа игрок берет первую карту. Поскольку количество карт не делится на пять, у некоторых игроков будет на одну карту больше, чем у других.Игроки держат свои карты, чтобы они могли видеть свои лица, а их противники — нет.
Для последующих раздач терн и брать первую карту проходит против часовой стрелки. Игрок, который взял первую карту в предыдущей раздаче, должен срезать, а следующий игрок должен взять первую карту.
Держать в руках 34 или 35 карт будет необычным опытом для большинства западных игроков. В Китае игроки часто держат свои карты более чем в одном ряду или в некотором массиве с одинаковыми картами в столбце, как на фотографиях.

Держателем отмеченного красного джокера (карты императора) является император (или король), а владельцем отмеченного черного джокера является защитник императора (также известный как евнух или роялист), который играет в качестве партнера императора. Другие три игрока — простые люди, также известные как фермеры или революционеры. Держатель карты императора может выбрать не быть императором: в этом случае карта императора передается следующему игроку слева. В обмен не дается ни одна карта: у первоначального держателя карты императора теперь на одну карту меньше, а у нового императора на одну карту больше, чем было разыграно изначально.Если новый император не хочет этой роли, он или она может снова передать карту, и это продолжается по часовой стрелке вокруг стола, пока она не будет получена кем-то, кто желает стать императором. В необычном случае, когда ни один из других игроков не хочет быть императором, так что карта императора передается по всему столу и обратно игроку, который изначально ее держал, этот игрок должен быть императором.
Личность императора всегда известна, даже если карта не передана, потому что император начинает игру.Однако партнер императора и простые люди могут молчать о том, на чьей они стороне. В этом случае простые люди изначально не будут знать, какой игрок защищает императора: они могут заподозрить, кто это, наблюдая, кто, кажется, помогает императору во время игры, но это будет известно наверняка, только когда отмеченный черный джокер играл. Тем не менее, любой из других игроков может решить объявить о своей верности, за или против императора, до начала игры, и это удваивает счет за игру.Когда один из простых людей заявляет об этом, это называется восстанием ( zàofăn — 造反). В случае восстания другие игроки могут объявить или нет, как они хотят, без дальнейшего влияния на счет.
Если один игрок держит карты императора и евнуха, этот игрок будет играть один против команды из четырех человек. Император может ничего не сказать об этом, и в этом случае другие игроки изначально не поймут, что это ситуация. В качестве альтернативы император может объявить до начала игры, что он или она играет один, и это удваивает счет.Если император не хочет играть один, этого можно избежать, передав карту императора влево.
Во второй и последующих сделках есть штраф за проигравших предыдущей сделки. После того, как все карты были взяты, члены команды, потерявшей предыдущую сделку, должны отдать свою самую высокую карту, кроме джокера: обычно это две. Эти высокие карты кладутся на стол лицевой стороной вниз, забираются членами команды-победителя и добавляются в их руки.Император из предыдущей сделки должен отдать свои лучшие двух карт (кроме джокеров), если команда императора проиграла, и берет двух старших карт, предложенных фермерами, если команда императора выиграла. Император, который играл один, даст или получит четыре карты в следующей раздаче.
Если предыдущая сделка была ничьей (нулевой счет), дань не дается.
играбельных комбинаций
Карты могут быть сыграны по отдельности или несколько раз.Когда разыгрывается более одной карты, карты должны составлять играбельных комбинаций . Воспроизводимые комбинации:
- Любое количество одинаковых карт, независимо от масти, например, 8-8 или Q-Q-Q-Q или 9-9-9-9-9-9-9 .
- Любое количество равных карт вместе с любым количеством джокеров любого цвета, например, 7-7-черный или 6-красный или K-K-K-черно-красный . Комбинация, включающая одного джокера, называется guà le yī ge (hanging 了 一个: одна карта висит), с двумя джокерами guà le liăng ge (挂 了 两个: пара карт висит), с тремя джокерами 挂三个 三个 и так далее.
- Любое количество джокеров любого цвета, например черно-черно-красный .
Одна карта может быть побита только одной более высокой картой. Комбинация бьет ранее сыгранную комбинацию тогда и только тогда, когда
- это играбельно, а
- имеет одинаковое количество карт, а
- каждая карта новой комбинации бьет соответствующую карту предыдущей комбинации.
Так, например:
- 7-7-7 может быть побежден 10-10-10 , который может быть побит AAA , который может быть побит 2-2-2 (два из них выше, чем туз в этом игра), которую могут победить только три джокера;
- 8-8-8-8 может быть побежден 9-9-9-чёрным , который может быть побит QQQ-красным , но 8-8-8-чёрный делает , а не 8-8-8-8 ;
- любая комбинация с красным джокером непобедима;
- комбинация, содержащая черных джокеров, может быть побеждена только , только старшей комбинацией, содержащей как минимум столько же красных джокеров — например, , 7-7-черный-черный может быть побита , 9-9-красный-красный или K-черный-красный-красный , но , а не от Q-черный-черный-красный (поскольку только один из черных джокеров в первой комбинации был побежден) и не по 7-7- красно-красный (так как 7 не бьет 7).
Play
Император начинает с каждой отдельной карты или игровой комбинации. Все игроки в порядке против часовой стрелки могут либо сдать — например, ‘bùyào’ (不要) или ‘guò’ (过) — или победить его, разыгрывая старшую карту или комбинацию. Как объяснялось выше, каждая игра должна состоять из одинакового количества карт и должна быть выше, чем в предыдущей игре. Это продолжается столько раз, сколько необходимо, пока никто не сможет и не захочет побить последнюю карту или комбинацию, которая была сыграна.Когда за игрой следуют последовательные пасы от всех других игроков, игрок, сыгравший последнюю (непобедимую) комбинацию, начинает снова и может разыграть любую карту или игровую комбинацию.
Обратите внимание, что передача не мешает игроку играть на его или ее следующем ходу, если кто-то еще играл за это время.
Игрок, чья игра в настоящее время непобедима, может попросить других игроков не побить его, сказав «zhàn pái» (站 牌). Если команды еще не известны, это может дать представление о том, на какой стороне находится игрок или может быть обманчивым.Другие игроки не должны подчиняться.
Когда у игроков заканчиваются карты, они выпадают из игры, а остальные продолжают, пока все члены одной или другой команды не разыграют все свои карты. Если кто-то разыграет свои последние карты и они не побиты, ход, чтобы возобновить игру с любой картой или комбинацией, которую можно сыграть, переходит к следующему игроку справа, у которого еще есть карты.
забил
Когда у императора есть партнер, оценка каждой команды определяется порядком, в котором финишировали ее игроки: +2 балла за игрока, который финиширует первым, +1 балл за второй, 0 за третий, -1 за четвертый и -2 за последний.Так, например, если команда императора займёт 1-е и 3-е место, их результат будет +2 (= + 2 + 0), а команда людей получит -2 (= + 1-1-2) за 2-й, 4-й и 5-й. Каждый из простых людей и партнер императора набирает сумму, набранную их командой, а император получает двойную оценку. Таким образом, в приведенном выше примере император набирает +4 за руку, евнух набирает +2, а люди набирают -2 каждый.
Если партнер императора или кто-либо из простых людей объявит, на какой стороне они находятся, перед игрой, вышеуказанные оценки удваиваются.
Когда император играет один и идет первым, император получает +12, а остальные игроки получают по -3 каждый. Когда император играет один и идет вторым, каждый получает 0, а если император играет один и идет третьим или хуже, император получает -12, а люди получают +3 каждый.
Если император заявляет, что он или она играет один, или если кто-либо из противников императора объявляет восстание, эти очки удваиваются (+ 24 / -6 или -24 / + 6).
Шестых Сыграно Последние
Бао Хуан часто играется с дополнительным правилом, согласно которому шестерки (младшие карты) должны быть сыграны последними.В этой версии запрещено играть шестерку, пока в руке нет ничего, кроме шестерок. Шестерки не могут быть объединены с джокерами в этой версии.
Игра в этом варианте несколько сложнее. Для того, чтобы быть первым из карт, необходимо сохранить выигрышную комбинацию для вашей второй до последней игры, чтобы закончить, ведя все свои шестерки. Если ваша вторая до последней игры побита, вы обречены быть последними, если только игрок перед вами не закончил с непобедимым набором шестерок, что позволит вам вести свои шестерки дальше.
Другие вариации
216 карточек
Бо Хуан довольно часто разыгрывается с четырьмя полными колодами плюс джокерами, всего 216 карт, включая 3, 4 и 5. В этом случае 3 — самые младшие карты, затем 4, 5, 6 и т. Д.
Выбор партнера императора
Многие игроки не используют отмеченного черного джокера для выбора партнера императора. Вместо этого император должен показать три одинаковые карты, а держателем четвертой соответствующей карты является евнух, который защищает императора.Если вы получили карту императора и у вас нет трех одинаковых карт, вы должны передать карту императора слева. Если карта императора передается полностью за стол обратно первому игроку, а у первого игрока нет трех одинаковых карт, ее необходимо передать обратно ближайшему игроку, вращающемуся против часовой стрелки, у которого есть три одинаковые карты — это последняя квалифицированный игрок, который отверг это. Если ни у кого нет трех одинаковых карт, карты добавляются, и начинается новый розыгрыш того же игрока.
Император, имеющий четыре одинаковых карты, может играть в одиночку, показывая три из этих карт и не раскрывая четвертую, или может объявить и удвоить счет, показывая все четыре одинаковые карты.
Передача на карту императора
Некоторые играют, что если в ходе сделки карта императора передается более одного раза, второй и последующие игроки должны передать свою наивысшую отдельную карту, кроме карты императора, следующему игроку слева вместе с картой императора.Только игрок, который изначально вытянул карту императора, может передать ее без сопроводительной карты.
Solo Usurper ( Qiăng dú — 独 独)
Некоторые разрешают любому игроку до начала игры требовать карту императора у того, у кого она есть, и заявляют, что они будут играть в одиночку (оценка: 24 очка, так же, как когда любой император объявляет игру в одиночку). Предположительно, оригинальный держатель карты императора также может сделать это, если не требуется партнер.
Открытые карты дани
Некоторые играют, когда проигравшая команда кладет свои наивысшие карты (кроме джокеров) на стол лицевой стороной вверх, и они берутся победившей командой в порядке их финишной позиции в предыдущей раздаче.
Рейтинг джокеров
Некоторые играют, что отмеченный красный джокер выше, чем другие красные джокеры.
Несколько человек играют, что красный джокер может быть побежден тремя двумя.
Порядок играбельных комбинаций
Немногие играют, когда играют комбинацию, включающую джокеров, только джокеры бьют соответствующие карты предыдущей игры. Достаточно, чтобы обычные карты были равны. С этим правилом 9-9-9-9 может быть побежден 9-9-9-черный , который может быть побит 9-9-9-красный .Однако джокеров нужно побеждать, а не равнять, поэтому комбинация, включающая красного джокера, по-прежнему непобедима. Кроме того, набор обычных карт может быть побит другим набором того же ранга, если используется джокер.
Играть без начисления очков
Некоторые игроки не ведут счет. Вместо этого результат каждой сделки выглядит следующим образом:
- Если первый и последний игроки, у которых закончились карты, принадлежат противоположным командам, команда первого игрока выигрывает, а команда последнего игрока проигрывает.
- Если у императора есть партнер, а первый и последний игроки принадлежат к одной команде, игра является ничьей (в следующей раздаче карты дани не выдаются).
- Если император одинок, он выигрывает, если у него закончились карты, и проигрывает иначе.
Направление игры
Иногда вся игра ведется по часовой стрелке, а не против часовой стрелки.
Другие сайты Бао Хуан
В онлайн-энциклопедии Baidu Baike есть страница с описанием Бао Хуан.
Бао Хуан можно сыграть на популярном китайском онлайн-сайте QQ games.
Набор правил на китайском языке можно найти на homygame.com.
,| BAO | Выход базальтовой кислоты Медицина »Физиология | Оценить: | ||||||||||||||||||||||||||||||||||||
| BAO | Unsell | Оценить: | ||||||||||||||||||||||||||||||||||||
| BAO | Атмосферная обсерватория Боулдер Академические науки »Наука об океане | |||||||||||||||||||||||||||||||||||||
Брюс Артвик Организация Бизнес »Компании и фирмы | Оценить: | |||||||||||||||||||||||||||||||||||||
| BAO | Только по назначению | 000000000000 Разное 9001 7 Оценить: | ||||||||||||||||||||||||||||||||||||
| BAO | Поле боя Аэрозоли и мракобесы Правительственные »Военные | Оценить: | 9000 Все | 9000 Все должны быть полезны Оптимизация | Оценить: | |||||||||||||||||||||||||||||||||
| BAO | Baccalaureus в Арте Obstetricia Разное» классифицировано | Оценить он: | ||||||||||||||||||||||||||||||||||||
| BAO | Барионная акустических колебаний Разное »классифицировано | Оценить: | ||||||||||||||||||||||||||||||||||||
| BAO | артерии Окклюзия Медицина» Briti ш Медицина | Оценить: | ||||||||||||||||||||||||||||||||||||
| BAO | Брух Artwick Организация Разное »классифицировано | Оценить: | ||||||||||||||||||||||||||||||||||||
| BAO | Business Access Object Business — и многое другое… | Оценить: | ||||||||||||||||||||||||||||||||||||
| BAO | Бакалавр акушерства (Arte Obstetricia) Академические науки и науки »
Реагируйте с помощью TypeScript: компоненты как объявления функций и выражения функций | JavaScript Joe  Фотография Николь Вольф на Unsplash Фотография Николь Вольф на UnsplashКогда я впервые начал изучать TypeScript и использовать его с React, я следовал шаблонам. Друг показал мне, как набрать компонент. Я использовал это в качестве примера всякий раз, когда создавал новый компонент. Этот пример выглядел примерно так: const MyComponent: React.FC = () => |