Тесты по основаниям с ответами
Ответы в файле для скачивания
1. К щелочам относится основание:
а) Ba(OH)2 б) Cu(OH)2 в) CaSO3
2. К щелочам относится основание:
а) Mg(OH)2 б) NaOH в) Cu(OH)2
3. К щелочам относится основание:
а) Al(OH)3 б) Mg(OH)2 в) KOH
4. Между собой реагируют:
а) гидроксид меди (II) и соляная кислота
б) карбонат бария и гидроксид меди (II)
в) гидроксид магния и нитрат свинца (II)
5. Выберите правую часть уравнения Ca(OH)2 + h3SO4 =
а) CaSO3 + h3O б) CaSO4 в) CaSO4 + 2h3O
6. При разложении нерастворимых основании в ходе нагревания образуется:
а) металл, водород и кислород б) оксид металла и вода
в) оксид металла и водород
7. Основания – это:
а) сложные вещества состоящие из металла и кислотного остатка
б) сложные вещества состоящие из водорода и кислотного остатка
в) сложные вещества, состоящие из атомов металла и гидроксогруппы
8. Выберите правую часть уравнения Ca(OH)2 + SO2 =:
а) CaSO3 + h3O б) CaSO4 + h3O в) CaSO4 + 2h3O
 В щелочной среде метилоранж окрашивается в такой цвет:
В щелочной среде метилоранж окрашивается в такой цвет:а) оранжевый б) синий в) желтый
10. При реакции нейтрализации продуктами являются:
а) кислота и вода б) соль и вода в) соль и водород
11. Какое количество вещества оксида меди (II) образуется при разложении из 9,8 г гидроксида меди (II):
а) 0,1 б) 0,01 в) 0,11
12. Выберите правую часть уравнения CaO + h3SO4 =:
а) CaSO3 + h3O б) CaSO4 + h3O в) CaSO4
13. Соединение состава Сu(OH)2 называется:
а) гидроксид меди (II) б) медный купорос в) гидрид меди (II)
14. В щелочной среде малиновую окраску приобретает индикатор:
а) лакмус б) метиловый оранжевый в) фенолфталеин
15. Какое из приведенных ниже веществ является основанием:
а) Fe(OH)2 б) СаО в) Na2SO4
16. При нагревании разлагается:
а) гидроксид аммония б) гидроксид меди (II) в) гидроксид лития
17. Щелочь не взаимодействует с:
а) кислотой б) кислотным оксидом в) основным оксидом
18. Формулы только оснований записаны в ряду:
а) Li2O, Na2O, Cu(OH)2 б) NaOH, KOH, Al(OH)3 в) К2О, КОН, Fe(OH)2
19.
 В щелочах окраска лакмуса меняется на:
В щелочах окраска лакмуса меняется на:а) желтую б) малиновую в) синюю
20. С какими веществами реагирует раствор NaOH:
а) h3SO4, SO2, K2SO4 б) HCl, CO2, AlCl3 в) СО2, Сu, Cu(OH)2
21. Что образуется при взаимодействии NaOH с СО2:
а) соль и вода б) соль и кислота в) основание и оксид
22. Основание диссоциирует на:
а) катионы водорода и анионы кислотного остатка
б) катионы металла и гидроксид анионы
в) катионы металла и анионы кислотного остатка
23. Формулы только щелочей записаны в ряду:
а) Cu(OH)2, Al(OH)3, Zn(OH)2 б) NaОH, КОН, Fe(OH)2
в) NaOH, KOH, Ba(OH)2
24. Гидроксиду натрия соответствует формула:
а) ZnOH б) Zn(OH)2 в) ZnO
25. Малорастворимым основанием является:
а) Cu(OH)2 б) Pb(OH)2 в) Са(OH)2
27. Какое уравнение соответствует реакции нейтрализации:
а) НСl + KOH =KCl + h3O б) НСl + Zn = ZnCl2 + h3
в) НСl + AgNO3 = AgCl + HNO3
28.
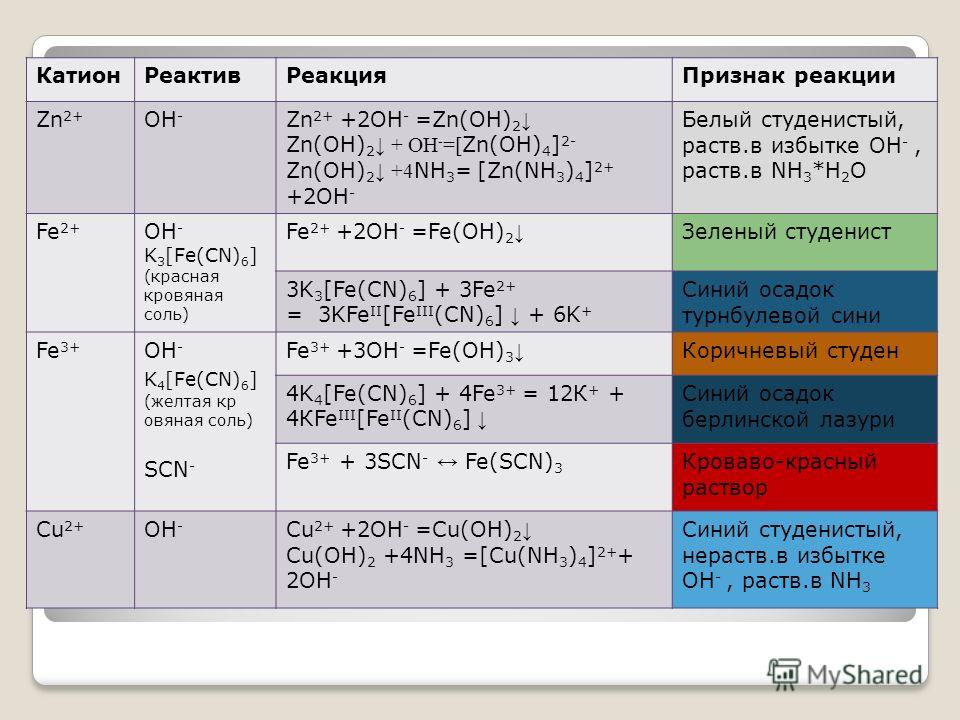 -` даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
-` даже в растворах нерастворимых оснований определяют свойства этого класса соединений.Классификация оснований
|
Признак классификации |
Тип оснований |
Примеры |
|
Число гидроксогрупп в молекуле |
Однокислотные |
`»NaOH», «KOH», «NH»_4″OH»` |
|
Двухкислотные |
`»Ca(OH»)_2, «Fe(OH»)_2` |
|
|
Трехкислотные |
`»Mn(OH»)_3, «Co(OH»)_3` |
|
|
Растворимость в воде и степень диссоциации |
Растворимые в воде сильные основания (щёлочи) |
`»LiOH», «NaOH», «KOH», «Ca(OH»)_2, «Ba(OH»)_2` |
|
Нерастворимые в воде, слабые основания |
`»Fe(OH)»_2, «Fe(OH)»_3, «Cu(OH)»_2` |
Химические свойства оснований и амфотерных гидроксидов
Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов:
$$ 2\mathrm{Fe}(\mathrm{OH}{)}_{3}\stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{Fe}}_{2}{\mathrm{O}}_{3} + 3{\mathrm{H}}_{2}\mathrm{O}$$;
Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации.
`»Cu(OH)»_2+»H»_2″SO»_4 -> «CuSO»_4+2″H»_2″O»`.
Амфотерные гидроксиды реагируют со щелочами при сплавлении с образование солей:
$$ \mathrm{Al}(\mathrm{OH}{)}_{3} + \mathrm{NaOH} \stackrel{\mathrm{t}°\mathrm{C}}{\to } {\mathrm{NaAlO}}_{2} + 2{\mathrm{H}}_{2}\mathrm{O}$$.
`2″Al»(«OH»)_3+3″H»_2″SO»_4 -> «Al»_2(«SO»_4)_3+6″H»_2″O»`.
Гидроксид алюминия растворяется в щелочах, но не растворяется в растворе аммиака.
Амфотерные гидроксиды реагируют со щелочами при сплавлении с образование солей:
Zn(OH)2+2NaOH→t°CNa2ZnO2+2h3O\mathrm{Zn}(\mathrm{OH}{)}_{2}+2\mathrm{NaOH}\stackrel{t°\mathrm{C}}{\to }{\mathrm{Na}}_{2}{\mathrm{ZnO}}_{2}+2{\mathrm{H}}_{2}\mathrm{O};
Однако, взаимодействие амфотерных гидроксидов с водными растворами щелочей приводит к образованию комплексных соединений:
`»Zn(OH)»_2+2″NaOH»->»Na»_2[«Zn(OH)»_4]`;
Правильнее: `2″NaOH»+»ZnO»+»H»_2″O»->»Na»_2″[Zn(OH)»_4]`;
Гидроксид цинка растворяется как в щелочах, так и в растворе аммиака:
Zn(OH)2 + 4Nh4 → [Zn(Nh4)4](OH)2 гидроксид тетрааминцинка\underset{\mathrm{гидроксид} \mathrm{тетрааминцинка}}{\mathrm{Zn}(\mathrm{OH}{)}_{2} + 4{\mathrm{NH}}_{3} \to [\mathrm{Zn}\left({\mathrm{NH}}_{3}{)}_{4}\right](\mathrm{OH}{)}_{2} }\phantom{\rule{0ex}{0ex}}
Гидроксид меди (II) не реагирует со щелочами, но растворяется в растворе аммиака:
`»Cu»(«OH»)_2+4″NH»_3 -> [«Cu»(«NH»_3)_4](«OH»)_2`.
Гидроксид магния не реагирует ни со щелочами, ни с аммиаком, но растворяется в растворе хлорида аммония:
`»Mg»(«OH»)_2+2″NH»_4″Cl»->»MgCl»_2+2″NH»_3 uarr +2″H»_2″O»`.
What, How to Balance & FAQs —
By Rakibul Islamic
Йодоводородная кислота является сильной кислотой и может реагировать с сильным основанием, таким как гидроксид бария. Сообщите нам некоторые факты о реакции между HI + Ba(OH) 2 .
HI — бесцветный газ с неприятным запахом. Гидроксид бария имеет химическую формулу Ba(OH) 2 . Это прозрачный белый порошок без запаха. Он ионный по своей природе, с двумя ионами гидроксида на молекулу гидроксида бария (Ba(OH) 2 ) в водном растворе.
В этой статье мы узнаем о межмолекулярных силах, окислительно-восстановительной реакции, сопряженных парах и т. д. реакции между HI + Ba(OH) 2 .
Что является продуктом HI и Ba(OH) 2 ? BaI 2 и вода являются продуктом, образующимся при взаимодействии HI с Ba(OH) 2 .
HI + Ba(OH) 2 = BaI 2 + H 2 O
Какой тип реакции HI + Ba(OH) 2 ?Реакция между HI + Ba(OH) 2 является кислотно-основной реакцией, где HI, будучи сильной кислотой, нейтрализует сильное основание, такое как Ba(OH) 2 , с образованием BaI 2 в виде соли и вода.
Как сбалансировать HI + Ba(OH) 2 ?Мы должны выполнить следующие шаги, чтобы сбалансировать HI + Ba(OH) 2 :-
- Сначала запишите общее уравнение реакции.
- Затем мы определяем состояние (s, l, g, aq) для каждого реагента и продукта.
- Поскольку HI является сильной кислотой, она полностью диссоциирует на составляющие его ионы в водном растворе.
- После этого мы уравновешиваем количество молей каждого элемента по обе стороны уравнения.

- Реакция уравновешена, и уравновешенная реакция представлена как –
2 HI (водн.) + Ba(OH) 2 (водн.) = BaI 2 (водн.) + 2 H 2 O (водн.)
22 2 титрованиеТитрование реакции HI + Ba(OH) 2 является кислотно-основным титрованием. Так как HI — сильная кислота, а Ba(OH) 2 — сильное основание. Титрование можно проводить, следуя приведенной ниже процедуре:
Используемый аппаратХимические стаканы, промывная бутыль, мешалка, пипетка, дистиллированная вода, коническая колба, мерная колба и пипетка.
ИндикаторВ этом титровании в качестве основного индикатора используется фенолфталеин, который используется для определения конечной точки титрования.
Процедура- Йодоводородная кислота, которая является сильной кислотой в водном растворе, сначала помещается в коническую колбу, а затем титруется сильным основанием Ba(OH) 2 .

- Затем к нему добавляют 1 или 2 капли фенолфталеина.
- Затем титруют известной концентрацией сильного основания Ba(OH) 2 . После этого к раствору HI по каплям добавляют раствор Ba(OH) 2 до тех пор, пока раствор не станет розовым и не будет определена конечная точка.
- После этого записываем количество объемов, необходимых для нейтрализации раствора йодистоводородной кислоты.
- Описанные выше шаги повторяются три раза, пока не будут получены три последовательных показания.
Чистое ионное уравнение между HI + BA (OH) 2 IS —
2 H + + 2 I 4 2 H + + 2 I 40002 2 H + + 2 I 40002 2 H + + 2 I 2 H + + 2 I
Для записи результирующего ионного уравнения необходимо выполнить следующие шаги: —
- Напишите уравнение реакции.

- Затем запишите физическое состояние каждого реагента и продукта.
- 2 HI (водн.) + Ba (OH) 2 (водн.) = BaI 2 (водн.) + 2 H полностью диссоциируют с образованием ионов 2 H + и 2 I + .
- 2 HI (водн.) = 2 H + + 2 I –
- В Ba (OH) 2 барий имеет формальный заряд +2, а гидроксид имеет формальный заряд -1, поэтому он диссоциирует на Ba 2+ и 2 OH – .
- BA (OH) 2 (aq) = BA 2+ + 2 OH —
- на стороне продукта сбалансированного уравнения, BAI 2 Диспациал на BA 2 lepation, BAI 2 Discocliates Into Ba 4 2+ 4018 и 2 I – .
- Таким образом получается чистая ионная реакция.
HI + BA (OH) 2 Реакция имеет следующие конъюгатные пары-
- 70009 .
 Корядов. I – ион.
Корядов. I – ион. - Сопряженная кислота Ba(OH) 2 представляет собой Ba 2+ .
HI + Ba(OH) 2 реакция имеет следующие межмолекулярные силы-
- Силы, действующие на йодистоводородную кислоту, представляют собой силы Лондона и диполь-дипольные взаимодействия.
- Ba (OH) 2 является ионным соединением, поэтому на Ba 2+ и 2 OH – действуют сильные ионные силы притяжения.
HI + Ba (OH) 2 имеет отрицательное значение стандартная энтальпия реакции .
Является ли HI + Ba (OH) 2 буферным раствором? HI + Ba (OH) 2 не является буферным раствором, так как оба являются сильными кислотами и сильными основаниями соответственно . Чтобы раствор считался буферным, он должен состоять из слабой кислоты с ее солью или слабого основания с ее солью .
Чтобы раствор считался буферным, он должен состоять из слабой кислоты с ее солью или слабого основания с ее солью .
HI + Ba (OH) 2 представляет собой полный раствор, поскольку и HI, и Ba (OH) 2 являются сильной кислотой и основанием соответственно, поэтому он полностью диссоциирует на составляющие его катион и анион.
Является ли HI + Ba (OH) 2 экзотермической реакцией?HI + Ba (OH) 2 представляет собой экзотермическую реакцию , так как энтальпия реакции отрицательна.
Является ли HI + Ba (OH) 2 окислительно-восстановительной реакцией? HI + Ba (OH) 2 не является окислительно-восстановительной реакцией, так как степень окисления не изменяется.
HI + Ba (OH) 2 не является реакцией осаждения, так как образующаяся соль полностью растворима в растворе.
Является ли HI + Ba (OH) 2 необратимой реакцией?HI + Ba (OH) 2 является необратимой реакцией, так как мы не можем изменить направление реакции, т.е. мы не можем получить реагенты из продуктов.
Является ли HI + Ba (OH) 2 реакцией замещения?HI + Ba (OH) 2 не является реакцией замещения, поскольку она не принимает форму AB + CD = AD + CB.
Заключение Продукт реакции BaI 2 широко используется для производства йода. Он бесцветен и полностью растворим в воде. Он используется для уплотнения медных отливок, которые были предметом исследования, представленного Электрохимическому обществу.
гидроксид бария и йодистоводородная кислота — Google
AlleBilderVideosShoppingMapsNewsBücher
suchoptionen
Йодоводородная кислота реагирует с гидроксидом бария с образованием йодида бария и воды.
Напишите результирующее ионное уравнение для реакции, которая происходит, когда водная …
homework.study.com › Наука › Химия › Осаждение (химия) Ba(OH)2 = BaI2 + h3O
www.youtube.com › смотреть
02.05.2020 · Есть три основных шага для написания суммарного ионного уравнения для HI + Ba(OH)2 = BaI2 + h3O …
Dauer: 3:25
Прислан : 02.05.2020
HI + Ba(OH)2 = BaI2 + h3O — Chemical Equation Balancer
www.chemicalaid.com › инструменты ›equationbalancer
Баланс реакции HI + Ba(OH)2 = BaI2 + h3O с помощью этого балансировщика химических уравнений! … иодоводород + гидроксид бария = иодид бария + вода.
Ähnliche Fragen
Какова формула гидроксида бария йодистоводородной кислоты?
Какова сбалансированная реакция для соляной кислоты и гидроксида бария?
Какое химическое уравнение для хлорида бария и соляной кислоты?
Как вы представляете реакцию между «гидроксидом бария» и . ..
..
socratic.org › вопросы
Ba(OH)2(aq)+2HI(aq)→BaI2(aq)+2h3O( л). Объяснение: гидроксид бария умеренно нерастворим… однако реакция будет протекать как …
Напишите краткое ионное уравнение реакции, протекающей при водном …
homework.study.com › … › Осаждение (химия)
Ответ на: Напишите краткое ионное уравнение протекающей реакции при смешивании водных растворов гидроксида бария и йодистоводородной кислоты….
Bilder
Alle anzeigen
Alle anzeigen
15 Facts on HI + Ba(OH)2: What, How to Balance & FAQs —
lambdageeks.com › привет-baoh3
Йодоводородная кислота является сильной кислотой и может реагировать с сильным основанием, таким как гидроксид бария. Сообщите нам некоторые факты о реакции между HI + Ba(OH)2.
Решено Напишите суммарное ионное уравнение реакции, которая | Chegg.com
www.chegg.com › вопросы и ответы › пишите-ne…
.




 Корядов. I – ион.
Корядов. I – ион.