Реакция хлорида натрия с водой
Мировая экономика
Нефть Brent и WTI
USD/JPY
USD/AUD
USD/CHF
USD/GBP
USD/CAD
Серебро
Палладий
Золото
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 776)
- Экономика Второй индустриализации России (104 801)
- Этилен (этен), получение, свойства, химические реакции (37 055)
- Программа искусственного интеллекта ЭЛИС (31 887)
- Крахмал, свойства, получение и применение (31 028)
- Природный газ, свойства, химический состав, добыча и применение (30 476)
- Метан, получение, свойства, химические реакции (30 053)
- Целлюлоза, свойства, получение и применение (29 438)
- Пропилен (пропен), получение, свойства, химические реакции (28 320)
- Прямоугольный треугольник, свойства, признаки и формулы (27 557)
Еще технологии
Поиск технологий
 Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия
Подготовка кадровПищевая промышленностьПолучение энергии. ЭлектроэнергетикаПроизводство компьютеров, электронных и оптических изделийПроизводство лекарственных средств и материаловПроизводство машин и оборудованияПроизводство металлических изделийПроизводство прочей неметаллической минеральной продукцииПроизводство резиновых и пластмассовых изделийПроизводство транспортных средств и оборудованияПроизводство электрического оборудованияПромышленность строительных материаловСбор и утилизация отходов, ликвидация загрязненийСельское хозяйство, лесное хозяйство, охота, рыболовство и рыбоводствоСистемы (технологии) управленияСтекольная и фарфоро-фаянсовая промышленностьСтроительствоСупер прорывные технологииТопливная промышленностьТранспортировкаХимическая промышленностьХранениеЦеллюлозно-бумажная промышленностьЧерная и цветная металлургия Поиск технологий
Финансирование:Технологии ожидают финансирования
В процессе разработки:Технологии в процессе разработки
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.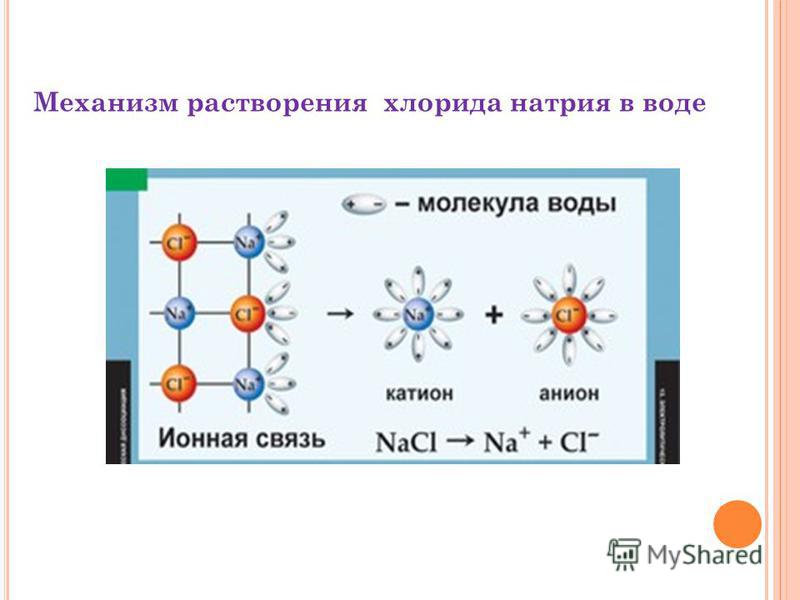
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Может быть интересно:
Реакция воды и натрия: что там происходит
17080
Добавить в закладки
Группа исследователей во главе с Павлом Юнгвиртом (Pavel Jungwirth) из Чешской академии наук в Праге (Чехия) провели эксперимент для изучения деталей детонации натрия в воде. Ученые засняли реакцию с помощью камер замедленной съемки и обнаружили удивительные подробности. Результаты исследования опубликованы в Nature Chemistry.
В ходе популярного эксперимента, известного еще с XIX века, в
обычную воду опускают кусок натрия. Это вызывает мгновенную и
бурную реакцию, а иногда, на радость школьников — и взрыв. Все
дело в том, что натрий является одним из щелочных металлов. В
«чистом виде» при комнатной температуре он представляет собой
твердое вещество, которое, однако, можно резать ножом. Всем
известна поваренная соль. В этом виде натрий стабилен, и мы не
видим подобной реакции, к примеру, подсаливая суп, поскольку в
соли натрий присутствует в виде хлорида. Чистые щелочные металлы
– совсем другое дело. Когда они соприкасаются с водой, происходит
реакция окисления. Электроны покидают металл, выделяется тепло и
газ водород, который может воспламениться. Так описывает процесс
хрестоматийная теория популярного эксперимента. Однако в ней все
еще остаются белые пятна.
В
«чистом виде» при комнатной температуре он представляет собой
твердое вещество, которое, однако, можно резать ножом. Всем
известна поваренная соль. В этом виде натрий стабилен, и мы не
видим подобной реакции, к примеру, подсаливая суп, поскольку в
соли натрий присутствует в виде хлорида. Чистые щелочные металлы
– совсем другое дело. Когда они соприкасаются с водой, происходит
реакция окисления. Электроны покидают металл, выделяется тепло и
газ водород, который может воспламениться. Так описывает процесс
хрестоматийная теория популярного эксперимента. Однако в ней все
еще остаются белые пятна.
Чешские исследователи задались целью выяснить подробности этого
процесса. Поначалу они опускали в воду небольшие кусочки натрия.
Результаты оказались непредсказуемы: вспышка то происходила, то
нет. Причиной нестабильности были незначительные колебания в
размере и форме металла. Тогда ученые использовали смесь жидкого
натрия и другого щелочного металла, калия.
Съемка со скорость тысяча кадров в секунду показала, что через пять миллисекунд, попав в воду, щелочной металл «съеживается», выпуская десятки и сотни «игл». Ученые предположили, что это происходит в силу того, что электроны из металла мгновенно уходят в воду, и в нем происходит накопление положительного заряда. Взаимное отталкивание положительно заряженных частиц разрывает металл, вызывая появление «игл». В свою очередь это увеличивает площадь металла, контактирующего с водой, вызывая бурную реакцию. Компьютерное моделирование, проведенное после эксперимента, подтвердило этот эффект, хотя и на примере значительно меньшего количества натрия из-за ограниченности вычислительной мощности.
Подробное объяснение природы этой реакции — которым, как ни
странно, до сих пор никто не озаботился — может быть применено
для предотвращения подобных взрывов на производственных объектах,
использующих щелочные металлы, например, в некоторых видах
ядерных реакторов, которые охлаждаются жидким металлом.
И добавим о российских химических новостях — не так взрывчато, зато куда фундаментальнее — как сообщал недавно наш портал, российским химикам удалось получить титан с особо низкой радиактивностью, что может быть крайне полезным для экспериментов с элементарными частицами.
вода натрий щелочные металлы
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
Узнайте о химической реакции хлорида натрия с водой
При смешивании хлорида натрия с водой вы получаете порошок без цвета, запаха и вкуса. Он называется хлоридом натрия, и на вкус он похож на соль. Хлорид натрия в быту называют «поваренной солью», потому что он используется для приправы пищи. Химическая формула состоит из NaCl. Там он представлен в виде галита или каменной соли. Чистый хлорид натрия не имеет цвета, но если в нем есть примеси, он может иметь другой цвет. Фиолетовый или синий, желтый или розовый.
Химическая формула состоит из NaCl. Там он представлен в виде галита или каменной соли. Чистый хлорид натрия не имеет цвета, но если в нем есть примеси, он может иметь другой цвет. Фиолетовый или синий, желтый или розовый.
В химическом уравнении это начало хлорно-щелочного процесса, который представляет собой промышленный процесс получения хлора и гидроксида натрия.
2 NaCl + 2 h3O → Cl2 + h3 + 2NaOH
Все ячейки, используемые для этого электролиза, либо сделаны из ртути, либо из резины, либо из мембран. Для каждого из них используется свой метод отделения хлорида от гидроксида, но все они делают одно и то же: разрабатываются другие технологии, потому что электролиз требует много энергии, а небольшие улучшения эффективности могут иметь большое значение для экономики. . Некоторые из вещей, для которых используется хлор, включают ПВХ, дезинфицирующие средства и растворители. Гидроксид натрия помогает предприятиям, производящим бумагу, мыло и алюминий.
Хлорид натрия распадается на ионы Na+ и Cl- при смешивании с водой. Это можно записать в виде химического уравнения
NaCl(s) → Na+(aq) + Cl–(aq)
Поскольку соль растворяется в воде, это химическое изменение. Примером реакции является смешивание хлорида натрия с водой для получения хлорида натрия (или NaCl). Продукты не одинаковы (катион натрия и анион хлора). Таким образом, любое ионное соединение, которое может быть растворено в воде, изменит в результате этого свое химическое состояние. Поскольку растворение чего-то вроде сахара не вызывает химической реакции, когда сахар растворяется, молекулы распространяются по воде, но не меняют свой химический состав.
В соли и воде есть электрические заряды, из-за чего они растворяются в воде на молекулярном уровне, потому что они оба полярны, с положительными и отрицательными зарядами на противоположных сторонах друг друга. Их называют ионными связями, потому что ионы хлора и натрия имеют электрический заряд. Она также ионная, но связь называется ковалентной, при этом два атома водорода имеют положительный заряд с одной стороны атома кислорода, который имеет отрицательный заряд с другой. В воде больше ковалентных связей, чем в молекулах соли, поэтому при смешивании соли и воды соль растворяется.
В воде больше ковалентных связей, чем в молекулах соли, поэтому при смешивании соли и воды соль растворяется.
Ионы хлорида заряжены отрицательно, а ионы натрия – положительно. Положительно заряженные молекулы воды притягиваются к ионам хлора, а отрицательно заряженные молекулы воды притягиваются к ионам натрия. По сути, происходит перетягивание каната, и молекулы воды побеждают. Связь между ионами натрия и хлорида разрывается, когда молекулы воды раздвигают их и раздвигают. Если расщепить соль, молекулы воды окружат атомы натрия и хлорида. На этой диаграмме показано, как это выглядит после этого. Как только это происходит, соль растворяется, в результате получается раствор, который везде одинаков.
Характеристики воды и хлорида натрияВажно знать химические свойства воды:
- Чистая вода не пропускает электричество.
- Сколько тепла может удерживать лед. Это 336 Дж/г.
- Когда вода испаряется, для этого требуется 2260 Дж/г тепла.

- Молекулы воды имеют удельную теплоемкость 4,2 Дж, а это значит, что они могут удерживать много тепла.
- В этом случае значение диэлектрической проницаемости воды очень велико.
- Некоторые вещества можно смешивать с водой.
- Вы можете сказать, что вода имеет две стороны, потому что она состоит из неорганического вещества, которое является полярным.
Вот некоторые из физических свойств воды:
- Водородные связи между молекулами воды улучшают их сцепление друг с другом.
- 100° и 0°C — это температуры, при которых вода закипает и тает.
- Твердые, жидкие и газообразные три формы, в которых вода может находиться.
- Вода имеет полярную природу, а это значит, что она может растворять почти любое вещество и называется универсальным растворителем, потому что она может делать это почти со всем остальным.
- На данный момент вода состоит из кристаллов, которые образуют клеточную структуру в 3-D. Лед может плавать на воде, потому что кристаллическая структура воды имеет много пустот, что делает ее менее плотной, чем вода.

- Известно, что при 4°C плотность воды составляет 0,99 г/мл.
- Очень легко растворяется в воде, но не очень легко или невозможно растворяется в других жидкостях.
- Это белые кристаллы без запаха, но они имеют соленый вкус, который вы можете почувствовать.
- NaCl является хорошим проводником электричества, поскольку ионы могут свободно перемещаться.
- Плавится при 801°C и кипит при 1413°C.
- выглядит как белое кристаллическое вещество. Товарный сорт обычно содержит много хлоридов кальция и магния, из-за чего он затвердевает и становится комковатым.
- При 68°F растворимость больше или равна 100 мг/мл. Он легко растворяется в воде, но мало или совсем не растворяется в других типах жидкости.
- При 77° F плотность составляет 2,165.
- В воздухе при температуре 1589°F давление паров составляет 1 мм рт.ст.
- При нагревании до разложения выделяет токсичные пары соляной кислоты и двуокиси натрия, вредные для здоровья.

- Вязкость насыщенного раствора воды составляет 1,93 мПа-с.
- Растворы хлорида натрия вредны для не очень твердых металлов.
- Его водный раствор имеет pH от 6,7 до 7,3, что означает, что он не кислый и не кислый.
Соединения натрия встречаются в воде естественным образом и со временем. Как мы уже говорили, натрий поступает из горных пород и почвы. В морях, реках и озерах много натрия. В зависимости от геологических условий и загрязнения сточных вод концентрации могут быть намного ниже, чем раньше.
Соединения натрия можно использовать для самых разных целей на рабочем месте, и из-за этого они также могут попасть в воду. Металлургия использует их, а ядерные реакторы используют их в качестве хладагента для охлаждения. Нитрат натрия широко используется как синтетическое удобрение.
Натрий и вода реагируют, и квантовая физика объясняет, почему
Это немного парадоксально: когда мы впервые сталкиваемся с чем-то неожиданным, мы удивляемся, почему это происходит именно так. Но если мы сталкиваемся с явлением достаточно часто, даже если оно должно нас удивлять и требовать объяснения, мы просто принимаем, что мир устроен именно так.
Но если мы сталкиваемся с явлением достаточно часто, даже если оно должно нас удивлять и требовать объяснения, мы просто принимаем, что мир устроен именно так.
Бросьте кристалл соли — простой хлорид натрия — в воду, и он просто растворится.
Добавьте немного хлора в воду, и вы сможете обеззаразить ее: убить бактерии, вирусы и другие болезнетворные микроорганизмы, находящиеся внутри.
А если натрий капнуть в воду? Последовавшая за этим реакция легендарна по своей жестокости.
Как только вы намочите этот кусок металла, реакция закипит и нагреется, натрий подпрыгнет на поверхности воды, и даже возникнет пламя. Конечно, это просто химия. Но на фундаментальном уровне есть нечто большее: между металлическим натрием и молекулами воды (и его диссоциированными ионами) происходят квантовые взаимодействия, которые могут возникнуть немедленно. Хотя заманчиво сказать «это просто химия», физическая причина этой реакции увлекательна и информативна, напоминая нам, что мы должны сохранять любопытство даже к мирским явлениям, к которым мы привыкли во Вселенной.
Хотя есть много способов думать об атомах, химические реакции, которые происходят между натрием и водой, имеют наибольший смысл, если вы думаете об атомах как о «благородных газах» с дополнительными протонами в их ядре и дополнительными электронами в их валентности. снаряды. Натрий, например, очень похож на благородный газ неон, десятый элемент периодической таблицы, который имеет десять протонов в ядре и имеет как первый (1s, с двумя электронами), так и второй (2s, с двумя электронами, и 2p, с шестью электронами) орбитали, заполненные всего десятью электронами.
Благородные газы славятся тем, что ни с чем не реагируют, и причина этого в том, что все их занятые атомные орбитали полностью заполнены электронами. Эта сверхстабильная конфигурация разрушается, когда вы поднимаетесь на один элемент вверх в периодической таблице, и это происходит со всеми элементами, которые соответствуют этому шаблону, включая натрий.
Периодическая таблица элементов отсортирована в том виде, в каком она есть (по строкам периодов и по группам столбцов) из-за количества свободных/занятых валентных электронов, которое является фактором номер один в определении химических свойств каждого атома. Атомы могут соединяться в огромное разнообразие молекул, но именно электронная структура каждого из них в первую очередь определяет, какие конфигурации возможны, вероятны и энергетически выгодны.
(Фото: Adobe Stock)Причина чрезвычайной реактивности? Это лишний электрон.
Когда мы изучаем атомы, мы учимся думать о ядре как о твердом маленьком положительно заряженном ядре в центре, а об электронах — как об отрицательно заряженных точках, вращающихся вокруг него. Но в квантовой физике это еще не все. Электроны могут вести себя как точки, особенно если вы направите в них другую высокоэнергетическую частицу или фотон, но если предоставить их самим себе, они расползутся и будут вести себя как волны. Эти волны могут настроить себя определенным образом:
Но в квантовой физике это еще не все. Электроны могут вести себя как точки, особенно если вы направите в них другую высокоэнергетическую частицу или фотон, но если предоставить их самим себе, они расползутся и будут вести себя как волны. Эти волны могут настроить себя определенным образом:
- сферически (для s -орбиталей, принимающих по 2 электрона),
- перпендикулярно (для p -орбиталей, принимающих по 6 электронов),
- и так далее до d — орбиталей (принимающих 10 электронов),
- f -орбиталей (принимающих 14),
и далее по схеме, впервые выявленной Менделеевым.
Атомные орбитали в их основном состоянии (вверху слева) вместе со следующими состояниями с наименьшей энергией по мере продвижения вправо, а затем вниз. Эти фундаментальные конфигурации управляют тем, как атомы ведут себя и проявляют межатомные силы.
(Источник: страница Atomic Orbital в английской Википедии) Причины заполнения этих оболочек связаны с принципом исключения Паули, который не позволяет любым двум идентичным фермионам (например, электронам) занимать одно и то же квантовое состояние. Поскольку электроны обладают фундаментальным квантово-механическим свойством, называемым спином — мерой собственного углового момента электрона — и спин электрона может быть +½ или -½, каждое уникальное квантовое состояние может иметь внутри себя два электрона: один со спином +½ и тот, что спин -½.
Поскольку электроны обладают фундаментальным квантово-механическим свойством, называемым спином — мерой собственного углового момента электрона — и спин электрона может быть +½ или -½, каждое уникальное квантовое состояние может иметь внутри себя два электрона: один со спином +½ и тот, что спин -½.
В атоме после того, как электронная оболочка или орбиталь полностью заполнены, единственное место, куда можно поместить дополнительный электрон, находится на следующей верхней орбитали. Атом, подобный хлору или фтору, с готовностью примет дополнительный электрон, поскольку ему требуется только еще один электрон, чтобы заполнить его электронную оболочку; и наоборот, атом натрия или калия легко отдаст свой последний электрон, поскольку у него есть один дополнительный электрон по сравнению с тем, что заполнит оболочку. Вот почему хлорид натрия (NaCl) является такой хорошей солью: натрий отдает электрон хлору, и оба атома впоследствии существуют в более энергетически выгодной конфигурации.
Этот график показывает первую энергию ионизации каждого атома в периодической таблице по атомному номеру. Именно столько энергии требуется, чтобы полностью отделить наиболее свободно удерживаемый электрон от атома и ионизировать его. Элементы первой группы периодической таблицы, особенно литий, натрий, калий, рубидий и т. д., теряют свой первый электрон гораздо легче, чем любые другие элементы.
(Источник: Glrx/Wikimedia Commons)Фактически, количество энергии, необходимое нейтральному атому для того, чтобы отдать свой самый внешний электрон, известное как его первая энергия ионизации, особенно мало для всех металлов с одним валентным электроном. Если вы посмотрите на цифры, то оторвать один электрон от лития, натрия, калия, рубидия, цезия и т. д. намного проще, чем от любого другого элемента.
Более того, если мы посмотрим на все более тяжелые элементы — с большим числом протонов в ядре в целом и, следовательно, с большим числом полностью заполненных орбиталей — мы обнаружим, что общая энергия ионизации резко уменьшается.
Верите или нет, это свойство играет важную роль в формировании новых звезд. Когда сформировались первые звезды, Вселенная состояла только из трудно поддающихся ионизации водорода и гелия, поэтому, если вы не нагрели эти элементы до температуры, достаточной для их ионизации, они очень медленно охлаждали газовые облака. Это приводит к образованию облаков большой массы, из которых образуются звезды с большей массой; позже во Вселенной, когда будет больше тяжелых элементов, охлаждение происходит гораздо легче из-за обилия более легко ионизируемых молекул. Более поздние звезды могут образовываться из облаков с меньшей массой, что приводит к звездам с меньшей массой, чем их более ранние, более нетронутые аналоги.
Это иллюстрирует взаимодействие молекул воды друг с другом. Вода представляет собой молекулу V-образной формы с отрицательно заряженной стороной (где находится атом кислорода) и положительно заряженными концами там, где находятся атомы водорода. Соседние молекулы воды взаимодействуют друг с другом посредством водородных связей, изображенных на этом рисунке пунктирными линиями.
Так что же тогда происходит, когда вы берете с собой атом натрия — легко ионизуемый атом натрия, который относительно слабо удерживает только самый внешний электрон? — в присутствии воды?
У вас может возникнуть соблазн думать о воде как об отдельной очень стабильной молекуле: H 2 O, с двумя атомами водорода, связанными с одним кислородом. Но вода — высокополярная молекула, а это означает, что одна сторона молекулы H 2 O (сторона, обращенная в сторону от двух атомов водорода) имеет преимущественно отрицательный заряд, а противоположная сторона — преимущественно положительный заряд.
Это означает, что каждая молекула воды имеет «отрицательно заряженный» конец, где находится кислород, и противоположный ему «положительно заряженный» конец. Когда у вас есть жидкая вода, эти молекулы выстраиваются относительно друг друга таким образом, что электрическая потенциальная энергия минимизируется, и отрицательный конец одной молекулы воды с большей вероятностью притянется к положительному концу других молекул воды. Это достаточно значительный эффект, который заставляет некоторые молекулы воды — примерно одну из нескольких миллионов или около того — диссоциировать на два иона: один протон (H + ) и ион гидроксила (ОН – ).
Это достаточно значительный эффект, который заставляет некоторые молекулы воды — примерно одну из нескольких миллионов или около того — диссоциировать на два иона: один протон (H + ) и ион гидроксила (ОН – ).
В присутствии большого количества чрезвычайно полярных молекул воды одна из каждых нескольких миллионов молекул воды расщепляется на гидроксильные ионы и свободные протоны посредством процесса, известного как аутопротолиз.
(Источник: Cdang/Wikimedia Commons)Это имеет множество последствий для таких вещей, как кислоты и основания, растворение солей, активация химических реакций и т. д. Но что происходит, когда у вас есть даже чистая вода, состоящая не только из H? 2 O , но также содержащий небольшой (чуть меньше 0,0001%) процент как протонов (H + ), так и ионов гидроксила (OH – ), а потом к нему добавляется нейтральный натрий?
Натрий, этот нейтральный атом со свободно удерживаемым крайним электроном, теперь находится в присутствии воды: нейтральной, но полярной воды, свободных протонов и ионов гидроксила. Тогда мы должны спросить, какая конфигурация является наиболее энергетически выгодной?
Тогда мы должны спросить, какая конфигурация является наиболее энергетически выгодной?
- Отдаст ли натрий свой крайний электрон нейтральной воде?
- Отдаст ли натрий свой внешний электрон иону гидроксила?
- Отдаст ли натрий свой крайний электрон свободному протону?
- Или натрий сохранит свой внешний электрон или даже получит электрон от одной из других частиц?
Ответ прост; практически в каждом случае электрон перепрыгнет с атома натрия на первый же найденный протон.
Потеряв электрон, ион натрия с радостью растворится в воде, как и ион хлорида, получив электрон. В случае натрия гораздо более энергетически выгодно, чтобы этот электрон вместо этого соединился с ионом водорода (то есть со свободным протоном).
(Источник: RockEDU/Университет Рокфеллера) На самом деле, это даже не соревнование. В масштабе отдельных атомов и ионов мы обычно думаем об ответах на такие вопросы, как «Сколько энергии требуется для ионизации электрона?» или «Сколько энергии высвобождается, когда электрон находит ион и образует нейтральный атом в основном состоянии?» в энергиях по шкале электрон-вольт (эВ). Для ионизации нейтрального атома натрия требуется чуть более 5 эВ энергии, и когда ион натрия получает электрон, он высвобождает те же ~5 эВ энергии. Но для ионизации нейтрального водорода требуется более 13 эВ энергии, и те же самые 13,6 эВ энергии высвобождаются, когда ион водорода снова становится нейтральным.
Для ионизации нейтрального атома натрия требуется чуть более 5 эВ энергии, и когда ион натрия получает электрон, он высвобождает те же ~5 эВ энергии. Но для ионизации нейтрального водорода требуется более 13 эВ энергии, и те же самые 13,6 эВ энергии высвобождаются, когда ион водорода снова становится нейтральным.
Вот почему реакция происходит так быстро, когда металлический натрий падает в воду, и почему он выделяет так много энергии. Фактически, по мере того как электроны, отдаваемые натрием, начинают объединяться с ионами водорода, нейтральная вода далее диссоциирует на свободные протоны и гидроксильные ионы, создавая еще больше «топлива» для реакции натрия.
Но и это еще не все. Теперь, когда мы создали нейтральные атомы водорода, они не просто образуют блок отдельных атомов, которые можно связать вместе, как это делает металлический натрий. Вместо этого при комнатных температурах и давлениях водород представляет собой газ и переходит в еще более энергетически выгодное состояние: образуя нейтральную молекулу водорода H 2 . Итак, теперь у вас есть много свободной энергии (которая идет на тепло окружающих молекул), нейтральный газообразный водород, и он поднимается из водного раствора в атмосферу, которая в основном состоит из нейтрального азота (N 2 ) и кислород (O 2 ) газы.
Итак, теперь у вас есть много свободной энергии (которая идет на тепло окружающих молекул), нейтральный газообразный водород, и он поднимается из водного раствора в атмосферу, которая в основном состоит из нейтрального азота (N 2 ) и кислород (O 2 ) газы.
Удаленная камера делает крупный план главного двигателя космического корабля «Шаттл» во время испытательного запуска в Космическом центре Джона К. Стенниса. Водород предпочтительнее в качестве источника топлива в ракетах из-за его низкой молекулярной массы и большого количества кислорода в атмосфере, с которым он может реагировать.
(Фото: НАСА)Узнаете этот рецепт?
У вас много свободной энергии в виде тепла. У вас есть газообразный молекулярный водород, и у вас есть газообразный молекулярный кислород.
Это верный рецепт возгорания! Сгорание водорода/кислорода является ключевым компонентом ракетного топлива, транспортных средств на водородных топливных элементах и знаменитой катастрофы Гинденберга. (Именно поэтому сегодня мы наполняем дирижабли инертным гелием вместо горючего водорода!)
(Именно поэтому сегодня мы наполняем дирижабли инертным гелием вместо горючего водорода!)
Когда кислород и водород реагируют в присутствии энергии, эта огненная реакция горения производит водяной пар, но также выделяет еще больше энергии. Это объясняет, почему, когда вы бросаете достаточно большой кусок натрия (или любого элемента группы 1 из таблицы Менделеева) в воду, вы получаете такой колоссальный взрывной выброс энергии. Все это обусловлено переносом электронов, который происходит благодаря квантовым законам, управляющим Вселенной, и электромагнитным свойствам заряженных частиц, из которых состоят эти атомы и ионы.
Уровни энергии и волновые функции электрона, которые соответствуют различным состояниям внутри атома водорода, хотя конфигурации для всех атомов очень похожи. То, как атомы связываются друг с другом, образуя молекулы и другие, более сложные структуры, представляет собой сложную задачу, если начинать с фундаментальных частиц и взаимодействий, но понимание основ — это то, как мы приближаемся к объяснению более сложных систем.
Итак, если вы бросите кусок натрия в воду, вот что произойдет.
- Во-первых, натрий немедленно отдает свой внешний электрон водному раствору, то есть воде.
- Затем этот электрон поглощается ионом водорода, образуя нейтральный атом водорода.
- Эта начальная реакция высвобождает большое количество свободной энергии, заставляя окружающие молекулы нагреваться.
- Сразу после этого нейтральные атомы водорода соединяются вместе, быстро образуя большое количество молекулярного газообразного водорода.
- Газообразный водород намного легче и менее плотный, чем другие атмосферные газы, поэтому он поднимается из водного раствора.
- И, наконец, если энергии достаточно, кислород атмосферы вступает в реакцию с газообразным водородом, вызывая реакцию горения.
Блок металлического натрия, как показано здесь, выглядит довольно непримечательно. Но вы не должны касаться его голыми руками, и вы не должны мочить его, если вы не готовы к последствиям. Натрий очень активно реагирует с водой, и результаты часто могут быть взрывоопасными.
Натрий очень активно реагирует с водой, и результаты часто могут быть взрывоопасными.
Это будет продолжаться до тех пор, пока весь металлический натрий не исчезнет, или, скорее, пока натрий полностью не растворится в ионизированной форме в оставшейся воде. Это не просто химия в действии; именно лежащая в основе квантовая физика делает все это возможным.
Сами правила, управляющие поведением каждой из этих химических реакций, вытекают из еще более фундаментальных законов:
- законов квантовой физики, включая правило запрета Паули, управляющее поведением электронов в атомах,
- и законов классический электромагнетизм, который определяет взаимодействие заряженных частиц.
Нечасто удается вывести полное поведение сложной системы из простых фундаментальных правил, лежащих в основе составляющих ее компонентов, но в случае реакции натрия с водой мы можем сделать именно это. Без этих физических законов и сил у нас вообще не было бы химии! Тем не менее, благодаря им каждый раз, когда вы добавляете натрий в воду, вы точно знаете, чего ожидать.



