Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
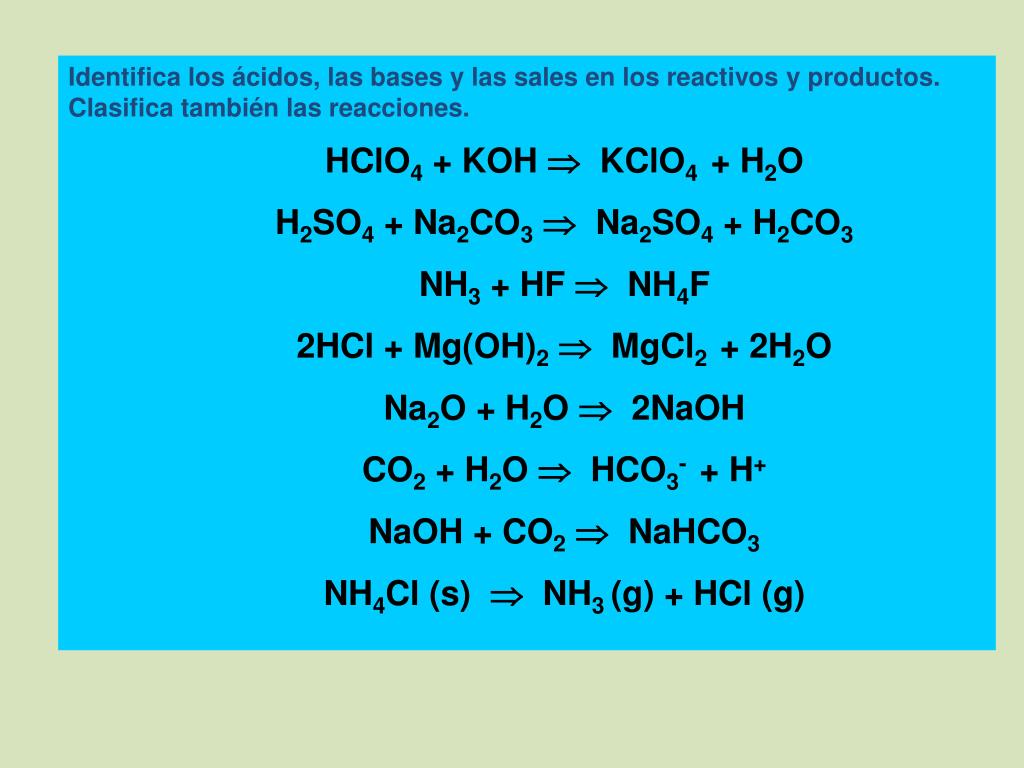
Задания №6 с решениями
Главная \ Подготовка к ОГЭ \ Химия \ Задания №6 с решениями
Разберем задания №6 из ОГЭ за 2016 год.
Перед решением рекомендуем повторить темы: «Классификация химических реакций», «Химические свойства кислот, оснований, солей, оксидов», «Признаки химических реакций», «Расчеты по химическим реакциям».
Задания с решениями.
Задание №1.
Взаимодействие оксида меди (II) с соляной кислотой относят к реакциям:
1. Соединения
2. Замещения
Замещения
3. Обмена
4. Разложения
Объяснение: запишем данную реакцию
CuO + h3SO4 → CuSO4 + h3O
В реакцию вступают два сложных вещества, продукты — тоже два сложных вещества другого состава. Реакция протекает без изменения степени окисления, следовательно, это реакция обмена.
Правильный ответ — 3.
Задание №2.
Образование осадка происходит при сливании растворов:
1. Хлорида кальция и нитрата серебра
2. Азотной кислоты и гидроксида калия
3. Карбоната натрия и соляной кислоты
4. Гидроксида железа (III) и серной кислоты
Объяснение: запишем реакции, о которых идет речь
1. CaCl2 + 2AgNO3 → AgCl↓ + Ca(NO3)2 (образуется осадок)
2. HNO3 + KOH → KNO3 + h3O (реакция нейтрализации)
3. Na2CO3 + 2HCl → 2NaCl +h3O + CO2↑ (угольная кислота в растворе неустойчива и начинает распадаться на воду и углекислый газ)
4. 2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + 6h3O (реакция нейтрализации)
2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + 6h3O (реакция нейтрализации)
Правильный ответ — 3.
Задание №3.
Признаком протекания химической реакции между йодидом алюминия и нитратом серебра является
1. Появление запаха
2. Выделение газа
3. Изменение цвета раствора
4. Выпадение желтого осадка
Объяснение: рассмотрим данную реакцию
AlI3 + 3AgNO3 → 3AgI↓ + Al(NO3)3
В процессе реакции выпадает осадок желтого цвета. Следовательно, правильный ответ — 4.
Задание №4.
Уравнение реакции нейтрализации:
1. CaO + 2HCl → CaCl2 + h3O
2. Ba(NO3)2 + K2SO4 → BaSO4 + 2KNO3
3. HNO3 + KOH → KNO3 + h3O
4. ZnSO4 + 2NaOH → Zn(OH)2 + Na2SO4
Объяснение: реакция нейтрализации — это реакция между основанием и кислотой, продуктами такой реакции являются соль и вода.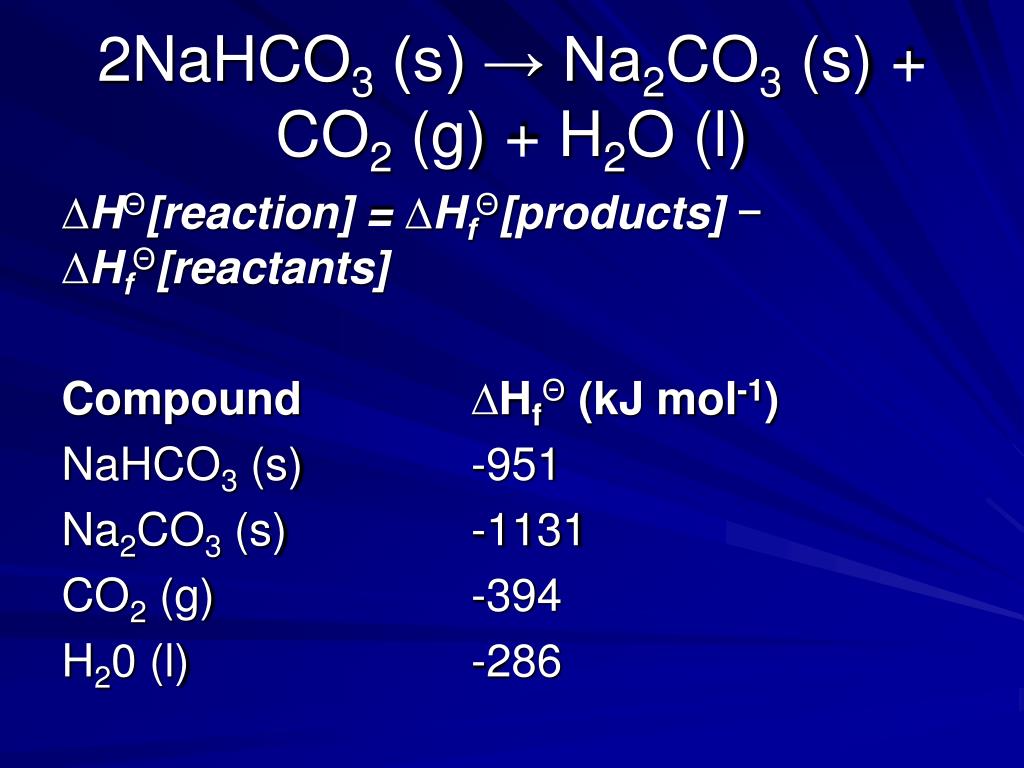 Под данное определение подходит №3. Правильный ответ — 3.
Под данное определение подходит №3. Правильный ответ — 3.
Задание №5.
Реакции замещения соответствует уравнение:
1. 2NaOH + CO2 → Na2CO3 + h3O
2. NaCl + AgNO3 → NaNO3 + AgCl
3. CuO + h3SO4 → CuSO4 + h3O
4. Fe2O3 + 3C → 2Fe + 3CO
Объяснение: реакция замещения — это реакция между сложным веществом и простым, в процессе такого взаимодействия получается сложное вещество другого состава и замещенное простое вещество. Правильный ответ — 4.
Задание №6.
Признаком протекания химической реакции между карбонатом кальция и соляной кислотой является:
1. Выпадение осадка
2. Выделение газа
3. Появление запаха
4. Изменение цвета
Объяснение: запишем реакцию
CaCO3 + HCl → CaCl2 + h3O + CO2
В процессе данной реакции выделяется углекислый газ, так как угольная кислота в растворе неустойчива. Правильный ответ — 2.
Правильный ответ — 2.
Задание №7.
Реакции ионного обмена соответствует химическое уравнение:
1. 2NaOH + CO2 → Na2CO3 + h3O
2. CaO + CO2 → CaCO3
3. CuO + h3SO4 → CuSO4 + h3O
4. NaCl + AgNO3 → AgCl + NaNO3
Объяснение: реакция ионного обмена — это реакция между двумя сложными веществами, в ходе которой эти два вещества обмениваются своими составными частями. Такая реакция должна проходить без изменения степеней окисления. Правильный ответ — 3.
Задание №8.
К окислительно-восстановительным реакциям относится взаимодействие между:
1. Железом и водой
2. Оксидом натрия и водой
3. Оксидом углерода (IV) и водой
4. Серной кислотой и нитратом бария
Объяснение: окислительно-восстановительная реакция проходит с изменением степеней окисления. Рассмотрим первую реакцию:
Рассмотрим первую реакцию:
Fe + 2h3O → Fe(OH)2 + h3
Железо меняет степень окисления с 0 на +2, водород — с +1 на 0.
Правильный ответ — 1.
Задание №9.
Для взаимодействия с 8 г кислорода потребуется водород количеством вещества:
1. 1,5 моль
2. 1 моль
3. 0,25 моль
4. 0,5 моль
Объяснение: запишем уравнение реакции
2h3 + O2 → 2h3O
Рассчитаем количество вещества кислорода:
n(O2) = 8/16 = 0,5 моль
Соотнесем количества кислорода и водорода: на 1 моль кислорода требуется 2 моль водорода (в два раза больше; смотрим на коэффициенты перед соответствующими веществами), следовательно, на 0,5 моль кислорода требуется 1 моль водорода. Правильный ответ — 2.
(можно смотреть не по молям, а по молекулам, чтобы не запутаться, но результат будет тот же, в данном случае, на одну молекулу кислорода требуется две молекулы водорода — что логично, потому что в молекуле воды два атома водорода и один атом кислорода)
Задание №10.
Верны ли следующие суждения о химических реакциях?
А. Все реакции между двумя сложными веществами относятся к реакциям ионного обмена.
Б. Реакции между кислотой и основанием относятся к реакциям нейтрализации.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны.
Объяснение: А не совсем верно, так как реакция между сложными веществами может быть окислительно-восстановительной, но второе утверждение верно. Подтвердим его реакцией:
NaOH + HCl → NaCl + h3O
Правильный ответ — 2.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельного решения.
1. Верны ли следующие суждения о химических реакциях?
А. Реакции между растворами электролитов относятся к реакциям ионного обмена.
Б. Взаимодействие цинка с хлоридом железа (II) относится к реакциям замещения.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
2. Взаимодействие раствора гидроксида натрия с соляной кислотой является реакцией:
1. Обратимой, экзотермической
2. Необратимой, эндотермической
3. Необратимой, экзотермической
4. Обратимой, экзотермической
3. Реакции ионного обмена соответствует уравнение:
1. 2NaOH + CO2 → Na2CO3 + h3O
2. CaO + CO2 → CaCO3
3. CuO + h3SO4 → CuSO4 + h3O
4. NaCl + AgNO3 → AgCl + NaNO3
4. Признаком протекания реакции между карбонатом калия и соляной кислотой является:
1. Изменение цвета
2. Выпадение осадка
3. Выделение газа
4. Появление запаха
5. К реакциям соединения относят реакцию:
1. Fe(OH)2 → FeO + h3O
2. Al + HCl → AlCl3 + h3
3. KOH + HCl → KCl + h3O
4. Li2O + h3O → LiOH
6. Признаком протекания химической реакции между цинком и соляной кислотой является
1. Появление запаха
Появление запаха
2. Выделение газа
3. Изменение цвета
4. Выпадение осадка
7. К реакциям обмена относят реакцию между
1. Серой и железа
2. Оксидом серы (IV) и водой
3. Растворами хлорида натрия и нитрата серебра
4. Раствором йодида и хлорной водой
8. К реакциям замещения не относят реакцию между
1. Оксидом вольфрама (VI) и кальцием
2. Оксидом кальция и водой
3. Оксидом железа (III) и алюминием
4. Оксидом меди (II) и водородом
9. К окислительно-восстановительным реакциям относят реакцию между
1. Оксидом серы (VI) и водой
2. Оксидом серы (IV) и кислородом
3. Оксидом натрия и водой
4. Оксидом меди (II) и раствором серной кислоты
10. Верны ли следующие суждения о химических реакциях?
А. Ни одна реакция обмена не относится к окислительно-восстановительным реакциям
Б. Все реакции замещения являются окислительно-восстановительными
1. Верно только А
Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А.С. и Купцовой А.А.
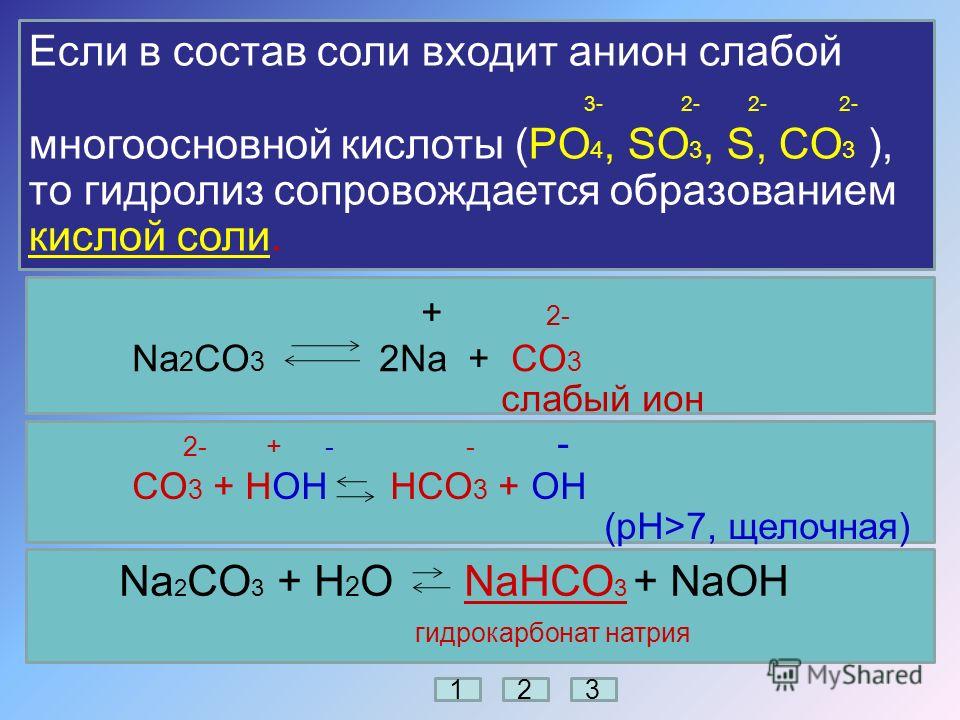
Hcl+na2co3 решить уравнение в молекулярном полном и кратком ионном виде
Химия, 2020-08-24 00:34:27, lyuda29m
Ответ
Ответ разместил: svetlans2
Надеюсь хоть и не шарю,но помню.
2HCl+Na2CO3=h3CO3+2NaCl
2H+ +2Cl- +2Na+ +CO3=h3CO3+2Na+ +2Cl-
2H+ +CO3- =h3CO3
h3CO3-не распадается на ионы, т. к. является слабым электролитом, можно написать
h3CO3=h3O+CO2
Ответ
Ответ разместил: ВладДвоичник2002
Вот, держи……….
Отметь ответ как лучший, если не сложно
Ответ
Ответ разместил: nastya123litvin
ответ: смотри фото
Объяснение:
Ответ
Ответ разместил: Ismira1805
A)ZnSO4+Ba(NO3)2=Zn(NO3)2+BaSO4(осадок,белый цвет)
Zn2+ + SO42- + Ba2+ + 2NO3- = Zn2+ + 2NO3- + BaSO4(осадок)
Ba2+ + SO42- = BaSO4(осадок)
б)ZnSO4+MgCl2ZnCl2+MgSO4 (такая реакция не протекает,нет приз. реакции)
реакции)
Zn2+ + SO42- + Mg2+ + 2Cl- = Zn2+ + 2Cl- + Mg2+ + SO42-
всё сокращается,что подтверждает,что ни одно из веществ в реакции не принимало участии
Ответ
Ответ разместил: Aruuuuuuuu
BaCl2 + Na2SO3 = BaSO3 + 2NaCl
Ba(2+) + 2Cl(-) + 2Na(+) + SO3(2-) = BaSO3 + 2Na(+) + 2Cl(-)
Ba(2+) + SO3(2-) = BaSO3
Ответ
Ответ разместил: Dolboeb9000
Kno3+nacl=kcl+nano3- молекулярное уравнение к(+1) no3(-1) +na(+1) cl(-1) ионное уравнение в этом уравнений ничего не сократиться потому что нет одинковых элементов.
Ответ
Ответ разместил: agzamov03
А) сульфата цинка и нитрата бария
ZnSO4 + Ba(NO3)2=Zn(NO3)2 + BaSO4 (осадок)
Zn(+2) + SO4(-2) + Ba(+2) + 2NO3(-1)=Zn(+2) + 2NO3(-1) + BaSO4 (осадок)
SO4(-2) + Ba(+2)= BaSO4 (осадок)
!цифры в скобках это заряд!
б) ZnSO4 + MgCl = реакция не идет.
Другие вопросы по: Химия
Стороны треугольника равны 6 см, 8 см и 10 см. найдите косинус угла, лежащего против стороны 6 см….
найдите косинус угла, лежащего против стороны 6 см….
Опубликовано: 27.02.2019 15:00
Ответов: 3
Втрёх цехах фабрики работают 480 человек. число людей, работающих во втором цехе, составляет 36% числа людей первого цеха, а число людей, работающих в третьем цехе, составляет 2/3…
Опубликовано: 28.02.2019 07:50
Ответов: 1
Брюки дороже на 20%,а бриджы дороже рубашки на 44%.на сколько процентов пиждак дороже брюк?…
Опубликовано: 28.02.2019 20:10
Ответов: 2
Напишите 5 предложений со словом «чтобы»…
Опубликовано: 01.03.2019 20:30
Ответов: 1
Багаж массой 836 кг грузчики положили на 3 тележки масса багажа на второй тележки в 2 раза больше чем на первой какова масса багажа на третьей тележке если масса багажа на первой и…
Опубликовано: 02.03.2019 09:00
Ответов: 3
Какая масса амоний хлорид получится с амиака массой 30 грам и хлорид водорода массой 73 грамма. 2+6=4…
2+6=4…
Опубликовано: 01.03.2019 08:00
Ответов: 3
Спишите, вставляя пропущенные буквы. обозначьте глагольные суффиксы. объясните их провописание. слово разузнавать…
Опубликовано: 02.03.2019 11:20
Ответов: 2
Скласти план до оповідання «якого кольору слова? «…
Опубликовано: 02.03.2019 14:00
Ответов: 1
Некто взял из сокровищницы 1/13 другой 1/17 из оставшегося и осталось 150 сколько было сокровищ изначально. решение с иксом, уравнение…
Опубликовано: 03.03.2019 13:20
Ответов: 3
В) 44 2/9+8 5/9-7/9 г)5 7/10+3 9/10+1 3/10 д)3 17/100-2 13/100-1 е)8-4 31/100-2 57/100…
Опубликовано: 03.03.2019 19:00
Ответов: 2
Составьте электронные уравнения. расставьте коэффициенты в уравнениях реакций. для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем, какое вещес. cos2x…
cos2x…
Опубликовано: 08.03.2019 03:10
Ответов: 2
Впрогрессии b5=81,q=3/4. запишите формулу n-го члена этой прогрессии…
Опубликовано: 08.03.2019 07:50
Ответов: 2
Больше вопросов по предмету: Химия Случайные вопросы
Титрование Na2CO3.xh3O соляной кислотой – Международный бакалавриат по химии
- Поиск
- Присоединяйтесь к более чем 1,2 миллионам студентов каждый месяц
- Ускорьте свое обучение на 29%
- Неограниченный доступ всего от 6,99 фунтов стерлингов в месяц
Выдержки из этого документа…
Химический лабораторный отчет — Титрование Введение: Цель: Определить число молей кристаллизационной воды (x) в гидратированном карбонате натрия (Na2CO3.xh3O) путем его титрования соляной кислотой (HCl). Гипотеза: при постоянном добавлении HCl к раствору карбоната натрия цвет будет медленно меняться. И когда будет достигнута конечная точка титрования, произойдет изменение цвета. Это изменение цвета будет связано с медленной реакцией раствора карбоната натрия с HCl с образованием хлорида натрия, воды и углекислого газа. Когда весь раствор карбоната натрия будет израсходован, это будет означать конечную точку титрования, а также точку полного изменения окраски. Общие сведения. Кислота, согласно теории кислот и оснований Бренстеда и Лоури, является донором протона (иона водорода, Н+). С другой стороны, основание определяется как акцептор протона (иона водорода, Н+). Хорошим примером сильной кислоты является серная кислота (h3SO4), а гидроксид натрия (NaOH) является примером сильного основания или щелочи, поскольку он растворим в воде. Когда кислота вступает в реакцию с карбонатом, она нейтрализуется, и вместе с водой и углекислым газом образуется соль, как показано ниже: Кислота + Карбонат ==>
И когда будет достигнута конечная точка титрования, произойдет изменение цвета. Это изменение цвета будет связано с медленной реакцией раствора карбоната натрия с HCl с образованием хлорида натрия, воды и углекислого газа. Когда весь раствор карбоната натрия будет израсходован, это будет означать конечную точку титрования, а также точку полного изменения окраски. Общие сведения. Кислота, согласно теории кислот и оснований Бренстеда и Лоури, является донором протона (иона водорода, Н+). С другой стороны, основание определяется как акцептор протона (иона водорода, Н+). Хорошим примером сильной кислоты является серная кислота (h3SO4), а гидроксид натрия (NaOH) является примером сильного основания или щелочи, поскольку он растворим в воде. Когда кислота вступает в реакцию с карбонатом, она нейтрализуется, и вместе с водой и углекислым газом образуется соль, как показано ниже: Кислота + Карбонат ==>
 …читать далее.
…читать далее.Средний объем (± 0,10 см3) 1 0 24,7 24,7 24,8 2 0 24,7 24,7 3 0 24,8 24,8 4 0 24,8 24,8 0,10) = (99 х 0,30) х 4 = (24,8 х 0,10) см3 Средний объем в дм3: = (24,8 х 0,10) х 10-3 дм3 = (0,0248 х 0,0001) дм3 Обработка и представление данных: * Химическое уравнение: 2HCl (водн.) + Na2CO3 (водн.) ==>
2NaCl (водн.) + h3O (ж) + CO2 (ж) * Из приведенного выше видно, что 2 моля HCl реагируют с 1 молем Na2CO3 с образованием 2 молей NaCl, 1 моль Н3О и 1 моль СО2. * Количество молей HCl = заданная масса (г) � Молярная масса (г) = 3,65 � (1 + 35,5) = 3,65 � 36,5 = 0,1 моль * Концентрация HCl = количество молей (моль) � Объем (дм3) = 0,1 х 1 = 0,1 моль дм-3 * Молярное соотношение: количество молей HCl : количество молей Na2CO3 = 2 : 1 (как показано в химическом уравнении) …читать далее. родинки. Процентная ошибка: 10,1 — 10,0 = 0,1 % Ошибка = 0,1 х 100 = 1 % 10 Оценка: Я должен был провести этот эксперимент по титрованию лучше, чем предыдущий, так как я получил результат, очень близкий к фактическому значению с процентной ошибкой только 1 %. Слабые стороны моего метода (источники ошибок): * Их было не так уж много, но одно точно заключалось в том, что я не получил хорошую подставку для зажима, так как все «хорошие» уже были заняты. У меня есть старая деревянная подставка для зажима, которая даже не держала бюретку устойчиво (т.е. я не мог зажать ее достаточно сильно). И стойка зажима была тоже не вертикально, а немного наклонена вперед. Это привело к тому, что бюретка также наклонилась вперед, что привело к некоторым ошибкам в считывании объема. Предотвращение этих ошибок: * Ошибку подставки с зажимом можно просто решить, используя лучшую походную подставку с хорошим «зажимом» и прочной вертикальной подставкой. Дальнейшие исследования: * Некоторые дальнейшие исследования могут быть проведены с другими карбонатами, такими как карбонат кальция (CaCO3) или карбонат магния (MgCO3), чтобы выяснить, одинаково ли количество молей кристаллизационной воды во всех карбонатах ?? ?? ?? ?? Учитель: Минати Саху 1 Келвин Джоанес — I.B ..
Слабые стороны моего метода (источники ошибок): * Их было не так уж много, но одно точно заключалось в том, что я не получил хорошую подставку для зажима, так как все «хорошие» уже были заняты. У меня есть старая деревянная подставка для зажима, которая даже не держала бюретку устойчиво (т.е. я не мог зажать ее достаточно сильно). И стойка зажима была тоже не вертикально, а немного наклонена вперед. Это привело к тому, что бюретка также наклонилась вперед, что привело к некоторым ошибкам в считывании объема. Предотвращение этих ошибок: * Ошибку подставки с зажимом можно просто решить, используя лучшую походную подставку с хорошим «зажимом» и прочной вертикальной подставкой. Дальнейшие исследования: * Некоторые дальнейшие исследования могут быть проведены с другими карбонатами, такими как карбонат кальция (CaCO3) или карбонат магния (MgCO3), чтобы выяснить, одинаково ли количество молей кристаллизационной воды во всех карбонатах ?? ?? ?? ?? Учитель: Минати Саху 1 Келвин Джоанес — I.B ..
Приведенный выше предварительный просмотр представляет собой неформатированный текст
Эта студенческая письменная работа — одна из многих, которые можно найти в разделе «Химия» нашего международного бакалавриата.
Нашли то, что искали?
Не тот? Найдите название своего сочинения…
- Присоединяйтесь к более чем 1,2 миллионам студентов каждый месяц
- Ускорьте свое обучение на 29%
- Неограниченный доступ всего от 6,99 фунтов стерлингов в месяц
Посмотреть связанные эссе
Теперь для расчета массы NaHCO3 можно просто вычислить унитарным методом следующим образом — Пусть масса NaHCO3 будет X 168 62 X 0,222 Следовательно, X = 0,602 + 0,001 г. Поскольку мы знаем, что масса смеси до нагревания была 0,837 + 0,002 г
веса во времени в данный момент времени (но до завершения одной из реакций, так как после завершения реакции продукт больше не образуется, и сравнение двух результатов покажет нерелевантные данные) или сравните наклоны двух реакций.

44,4 (через 10 мин) 40,2 (через 15 мин) 45,2 (через 20 мин) ФОРМУЛА: Масса потерянной воды = Масса тигля, крышки и гидрата (2) — Масса тигля, крышки и безводной соли (5) Масса безводной соли = Масса гидрата — Масса потерянной воды Данные
На самом деле, общий процент ошибок меньше, чем процент случайных ошибок; 1,00 % < 1,15 %, что означает, что приведенное в литературе значение относительной молекулярной массы X2CO3 (105,99 г/моль) находится в диапазоне полученных значений от 105,44 г/моль до 108,66 г/моль.
21,09 21,09 Бледно-розовый 5 0,00 20,95 20,95 Бледно-розовый 6 1,00 22,15 21,15 Бледно-розовый 7 4,00 25,10 21,10 Бледно-розовый Первоначально моль HCl = c x v = 2,0 x 0,1 = 0,2 моль NaOH+Hcl -> NaCl+ h30 =
Далее я узнал, что кристаллизационная вода отвечает за форму кристаллов. На самом деле расположение и форму кристалла можно определить с помощью рентгеновской кристаллографии.
 Кристаллографические методы теперь зависят от анализа дифракционных картин образца, направленного лучом определенного типа.
Кристаллографические методы теперь зависят от анализа дифракционных картин образца, направленного лучом определенного типа.
Это можно доказать из-за того, что среднее изменение температуры было отрицательным -7,4 и -4,1, что означает, что тепло из окружающей среды поглощалось частицами. Из результатов мы также можем заключить, что наши эксперименты были вполне удовлетворительными, так как для B и C тесты варьировались только в
раз.По этой причине лучшим индикатором оказался фенолфталеин. График А иллюстрирует различные объемы гидроксида натрия, необходимые для достижения конечной точки реакции при добавлении к раствору уксуса с использованием различных индикаторов.
- Более 160 000 штук
письменных работ студентов - Аннотировано
опытными учителями - Идеи и отзывы для
улучшения вашей работы
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Окислительно-восстановительная реакция Реакция двойной замены
| jpg» substance-weight=»36.4609″> 2HCl | + | 123355000000-2000px-NaCl_li.svg.png» substance-weight=»58.4428″> 2NaCl | + | 105754000000-200px-Cacbon_dioxit.png» substance-weight=»44.0095″> CO 2 | |||||
| hydrogen chloride | sodium carbonate | вода | натрия хлорид | углекислый газ | |||||
| 01 (dd) | 020102 | (dd) | (lỏng) | (dd) | (khí) | ||||
| (không màu) | (trắng) | (không màu) | (trắng) | (không màu) | |||||
| 2 | 1 | 1 | 2 | 1 | Hệ số | ||||
| Nguyên — Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Кхой лунг (г) |
Дополнительная информация об уравнении 2HCl + Na
2 CO 3 → H 2 O + 2NaCl + CO 2Каковы условия реакции HCl (хлористый водород) реагирует с Na2CO3 (карбонатом натрия) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (вода), NaCl (хлорид натрия) и CO2 (двуокись углерода)?
Поместите HCl в пробирку, содержащую Na2CO3
Явление после реакции HCl (хлористого водорода) с Na2CO3 (карбонатом натрия)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
Карбонатная соль реагирует с кислотой более сильно, чем угольная кислота, образуя новую соль и выделяя газ CO2 9.0019
Категории уравнений
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Другие вопросы, связанные с химическими реакциями 2HCl + Na
2 CO 3 → H 2 O + 2NaCl + CO 2Вопросы, связанные с химическим реагентом HCl (хлористый водород)
3 901 характеристика HCl (хлороводород)? В каких химических реакциях используется HCl (хлороводород) в качестве реагента?Вопросы, связанные с реагентом Na2CO3 (карбонат натрия)
Каковы химические и физические характеристики Na2CO3 (карбонат натрия)? В каких химических реакциях используется Na2CO3 (карбонат натрия) в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (карбоната натрия)? В каких химических реакциях образуется h3O (вода)?
Вопросы, связанные с продуктом NaCl (хлорид натрия)
Каковы химические и физические характеристики NaCl (карбоната натрия)? Какие химические реакции происходят с NaCl (хлоридом натрия) в качестве продукта?
Вопросы, связанные с продуктом CO2 (двуокись углерода)
Каковы химические и физические характеристики CO2 (карбоната натрия)? В каких химических реакциях образуется CO2 (двуокись углерода)?
Рекламное объявление
1 результатов найдено
Отображение уравнения из 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция HCl (эксит кловодородная) Реакция с Na2CO3 (натрикаконат) с образованием h3O (nước) и CO2 (какбон диоксит)
Реакция с образованием вещества HCl (акситохлористый) (хлористый водород)
Cl 2 + C 3 H 8 → HCl + C 3 H 7 Cl CO + H 2 O + PdCl 2 → 2HCl + CO 2 + Pd Cl 2 + H 2 S → 2HCl + S
Реакция с образованием вещества Na2CO3 (natri cacbonat) (sodium carbonate)
C + 6NaOH → 3H 2 + 2Na + 2Na 2 CO 3 (NH 2 ) 2 CO + NaOH → Na 2 CO 3 + NH 3 2NaOH + CH 2 (COONa) 2 → CH 4 + 2Na 2 CO 3
Реакция, в результате которой образуется вещество h3O (nước) (water)
3NH 4 NO 3 + CH 2 → 7H 2 O + 3N 2 + CO 2 2NH 3 + 3PbO → 3H 2 O + N 2 + 3PB 2 (NH 4 ) 3 PO 4 + 3BA (OH) 2 → 6H 2 O + 6NH 3 + Ba. ) 2
) 2
Реакция с образованием вещества NaCl (Natri Clorua) (хлорид натрия)
HCl + NaOH → H 2 O + NaCl CL 2 + 2NA → 2NACL BACL 2 + NA 2 SO 4 → 2NACL + BASO 4 4 → 2NACL + BASO 4 → 2NACL + BASO 4 4
4. . CO2 (Cacbon dioxit) (carbon dioxide)3NH 4 NO 3 + CH 2 → 7H 2 O + 3N 2 + CO 2 Fe 2 (CO 3 ) 3 + 3H 2 O → 3CO 2 + 2Fe(OH) 3 C + O 2 → CO 2
Уравновешивание химических уравнений: практика и повторение
Из всех навыков, необходимых для изучения химии, уравновешивание химических уравнений является, пожалуй, самым важным. Очень многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и работу в лаборатории. Это подробное руководство покажет вам, как сбалансировать даже самые сложные реакции, и проведет вас через серию примеров, от простых к сложным.
Это подробное руководство покажет вам, как сбалансировать даже самые сложные реакции, и проведет вас через серию примеров, от простых к сложным.
Конечная цель уравновешивания химических реакций состоит в том, чтобы сделать обе стороны реакции, реагенты и продукты, равными по количеству атомов на элемент. Это вытекает из универсального закона сохранения массы, который гласит, что материя не может быть ни создана, ни уничтожена. Итак, если мы начинаем с десяти атомов кислорода до реакции, нам нужно получить десять атомов кислорода после реакции. Это означает, что химические реакции не изменяют фактические строительные блоки материи; скорее, они просто меняют расположение блоков. Простой способ понять это — представить себе дом из блоков. Мы можем разбить дом и построить самолет, но цвет и форма самих блоков не изменятся.
Но как сбалансировать эти уравнения? Мы знаем, что количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения, поэтому для этого достаточно найти правильные коэффициенты (числа перед каждой молекулой). Лучше всего начать с атома, который встречается наименьшее количество раз с одной стороны, и уравновешивать его первым. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте еще раз подсчитать количество атомов каждого элемента с каждой стороны, просто для уверенности.
Лучше всего начать с атома, который встречается наименьшее количество раз с одной стороны, и уравновешивать его первым. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте еще раз подсчитать количество атомов каждого элемента с каждой стороны, просто для уверенности.
Поясним это на примере:
P 4 O 10 + H 2 O → H 3 PO 4
Во-первых, давайте посмотрим на наименее часто встречающийся элемент. Обратите внимание, что кислород встречается дважды с левой стороны, так что это не лучший элемент для начала. Мы могли бы начать либо с фосфора, либо с водорода, так что давайте начнем с фосфора. С левой стороны четыре атома фосфора, а с правой только один. Таким образом, мы можем присвоить коэффициент 4 молекуле с фосфором с правой стороны, чтобы сбалансировать их.
P 4 O 10 + H 2 O → 4 H 3 PO 4
Теперь мы можем проверить водород. Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он встречается более чем в одной молекуле с левой стороны. Легче всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, слева две молекулы водорода, а справа двенадцать (обратите внимание, что на молекулу H 3 PO 4 приходится по три молекулы, а у нас четыре молекулы). Итак, чтобы сбалансировать их, мы должны поставить шестерку перед H 9.0145 2 О слева.
Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он встречается более чем в одной молекуле с левой стороны. Легче всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, слева две молекулы водорода, а справа двенадцать (обратите внимание, что на молекулу H 3 PO 4 приходится по три молекулы, а у нас четыре молекулы). Итак, чтобы сбалансировать их, мы должны поставить шестерку перед H 9.0145 2 О слева.
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
На этом этапе мы можем проверить баланс кислорода. Слева у нас есть десять атомов кислорода от P 4 O 10 и шесть от H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами ). Итак, кислород уже уравновешен. Это дает нам окончательное сбалансированное уравнение
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
Попробуйте сбалансировать эти десять уравнений самостоятельно, а затем проверьте ответы ниже. Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся слишком сложными. Просто не забудьте начать с элемента, который отображается меньше всего, и продолжить оттуда. Лучший способ подходить к этим проблемам — медленно и систематически. Глядя на все сразу, легко можно утомиться. Удачи!
Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся слишком сложными. Просто не забудьте начать с элемента, который отображается меньше всего, и продолжить оттуда. Лучший способ подходить к этим проблемам — медленно и систематически. Глядя на все сразу, легко можно утомиться. Удачи!
- CO 2 + H 2 O → C 6 H 12 O 6 + O 2
- SiCl 4 + H 2 O → H 4 SiO 4 + HCl
- Al + HCl → AlCl 3 + H 2
- Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2
- C 7 H 6 O 2 + O 2 → CO 2 + H 2 О
- Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe(OH) 3
- Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3
- KClO 3 → KClO 4 + KCl
- Al 2 (SO 4 ) 3 + Ca(OH) 2 → Al(OH) 3 + CaSO 4
- Ч 2 SO 4 + HI → H 2 S + I 2 + H 2 O
Полные решения:
1. CO 2 + H 2 O → C 6 H 12 O 6 + O 2 9 903 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9. 9018 9018 9. 9018 9018 9. . появляются только один раз на каждой стороне уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. Слева только один атом углерода, а справа шесть. Итак, прибавляем коэффициент шесть к углеродсодержащей молекуле слева.
CO 2 + H 2 O → C 6 H 12 O 6 + O 2 9 903 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9018 9. 9018 9018 9. 9018 9018 9. . появляются только один раз на каждой стороне уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. Слева только один атом углерода, а справа шесть. Итак, прибавляем коэффициент шесть к углеродсодержащей молекуле слева.6CO 2 + H 2 O → C 6 H 12 O 6 + O 2
Далее рассмотрим водород. Два атома водорода слева и двенадцать справа. Итак, добавим коэффициент шесть к водородосодержащей молекуле слева.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + O 2
Теперь пора проверить кислород. Всего слева 18 молекул кислорода (6×2 + 6×1). Справа восемь молекул кислорода. Теперь у нас есть два варианта выравнивания правой части: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент. Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
Справа восемь молекул кислорода. Теперь у нас есть два варианта выравнивания правой части: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент. Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
2. SiCl 4 + H 2 O → H 4 SiO 4 + HCl Единственный элемент, который встречается здесь более одного раза в одной и той же части уравнения, — это водород, поэтому мы можем начать с любого другого элемента. Начнем с кремния. Обратите внимание, что с каждой стороны находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
Начнем с кремния. Обратите внимание, что с каждой стороны находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
SiCl 4 + H 2 O → H 4 SiO 4 + 4HCl
Теперь давайте посмотрим на кислород. Помните, что сначала мы хотим проанализировать все элементы, которые встречаются только один раз на одной стороне уравнения. Слева всего один атом кислорода, а справа четыре. Итак, мы добавим коэффициент четыре в левой части уравнения.
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Мы почти закончили! Теперь нам просто нужно проверить количество атомов водорода с каждой стороны. У левого есть восемь, и у правого также есть восемь, так что мы закончили. Наш окончательный ответ
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Как всегда, прежде чем продолжить, убедитесь, что число атомов каждого элемента сбалансировано с каждой стороны.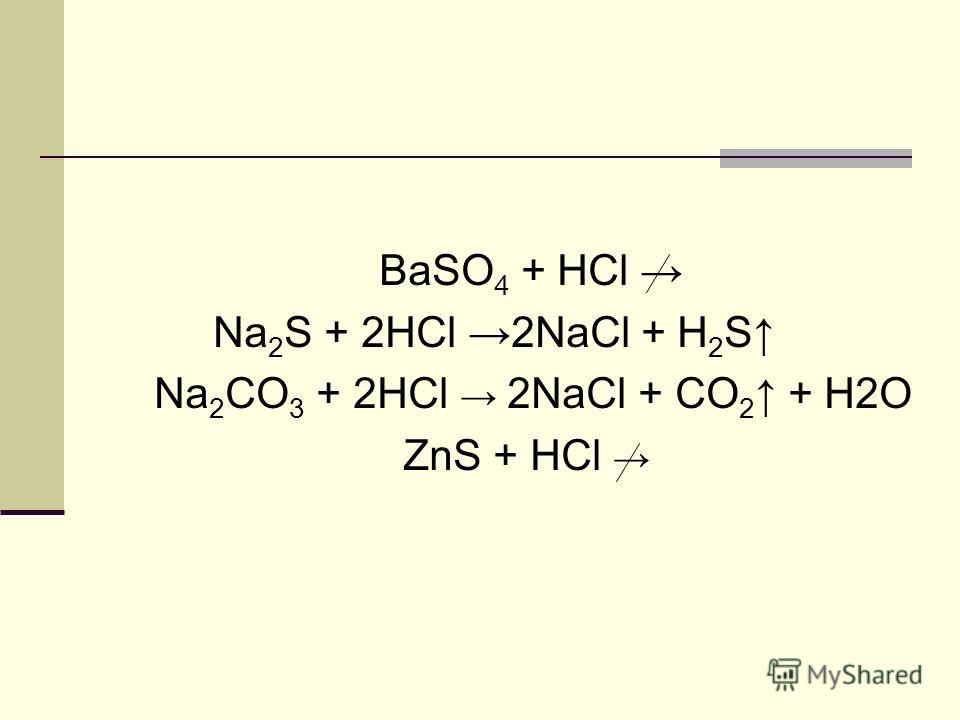
Эта задача немного сложна, так что будьте осторожны. Всякий раз, когда один атом находится в одиночестве по обе стороны уравнения, проще всего начать с этого элемента. Итак, мы начнем с подсчета атомов алюминия с обеих сторон. Есть один слева и один справа, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на водород. Слева тоже один, а справа два. Итак, мы добавим коэффициент два слева.
Al + 2HCl → AlCl 3 + H 2
Далее мы рассмотрим хлор. Слева теперь двое, а справа трое. Теперь это не так просто, как просто добавить коэффициент к одной стороне. Нам нужно, чтобы количество атомов хлора было одинаковым с обеих сторон, поэтому нам нужно, чтобы два и три были равны. Мы можем сделать это, найдя наименьшее общее кратное. В этом случае мы можем умножить два на три и три на два, чтобы получить наименьшее общее кратное шести. Итак, умножим 2HCl на три и AlCl 3 на два:
Итак, умножим 2HCl на три и AlCl 3 на два:
Al + 6HCl → 2AlCl 3 + H 2
Мы рассмотрели все элементы, поэтому легко сказать, что мы закончили. Тем не менее, всегда проверяйте дважды. В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий, в правой части, алюминий больше не сбалансирован. Слева один, а справа два. Итак, добавим еще один коэффициент.
2Al + 6HCl → 2AlCl 3 + H 2
Мы еще не совсем закончили. Просматривая уравнение в последний раз, мы видим, что водород также был несбалансирован. Слева шесть, а справа два. Итак, с последней корректировкой, мы получаем наш окончательный ответ:
2Al + 6HCl → 2AlCl 3 + 3H 2
4. Na 2 CO 1 5 6 90 + HCl + HCl O + CO 2 Будем надеяться, что к этому моменту уравнения балансировки станут проще, и вы освоите их. Глядя на натрий, мы видим, что он встречается дважды слева и один раз справа.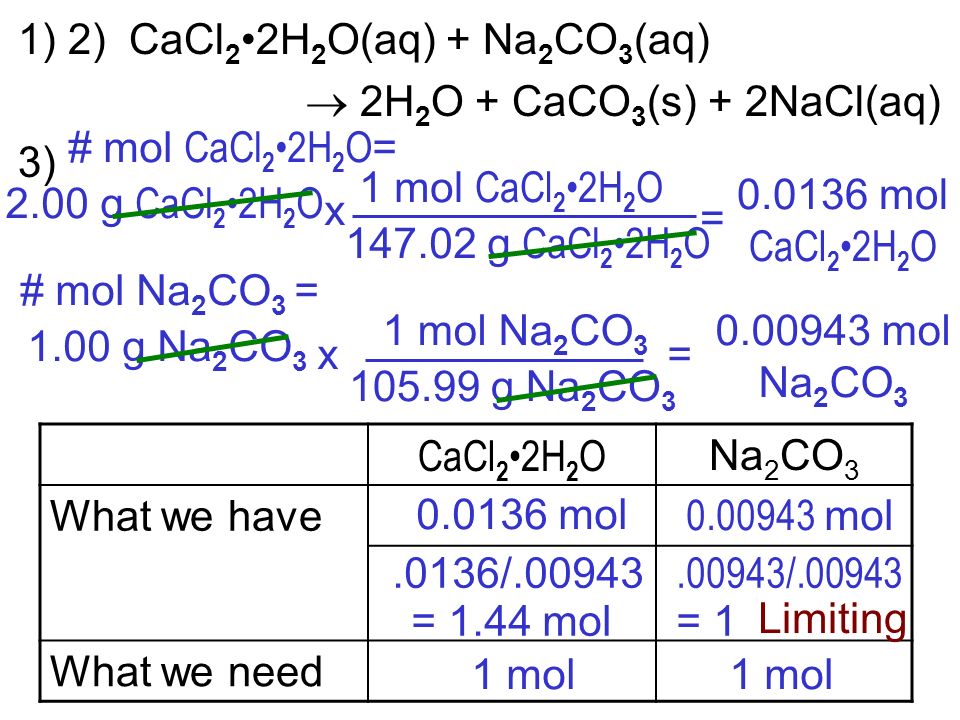 Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Na 2 CO 3 + HCl → 2NaCl + H 2 O + CO 2
Теперь давайте посмотрим на углерод. Один слева и один справа, поэтому коэффициенты добавлять не нужно. Так как кислород встречается более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Слева один и справа два, поэтому добавим коэффициент слева.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Затем, глядя на хлорку, мы видим, что она уже уравновешена двумя с каждой стороны. Теперь мы можем вернуться к кислороду. Три слева и три справа, поэтому наш окончательный ответ:
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
4. C 4. C H 6 O 2 + O 2 → CO 2 + H 2 O Мы можем начать балансировать это уравнение, взглянув на углерод или водород. Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + H 2 O
Затем два справа, для водорода, шесть атомов слева и два атома справа, для водорода, шесть. Итак, мы добавим коэффициент три справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + 3H 2 O
Теперь немного поковыряюсь, по кислороду,
. Кислород присутствует в каждой молекуле уравнения, поэтому мы должны быть очень осторожны при его балансировании. Четыре атома кислорода слева и 17 справа. Не существует очевидного способа сбалансировать эти числа, поэтому мы должны использовать небольшую хитрость: дроби. Теперь, когда мы пишем наш окончательный ответ, мы не можем включать дроби, так как это неправильная форма, но иногда их использование помогает решить задачу. Кроме того, старайтесь избегать чрезмерного манипулирования органическими молекулами. Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Итак, чтобы сбалансировать четыре и семнадцать, мы можем умножить O 2 слева на 7,5. Это даст нам
C 7 H 6 O 2 + 7.5O 2 → 7CO 2 + 3H 2 O
90 уравнения, поэтому умножьте все на два, чтобы получить целые значения. Теперь наш окончательный ответ:
2C 7 H 6 O 2 + 15O 2 → 14CO 2 + 6H 2 O
6. Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe(OH) 3- Начнем с балансировки утюга с обеих сторон. У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + 2Fe(OH) 3-
Затем мы можем посмотреть на серу. Слева их три, а справа только один. Итак, мы добавим коэффициент три в правую часть.
Fe 2 (SO 4 ) 3 + KOH → 3K 2 SO 4 + 2Fe(OH) 3-
FE 2 (SO 4 ) 3 + 6KOH → 3K 2 SO 4 + 2FE (OH) 3-
(OH) 3- (OH) 3-
) . 2 + SiO 2 → P 4 O 10 + CaSiO 3
Глядя на кальций, мы видим, что их три слева и один справа, поэтому мы можем добавить коэффициент из трех справа, чтобы сбалансировать их.
Ca 3 (ПО 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Тогда для фосфора мы видим, что их два слева и четыре справа. Чтобы сбалансировать их, добавьте коэффициент два слева.
2CA 3 (PO 4 ) 2 + SIO 2 → P 4 O 10 + 3CASIO 3
9 10 + 3CASIO 3 9. слева. Каждый раз, когда вы добавляете коэффициент, дважды проверяйте, влияет ли этот шаг на какие-либо элементы, которые вы уже сбалансировали. В этом случае количество атомов кальция слева увеличилось до шести, а справа по-прежнему три, поэтому мы можем изменить коэффициент справа, чтобы отразить это изменение.
2CA 3 (PO 4 ) 2 + SIO 2 → P 4 O 10 + 6CASIO 3
5 10 + 6CASIO 3 5 10 + 6CASIO 3 5 10 + 6CASIO 3 5 10 + 6CASIO 3 5 . на данный момент. Ориентируясь на кремний, мы видим, что слева он один, а справа шесть, поэтому мы можем добавить коэффициент слева.
на данный момент. Ориентируясь на кремний, мы видим, что слева он один, а справа шесть, поэтому мы можем добавить коэффициент слева.2Ca 3 (ПО 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3 91450146
Теперь проверим количество атомов кислорода с каждой стороны. В левой части 28 атомов, а в правой тоже 28. Итак, после проверки того, что все остальные атомы одинаковы с обеих сторон, мы получаем окончательный ответ
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
8. KClO 3 → KClO 4 + KCl This problem is particularly tricky because every atom, except oxygen , встречается в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, с него и начнем. Их три слева и четыре справа. Чтобы сбалансировать их, мы находим наименьшее общее кратное; в данном случае 12. Добавляя коэффициенты четыре слева и три справа, мы можем сбалансировать кислород.
Добавляя коэффициенты четыре слева и три справа, мы можем сбалансировать кислород.
4KClO 3 → 3KClO 4 + KCl
Теперь мы можем проверить калий и хлор. Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также уравновешен, по четыре с каждой стороны, так что мы закончили, с окончательным ответом
4KClO 3 → 3KClO 4 + KCl
9. Al 2 (SO 5Ал 2 (SO 4 ) 3 + Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
Двигаясь прямо к кальцию, слева есть только один, а справа три правильно, поэтому мы должны добавить коэффициент три.
Al 2 (SO 4 ) 3 + 3Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
19 элементы сбалансированы, поэтому наше окончательное уравнение равно
Al 2 (SO 4 ) 3 + 3Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
10. H 2 SO 4 + HI → H 2 S + I 2 + H 2 O Поскольку водород встречается более одного раза слева, мы временно пропустим его и перейдем к сере. Один атом слева и один справа, так что балансировать пока нечего. Глядя на кислород, четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы сбалансировать их.
Глядя на кислород, четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы сбалансировать их.
H 2 SO 4 + HI → H 2 S + I 2 + 4H 2 O
Только один йод слева и два справа, поэтому простой коэффициент может уравновесить тех.
H 2 SO 4 + 2HI → H 2 S + I 2 + 4H 2 O
Теперь мы можем взглянуть на самый сложный элемент: водород. Слева их четыре, справа десять. Итак, мы знаем, что должны изменить коэффициент либо H 2 SO 4 или HI. Мы хотим изменить что-то, что впоследствии потребует наименьшей доработки, поэтому мы изменим коэффициент HI. Чтобы в левой части было десять атомов водорода, нам нужно, чтобы в HI было восемь атомов водорода, поскольку H 2 SO 4 уже имеет два. Итак, изменим коэффициент с 2 на 8.
H 2 SO 4 + 8HI → H 2 S + I 2 + 4H 2 O
Однако это тоже меняет баланс для йода. Слева теперь восемь, а справа только два. Чтобы исправить это, мы добавим коэффициент 4 справа. После проверки того, что все остальное также уравновешено, мы получаем окончательный ответ
Слева теперь восемь, а справа только два. Чтобы исправить это, мы добавим коэффициент 4 справа. После проверки того, что все остальное также уравновешено, мы получаем окончательный ответ
H 2 SO 4 + 8HI → H 2 S + 4I 2 + 4H 2 O
Как и в случае с большинством навыков, при изучении баланса химических уравнений требуется практика. Продолжайте усердно работать и постарайтесь решить как можно больше задач, чтобы отточить свои навыки балансировки.
Есть ли у вас какие-либо советы или приемы, которые помогут вам сбалансировать химические уравнения? Дайте нам знать об этом в комментариях!
Давайте применим все на практике. Попробуйте этот практический вопрос по общей химии: Ищете дополнительную практику по общей химии? На Albert.io можно найти тысячи практических вопросов. Albert.io позволяет вам настроить учебный процесс так, чтобы он ориентировался на практику, в которой вам больше всего нужна помощь.


 Кристаллографические методы теперь зависят от анализа дифракционных картин образца, направленного лучом определенного типа.
Кристаллографические методы теперь зависят от анализа дифракционных картин образца, направленного лучом определенного типа.