стехиометрическое соотношение окислителя к горючему
При проектировании и эксплуатации газопламенного оборудования часто возникает вопрос об определении оптимального соотношения количества горючего и окислителя, обеспечивающего их полное сгорание с выделением максимального количества тепловой энергии.
Рассмотрим методику определения оптимального соотношения количества горючего и окислителя на примере: горючий газ – метан (Ch5), окислитель – кислород (O2).
Реакция окисления (горения) метан/кислород:
CH4+2xO2→CO2+2xh3O (1)
Молярная масса одной молекулы: водорода (Н) – 1 г/моль, углерода (C) составляет 12 г/моль, кислород (O) – 16 г/моль. Тогда, молярная масса молекулы метана (CH4) составляет 16 г/моль, а молярная масса молекулы кислорода (O2) составляет 32 г/моль. Как следует из формулы (1), для полного окисления одной молекулы метана (CH4) требуется две молекулы кислорода (O2).
Введем понятие стехиометрического отношения [1] окислителя к горючему (по массе):
где m – масса газа;
ν — количество вещества, моль [2];
M – молярная масса газа;
индекс «ок» — окислитель;
индекс «гг» – горючий газ.
Количество вещества определяется в молях и характеризует число структурных единиц (ими могут быть атомы или молекулы) определяемого вещества, отнесенного к числу структурных единиц (атомов) в 0,012 кг (12 гр) изотопа углерода C12. Из этого следует, что в 0,012 кг (12 гр) изотопа углерода C12 содержится один моль количества вещества. Само число структурных единиц, содержащихся в одном моле вещества, называется числом Авогадро и равно NA = 6,023×1023 моль-1 = 6,023×1026 кмоль-1 [2].
В таком случае количество вещества определяется соотношением:
где N — число структурных единиц (молекул) веществ, участвующих в реакции окисления.
Как указывалось выше, в одном моле любого вещества содержится NA число структурных единиц, при этом у каждого вещества структурная единица обладает своей массой (масса атома, масса молекулы). Следовательно, массой обладает и один моль вещества, эта масса называется молярной массой. В таком случае, если вещество (в частности газ) имеет массу m, а число структурных единиц этого вещества таково, что количества вещества составляет ν, то:
Тогда, в частном случае, при сгорании метана в кислороде, можно записать:
индекс «O2» — кислород;
индекс «CH4» – метан.
На практике измерять массу газа неудобно и используется измерение объемов газа. Для того, что бы определить потребный объем кислорода для полного сгорания 1 м3 метана, запишем уравнение состояния [2] для каждого из газов:
где p – давление газа;
V – объем газа;
R – универсальная газовая постоянная;
T – температура газа.
Следует заметить, что в момент реакции давление и температура газов будут одинаковыми.
Решим соотношения (5а) и (5б) относительно объемов соответствующих газов и определим стехиометрическое отношение кислорода к метану (по объему):
Т.к. стехиометрическое соотношение кислорода к метану для полного сгорания определено в (4), то определим следующие значения для соотношения (6):
В таком случае отношение объема кислорода к объему метана равно 2, т.е. для сжигания 1 м 3 метана потребуется 2 м3 кислорода.
Соотношение (6) можно записать более универсально:
Очень часто в газопламенном оборудовании в качестве окислителя используется воздух, а именно содержащийся в воздухе кислород. По данным, приведенным в [1], процентное содержание кислорода в воздухе (по массе) составляет 23,2%. Запишем соотношение:
где индекс «вз» — воздух;
Если в соотношение (8) числитель (масса кислорода) и знаменатель (масса воздуха) помножить на массу горючего газа, который необходимо сжечь (окислить), то можно перейти к стехиометрическим соотношениям (по массе):
Для исследования процесса горения метана в воздухе необходимо в соотношение (9б) подставить значение
тогда получим
т. е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха.
е. для полного сжигания 1 кг метана требуется 17,24 кг воздуха.
Для определения объема воздуха, необходимого для сжигания 1м3 метана, воспользуемся соотношением (7):
где МВЗ = 29 г/моль [1].
В общем виде соотношение (10а) примет вид:
Подставив значения в соотношение (10б), получим, что для сжигания 1 м3 метана потребуется
9,512 м3 воздуха.
Так же в качестве горючих газов часто используются пропан (C3H8) и бутан (C4H10).
Реакция окисления (горения) пропан/кислород и бутан/кислород:
C3H8 + 5xO2 → 3xCO2 + 4xH2O (11)
2xC4H10 + 13xO2 → 8xCO2+10xH2O (12)
Молярные массы: пропана – MC3H8 = 44 г/моль; бутана – MC4 H10 = 58 г/моль.
Используя выводы, сделанные для реакции окисления метана и кислорода, получаем, что требуемая масса кислорода (O2) для сжигания 1 кг пропана (C3H8) – 3,636 кг кислорода (O2), а для сжигания 1 кг бутана (C4H10) – 3,586 кг кислорода (O2).
Тогда можем записать:
Учитывая соотношение (9б), определяем, что
т.е. для сжигания 1 кг пропана необходимо 15,672 кг воздуха, а для сжигания 1 кг бутана – 15,457 кг воздуха.
Используя соотношение (7) или (10б), определяем объем кислорода (O2) и воздуха, которые соответственно необходимы для сжигания 1 м3 пропана и 1 м3 бутана, что показано в таблице 1.
Таблица 1. Расход окислителя на 1 кг (1 м3) горючего газа
| Окислитель | Горючий газ | Метан (CH4) | Пропан (C3H8) | Бутан (C4H10) |
| Кислород (O2) | 4 кг (2 м3) | 3,636 кг (5 м3) | 3,586 кг (6,5 м3) |
| Воздух | 17,24 кг (9,512 м3) | 15,672 кг (23,779 м3) | 15,457 кг (30,914 м3) |
Пропан (C3H8) и бутан (C4H10) чаще всего используются не по отдельности, а как смесь горючих газов. Поэтому требуемое количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Поэтому требуемое количество окислителя для полного сгорания пропанобутановой смеси будет зависеть от процентного соотношения каждого из компонентов.
Пусть γ — доля (по массе) содержания пропана в смеси, а β — доля (по массе) содержания бутана в смеси. γ и β подчинены следующему соотношению:
γ + β=1 (13)
Т.к. пропан и бутан не вступают в химические реакции, то стехиометрическое отношение для каждого из газов не будет меняться, а стехиометрическое отношение для пропанобутановой смеси в зависимости от окислителя будет определяться соотношением:
индекс «C3H8 – C4H10» – пропанобутановая смесь.
Значения стехиометрических соотношений в зависимости от процентного содержания пропана и бутана в смеси представлены в таблице 2.
Таблица 2. Стехиометрические отношения (по массе) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 | |
| Кислород (O2) | 3,621 | 3,616 | 3,611 |
| Воздух | 15,607 | 15,586 | 15,565 |
Для того, чтобы определить отношение объема окислителя к объему пропанобутановой смеси, обеспечивающее полное сгорание, согласно соотношению (7) необходимо определить молярную массу пропанобутановой смеси — MC3H8-C4H10.
Для этого воспользуемся законом Дальтона [1]:
Надо учитывать, что в законе Дальтона как температура каждого из газов и их смеси, так и объем, занимаемый как отдельным газом, так и их смесью, одинаковы.
Выразив давление для пропана, бутана, а так же их смеси через уравнение состояния, аналогично (5а) и (5б), можем перейти к следующему соотношению:
Учитывая, что
соотношение (16) можно переписать:
Значения молярных масс пропанобутановых смесей для наиболее используемых соотношений γ и β, приведены в таблице 3.
Таблица 3. Молярные массы пропанобутановых смесей
| Молярная масса | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| MC3H8-C4H10 | 47,435 | 48,702 |
Тогда в соответствии с соотношением (7) или (10б) можно рассчитать стехиометрические соотношения (по объему) для различных пропанобутановых смесей, что и приведено в таблице 4.
Таблица 4. Стехиометрические отношения (по объему) для пропанобутановых смесей
| Окислитель | Пропанобутановая смесь | γ = 0,7; β = 0,3 | γ = 0,6; β = 0,4 | γ = 0,5; β = 0,5 |
| Кислород (O2) | 5,368 | 5,503 | 5,647 |
| Воздух | 25,529 | 26,175 | 26,857 |
Следует заметить, что полученные значения расхода окислителя (как по массе, так и по объему) на единицу горючего газа, следует увеличить на 2-5%, т.к. в воздухе и техническом кислороде присутствуют другие компоненты, которые под действием высоких температур горения сами вступают в реакцию окисления и тем самым снижают долю окислителя, приходящуюся на горючий газ.
Так же согласно [1] и [2] закон Дальтона и уравнение состояния соблюдаются в диапазоне низких давлений. Тем не менее, большинство газопламенного оборудования используется при давлениях
до 5 МПа, что позволяет применять как полученные соотношения, так и приведенные значения.
Газопламенное оборудование, спроектированное ООО «Машпроект» (сайт: машпроект.рф
E-mail:
Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
), обеспечивает оптимальное сгорание горючих газов, как в кислороде, так и в воздухе. Поэтому наша продукция обладает высокой топливной эффективностью и, как следствие, низкими эксплуатационными затратами.
СПИСОК ЛИТЕРАТУРЫ
1. Глинка Н.Л. Общая химия – Л.: Химия, 1979. – 720 с.
2. Савельев И.В. Общий курс физики. Т. 1 – М.: Наука, 1977 – 416 с.
Какой объем кислорода требуется для сжигания 2 м3 пропана? Какой объем углекислого газа при этом образуется?
Какой объем кислорода требуется для сжигания 2 м3 пропана? Какой объем углекислого газа при этом образуется?
Решение.
Запишем краткое
V (C3H8) = 2 м3
| Запишем уравнение реакции горения пропана: С3Н8 + 5 О2 = 3 СО2 + 4 Н2О 1 моль 5 моль 3 моль 4 моль
|
V (O2) – ? V (CO2) – ? |
условие задачи и дополнительные данные, необходимые для ее решения.
Газы, участвующие в реакции, находятся при одинаковых условиях, поэтому для расчета их объемов не обязательно находить количество вещества, а можно применить следствие из закона Авогадро, согласно которому в газовых реакциях отношение объемов реагирующих веществ равно отношению соответствующих коэффициентов в уравнении реакции.
По уравнению сгорания
для сжигания 1 объема С3Н8 необходимо 5 объемов О2;
для сжигания 2 м3 С3Н8 необходимо V м3 О2.
V (O2) = 2 ∙ 5 / 1 = 10 (м3).
Аналогично рассчитываем объем получающегося в реакции углекислого газа:
при сжигании 1 объема С3Н8 образуется 3 объема СО2;
при сжигании 2 м3 С3Н8 образуется V м3 СО2.
V (СO2) = 2 ∙ 3 / 1 = 6 (м3).
Ответ: V (O2) = 10 м3; V (СO2) = 6 м3.
напишите уравнение реакции горения пропана расставьте коэффициенты и докажите что эта реакция окислительно-восстановительная
Ch3(OH)-C*H(OH)-C*H(OH)-CHO (углевод альдотетроза)два асимметрических атома углерода: С-2 и С-З.
 При наличии двух центров хиральности этот альдегид должен существовать в виде четырех стереоизомеров, представляющих собой две пары энантиомеров. Энантиомеры (I) и (II), (III) и (IV), имеют одинаковые физические и химические свойства, но противоположные знаки вращения плоскости поляризации света. (I) не является зеркальным изображением стереоизомеров (III) или (IV). => (I) и (III), а также (I) и (IV), (II) и (III) или (II) и (IV) представляют пары диастереомеров — сигма-диастереомеры, так как в них заместители связаны с центром хиральности сигма-связями. Можно заметить, что у сигма-диастереомеров конфигурации одного центра хиральности одинаковы, у другого — противоположны. С увеличением числа центров хиральности возрастает число сигма-диастереомеров.
При наличии двух центров хиральности этот альдегид должен существовать в виде четырех стереоизомеров, представляющих собой две пары энантиомеров. Энантиомеры (I) и (II), (III) и (IV), имеют одинаковые физические и химические свойства, но противоположные знаки вращения плоскости поляризации света. (I) не является зеркальным изображением стереоизомеров (III) или (IV). => (I) и (III), а также (I) и (IV), (II) и (III) или (II) и (IV) представляют пары диастереомеров — сигма-диастереомеры, так как в них заместители связаны с центром хиральности сигма-связями. Можно заметить, что у сигма-диастереомеров конфигурации одного центра хиральности одинаковы, у другого — противоположны. С увеличением числа центров хиральности возрастает число сигма-диастереомеров.Ch3(OH)-CH(OH)-CO-Ch3(OH)
Ca + 2h3O = Ca(OH)2 + h3Ca(OH)2 + CO2 = CaCO3 + h3O
CaCO3 + 2HCL = CaCl2 + h3O + CO2
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl
В задаче не уверена, извини
Ch5 + 2O2 = CO2 + 2h3O
M(Ch5) = 12+1*4 = 16 г/моль
n(Ch5) = m/M = 16/16 = 1 моль
M(O2) = 16*2 = 32 г/моль
n(O2) = m/M = 64/32 = 2 моль
M(CO2)= 12+16*2 =44 г/моль
n(CO2) = m/M = 44/44 = 1 моль
При расчете все на 1 моль вещества, получается, что все вещества взяты в равном количестве. Отсюда следует, что n(h3O)=2n(Ch5) = n(O2) = 2n(CO2) =2 моль
M(h3O) = 1*2+16=18 г/моль
m(h3O) =n*M = 2*18=36 г
Отсюда следует, что n(h3O)=2n(Ch5) = n(O2) = 2n(CO2) =2 моль
M(h3O) = 1*2+16=18 г/моль
m(h3O) =n*M = 2*18=36 г
разбираем происшествие на подводном продуктопроводе «СибурТюменьГаза»
Югорчане до сих пор обсуждают прорыв на подводном трубопроводе компании «СибурТюменьГаз» в Нижневартовском районе и его последствия.
Эта тема и сейчас периодически появляется в новостной ленте в соцсетях: «Обь продолжает гореть», «Рыба задыхается», «Отголоски нефти все еще видны», «Дышать можно». Конечно, некоторые площадки в СМИ и соцсетях играют в кликбейт, но полной картины произошедшего действительно пока нет, поскольку расследование еще идет. Тем не менее, какие-то версии и слухи вокруг события можно легко отсечь уже сейчас.
Информационная лавина порою напоминают историю об йети — снежном человеке. Многие его видели, кое-кто даже ухитрился добыть фото- и видеосвидетельства существования снежных людей, но эксперты, разглядывая эти пленки, не нашли в них следов доказательств. В общем, кем бы ни был снежный человек — гигантской обезьяной или кем-то более невероятным — его существование так и не доказано. Вот то же и с нашим происшествием: слухов много, и они разные. Вокруг этой истории, как и в случае со снежным человеком, появились свои мифы, которые мы решили разобрать по полочкам, обратившись за помощью к экспертам, а еще — банально к википедии и здравому смыслу.
Многие его видели, кое-кто даже ухитрился добыть фото- и видеосвидетельства существования снежных людей, но эксперты, разглядывая эти пленки, не нашли в них следов доказательств. В общем, кем бы ни был снежный человек — гигантской обезьяной или кем-то более невероятным — его существование так и не доказано. Вот то же и с нашим происшествием: слухов много, и они разные. Вокруг этой истории, как и в случае со снежным человеком, появились свои мифы, которые мы решили разобрать по полочкам, обратившись за помощью к экспертам, а еще — банально к википедии и здравому смыслу.
Миф № 1: горела нефть
После происшествия ленты соцсетей и информагентств заполнили фотографии и видео пожара на реке. Многие потрясены — пламя полыхало прямо на льду. Сотни комментариев почти под каждым таким видео.
«Это нефть горит, не дай бог тут все взорвется. Может, нас всех пора эвакуировать?» — это одни из первых сообщений жителей Нижневартовска.
Итак, в нашем рейтинге — это миф № 1. Горела не нефть, как считают многие обыватели, а широкая фракция легких углеводородов — ШФЛУ, или пропан-бутан, используемый в быту и как газомоторное топливо. Попутный нефтяной газ — это легкие, газообразные при нормальных условиях углеводороды (метан, этан, пропан, бутан, изобутан) и некоторые другие. Вспоминайте, все эти компоненты знакомы нам как участники простейшей химической реакции — горения.
Горела не нефть, как считают многие обыватели, а широкая фракция легких углеводородов — ШФЛУ, или пропан-бутан, используемый в быту и как газомоторное топливо. Попутный нефтяной газ — это легкие, газообразные при нормальных условиях углеводороды (метан, этан, пропан, бутан, изобутан) и некоторые другие. Вспоминайте, все эти компоненты знакомы нам как участники простейшей химической реакции — горения.
В дальнейшем эти газы могут использоваться как топливо в реактивных двигателях самолетов и энергетических установках судов и кораблей, кроме этого, из них делают и пластик. Бутан — в каждой газовой зажигалке.
Нефть и газ — это смеси углеводородов. Основное отличие в том, что нефть — жидкость, а газ — не жидкость. У природного газа небольшие плотность и вязкость, он легче воздуха. А нефть обладает относительно высокой плотностью и вязкостью, сопоставимой с водой. Образует пленку, оседает в толще воды и в донных отложениях. Чистить воду от нефтяных разливов — очень сложно и дорого.
В отсеченном участке трубы на момент происшествия находилось около 600-700 тонн газов. Однако приблизительно 90 % от этого объема удалось откачать и отправить в амбары дожига, где газ был утилизирован.
Если бы горела нефть, как утверждают некоторые, мы бы видели совсем иную картину визуального загрязнения. Аналитик Rupec Александр Собко отметил, что авария на трубопроводе не привела к загрязнению окружающей среды. Эксперт заявил, что содержавшаяся в трубе пропан-бутановая смесь — это легкие углеводороды, которые быстро испаряются. Пропан закипает при температуре минус 42 градуса Цельсия, для бутана эта величина равна минус 0,5 градуса. Полное их испарение, по словам аналитика, вопрос времени. Впрочем, те, кто долго живет в Западной Сибири — основном нефтегазодобывающем районе России — отлично знают эти различия, ведь почти в каждой семье есть свой нефтяник.
Миф № 2: горение нужно срочно тушить
Долгое время на Оби можно было заметить остаточное тление.
«Почему не тушат! Это же сколько выбросов идет в атмосферу. Опасно для жизни», — это еще часть высказываний пользователей соцсетей.
Действительно, Обь «горела», а действий, кроме закрытия периметра очага, не наблюдалось. Да еще, как сообщалось, при согласовании МЧС и надзорных органов. Вопрос, однако.
«Порыв произошел под водой, поэтому мы и видим остаточное тление. Добавлю, что тушить его нельзя — утилизация остаточных углеводородов происходит самым безопасным способом. Ему просто надо время прогореть, протлеть, если хотите, полностью. Это безопасно для окружающей среды. Помните, сколько у вас горело факелов в свое время? Компании просто сжигали попутный газ десятилетиями. Сейчас идет естественный процесс, который самый безопасный, — пояснил нам заместитель директора по развитию исследовательской школы химических и биомедицинских технологий национального исследовательского Томского политехнического университета Юрий Ленерт.
«Тлеют легкие углеводороды, так они не останутся в составе воды, а уйдут вверх», — добавляет кандидат химических наук Югорского госуниверситета Дмитрий Корнеев.
Так что как бы это странно не казалось — тактика в данном случае выбрана верная. «Заливать» остаточное тление было нельзя, финалом таких действий стало бы нарушение водной экосистемы.
«Газ стремится попасть в атмосферу и улетучиться. Попадание в атмосферу небольших объемов легких углеводородов — неизбежное явление для нефтегазодобывающих регионов. Газы улетучиваются как при горении на факеле, так и без него», — отмечает профессор РЭУ им. Плеханова, председатель комиссии по этнологической экспертизе Иван Потравный.
Жители столицы Самотлора отлично понимают, о чем идет речь: десятки лет они жили при факелах, сжигающих попутный газ. Хорошего от такого горения, откровенно говоря, тоже мало. Но будем реалистами: двухнедельный огонь на реке — ничто в сравнении с объемами вредных веществ от факелов сжигания ПНГ. Благо их становится все меньше. Кстати, здесь прямая связь с трубопроводом, по которому идут продукты переработки ПНГ.
Миф № 3: рыба гибнет
Этот вопрос сложнее. О заморе рыбы в эти дни не говорил только ленивый. Напомним, что практически сразу же после происшествия в соцсетях появилось видео, где его автор показал большое скопление рыбы, задыхающейся в полынье на Оби. Он предположил, что это связано с аварией выше по течению реки Обь, и именно продукты из газопровода могли оказать такое воздействие на рыбу. Правда, югорчане сразу раскритиковали автора, назвав явление обыкновенным сезонным замором из-за кислородного голодания под толстым льдом.
О заморе рыбы в эти дни не говорил только ленивый. Напомним, что практически сразу же после происшествия в соцсетях появилось видео, где его автор показал большое скопление рыбы, задыхающейся в полынье на Оби. Он предположил, что это связано с аварией выше по течению реки Обь, и именно продукты из газопровода могли оказать такое воздействие на рыбу. Правда, югорчане сразу раскритиковали автора, назвав явление обыкновенным сезонным замором из-за кислородного голодания под толстым льдом.
Очередной миф или реальность?
Напомним, что 9 марта ряд СМИ со ссылкой на официально опубликованную информацию сообщили, что замор рыбы никак не связан с происшествием на трубопроводе «СибурТюменьГаз». В рыбоохране при этом назвали такие выводы преждевременными, потому что научное исследование изъятых образцов рыб еще не завершено.
«В настоящее время, в связи с происшествием в акватории реки Обь, ФГБНУ «ВНИРО» отобраны соответствующие пробы, в том числе образцы рыбы, для проведения соответствующей экспертизы. Окончательный вывод о причине гибели рыбы, которая была обнаружена в Сургутскому районе, можно сделать только после получения официальных результатов исследований данной научной организацией», — сообщили в ведомстве.
Окончательный вывод о причине гибели рыбы, которая была обнаружена в Сургутскому районе, можно сделать только после получения официальных результатов исследований данной научной организацией», — сообщили в ведомстве.
Это официальные данные. А вот то, что говорят независимые эксперты и рыбаки, интереснее.
«Надо понимать, что сейчас река находится в некомфортном состоянии: из-за толщины льда в нее поступает мало кислорода, — говорит кандидат географических наук, доцент, директор Института науки о Земле ТюмГУ Виталий Хорошавин.
Так что вот вам еще одна версия, к слову, имеющая под собой обоснование. В Югре периодически проходятакции по спасению рыбы после суровой зимы. Недавно, к слову, прошла одна из них: активисты вышли на реки региона для бурения лунок. Таким образом в воду попадает кислород, и речные обитатели не задыхаются.
«Подобная акция планировалась еще год назад, но, к сожалению, помешала пандемия. В этом году коронавирус начал потихоньку отступать и появилась возможность собраться, выйти и помочь выжить природе», — говорит Эдуард Логинов, член Общественной палаты Югры:
Доступ к кислороду рыбе открывали и вартовчане на Оби.
«Толщина льда больше метра, но техника позволяет пробурить лунки», — говорит участник акции в Нижневартовске Виктор Сенкевич.
Больше метра! Понятно же, что кислород в реку почти не поступает. В этом году ледяной покров, как никогда ранее, большой. Нынешняя зима побила все рекорды по морозам: в январе среднесуточная температура составила −28,8 градусов Цельсия. Это на 8,5 градусов ниже средней температуры января за 40 лет наблюдений с 1981 по 2020 год.
Так что, естественный замор рыбы из-за недостатка кислорода — обычное для нашего региона явление для весны. Об этом говорят и бывалые рыбаки.
Тем не менее часть экологов считает, что делать выводы можно только после получения анализов Росрыболовства. По словам Алексея Книжникова из Всемирного фонда дикой природы, может иметь место сочетание техногенного фактора и традиционного замора. Ждем анализов.
… До изобретения газет, радио, телевидения информация циркулировала в обществе в виде пересудов, кривотолков и всевозможных слухов. Сегодня «сарафанное радио» ушло в Интернет, точнее соцсети. Каждому есть что сказать, что предположить — площадка-то просторная. Но давайте все же опираться на конкретные факты, а то, как и со снежным человеком, можем дойти до полного абсурда.
Сегодня «сарафанное радио» ушло в Интернет, точнее соцсети. Каждому есть что сказать, что предположить — площадка-то просторная. Но давайте все же опираться на конкретные факты, а то, как и со снежным человеком, можем дойти до полного абсурда.
Сегодня над выяснением причин происшествия и его последствий работают надзорные органы и привлеченные ими эксперты. Именно им предстоит дать свою экспертную оценку.
Напишите уравнения реакций изомеризации бутана горения пропана
Ответы на вопрос
a)ch4-ch3-ch3-ch4-> ch4-ch-ch4(катализатор alcl3)(2-метилпропан)
б)c3h8+5o2-> 3co2+4h3o(условие t)
m(p-panaoh) = m(h3o) + m(naoh) = 1000 + 600 = 1600 г.
w(naoh) = 600/1600 = 0,375 или 37,5%.
na2co3 + h3sio3 = na2sio3 +h3o + co2
na2co3 +2hcl = 2nacl + h3o + co2
пусть к- коэффициент пропорциональности
тогда объем газов, а соответственно и их количества относятся 3х/2х
количества исходных веществ по уравнению реакции из 1 реакции количество v1(na2co3) = v(h3sio3)=3x
из второй реакции v2(na2co3)=2x
итого соды 2х+3х=5х весит 5*х*106=530х г
кремниевой кислоты 2*х*78=234х г
тогда массовая доля кремниевой кислоты w=234x*100%/(234x+530x)=30,63%
ПОМОГИТЕ ПОЖАЙЛУСТА. НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ А)ИЗОМЕРИЗАЦИИ БУТАНА Б)ГОРЕНИЕ ПРОПАНА В КИСЛОРОДЕВ)1,2,3Й СТАДИИ ХЛОРИРОВАНИЯ МЕТАНАДАЙТЕ НАЗВАНИЯ ВСЕМ ПРОДУКТОМ РЕАКЦИИ
НАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ А)ИЗОМЕРИЗАЦИИ БУТАНА Б)ГОРЕНИЕ ПРОПАНА В КИСЛОРОДЕВ)1,2,3Й СТАДИИ ХЛОРИРОВАНИЯ МЕТАНАДАЙТЕ НАЗВАНИЯ ВСЕМ ПРОДУКТОМ РЕАКЦИИ
Лучший ответ:
а) конкретнее, что нужно сделать, бутан не изомеризуется просто так, либо через Вюрцаб) С3Н8+5О2=3СО2+4Н2Ов)СН4+Сl2=Ch4Cl+HCl хлорметан+хлороводородCh4Cl+Cl2=Ch3Cl2+HCl дихлорметанCh3Cl2+Cl2=CHCl3+HCl тетрахлорметан
Другие вопросы:
Отметь кружком- можно просто номер написать, те утверждения, с которыми согласен! ПОМОГИТЕ СРОчно 1) Настоящий друг-это тот, кто никогда не обманет своего друга. 2)Настоящий друг-это тот, кто не пожалеет поделится со своим другом всем,что сам имеет. 3)Настоящий друг-это тот, кто никому не выдаст секреты своего друга. 4)Настоящий друг-это тот, кто не станет смеяться над бедой или неудачей своего друга. 5)Настоящий друг-это тот, с кем всегда интересно и никогда не скучно. 6)Настоящий друг-это тот, кто постарается защитить от обидчика. ПОМОГИТЕ СРОЧНО какой номер правильней всех номеров?
ученикам 7 класса (!) вопросГруз массой 2 кг равномерно движется по столу под действием силы 2Н. Чему равен коэффициент трения?
Чему равен коэффициент трения?
сочинить стихи зна заданные рифмы. курочка . подружка . птичка. дудочка . ватрушка . спичка
считаете ли вы , что право на неприкосновенность частной жизни необходимо гражданам всех стран. Аргументируйте свой ответ
Помогите пожалуста! очень нужно на завтра, я месяц болею уже, ничего не понимаю.(
OBRAZOVALKA.COM — образовательный портал
Наш сайт это площадка для образовательных консультаций, вопросов и ответов для школьников и студентов .
На вопросы могут отвечать также любые пользователи, в том числе и педагоги.
Консультацию по вопросам и домашним заданиям может получить любой школьник или студент.
Химические свойства алканов | CHEMEGE.RU
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Строение алканов
Гомологический ряд
Получение алканов
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.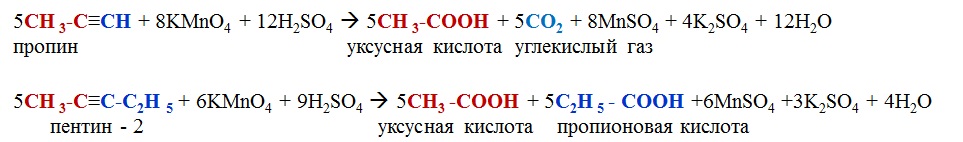
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.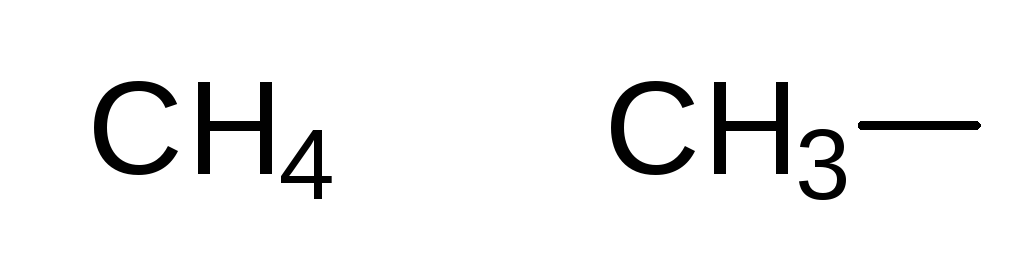 |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
| Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
| Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом. С третичный–Н > С вторичный–Н > С первичный–Н |
| Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан: |
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
| Например. При нитровании пропана образуется преимущественно 2-нитропропан: |
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, при дегидрировании этана образуются этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана.
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
| Например, н-бутан под действием катализатора хлорида алюминия и при нагревании превращается в изобутан: |
ВМЕСТО ПРОПАНА – АЦЕТИЛЕН ???
Ежегодно в конце лета цены на пропан устремляются ввысь. Не стал исключением и этот год. Осложнило ситуацию еще и то, что момент окончания выборки квот поставок пропана на внутренний рынок РФ по времени совпал с очередным витком кризиса в отношениях между Россией, Украиной и Европой, что побудило шустрых Европейских коммерсантов активно включиться в закупку жидкого «голубого топлива» в РФ. И вот встает вопрос: «А не выгоднее уже теперь использовать ацетилен там, где его заменяют пропаном именно с целью экономии?»
Температура горения пропана в резаке 2000-2500 градусов Цельсия, у ацетилена – 3260. Время нагрева металла до температуры плавления при кислородной резке при пропане значительно больше. Резка слаболегированных и сталей больших толщин возможна только на ацетилене. Ацетиленовый баллон, несмотря на большую стоимость, обладает гораздо большей живучестью, по сравнению с пропановым. Использование клапанных резаков, отсекающих греющую смесь на время непосредственной резки, добавит еще экономии на газе. Ниже в таблице приведены характеристики из паспорта резака типа Р1. Из этой таблицы видно, что не только пропана, но и кислорода в пропановом резаке тратится на 30% больше, чем в ацетиленовом. И это при том, что разница в цене заправки ацетиленового и пропанового баллона уже отличается всего на те же 30%.
Может, есть смысл заглянуть в дальние уголки склада, вытащить запыленные ацетиленовые баллоны, заменить мундштук в резаке с пропанового на ацетиленовый и попробовать? А если еще вспомнить, что ацетиленом можно еще и варить? И что ацетиленовая горелка стоит намного меньше сварочного полуавтомата. А в качестве сварочной проволоки в аварийной ситуации, когда дорога каждая минута, можно использовать обычный электрод, который можно просто «обстучать от обмазки», а не покупать 5 кг бобину. И не нужно нестись за углекислотой или смесью. Может пора начать экономить?
| Техническая Характеристика | ||||
| Толщина разрезаемой стали, мм | до 15 | 15-50 | 50-100 | |
| Мундтштук внутренний | 1А/1П | 3А/3П | 4А/4П | |
| Мундштук наружный | 1А/1П | |||
| Давление на входе кгс/см2 | Кислорода (номинальное) | 3,0-3,5 | 4,0-4,2 | 4,5-5,0 |
| горючего газа, А/П | 0,03 — 1,2/0,01 — 1,5 | |||
| Расход м3/час | кислорода при работе на А | 2,6 — 2,8 | 5,4 — 5,8 | 8,6 — 10,2 |
| кислорода при работе на П | 3,2 — 3,5 | 7,7 — 8,5 | 11,1 — 13,1 | |
| горючего газа, А/П, не более | 0,26/0,4 | 0,33/0,48 | 0,36/0,56 | |
| Масса резака, кг, не более | 0, 75 | |||
| Длина резака, мм, не более | 500 | |||
|
Внутренний диаметр присоедняемых рукавов — 6 или 9 мм |
||||
Молекула гексана
Для просмотра молекулы пропана в 3D — >> в 3D с Jsmol
Химические и физические свойства молекулы пропана
А трехуглеродный алкан, пропан иногда полученные из других нефтепродуктов в процессе добычи нефти или природного переработка газа. Пропан имеет химическое Формула: C 3 H 8
Когда обычно продается как топливо, он также известен как сжиженная нефть газ (сжиженный нефтяной газ или сжиженный нефтяной газ) и представляет собой смесь пропана с меньшими количества пропилена, бутана и бутилена, плюс одорант этилмеркаптана, чтобы позволить обычно без запаха пропан необходимо нюхать.Он используется в качестве топлива в кулинарии на многих барбекю и переносные печи и в автотранспортных средствах. Пропан питает некоторые автобусы, погрузчики и такси и используется для обогрева и приготовление пищи в транспортных средствах для отдыха и в кемпингах. Во многих в сельских районах США пропан также используется в печах, водопроводных обогреватели, сушилки для белья и другие тепловыделяющие устройства. Грузовики наполняют большие резервуары, которые установлены на постоянной основе. на имущество (иногда свиней ) или обмен бутылки с пропаном.
Свойства и реакции
Пропан претерпевает реакции горения аналогичным образом. к другим алканам. При избытке кислорода пропан ожоги с образованием воды и углекислого газа.
- C 3 H 8 + 5 O 2 â † ’3 CO 2 + 4 H 2 O + тепло
Когда кислорода недостаточно для полного сгорания, пропан горит с образованием воды и углерода монооксид.
- 2 C 3 H 8 + 7 O 2 â † ’6C O + 8 H 2 O + тепло
В отличие от природного газа, пропан тяжелее воздуха (в 1,5 раза плотнее). В неочищенном состоянии пропан раковины и бассейны в пол. Жидкий пропан превратится в пар при атмосферном давлении. давление и выглядит белым из-за конденсации влаги из воздух.
При правильном сгорании пропан производит около 2500 БТЕ. на кубический фут газа (91 600 БТЕ на галлон жидкости).В общая теплота сгорания одного нормального кубометра пропана составляет около 50 мегаджоулей (â ‰ ˆ13,8 кВтч) или 101 МДж / м3 в единицах СИ.
Пропан нетоксичен; однако при злоупотреблении в качестве ингалянта он представляет собой умеренный риск удушья из-за кислородного голодания. Также необходимо отметить, что товарный продукт содержит углеводороды. помимо пропана, что может увеличить риск. Пропан и его смеси может вызвать легкое обморожение при быстром расширении.
Пропан сгорает намного чище, чем бензин. не такой чистый, как природный газ. Наличие связей C-C, плюс кратные связи пропилена и бутилена создают органические выхлопы помимо углекислого газа и водяного пара во время типичных горение. Эти связи также вызывают горение пропана с видимое пламя.
См. Также:
Список литературы
1-молекула пропана — PubChem
Центр обработки данных по двум альтернативным видам топлива — Пропан
Пропан — Энергетическое образование
Рисунок 1.Модель заполнения пространства молекулы пропана. Черные сферы представляют углерод, а белые сферы — водород [1]Пропан представляет собой алкан с химической формулой C 3 H 8 . Как тип углеводорода, он может подвергаться сгоранию углеводородов с выделением тепла. Пропан — один из углеводородных компонентов сырого природного газа, который является одним из видов ископаемого топлива. [2] Пропан обычно удаляется из природного газа перед отправкой потребителям, но он также продается отдельно как топливо.
Рисунок 2. Стандартный резервуар для хранения пропана. [3]Пропан во время потребления обычно находится в газообразном состоянии. Однако обычно он хранится в виде сжиженного пропана в резервуарах, подобных показанному на Рисунке 2. Пропан имеет одну из самых высоких плотностей энергии (50,3 МДж / кг) среди всех углеводородов, уступая только метану. [4]
Пропан — это углеводород, обычно используемый в домашних условиях. Обычно он встречается в таких приборах, как барбекю, обогреватели для патио и походные печи.
Недвижимость
Ниже приводится таблица некоторых основных свойств пропана.
| Химическая формула | C 3 H 8 |
| Молекулярная масса | 44,1 г / моль |
| Плотность энергии | 50,3 МДж / кг [4] |
| Точка плавления | -190 o C [5] |
| Точка кипения | -42 o C [5] |
Реакция горения
Пропан выделяет свою химическую энергию при сгорании углеводородов.Ниже приведена анимация горения углеводородов, показывающая чистую реакцию, которая происходит, когда пропан соединяется с кислородом.
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O + Тепловая энергия (энтальпия)Реакция горения углеводородов выделяет тепловую энергию и является примером экзотермической реакции. Реакция также имеет отрицательное значение изменения энтальпии (ΔH).
Для дальнейшего чтения
Список литературы
Авторы и редакторы
Bethel Afework, Semaa Amin, Allison Campbell, Jordan Hanania, James Jenden, Kailyn Stenhouse, Jason Donev
Последнее обновление: 31 января 2020 г.
Получить ссылку
Propane (C3H8)
Пропан представляет собой трехуглеродный алкан, обычно газ, но сжимаемый до переносимой жидкости.Его получают из других нефтепродуктов при переработке нефти или природного газа. Он обычно используется в качестве топлива для двигателей, газовых горелок, барбекю, переносных печей и центрального отопления жилых домов.
При использовании в качестве автомобильного топлива он обычно известен как сжиженный нефтяной газ (LPG или LP-газ), который может представлять собой смесь пропана с небольшими количествами пропилена, бутана и бутилена. Также добавляется одорант этантиол, чтобы люди могли легко почувствовать запах газа в случае утечки.
ЭтимологияЕго название произошло от части пропионовой кислоты (которая также имеет 3 атома углерода) и суффикса -ane.
Свойства и реакции
Пропан вступает в реакции горения аналогично другим алканам. В присутствии избытка кислорода пропан горит с образованием воды и диоксида углерода.
- C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O + тепло
Пропан + Кислород → Двуокись углерода + Вода
Когда кислорода недостаточно для полного сгорания, происходит неполное сгорание, когда пропан горит и образует воду, монооксид углерода, диоксид углерода и углерод.
- C 3 H 8 + 3,5 O 2 → CO 2 + CO + C + 4 H 2 O + тепло
Пропан + Кислород → Двуокись углерода + Окись углерода + Углерод + Вода
В отличие от природного газа, пропан тяжелее воздуха (в 1,5 раза плотнее). В сыром виде пропан сливается и образует лужи на полу. Жидкий пропан превращается в пар при атмосферном давлении и выглядит белым из-за конденсации влаги из воздуха.
При правильном сгорании пропан производит около 50 МДж / кг.Общая теплота сгорания одного нормального кубического метра пропана составляет около 91 мегаджоуля
Пропан нетоксичен; однако при злоупотреблении в качестве ингалянта он создает умеренный риск удушья из-за кислородного голодания. Коммерческие продукты содержат углеводороды помимо пропана, что может увеличить риск. Обычно хранящийся под давлением при комнатной температуре, пропан и его смеси расширяются и охлаждаются при высвобождении и могут вызвать легкое обморожение.
Сжигание пропана намного чище, чем сгорание бензина, но не так чисто, как сгорание природного газа.Присутствие связей C-C, а также множественные связи пропилена и бутилена создают органические выхлопы помимо углекислого газа и водяного пара во время обычного горения. Эти связи также вызывают горение пропана с видимым пламенем.
Коэффициенты выбросов парниковых газов для пропана составляют 62,7 кг CO 2 / mBTU или 1,55 кг CO 2 на литр или 73,7 кг / ГДж.
В отличие от природного газа, пропан тяжелее воздуха (в 1,5 раза плотнее). В сыром виде пропан сливается и образует лужи на полу.Жидкий пропан превращается в пар при атмосферном давлении и выглядит белым из-за конденсации влаги из воздуха.
При правильном сгорании пропан производит около 50 МДж / кг. Общая теплота сгорания одного нормального кубического метра пропана составляет около 91 мегаджоуля
Пропан нетоксичен; однако при злоупотреблении в качестве ингалянта он создает умеренный риск удушья из-за кислородного голодания. Коммерческие продукты содержат углеводороды помимо пропана, что может увеличить риск. Обычно хранящийся под давлением при комнатной температуре, пропан и его смеси расширяются и охлаждаются при высвобождении и могут вызвать легкое обморожение.
Сжигание пропана намного чище, чем сгорание бензина, но не так чисто, как сгорание природного газа. Присутствие связей C-C, а также множественные связи пропилена и бутилена создают органические выхлопы помимо углекислого газа и водяного пара во время обычного горения. Эти связи также вызывают горение пропана с видимым пламенем.
Коэффициенты выбросов парниковых газов для пропана составляют 62,7 кг CO 2 / mBTU или 1,55 кг CO 2 на литр или 73,7 кг / ГДж.
ИспользуетПропан используется в качестве топлива при приготовлении пищи на многих барбекю, переносных печах и в автомобилях. Вездесущий стальной контейнер объемом 4,73 галлона (20 фунтов) часто называют «баком для барбекю». Пропан остается популярным выбором для барбекю и переносных печей, поскольку его низкая точка кипения -42 ° C (-43,6 F) заставляет его испаряться, как только он выходит из контейнера под давлением. Следовательно, карбюратор или другое испарительное устройство не требуется; простая дозирующая форсунка.Пропан используется в некоторых локомотивах, автобусах, вилочных погрузчиках, такси и машинах для обработки льда, а также используется для обогрева и приготовления пищи в транспортных средствах для отдыха и кемпингах. Во многих сельских районах Северной Америки пропан используется в печах, кухонных плитах, водонагревателях, сушилках для стирки и других устройствах, вырабатывающих тепло. В этом случае он обычно хранится в большом стационарном баллоне, который перезаряжается грузовиком для доставки пропана. По состоянию на 2000 год 6,9 миллиона американских домохозяйств использовали пропан в качестве основного топлива для отопления.
Коммерчески доступное «пропановое» топливо или СНГ не является чистым. Обычно в США и Канаде это в основном пропан (не менее 90%), остальное — в основном бутан и пропилен (максимум 5%), а также отдушки. Это стандарт HD-5 (Heavy Duty — максимальное допустимое содержание пропилена 5%), разработанный для двигателей внутреннего сгорания. LPG при извлечении из природного газа не содержит пропилена. LPG, очищенный от сырой нефти, действительно содержит пропилен. Не все продукты с маркировкой «пропан» соответствуют этому стандарту.В Мексике, например, содержание бутана намного выше.
Топливо бытовое и промышленное
В Северной Америке местные грузовики для доставки, называемые «бобтейлами», со средним объемом резервуара 3000 галлонов, заполняют большие резервуары (иногда называемые свиней ), которые постоянно установлены на территории, или другие грузовые автомобили для обслуживания меняют пустые баллоны пропана с заполненные баллоны. Большие тягачи с прицепами, называемые «грузовыми лайнерами», со средним объемом цистерны 10 000 галлонов, транспортируют пропан от трубопровода или нефтеперерабатывающего завода до местного завода по доставке.Бобтейл и транспорт не являются уникальными для североамериканского рынка, хотя такая практика не так распространена где-либо еще, и транспортные средства обычно называются танкерами . Во многих странах пропан доставляется потребителям через небольшие или средние индивидуальные резервуары.
Использование пропана быстро растет в непромышленных регионах мира. Пропан заменяет древесину и другие традиционные источники топлива в таких местах, где его теперь иногда называют «кухонным газом». Североамериканские грили-барбекю, работающие на пропане, нельзя использовать за границей.«Пропан», продаваемый за границей, на самом деле представляет собой смесь пропана и бутана. Чем теплее страна, тем выше содержание бутана, обычно 50/50, а иногда и 75% бутана. Использование калибровано для форсунок разного размера, имеющихся в грилях за пределами США. Американцы, которые везут свои грили за границу, например, военнослужащие, могут найти пропан, соответствующий требованиям США, на военных почтовых биржах AAFES.
Отрасли промышленности Северной Америки, использующие пропан, включают производство стекла, печи для обжига кирпича, птицефабрики и другие отрасли, которым требуется переносное тепло.
Холодильное оборудование
Пропан также играет важную роль в обеспечении автономного охлаждения, обычно с помощью газоабсорбционного холодильника.
Смеси чистого, сухого «изопропана» (R-290a) (коммерческий термин, используемый для описания смесей изобутан / пропан) и изобутана (R-600a) имеют незначительный озоноразрушающий потенциал и очень низкий потенциал глобального потепления и могут служить функциональной заменой R -12, R-22, R-134a и другие хлорфторуглеродные или гидрофторуглеродные хладагенты в обычных стационарных системах охлаждения и кондиционирования воздуха.
В автотранспортных средствахТакая замена широко запрещена или не рекомендуется в автомобильных системах кондиционирования воздуха на том основании, что использование горючих углеводородов в системах, изначально предназначенных для перевозки негорючего хладагента, представляет значительный риск пожара или взрыва.
Продавцы и сторонники углеводородных хладагентов выступают против таких запретов на том основании, что таких инцидентов было очень мало по сравнению с количеством автомобильных систем кондиционирования воздуха, заполненных углеводородами.Одно конкретное испытание было проведено профессором Университета Нового Южного Уэльса, который непреднамеренно испытал наихудший сценарий внезапной и полной утечки хладагента в пассажирский салон с последующим возгоранием. Он и несколько других находившихся в машине получили ожоги лица, ушей и рук, а несколько наблюдателей получили порезы от разбитого стекла окна переднего пассажира.
Топливо автомобильное
Пропан также все чаще используется в качестве автомобильного топлива.В США 190 000 дорожных транспортных средств используют пропан, а 450 000 вилочных погрузчиков используют его в качестве источника энергии. Это третье по популярности автомобильное топливо в Америке после бензина и дизельного топлива. В других частях света пропан, используемый в транспортных средствах, известен как автогаз. Около 9 миллионов автомобилей по всему миру используют автогаз.
Преимущество пропана — его жидкое состояние при умеренном давлении. Это обеспечивает быструю заправку, доступную конструкцию топливного бака и диапазон, сопоставимый с бензином (хотя и меньший).Между тем, он заметно чище (как при обращении, так и при сгорании), приводит к меньшему износу двигателя (из-за отложений углерода) без разбавления моторного масла (часто с увеличенными интервалами замены масла), и до недавнего времени это было относительно выгодной сделкой в Северной Америке. Октановое число заметно выше 110. Однако общественные заправочные станции все еще редки. Многие переделанные автомобили имеют приспособления для доливки из «бутылок для барбекю». Специализированные автомобили часто входят в состав коммерческих автопарков и имеют частные заправочные станции.
Пропан обычно хранится и транспортируется в стальных баллонах в виде жидкости с паровым пространством над жидкостью. Давление пара в цилиндре зависит от температуры. Когда газообразный пропан всасывается с высокой скоростью, скрытая теплота испарения, необходимая для создания газа, вызывает охлаждение баллона. (Вот почему вода часто конденсируется на стенках бутылки, а затем замерзает). В крайних случаях это может вызвать такое сильное снижение давления, что процесс больше не будет поддерживаться.Кроме того, легкие высокооктановые соединения испаряются раньше, чем более тяжелые, низкооктановые. Таким образом, свойства воспламенения изменяются по мере опорожнения бака. По этим причинам жидкость часто отбирают с помощью погружной трубки.
Прочие
- Пропан используется в качестве сырья для производства основных нефтехимических продуктов при паровом крекинге.
- Пропан используется в некоторых огнеметах в качестве топлива или сжатого газа.
- Некоторое количество пропана становится сырьем для пропилового спирта, обычного растворителя.
- Пропан — основное топливо для воздушных шаров.
- Используется в производстве полупроводников для осаждения карбида кремния.
- Пропан смешивается с силиконом для образования пропеллента (продается как зеленый газ), который используется для питания газового оружия, используемого в боевых играх страйкбола.
- Жидкий пропан обычно используется в тематических парках и в киноиндустрии в качестве недорогого высокоэнергетического топлива для взрывов и других особых эффектов.
Пропан тяжелее воздуха.Если произойдет утечка в системе пропанового топлива, газ будет иметь тенденцию опускаться в любое закрытое пространство и, таким образом, представляет опасность взрыва и возгорания. Типичный сценарий — протекающий баллон, хранящийся в подвале; Утечка пропана дрейфует по полу к контрольной лампе печи или водонагревателя и приводит к взрыву или возгоранию.
Пропан покупается и хранится в жидкой форме (СНГ), поэтому энергия топлива может храниться в относительно небольшом пространстве. Сжатый природный газ (СПГ), в основном метан, является еще одним газом, используемым в качестве топлива, но его нельзя сжижать путем сжатия при нормальных температурах (которые намного выше критической температуры метана, и поэтому для хранения требуется очень высокое давление (что создает опасность того, что в случае аварии баллон для сжатого природного газа может взорваться с большой силой или протечь достаточно быстро, чтобы превратиться в самоходную ракету).Следовательно, СПГ гораздо менее эффективно хранить из-за необходимого большого объема резервуара. Таким образом, пропан гораздо чаще используется в качестве топлива для транспортных средств, чем природный газ, и ему требуется всего 1220 килопаскалей (177 фунтов на квадратный дюйм) давления, чтобы поддерживать его в жидком состоянии при температуре 37,8 ° C (100 F).
Измерение остатка в баке пропанаУровень жидкости в баллоне с пропаном можно измерить с помощью внутреннего магнитного «поплавка». Затем внешний датчик может определить местоположение поплавка в баке. Эта система с магнитным поплавком не может точно измерить общее количество пропана, поскольку газообразная часть пропана внутри резервуара не учитывается при измерении.
Самый точный способ измерить количество пропана, оставшегося в пропановом баллоне, — это взвесить его. На боковой стороне резервуара должны быть выбиты буквы TW, за которыми следует цифра. Это число представляет собой вес пустого бака в фунтах или его собственный вес. Типичный 5-галлонный баллон с пропаном может иметь собственный вес 10 фунтов. Если этот резервуар весил 20 фунтов, это означает, что в резервуаре хранится 10 фунтов пропана
Галлон пропана содержит 91 690 БТЕ. Умножение этого числа на количество галлонов в резервуаре дает 152 205 БТЕ тепловой энергии (1.66 91 690 = 152 205).
Затем можно рассчитать время работы конкретного прибора, если известно потребление прибора в БТЕ. Это число, выраженное в БТЕ в час, обычно можно найти на приборе или у производителя. Продолжая этот пример, устройство, потребляющее 12 000 БТЕ в час, обеспечит 12,68 часа работы (152 205 12 000 ≈ 12,68).
ИсточникиПропан производится как побочный продукт двух других процессов: переработки природного газа и нефтепереработки.
Обработка природного газа включает удаление бутана, пропана и большого количества этана из неочищенного газа для предотвращения конденсации этих летучих веществ в трубопроводах природного газа. Кроме того, нефтеперерабатывающие заводы производят пропан как побочный продукт при крекинге нефти в бензин или топочный мазут.
Предложение пропана не может быть легко скорректировано с учетом возросшего спроса из-за побочного продукта производства пропана. Около 90% пропана в США производится внутри страны.
Соединенные Штаты импортируют около 10% пропана, потребляемого ежегодно, из которых около 70% поступает из Канады по трубопроводам и железной дороге. Остальные 30% импортируемого пропана поступают в США из других источников морским транспортом.
После производства североамериканский пропан хранится в огромных соляных пещерах, расположенных в форте Саскачеван, Альберта, Канада; Мон-Бельвье, штат Техас, и Конвей, штат Канзас. Эти соляные пещеры были выдолблены в 1940-х годах и могут хранить до 80 миллионов баррелей пропана или больше.Когда пропан необходим, большая часть его транспортируется по трубопроводам в другие районы Среднего Запада, Севера и Юга для использования потребителями. Пропан также доставляется баржами и железнодорожными вагонами в определенные районы США.
Реакции горения
Реакции горенияВсе реакции горения укладываются в схему:
топливо + O 2 -> CO 2 + H 2 O
Коэффициенты сбалансированного уравнения будут меняться в зависимости от топливо. Топливо может быть практически любым, включая метан (CH 4 ), пропан (C 3 H 8 ), бутан (C 4 H 10 ), октан (C 8 H 18 ) или сахар (C 6 H 12 O 6 ).
Вычисленное уравнение для метана: CH 4 + 2 O 2 -> CO 2 + 2 H 2 O
Вычисленное уравнение для октана это
2 C 8 H 18 + 25 О 2 -> 16 СО 2 + 18 H 2 O
Сжигание метана или октана экзотермическое; это выпускает энергия.
CH 4 + 2 O 2 -> CO 2 + 2 H 2 O + энергия
Энергия продуктов равна ниже энергий реагентов. Избыточная энергия выделяется в виде тепла и света.
Материя имеет тенденцию переходить в более низкие энергетические состояния. Хорошая аналогия для реакция мяч падает с холма. Экзотермический реакции более вероятны. Эндотермический реакции поглощают энергию.В этих реакции продукты выше по энергии, чем реагенты. Эндотермические реакции менее вероятны. Ты редко можно увидеть, как мяч самопроизвольно поднимается в гору. Эндотермические реакции могут происходить, когда энтропия вызывает реакцию (толкает мяч в гору). Эти реакции встречаются гораздо реже. В химической горячей упаковке происходит экзотермическая реакция. (Лыжники знают о грелках для рук и ног.) В химической холодильной упаковке происходит эндотермическая реакция.
Энергия активации
Если вы смешиваете метан и кислород вместе, реакции не происходит сразу. Есть преграда для реакции. Этот барьер связан с тем, что для получения CO 2 и H 2 O мы должны разорвать 4 связи углерод-водород и некоторые связи кислород-кислород. Однако, исходя из этих первоначальных инвестиций в энергию, мы получить больше выплата энергии, когда связи углерод-кислород и водород-кислород сформирован.
Энергетический барьер называется энергией активации. Чистая энергия принадлежащий реакция — это энергия, которая выделяется при горении метана. Как преодолеть первоначальный энергетический барьер? Обычно мы зажигаем реагенты зажигалкой или искрой. Как только мы начнем реакцию, высвободившаяся энергия может позволить другим реакции преодолеть их энергию активации, и пожар начнется.
(экзотермическая реакция)
Пожалуйста, посмотрите анимацию 11.1: Реакции и энергия на вашем CD
Какова реакция горения пропана? — Реабилитацияrobotics.net
Какова реакция горения пропана?
Вычисленное химическое уравнение горения пропана: C3H8 (г) + 5O2 (г) → 3CO2 (г) + 4h3O (г).C 3 H 8 (г) + 5 O 2 (г) → 3 C O 2 (г) + 4 H 2 O (г).
Каковы продукты реакции горения пропана C3H8 с газообразным кислородом?
Пропан (C3H8) горит с кислородом и выделяет углекислый газ, жидкую воду и энергию.
При полном сгорании 10 мл пропана объем газа СО2, полученного в аналогичных условиях, составляет?
∴ 0,01 литра пропана дает 3 × 0,01 литра углекислого газа. = 0,03 литра двуокиси углерода.= 30 мл двуокиси углерода. ∴ Объем углекислого газа, полученного при сжигании 10 мл в аналогичных условиях, составляет 30 мл.
У какого бензина или сжиженного нефтяного газа температура воспламенения ниже?
Что имеет более низкую температуру воспламенения — керосин или сжиженный нефтяной газ? LPG имеет более низкую температуру воспламенения. СНГ — лучшее домашнее топливо, чем древесина. LPG имеет более высокую теплотворную способность и не загрязняет окружающую среду.
Какова температура воспламенения сжиженного нефтяного газа?
около 410-580 град. C
Что из следующего является легковоспламеняющимся веществом?
Например, бензин, спирт и сжиженный нефтяной газ (СНГ) называются легковоспламеняющимися веществами.Полный пошаговый ответ: легковоспламеняющиеся и легковоспламеняющиеся вещества означают горючие вещества. Вещество с низкой температурой воспламенения легко воспламеняется.
Какое из следующих негорючих веществ?
Что из перечисленного не является горючим? Пояснение: Камфора, стекло, солома могут гореть на воздухе и являются горючими веществами. Стекло не горит на воздухе и является негорючим веществом.
Что такое негорючие вещества?
Примеры негорючих материалов включают гелий, стекло и сталь.Это может вас удивить, но еще одним примером негорючего вещества является кислород, который в качестве окислителя вместо этого является горючим.
Каковы основные требования для разведения огня?
Три основных требования: Топливо. Воздух. Нагрейте до температуры воспламенения.
Каковы три важных требования для разжигания огня?
Для возгорания и сгорания необходимы три вещи в правильном сочетании: тепло, кислород и топливо.Должно быть топливо, которое можно сжечь. Для подачи кислорода необходим воздух. Для начала и продолжения процесса горения необходимо наличие тепла (температуры воспламенения).
Что из перечисленного не требуется для разжигания огня?
(d) Двуокись углерода не требуется для сжигания.
Каковы три основных требования для разведения огня?
Кислород, тепло и топливо часто называют «огненным треугольником». Добавьте четвертый элемент, химическую реакцию, и вы получите огненный «тетраэдр».Важно помнить: уберите любую из этих четырех вещей, и у вас не будет пожара или пожар будет потушен.
Глава 11: Горение (Обновлено 31.05.10)
Глава 11: Горение (Обновлено 31.05.10) Глава 11: Сжигание
(Спасибо
в Дэвид
Bayless за помощь в письменной форме.
этот раздел)
Введение — До этого точка тепла Q во всех задачах и примерах была либо заданной значение или было получено из отношения Первого закона.Однако в различных тепловые двигатели, газовые турбины и паровые электростанции тепло полученные в процессе сгорания с использованием твердого топлива (например, уголь или дрова). жидкое топливо (например, бензин, керосин или дизельное топливо), или газообразное топливо (например, природный газ или пропан).
В этой главе мы познакомимся с химией и термодинамика горения типовых углеводородных топлив — (C x H y ), в котором окислителем является кислород, содержащийся в атмосферном воздухе. Обратите внимание, что мы не будем рассматривать сжигание твердого топлива или сложные смеси и смеси углеводородов, входящих в состав бензин, керосин или дизельное топливо.
Атмосферный воздух содержит примерно 21% кислорода (O 2 ) по объему. Остальные 79% «прочих газов» в основном азот (N 2 ), т. предположим, что воздух состоит из 21% кислорода и 79% азота, объем. Таким образом, каждый моль кислорода, необходимый для окисления углеводорода, равен сопровождается 79/21 = 3,76 моля азота. Используя эту комбинацию молекулярная масса воздуха становится 29 [кг / кмоль]. Обратите внимание, что это предполагается, что азот обычно не подвергается каким-либо химическим воздействиям. реакция.
Процесс горения — Основной процесс сгорания можно описать с помощью топлива ( углеводород) плюс окислитель (воздух или кислород) под названием Реагенты , которые подвергаются химическому процессу, выделяя тепло, чтобы сформировать Продукты горения, так что масса сохраняется. в простейший процесс сгорания, известный как стехиометрический Сгорание , весь углерод в топливе образует диоксид углерода (CO 2 ) и весь водород образует воду (H 2 O) в продуктах, поэтому мы можем записать химическую реакцию следующим образом:
где z известен как стехиометрический коэффициент для окислителя (воздуха)
Обратите внимание, что эта реакция дает пять неизвестных: z, a, b, c, d, поэтому нам нужно решить пять уравнений.Стехиометрический горение предполагает отсутствие в продуктах избыточного кислорода, поэтому d = 0. Остальные четыре уравнения мы получаем в результате уравновешивания числа атомов каждого элемента в реагентах (углерод, водород, кислород и азота) с числом атомов этих элементов в продукты. Это означает, что никакие атомы не разрушаются и не теряются в реакция горения.
Элемент | Количество в реактивах | = | Количество товаров | Сокращенное уравнение |
Углерод (C) | х | а | а = х | |
Водород (H) | л | 2b | b = y / 2 | |
Кислород (O) | 2z | 2a + b | г = а + Ь / 2 | |
Азот (N) | 2 (3.76) z | 2c | c = 3,76z |
Обратите внимание, что образующаяся вода может находиться в паре или жидкая фаза, в зависимости от температуры и давления продукты сгорания.
В качестве примера рассмотрим стехиометрическое горение метана (CH 4 ) в атмосферном воздухе. Приравнивание моляра коэффициенты реагентов и продуктов получаем:
Теоретическое соотношение воздух и воздух-топливо -The минимальное количество воздуха, которое позволит полностью сгорать топливо называется Теоретическая Air (также именуемый Стехиометрический воздух ).В этом случае продукты не содержат кислорода. Если мы поставляем меньше теоретического воздуха, тогда продукты могут содержать углерод монооксида (CO), поэтому обычной практикой является подача более теоретический воздух, чтобы предотвратить это явление. Это превышение Воздух приведет к появлению кислорода в продукты.
Стандартная мера количества воздуха, используемого в процесс сгорания топлива воздух-топливо Коэффициент (AF), определяемый следующим образом:
Таким образом, учитывая только реагенты метана при сжигании теоретическим воздухом, представленным выше, получаем:
Решенная задача 11.1 — В В этой задаче мы хотим разработать уравнение горения и определить соотношение воздух-топливо для полного сгорания н-бутана (C 4 H 10 ) с а) теоретическим воздухом и б) 50% избытком воздуха.
Анализ продуктов сгорания — Горение всегда происходит при повышенных температурах и мы предполагаем, что все продукты горения (включая воду пар) ведут себя как идеальные газы. Поскольку у них другой газ постоянных, удобно использовать уравнение состояния идеального газа в условия универсальной газовой постоянной:
В анализе продуктов сгорания нет представляет ряд интересных объектов:
1) Что такое процентный объем конкретных продуктов, в частности углекислого газа (CO 2 ) и углерода монооксид (CO)?
2) Что такое роса точка водяного пара в продуктах сгорания? Это требует оценка парциального давления паровой составляющей воды продукты.
3) Существуют экспериментальные методы объемного анализ продуктов сгорания, обычно проводится на Dry Основа , дающая процент объема всех компонентов, кроме водяного пара. Это позволяет просто метод определения действительного воздушно-топливного отношения и использованного избыточного воздуха в процессе горения.
Для идеальных газов мы находим, что мольная доля y i i-го компонента в смеси газов при определенном давлении P
а температура T равна объемной доле этого компонента.
Т.к. из молярного отношения идеального газа: P.V = N.R u .T,
у нас:
Кроме того, поскольку сумма объемов компонентов V и должны равняться общему объему V, имеем:
Используя аналогичный подход, определяем частичную давление компонента с использованием закона парциальных давлений Дальтона:
Решенная проблема 11.2 — дюймов эта проблема Пропан (C 3 H 8 ) сжигается с 61% избытком воздуха, который поступает в камеру сгорания при 25 ° С.Предполагая полное сгорание и полное давление 1 атм. (101,32 кПа), определите а) соотношение воздух-топливо [кг-воздух / кг-топливо], б) процентное содержание двуокиси углерода в продуктах, и c) температура точки росы продуктов.
Решенная проблема 11,3 — дюймов эта проблема Этан (C 2 H 6 ) сжигается атмосферным воздухом, и объемный анализ сухие продукты сгорания дает: 10% CO 2 , 1% CO, 3% O 2 и 86% № 2 .Развивать уравнение горения, и определить а) процент превышения воздух, б) соотношение воздух-топливо и в) точка росы при сгорании. продукты.
Анализ горения по первому закону — Основная цель горения — выработка тепла за счет изменения энтальпия от реагентов к продуктам. Из Первого Закона уравнение в контрольном объеме без учета кинетической и потенциальной энергии изменений и, если не делать никаких работ, имеем:
, где суммирование ведется по всем продукты (p) и реагенты (r).N означает количество молей каждого компонента, а h [кДж / кмоль] относится к молярной энтальпии каждый компонент.
Поскольку существует ряд различных веществ нам нужно установить общее эталонное состояние для оценки энтальпия, обычно выбирают 25 ° C и 1 атм, что составляет обычно обозначается надстрочным индексом o. Проф. С. Бхаттачарджи из Государственный университет Сан-Диего разработал экспертную систему на базе Интернета в < www.thermofluids.net > называется ТЕСТ ( т он E xpert S система для T гермодинамика) в который он включил набор таблиц свойств идеального газа, все основанные на по энтальпии h o = 0 по этой общей ссылке.Мы адаптировали некоторые из этих таблиц специально для этого раздела, и их можно найти в следующая ссылка:
Горение Таблицы молярной энтальпии
В качестве примера снова рассмотрим полное сгорание. метана (CH 4 ) с теоретическим воздухом:
Обратите внимание, что в реагентах и продуктах В приведенном выше примере у нас есть основные элементы O 2 и N 2 как а также соединения CH 4 , CO 2 и H 2 O.Когда соединение образуется, изменение энтальпии называется изменением энтальпии. Энтальпия формации , обозначенной h f o , и для нашего примера:
Вещество
Формула
hfo [кДж / кмоль]
Двуокись углерода
CO 2 (г)
-393 520
Водяной пар
H 2 O (г)
-241 820
Вода
H 2 O (л)
-285 820
Метан
CH 4 (г)
-74,850
где (г) относится к газу, а (л) относится к жидкость.
Знак минус означает, что процесс экзотермический , т.е. при образовании соединения выделяется тепло. Обратите внимание, что энтальпия образования основных элементов O 2 и N 2 составляет нуль.
Сначала рассмотрим случай, когда достаточно теплопередача таким образом, чтобы и реагенты, и продукты находились на 25 ° C и давление 1 атм, и что водный продукт является жидким. С нет заметного изменения энтальпии, уравнение энергии становится:
Это тепло (Qcv) называется энтальпией . горения или отопления Стоимость топлива.Если продукты содержат жидкую воду, тогда это Выше Теплотворная способность (как в нашем примере), однако, если продукт содержит водяной пар, то это Lower Теплотворная способность топлива. В энтальпия сгорания — это наибольшее количество тепла, которое может быть высвобождается заданным топливом.
Температура адиабатического пламени — Противоположная крайность приведенного выше примера, в котором мы оценили энтальпия горения — это случай адиабатического процесса, в котором тепло не выделяется.Это приводит к значительному повышению температуры. увеличение количества продуктов сгорания (обозначается адиабатическим Температура пламени ), которая может быть уменьшается за счет увеличения воздушно-топливной смеси.
Решенная задача 11.4 — Определить температура адиабатического пламени для полного сгорания Метан (CH 4 ) с 250% теоретического воздуха в адиабатическом контрольном объеме.
Это уравнение может быть решено только итеративным методом. метод проб и ошибок с использованием таблиц Sensible Энтальпия против температуры для всех четырех компоненты продукции — CO 2 , H 2 O, O 2 , и N 2 .Быстрый приближение к температуре адиабатического пламени может быть получено следующим образом: при условии, что продукты полностью состоят из воздуха. Такой подход был представил нам Potter и Somerton в их Schaum’s Очерк термодинамики для инженеров , в котором они предположили, что все продукты имеют номер N 2 . Мы считаем, что более удобно использовать воздух, предполагая репрезентативное значение из Специального Теплоемкость воздуха : C p, 1000K = 1,142 [кДж / кг.K].
Таким образом, суммируя все моли продуктов, получаем:
Использование таблиц Sensible Энтальпия в зависимости от температуры мы оценили энтальпия всех четырех продуктов при температуре 1280К.Этот в результате общая энтальпия составила 802 410 [кДж / кмоль топлива], что составляет чрезвычайно близкое к требуемому значению, что оправдывает такой подход.
Задача 11.5 — — Определите адиабатическую температуру пламени для полное сгорание пропана (C 3 H 8 ) с 250% теоретического воздуха в адиабатическом контрольном объеме [T = 1300 КБ].
______________________________________________________________________________________
Инженерная термодинамика, Израиль
Уриэли под лицензией Creative
Общедоступное авторское право — Некоммерческое использование — Совместное использование 3.0 Соединенные Штаты
Лицензия
Почему из пропана образуется вода
Пропан — это газ, с которым многие люди знакомы, но мало кто понимает. Если человек хочет узнать больше о пропане, горении и причинах образования воды, важно понять, как атомы взаимодействуют во время горения. Образование воды происходит за счет комбинации кислорода, пропана и углекислого газа в процессе сгорания.
Описание
Пропан — это газ, который производится при добыче нефти.Пропан — это трехуглеродный алкан (молекула, состоящая из трех атомов углерода и пяти атомов водорода). Поскольку пропан нетоксичен и обеспечивает экологически чистое горение, его используют для обогрева домов и приготовления пищи. Пропан также используется во множестве других применений, таких как сварка, и как альтернатива бензину. Пропан тяжелее воздуха и будет «скапливаться» на низких участках, создавая потенциально опасную ситуацию.
Состав
Реакции пропана происходят из-за отдачи и поглощения атомов. Протоны и электроны несут положительный (протоны) или отрицательный (электроны) заряд, который определяет свойства связанных с ними атомов.Химические реакции происходят всякий раз, когда возникает химический дисбаланс в той или иной форме; реакция изменяет свойства связанного соединения. Так при горении могут образовываться вода и углекислый газ.
Горение
Вода становится побочным продуктом пропана в процессе горения. Горение происходит при содержании от 1,8% до 8,6% пропана и от 91,4% до 98,2% воздуха. Больше или меньше пропана, и сгорание не может происходить полностью.Это приводит к неправильному уравнению и создает смертельный газ — оксид углерода. Уравнение полного сгорания пропана выглядит следующим образом: 3CH8 + 5O2> 3CO2 + 4h3O.
Производство воды
Трехуглеродный алкан пропана (3CH8) добавляется к пяти молекулам кислорода (O5). Когда смесь нагревается, происходит горение, и атомы начинают бурно взаимодействовать.
