Нитрат алюминия
Нитрат алюминия, азотнокислый алюминий — Al(NO3)3, неорганическое соединение, алюминиевая соль азотной кислоты.
Помимо собственно безводного нитрата, у алюминия существуют и основные нитраты: AlOH(NO3)2 и Al(OH)2NO3, а также ряд гидратированных солей Al(NO3)3•xH2O (х = 4, 6, 8, 9), среди которых наиболее стабилен нонагидрат: Al(NO3)3•9H2O.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Лабораторные методы
- 3.2 Промышленное производство
- 4 Применение
- 5 Опасность
Физические свойства
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе. Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях. Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C.
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды.
Плотность водного раствора нитрата алюминия при 18 °C:
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
|---|---|---|---|---|---|---|---|---|
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу:
- Al(NO3)3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3 NO3−
- [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+
- Водные растворы нитрата алюминия имеют pH от 2,5 до 3,7.

- При нагревании гидролиз можно провести полностью:
- Al(NO3)3 + 3 H2O = Al(OH)3 ↓ + 3 HNO3 ↑
- Вступает в реакцию со щелочами:
- Al(NO3)3 + 3 NaOH = Al(OH)3 ↓ + 3 NaNO3
- Al(NO3)3 + 4 NaOH = Na[Al(OH)4] + 3 NaNO3
- Реакция с концентрированным водным раствором аммиака может идти по двум направлениям.
- На холоде:
- Al(NO3)3 + 3 NH3 + 3 H2O = Al(OH)3 ↓ + 3 NH4NO3
- При нагревании:
- Al(NO3)3 + 3 NH3 + 3 H2O = AlO(OH) ↓ + 3 NH4NO3 + H2O
- При нагревании разлагается:
- 4 Al(NO3)3 = 2 Al2O3 + 12 NO2 ↑ + 3 O2 ↑
- Нонагидрат при сильном нагревании (135 °C) сперва образует основную соль Al(OH)2NO3•1,5H2O, а при более высокой температуре (200 °C) разлагается до аморфного оксида алюминия.

- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
- 8 Al + 30 HNO3 = 8 Al(NO3)3 + 3 N2O ↑ + 15 H2O
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
- Al(OH)3 + 3 HNO3 = Al(NO3)3 + 3 H2O
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
- Al2(SO4)3 + 3 Ba(NO3)2 = 2 Al(NO3)3 + 3 BaSO4 ↓
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты.
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота V (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)):
- Al(NO3)3 ⋅ 9 H2O + 9 N2O5 ⟶ Al(NO3)3+ 18 HNO3 (1)
- AlCl3 + 3 ClNO3 ⟶ Al(NO3)3 + 3 Cl2 (2)
Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота V:
- Al2O3 + 3 N2O5 ⟶ 2 Al(NO3)3
- Al(OH)3 + 3 N2O5 ⟶ Al(NO3)3 + 3 HNO3
В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:
- 2 AlBr3 + 8 N2O5 = 2 [NO2]− [Al(NO3)4]+ + 3 Br2 + 6 NO2
- 2 [NO2]− [Al(NO3)4] = 2 Al(NO3)3 + 4 NO2 + O2
Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике.
Опасность
ЛД50 (крысы, перорально) = 4,28 г/кг.
Задачи на неполное разложение | CHEMEGE.RU
Задачи на частичное разложение — это задачи, в которых исходное вещество распадается только частично, то есть часть исходного вещества остается. При разложении твердого вещества может образоваться новый твердый продукт, но также остается часть исходного реагента, который не разложился. Это необходимо учитывать при составлении химических реакций.
По сути, это одна из разновидностей задач на материальный баланс.
Рассмотрим несколько примеров решения задач на частичное разложение из реальных ЕГЭ по химии.
1. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Для полного растворения образовавшегося твёрдого остатка необходимо затратить 60 г 40%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массу исходного образца нитрата алюминия.
Определите массу исходного образца нитрата алюминия.
Решение:
Реакция разложения нитрата алюминия:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Из условия известно, что распалась только часть исходного вещества.
Количество вещества смеси газов:
nсм = V/Vm = 10,08 л/22,4 л/моль = 0,45 моль
Примем количество образовавшегося кислорода за х моль:
n(О2) = x моль
тогда количество вещества оксида азота (IV) равно 4х моль:
n(NО2) = 4x моль
Получаем уравнение:
х + 4х = 0,45
5х = 0,45
х = 0,09 моль
Количество образовавшегося оксида алюминия:
n(Al2О3) = 0,06 моль
Количество и масса разложившегося нитрата алюминия:
nразлож(Al(NО3)3) = 0,12 моль
mразлож(Al(NО3)3) = n·M = 0,12 моль · 213 г/моль = 25,56 г
С гидроксидом натрия реагирует и образовавшийся оксид алюминия, и остаток нитрата алюминия:
Al(NO3)3 + 4NaOH = Na[Al(OH)4] + 3NaNO3
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Определим массу и количество вещества гидроксида натрия:
m(NaOH) = ω(NaOH)·mр-ра(NaOH) = 0,40 ·60 г = 24 г
n(NaOH) = m(NaOH)/M(NaOH) = 24 г/40 г/моль = 0,6 моль
Определим количество гидроксида натрия, который потребуется для растворения оксида алюминия во второй реакции:
n2(NaOH) = 2n(Al2О3) = 2·0,06 моль = 0,12 моль
Тогда в первой реакции будет израсходовано:
n1(NaOH) = n(NaOH) – n2(NaOH) = 0,6 моль – 0,12 моль = 0,48 моль
Количество неразложившегося нитрата алюминия, который затем растворится в щелочи в первой реакции:
nнеразлож. (Al(NО3)3) = 1/4·n1(NaOH) = 1/4·0,48 моль = 0,12 моль
(Al(NО3)3) = 1/4·n1(NaOH) = 1/4·0,48 моль = 0,12 моль
Масса этого неразложившегося нитрата алюминия:
mнеразлож.(Al(NО3)3) = nнеразлож.(Al(NО3)3)·M = 0,12 моль·213 г/моль = 25,56 г.
Масса исходного нитрата алюминия:
m(Al(NО3)3) = mразлож.(Al(NО3)3) + mнеразлож.(Al(NО3)3) = 25,56 г + 25,56 г = 51,12 г
Ответ: m(Al(NO3)3) = 51,12 г
2. При нагревании карбоната магния часть вещества разложилась. При этом выделилось 5,6 л газа и образовалось 18,4 г твёрдого остатка. Остаток растворили в 365 г соляной кислоты, при этом массовая доля кислоты в конечном растворе составила 2,9%. Вычислите массовую долю соляной кислоты в исходном растворе.
3. При нагревании хлората калия (KClO3) в присутствии катализатора часть вещества разложилась. При этом выделилось 6,72 л (н.у.) газа и образовался твёрдый остаток массой 16 г. К остатку добавили 170 г 30%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в полученном растворе. (KClO3 и AgClO3 растворимы в воде.)
4. При нагревании образца нитрата магния часть вещества разложилась. При этом выделилось 10,08 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 69,36 г. К этому остатку последовательно добавили 100 мл воды и 240 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
5. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом образовался твёрдый остаток массой 50,8 г. К остатку добавили 150 г 20%-ного раствора гидроксида натрия.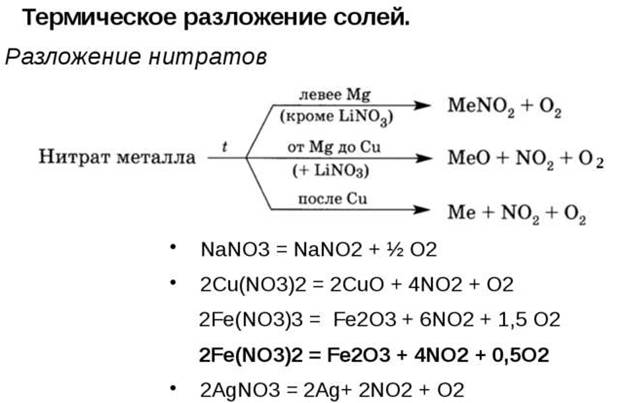 При этом образовался раствор с массой 159 г и массовой долей гидроксида натрия 13,84%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата меди(II).
При этом образовался раствор с массой 159 г и массовой долей гидроксида натрия 13,84%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата меди(II).
6. При нагревании образца нитрата серебра часть вещества разложилась. При этом образовался твёрдый остаток массой 88 г. К этому остатку добавили 200 г 20%-ного раствора соляной кислоты. При этом образовался раствор массой 205,3 г с массовой долей соляной кислоты 15,93%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата серебра.
7. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 1,12 л (н.у.) газа. Масса твёрдого остатка составила 27,35 г. Этот остаток добавили к 73 г 30%-ного раствора соляной кислоты. Определите массовую долю кислоты в полученном растворе.
8. При нагревании образца нитрата цинка часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 64,8 г. Остаток полностью растворили в минимальном объёме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в полученном растворе.
При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 64,8 г. Остаток полностью растворили в минимальном объёме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в полученном растворе.
9. При нагревании образца нитрата серебра часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25 г. К этому остатку последовательно добавили 50 мл воды и 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
10. При нагревании образца нитрата меди(II) массой 94 г часть вещества разложилась. При этом выделилось 11,2 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 292 г 10%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
11. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 15,4 г. Этот остаток прореагировал с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата магния и объём смеси газов (в пересчёте на н.у.), выделившихся при частичном разложении нитрата магния.
При этом образовался твёрдый остаток массой 15,4 г. Этот остаток прореагировал с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата магния и объём смеси газов (в пересчёте на н.у.), выделившихся при частичном разложении нитрата магния.
12. При нагревании образца карбоната бария часть вещества разложилась, при этом выделилось 4,48 л (н.у.) газа. К образовавшемуся твёрдому остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.
13. Оксид меди(II) массой 16 г нагрели в присутствии водорода объёмом 3,36 л (н.у.). При этом водород прореагировал полностью. Полученный твёрдый остаток растворили в 535,5 г 20%-ного раствора азотной кислоты, при этом наблюдали выделение бесцветного газа. Определите массовую долю азотной кислоты в образовавшемся растворе.
14. При нагревании образца нитрата железа(III) часть вещества разложилась.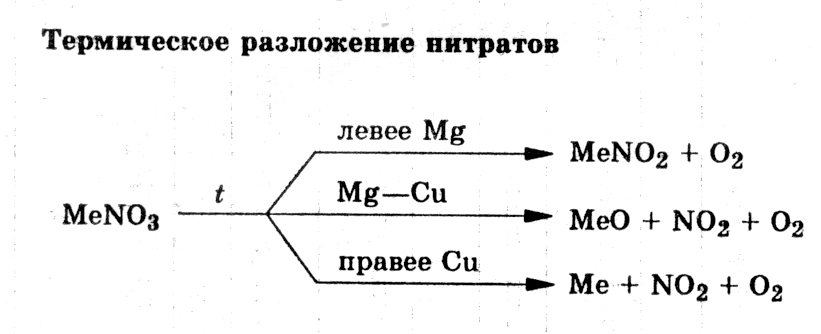 При этом образовалось 88,6 г твёрдого остатка. Этот остаток может прореагировать с 225 г 16%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата железа(III) и объём выделившейся смеси газов (в пересчёте на н.у.).
При этом образовалось 88,6 г твёрдого остатка. Этот остаток может прореагировать с 225 г 16%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата железа(III) и объём выделившейся смеси газов (в пересчёте на н.у.).
15. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 0,448 л (н.у.) углекислого газа и образовалось 4,64 г твёрдого безводного остатка. Остаток добавили к 0,15%-ному раствору гидроксида кальция. При этом в полученном растворе не осталось ионов кальция и карбонат-анионов. Определите массовую долю гидроксида натрия в конечном растворе.
16. При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
17. При нагревании образца нитрата магния массой 44,4 г часть вещества разложилась. При этом выделилось 13,44 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 124,1 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
При этом выделилось 13,44 л (в пересчёте на н.у.) смеси газов. К полученному твёрдому остатку добавили 124,1 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
18. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 5,6 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 26,8 г. К этому остатку последовательно добавили 50 мл воды и 10%-ный раствор гидроксида натрия в количестве, необходимом для полного осаждения ионов меди. Определите массовую долю нитрата натрия в образовавшемся растворе.
19. При нагревании образца нитрата меди(II) часть вещества разложилась. При этом выделилось 2,8 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 32,2 г. К этому остатку последовательно добавили 50 мл воды и 160 г 10%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
20. При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25,38 г. Остаток полностью растворили в необходимом для реакции минимальном объёме 24%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массовую долю нитрата натрия в полученном растворе.
При нагревании образца нитрата алюминия часть вещества разложилась. При этом выделилось 6,72 л (в пересчёте на н.у.) смеси газов. Масса твёрдого остатка составила 25,38 г. Остаток полностью растворили в необходимом для реакции минимальном объёме 24%-ного раствора гидроксида натрия. При этом образовался тетрагидроксоалюминат натрия. Определите массовую долю нитрата натрия в полученном растворе.
21. При нагревании образца гидрокарбоната натрия часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 63,2 г твёрдого безводного остатка. К полученному остатку добавили минимальный объём 20%-ного раствора соляной кислоты, необходимый для полного выделения углекислого газа. Определите массовую долю хлорида натрия в конечном растворе.
22. При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 53,6 г. К остатку добавили 200 г 24%-ного раствора гидроксида натрия. При этом образовался раствор с массой 206,4 г и массовой долей гидроксида натрия 15,5%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата магния.
При этом образовался раствор с массой 206,4 г и массовой долей гидроксида натрия 15,5%. Определите объём смеси газов (в пересчёте на н.у.), выделившихся в результате частичного разложения нитрата магния.
23. При нагревании образца карбоната бария часть вещества разложилась. При этом выделилось 4,48 л (н.у.) газа и образовалось 50 г твёрдого остатка. К остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Вычислите массовую долю гидроксида натрия в полученном растворе.
25. При нагревании образца нитрата железа(III) часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 58 г обработали 267 г 20%-ного раствора гидроксида натрия. При этом массовая доля щёлочи в растворе уменьшилась вдвое. Вторую часть массой 29 г растворили в 126 г 10%-ного раствора азотной кислоты. Вычислите массовую долю соли в образовавшемся растворе.
26. При нагревании образца нитрата меди(II) часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 59 г обработали 127,5 г 25,1%-ного раствора гидроксида натрия. При этом образовался раствор с массовой долей щёлочи 8%. Вторую часть массой 23,6 г растворили в 245 г 10%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе
При нагревании образца нитрата меди(II) часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 59 г обработали 127,5 г 25,1%-ного раствора гидроксида натрия. При этом образовался раствор с массовой долей щёлочи 8%. Вторую часть массой 23,6 г растворили в 245 г 10%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе
27. При нагревании образца нитрата цинка часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 27 г обработали 87,2 г 20%-ного раствора сульфида натрия. При этом массовая доля сульфида натрия в растворе уменьшилась вдвое. Вторую часть массой 81 г добавили к 202,5 г 40%-ного раствора бромоводородной кислоты. Вычислите массовую долю бромоводородной кислоты в образовавшемся растворе.
28. При нагревании образца нитрата алюминия часть вещества разложилась. В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 73,2 г добавили к 663,6 г 15%-ного раствора карбоната натрия. При этом массовая доля соды в растворе уменьшилась в полтора раза. Вторую часть массой 24,4 г растворили при нагревании в 245 г 20%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе.
В результате образовался твёрдый остаток, который разделили на две части. Первую часть массой 73,2 г добавили к 663,6 г 15%-ного раствора карбоната натрия. При этом массовая доля соды в растворе уменьшилась в полтора раза. Вторую часть массой 24,4 г растворили при нагревании в 245 г 20%-ного раствора серной кислоты. Вычислите массовую долю кислоты в образовавшемся растворе.
29. При нагревании образца карбоната кальция часть вещества разложилась. При этом масса карбоната кальция в образовавшемся твёрдом остатке оказалась в 1,4 раза больше массы оксида кальция. Остаток добавили к 640 г 25%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите объём газа (в пересчёте на н.у.), выделившегося в результате частичного разложения карбоната кальция.
Понравилось это:
Нравится Загрузка…
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
| Поиск |
нитрат алюминия = оксид алюминия + диоксид азота + кислород | Температура: 150 — 200
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Реакция разложения Окислительно-восстановительная реакция
| jpg» substance-weight=»212.9962″> 4Al(NO 3 ) 3 | → | 12NO 90 029 2 | + | 3O 2 | |||
| нитрат алюминия | оксид алюминия | азота диоксид | кислород | 9 0011||||
| (рун) | (rắn) | (khí) | (khí) | ||||
| (trắng ) | (нау) | (кхонг мау) | |||||
| 4 | 2 | 12 | 3 | Хо су | |||
| 900 05 | Нгуен — Фантой Кхой (г/моль) | ||||||
| Сомол | |||||||
| 90 006 | Хой лунг (г) |
Реклама
Дополнительная информация об уравнении 4Al(NO
3 ) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2Каковы условия реакции Al(NO3)3 (нитрат алюминия ) ?
Температура: 150–200°C
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием Al2O3 (оксид алюминия) и NO2 (диоксид азота) и O2 (кислород)?
Пиролиз нитрата алюминия
В полном предложении вы также можете сказать Al(NO3)3 (нитрат алюминия) и получить Al2O3 (оксид алюминия) и NO2 (диоксид азота) и O2 (кислород)
Явление после Al(NO3)3 (нитрат алюминия)
Нажмите, чтобы увидеть явление уравненияКакую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями 4Al(NO
3 ) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2Вопросы, связанные с реагентом Al(NO3) 3 (нитрат алюминия)
Каковы химические и физические характеристики Al(NO3)3 (нитрат алюминия)? В каких химических реакциях используется Al(NO3)3 (нитрат алюминия) в качестве реагента?Вопросы, связанные с продуктом Al2O3 (оксид алюминия)
Каковы химические и физические характеристики Al2O3 (нитрат алюминия)? Каковы химические реакции, в которых Al2O3 (оксид алюминия) является продуктом?Вопросы, связанные с продуктом NO2 (двуокись азота)
Каковы химические и физические характеристики NO2 (нитрата алюминия)? Какие химические реакции имеют NO2 (двуокись азота) в качестве продукта?Вопросы, связанные с продуктом O2 (кислород)
Каковы химические и физические характеристики O2 (нитрата алюминия)? Каковы химические реакции, в которых O2 (кислород) является продуктом?Новости Только 5% НАСЕЛЕНИЯ знают
Essentt — Товары, подобранные вручнуюПродукты, подобранные вручную, необходимые при работе из дома!
Уравнения с Al(NO3)3 в качестве реагента
нитрат алюминия
4Al(NO 3 ) 3 → 2Al 2 O 3 + 12NO 2 + 3O 2 3NaOH + Al(NO 3 ) 3 → Al(OH) 3 + 3NaNO 3 3Cu + 4H 2 SO 4 + 2Al(NO 3 ) 3 → Al 2 (SO 4 ) 3 + 2Cu(NO 3 ) 2 + 4H 2 O + NO + CuSO 4 Просмотреть все уравнения с Al(NO3)3 в качестве реагента РекламаУравнения с Al(NO3)3 как произведение
нитрат алюминия
2Al + 3Zn(NO 3 ) 2 → 3Zn + 2Al(NO 3 ) 3 Al + 6HNO 3 → 3H 9002 9 2 O + 3NO 2 + Al(NO 3 ) 3 8Al + 30HNO 3 → 15H 2 O + 3N 2 O + 8Al(NO 3 ) 3 Просмотреть все уравнения с Al(NO3)3 как произведениеУравнения с Al(NO3)3 как произведение
нитрат алюминия 2Al + 3Zn(NO 3 ) 2 → 3Zn + 2Al(NO 3 ) 3 Al + 6HNO 3 → 3H 9002 9 2 O + 3NO 2 + Al(NO 3 ) 3 8Al + 30HNO 3 → 9H 2 O + 3NH 4 NO 3 + 8Al(NO 3 ) 3 Просмотреть все уравнения с Al(NO3)3 как произведениеУравнения с Al(NO3)3 как произведение
нитрат алюминия
2Al + 3Zn(NO 3 ) 2 → 3Zn + 2Al(NO 3 ) 3 Al + 6HNO 3 → 3H 9002 9 2 O + 3NO 2 + Al(NO 3 ) 3 Al 2 O 3 + 6HNO 3 → 3H 2 О + 2Al(НО 3 ) 3 Просмотреть все уравнения с Al(NO3)3 как произведениенитрат алюминия
- Главная
- Результаты для «нитрат алюминия»
| ID | КАС | Имя | Синонимы | Молекулярная формула | Категория |
|---|---|---|---|---|---|
| 1 | 13473-90-0 | Нитрат алюминия | UN1438 AL(NO3)3 HSDB 574 NSC 143017 Нитрат алюминия НИТРАТ АЛЮМИНИЯ НИТРАТ АЛЮМИНИЯ Нитрат алюминия Нитрат de aluminio Тринитрат алюминия НИТРАТ АЛЮМИНИЯ РАСТВОР Азотная кислота, соль алюминия Азотная кислота, соль алюминия Nitrato de aluminio [испанский] Алюминиевая соль триазотной кислоты Азотная кислота, соль алюминия (3+) АЛЮМИНИЙ СТАНДАРТ ICP, AL(NO3)3 Нитрат алюминия [UN1438] [Окислитель] | AlN3O9 | Неорганические вещества; Органические материалы; Металлоорганические соединения; Промышленные/тонкие химикаты |
| 2 | 13473-90-0 | Нитрат алюминия | UN1438 AL(NO3)3 HSDB 574 NSC 143017 Нитрат алюминия НИТРАТ АЛЮМИНИЯ НИТРАТ АЛЮМИНИЯ Нитрат алюминия Нитрат алюминия Тринитрат алюминия НИТРА АЛЮМИНИЯ TE SOLUTION Азотная кислота, соль алюминия Азотная кислота, соль алюминия Nitrato de aluminio [испанский] Алюминиевая соль триазотной кислоты Азотная кислота, алюминиевая (3+) соль АЛЮМИНИЙ СТАНДАРТ ICP, AL(NO3)3 Нитрат алюминия [UN1438] [Окислитель] | AlN3O9 | Неорганические вещества; Органические материалы; Металлоорганические соединения; Промышленные/тонкие химикаты |
| 3 | 7784-27-2 | Алюминий нитрат нонагидрат с низким содержанием ртути | АЛЮМИНИЙ СТАНДАРТ НИТРАТ АЛЮМИНИЯ 9h3O НИТРАТ АЛЮМИНИЯ 9h3O НИТРАТ АЛЮМИНИЯ ГИДРАТНЫЙ НИТРАТ АЛЮМИНИЯ 9-ГИДРАТНЫЙ НИТРАТ АЛЮМИНИЯ НОНАГИДРАТНЫЙ Алюминий нитрат нонагидрат Алюминий нитрат нонагидрат азотная кислота, нонагидрат соли алюминия Нитрат алюминия, нонагидрат с низким содержанием ртути | AlH6NO4 | Алюминий, металл и углерод, соли алюминия, стандартные реагенты, химические реагенты, основные химические вещества, химический синтез класса ACS, высокочистые неорганические реагенты, ката лизис и неорганическая химия |
| 4 | Алюминий азотнокислый основной | Алюминий азотнокислый основной | AlN3O9 | ||
| 5 900 06 | 7784-27-2 | Алюминий нитрат нонагидрат с низким содержанием ртути | АЛЮМИНИЙ СТАНДАРТ АЛЮМИНИЯ НИТРАТ 9h3O АЛЮМИНИЯ НИТРАТ 9h3O АЛЮМИНИЯ НИТРАТ HY DRATED НИТРАТ АЛЮМИНИЯ ВОДНЫЙ НИТРАТ АЛЮМИНИЯ 9-ГИДРАТНЫЙ НИТРАТ АЛЮМИНИЯ НОНАГИДРАТНЫЙ Алюминий нитрат нонагидрат нитрат алюминия нонагидрат азотная кислота, соль алюминия, нонагидрат нитрат алюминия, нонагидрат, с низким содержанием ртути | AlH6NO4 | Алюминий, Металл и С, Соли алюминия, Обычные реагенты, Химические реагенты, Основные химические вещества, Химический синтез класса ACS, Неорганические реагенты высокой чистоты, Катализ и неорганическая химия |
| 6 | A НИТРАТ АЛЮМИНИЯ 60% ВОДНЫЙ РАСТВОР | AlN3O9 | |||
| 7 | НИТРАТ АЛЮМИНИЯ 60% В/В РАСТВОР | AlN3O9 | |||
| 8 | АЛЮМИНИЙ НИТРАТ 2М ВОДНЫЙ РАСТВОР | НИТРАТ АЛЮМИНИЯ 2М ВОДНЫЙ РАСТВОР | AlN3O9 |
| ID | КАС | Название продукта | Описания | |
|---|---|---|---|---|
| 1 | 7784-27-2 | Нитрат алюминия нонагидрат | Wuhan Xiju Biotechnology Co. |

