Гидролиз в химии — что это такое? Примеры и определение
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
Гидролиз солей — это реакция взаимодействия ионов соли с Н+ и ОН− ионами воды, которая ведет к распаду исходного соединения. |
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает в себя часть гидроксида и часть кислоты. За часть гидроксида отвечает катион металла, а за кислоту — анион кислотного остатка.
Например:
сульфат меди CuSO4 состоит из основания Cu(ОН)2 и кислоты H2SO4;
-
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
карбонат натрия Na2CO3 состоит из основания NaOH и кислоты H2CO3.

В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H+ или гидроксильная группа OH− .
Запоминаем!
Важное условие гидролиза — наличие в составе соли слабого иона.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так: XY + HOH = XOH + HY В данном случае: |
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Важно!
В учебном материале и в задачах вместо словосочетания «среда раствора» можно встретить «водородный показатель pH». По сути это одно и то же. В нейтральной среде pH = 7, в кислой среде с избытком положительно заряженных ионов водорода H+ — pH меньше 7, а в щелочной среде с избытком отрицательно заряженных ионов OH− — pH больше 7.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона гидроксида. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+.
Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+.Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Пример:
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4+ связывает ионы воды OH−.
Молекулярное уравнение: NH4NO3 + H2O ↔ NH3 · H
Ионное уравнение: NH4+ + NO3− + HOH ↔ NH4OH + H+ + NO3−
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону.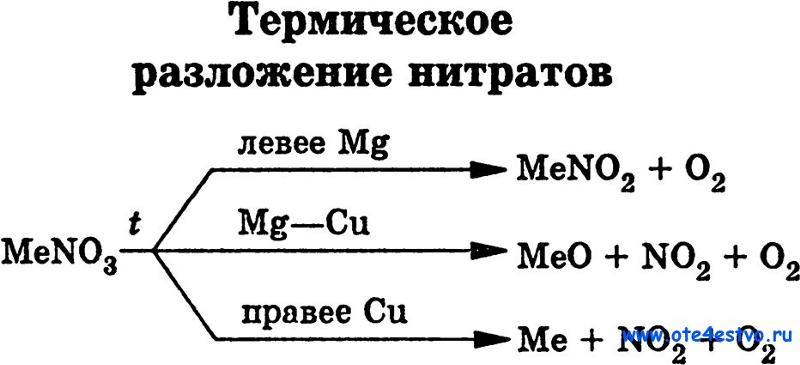 Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H+ в молекуле воды. В итоге получается раствор с повышенным содержанием OH−.
Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H+ в молекуле воды. В итоге получается раствор с повышенным содержанием OH−.
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Пример:
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO 2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2− связывает ионы воды H+.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K+ + NO2− + HOH ↔ HNO2 + K+ + OH−
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH− а анион кислоты связывает ионы H+
Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH− а анион кислоты связывает ионы H+
Среда водного раствора: нейтральная.
Реакция индикаторов: могут не изменить свой цвет.
Пример:
Цианид аммония NH
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4+ + CN− + HOH ↔ NH4OH + HCN
Среда в данном случае будет нейтральной.
Обобщим все эти сведения в таблице гидролиза солей.
Важно!
При взаимодействии гидрофосфатов с водой среда всегда будет щелочной. Дигидрофосфаты, гидросульфиты и гидросульфаты всегда дают кислую среду, независимо от силы основания.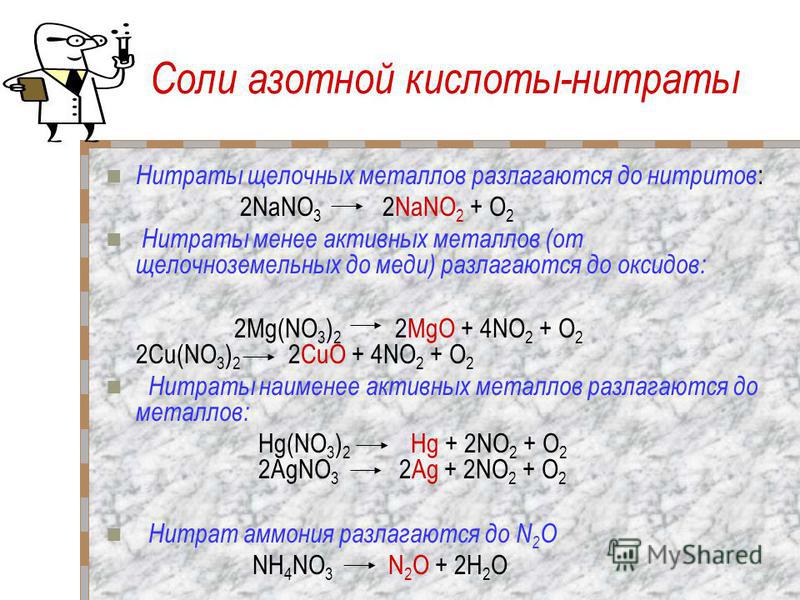 Например, гидросульфит натрия имеет сильное основание и слабую кислоту, исходя из чего можно было бы предположить образование щелочной среды. Но ввиду особенностей диссоциации в водном растворе pH будет меньше 7 (кислая среда).
Например, гидросульфит натрия имеет сильное основание и слабую кислоту, исходя из чего можно было бы предположить образование щелочной среды. Но ввиду особенностей диссоциации в водном растворе pH будет меньше 7 (кислая среда).
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.Как определить количество ступеней:
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: KHCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Важно!
Определить среду водного раствора, получившегося в результате гидролиза кислых солей, бывает непросто. В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Al2S3+ 6H2O= 2AL(OH)3↓ + 3H2S↑
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимый гидролиз имеет место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
CaC2+ 2H2O= Ca(OH)2+ C2H2↑
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h = nгидр/nобщ. h — степень гидролиза, nгидр. — количество гидролизованного вещества, nобщ. — общее количество растворенного в воде вещества. |
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.

Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
29.12.2022
Успех во Всероссийском конкурсе учебных судов
Команда СУНЦ УрФУ впервые в истории Свердловской области приняла участие в финальном этапе XVI Всероссийского конкурса учебных судов.
24.12.2022
Победа в первом региональном турнире учебных судов
Команда СУНЦ УрФУ одержала победу в первом в истории Свердловской области региональном турнире XVI Всероссийского конкурса учебных судов.
23.12.2022
Долгожданная награда
Награду из рук губернатора Свердловской области получил победитель Всероссийской олимпиады по искусственному интеллекту.
23.12.2022
Волейбол. Итоги
Команды СУНЦ успешно выступили на первенстве Кировского района Екатеринбурга.
22.12.2022
Успех на всероссийской олимпиаде
Команды СУНЦ УрФУ успешно выступили на всероссийской олимпиаде по программированию.
21.12.2022
С Новым годом, лицей!
Любимый зимний праздник пришел и в наш СУНЦ!
Больше новостей
Видеогалерея:
Новогодние поздравления (декабрь 2022)
СУНЦ.АРТ (ноябрь 2022)
«Горнозаводской Урал» (октябрь 2022)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.

ТЕРМОУСТОЙЧИВОСТЬ КАРБОНАТОВ И НИТРАТОВ 2-Й ГРУППЫ На этой странице рассматривается влияние тепла на карбонаты и нитраты элементов 2-й группы — бериллия, магния, кальция, стронция и бария. Он описывает и поясняет, как изменяется термическая стабильность соединений по мере продвижения вниз по Группе. Факты Воздействие тепла на карбонаты группы 2 Все карбонаты этой группы подвергаются термическому разложению с образованием оксида металла и газообразного диоксида углерода. Термическое разложение — это термин, обозначающий расщепление соединения при нагревании. Все эти карбонаты представляют собой белые твердые вещества, и образующиеся оксиды также представляют собой белые твердые вещества. Если «X» представляет любой из элементов:
По мере спуска по Группе карбонаты должны нагреваться сильнее, прежде чем они разложатся. Влияние тепла на нитраты группы 2 Все нитраты этой группы подвергаются термическому разложению с образованием оксида металла, диоксида азота и кислорода. Нитраты представляют собой белые твердые вещества, и образующиеся оксиды также представляют собой белые твердые вещества. Вместе с кислородом выделяется бурый газообразный диоксид азота. Нитраты магния и кальция обычно имеют кристаллизационную воду, и твердое вещество может растворяться в собственной кристаллизационной воде с образованием бесцветного раствора до того, как оно начнет разлагаться. Опять же, если «X» представляет любой из элементов: 2X(NO 3 ) 2 (s) 2XO(s) + 4NO 2 (g) + O 2 (g) По мере того, как вы спускаетесь по Группе, нитраты также должны нагреваться сильнее, прежде чем они разложатся. Сводка Как карбонаты, так и нитраты становятся более термически стабильными по мере продвижения вниз по Группе. Пояснения На этой странице предлагается два разных взгляда на проблему. Вам нужно выяснить, что из этого ваши экзаменаторы, скорее всего, ожидают от вас, чтобы вы не ввязывались в более сложные вещи, чем вам на самом деле нужно. Вы должны посмотреть на свой учебный план и прошлые экзаменационные работы — вместе с их схемами оценок | ||||||||||||
Примечание: Если вы готовитесь к экзамену в Великобритании (уровень A или его эквивалент) и у вас нет копий учебного плана и предыдущих работ, перейдите по этой ссылке, чтобы узнать, как их получить. | ||||||||||||
Подробные пояснения даны для карбонатов, потому что диаграммы легче рисовать, а их уравнения также проще. Точно такие же аргументы применимы и к нитратам. Объяснение тенденции с точки зрения поляризующей способности положительного иона Небольшой ион 2+ имеет большой заряд, упакованный в небольшой объем пространства. Более крупный ион 2+ имеет тот же заряд, распределенный по большему объему пространства. Плотность его заряда будет ниже, и он будет вызывать меньше искажений для близлежащих отрицательных ионов. Структура карбонат-иона Если бы вы рассчитали структуру карбонат-иона с помощью «точек и крестиков» или подобного метода, вы, вероятно, получили бы: Здесь показаны две одинарные связи углерод-кислород и одна двойная, причем два атома кислорода несут отрицательный заряд. К сожалению, в реальных карбонатных ионах все связи идентичны, а заряды рассредоточены по всему иону, хотя и сосредоточены на атомах кислорода. Мы говорим, что зарядов делокализованный . Это более сложная версия связи, с которой вы могли столкнуться в бензоле или в ионах, таких как этаноат. | ||||||||||||
Примечание: Если вам интересно, вы можете перейти по этим ссылкам на бензол или органические кислоты. Любая из этих ссылок, вероятно, вовлечет вас в довольно трудоемкий обход! | ||||||||||||
На следующей диаграмме показаны делокализованные электроны. Затенение призвано показать, что больше шансов обнаружить их вокруг атомов кислорода, чем вблизи углерода. Поляризация карбонат-иона А теперь представьте, что произойдет, если этот ион поместить рядом с положительным ионом. Положительный ион притягивает к себе делокализованные электроны карбонат-иона. Карбонат-ион становится поляризованным. При нагревании двуокись углерода высвобождается, оставляя оксид металла. Сколько вам нужно нагреть карбонат, прежде чем это произойдет, зависит от того, насколько поляризован ион. Чем меньше положительный ион, тем выше плотность заряда и тем большее влияние он окажет на ион карбоната. По мере того, как положительные ионы становятся больше по мере продвижения вниз по Группе, они оказывают меньшее влияние на ионы карбоната рядом с ними. Чтобы компенсировать это, вам нужно больше нагревать соединение, чтобы заставить углекислый газ вырваться на свободу и покинуть оксид металла. Другими словами, по мере продвижения вниз по Группе карбонаты становятся более термически устойчивыми. А нитраты? Аргумент здесь точно такой же. Небольшие положительные ионы в верхней части группы поляризуют нитрат-ионы больше, чем более крупные положительные ионы в нижней части. Начертить диаграммы, чтобы показать, как это происходит, гораздо сложнее, потому что в этом процессе участвуют более одного нитрат-иона. От вас не ожидают, что вы попытаетесь нарисовать это на экзамене. Объяснение тенденции с точки зрения энергетики процесса Глядя на изменение энтальпии Если вы подсчитаете изменения энтальпии при разложении различных карбонатов, вы обнаружите, что все изменения являются довольно сильно эндотермическими. Это означает, что реакции, вероятно, должны постоянно нагреваться, чтобы они происходили. | ||||||||||||
Примечание: Если вас не устраивают изменения энтальпии, вы можете изучить раздел энергетики Chemguide или мою книгу по химическим расчетам. | ||||||||||||
Изменения энтальпии (в кДж моль -1 ), рассчитанные мною по изменениям энтальпии образования, приведены в таблице. Цифры для расчета содержания карбоната бериллия отсутствовали. Помните, что реакция, о которой мы говорим, это:
Вы можете видеть, что реакции становятся более эндотермическими по мере продвижения вниз по Группе. Объяснение изменения энтальпии Вот тут-то и начинаются сложности! Если вы не знакомы с циклами закона Гесса (или с циклами Борна-Габера) и с энтальпиями решетки (энергией решетки), вы не поймете следующий момент. Не тратьте время на его просмотр. Использование энтальпийного цикла Вы можете покопаться, чтобы найти основные причины все более эндотермических изменений по мере продвижения вниз по Группе, нарисовав энтальпийный цикл, включающий энтальпии решетки карбонатов и оксидов металлов. Как ни странно, существует два способа определения энтальпии решетки. Чтобы сделать аргумент математически проще, в оставшейся части этой страницы я буду использовать менее распространенную версию (что касается учебных программ уровня A в Великобритании): Энтальпия решетки — это количество тепла, необходимое для расщепления одного моля кристалла в его стандартном состоянии на отдельные газообразные ионы. MgO(т) Mg 2+ (г) + O 2- (г) LE= +3889 кДж моль -1 | ||||||||||||
Примечание: Энтальпия решетки обычно определяется как тепло, выделяющееся при образовании 1 моля кристалла из его газообразных ионов. В этом случае энтальпия решетки для оксида магния будет равна -3889 кДж моль -1 . Используемый здесь термин правильнее было бы назвать «энтальпией диссоциации решетки». | ||||||||||||
Интересующий нас цикл выглядит так: Вы можете применить к этому закон Гесса и найти два маршрута, которые будут иметь одинаковое изменение энтальпии, потому что они начинаются и заканчиваются в одних и тех же местах. По причинам, которые мы вскоре рассмотрим, энтальпии решетки как оксидов, так и карбонатов падают по мере продвижения вниз по Группе. Энтальпия решетки оксида падает быстрее, чем энтальпия карбоната. Если вы внимательно подумаете о том, что происходит со значением общего изменения энтальпии реакции разложения, вы увидите, что оно постепенно становится более положительным по мере продвижения вниз по группе. Объяснение относительного падения энтальпии решетки Величина энтальпии решетки определяется несколькими факторами, одним из которых является расстояние между центрами положительных и отрицательных ионов в решетке. Силы притяжения максимальны, если расстояния между ионами малы. Если притяжения велики, то для разделения ионов придется затратить много энергии — энтальпия решетки будет велика. Энтальпии решетки как карбонатов, так и оксидов падают по мере продвижения вниз по Группе, потому что положительные ионы становятся больше. Межионные расстояния увеличиваются, поэтому притяжение ослабевает.
Энтальпии решетки падают с разной скоростью из-за разных размеров двух отрицательных ионов — оксида и карбоната. Оксидный ион относительно мал для отрицательного иона (0,140 нм), тогда как карбонатный ион велик (рисунка нет). В оксидах при переходе от оксида магния к оксиду кальция, например, межионное расстояние увеличивается с 0,205 нм (0,140 + 0,065) до 0,239 нм (0,140 + 0,099) — увеличение примерно на 17%. В карбонатах межионное расстояние определяется гораздо более крупным карбонатным ионом. Хотя межионное расстояние будет увеличиваться на ту же величину при переходе от карбоната магния к карбонату кальция, в процентах от общего расстояния увеличение будет намного меньше. На некоторых выдуманных фигурках это ясно видно. Я не могу найти значение радиуса карбонат-иона, поэтому не могу использовать реальные цифры. Ради аргумента предположим, что радиус карбонат-иона составляет 0,3 нм. Межионные расстояния в двух случаях, о которых мы говорим, увеличились бы с 0,365 нм до 0,39 нм.9 нм — прирост всего около 9%. Скорость, с которой две энергии решетки падают по мере того, как вы спускаетесь вниз по Группе, зависит от процентного изменения при переходе от одного соединения к другому. Исходя из этого, энтальпии решетки оксидов должны падать быстрее, чем энтальпии карбонатов. А нитраты? Ион нитрата больше, чем ион оксида, поэтому его радиус имеет тенденцию преобладать над межионным расстоянием. Энтальпия решетки оксида снова будет падать быстрее, чем нитрата. если бы вы построили подобный цикл выше по странице, применялись бы те же аргументы.
В меню группы 2 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2002 г. (последнее изменение: декабрь 2021 г.) | ||||||||||||
7.10: Классификация химических реакций — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47512
Цели обучения
- Классифицировать химическую реакцию как синтез, разложение, однократное замещение, двойное замещение или реакцию горения.

- Предсказать продукты простых реакций.
Химические реакции, которые мы описали, являются лишь крошечной выборкой из бесконечного числа возможных химических реакций. Как химики справляются с этим огромным разнообразием? Как они предсказывают, какие соединения будут реагировать друг с другом и какие продукты будут образовываться? Ключ к успеху — найти полезные способы классификации реакций. Знакомство с несколькими основными типами реакций поможет вам предсказать продукты, образующиеся при контакте определенных видов соединений или элементов.
Большинство химических реакций можно разделить на один или несколько из пяти основных типов: кислотно-основные реакции, реакции обмена, реакции конденсации (и наоборот, реакции расщепления) и реакции окисления-восстановления. Общие формы этих пяти видов реакций приведены в таблице \(\PageIndex{1}\) вместе с примерами каждого из них. Однако важно отметить, что многие реакции могут быть отнесены более чем к одной классификации, как вы увидите в нашем обсуждении.
| Название реакции | Общая форма | Примеры |
|---|---|---|
| Окислительно-восстановительный (окислительно-восстановительный) | окислитель + восстановитель → восстановленный окислитель + окисленный восстановитель | C 7 H 16 (л) + 11O 2 (г) → 7CO 2 (г) + 8H 2 O(г) |
| Кислотно-основное | кислота + основание → соль | NaOH(водн.) + HNO 3 (водн.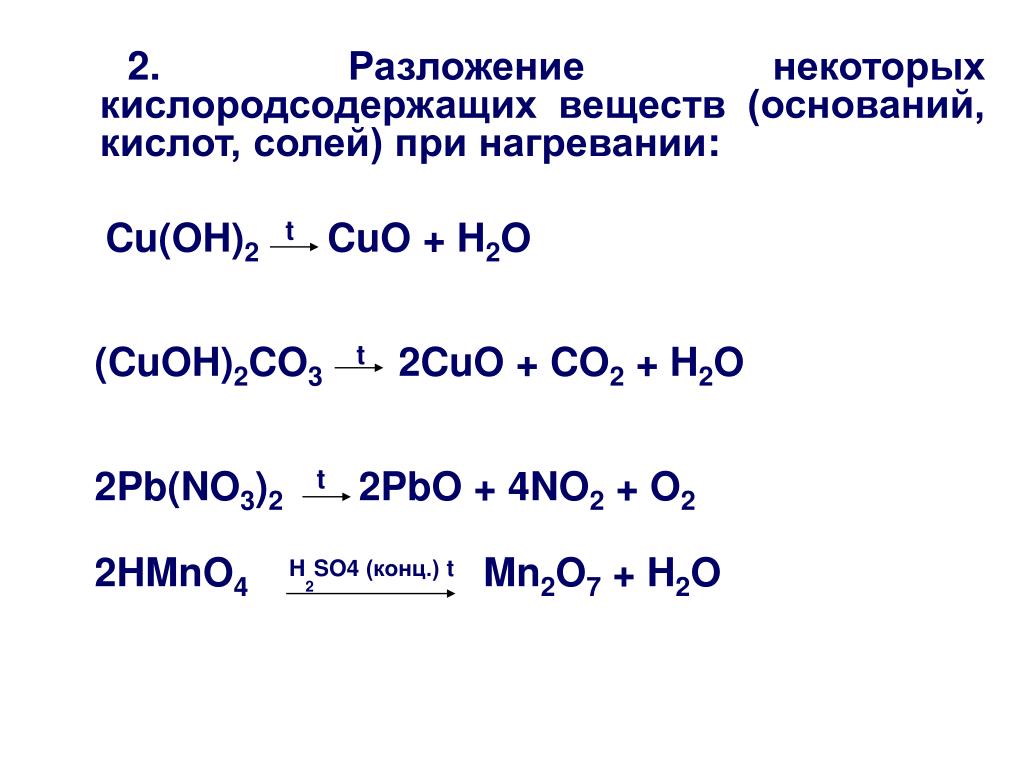 ) → NaNO 3 (водн.) +H 2 O(л) ) → NaNO 3 (водн.) +H 2 O(л) |
| Замена: одиночная замена | АВ + С → АС + В | ZnCl 2 (водн.)+ Mg(тв) → MgCl 2 (водн.)+ Zn(тв) |
| Замена: двойная замена | AB + CD → AD + CB | BaCl 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (тв.) + 2NaCl (водн.) |
| Комбинация (Синтез) | А + В → АВ | CO 2 (г) + H 2 O(ж) → H 2 CO 3 (водн.) № 2 (ж) + 2O 2 (ж)→ 2NO 2 (ж) |
| Разложение | АВ → А + В | CaCO 3 (т) → CaO(т) + CO 2 (г) |
Схема классификации предназначена только для удобства; одну и ту же реакцию можно классифицировать по-разному, в зависимости от того, какая из ее характеристик является наиболее важной. В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит перенос электронов от одного атома к другому, и реакции конденсации. Кислотно-основные реакции — один из видов обменных реакций — образование нерастворимой соли, например сульфата бария, при смешивании растворов двух растворимых солей.
В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит перенос электронов от одного атома к другому, и реакции конденсации. Кислотно-основные реакции — один из видов обменных реакций — образование нерастворимой соли, например сульфата бария, при смешивании растворов двух растворимых солей.
Реакции комбинирования
Реакция комбинирования — это реакция, в которой два или более веществ объединяются с образованием одного нового вещества. Реакции сочетания можно также назвать реакциями синтеза. Общая форма комбинированной реакции:
\[\ce{A} + \ce{B} \rightarrow \ce{AB} \nonumber \]
Одна комбинированная реакция — это соединение двух элементов с образованием соединения. Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\[2 \ce{Na} \left( s \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{NaCl} \left( s \right) \nonumber \]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, существующих в природе в виде двухатомных молекул (\(\ce{H_2}\), \(\ce{N_2}\), \ (\ce{O_2}\), \(\ce{F_2}\), \(\ce{Cl_2}\), \(\ce{Br_2}\) и \(\ce{I_2}\)) .
Одним из часто встречающихся типов комбинированных реакций является реакция элемента с кислородом с образованием оксида. Металлы и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и бурно реагирует при воспламенении, соединяясь с кислородом воздуха с образованием тонкого порошка оксида магния:
\[2 \ce{Mg} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{MgO} \left( s \right) \nonumber \]
Сера реагирует с кислородом с образованием диоксида серы:
\[\ce{S} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow \ce{SO_2} \left( g \right) \nonumber \]
Когда неметаллы реагируют друг с другом, продукт представляет собой молекулярное соединение. Часто неметаллические реагенты могут сочетаться в разных соотношениях и давать разные продукты. Сера также может соединяться с кислородом с образованием триоксида серы:
\[2 \ce{S} \left( s \right) + 3 \ce{O_2} \left( g \right) \rightarrow 2 \ce{SO_3} \left( g \right) \nonumber \]
Переходные металлы способны приобретать множественные положительные заряды в составе своих ионных соединений. Следовательно, большинство переходных металлов способны образовывать различные продукты в реакции соединения. Железо реагирует с кислородом с образованием как оксида железа (II), так и оксида железа (III):
Следовательно, большинство переходных металлов способны образовывать различные продукты в реакции соединения. Железо реагирует с кислородом с образованием как оксида железа (II), так и оксида железа (III):
\[2 \ce{Fe} \left( s \right) + \ce{O_2} \left( g \right) \ стрелка вправо 2 \ce{FeO} \left( s \right) \nonumber \]
\[4 \ce{Fe} \left( s \right) + 3 \ce{O_2} \left( g \right) \rightarrow 2 \ce{Fe_2O_3} \left( s \right) \nonumber \]
Пример \(\PageIndex{1}\): сжигание твердого калия
Калий — очень активный щелочной металл, который необходимо хранить под маслом, чтобы предотвратить его реакцию с воздухом. Напишите сбалансированное химическое уравнение реакции соединения калия с кислородом.
Решение
| Решить. | Каркасное (несбалансированное) уравнение: \[\ce{K} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow \ce{K_2O} \left( s \right) \nonumber \] Тогда уравнение легко уравновешивается коэффициентами. \[4 \ce{K} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{K_2O} \left( s \right) \nonumber \] |
| Подумайте о своем результате. | Формулы верны, и полученная реакция объединения уравновешена. |
Реакции сочетания также могут иметь место, когда элемент реагирует с соединением с образованием нового соединения, состоящего из большего числа атомов. Угарный газ реагирует с кислородом с образованием углекислого газа по уравнению:
\[2 \ce{CO} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{ CO_2} \left( g \right) \nonumber \]
Два соединения также могут реагировать с образованием более сложного соединения. Очень распространенным примером являются реакции оксидов с водой. Оксид кальция легко реагирует с водой с образованием водного раствора гидроксида кальция:
\[\ce{CaO} \left( s \right) + \ce{H_2O} \left( l \right) \rightarrow \ce{Ca (OH)_2} \left( aq \right) \nonumber \]
Газообразный триоксид серы реагирует с водой с образованием серной кислоты. К сожалению, это обычная реакция, происходящая в атмосфере в некоторых местах, где в качестве загрязнителей присутствуют оксиды серы. Кислота, образовавшаяся в результате реакции, выпадает на землю в виде кислотных дождей.
К сожалению, это обычная реакция, происходящая в атмосфере в некоторых местах, где в качестве загрязнителей присутствуют оксиды серы. Кислота, образовавшаяся в результате реакции, выпадает на землю в виде кислотных дождей.
\[\ce{SO_3} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow \ce{H_2SO_4} \left( aq \right) \nonumber \]
Рисунок \ (\PageIndex{1}\): Кислотные дожди имеют серьезные последствия как для естественных, так и для искусственных объектов. Кислотный дождь разрушает мраморные статуи, подобные той, что слева (A). Деревья в лесу справа (B) погибли от кислотных дождей.Упражнение \(\PageIndex{1}\)
- Напишите химическое уравнение синтеза бромида серебра \(\ce{AgBr}\).
- Предскажите продукты следующей реакции: \(\ce{CO_2} \left( g \right) + \ce{H_2O} \left( l \right)\)
- Ответ а:
- \(2 \ce{Ag} + \ce{Br_2} \rightarrow 2 \ce{AgBr}\)
- Ответ б:
- \(\ce{CO_2} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow \ce{H_2CO_3}\)
Реакции разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества. Общая форма реакции разложения:
Общая форма реакции разложения:
\[\ce{AB} \rightarrow \ce{A} + \ce{B} \nonumber \]
Большинство реакций разложения требуют затрат энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на его элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода:
\[2 \ce{HgO} \left( s \right) \rightarrow 2 \ce{Hg} \left( l \ справа) + \ce{O_2} \left( g \right) \nonumber \]
Видео \(\PageIndex{2}\): Оксид ртути (II) представляет собой твердое вещество красного цвета. При нагревании он разлагается на металлическую ртуть и газообразный кислород.
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединениями. Карбонат металла разлагается на оксид металла и углекислый газ. Например, карбонат кальция разлагается на оксид кальция и углекислый газ:
Карбонат металла разлагается на оксид металла и углекислый газ. Например, карбонат кальция разлагается на оксид кальция и углекислый газ:
\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \ влево( г \вправо) \номер\]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды. Гидроксид натрия разлагается с образованием оксида натрия и воды:
\[2 \ce{NaOH} \left( s \right) \rightarrow \ce{Na_2O} \left( s \right) + \ce{H_2O} \left( g \right) \nonumber \]
Некоторые нестабильные кислоты разлагаются с образованием оксидов неметаллов и воды. Углекислота легко разлагается при комнатной температуре на углекислый газ и воду:
\[\ce{H_2CO_3} \left( aq \right) \rightarrow \ce{CO_2} \left( g \right) + \ce{H_2O} \ влево( л \вправо) \номер\]
Пример \(\PageIndex{2}\): Электролиз воды
При пропускании электрического тока через чистую воду она разлагается на составные элементы. Напишите уравнение разложения воды.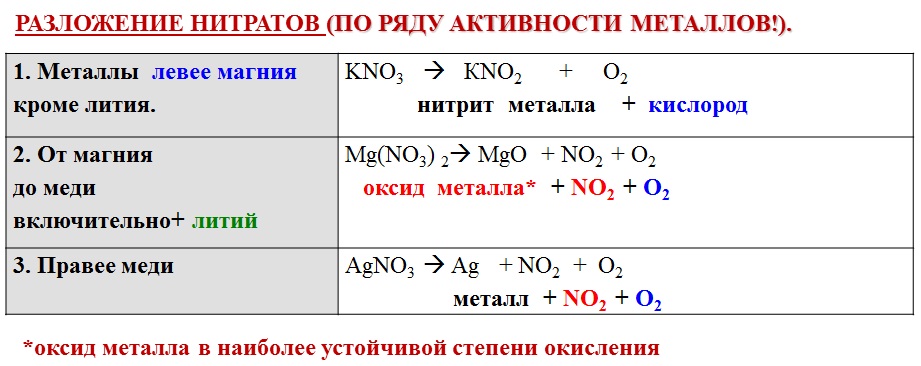
Решение
| Ступени | Пример решения |
|---|---|
| Спланируйте задачу. | Вода представляет собой бинарное соединение, состоящее из водорода и кислорода. Газообразные водород и кислород, образующиеся в результате реакции, представляют собой двухатомные молекулы. |
| Решить. | Каркасное (несбалансированное) уравнение: \[\ce{H_2O} \left( l \right) \overset{\text{elec}}{\rightarrow} \ce{H_2} \left( g \right) + \ce{O_2} \left( g \справа) \номер\] Обратите внимание на аббревиатуру «\(\text{elec}\)» над стрелкой, обозначающую прохождение электрического тока для инициирования реакции. \[2 \ce{H_2O} \left( l \right) \overset{\text{elec}}{\rightarrow} 2 \ce{H_2} \left( g \right) + \ce{O_2} \left ( г \право) \номер\] |
| Подумайте о своем результате. | Произведения являются элементами, и уравнение уравновешено. |
Упражнение \(\PageIndex{2}\)
Напишите химическое уравнение разложения:
- \(\ce{Al_2O_3}\)
- \(\ce{Ag_2S}\)
- Ответить на
- \(2 \ce{Al_2O_3} \rightarrow 4 \ce{Al} + 3 \ce{O_2}\)
- Ответ б
- \(\ce{Ag_2S} \rightarrow 2 \ce{Ag} + \ce{S}\)
Реакции одиночного замещения
Третий тип реакции — это реакция одиночного замещения, в которой один элемент заменяет аналогичный элемент в соединении. Общая форма реакции с одним замещением (также называемой с одним смещением):
\[\ce{A} + \ce{BC} \rightarrow \ce{AC} + \ce{B} \nonumber \]
В этой общей реакции элемент \(\ce{A}\) является металлом и заменяет элемент \(\ce{B}\), также металл, в соединении. Когда замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает вид:
Когда замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает вид:
\[\ce{Y} + \ce{XZ} \rightarrow \ce{XY} + \ce{Z} \nonumber \]
где \(\ce{Y}\) неметалл и заменяет неметалл \(\ce{Z}\) в соединении с \(\ce{X}\).
Замена металла
Магний является более активным металлом, чем медь. Когда полоску металлического магния помещают в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\[\ce{Mg} \left( s \right) + \ce{Cu(NO_3)_2} \left( aq \right) \rightarrow \ce{Mg(NO_3)_2} \left( aq \right ) + \ce{Cu} \left( s \right) \nonumber \]
Эта подкатегория реакций одинарного замещения называется реакцией замещения металла, потому что это замещаемый металл (медь).
Замена водорода
Многие металлы легко реагируют с кислотами, и при этом одним из продуктов реакции является газообразный водород. Цинк реагирует с соляной кислотой с образованием водного раствора хлорида цинка и водорода (рисунок ниже).
Цинк реагирует с соляной кислотой с образованием водного раствора хлорида цинка и водорода (рисунок ниже).
\[\ce{Zn} \left( s \right) + 2 \ce{HCl} \left( aq \right) \rightarrow \ce{ZnCl_2} \left( aq \right) + \ce{H_2} \влево( г \вправо) \номер\]
В реакции замещения водорода водород в кислоте заменяется активным металлом. Некоторые металлы настолько реакционноспособны, что способны заменить водород в воде. Продуктами такой реакции являются гидроксид металла и газообразный водород. Все металлы группы 1 подвергаются этому типу реакции. Натрий энергично реагирует с водой с образованием водного раствора гидроксида натрия и водорода (см. рисунок ниже).
\[2 \ce{Na} \left( s \right) + 2 \ce{H_2O} \left( l \right) \rightarrow 2 \ce{NaOH} \left( aq \right) + \ce{ H_2} \left( g \right) \nonumber \]
Рисунок \(\PageIndex{2}\): (Первое изображение) Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции с одним замещением. (Второе изображение) Металлический натрий энергично реагирует с водой, выделяя газообразный водород.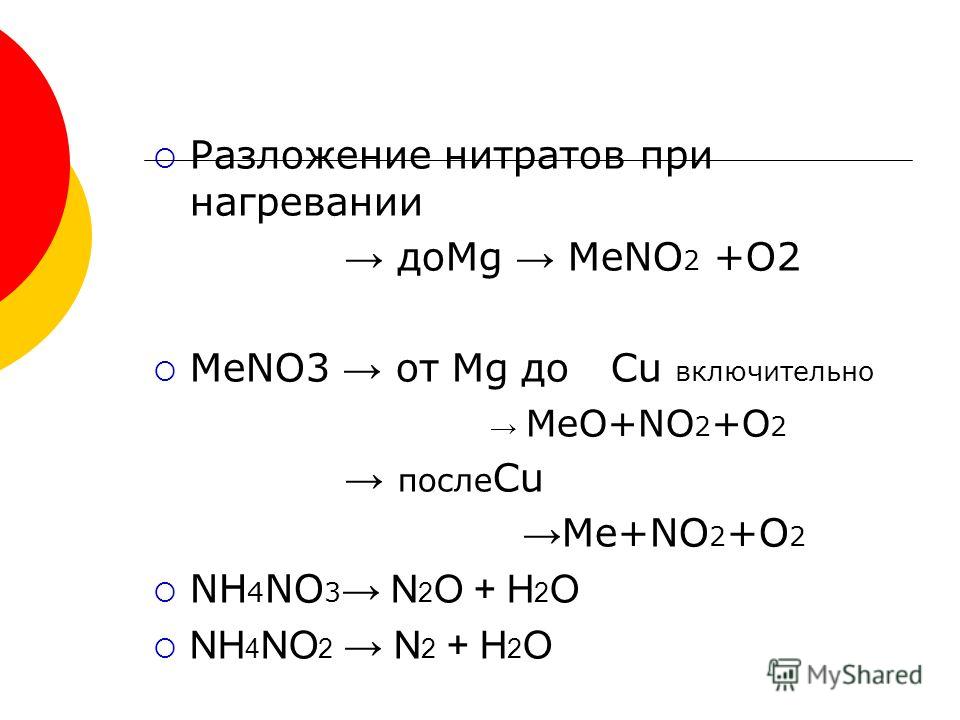 Большой кусок натрия часто выделяет столько тепла, что воспламеняется водород.
Большой кусок натрия часто выделяет столько тепла, что воспламеняется водород.Замена галогена
Элемент хлор реагирует с водным раствором бромида натрия с образованием водного раствора хлорида натрия и элементарного брома:
\[\ce{Cl_2} \left( g \right) + 2 \ce{NaBr} \left ( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{Br_2} \left( l \right) \nonumber \]
Реакционная способность группы галогена (группа 17) уменьшается сверху вниз внутри группы. Фтор является наиболее реакционноспособным галогеном, а йод — наименее. Поскольку хлор выше брома, он более реакционноспособен, чем бром, и может заменить его в реакции замещения галогена.
Пример \(\PageIndex{3}\)
Какие продукты реакции между твердым алюминием (\(\ce{Al}\)) и оксидом железа (III) (\(\ce{Fe_2O_3}\ ))?
Решение
| Ступени | Пример решения |
|---|---|
Спланируйте задачу. | Чтобы предсказать продукты, нам нужно знать, что алюминий заменит железо и образует оксид алюминия (металл заменит ион металла в соединении). Алюминий имеет заряд \(+3\), а кислород имеет заряд \(-2\). Таким образом, соединение, образующееся между алюминием и кислородом, будет \(\ce{Al_2O_3}\). Поскольку железо в соединении заменено алюминием, железо теперь будет единственным элементом в продуктах. |
| Решить. | Неуравновешенное уравнение будет: \[\ce{Al} + \ce{Fe_2O_3} \rightarrow \ce{Al_2O_3} + \ce{Fe} \nonumber \] и сбалансированное уравнение будет: \[2 \ce{Al} + \ce{Fe_2O_3} \rightarrow \ce{Al_2O_3} + 2 \ce{Fe} \nonumber \] |
| Подумайте о своем результате. | Это реакция с одним замещением, и при уравновешивании коэффициенты точно отражают тот факт, что железо и алюминий имеют одинаковый заряд в этой реакции. |
Упражнение \(\PageIndex{3}\)
- Напишите химическое уравнение для простой реакции замещения между твердым цинком и раствором нитрата свинца (II) с образованием раствора нитрата цинка и твердого свинца. (Обратите внимание, что цинк образует ионы с зарядом \(+2\).)
- Предскажите продукты следующей реакции: \(\ce{Fe} + \ce{CuSO_4}\). (Предположим, что в этой реакции железо образует ионы с зарядом \(+2\).)
- Ответ
- \(\ce{Zn} + \ce{Pb(NO_3)_2} \rightarrow \ce{Pb} + \ce{Zn(NO_3)_2}\)
- Ответ б
- \(\ce{Fe} + \ce{CuSO_4} \rightarrow \ce{Cu} + \ce{FeSO_4}\)
Реакции двойного замещения
Реакция двойного замещения — это реакция, в которой положительные и отрицательные ионы двух ионных соединений меняются местами с образованием двух новых соединений. Общая форма реакции двойного замещения (также называемая двойным замещением):
\[\ce{AB} + \ce{CD} \rightarrow \ce{AD} + \ce{BC} \nonumber \]
В этой реакции \(\ce{A}\) и \( \ce{C}\) — положительно заряженные катионы, а \(\ce{B}\) и \(\ce{D}\) — отрицательно заряженные анионы. Реакции двойного замещения обычно происходят между веществами в водном растворе. Чтобы произошла реакция, одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Реакции двойного замещения обычно происходят между веществами в водном растворе. Чтобы произошла реакция, одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Образование осадка
Осадок образуется в реакции двойного замещения, когда катионы одного из реагентов объединяются с анионами другого реагента с образованием нерастворимого ионного соединения. При смешивании водных растворов йодида калия и нитрата свинца (II) протекает следующая реакция: 9-}\) и в результате образуется ярко-желтый осадок (рис. \(\PageIndex{3}\)). Другой продукт реакции, нитрат калия, остается растворимым.
Рисунок \(\PageIndex{3}\): Иодид свинца (II) выпадает в осадок при смешивании йодида калия с нитратом свинца (II) (уравнение \ref{eq10}). (CC BY-SA 3.0; PRHaney).Образование газа
Некоторые реакции двойного замещения производят газообразный продукт, который затем выделяется из раствора пузырьками и улетучивается в воздух. При смешивании растворов сульфида натрия и соляной кислоты продуктами реакции являются водный раствор хлорида натрия и сероводородный газ:
\[\ce{Na_2S} \left(водн. \right) + 2 \ce{HCl} \left( водн. \right) \rightarrow 2 \ce{NaCl} \left( водн. \right) + \ce{H_2S } \left( g \right) \nonumber \]
\right) + 2 \ce{HCl} \left( водн. \right) \rightarrow 2 \ce{NaCl} \left( водн. \right) + \ce{H_2S } \left( g \right) \nonumber \]
Образование молекулярного соединения
Другой тип реакции двойного замещения — это реакция, при которой в качестве одного из продуктов образуется молекулярное соединение. Многие примеры в этой категории представляют собой реакции, в результате которых образуется вода. При взаимодействии водного раствора соляной кислоты с водным раствором гидроксида натрия образуются водный раствор хлорида натрия и вода:
\[\ce{HCl} \left(водн. \right) + \ce{NaOH} \left( водн. \right) \rightarrow \ce{NaCl} \left( водн. \right) + \ce{H_2O} \ left( l \right) \nonumber \]
Пример \(\PageIndex{4}\)
Напишите полное и сбалансированное химическое уравнение для реакции двойной замены \(\ce{NaCN} \left( aq \right ) + \ce{HBr} \left( aq \right) \rightarrow\) (образуется цианистый водород).
Решение
| Этапы | Пример решения |
|---|---|
| Спланируйте задачу. | Производство газа приводит к реакции. |
| Решить. | Катионы обоих реагентов являются заряженными ионами \(+1\), а анионы — заряженными ионами \(-1\). После обмена партнерами сбалансированное уравнение: \[\ce{NaCN} \left( aq \right) + \ce{HBr} \left( aq \right) \rightarrow \ce{NaBr} \left( aq \right) + \ce{HCN} \left ( г \право) \номер\] |
| Подумайте о своем результате. | Это реакция двойной замены. Все формулы верны, уравнение сбалансировано. |
Упражнение \(\PageIndex{4}\)
Напишите полное и сбалансированное химическое уравнение для реакции двойной замены \(\ce{(NH_4)_2SO_4} \left( aq \right) + \ce{ Ba(NO_3)_2} \left( aq \right) \rightarrow\) (образуется осадок сульфата бария).
- Ответить а:
- \[\ce{(NH_4)_2SO_4} \left( aq \right) + \ce{Ba(NO_3)_2} \left( aq \right) \rightarrow 2 \ce{NH_4NO_3} \left( aq \right) + \ce{BaSO_4} \left( s \right) \nonumber \]
Иногда в результате реакции образуется как газ, так и молекулярное соединение. Реакция раствора карбоната натрия с соляной кислотой дает водный раствор хлорида натрия, углекислый газ и воду:
\[\ce{Na_2CO_3} \left(водн. \right) + 2 \ce{HCl} \left( водн. \right) \rightarrow 2 \ce{NaCl} \left( водн. \right) + \ce{CO_2 } \left( g \right) + \ce{H_2O} \left( l \right) \nonumber \]
7.10: Классификация химических реакций распространяется по лицензии CK-12, автором, ремиксом и/или куратором выступили Мариса Альвиар-Агнью и Генри Агнью.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СК-12
- Показать страницу TOC
- нет на странице
- Метки
- автор @ Генри Агнью
- автор@Мариса Альвиар-Агнью
- источник@https://www.



 * 100%
* 100%


 Те, что внизу, должны быть нагреты сильнее, чем те, что наверху, прежде чем они разложатся.
Те, что внизу, должны быть нагреты сильнее, чем те, что наверху, прежде чем они разложатся. Он имеет высокую плотность заряда и будет оказывать заметный искажающий эффект на любые отрицательные ионы, оказавшиеся рядом с ним.
Он имеет высокую плотность заряда и будет оказывать заметный искажающий эффект на любые отрицательные ионы, оказавшиеся рядом с ним.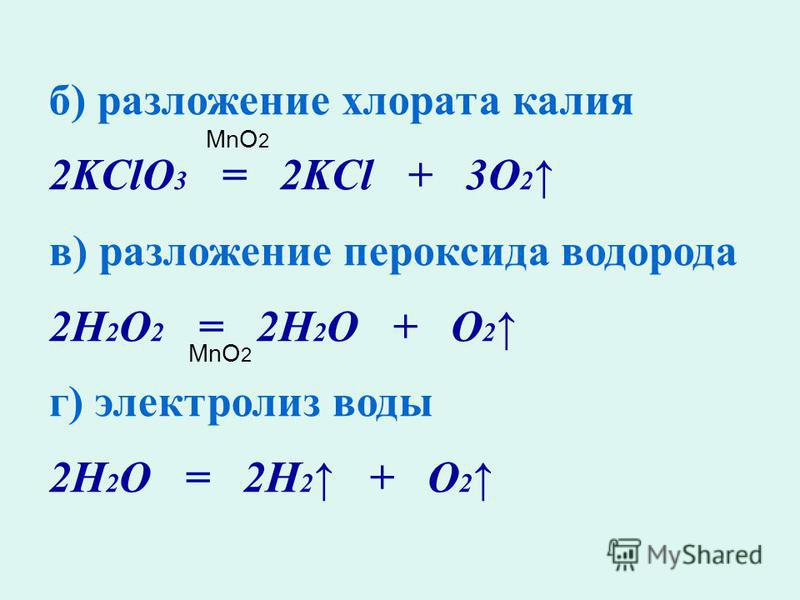 Для целей этой темы вам не нужно понимать, как возникла эта связь.
Для целей этой темы вам не нужно понимать, как возникла эта связь. Если он сильно поляризован, вам нужно меньше тепла, чем если бы он был слабо поляризован.
Если он сильно поляризован, вам нужно меньше тепла, чем если бы он был слабо поляризован.
 Именно этого и следовало ожидать, поскольку карбонаты становятся более термически стабильными. Вы должны поставлять все большее количество тепловой энергии, чтобы заставить их разлагаться.
Именно этого и следовало ожидать, поскольку карбонаты становятся более термически стабильными. Вы должны поставлять все большее количество тепловой энергии, чтобы заставить их разлагаться. Например, для оксида магния это количество тепла, необходимое для осуществления 1 моля этого превращения:
Например, для оксида магния это количество тепла, необходимое для осуществления 1 моля этого превращения: Но они не падают с той же скоростью.
Но они не падают с той же скоростью. 065
065
 Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.
Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.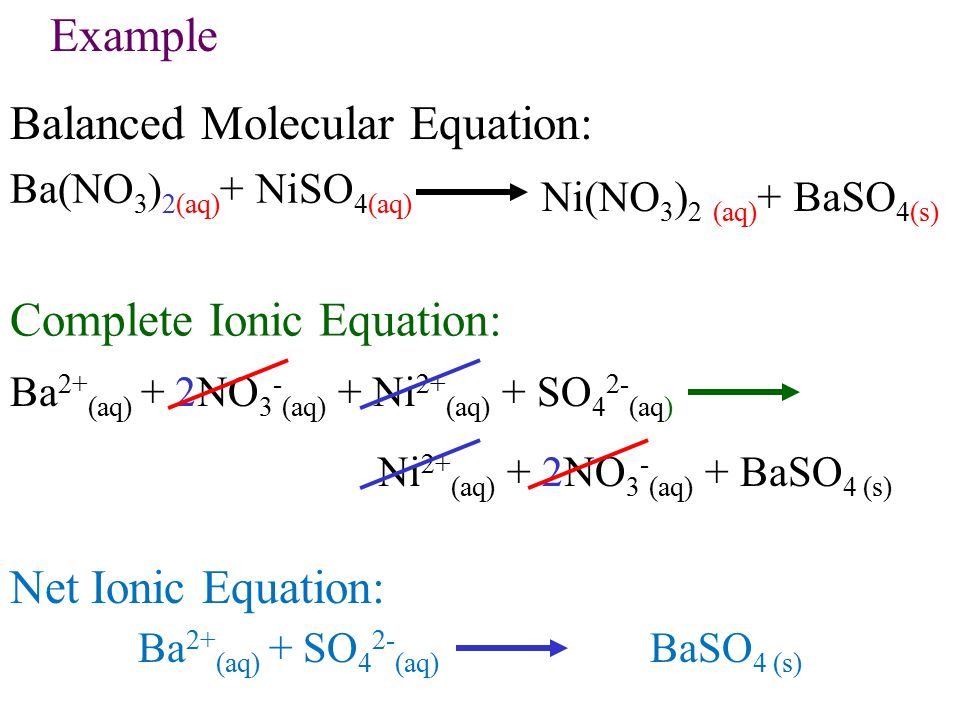

 Сбалансируйте уравнение.
Сбалансируйте уравнение. 10.4
10.4