Растворимость в воде алюминия — Справочник химика 21
Растворимость осадка. Растворимость оксихинолината алюминия в воде чрезвычайно мала. Произведение растворимости составляет [c.184]Безводный хлористый алюминий на воздухе дымит, выделяя небольшие количества хлористого водорода, в очень разбавленных водных растворах он в значительной степени гидролизуется. Растворимость хлористого алюминия в воде при 15 °С составляет 41,13%. Плотность растворов различной концентрации [c.516]
Растворимость хлорида алюминия в воде уменьшается при добавлении НС1. Растворимость при 25° С составляет [761] [c.15]
Гидролиз солей металлов. В большинстве случаев коагулянты представляют собой соли слабых оснований и сильных кислот. При растворении их в воде происходит гидролиз и образуются малорастворимые основания — гидроксиды алюминия или железа.
Растворимость нитрата алюминия при 30° С составляет 81 г соли в 100 г воды. Сколько кристаллогидрата А1 (КОз)з ЭНгО можно растворить при указанной температуре в том же количестве воды [c.73]
Растворимость хлорида алюминия в воде [c.86]
Деформируемые алюминиевые сплавы, упрочняемые термической обработкой, легируются элементами, обладающими ограниченной растворимостью в алюминии в твердом состоянии, уменьшающейся при понижении температуры.
Рис, 3.7. Зависимость растворимости оксида алюминия в воде от pH (по данным [65]). [c.262]
Гидратированные ионы алюминия в процессе гидролиза отдают протон от координированной молекулы воды, образуя последовательно комплексные ионы [А1 (Н2О) 5 (ОН) ] и [Л1 (Н2О)4 (ОН)2] остающиеся в растворе. Когда последний нейтральный комплекс [А1(Н20)з(0Н)з] теряет воду, образуется плохо растворимый гидроксид алюминия.
Изучение влияния анионного и катионного состава минеральных примесей воды на процесс растворения алюминиевого анода и выход алюминия по току показало [70], что в присутствии ионов СГ алюминиевый анод находится в активном состоянии и наряду с электрохимическим растворением алюминия идет процесс его химического растворения. Кроме того, ионы хлора, проявляя себя как специфические депассиваторы, препятствуют образованию кислородного барьера и не пассивируют анод в связи с высокой растворимостью хлорида алюминия. Сульфат- и особенно бикарбонат-ионы в некоторой степени тормозят процесс анодного растворения алюминия и уменьшают активирующее действие СГ-ионов. С целью обеспечения надежной, длительной и бесперебойной работы электролизеров рекомендуется введение в воду до 20% хлористых солей от общего количества анионов (считая в миллиграмм-эквивалентах на 1л).
 Катионный состав минеральных примесей воды на процесс растворения алюминиевого анода значительного влияния не оказывает. [c.155]
Катионный состав минеральных примесей воды на процесс растворения алюминиевого анода значительного влияния не оказывает. [c.155] Сопоставление величины произведения растворимости купфероната циркония (2,35-10 ) и найденного Пятницким [239] произведения растворимости купфероната алюминия (2,3-10″ ) показывает, что легко могут быть найдены условия количественного разделения этих элементов при помощи купферона. Вычисленная по найденному значению произведения растворимости растворимость купфероната циркония в воде составляет (в моль л)
При температуре выше комнатной метиловый спирт реагирует с алюминием, образуя растворимый метилат алюминия [12]. В технически чистом метаноле на поверхности алюминия наблюдается неглубокая точечная коррозия. Добавка воды к безводному чистому метиловому спирту резко снижает его агрессивность. [c.485]
Д. Растворимые ультрафильтры. Исследуемая вода пропускается через растворимый фильтр (алюминий-альгинатное желе), концентрирующий вирусы. Далее фильтр растворяют в 3,8% растворе цитрата натрия и взвесь, содержащую вирусы, засевают в культуру ткани [22]. [c.281]
Далее фильтр растворяют в 3,8% растворе цитрата натрия и взвесь, содержащую вирусы, засевают в культуру ткани [22]. [c.281]
Растворимость сульфата алюминия составляет при 20° С 362 г/л. Этот коагулянт применяется для осветления и обесцвечивания воды. Плотность образующихся хлопьев гидроксида алюминия 2,4. При отсутствии щелочного резерва в воде сульфат алюминия вызывает резкое снижение pH (до 4,5) и вода становится агрессивной по отнощению к железу и бетону. [c.131]
Растворимость сернокислого алюминия в воде составляет 46 56 и 66% при температуре соответственно О, 30 и 50° С. [c.73]
Гидроокись алюминия малорастворима в воде в 1 л растворяется 7,5-10 г-мол гидроокиси алюминия (ПР = 5,1 -10 ). Однако растворимость гидроокиси алюминия в значительной степени зависит от концентрации ионов водорода. [c.109]
Сжатый пропилен конденсируется в конденсаторе 9, охлаждаемом водой. Содержащиеся в пропилене пары воды также конденсируются и, поскольку растворимость воды в жидком пропилене ниже, чем ее содержание в газообразном пропилене, часть воды отделяется и выводится из системы.
Концентрация насыщенного раствора гидроксида алюминия в воде при 20° равна 1,855-Ю моль/л. Чему равно значение произведения растворимости гидроксида алюминия при этой температуре [c.46]
Минимальную растворимость гидроокись алюминия имеет в интервале pH 6,5 — 8, при больших значениях pH гидроокись начинает растворяться, при pH Таким образом, одним из условий успешной коагуляции природной воды является оптимальная величина pH, равная 6,5 — 8 для Al(OH)j для хлорного железа и других железосодержащих коагулянтов величина pH уменьшается.
Количество осушителя, необходимое для обезвоживания определенного объема жидкости, рассчитывают исходя из начального содержания воды в растворителе и влагопоглощающей способности твердого поглотителя. Практически рекомендуется брать осушитель с двух-, а иногда даже трехкратным избытком. Пусть, например, необходимо высушить 1 л товарного диэтилового эфира оксидом алюминия. Поскольку растворимость воды в эфире при 20 °С составляет около 1,2%, а прокаленный оксид алюминия поглощает примерно 20% воды по отношению к своей массе, расчетное количество адсорбента для осушки 1 л эфира составит 60 г. Практически следует взять 120—150 г оксида алюминия, причем разделить это количество на две равные части. С первой порцией эфир встряхивают около часа, после чего его осторожно сливают, добавляют вторую порцию и оставляют над ней на ночь. Эфир после такой обработки будет содержать не более 0,01% (масс.
В разбавленной кислоте растворимость АЬ(804)3 выше, чем в чистой воде, но с дальнейшим увеличением концентрации Нг804 растворимость резко понижается, достигая 1 % в 60 %-ной серной кислоте. В более крепкой кислоте растворимость сульфата алюминия опять повышается. [c.44]
Известно несколько методов понижения адсорбционной активности. Центры адсорбции дезактивировались, например, с помощью паров воды, введенных в газ-носитель [22]. Недостатком этого метода, как общего метода понижения адсорбционной активности носителя, является введение в газ-носитель компонента, который может влиять на распределение анализируемых веществ и работу детектора. Применялась также обильная промывка кислотами и щелочами как метод удаления растворимых окисей алюминия и железа [17] и понижения адсорбционной активности. Более радикальный метод применялся Омеродом и Скоттом [25], [c.167]
То обстоятельство, что алюминиЁ не реагирует с водой и с разбавленными, слабо диссоциирующими кислотами, объясняется образованием чрезвычайно трудно растворимого окисла алюминия, произведение растворимости которого в растворах с низкой концентрацией водородных ионов еще не достигается. Напротив, в щелочах окись алюминия растворима с образованием гидроксоалюминатов (см, стр. 353). [c.385]
Напротив, в щелочах окись алюминия растворима с образованием гидроксоалюминатов (см, стр. 353). [c.385]
Практически важно, что растворимость хлоридов и, в частности, 5сС1з резко понижается в воде, насыщенной НС1, особенно в присутствии эфира. Так как, однако, растворимость хлоридов алюминия и иттрия снижается в таких случаях еще резче, то этим пользуются для отделения скандия от этих элементов.
Джефкотт и Джонстон [38] показали, что растворимость аморфного тонко изме.тьченного кремнезема в воде, которая, как они нашли, была равна 0,017% при 37°, понижалась до 0,003 и до 0,0097%, если к системе была добавлена окись алю.мпния, и меньше, чем до 0,0 001%, если присутствовал порошкообразный алюминий. Так как также было показано, что добавка кремнезема к суспензии глинозема понижает растворимость глинозема, кажется вероятным, что образование очень мало растворимого силиката алюминия на поверхности фаз кремнезема пли глинозема просто препятствует переходу этих окислов в раствор. [c.16]
[c.16]
При образовании алюмосиликатных катализаторов для крекинга нефти высокое содержание алюминия и общая поверхность не существенны важен объем и диаметр пор, так же как общая активная поверхность каталитически активных алюмосиликатных групп. По этой причине часто предпочитают приготовить силикагель, а затем насытить его растворимым соединением алюминия, чтобы образовать активную поверхность, либо смешать золи алюминия и кремнезема, либо дал е гели. В подобных случаях песом-иенно происходит совместное взаимодействие, так как Джефкотт и Джонстон [17] показали, что растворимость глинозема в воде уменьшалась при добавлении порошка кремнезема и, наоборот, потому что в каждом случае твердые фазы покрываются малорастворимым алюмосиликатом. Для достижения оптимальной активности процессов необходим строгий контроль концентрации, времени, температуры, рП промывной воды и условт сушки [18]. Гель катализатора должен также быть прочным против истирания и удара. Марасик [19] и его сотрудники приготовили шариковые катализаторы, пропуская капельки подкисленной смеси алюмини- [c. 179]
179]
Сущность гидролиза соединений алюминия и железа сводится к отрыву протона от гидратированного иона молекулой воды и образованию гидрооксокомплексов. Обязательным условием эффективности действия коагулянтов является полнота их гидролиза с образованием труднорастворимых гидроксидов. Растворимость гидроксида алюминия при 18°С составляет 2,26-10 а гидроксида железа (1П) —2,3-10-5 мг/л. Из приведенных уравнений гидролиза следует, что для увеличения степени гидролиза необходимо связывать образующиеся ионы Н+. Это достигается за счет гидрокарбонат- карбонат- или гидроксид-ионов, присутствующих в обрабатываемой воде (щелочного резерва). [c.125]
При взаимодействии с водой и водными растворами происходит гидролиз минерала, и поэтому определяю-шим фактором, от которого зависит подвижность элемента, является его химическая природа. Максимальной подвижностью обладают щелочи, соединеиия которых наиболее растворимы, затем алюминий и кремний, способные проявлять кислотные свойства. Нет причин предполагать, что тенденция в поведении щелочей изменится в 0,2 н. натровых растворах, для которых не определяли содержания этих элементов. Основные элементы — маг-1П1Й, железо, частично кальций — менее подвижны, так как их гидроокиси труднорастворимы. [c.205]
Нет причин предполагать, что тенденция в поведении щелочей изменится в 0,2 н. натровых растворах, для которых не определяли содержания этих элементов. Основные элементы — маг-1П1Й, железо, частично кальций — менее подвижны, так как их гидроокиси труднорастворимы. [c.205]
Хорошо известна растворимость хлористого алюминия в бензоле, причем растворенное вещество в этом случае существует в виде димерной молекулы [78, 79, 115]. Однако из-за быстрого гидролиза этого соединения в водных растворах эк-стракщюнные исследования не были возможны. Большинство галогенидов металлов не растворяется в органических растворителях. Хлорид железа лишь слабо растворяется в диизопро-пиловом эфире [90], а бромид золота (III), как отмечено в работе [105], вообще не растворяется в эфире в отсутствие воды. Эти галогениды металлов могут экстрагироваться основными растворителями в виде ионных соединений, а именно в виде кислот НМХ4 (см. 6). [c.16]
Жидкий бром является плохим растворителелг. Растворимость воды в броме составляет 0,029″о. Из солей растворимы в броме только бромистый алюминий и в небольшой степени бромное железо РеВг.). Хорошо растворяются в броме галогениды и оксн-галогениды фосфора, мышьяка, сурь.мы и других металлов, а также многие органические вещества. [c.88]
Растворимость воды в броме составляет 0,029″о. Из солей растворимы в броме только бромистый алюминий и в небольшой степени бромное железо РеВг.). Хорошо растворяются в броме галогениды и оксн-галогениды фосфора, мышьяка, сурь.мы и других металлов, а также многие органические вещества. [c.88]
Одной из неполадок, связанных с наличием в системе влаги, является замерзание нерастворенвой воды при дросселировании рабочего тела в регулирующем вентиле. Образовавшиеся частицы льда забивают проходное сечение дроссельных устройств и нарушают нормальную работу установки. Присутствие воды в рабочих телах способствует корразии металлов. Так, водоаммиачный раствор вызывает коррозию цинка, меди и ее сплавов (за исключением фосфористой бронзы) хлористый метил—коррозию цинка, магния и алюминия, хладон-12 — коррозию латуни и сплавов магния, хладон-22 — коррозию сплавов магния. По этим причинам предъявляют высокие требования к содержанию влаги в рабочем теле с ограниченной растворимостью воды, особенно для установок, работающих при низкиХ температурах. [c.126]
[c.126]
Разновидностью электролитической коагуляции является предложенная В. Д. Дмитриевым электрореагентная коагуляция, при которой взаимодействие примесей воды осуществляется под действием электрического поля за счет введения пониженных по сравнению с расчетными дозами химических реагентов. При этом возможно использование растворимых электродов или нерастворимых анодов (графит, ОРТА, ОКТА и других), а также растворимых катодов (алюминий и другие). [c.122]
Фторид алюминия AIF3 существенно отличается от других галогенидов этого металла. Это бесцветное кристаллическое термодинамически устойчивое соединение с преобладанием ионного характера связи. Прочность кристаллической решетки, обусловленная интенсивным электростатическим взаимодействием небольших по размерам ионов А1 + и F, а также большим зарядом катиона, является причиной малой растворимости фторида алюминия в воде. При температуре 1270 °С AIF3 возгоняется, т. е. переходит в газообразное состояние, минуя жидкое. В парах существуют плоские треугольные молекулы AIF3. [c.321]
В парах существуют плоские треугольные молекулы AIF3. [c.321]
Химические свойства алюминия и основные реакции
Нахождение в природе
Алюминий впервые получен химическим путем немецким химиком Ф. Велером в 1827 г., а в 1856 г. французский химик Сен-Клер Девиль выделил его электрохимическим методом.
Алюминий является самым распространенным в природе металлом. Содержание его в земной коре составляет 7,45% (по массе). Важнейшие природные соединения алюминия — алюмосиликаты, боксит, корунд и криолит.
Алюмосиликаты составляют основную массу земной коры. Продукт их выветривания — глина и полевые шпаты (ортоклаз, альбит, анортит). Основной состав глин (каолин) соответствует формуле Аl2O3•2SiO2•2Н2O.
Боксит — горная порода, из которой получают алюминий. Состоит главным образом из гидратов оксида алюминия Аl2O3•nН2O.
Физические свойства
Физические свойства алюминия хорошо изучены. Это — серебристо-белый легкий металл, плавящийся при 660°С. Он очень пластичен, легко вытягивается в проволоку и раскатывается в листы. Из алюминия можно изготовить фольгу толщиной менее 0,01мм. Алюминий обладает очень большой тепло- и электропроводностью. Сплавы алюминия с различными металлами обладают большой прочностью и легкостью.
Это — серебристо-белый легкий металл, плавящийся при 660°С. Он очень пластичен, легко вытягивается в проволоку и раскатывается в листы. Из алюминия можно изготовить фольгу толщиной менее 0,01мм. Алюминий обладает очень большой тепло- и электропроводностью. Сплавы алюминия с различными металлами обладают большой прочностью и легкостью.
Химические свойства
Алюминий очень активный металл. В ряду напряжений он стоит после щелочных и щелочноземельных металлов. Однако на воздухе он довольно устойчив, так как его поверхность покрывается очень плотной пленкой оксида, предохраняющей его от дальнейшего контакта с воздухом. Если с алюминиевой проволоки снять защитную оксидную пленку, то алюминий начнет энергично взаимодействовать с кислородом и водяными парами воздуха, превращаясь в рыхлую массу гидроксида алюминия. Эта реакция сопровождается выделением тепла. Очищенный от защитной оксидной пленки алюминий взаимодействует с водой с выделением водорода:
2Аl + 6Н2O = 2Аl(OН)3 + 3H2↑
Алюминий хорошо растворим в разбавленных серной и соляной кислотах:
2Al + 6НС1= 2AlС13 + 3H2↑
2AI + 3H2SO4 = Al2(SO4)3 + 3H2↑
Разбавленная азотная кислота на холоду пассивирует алюминий, но при нагревании алюминий растворяется в ней с выделением монооксида азота, гемиоксида азота, свободного азота или аммиака, например:
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O + 15Н2O
Концентрированная азотная кислота пассивирует алюминий.
Так как оксид и гидроксид алюминия обладают амфотерными свойствами, то алюминий легко растворяется в водных растворах всех щелочей, кроме гидроксида аммония:
2AI + 6NaOH + 6Н2O = 2Na3[A1ОН)6] + 3H2↑
Порошкообразный алюминий легко взаимодействует с галогенами, кислородом и всеми неметаллами. Для начала реакций необходимо нагревание. В дальнейшем реакции протекают очень интенсивно и сопровождаются выделением большого количества тепла:
2Al + 3Вr2 — 2AlBr3 (бромид алюминия)
4Al + 3O2 = 2Al2O3 (оксид алюминия)
2Al + 3S = A12S3 (сульфид алюминия)
2Al + N2 = 2A1N (нитрид алюминия)
4Al + ЗС = Al4С3 (карбид алюминия).
Сульфид алюминия может существовать только в твердом виде. В водных растворах он подвергается полному гидролизу с образованием гидроксида алюминия и сероводорода:
A12S3 + 6H2O = 2A1(OН)3 + 3H2S.
Алюминий легко отнимает кислород и галогены у оксидов и солей других металлов. Реакция сопровождается выделением большого количества тепла:
8Al + 3Fe3O4 = 9Fe + 4Al2O3
Процесс восстановления металлов из их оксидов алюминием называется алюмотермией. Алюмотермией пользуются при получении некоторых редких металлов, которые образуют прочную связь с кислородом (ниобий, тантал, молибден, вольфрам и др.).
Смесь мелкого порошка алюминия и магнитного железняка называется термитом. После поджигания термита с помощью специального запала реакция протекает самопроизвольно и температура смеси повышается до 3500°С. Железо при такой температуре находится в расплавленном состоянии. Эту реакцию используют для сваривания рельсов.
Получение
Впервые алюминий был получен восстановлением хлорида алюминия металлическим натрием:
AlС13 + 3Na = Al + 3NaCl
В настоящее время его получают электролизом расплавленных солей. В качестве электролита служит расплав, содержащий 85— 90% комплексной соли 3NaF • A1F3 (или Na3AlFe) — криолита и 10–15% оксида алюминия Al2O3 — глинозема. Такая смесь плавится при температуре около 1000°С. При растворении в расплавленном криолите глинозем ведет себя как соль алюминия и алюминиевой кислоты и диссоциирует на катионы алюминия и анионы кислотного остатка алюминиевой кислоты:
В качестве электролита служит расплав, содержащий 85— 90% комплексной соли 3NaF • A1F3 (или Na3AlFe) — криолита и 10–15% оксида алюминия Al2O3 — глинозема. Такая смесь плавится при температуре около 1000°С. При растворении в расплавленном криолите глинозем ведет себя как соль алюминия и алюминиевой кислоты и диссоциирует на катионы алюминия и анионы кислотного остатка алюминиевой кислоты:
Al2O3 ⇔ Al3+ + АlO33−
Криолит диссоциирует:
Na3 [AlF6]⇔ 3Na+ + [A1F6]
При пропускании электрического тока катионы алюминия и натрия движутся к катоду — графитовому корпусу ванны, покрытому на дне слоем расплавленного алюминия, получаемого в процессе электролиза. Так как алюминий менее активен, чем натрий, то он восстанавливается в первую очередь. Восстановленный алюминий в расплавленном состоянии собирается на дне ванны, откуда его периодически выводят.
Анионы AlO33− и A1F63− движутся к аноду — графитовым стержням или болванкам. На аноде в первую очередь разряжается анион AlO33−:
AlO33− — 12е = 2Al2O3 + 3O2
Оксид алюминия вновь диссоциирует, и процесс повторяется. Расход глинозема все время восполняется. Количество криолита практически не меняется. Незначительные потери криолита происходят вследствие образования на аноде тетрафторида углерода CF4 . Электролитическое производство алюминия требует больших затрат электроэнергии (на получение 1 т алюминия расходуется около 20 тыс. квт • ч электроэнергии), поэтому алюминиевые заводы строят вблизи электростанций.
Применение
Алюминий находит самое широкое применение. Он используется в электротехнике, его сплавы, отличаясь большой легкостью и прочностью, применяются в самолето- и машиностроении, он все больше вытесняет стали в производстве теплообменных аппаратов, из него изготовляют фольгу, применяемую в радиотехнике и для упаковки пищевых продуктов. Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000° С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида аммония (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание°С, не подвергаясь коррозии.
Алюминием покрывают стальные и чугунные изделия в целях предохранения их от коррозии: изделия нагревают до 1000° С в смеси алюминиевого порошка (49%), оксида алюминия (49%) и хлорида аммония (2%). Этот процесс называется алитированием. Алитированные изделия выдерживают нагревание°С, не подвергаясь коррозии.
Оксид алюминия Al
2O3 Представляет собой белое вещество, обладающее высокой температурой плавления (2050°С). В природе оксид алюминия встречается в виде корунда и глинозема. Иногда встречаются прозрачные кристаллы корунда красивой формы и окраски. Корунд, окрашенный соединениями хрома в красный цвет, называют рубином, а окрашенный соединениями титана и железа в синий цвет — сапфиром. Рубин и сапфир являются драгоценными
камнями. В настоящее время их довольно легко получают искусственно.
Оксид алюминия обладает амфотерными свойствами, но он не растворяется в воде, кислотах и щелочах. При кипячении оксида алюминия в концентрированном растворе щелочи он частично переходит в раствор. Оксид алюминия переводят в растворимое состояние сплавлением со щелочами или с пиросульфатом калия:
Оксид алюминия переводят в растворимое состояние сплавлением со щелочами или с пиросульфатом калия:
Al2O3 + 2NaOH = 2NaA1O2 + Н2O
Al2O3 + 3K2S2O7 = Al2(SO4)3 + 3K2SO4.
Полученные сплавы растворяются в воде. При сплавлении оксида алюминия с поташом или содой образуются алюминаты, которые легко растворяются в воде:
Al2O3 + Na2CO3 = 2NaA1O2 + CO2,
Природный корунд — очень твердое вещество. Он применяется для изготовления наждачных кругов и шлифовальных порошков. Рубин используют для изготовления втулок часовых и других точных механизмов.
Глинозем используется как сырье для получения алюминия. Обезвоженный оксид алюминия применяется как адсорбент при очистке и разделении органических веществ методом хроматографии.
Гидроксид алюминия Al (ОН)
3Представляет собой белое вещество, которое при нагревании теряет воду, превращаясь оксид алюминия. Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
Гидроксид алюминия обладает амфотерными свойствами. Свежеосажденный гидроксид легко растворяется в кислотах и щелочах (кроме гидроксида аммония):
Al(ОН)3 + ЗНС1 = AlС13 + ЗН2O
Al(ОН)3 + 3NaOH= Na3 [Al(OH)6].
Гидроксид алюминия является слабым основанием и еще более слабой кислотой, поэтому соли алюминия находятся в растворе только в присутствии избытка кислоты, а алюминаты — только в присутствии избытка щелочи. При разбавлении растворов водой эти соединения сильно гидролизуют.
Высушенный гидроксид алюминия теряет часть воды, не растворяется ни в кислотах, ни в щелочах и этим напоминает оксид алюминия.
Гидроксид алюминия обладает свойством поглощать различные вещества, поэтому его применяют при очистке воды.
ICSC 0373 — ГИДРОКСИД АЛЮМИНИЯ
ICSC 0373 — ГИДРОКСИД АЛЮМИНИЯ| ГИДРОКСИД АЛЮМИНИЯ | ICSC: 0373 (Март 1998) |
| CAS #: 21645-51-2 |
| EINECS #: 244-492-7 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Применять местную вытяжку. | Свежий воздух, покой. | |
| Кожа | Защитные перчатки. | Промыть кожу большим количеством воды или принять душ. | |
| Глаза | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
|
| Проглатывание | Прополоскать рот. Отдых. | ||
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Смести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ГИДРОКСИД АЛЮМИНИЯ | ICSC: 0373 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: AlH3O3 / Al(OH)3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
TLV: (вдыхаемая фракция): 1 mg/m3, как TWA; A4 (не классифицируется как канцероген для человека). MAK: (ингаляционная фракция): 4 mg/m3; (вдыхаемая фракция): 1.5 mg/m3; группа риска для беременности: D |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Приведена кажущаяся точка плавления, обусловленная потерей кристаллической воды.
|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Лед и в пламя: «горящий» в холодной воде металл обогреет Арктику | Статьи
Российские ученые предложили безопасный и экологичный метод добычи тепла и энергии в условиях Арктики. Физики выяснили, что при окислении порошка магния и алюминия в смеси ледяной воды и особого солевого раствора выделяется водород. Этот элемент можно сжигать, получая огромное количество энергии для обогрева помещений или выработки электричества.
Холодное тепло
Одна из главных проблем арктического региона — тепло- и электроснабжение. Чаще всего для добычи электроэнергии здесь используют дизельное топливо, однако это крайне негативно влияет на экологию региона.
Ученые из Объединенного института высоких температур (ОИВТ) РАН предлагают использовать в качестве арктического топлива химически активные элементы — магний и алюминий. Ранее их реакционные свойства при низких температурах практически не исследовали. Физики впервые изучили возможности окисления данных металлов в водных растворах при низких температурах, которые держатся в Арктической зоне России минимум полгода.
Чтобы вода не замерзала, в нее добавляли различные соли — хлориды натрия, калия, магния, кальция, алюминия и другие. Чем больше концентрация соли, тем меньше температура замерзания водного раствора. При химической реакции окисления магния и алюминия в таком растворе выделяется тепло и образовывается водород. При исследованиях самая низкая полученная температура водного раствора составила минус 40°C. Снижать ее больше не имело смысла, так как дальнейший процесс уменьшил бы скорость реакции окисления. Следовательно, магний стал бы отдавать энергию крайне долго.
Снижать ее больше не имело смысла, так как дальнейший процесс уменьшил бы скорость реакции окисления. Следовательно, магний стал бы отдавать энергию крайне долго.
— Металлы запасают в себе энергию, по удельным характеристикам сопоставимую с традиционным углеводородным топливом, — пояснил заведующий лабораторией энергоаккумулирующих веществ ОИВТ РАН Михаил Власкин. — Но при сжигании металлов в атмосферу не попадают вредные выбросы и парниковые газы. Ведь продукт окисления — оксид металла, твердое вещество, которое не представляет вреда здоровью человека. Оно может быть возвращено обратно в цикл производства или использовано на месте в качестве строительного материала или в других более высокотехнологичных приложениях.
В ходе экспериментов ученые определили наиболее перспективные с точки зрения энергоэффективности композиции. Оказалось, что быстрее всего порошок магния окисляется в водных солевых растворах магния и алюминия. Ускорить реакцию помогло добавление к магнию таких металлов, как никель и галлий.
Просто добавь воды
Выделяющийся в ходе реакции водород используют для получения тепла или электроэнергии. Причем продукт сжигания водорода — вода без выделения каких-либо газов, то есть вредных выбросов в атмосферу нет.
Таким образом, для создания экологически безопасных систем тепло- и электроснабжения на севере достаточно будет порошка магния или алюминия, солевого раствора и устройства, преобразующего энергию водорода. Доставить эти материалы в отдаленные регионы проще, чем жидкое топливо.
— Это классическая химическая реакция: когда металл растворяется (реагирует с водой), выделяется водород, — напомнил заведующий лабораторией литий-ионных источников тока МФТИ Дмитрий Семененко. — Ее широко используют на практике, например в качестве способа хранения водорода для топливных элементов (устройство, вырабатывающее постоянный ток путем химической реакции, в данном случае с водородом. — «Известия»). Но для выделения водорода обычно используют сложные сплавы — чистые металлы не реагируют с водой, потому что у них есть поверхностный оксидный слой. В данном случае разработчики добились результата довольно простым способом, понизив температуру и добавив в раствор соли особого состава для ускорения реакции. В подобных условиях процесс взаимодействия магния и алюминия с водой проходит эффективно. Это сравнительно простой и дешевый способ получения водорода. Данная технология вполне может стать востребованной в удаленных регионах страны.
В данном случае разработчики добились результата довольно простым способом, понизив температуру и добавив в раствор соли особого состава для ускорения реакции. В подобных условиях процесс взаимодействия магния и алюминия с водой проходит эффективно. Это сравнительно простой и дешевый способ получения водорода. Данная технология вполне может стать востребованной в удаленных регионах страны.
По словам эксперта, сейчас в Арктической зоне всё чаще используют cистемы с возобновляемыми источниками энергии. Ведь в условиях сурового севера завозное топливо часто бывает недоступно.
— Думаю, данная разработка позволяет создать недорогой и эффективный способ получения электроэнергии, — подчеркнул Дмитрий Семененко.
По словам доцента кафедры теоретических основ теплотехники им. М.П. Вукаловича НИУ «МЭИ» Кирилла Кузнецова, достоинством метода является то, что он не требует повышенных температур. Его применение может быть актуальным в холодных и труднодоступных районах России. Правда, следует учесть, что получение алюминия и магния тоже требует затрат электроэнергии. В итоге, как подчеркнул эксперт, эти затраты могут перевесить пользу от использования экологически чистого водорода. Однако работа, по его мнению, несомненно вносит вклад в развитие нового направления в энергетике.
В итоге, как подчеркнул эксперт, эти затраты могут перевесить пользу от использования экологически чистого водорода. Однако работа, по его мнению, несомненно вносит вклад в развитие нового направления в энергетике.
В дальнейшем ученые планируют создать двигатель для производства электрической энергии или тяги на основе принципов окисления металла при минусовых температурах.
ЧИТАЙТЕ ТАКЖЕ
Коррозия алюминия
Коррозия алюминия – разрушение металла под влиянием окружающей среды.
Для реакции Al3+ +3e → Al стандартный электродный потенциал алюминия составляет -1,66 В.
Температура плавления алюминия — 660 °C.
Плотность алюминия — 2,6989 г/см3 (при нормальных условиях).
Алюминий, хоть и является активным металлом, отличается достаточно хорошими коррозионными свойствами. Это можно объяснить способностью пассивироваться во многих агрессивных средах.
Коррозионная стойкость алюминия зависит от многих факторов: чистоты металла, коррозионной среды, концентрации агрессивных примесей в среде, температуры и т. д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
д. Сильное влияние оказывает рН растворов. Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка.
При нагревании алюминий может реагировать с некоторыми неметаллами:
2Al + N2 → 2AlN – взаимодействие алюминия и азота с образованием нитрида алюминия;
4Al + 3С → Al4С3 – реакция взаимодействия алюминия с углеродом с образованием карбида алюминия;
2Al + 3S → Al2S3 – взаимодействие алюминия и серы с образованием сульфида алюминия.
Коррозия алюминия на воздухе (атмосферная коррозия алюминия)
Алюминий при взаимодействии с воздухом переходит в пассивное состояние. При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
При соприкосновении чистого металла с воздухом на поверхности алюминия мгновенно появляется тонкая защитная пленка оксида алюминия. Далее рост пленки замедляется. Формула оксида алюминия – Al2O3 либо Al2O3•H2O.
Реакция взаимодействия алюминия с кислородом:
4Al + 3O2 → 2Al2O3.
Толщина этой оксидной пленки составляет от 5 до 100 нм (в зависимости от условий эксплуатации). Оксид алюминия обладает хорошим сцеплением с поверхностью, удовлетворяет условию сплошности оксидных пленок. При хранении на складе, толщина оксида алюминия на поверхности металла составляет около 0,01 – 0,02 мкм. При взаимодействии с сухим кислородом – 0,02 – 0,04 мкм. При термической обработке алюминия толщина оксидной пленки может достигать 0,1 мкм.
Алюминий достаточно стоек как на чистом сельском воздухе, так и находясь в промышленной атмосфере (содержащей пары серы, сероводород, газообразный аммиак, сухой хлороводород и т. п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
п.). Т.к. на коррозию алюминия в газовых средах не оказывают никакого влияния сернистые соединения – его применяют для изготовления установок переработки сернистой нефти, аппаратов вулканизации каучука.
Коррозия алюминия в воде
Коррозия алюминия почти не наблюдается при взаимодействии с чистой пресной, дистиллированной водой. Повышение температуры до 180 °С особого воздействия не оказывает. Горячий водяной пар на коррозию алюминия влияния также не оказывает. Если в воду, даже при комнатной температуре, добавить немного щелочи – скорость коррозии алюминия в такой среде немного увеличится.
Взаимодействие чистого алюминия (не покрытого оксидной пленкой) с водой можно описать при помощи уравнения реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2↑.
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям. Для эксплуатации алюминия в морской воде в его состав вводят небольшое количество магния и кремния. Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Коррозионная стойкость алюминия и его сплавов, при воздействии морской воды, значительно снижается, если в состав метала будет входить медь.
Коррозия алюминия в кислотах
С повышением чистоты алюминия его стойкость в кислотах увеличивается.
Коррозия алюминия в серной кислоте
Для алюминия и его сплавов очень опасна серная кислота (обладает окислительными свойствами) средних концентраций. Реакция с разбавленной серной кислотой описывается уравнением:
2Al + 3H2SO4(разб) → Al2(SO4)3 + 3H2↑.
Концентрированная холодная серная кислота не оказывает никакого влияния. А при нагревании алюминий корродирует:
2Al + 6H2SO4(конц) → Al2(SO4)3 + 3SO2↑ + 6H2O.
При этом образуется растворимая соль – сульфат алюминия.
Al стоек в олеуме (дымящая серная кислота) при температурах до 200 °С. Благодаря этому его используют для производства хлорсульфоновой кислоты (HSO3Cl) и олеума.
Коррозия алюминия в соляной кислоте
В соляной кислоте алюминий или его сплавы быстро растворяются (особенно при повышении температуры). Уравнение коррозии:
2Al + 6HCl → 2AlCl3 + 3H2↑.
Аналогично действуют растворы бромистоводородной (HBr), плавиковой (HF) кислот.
Коррозия алюминия в азотной кислоте
Концентрированный раствор азотной кислоты отличается высокими окислительными свойствами. Алюминий в азотной кислоте при нормальной температуре исключительно стоек (стойкость выше, чем у нержавеющей стали 12Х18Н9). Его даже используют для производства концентрированной азотной кислоты методом прямого синтеза
При нагревании коррозия алюминия в азотной кислоте проходит по реакции:
Al + 6HNO3(конц) → Al(NO3)3 + 3NO2↑ + 3H2O.
Коррозия алюминия в уксусной кислоте
Алюминий обладает достаточно высокой стойкостью к воздействию уксусной кислоты любых концентраций, но только если температура не превышает 65 °С. Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
Его используют для производства формальдегида и уксусной к-ты. При более высоких температурах алюминий растворяется (исключение составляют концентрации кислоты 98 – 99,8%).
В бромовой, слабых растворах хромовой (до10%), фосфорной (до 1%) кислотах при комнатной температуре алюминий устойчив.
Слабое влияние на алюминий и его сплавы оказывают лимонная, масляная, яблочная, винная, пропионовая кислоты, вино, фруктовые соки.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2(NaOH•H2O) + 2Al → 2NaAlO2 + 3H2↑.
Образуются алюминаты.
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.
Растворение — алюминий — Большая Энциклопедия Нефти и Газа, статья, страница 2
Растворение — алюминий
Cтраница 2
Скорость растворения алюминия уменьшается с увеличением содержания никеля в твердом растворе. Известно [21], что из соединения NiAl алюминий нельзя перевести в раствор даже при помощи горячего КОН. Хотя порошок сплава тонко размолот, но он спрессован и спечен с опорным скелетом из порошка карбонильного никеля, поэтому при низких температурах нельзя ожидать быстрого и полного растворения алюминия. [16]
Результаты растворения алюминия в растворе NaOH показаны на фиг. [17]
После окончательного растворения алюминия массу нагревают до 70 — 100 С, а затем охлаждают, промывают водой до нейтральной реакции, а потом спиртом.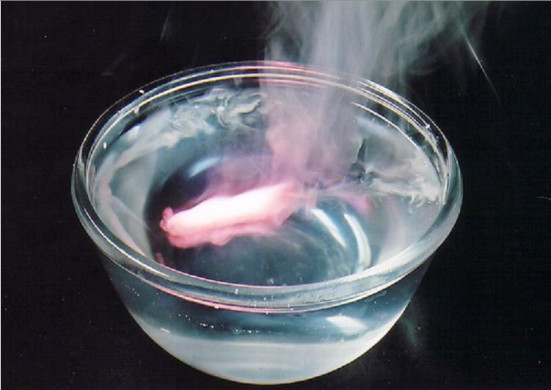 Никель, нерастворимый в щелочи, остается в виде мелкодисперсного тяжелого порошка. Полученный катализатор содержит небольшое количество алюминия, который оказывает влияние на его активность Полное удаление алюминия приводит к дезактивации катализатора Никель Ренея хранят под слоем спирта из-за его высокой пнрофорности По методу Ренея получают также скелетные кобальтовые, железные и медные катализаторы, но они применяются гораздо реже.
[18]
Никель, нерастворимый в щелочи, остается в виде мелкодисперсного тяжелого порошка. Полученный катализатор содержит небольшое количество алюминия, который оказывает влияние на его активность Полное удаление алюминия приводит к дезактивации катализатора Никель Ренея хранят под слоем спирта из-за его высокой пнрофорности По методу Ренея получают также скелетные кобальтовые, железные и медные катализаторы, но они применяются гораздо реже.
[18]
При растворении алюминия в соляной кислоте получают ок-сихлорид алюминия высокой чистоты. [19]
При растворении алюминия и цинка в реактиве осадок не образуется. [20]
При растворении алюминия в минеральных кислотах образуются соли. К действию таких органических кислот, как разбавленные уксусная и лимонная кислоты, алюминий устойчив на холоду, но не при нагревании. В концентрированной уксусной кислоте он растворяется. Даже раствор хлорида натрия медленно действует на него; поэтому алюминий можно использовать для изготовления лишь определенной кухонной посуды. Алюминий весьма устойчив только по отношению к разбавленной и концентрированной азотной кислоте. Поэтому для хранения и транспортировки этой кислоты используются емкости и цистерны из алюминия. При нагревании до кипения азотная кислота может, однако, внезапно оказывать сильное окислительное действие.
[21]
Даже раствор хлорида натрия медленно действует на него; поэтому алюминий можно использовать для изготовления лишь определенной кухонной посуды. Алюминий весьма устойчив только по отношению к разбавленной и концентрированной азотной кислоте. Поэтому для хранения и транспортировки этой кислоты используются емкости и цистерны из алюминия. При нагревании до кипения азотная кислота может, однако, внезапно оказывать сильное окислительное действие.
[21]
При растворении алюминия в щелочах образуется алюминат натрия и выделяется большое количество водорода. [22]
При растворении алюминия в НС1 с наложением ультразвука наблюдается уменьшение скорости растворения, и только при частоте 16 кгц и интенсивности 1 3 вт / см2 процесс несколько ускоряется. [23]
При катодном растворении алюминия анионный состав оказывает незначительное влияние на выход по току. В бикарбонат-ных и сульфатных растворах катодное растворение не ухудшается, а даже интенсифицируется. Однако ионы Са2 и Mg2 угнетают процесс катодного растворения из-за образования на поверхности катода карбонатных отложений.
[24]
В бикарбонат-ных и сульфатных растворах катодное растворение не ухудшается, а даже интенсифицируется. Однако ионы Са2 и Mg2 угнетают процесс катодного растворения из-за образования на поверхности катода карбонатных отложений.
[24]
Затем идет растворение алюминия в воде. [25]
Нередко для растворения алюминия применяют смесь трех кислот: азотной, соляной и серной. [26]
Возможно ли растворение алюминия в щелочи. Если возможно, то составьте уравнение реакции. [27]
По мере растворения алюминия из анода вводят в анодный сплав ( через графитовую воронку) новые порции алюминия-сырца. Анодный сплав постепенно обогащается примесями железа, кремния и титана и становится трудноплавким. Поэтому время от времени его выпускают через летку и заменяют новым сплавом алюминия с медью. [29]
[29]
В результате растворения алюминия во флюсе ослабляется связь имеющихся на поверхности окислов с металлом паяемого изделия, а входящие во флюс летучие составляющие ( например, Nh5C1) и пары образовавшегося при реакции соединения А1С1, подрывают окисную пленку и тем самым очищают поверхность алюминия. [30]
Страницы: 1 2 3 4
Алюминий и посуда из него
Основой алюминиевой посуды, как с антипригарным покрытием, так и без покрытий, является АЛЮМИНИЙ — химический элемент III группы периодической системы Д.И. Менделеева, занимающий 3-е место по распространенности после кислорода и кремния в земной коре (порядка 9%). Вопреки предубеждениям многих обывателей, безосновательно поддерживаемых сообщениями СМИ о вреде алюминия, этот металл является безопасным и самым «удобным» для производства посуды с антипригарным покрытием.
По своей природе чистый алюминий является очень активным химическим элементом. Благодаря своей способности интенсивно окисляться, он постоянно покрыт плотной оксидной пленкой Al203, которая и препятствует его дальнейшему окислению. Инертность оксида алюминия настолько велика, что покрытый им алюминий:
- практически не реагирует с концентрированной и разбавленной АЗОТНОЙ КИСЛОТОЙ;
- с трудом взаимодействует с концентрированной и разбавленной СЕРНОЙ КИСЛОТОЙ;
- не растворяется в ОРТОФОСФОРНОЙ КИСЛОТЕ.
Полезные природные свойства алюминия сегодня находят применение в различных сферах жизнедеятельности человека:
ПРИРОДНЫЕ СВОЙСТВА АЛЮМИНИЯ
- Подтвержденная высокая коррозийная стойкость алюминия
Основная характеристика оксида алюминия, как было описано выше – это постоянное окисление при взаимодействии с кислородом и, как следствие, образование тончайшей оксидной пленки на поверхности алюминия, которая служит «броней» и защищает металл от кислот.
- Сохранение витаминов и микроэлементов
Благодаря тончайшей оксидной пленке алюминий обладает ценным свойством – он не разрушает витамины и ценные микроэлементы в продуктах питания. Именно поэтому из него изготавливают аппаратуру для медицинской, маслобойной, сахарной, кондитерской и пивоваренной промышленности.
- Активное использование алюминия при производстве упаковки
Так же в защиту безопасности данного металла говорит его активное применение в упаковочной промышленности (йогурт, шоколад, лекарства, напитки). Алюминий непроницаем для ультрафиолетовых лучей, которые разрушают многие продукты питания. Это непроницаемый для газов, запахов, жидкостей и пыли материал. Используется при производстве крышек, банок для безалкогольных и слабоалкогольных напитков и пива, упаковок различных продуктов – от йогурта до лекарств.
ПОЧЕМУ АЛЮМИНИЙ ИДЕАЛЕН ДЛЯ ПРОИЗВОДСТВА ПОСУДЫ?
Количество алюминия в морской воде колеблется от 0,013 до 5 частей на миллиард. Известно, что Атлантический океан содержит больше алюминия, чем Тихий океан. Речная вода обычно содержит около 400 частей на миллиард алюминия. Известно, что Атлантический океан содержит больше алюминия, чем Тихий океан. Речная вода обычно содержит около 400 частей на миллиард алюминия. Алюминий в основном встречается как Al 3+ (водный) в кислых условиях и как Al (OH) 4 — (водный) в нейтральных или щелочных условиях. Другие формы включают AlOH 2 + (водн.) И Al (OH) 3 (водн.). Металлический алюминий быстро образует тонкий слой оксида алюминия толщиной в несколько миллиметров, который предотвращает реакцию металла с водой. Когда этот слой корродирует, развивается реакция с выделением легковоспламеняющегося газообразного водорода. Al 3+ (водн.) + 6H 2 O (l) <-> [Al (H 2 O) 6 ] 3+ ( вод. Алюминий образуется при выветривании полевых шпатов, таких как ортоклаз, анортит, альбит, слюды и бокситы, и впоследствии попадает в глинистые минералы. Ряд драгоценных камней содержит алюминий, например рубин и сапфир. Алюминий может по-разному отрицательно влиять на наземную и водную жизнь. Обычные концентрации алюминия в грунтовых водах составляют около 0.4 ppm, потому что он присутствует в почвах в виде нерастворимого в воде гидроксида. При значениях pH ниже 4,5 растворимость быстро увеличивается, вызывая повышение концентрации алюминия выше 5 ppm. Это также может происходить при очень высоких значениях pH. Общая концентрация алюминия в организме человека составляет примерно 9 частей на миллион (сухая масса).В некоторых органах, особенно в селезенке, почках и легких, могут присутствовать концентрации до 100 частей на миллион (сухая масса). Суточная доза алюминия составляет примерно 5 мг, из которых абсорбируется лишь небольшая часть. Это приводит к относительно низкой острой токсичности. Абсорбция составляет около 10 мкг в сутки. Эти количества считаются безвредными для человека. Кремний может снизить поглощение алюминия. Однако, как только элемент попадает в корпус, его нелегко удалить. Алюминий можно удалить из воды посредством ионного обмена или коагуляции / флокуляции. Литература и другие элементы и их взаимодействие с водой |
Реакция алюминия + воды — Труды Общества Фарадея (RSC Publishing)
Во время реакции алюминий + вода ионы и электроны алюминия удаляются отдельными этапами на разных участках поверхности.Ионы удаляются практически равномерно по всей поверхности, которая все время покрыта тонкой пленкой аморфного оксида. Внешняя поверхность этого оксида сначала гидролизуется, а затем растворяется с образованием растворимых частиц, которые либо остаются в растворе, либо, при промежуточных значениях pH, осаждаются в виде пористого гидроксида с чрезвычайно маленьким размером частиц. Гидроксид идентичен псевдобемиту. Общая скорость реакции коррозии регулируется растворением пленки и распределением растворимых продуктов.Скорость коррозии почти не зависит от потенциала образца, pH раствора ниже 10 и присутствия в растворе многих солей при концентрациях до 1 моль / л. Скорость сильно зависит от температуры, наличия специфических ингибирующих солей и быстро увеличивается при высоком pH. В средах, которые препятствуют растворению оксидов, например, смеси вода + диоксан или водяной пар, скорость коррозии резко снижается. Скорость коррозии постоянна, когда не образуется твердый гидроксид, и в остальном сильно зависит от количества реакции.При высоких температурах скорость снижается со временем, так как осажденный гидроксид затрудняет транспортировку. При более низких температурах скорость может сначала увеличиваться со временем, поскольку зародышеобразование гидроксида обеспечивает сток для растворимых частиц вблизи границы раздела, а затем в долгое время скорость снижается по мере утолщения гидроксидного слоя.
Гидроксид идентичен псевдобемиту. Общая скорость реакции коррозии регулируется растворением пленки и распределением растворимых продуктов.Скорость коррозии почти не зависит от потенциала образца, pH раствора ниже 10 и присутствия в растворе многих солей при концентрациях до 1 моль / л. Скорость сильно зависит от температуры, наличия специфических ингибирующих солей и быстро увеличивается при высоком pH. В средах, которые препятствуют растворению оксидов, например, смеси вода + диоксан или водяной пар, скорость коррозии резко снижается. Скорость коррозии постоянна, когда не образуется твердый гидроксид, и в остальном сильно зависит от количества реакции.При высоких температурах скорость снижается со временем, так как осажденный гидроксид затрудняет транспортировку. При более низких температурах скорость может сначала увеличиваться со временем, поскольку зародышеобразование гидроксида обеспечивает сток для растворимых частиц вблизи границы раздела, а затем в долгое время скорость снижается по мере утолщения гидроксидного слоя.
Электроны легче удаляются на специальных участках, и в наших образцах эти участки находились в основном на границах зерен. Удаление электронов приводит к увеличению концентрации гидроксильных ионов, что, в свою очередь, приводит к более быстрой атаке на защитный оксид.На таких катодах поддерживается небольшая постоянная толщина оксидной пленки, при которой существует баланс между скоростью ее растворения основным раствором и ростом из-за большого сродства алюминия к кислороду. Таким образом, на катодных участках также присутствует анодная активность, но преобладает удаление электронов. Металл корродирует быстрее на катодах, вызывая выраженную атаку границ зерен в наших образцах. Применение анодных потенциалов устраняет атаку границ зерен.
pH-зависимое растворение осадка алюминия в шести датских озерах, обработанных алюминием
. 2013 1 марта; 47 (3): 1409-20.
DOI: 10.1016 / j.watres.2012.12.004.
Epub 2012 14 декабря.
2013 1 марта; 47 (3): 1409-20.
DOI: 10.1016 / j.watres.2012.12.004.
Epub 2012 14 декабря.Принадлежности Расширять
Принадлежность
- 1 Институт биологии Университета Южной Дании, Campusvej 55, DK-5230 Odense M, Дания[email protected]
Элемент в буфере обмена
Kasper Reitzel et al.
Water Res. .
Показать варианты
Формат АннотацияPubMedPMID
.2013 1 марта; 47 (3): 1409-20. DOI: 10.1016 / j.watres.2012.12.004. Epub 2012 14 декабря.Принадлежность
- 1 Институт биологии Университета Южной Дании, Campusvej 55, DK-5230 Odense M, Дания[email protected]
Элемент в буфере обмена
Полнотекстовые ссылки Опции дисплея CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
Возможное pH-зависимое растворение гидроксидов алюминия (Al (OH) (3)) из озерных отложений было изучено в шести озерах, ранее обработанных Al для связывания избыточного фосфора (P). Поверхностный осадок суспендировали в течение 2 часов в озерной воде с pH 7,5, 8,5 или 9,5, в результате чего наблюдалось ступенчатое увеличение растворенного Al, наблюдаемое во всех озерах. Количество растворенного Al увеличивалось пропорционально содержанию в осадке Al (OH) (3), как количественно определено методом последовательной экстракции. До 24% осадка Al (OH) (3) могло раствориться в течение 2 часов при pH 9,5, при этом часть осадка P растворялась. Понижение pH до 7 вызывало повторное осаждение 30-100% растворенного Al через 24 часа.Повторное осаждение мобилизованного фосфора варьировалось от 50% до более чем 100%. Испытание с необработанным осадком показало такую же пропорциональность, что означает, что также местный Al (OH) (3) может часто растворяться в озерах с водой с высоким pH. Скорости высвобождения растворенного Al из кернов неповрежденных отложений при тех же трех значениях pH были измерены в трех озерах и показали повышенные скорости высвобождения Al при pH 8,5 в одном из озер и 9,5 в двух озерах.
Поверхностный осадок суспендировали в течение 2 часов в озерной воде с pH 7,5, 8,5 или 9,5, в результате чего наблюдалось ступенчатое увеличение растворенного Al, наблюдаемое во всех озерах. Количество растворенного Al увеличивалось пропорционально содержанию в осадке Al (OH) (3), как количественно определено методом последовательной экстракции. До 24% осадка Al (OH) (3) могло раствориться в течение 2 часов при pH 9,5, при этом часть осадка P растворялась. Понижение pH до 7 вызывало повторное осаждение 30-100% растворенного Al через 24 часа.Повторное осаждение мобилизованного фосфора варьировалось от 50% до более чем 100%. Испытание с необработанным осадком показало такую же пропорциональность, что означает, что также местный Al (OH) (3) может часто растворяться в озерах с водой с высоким pH. Скорости высвобождения растворенного Al из кернов неповрежденных отложений при тех же трех значениях pH были измерены в трех озерах и показали повышенные скорости высвобождения Al при pH 8,5 в одном из озер и 9,5 в двух озерах. Наше исследование демонстрирует риск растворения осадка Al (OH) (3) с образованием алюмината в мелководных озерах, где часто возникают ресуспендирование и высокий pH в воде.В худшем случае растворенный Al может достигать токсичных уровней в озерах, обработанных Al, но также сопутствующее высвобождение P и возможная потеря растворенного Al в экосистемы, расположенные ниже по течению, являются негативными эффектами, которые могут возникать уже при более умеренном растворении Al (OH) (3 ) и Al-связанный P.
Наше исследование демонстрирует риск растворения осадка Al (OH) (3) с образованием алюмината в мелководных озерах, где часто возникают ресуспендирование и высокий pH в воде.В худшем случае растворенный Al может достигать токсичных уровней в озерах, обработанных Al, но также сопутствующее высвобождение P и возможная потеря растворенного Al в экосистемы, расположенные ниже по течению, являются негативными эффектами, которые могут возникать уже при более умеренном растворении Al (OH) (3 ) и Al-связанный P.
Copyright © 2012 Elsevier Ltd. Все права защищены.
Похожие статьи
- Видообразование Al, Fe и P в недавних отложениях из трех озер в штате Мэн, США.
Нортон С.А., Кулидж К., Амирбахман А., Бушар Р., Копачек Дж., Рейнхардт Р. Нортон С.А.
 и др.
Sci Total Environ. 15 октября 2008 г .; 404 (2-3): 276-83. DOI: 10.1016 / j.scitotenv.2008.03.016. Epub 2008 25 апреля.
Sci Total Environ. 2008 г.
PMID: 18440053
и др.
Sci Total Environ. 15 октября 2008 г .; 404 (2-3): 276-83. DOI: 10.1016 / j.scitotenv.2008.03.016. Epub 2008 25 апреля.
Sci Total Environ. 2008 г.
PMID: 18440053 - Геохимия отложений Al, Fe и P для двух исторически кислых олиготрофных озер штата Мэн.
Уилсон Т.А., Нортон С.А., Лейк Б.А., Амирбахман А.Уилсон Т.А. и др. Sci Total Environ. 15 октября 2008 г .; 404 (2-3): 269-75. DOI: 10.1016 / j.scitotenv.2008.06.061. Epub 2008 28 августа. Sci Total Environ. 2008 г. PMID: 18760448
- Факторы, влияющие на адсорбцию фосфата алюминием в воде озера: значение для восстановления озера.
де Висенте I, Йенсен Х.С., Андерсен ФО. де Висенте I и др. Sci Total Environ.2008 15 января; 389 (1): 29-36. DOI: 10.
 1016 / j.scitotenv.2007.08.040. Epub 2007 27 сентября.
Sci Total Environ. 2008 г.
PMID: 174
1016 / j.scitotenv.2007.08.040. Epub 2007 27 сентября.
Sci Total Environ. 2008 г.
PMID: 174 - Сравнение методов дозирования алюминия для снижения выброса фосфора из донных отложений в озерах.
Кустер А.С., Кустер А.Т., Хузер Б.Дж. Kuster AC, et al. J Environ Manage. 2020 1 мая; 261: 110195. DOI: 10.1016 / j.jenvman.2020.110195. Epub 2020 3 февраля.J Environ Manage. 2020. PMID: 32148269 Рассмотрение.
- Почему фосфат алюминия менее токсичен, чем гидроксид алюминия.
Бертон Дж., Дайде С. Бертон Г. и др. J Am Coll Nutr. 1992 июн; 11 (3): 340-8. DOI: 10.1080 / 07315724.1992.10718236. J Am Coll Nutr. 1992 г. PMID: 1619187 Рассмотрение.
Процитировано
4 статей- Исследование влияния защитного покрытия на внутреннее высвобождение фосфора из донных отложений при восстановлении корневых макрофитов (Phragmites australis).

Ю Дж, Чжун Дж, Чен Кью, Хуанг В, Ху Л, Чжан И, Фань К. Yu J, et al. Environ Sci Pollut Res Int. 2018 сентябрь; 25 (25): 24682-24694. DOI: 10.1007 / s11356-018-2432-1. Epub 2018 18 июня. Environ Sci Pollut Res Int. 2018. PMID: 29916150
- Влияние добавления соли железа и алюминия на адсорбцию фосфора в отложениях заболоченных земель.
Хуан С, Хуан Х, Чжу Х.Хуанг С. и др. Environ Sci Pollut Res Int. 2016 Май; 23 (10): 10022-7. DOI: 10.1007 / s11356-016-6188-1. Epub 2016 11 февраля. Environ Sci Pollut Res Int. 2016 г. PMID: 26865486
- Влияние факторов окружающей среды на адсорбцию фосфора бентонита, модифицированного лантаном, в эвтрофной воде и отложениях.
Лю С, Ли Дж, Ян И, Ван Дж, Дин Х.
 Лю С. и др.Environ Sci Pollut Res Int. 2016 Февраль; 23 (3): 2487-94. DOI: 10.1007 / s11356-015-5453-z. Epub 2015 1 октября.
Environ Sci Pollut Res Int. 2016 г.
PMID: 26423284
Лю С. и др.Environ Sci Pollut Res Int. 2016 Февраль; 23 (3): 2487-94. DOI: 10.1007 / s11356-015-5453-z. Epub 2015 1 октября.
Environ Sci Pollut Res Int. 2016 г.
PMID: 26423284 - Иммобилизация фосфора из воды и осадков с помощью цеолитов, модифицированных цирконием.
Ян М., Линь Дж., Чжан Ю., Чжу З., Чжан Х. Ян М. и др. Environ Sci Pollut Res Int. 2015 Март; 22 (5): 3606-19.DOI: 10.1007 / s11356-014-3604-2. Epub 2014 26 сентября. Environ Sci Pollut Res Int. 2015 г. PMID: 25253056
Типы публикаций
- Поддержка исследований, за пределами США. Правительство
Условия MeSH
- Гидроксид алюминия / химия *
- Геологические отложения / химия *
- Концентрация водородных ионов
- Загрязнение воды, химия / химия *
Вещества
- Загрязняющие воду химические вещества
LinkOut — дополнительные ресурсы
Источники полных текстов
Другие источники литературы
цитировать
КопироватьФормат: AMA APA ГНД NLM
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Алюминий — химический состав и соединения — натрий, гидроксид, растворенные вещества и металл
Алюминий — необычный металл, который реагирует не только с кислотами, но и с основаниями.Как и многие активные металлы, алюминий растворяется в сильных кислотах с выделением водорода и газа и образованием солей. Фактически, приготовление даже слабокислых продуктов, таких как помидоры, в алюминиевой посуде, может растворить достаточно алюминия, чтобы придать блюду «металлический» вкус . Но алюминий также растворяется в сильных основаниях, таких как гидроксид натрия , широко известный как щелочь. Большинство чистящих средств для духовок, предназначенных для обработки стали и фарфора, содержат гидроксид натрия или калия; пользователь должен следить за тем, чтобы он не попал на алюминиевые части диапазона, поскольку это может вызвать неблагоприятные последствия.Некоторые коммерческие очистители канализации содержат щелок, смешанный со стружкой металлического алюминия; Алюминий растворяется в растворе гидроксида натрия с образованием пузырьков газообразного водорода, которые добавляют механическое разрушающее действие к действию щелока по растворению жира.
Гидратированный хлорид алюминия, AlCl 3 • H 2 O, также называемый хлоргидратом алюминия, используется в антиперспирантах, потому что, как и квасцы ( калий-сульфат алюминия ), он оказывает вяжущее действие — эффект сокращения — закрытие протоков потовых желез и прекращение потоотделения.
Более одного миллиона тонн сульфата алюминия, Al 2 (SO 4 ) 3 , производится в Соединенных Штатах каждый год путем растворения оксида алюминия в серной кислоте , H 2 СО 4 . Он используется для очистки воды, потому что, когда он вступает в реакцию с известью (или любой другой основой), он образует липкий осадок гидроксида алюминия, который сметает мельчайшие частицы примесей. Сульфат натрия и алюминия, NaAl (SO 4 ) 2 • 12H 2 O, разновидность квасцов, используется в разрыхлителях двойного действия.Он действует как кислота, реагируя при температуре печи с бикарбонатом натрия в порошке с образованием пузырьков газа диоксида углерода .
Книги«Алюминий». Кирк-Отмер Энциклопедия химической технологии. 4-е изд. Дополнение Нью-Йорк: John Wiley & Sons, 1998.
.Браунгарт, Майкл и Уильям Макдонаф. От колыбели до колыбели: переделывая то, как мы делаем вещи. North Point Press, 2002.
Лиде, Д.Красный. CRC Handbook of Chemistry and Physics Boca Raton: CRC Press, 2001.
Снайдер, C.H. Необычная химия обычных вещей. 4-е изд. Нью-Йорк: John Wiley and Sons, 2002.
Керамика — Исследования
Дэниел М. Даббс
Загрязнение алюминием почвы и грунтовых вод и возможные связи к широкому спектру человеческих недугов привело к повышенному интересу к видообразованию алюминия в природных водах [1], почве [2] и сыворотке крови.[3] В результате проценты сосредотачивается на физиологическом диапазоне pH 6-9, [4,5] и информации о растворимости алюминия в растворах с высоким pH (pH ≥ 10), условиях сильного гидролиза, составляет ограничивается в основном преобладающими алюминийсодержащими соединениями, наблюдаемыми в термодинамически стабильные растворы. [6] Несмотря на это очевидное отсутствие предыстории информации, вид алюминия в условиях высокого pH важен для восстановление водных растворов опасных отходов, особенно найденные в цистернах с радиоактивными отходами.[7]
Оксигидроксиды алюминия растворимые и нерастворимые алюминийсодержащие частицы комплекс с лимонной кислотой в условиях высокого гидролизишгидроксид-иона до соотношение алюминия превышает 2,46 моль / моль [8] Органическое вещество может защищать существующие поверхности частиц от растворения или для поддержания растворимости катионов. Мы титровали растворы хлорида алюминия NaOH (водн.), Добавляя лимонную кислоту. кислота в количестве от нуля до немного меньшего, чем цитрат / Al = 1 моль / моль.
Механизмы комплексообразования и коллоидной стабилизации молекул. Взаимодействия между комплексообразователем и целевым атомом чешуйки от микромасштаба (поверхностей) к атомному. Стабильность, продолжение существования частицы или молекулы, может быть придан термодинамически или кинетически.
Изменения размера частиц суспензии измерены с использованием квазиупругое рассеяние света.Растворы хлорида алюминия без лимонной кислоты добавленная кислота образовывала крупные частицы, которые быстро сжимались до достаточного гидроксид добавляли, и частицы оставались в суспензии. Большой алюминийсодержащие поликатионы детектировали методом ЯМР раствора 27 Al под условия сильного гидролиза, и они могли обеспечить зародыши для частиц формирование.
Добавление лимонной кислоты изменило динамику обоих растворов и подвески.В растворах очень высокого гидролиза (OH / Al = 3,29) частицы не не образуется, когда мольное / мольное отношение цитрата к алюминию равно 0,8. Под те же условия гидролиза, но при соотношении цитрат / Al менее 0,8, частицы образовались, но зарождение и рост были заметно замедлены. В условиях высокого гидролиз (OH / Al = 2,46), частицы образуются в присутствии лимонной кислоты, когда основание добавляли, но скорость образования замедлялась. Поликатионов не было обнаружен в растворах, содержащих лимонную кислоту, что позволяет предположить, что важные семена или строительные блоки в формировании и росте частиц были устранены взаимодействия лимонной кислоты с алюминиевыми центрами.
При добавлении NaOH (водн.) К растворам AlCl 3 частицы нестабильны для OH / Al менее 2,6. Частицы быстро образуются и достигают больших размеров, а затем сжимаются (или дезагрегируются). и исчезнуть. При OH / Al выше 2,6 частицы сжимаются до стабильного размера, и полученная суспензия остается стабильным при комнатной температуре.
Рост частиц остается быстрым, но последующее уменьшение замедляется в присутствии лимонной кислоты в условиях сильного гидролиза.При более высоком содержании OH / Al рост частиц можно остановить, используя достаточное количество лимонная кислота (~ 0,8 лимонной кислоты на алюминий в молях).
Список литературы
1. г. до н. Э. Фауст, В. Лабиоза, К. Дай, Дж. Макфолл, Б.А. Браун, А.А. Рибейро, Д. Рихтер Геохим. Космохим. Акта 1995 59 2651-61.
2. D.L. Jones Plant and Soil 1998 205 2544; Дж.Ф. Ма, P.R. Ryan, E. Delhaize Trends Plant Sci. 2001 6 273-8.
3. А. Лакатос, Ф. Эваникс, Г. Домби, Р. Бертани, Т. Поцелуй евро. J. Inorg. Chem. 2001 12 3079-86.
4. Л.-О. hman Chem. Геол. 1998 151 4150.
5. R.B. Martin В соотв. Chem. Res. 1994 27 204-210; Л.-О. hman, R.B. Martin Clin.Chem. 1994 40 598-601.
6. A. Lakatos, I. Bnyai, P. Decock, T. Kiss Eur. J. Inorg. Chem. 2001 2 461-9.
7. Танки Фокусное направление , Годовой отчет 1997 (Национальный технический Информационная служба Министерства торговли США, Спрингфилд, Вирджиния, 1998 г.



 Начало реакции гидролиза следующее:
Начало реакции гидролиза следующее: Кроме того, алюминий в значительной степени перерабатывается, потому что это вполне возможно. Он применяется, например, в рамах, дверных ручках, кузовах автомобилей, деталях самолетов (соотношение веса и прочности очень благоприятное), двигателях, тросах и канистрах. Алюминий является хорошим отражателем и поэтому применяется в солнечных зеркалах и теплоотражающих одеялах. Алюминий перерабатывается в банки, проводку и сплавы.
Кроме того, алюминий в значительной степени перерабатывается, потому что это вполне возможно. Он применяется, например, в рамах, дверных ручках, кузовах автомобилей, деталях самолетов (соотношение веса и прочности очень благоприятное), двигателях, тросах и канистрах. Алюминий является хорошим отражателем и поэтому применяется в солнечных зеркалах и теплоотражающих одеялах. Алюминий перерабатывается в банки, проводку и сплавы.  и агент гидратации.
и агент гидратации. Это объясняет корреляцию между кислотными дождями и концентрацией алюминия в почве. При увеличении осаждения нитратов количество алюминия увеличивается, тогда как под большими вересковыми и сельскохозяйственными угодьями оно уменьшается.В лесных почвах он увеличивается.
Это объясняет корреляцию между кислотными дождями и концентрацией алюминия в почве. При увеличении осаждения нитратов количество алюминия увеличивается, тогда как под большими вересковыми и сельскохозяйственными угодьями оно уменьшается.В лесных почвах он увеличивается.  Алюминий в основном токсичен для рыб при значениях pH 5,0-5,5. Ионы алюминия накапливаются на чайках и забивают их слизистым слоем, что ограничивает дыхание. Когда значения pH снижаются, ионы алюминия влияют на регулирование проницаемости чаек кальцием.Это увеличивает потери натрия. Кальций и алюминий антагонистичны, но добавление кальция не может ограничить потерю электролита. В основном это касается молодняка. Концентрация алюминия 1,5 мг / л оказалась фатальной для форели. Этот элемент также влияет на рост пресноводных костистых рыб.
Алюминий в основном токсичен для рыб при значениях pH 5,0-5,5. Ионы алюминия накапливаются на чайках и забивают их слизистым слоем, что ограничивает дыхание. Когда значения pH снижаются, ионы алюминия влияют на регулирование проницаемости чаек кальцием.Это увеличивает потери натрия. Кальций и алюминий антагонистичны, но добавление кальция не может ограничить потерю электролита. В основном это касается молодняка. Концентрация алюминия 1,5 мг / л оказалась фатальной для форели. Этот элемент также влияет на рост пресноводных костистых рыб.  При пероральном приеме это 420 мг / кг для хлорида алюминия и 3671 мг / кг для нонагидрата алюминия. Механизм токсичности в основном основан на ингибировании ферментов.
При пероральном приеме это 420 мг / кг для хлорида алюминия и 3671 мг / кг для нонагидрата алюминия. Механизм токсичности в основном основан на ингибировании ферментов.  Это было связано с повреждением нервов. Отравление алюминием особенно восприимчиво к людям с поражением почек. Есть риск аллергии. Алюминий, вероятно, обладает мутагенными и канцерогенными свойствами. Предполагается корреляция между потреблением алюминия и увеличением числа случаев болезни Альцгеймера. Однако это неясно, потому что концентрация алюминия всегда увеличивается с возрастом. Повышенное потребление алюминия также может вызвать остеомаляцию (дефицит витамина D и кальция).
Это было связано с повреждением нервов. Отравление алюминием особенно восприимчиво к людям с поражением почек. Есть риск аллергии. Алюминий, вероятно, обладает мутагенными и канцерогенными свойствами. Предполагается корреляция между потреблением алюминия и увеличением числа случаев болезни Альцгеймера. Однако это неясно, потому что концентрация алюминия всегда увеличивается с возрастом. Повышенное потребление алюминия также может вызвать остеомаляцию (дефицит витамина D и кальция).  Соли алюминия применяются при очистке воды для реакций осаждения. Добавление сульфата алюминия и извести в воду вызывает образование гидроксида алюминия, что приводит к осаждению загрязняющих веществ. Гидроксид нерастворим в воде, поэтому остается только 0,05 ppm растворенного алюминия. Это ниже установленного Всемирной организацией здравоохранения (ВОЗ) предельного значения для питьевой воды, содержащего 0,2 промилле алюминия.
Соли алюминия применяются при очистке воды для реакций осаждения. Добавление сульфата алюминия и извести в воду вызывает образование гидроксида алюминия, что приводит к осаждению загрязняющих веществ. Гидроксид нерастворим в воде, поэтому остается только 0,05 ppm растворенного алюминия. Это ниже установленного Всемирной организацией здравоохранения (ВОЗ) предельного значения для питьевой воды, содержащего 0,2 промилле алюминия. и др.
Sci Total Environ. 15 октября 2008 г .; 404 (2-3): 276-83. DOI: 10.1016 / j.scitotenv.2008.03.016. Epub 2008 25 апреля.
Sci Total Environ. 2008 г.
PMID: 18440053
и др.
Sci Total Environ. 15 октября 2008 г .; 404 (2-3): 276-83. DOI: 10.1016 / j.scitotenv.2008.03.016. Epub 2008 25 апреля.
Sci Total Environ. 2008 г.
PMID: 18440053 1016 / j.scitotenv.2007.08.040. Epub 2007 27 сентября.
Sci Total Environ. 2008 г.
PMID: 174
1016 / j.scitotenv.2007.08.040. Epub 2007 27 сентября.
Sci Total Environ. 2008 г.
PMID: 174
 Лю С. и др.Environ Sci Pollut Res Int. 2016 Февраль; 23 (3): 2487-94. DOI: 10.1007 / s11356-015-5453-z. Epub 2015 1 октября.
Environ Sci Pollut Res Int. 2016 г.
PMID: 26423284
Лю С. и др.Environ Sci Pollut Res Int. 2016 Февраль; 23 (3): 2487-94. DOI: 10.1007 / s11356-015-5453-z. Epub 2015 1 октября.
Environ Sci Pollut Res Int. 2016 г.
PMID: 26423284