Исследование процесса получения сесквикарбоната натрия циклическим жидкофазным способом
АННОТАЦИЯ
Для разработки технологии жидкофазного циклического способа получения сесквикарбоната натрия проводился графический анализ системы NaНCO3 -Na2CO3 -H2O. Анализ системы также показывает, что для получения двойного соединения сесквикарбоната натрия процесс необходимо вести при температуре не более 100°С. Результаты проведенных экспериментов показывают, что плотность исходных растворов при 100оС увеличивается с повышением концентрации и снижается с увеличением в жидкой фазе соотношения Na2CO3:NaHCO3 при колебании в интервале 1,196-1,242 г/см3.
При проведении процесса кристаллизации при 25-30оС соотношение Ж:Т и плотность образующейся суспензии колеблются в интервалах 5,44-16,88 и 1,231-1,352 г/см3 соответственно.
ABSTRACT
To develop the technology of the liquid-phase cyclic method for obtaining sodium sesquicarbonate, a graphical analysis of NaНCO3 -Na2CO3 -H2O system is carried out. The system analysis also shows that the process must be conducted at temperature no more than 100 °C to obtain a double compound of sodium sesquicarbonate. Results of the carried out experiments show that the density of initial solutions at 100 °C rises with increasing concentration and decreases with the increase of the ratio Na2CO3:NaHCO3 in the liquid phase under the vibration in the interval 1,196-1,242g/cm3.
Carrying out the crystallization process at 25-30 оС, the ratio L: S and the density of the resulting suspension fluctuate within the ranges 5,44 – 16,88 and 1,231-1,352 g / cm3, respectively.
Сесквикарбонат натрия (Na2CO3·NaHCO3·2H2O) используется в составах экологически безопасных бесфосфатных моющих средств и производстве косметических средств, что связано с наличием положительного дерматологического эффекта и дезинфицирующих свойств. Его также применяют для десульфизации кислотных газов промышленных предприятий, обработки промышленных и городских сточных вод, регулирования рН воды плавательных бассейнов. Крупные месторождения сесквикарбоната натрия сконцентрированы, главным образом, в США и России в виде минерала троны. Однако выделение из него Na2CO3·NaHCO3·2H2O трудоемко и энергозатратно, поэтому интерес представляет получение синтетического сесквикарбоната натрия. Известны способы получения сесквикарбоната натрия, основанные на смешении порошкообразного карбоната натрия и водной суспензии гидрокарбоната натрия, недостатками которых является наличие в продуктах синтеза, помимо сесквикарбоната натрия, Na2CO3·H2O и NaHCO3 и, следовательно, низкое содержание основного вещества. В то же время отмечено, что путем политермической кристаллизации из насыщенного раствора возможно получение продукта с содержанием 96-98 мас. % Na2CO3·NaHCO3·2H2O.
Его также применяют для десульфизации кислотных газов промышленных предприятий, обработки промышленных и городских сточных вод, регулирования рН воды плавательных бассейнов. Крупные месторождения сесквикарбоната натрия сконцентрированы, главным образом, в США и России в виде минерала троны. Однако выделение из него Na2CO3·NaHCO3·2H2O трудоемко и энергозатратно, поэтому интерес представляет получение синтетического сесквикарбоната натрия. Известны способы получения сесквикарбоната натрия, основанные на смешении порошкообразного карбоната натрия и водной суспензии гидрокарбоната натрия, недостатками которых является наличие в продуктах синтеза, помимо сесквикарбоната натрия, Na2CO3·H2O и NaHCO3 и, следовательно, низкое содержание основного вещества. В то же время отмечено, что путем политермической кристаллизации из насыщенного раствора возможно получение продукта с содержанием 96-98 мас. % Na2CO3·NaHCO3·2H2O.
Теоретический анализ системы «гидрокарбонат натрия — карбонат натрия — вода» выполнен при 25, 80 и 100°С построением диаграммы путем экстраполяции литературных данных [1-4], в которых выявлено наличие разногласий по некоторым узловым точкам, что вынудило нас провести уточнения экспериментальным путем. На фазовой диаграмме состояния изучаемой системы были разграничены поля кристаллизации десяти- и семиводного карбоната натрия и сесквикарбоната натрия- NaНCO3·Na2CO3·2H2O. В исследуемых температурных интервалах происходит образование соединения NaНCO3·Na2CO3·2H2O. Основную часть диаграммы занимает поле кристаллизации гидрокарбоната натрия, что указывает на малую его растворимость относительно других компонентов системы. С повышением температуры наблюдается исчезновение поля кристаллизации десяти- и семиводного карбоната натрия.
Для разработки технологии жидкофазного циклического способа получения сесквикарбоната натрия проводился графический анализ системы NaНCO3 -Na2CO3 -H2O.
От точки А состава влажного гидрокарбоната натрия к точке Д состава, образующегося при смешении с раствором кальцинированной соды в системе при 100oС в результате его перехода в раствор, проводим луч растворения до пересечения координат Na2CO3-H2O (КС) с точкой С, которая показывает исходную концентрацию содового раствора.
Масса содового раствора относительно влажного гидрокарбоната натрия (ВГКН) по правилу рычага равна плечу АВ/ВС.
Следовательно, концентрация содового раствора в точке С равна 2,2%, а соотношение Мрент /=АВ/ВС=128/16=8.
128+16=144; 16·100/144=11,1%; 11.1·0,83=9,22%.
Расчеты показывают, что в систему добавляется (100/811-11,11%) ВГКН, тогда с учетом значения влажности 17% содержание гидрокарбоната натрия в системе составляет 11,1·0,83=9,22%, а содержание карбоната натрия -(100-11,11)·0,22=19,56%. Полученный раствор охлаждается до 25oС, в результате чего образуется кристаллический сесквикарбонат натрия и его насыщенный раствор.
Состав насыщенного маточного раствора определяется путем проведения луча кристаллизации от точки сесквикарбоната натрия к фигуративной точке системы (В). Луч кристаллизации проводится до пересечения с точкой М изотермы насыщения сесквикарбоната натрия при 25oС. При этом состав маточного раствора содержит масс%: 18,5 Na2CO3, 2,5 NaНCO3 и 79,0 H2O. Соотношение Ж:Т в суспензии равно ВТ/ВМ=100/116=6,25, т. е. содержание троны в суспензии составляет 13,79% (NaНCO3·Na2CO3·2H2O-37,14%). При 13,79·0,3414=5,13 выход ГКН составляет 5,13·100/9,22=55,59%. Полученный сесквикарбонат натрия подается на стадию сушки, а маточный раствор — на стадию приготовления содового раствора при температуре 25-35oС, которая обеспечивается за счет теплоты растворения кальцинированной соды. Соотношение маточного раствора и кальцинированной соды равно:
Ммат р/р/Мкс КС-С1 /С1М=151/10=15,1.
При добавлении к маточному раствору 6,211% кальцинированной соды образуется содовый раствор, соответствующий по составу фигуративной точке С1.
К полученному содовому раствору необходимо добавлять такое количество ГКН, чтобы состав системы соответствовал фигуративной точке В, определяемой по правилу рычага: АВ/ВС1=128/12=1067, т. е. в систему при 100oС добавляется 8,57% ВГКН (7,11% относительно сухого ГКН). Образующийся раствор охлаждается до 25oС с получением суспензии сесквикарбоната натрия, которая, как показано выше, содержит 17,59% твердой фазы. Суспензию фильтруют с получением сесквикарбоната натрия и маточного раствора. Таким образом, цикл закрывается с образованием треугольника (ВМС1) и выходом сесквикарбоната натрия по ГКН, достигающим 51113·100/7,4=72,15%. В данной технологии 10-15% ГКН в виде маточного раствора выводится из системы и используется в качестве содового раствора для других целей, а 10-13% ГКН превращается в карбонат натрия в стадии растворения, что принимается во внимание при приготовлении содового раствора.
Анализ системы также показывает, что для получения двойного соединения сесквикарбоната натрия процесс необходимо вести при температуре не более 100°С.
Для полного растворения кальцинированной соды и с учетом испарения в технологических стадиях количество добавляемой воды было одинаковым для всех опытов (240 г на 100 г суммы солей). Исходя из вышеизложенных экспериментов по получению сесквикарбоната натрия проводили путем политермической кристаллизации раствора карбоната и гидрокарбоната натрия. Наличие избыточного содержания карбоната натрия в насыщенном растворе связано с его высаливающим действием и незначительным изменением растворимости при понижении температуры от 100 до 25°С (рисунок).
Рисунок. График циклического способа получения сесквикарбоната натрия.
При проведении опытов к горячей воде медленно, при постоянном перемешивании добавляли карбонат и гидрокарбонат натрия. Полученную суспензию нагревали до 100°С и выдерживали при постоянном перемешивании до полного растворения солей, после чего медленно, в течение 15-20 мин раствор охлаждали до 25°С со скоростью 2-3оС/мин с выпадением ромбических (игольчатых) кристаллов сесквикарбоната натрия. Полученный продукт отфильтровывали на вакуум-фильтре под разрежением 0,3 кгс/см2 и промывали 17%-ным раствором сесквикарбоната натрия при соотношении 1:1 относительно сухого продукта. Осадок сушили при комнатной температуре. Маточный раствор анализировали на содержание карбонат- и гидрокарбонат- ионов и добавлением Na2CO3 и NaHCO3 донасыщали до их заданного содержания. После этого проводили второй цикл кристаллизации с соблюдением условий, аналогичных при первом цикле кристаллизации.
Полученную суспензию нагревали до 100°С и выдерживали при постоянном перемешивании до полного растворения солей, после чего медленно, в течение 15-20 мин раствор охлаждали до 25°С со скоростью 2-3оС/мин с выпадением ромбических (игольчатых) кристаллов сесквикарбоната натрия. Полученный продукт отфильтровывали на вакуум-фильтре под разрежением 0,3 кгс/см2 и промывали 17%-ным раствором сесквикарбоната натрия при соотношении 1:1 относительно сухого продукта. Осадок сушили при комнатной температуре. Маточный раствор анализировали на содержание карбонат- и гидрокарбонат- ионов и добавлением Na2CO3 и NaHCO3 донасыщали до их заданного содержания. После этого проводили второй цикл кристаллизации с соблюдением условий, аналогичных при первом цикле кристаллизации.
Содержание Сl-ионов определяли меркурометрическим методом, а HCO3— и CO32- ионов — титрованием кислотой. Фазовый состав устанавливали посредством рентгенофазового анализа на дифрактометре «ДРОН-3», морфологию и размер частиц — с помощью сканирующего электронного микроскопа Jeol JSM-6510LV (Япония). Термический анализ синтезированных продуктов осуществляли методом дифференциальной сканирующей калориметрии на приборе Mettler TOLEDOSTAR. Термографирование проводили при атмосферном давлении на воздухе в керамическом тигле при скорости нагрева 6 град/мин.
Термический анализ синтезированных продуктов осуществляли методом дифференциальной сканирующей калориметрии на приборе Mettler TOLEDOSTAR. Термографирование проводили при атмосферном давлении на воздухе в керамическом тигле при скорости нагрева 6 град/мин.
Эксперименты показывают, что плотность исходных растворов при 100оС увеличивается с повышением концентрации и снижается с увеличением в жидкой фазе соотношения Na2CO3:NaHCO3 при колебании в интервале 1,196-1,242 г/см3.
При проведении процесса кристаллизации при 25-30оС соотношение Ж:Т и плотность образующейся суспензии колебются в интервалах 5,44-16,88 и 1,231-1,352 г/см3 соответственно. Скорость фильтрации в зависимости от технологических параметров колеблетса в интервалах 202,00-926,58 кг/м2ч и, в частности, снижается с повышением соотношения Na2CO3:NaHCO3 и с увеличением содержания хлорида натрия в жидкой фазе до 4,412%, а дальнейшее его повышение приводит к значительному снижению на 293,79 кг/м2ч по сравнению с температурой 60оС. Влажность кеков в 1.5-2 раза ниже, чем при 60оС, и составляет 17,36-33,48%. Выход продуктов в некоторых случаях превышает 90%, в частности, при соотношении Na2CO3:NaHCO3 = 4.
Влажность кеков в 1.5-2 раза ниже, чем при 60оС, и составляет 17,36-33,48%. Выход продуктов в некоторых случаях превышает 90%, в частности, при соотношении Na2CO3:NaHCO3 = 4.
Как показывают полученные результаты, при снижении температуры образуются мелкие кристаллы, которые являются зародышами сесквикарбоната натрия, и их дальнейший рост оказывается возможным в результате достижения пересыщения при охлаждении раствора.
После донасыщения маточного раствора карбонатом и гидрокарбонатом при 100°С до заданной концентрации солей натрия раствор охлаждали таким же способом, как и в первом цикле. Расчеты показывают, что возврат маточного раствора в процесс позволяет сократить расход карбоната и гидрокарбоната натрия на приготовление насыщенного раствора и повысить выход продукта до 74,3%.
Список литературы:
1. Порошок на троне [Электронный ресурс] — Режим доступа: http://www.ecostar. com.ua (дата обращения: 17.08.2010).
com.ua (дата обращения: 17.08.2010).
2. Энергоэкономная технология получения высококачественного кристаллизационного сесквикарбоната натрия [Электронный ресурс]. — Режим доступа: http://niochim.kharkov.ua/ru/ innovations.html#2 (дата обращения: 17.08.2010).
3. Method of producing non-phosphate detergents based on powdered sodium sesquicarbonate: EP 1690923 Ukraine, C 11 D 3/10, C 11 D 11/04 / O. Kachur, W. Lemeshko; BRANDPAT Kan- celaria Patentowa; заявл. 15.02.2005; опубл. 16.08.2006 // Bulletin 2006/33 / European Patent Office. — 2006. — № 12/82.
4. Torgeson D. R. Heats of formation and decomposition of trona / D. R. Torgeson // J. of Industrial and Engineering Chemistry. — 1948. — Vol. 40. —№ 6. — P. 1152-1153.
Карбонат натрия
Карбонат натрия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Содержание
- 1 Свойства
- 2 Нахождение в природе
- 3 Получение
- 3.1 Способ Леблана
- 3.2 Промышленный аммиачный способ (способ Сольве)
- 3.3 Способ Хоу
- 3.3.1 Сравнение способов
- 4 Применение
- 5 Безопасность
- 6 Тривиальные названия
Свойства
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды.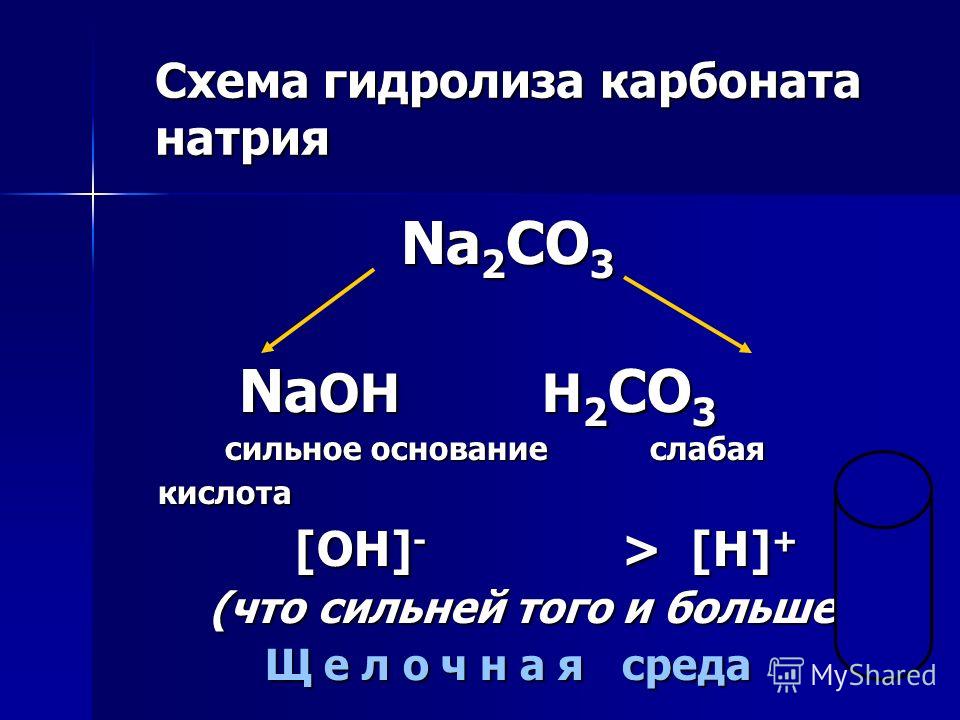 Уравнение гидролиза (в ионной форме):
Уравнение гидролиза (в ионной форме):
- CO32− + H2O ⇄ HCO3− + OH−
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
- нахколит NaHCO3
- трона Na2CO3·NaHCO3·2H2O
- натрит (сода) Na2CO3·10H2O
- термонатрит Na2CO3·Н2O.
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4 + 2 C → Na2S + 2CO2
Сульфид натрия реагирует с карбонатом кальция:
- Na2S + CaCO3 → Na2CO3 + CaS
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2 NaCl + H2SO4 → Na2SO4 + 2 HCl
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
Карбонат натрия
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3 →ot Na2CO3 + H2O + CO2↑
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.
Безопасность
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Как приготовить раствор карбоната натрия и его применение
Как приготовить раствор карбоната натрия — вопрос, который могут задать себе многие люди, имеющие дело с карбонатом натрия в лаборатории. Чтобы приготовить раствор карбоната натрия, вам нужно нагреть немного воды и растворить в ней порошкообразный карбонат натрия. pH этого раствора в конечном итоге будет между 8-9, что является довольно щелочным. Раствор карбоната натрия также называют стиральной содой, или содой. Это соединение также известно как средство для смягчения воды, поскольку оно содержится в моющих средствах и средствах для смягчения воды, которые используются для смягчения воды. При использовании карбоната натрия для смягчения воды из воды удаляются многие минералы, такие как железо и кальций.
Как приготовить раствор карбоната натрия
Чтобы приготовить раствор карбоната натрия, нужно нагреть немного воды и растворить в ней порошкообразный карбонат натрия.
Сначала вам нужно будет добавить в смесь карбонат натрия. Карбонат натрия представляет собой белый порошок, который часто растворяется в воде, поэтому он используется в мыловарении для получения мягкой пены. Его также можно использовать в качестве отбеливателя для белья. Карбонат натрия, который мы здесь используем, не такой, как обычный карбонат натрия, а не тот, который используется в мыловарении. Мы будем использовать примерно столовую ложку порошкообразного карбоната натрия на 2 литра воды. Соотношение порошка к воде должно быть от 1 грамма на литр до 2 граммов на литр. Чем больше карбоната натрия вы добавите, тем более щелочным станет раствор. Чтобы растворить его, просто перемешайте раствор, пока не перестанут быть видны частицы белого порошка.
После растворения карбоната натрия добавьте горячую воду и хорошо перемешайте, чтобы все равномерно распределилось.
Приготовив раствор карбоната натрия, вы можете использовать его для разных целей. Чаще всего используется для мытья одежды или рук. Если вы хотите использовать его для мытья рук, сделайте небольшое количество раствора и замочите в нем руки примерно на 10 минут. Это даст им тот же эффект, что и при нанесении лосьона или крема для рук, но после этого они не станут жирными (благодаря очищающей способности карбоната натрия). Вы также можете использовать этот раствор для удаления пятен с одежды. Намочите испачканный участок одежды небольшим количеством пресной воды и протрите его небольшим количеством этого раствора карбоната натрия.
Другое применение раствора карбоната натрия
1. Для удаления отложений железа с тканей
Если вы хотите почистить утюг или гладильную доску, вы можете протереть утюг небольшим количеством раствора карбоната натрия.
2. Средство от насекомых
Раствор карбоната натрия можно использовать для изготовления собственного средства от насекомых. Все, что вам нужно сделать, это смешать 1 часть карбоната натрия с 9 частями воды. Когда он будет готов, он должен побелеть и стать довольно блестящим, и он будет пахнуть уксусом. Можно распылять этот раствор прямо на одежду или на кожу, но следить, чтобы поблизости не было людей и других живых существ.
3. Для приготовления мягкого отбеливателя
Если вы хотите использовать карбонат натрия для очистки ванны и других принадлежностей для ванной комнаты, смешайте немного раствора карбоната натрия с уксусом и налейте на пятно. Вы также можете использовать этот раствор для отбеливания тканей или ванны, замачивая их в нем. Просто убедитесь, что вы не добавляете больше указанного количества карбоната натрия на литр воды, иначе они станут слишком слабыми. В некоторых случаях хлорный отбеливатель более эффективен для очистки ванн и душевых, но использование карбоната натрия в качестве заменителя все равно будет работать, если вы предпочитаете вообще не использовать какие-либо химические чистящие средства.
В заключение, раствор карбоната натрия является очень полезным химическим веществом, которое можно использовать по-разному. Это очень эффективное чистящее средство, и его можно использовать отдельно или с уксусом для дезинфекции поверхностей и удаления пятен. Есть много вещей, которые вы можете использовать для дома, но вы должны иметь базовые знания о том, как правильно его использовать, прежде чем обращаться с ним. Это объясняет, как сделать раствор карбоната натрия.
Это очень эффективное чистящее средство, и его можно использовать отдельно или с уксусом для дезинфекции поверхностей и удаления пятен. Есть много вещей, которые вы можете использовать для дома, но вы должны иметь базовые знания о том, как правильно его использовать, прежде чем обращаться с ним. Это объясняет, как сделать раствор карбоната натрия.
Отказ от ответственности: ECHEMI оставляет за собой право окончательного объяснения и пересмотра всей информации.
Раствор карбоната натрия, 0,1 М, 500 мл
Раствор карбоната натрия, 0,1 М, 500 мл | Флинн Сайентифик- Дом
- Товары
- Химикаты
- Раствор карбоната натрия
- Раствор карбоната натрия, 0,1 М, 500 мл
Артикул №: S0235
Цена: $6,61
В наличии.
(как Na 2 CO 3 )
См. дополнительные сведения о продукте
Опции:
просмотр вариантов в виде диаграммы
- информация о продукте
- Посмотреть паспорт безопасности
Этот товар можно отправить только в школы, музеи и научные центры
Ресурсы
- Раствор карбоната натрия
Другие опции
| Артикул № | S0235 | S0234 |
|---|---|---|
| Концентрация | 0,1 М | 1,0 М |
| Сумма | 500 мл | 500 мл |
| Цена | $6,61 | $6,88 |
| Введите количество элементов |
