Гипохлорит натрия
Растворы гипохлорита натрия используются для дезинфекции и обеззараживания воды около 100 лет. Многолетняя практика использования растворов гипохлорита натрия для обработки воды, как в нашей стране так и за рубежом показывает, что реагенты могут использоваться в широком диапазоне:
- для дезинфекции воды в плавательных бассейнах и водоемах различного назначения;
- для обработки природных и сточных вод в системе хозяйственно-питьевого водоснабжения;
- при обработке бытовых и промышленных сточных вод и др.
Использование растворов гипохлорита натрия для дезинфекции воды плавательных бассейнов и прудов позволяет получать чистую прозрачную воду, лишенную водорослей и бактерий. При обработке бассейнов растворами гипохлорита натрия необходимо тщательно контролировать содержание активного хлора в воде
Содержание остаточного хлора в воде плавательных бассейнов должно находиться на уровне 0,3-0,5 мг/дм3. Надежное обеззараживание в течение 30 мин. обеспечивают растворы, содержащие 0,1-0,2% гипохлорита натрия. При этом содержание активного хлора в зоне дыхания не должно превышать 0,1 мг/дм3 в публичных плавательных бассейнах и 0,03 мг/м3 в спортивных плавательных бассейнах. Замена газообразного хлора гипохлоритом натрия приводит к снижению выделения хлора в воздух, и, кроме того, позволяет легче поддерживать остаточное количество активного хлора в воде.
Использование растворов гипохлорита натрия для обработки питьевой воды предпочтительно на стадии предварительного окисления и для стерилизации воды перед подачей ее в распределительную сеть. Обычно в систему водоочистки растворы гипохлорита натрия вводят после разбавления примерно в 100 раз. При этом, помимо снижения концентрации активного хлора, снижается также величина Ph (c 12-13 до 10-11), что способствует повышению дезинфицирующей способности раствора.
Гипохлорит натрия широко применяется: для обработки бытовых и промышленных сточных вод; для разрушения животных и растительных микроорганизмов; устранения запахов; обезвреживания промышленных стоков, в том числе содержащих цианистые соединения. Он может быть использован также для обработки воды, содержащей аммоний, фенолы и гуминовые вещества.
Гипохлорит натрия также используется для обезвреживания промышленных стоков от цианистых соединений; для удаления из сточных вод ртути и для обработки охлаждающей конденсаторной воды на электростанциях.
Основные свойства гипохлорита натрия:
Гипохлорит натрия (натриевая соль хлорноватистой кислоты) – NaClO, получают хлорированием водного едкого натра (NaOH). Промышленностью выпускается в виде водных растворов различной концентрации. Малоконцентрированные растворы гипохлорита натрия получают электролизом раствора хлорида натрия (NaCl) в специальных электрохимических установках, как правило, непосредственно у потребителя.
Водные растворы гипохлорита натрия стали использоваться для дезинфекции с самого зарождения хлорной промышленности. Благодаря высокой антибактериальной активности и широкому спектру действия на различные микроорганизмы, это дезинфицирующее средство находит применение во многих направлениях человеческой деятельности.
Дезинфицирующее действие гипохлорита натрия основано на том, что при растворении в воде он точно так же, как хлор, образует хлорноватистую кислоту, которая оказывает непосредственное окисляющее и дезинфицирующее действие.
NaClO + H2O→← NaOH + HClO
Существуют растворы гипохлорита натрия различных марок.
Основные физико-химические показатели растворов гипохлорита натрия, выпускаемых в РФ:
| Наименование показателя | Норма для марок | ||||||
| По [3] | По [4] | ||||||
| Марка А | Марка Б | Марка А | Марка Б | Марка В | Марка Г | Марка Э | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 1. Внешний вид | Жидкость зеленовато-желтого цвета | Бесцветная жидкость | |||||
| 2. Коэффициент светопропускания, %, не менее | 20 | 20 | Не регламентируется | ||||
| 3. Массовая концентрация активного хлора, г/дм 3, не менее | 190 | 170 | 120 | 120 | 190 | 120 | 7 |
| 4. Массовая концентрация щелочи в пересчете на NaOH, г/дм 3, не менее | 10-20 | 40-60 | 40 | 90 | 10-20 | 20-40 | 1 |
| 5. Массовая концентрация железа, г/дм 3, не более | 0,02 | 0,06 | 120 | ||||
Растворы гипохлорита натрия различных марок применяют:
- раствор марки А по [3] – в химической промышленности, для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки;
- раствор марки Б по [3] – в витаминной промышленности, как окислитель;
- раствор марки А по [4] – для обеззараживания природных и сточных вод в хозяйственно-питьевом водоснабжении, дезинфекции воды рыбохозяйственных водоемов, в пищевой промышленности, для получения отбеливающих средств;
- раствор марки Б по [4] – для дезинфекции территорий, загрязненных фекальными сбросами, пищевыми и бытовыми отходами; обеззараживания сточных вод;
- раствор марки В, Г по [4] – для дезинфекции воды рыбохозяйственных водоемов;
- раствор марки Э по [4] – для дезинфекции аналогично марке А [4], а также дезинфекции в медико-санитарных учреждениях, предприятиях общественного питания, санаториях, детских учреждениях, бассейнах, объектах ГО и др., а также обеззараживания питьевой воды, стоков, отбеливания.
Необходимо отметить, что для изготовления растворов гипохлорита натрия марок А и Б по [3] и растворов марки А по [4] не допускается применение абгазного хлора от хлоропотребляющих органических и неорганических производств, а также едкого натра, полученного ртутным методом.
Растворы марки Б по [4] получают из абгазного хлора органических и неорганических производств и диафрагменного или ртутного едкого натра.
Растворы марок В и Г по [4] получают из абгазного хлора стадии сжижения производства хлора и диафрагменного едкого натра с добавлением стабилизирующей добавки — цитраля сорта ”Парфюмерный” по [5]. Растворы марки Э по [4] получают электролизом раствора поваренной соли.
waterhim.ru
Раствор гипохлорита натрия.
Rp: sol. Natrii hypochloridi 5%-100 ml
DS для антисептической обработки к/к
Раствор перекиси водорода.
Rp.: Sol. Hydrogenii peroxydi 3%-50 ml
D.S. По 1 ст. ложке на ½ стакана воды для обработки полости рта
Патогенез хронического периодонтита
Реакция тканей периодонта на раздражающее действие АГ, поступающих из корневой системы может проявиться 2 типами реакций:
1.АТ-зависимой (иммунологическая типа Артюса и иммунологическая Ig E –обусловленная).
2. Клеточнообусловленной – гиперчувствительность замедленного типа (ГЗТ).
Развитие иммунологических реакций
Для развития иммунокомплексной реакции при периодонтите необходимо:
— наличие плохофагоцитируемых имунных комплексов
— система комплемента
— большое количество полиморфноядерных лейкоцитов
Эта реакция имеет значение в развитии остеопороза в периапикальных тканях вследствие активации макрофагальной и остеокластической реакции.
Хронический гранулематозный периодонтит.
Клиника: жалобы больные не предъявляют. Или жалуются на болезненность при пальпации десны в области проекции верхушки корня пораженного зуба, припухлость в этой области. В прошлом — боли, проходящие либо послеюлечения, либо самостоятельно, и затрудненное пережевывание пищи. Объективно: коронка зуба в цвете изменена. Определяется глубокая кариозная полость. Зондирование корневого канала безболезненно. Корневая пульпа некротизированна и может иметь зловонный гнойный экссудат. Перкуссия (вертикальная) может быть умеренно болезненна. При этом возможно при гориз перкуссии наличие симптома «дрожания корня» (Heuser), которое ощущается указательным пальцем у верхушки корня зуба при перкуссии. Термртест отриц.При осмотре слизистой десны в проекции верхушки пораженного зуба может быть слегка отечна или наблюдаться свищи, что указывает на резорбцию костной стенки альвеолы пораженного зуба, через которые происходит периодическая эвакуация содержимого гранулемы. ЭОД — 100 мкА.
Рентгенологически: хроническцй гранулематозный периодонтит проявляется четким ограниченным просветлением в области верхушки пораженного зуба. Очертания могут быть различной величины от небольших размеров до 5 — 7 мм, правильной округлой формы. В случае нагноения патологического очага его очертания становятся менее четкими, переходящие в узкие полоски с нарушением структуры костных балок.
Пат.анатомия хронического гранулематозного периодонтита
Гранулема (d до 5мм)
— простая – очаг грануляционной ткани, ограниченный плотной соединительнотканной оболочкой
— эпителиальная – гранулема, содержащая эпителиальные клетки
Кистогранулема (d 5-8мм) – гранулема, имеющая в центре полости, выстланные эпителием)
Киста (d более 8мм) Киста — однокамерное образование с жидким содержимым. Оболочка кисты состоит из 2 слоев:
— эпителиального, обращенного в просвет полости
— соединительнотканный, окружающий кисту снаружи.
Полость кисты заполнена прозрачной жидкостью, содержащей кристаллы холестерина, мутнеющая при нагноении.
Жалобы при корневой кисте
Обычно отсутствуют Неприятные ощущения при жевании
Возможно выпячивание кости в области переходной складки при кистах больших размеров
Чувства парестезии половины нижней губы при кистах нижних премоляров
Объективно:
Цвет зуба изменен Коронка разрушена Веерообразное расхождение зубов
Десна нормального цвета Зондирование безболезненно
При удалении распада из корневых каналов может выделяться желтоватая жидкость
Перкуссия безболезненна При пальпации переходной складки может ощущаться податливость костной пластинки и характерная крепитация – симптом «пергаментного хруста» (по Dupuytren), что связано с сильным истончением кости
Rh – округлое или овальное полое образование d более 8мм, в которую погружен корень зуба
studfiles.net
ГОСТ 11086-76 Гипохлорит натрия. Технические условия
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ГИПОХЛОРИТ НАТРИЯ
Технические условия
ГОСТ 11086-76
ИПК ИЗДАТЕЛЬСТВО СТАНДАРТОВ
Москва
Содержание
|
1. МАРКИ И ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ 1 a. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ 2. ПРАВИЛА ПРИЕМКИ 3. МЕТОДЫ АНАЛИЗА 3.1. Отбор проб 3.3. Определение коэффициента светопропускания 3.4. Определение массовой концентрации активного хлора 3.5. Определение массовой концентрации щелочи в пересчете на NaOH 3.6. Определение массовой концентрации железа 4. УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ |
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
ГИПОХЛОРИТ НАТРИЯ Технические условия Sodium hypochlorite . Specifications |
ГОСТ 11086-76 |
Дата введения 01.07.77
Настоящий стандарт распространяется на гипохлорит натрия (хлорноватистокислый натрий), получаемый хлорированием водного раствора едкого натра.
Формула NaClO .
Молекулярная масса (по международным атомным массам 1985 г.) — 74,44.
Требования настоящего стандарта являются обязательными, кроме пп. 2 и 5 таблицы технических требований.
(Измененная редакция, Изм. № 2).
1.1а. Гипохлорит натрия должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
(Введен дополнительно, Изм. № 1).
1.1. В зависимости от назначения гипохлорит натрия выпускают марок А и Б.
Гипохлорит натрия марки А применяется в химической промышленности для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки, марки Б — в витаминной промышленности как окислитель и для отбеливания ткани.
Для изготовления гипохлорита натрия не допускается применение абгазного хлора от хлорпотребляющих органических и неорганических производств, а также едкого натра, полученного ртутным методом.
(Измененная редакция, Изм. № 1).
1.2. По физико-химическим показателям гипохлорит натрия должен соответствовать нормам, указанным в таблице.
|
Наименование показателя |
Норма для марок |
|
|
A |
B |
|
|
1. Внешний вид |
Жидкость зеленовато-желтого цвета |
|
|
2. Коэффициент светопропускания, %, не менее |
20 |
20 |
|
3. Массовая концентрация активного хлора, г/дм3, не менее |
190 |
170 |
|
4. Массовая концентрация щелочи в пересчете на NaOH , г/дм3 |
10-20 |
40-60 |
|
5. Массовая концентрация железа, г/дм 3, не более |
0,02 |
0,06 |
Примечание. Допускается потеря активного хлора по истечении 10 сут со дня отгрузки не более первоначального содержания и изменение окраски до красновато-коричневого цвета.
(Измененная редакция, Изм. № 1).
1а.1. Гипохлорит натрия является окислителем, вызывающим раздражение кожных покровов и слизистой оболочки. Гипохлорит натрия при попадании на кожу может вызвать ожоги, а при попадании в глаза - слепоту. При нагревании выше 35°С гипохлорит натрия разлагается с образованием хлоратов и выделением кислорода. Слабощелочной раствор довольно устойчив.
(Измененная редакция, Изм. № 2).
1а.2. Гипохлорит натрия негорюч и невзрывоопасен. Однако при контакте с органическими горючими веществами (опилки, ветошь и др.) в процессе высыхания может вызвать их загорание.
1а.3. Производственные помещения должны быть оборудованы приточно-вытяжной вентиляцией. Оборудование должно быть герметичным. Негерметичные узлы оборудования должны быть снабжены местными вентиляционными отсосами.
1а.4. Производственный персонал должен быть обеспечен специальной одеждой и иметь индивидуальные средства защиты: защитные очки, резиновые сапоги, резиновые перчатки, фартук из прорезиненной ткани и противогаз марки В или ВКФ ( ГОСТ 12.4.121-83).
(Измененная редакция, Изм. № 2).
1а.5. Гипохлорит натрия не допускается хранить вместе с органическими продуктами, горючими материалами и кислотами.
1а.6. При попадании гипохлорита натрия на кожные покровы необходимо обмывать их обильной струей воды в течение 10-12 мин. При попадании брызг продукта в глаза следует немедленно промыть их обильным количеством воды и направить пострадавшего к врачу.
1а.7. В случае загорания — тушить водой, песком, углекислотными огнетушителями.
1а.8. Разлившийся гипохлорит натрия смыть водой.
Разд. 1а. (Введен дополнительно, Изм. № 1).
2.1. Гипохлорит натрия принимают партиями. Партией считают количество продукта, однородное по своим качественным показателям и сопровождаемое одним документом о качестве.
Каждую цистерну или контейнер гипохлорита натрия принимают за партию.
Документ должен содержать:
наименование предприятия-изготовителя или его товарный знак;
наименование продукта, его марку;
номер партии;
дату изготовления;
массу брутто и нетто;
результаты проведенных анализов или подтверждение о соответствии качества продукта требованиям настоящего стандарта;
шифр группы по ГОСТ 19433;
обозначение настоящего стандарта.
2.2. Для контроля качества гипохлорита натрия на соответствие его показателей требованиям настоящего стандарта от партии отбирают выборку — 10 % упаковочных единиц, но не менее трех, или каждую цистерну, контейнер.
Допускается у изготовителя отбор проб из хранилища, в котором находился гипохлорит натрия до заполнения цистерн, контейнеров и бочек.
2.3. Коэффициент светопропускания и массовую концентрацию железа изготовитель определяет по требованию потребителя.
2.1 — 2.3. (Измененная редакция, Изм. № 1).
2.4. При получении неудовлетворительных результатов анализа хотя бы по одному из показателей проводят повторный анализ на удвоенной выборке или вновь отобранной пробе из цистерны, контейнера, хранилища.
Результаты повторного анализа распространяются на всю партию.
(Введен дополнительно, Изм. № 1).
3.1. Отбор проб
3.1.1. Точечные пробы отбирают пробоотборником из винипласта или полиэтилена из верхней, нижней и средней части цистерны или контейнера или хранилища.
При температуре минус 10°С возможно выпадение кристаллов пятиводного гипохлорита натрия. Поэтому при отборе проб из железнодорожной цистерны или контейнера необходимо тщательное перемешивание азотом или воздухом.
Перед отбором проб из бочек содержимое их перемешивают.
3.1.2. Точечные пробы соединяют, перемешивают и отбирают среднюю пробу объемом не менее 500 см3. Среднюю пробу помещают в чистую сухую стеклянную банку из темного стекла или бесцветного стекла со светозащитным покрытием, с притертой пробкой. На банку наклеивают этикетку с указанием:
наименования продукта, его марки;
номера партии;
места и даты отбора пробы;
фамилии пробоотборщика.
На этикетку должна быть нанесена надпись «Едкое вещество».
3.2. Внешний вид продукта определяют визуально в пробирке типа П1 по ГОСТ 25336 диаметром 30 мм.
3.3. Определение коэффициента светопропускания
3.3.1. Аппаратура
Фотоэлектроколориметр любой марки.
Воронка фильтрующая типа ВФ по ГОСТ 25336 исполнения 1 или 2 ПОР 16.
3.1.1.-3.3.1. (Измененная редакция, Изм. № 1).
3.3.2. Проведение анализа
На фотоэлектроколориметре определяют коэффициент светопропускания анализируемого продукта по отношению к контрольному раствору, используя кювету с толщиной поглощающего свет слоя 20 мм и светофильтр длиной волны 630-690 нм.
В качестве контрольного раствора используют анализируемый продукт, профильтрованный через фильтрующую воронку.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 2 %, при доверительной вероятности Р = 0,95.
Допускаемая абсолютная суммарная погрешность результатов определения ±1,4 % при доверительной вероятности Р = 0,95.
(Измененная редакция, Изм. № 1, 2).
3.4. Определение массовой концентрации активного хлора
3.4.1. Аппаратура, реактивы, растворы
Бюретка исполнения 1 или 3 вместимостью 50 см3
Колба коническая типа Кн по ГОСТ 25336 исполнения 1 или 2 вместимостью 250 см3.
Колба мерная по ГОСТ 1770 исполнения 1 или 2 вместимостью 250 см3.
Пипетка исполнения 2 вместимостью 10 см3.
Цилиндр мерный по ГОСТ 1770 исполнения 1 или 3 вместимостью 25 см3.
Термометр любого типа с пределом измерения от 0 до 100°С.
Вода дистиллированная по ГОСТ 6709 или вода эквивалентной чистоты.
Калий йодистый, раствор с массовой долей 10%, готовят по ГОСТ 4517.
Кислота серная, раствор концентрации c (1/2 H 2 SO 4 ) = 1 моль/дм3, готовят по ГОСТ 25794.1.
Крахмал растворимый, раствор с массовой долей 1 %, готовят по ГОСТ 4517.
Натрий серноватистокислый (тиосульфат натрия), раствор концентрации c ( Na 2 S 2 O 3 ·5Н2О) = 0,1 моль/дм3, готовят по ГОСТ 25794.2.
(Измененная редакция, Изм. № 1, 2).
3.4.2. Проведение анализа
10 см3 гипохлорита натрия температурой (20±2)°С переносят пипеткой в мерную колбу, доводят объем раствора водой до метки и тщательно перемешивают (раствор А).
10 см3 полученного раствора А переносят пипеткой в коническую колбу, прибавляют 10 см3 раствора йодистого калия, перемешивают, прибавляют 20 см3 раствора серной кислоты, вновь перемешивают, закрывают колбу пробкой и помещают в темное место.
Через 5 мин титруют выделившийся йод раствором серноватистокислого натрия до светло-желтой окраски раствора, затем прибавляют 2-3 см3 раствора крахмала и продолжают титрование до обесцвечивания раствора.
(Измененная редакция, Изм. № 1).
3.4.3. Обработка результатов
Массовую концентрацию активного хлора ( X ), г/дм3, вычисляют по формуле:
где V — объем раствора серноватистокислого натрия концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3;
0,003545 — масса активного хлора, соответствующая 1 см3 раствора серноватистокислого натрия концентрации точно 0,1 моль/дм3, г.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 2 г/дм3, при доверительной вероятности Р = 0,95.
Допускаемая абсолютная суммарная погрешность результатов определения ±1,5 г/дм3 при доверительной вероятности Р = 0,95.
(Измененная редакция, Изм. № 1, 2).
3.5. Определение массовой концентрации щелочи в пересчете на NaOH
3.5.1. Аппаратура, реактивы, растворы
Бюретка исполнения 1 или 3 вместимостью 50 см3.
Колба коническая типа Кн по ГОСТ 25336 исполнения 1 или 2 вместимостью 250 см3.
Пипетка исполнения 2 вместимостью 50 см3.
Цилиндр мерный по ГОСТ 1770
исполнения 1 или 3 вместимостью 25 см3.
Вода дистиллированная по ГОСТ 6709 или вода эквивалентной чистоты.
Водорода пероксид (пергидроль) по ГОСТ 10929, раствор с массовой долей 10 %, нейтрализованный по фенолфталеину.
Кислота соляная, раствор концентрации с(НС1) = 0,1 моль/дм3, готовят по ГОСТ 25794.1.
Спирт этиловый ректификованный технический по ГОСТ 18300 высшего сорта.
Фенолфталеин, спиртовой раствор с массовой долей 1 %, готовят по ГОСТ 4919.1.
(Измененная редакция, Изм. № 1, 2).
3.5.2. Проведение анализа
50 см3 раствора А, приготовленного по п. 3.4.2, переносят пипеткой в коническую колбу и осторожно небольшими порциями прибавляют 20-25 см3 раствора перекиси водорода, осторожно перемешивая во избежание сильного газовыделения. Через 2-3 мин после прекращения интенсивного газовыделения в колбу прибавляют 2-3 капли фенолфталеина и титруют ее содержимое раствором соляной кислоты до обесцвечивания раствора.
(Измененная редакция, Изм. № 1).
3.5.3. Обработка результатов
Массовую концентрацию щелочи в пересчете на NaOH ( X 1 ), г/дм3, вычисляют по формуле:
где V — объем раствора соляной кислоты концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3;
0,004 — масса гидроокиси натрия, соответствующая 1 см3 раствора соляной кислоты концентрации точно 0,1 моль/дм3, г.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 0,5 г/дм3 при доверительной вероятности Р = 0,95.
Допускаемая абсолютная суммарная погрешность результатов определения ±0,4 г/дм3 при доверительной вероятности Р = 0,95.
(Измененная редакция, Изм. № 1, 2).
3.6. Определение массовой концентрации железа
3.6.1. Аппаратура, реактивы
Колба коническая типа Кн по ГОСТ 25336 исполнения 1 или 2 вместимостью 100 см3.
Колба мерная по ГОСТ 1770 исполнения 1 или 2 вместимостью 50 см3.
Пипетки исполнения 2 вместимостью 10 и 25 см3.
Цилиндр мерный по ГОСТ 1770 исполнения 1 или 3 вместимостью 10 см3.
Кислота соляная по ГОСТ 3118.
Электроплитка любой марки.
3.6.2. Проведение анализа
25 см3 (для гипохлорита натрия марки А) и 10 см3 (для гипохлорита натрия марки Б) раствора А, приготовленного по п. 3.4.2, переносят пипеткой в коническую колбу, осторожно приливают 1-1,5 см3 соляной кислоты и кипятят на электроплитке в течение 5 мин.
Затем раствор охлаждают, количественно переносят в мерную колбу и далее анализ проводят по ГОСТ 10555 сульфосалициловым методом, не прибавляя раствор соляной кислоты к анализируемому раствору.
3.6 — 3.6.2. (Измененная редакция, Изм. № 1).
3.6.3. Обработка результатов
Массовую концентрацию железа ( X 2 ), г/дм3, вычисляют по формуле:
где m — масса железа, найденная по градуировочному графику, мг;
V — объем раствора продукта, взятый для анализа, см3.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 0,005 г/дм3, при доверительной вероятности Р = 0,95.
Допускаемая абсолютная суммарная погрешность результатов определения ±0,004 г/дм3 при доверительной вероятности Р = 0,95.
(Измененная редакция, Изм. № 1, 2).
4.1. Гипохлорит натрия заливают в специальные цистерны грузоотправителя (грузополучателя), стальные гуммированные, полиэтиленовые или из стеклопластика контейнеры, принадлежащие потребителю.
По требованию потребителей допускается заливать гипохлорит натрия в полиэтиленовые бочки вместимостью 50 — 200 дм3, принадлежащие потребителю.
(Измененная редакция, Изм. № 1, 2).
4.2. Крышки люков контейнеров должны быть оборудованы воздушником для сброса выделяющегося в процессе распада кислорода.
4.3. Цистерны, контейнеры и бочки должны быть заполнены на 90 % объема.
4.4. Наливные люки цистерн и контейнеров должны быть уплотнены резиновыми прокладками.
4.5. Контейнеры и бочки перед заполнением должны быть промыты.
4.2 — 4.5. (Измененная редакция, Изм. № 1).
4.6. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозки грузов, действующими на железнодорожном транспорте.
Транспортная маркировка — по ГОСТ 14192 с нанесением манипуляционного знака «Беречь от нагрева».
Маркировка, характеризующая транспортную опасность груза, с нанесением знака опасности по ГОСТ 19433 (класс 8, подкласс 8.2, черт. 8, классификационный шифр 8283) и серийного номера ООН 1791.
(Измененная редакция, Изм. № 2).
4.7. Маркировка, характеризующая упакованную продукцию, должна быть нанесена на каждую бочку или ярлык, прикрепляемый к бочке, и содержать следующие данные:
наименование предприятия-изготовителя и его товарный знак;
наименование продукта и его марку;
надпись «Не пригоден для обеззараживания питьевой воды и воды плавательных бассейнов» на бочки с гипохлоритом натрия марки Б;
номер партии и дату изготовления;
обозначение настоящего стандарта.
(Измененная редакция, Изм. № 1, 2).
4.8. Гипохлорит натрия транспортируют железнодорожным и автомобильным транспортом в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта. Гипохлорит натрия в цистерне транспортируют по железной дороге, в контейнерах и бочках — автомобильным транспортом.
4.9. Полиэтиленовые бочки с продуктом устанавливают в кузове автомобиля горловинами вверх, не более чем в два яруса, перестилом из досок между ярусами и надежно закрепляют.
4.10. Гипохлорит натрия хранят в специальных гуммированных или покрытых коррозионностойкими материалами емкостях, защищенных от солнечного света.
Полиэтиленовые бочки с продуктом хранят в закрытых складских неотапливаемых помещениях.
4.8-4.10. (Измененная редакция, Изм. № 1).
Разд. 5. (Исключен, Изм. № 1).
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 24.05.76 № 1265
3. ВЗАМЕН ГОСТ 11086-64, ГОСТ 5.2150-74
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссылка |
Номер пункта |
|
ГОСТ 12.4.121-83 |
1а.4 |
|
ГОСТ 1770-74 |
3.4.1; 3.5.1; 3.6.1 |
|
ГОСТ 3118-77 |
3.6.1 |
|
ГОСТ 4517-87 |
3.4.1 |
|
ГОСТ 4919.1-77 |
3.5.1 |
|
ГОСТ 6709-72 |
3.4.1; 3.5.1 |
|
ГОСТ 10555-75 |
3.6.2 |
|
ГОСТ 10929-76 |
3.5.1 |
|
ГОСТ 14192-96 |
4.6 |
|
ГОСТ 18300-87 |
3.5.1 |
|
ГОСТ 19433-88 |
2.1; 4.6 |
|
ГОСТ 25336-82 |
3.2; 3.3.1; 3.4.1; 3.5.1; 3.6.1 |
|
ГОСТ 25794.1-83 |
3.4.1; 3.5.1 |
|
ГОСТ 25794.2-83 |
3.4.1 |
5. Ограничение срока действия снято Постановлением Госстандарта СССР от 21.11.91 № 1780
6. ИЗДАНИЕ (ноябрь 2003 г.) с Изменениями № 1, 2, утвержденными в марте 1986 г., ноябре 1991 г. (ИУС 7-86, 2-92)
Еще документы скачать бесплатно
www.gosthelp.ru
Гипохлорит натрия | Метод получения, сфера применения, свойства и преимущества, инструкция по использованию – на промышленном портале Myfta.Ru
 Химическое соединение гипохлорит натрия получают хлорированием, растворенного в воде едкого натра, применяя для этого хлор в газообразном состоянии или используя электролиз раствора хлористого натрия, и называют еще натрий хлорноватистокислый. Это соединение отличается неустойчивостью в свободном состоянии, поэтому принято его использовать в водном растворе.
Химическое соединение гипохлорит натрия получают хлорированием, растворенного в воде едкого натра, применяя для этого хлор в газообразном состоянии или используя электролиз раствора хлористого натрия, и называют еще натрий хлорноватистокислый. Это соединение отличается неустойчивостью в свободном состоянии, поэтому принято его использовать в водном растворе.
Содержание в нем 95% хлора в активном виде, о чем свидетельствует формула гипохлорит натрия NaOCl, придает соединению сильные окислительные, дезинфицирующие и антисептические качества, которые определяют сферы его применения. В промышленности и быту применяется, как отбеливатель и дезинфицирующее средство, в водоснабжении, как средство обеззараживания и очистки воды, в химической промышленности, как окислитель во многих производственных процессах.
Сфера применения гипохлорит натрия, значительно шире, недаром он нашел применение и в медицине, как стерилизующее и бактерицидное средство, для тех же целей широко применяется в сельском хозяйстве и пищевой промышленности. Помимо свойств используемых человеком в свое благо, есть свойства гипохлорит натрия, которые создают определенные проблемы. К ним относятся:
- с течением времени в процессе хранения он теряет свою концентрацию, при этом велика вероятность выделения газообразных веществ. Кислород один из них. Поэтому сроки хранения должны быть минимальными и при этом не желателен контакт с металлами, и соблюдение низкотемпературного режима хранения;
- возрастание в 2-3 раза стоимости, в сравнении с отпускной стоимостью производителя, при транспортировке к месту назначения;
- присутствие его в воде с повышенным процентным содержанием солей магния и кальция, вызывает отложения гидроксидов и карбонатов, приводящие к проблемам обслуживания запорной арматуры и трубопроводов;
- раствор с концентрацией около 19% чрезвычайно агрессивен из-за содержания хлора и высокого рН, поэтому необходимо строгое соблюдение техники безопасности.
Существует инструкция к гипохлориту натрия и кальция, от 25 ноября 1971 г.№ 942а—71 для безопасного использования его в целях дезинфекции. В начале, в ней изложены сведения о техническом гипохлорите натрия, о существовании трех марок выпуска (А, Б и В), внешнему виду, содержании хлора, посуды и емкостях для хранения и транспортировки и условиях хранения. Далее рассказывается о применении растворов и способах использования, в зависимости от обрабатываемых предметов, объектов, и поверхностей.
Также приведены меры по мерам профилактики и личной безопасности, как и какими средствами индивидуальной защиты надо пользоваться. Приводится рецептура и нужные процентные соотношения, для приготовления рабочих растворов.
В целях повышения мер безопасности, следует учитывать, что электрохимический метод получения гипохлорита позволяет получать наиболее чистый продукт. Поэтому класс опасности гипохлорита, полученного электролизным способом, по степени воздействия его на человека, выражается цифрой 4, как самый высокий.
Самым распространенным веществом для обработки воды в мире, пока остается хлор, так как, он является дезинфектором длительного действия, и его наличие в воде, делает невозможным, ее повторное заражение на дальнейших стадиях водоснабжения. Но, применение жидкого хлора, имеет ряд серьезных недостатков, в виде опасностей, которые может представлять сбой хлор, при нештатных ситуациях.
Поэтому при использовании жидкого хлора, требуется строгое выполнение Правил по производству, транспортированию, хранению и потреблению хлора (ПБ 09-594-03), а это обуславливает затратный характер мероприятий по обеспечению безопасности, стоимость которых, превышает затраты на хлорирование само по себе.
 Тем не менее, обеззараживание воды гипохлоритом натрия, является неплохой альтернативой жидкому хлору. В последнее время, он становится самым предпочтительным реагентом обеззараживания воды для нужд населения. Причиной для такой замены, стали явные технологические преимущества, более безопасные условия использования и применения гипохлорита в виде водного раствора, по сравнению с жидким хлором.
Тем не менее, обеззараживание воды гипохлоритом натрия, является неплохой альтернативой жидкому хлору. В последнее время, он становится самым предпочтительным реагентом обеззараживания воды для нужд населения. Причиной для такой замены, стали явные технологические преимущества, более безопасные условия использования и применения гипохлорита в виде водного раствора, по сравнению с жидким хлором.Преимуществом так же является, то, что при использовании и хранении реагента отсутствует образование хлора в газообразном виде, существует возможность автоматизации процесса дозирования, либо с использованием расходомера (процесс без обратной связи), либо с использованием прибора, определяющего содержание реагента (процесс с обратной связью). Немаловажным является возможность использования, помещений и оборудования, которые применялись ранее для хлорирования.
Применяемый реагент отличается небольшими концентрациями около 15% активного хлора, что позволяет минимизировать размеры и сложность оборудования для его нейтрализации. В товарном гипохлорите содержится свободная щелочь 40-60 г/дм3, что при использовании коагулянтов со свободной кислотой, улучшаются условия обработки питьевой воды, при чем сокращаются затраты на подщелачивание воды.
Раствор реагента не так опасен при транспортировке, что позволяет перевозить его на всех видах транспорта. Применяя вместо жидкого хлора, раствор гипохлорита натрия, практически, получаем ту же качественную характеристику питьевой воды.
Тот факт, что появляется возможность размещать склады хранения реагента рядом с блоками по очистке и обеззараживанию, а не на удаленных площадках, как при хлорировании. Значительно улучшает оперативность контроля технологических процессов, и не создает условий для предпосылок, возникновения аварийных ситуаций масштабного характера, которые могли бы иметь место при использовании жидкого хлора.
 Существуют проектные решения, полной автоматизации технологических операций обеззараживания питьевой воды, в которых дозирование реагента происходит автоматически. АСУ ТП при этом осуществляет непрерывный контроль над параметрами, позволяющими управлять процессом, поддерживая текущие значения показателей в рамках регламента.
Существуют проектные решения, полной автоматизации технологических операций обеззараживания питьевой воды, в которых дозирование реагента происходит автоматически. АСУ ТП при этом осуществляет непрерывный контроль над параметрами, позволяющими управлять процессом, поддерживая текущие значения показателей в рамках регламента.Предусматривается полный комплекс мероприятий исключающих аварийную разгерметизацию системы, а также устранения выбросов веществ, представляющих угрозу окружающей среде и населению. Проработана система защиты персонала эксплуатирующего систему.
В пищевой промышленности также широко применяется раствор гипохлорита натрия.
Институт биологических исследований во французском Дижоне, еще в начале восьмидесятых годов, изучая дезинфицирующие средства, которые применяются в пищевой промышленности, пришел к выводу, что гипохлорит натрия оказывается наиболее пригодным и самым экономичным для этих целей.
Он оказался наиболее эффективным, по своему губительному воздействию почти на все виды спор, бактерий и растительных клеток. В силу этих обстоятельств он распространён в дезинфекции резервуаров, для промывки оборудования, уничтожения бактериофагов в сыроварении, в пивоваренной промышленности. Для этих целей используется раствор с содержанием 30-40 мг/л хлора в активном состоянии.
Являясь отменным антимикробным агентом, гипохлорит натрия также используется и в дезинфицирующих мероприятиях, проводимых в молочной промышленности, для предотвращения инфицирования молочных продуктов различными микроорганизмами. На российских молочных предприятиях в этих целях используется гипохлорит марки А содержащего 170 г/л хлора и 40-60 г/л щелочи. Недостатком является высокое коррозирующее воздействие на металлические поверхности оборудования.
В 2005 году было подсчитано, что глобальное мировое производство, составило более одного миллиона тонн гипохлорита натрия, и половина его была использована в бытовых нуждах, а другая половина в промышленных целях
Ваш бизнес связан с потреблением или производством гипохлорита натрия? Тогда на страницах нашего сайта в разделе с соответствующими каталогами вы можете найти ближайшего к себе производителя или потребителя, и тем самым снизить затраты на транспортировку.
Россия, как производитель гипохлорит натрия занимает одно из ведущих мест в мировом производстве этого реагента. Самыми крупными предприятиями по выпуску товарного гипохлорита натрия являются:
- ЗАО Каустик в Стерлитамаке;
- ОАО Каустик в Волгограде;
- ООО Сода-хлорат в Березниках;
- ООО Новомосковский хлор в Новомосковске.
myfta.ru
Гипохлорит натрия — это… Что такое Гипохлорит натрия?
| Гипохлорит натрия | |
| Общие | |
|---|---|
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода[К 1] |
| Химическая формула | NaOCl |
| Эмпирическая формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574[1] г/см³; 1,1[2] г/см³ |
| Термические свойства | |
| Температура плавления | NaOCl · 5H2O[К 2]: 24,4 °C; NaOCl · 2,5H2O: 57,5[3] °C |
| Температура разложения | 5%-й раствор[2]: 40 |
| Энтальпия образования (ст. усл.) | пентагидрат[К 3]: − 350,4[3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4[4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9[4] |
| Классификация | |
| Рег. номер CAS | 7681-52-9 |
| Регистрационный номер EC | 231-668-3 |
| RTECS | Nh4486300 |
Гипохлори́т на́трия (натрий хлорноватистокислый) — NaOCl[К 4], неорганическое соединение, натриевая соль хлорноватистой кислоты. Тривиальное (историческое) название водного раствора соли — «лабарракова вода» или «жавелевая вода»[К 1].
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Соединение — сильный окислитель, содержит 95,2 % активного хлора[К 5]. Обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве.
По мнению издания The 100 Most Important Chemical Compounds (Greenwood Press, 2007)[2], гипохлорит натрия входит в сотню самых важных химических соединений.
История открытия
В 1774 году шведским химиком Карлом Вильгельмом Шееле был открыт хлор[5]. Спустя 11 лет в 1785 году (по другим данным — в 1787 году[2]), другой химик, француз Клод Луи Бертолле, обнаружил, что водный раствор этого газа (см. уравнение (1)) обладает отбеливающими свойствами[6][К 6].
Небольшое Парижское предприятие Societé Javel, открытое в 1778 году на берегах Сены и возглавляемое Леонардом Альбаном (англ. Leonard Alban), адаптировало открытие Бертолле к промышленным условиям и начало выпуск белильной жидкости, растворяя газообразный хлор в воде. Однако получаемый продукт был очень нестабильным, поэтому в 1787 году процесс был модифицирован. Хлор стали пропускать через водный раствор поташа (карбоната калия) (см. уравнение (2)), в результате чего образовывался стабильный продукт, обладающий высокими отбеливающими свойствами. Альбан назвал его «Eau de Javel» («жавелевая вода»). Новый продукт стал моментально популярен во Франции и Англии из-за лёгкости его перевозки и хранения[7].
В 1820 году французский аптекарь Антуан Лабаррак (фр. Antoine Germain Labarraque) заменил поташ на более дешёвую каустическую соду (гидроксид натрия) (см. уравнение (3)). Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» («лабарракова вода»). Он стал широко использоваться для отбеливания и дезинфекции[7].
Несмотря на то, что дезинфицирующие свойства гипохлорита были обнаружены в первой половине XIX века, использование его для обеззараживания питьевой воды и очистки сточных вод началось только в конце века. Первые системы водоочистки были открыты в 1893 году в Гамбурге[2]; в США первый завод по производству очищенной питьевой воды появился в 1908 году в Джерси-Сити[8].
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C)[9].
У соединения известно три кристаллогидрата:
- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом[3].
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C[3].
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой белые (по другим данным — бледно-зелёные[10]) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 грамм воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения[3]. Температура плавления: 24,4 °C (по другим данным: 18 °C[10]), при нагревании (30—50 °C) разлагается[1].
Плотность водного раствора гипохлорита натрия при 18 °C[11]:
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций[12]:[стр. 458]:
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе[13]:
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
Самопроизвольное разложение медленно происходит даже при комнатной температуре: за 40 суток пентагидрат (NaOCl · 5H2O) теряет 30 % активного хлора[К 5][13]. При температуре 70 °C разложение безводного гипохлорита протекает со взрывом[14].
При нагревании параллельно происходит реакция диспропорционирования[13]:
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537[13]), гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства[13] (см. раздел «Физиологическое действие и воздействие на окружающую среду»).
Водные растворы гипохлорита натрия неустойчивы и со временем разлагаются даже при обычной температуре (0,085 % в сутки[3]). Распад ускоряет освещение, ионы тяжёлых металлов и хлориды щелочных металлов; напротив, сульфат магния, ортоборная кислота, силикат и гидроксид натрия замедляют процесс; при этом наиболее устойчивы растворы с сильнощелочной средой (pH > 11)[3].
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом[15]:
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования[15]:
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме[15]:
В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH < 3) при комнатной температуре наблюдается распад по следующей схеме[13]:
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Водный раствор гипохлорита натрия — сильный окислитель, вступающий в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды[16].
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде[17][К 7]:
- в кислой среде:
- в нейтральной и щелочной среде:
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
- Иодиды щелочных металлов окисляются до иода (в слабокислой среде), иодата (в нейтральной среде) или периодата (в щелочной среде)[13]:
- См. подробнее подраздел «Производство гидразина».
- Соединения металлов с низшими степенями окисления превращаются в соединения с высшими степенями окисления[18]:[стр. 138, 308][19]:[стр. 200]:
- По аналогии можно осуществить превращения: Fe(II) → Fe(III) → Fe(VI); Co(II) → Co(III) → Co(IV); Ni(II) → Ni(III); Ru(IV) → Ru(VIII); Ce(III) → Ce(IV) и прочие[20].
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Другой вариант — иодкрахмальная реакция в сильнокислой среде и цветная реакция с 4,4’-тетраметилдиаминодифенилметаном или n, n’-диокситрифенилметаном в присутствии бромата калия[21].
Распространённым методом количественного анализа гипохлорита натрия в растворе является потенциометрический анализ методом добавок анализируемого раствора к стандартному раствору (МДА)[К 8] или метод уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору (МУА)[К 9] с использованием бром-ионоселективного электрода (Br-ИСЭ)[22].
Также используется титриметрический метод с использованием иодида калия (косвенная иодометрия)[23].
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные[24]:
| Материал | Концентрация NaOCl, масс. % | Форма воздействия | Температура, °C | Скорость и характер коррозии |
|---|---|---|---|---|
| Алюминий | — | твёрдый, влажный | 25 | > 10 мм/год |
| 10; pH>7 | водный раствор | 25 | > 10 мм/год | |
| Медь | 2 | водный раствор | 20 | < 0,08 мм/год |
| 20 | водный раствор | 20 | > 10 мм/год | |
| Медные сплавы: БрА5, БрА7, Л59, Л63, Л68, Л80, ЛО68-1 | 10 | водный раствор | 20 | > 10 мм/год |
| Никель | < 34 | водный раствор | 20 | 0,1—3,0 мм/год |
| Никелевый сплав НМЖМц28-2,5-1,5 | < 34; активный хлор: 3 | водный раствор | 20 | 0,007 мм/год |
| Никелевый сплав Н70МФ | < 34 | водный раствор | 35—100 | < 0,004 мм/год |
| Платина | < 34 | водный раствор | < 100 | < 0,1 мм/год |
| Свинец | < 34; активный хлор: 1 | водный раствор | 20 | 0,54 мм/год |
| 40 | 1,4 мм/год | |||
| Серебро | < 34 | водный раствор | 20 | < 0,1 мм/год |
| Сталь Ст3 | — | твёрдый, безводный | 25—30 | < 0,05 мм/год |
| 0,1; pH > 10 | водный раствор | 20 | < 0,1 мм/год | |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Сталь 12Х17, 12Х18Н10Т | 5 | водный раствор | 20 | > 10,0 мм/год |
| Сталь 10Х17Н13М2Т | < 34; активный хлор: 2 | водный раствор | 40 | < 0,001 мм/год |
| T кип. | 1,0—3,0 мм/год | |||
| Сталь 06ХН28МДТ | < 34 | водный раствор | 20—T кип. | < 0,1 мм/год |
| Тантал | < 34 | водный раствор | 20 | < 0,05 мм/год |
| Титан | 10—20 | водный раствор | 25—105 | < 0,05 мм/год |
| 40 | водный раствор | 25 | < 0,05 мм/год | |
| Цирконий | 10 | водный раствор | 30—110 | < 0,05 мм/год |
| 20 | водный раствор | 30 | < 0,05 мм/год | |
| Чугун серый | < 0,1; pH > 7 | водный раствор | 25 | < 0,05 мм/год |
| > 0,1 | водный раствор | 25 | > 10,0 мм/год | |
| Чугун СЧ15, СЧ17 | < 34 | водный раствор | 25—105 | < 1,3 мм/год |
| Асбест | 14 | водный раствор | 20—100 | стоек |
| Графит, пропитанный феноло-формальдегидным олигомером | 25 | водный раствор | Т кип. | стоек |
| Полиамиды | < 34 | водный раствор | 20—60 | стоек |
| Поливинилхлорид | < 34 | водный раствор | 20 | стоек |
| 65 | относительно стоек | |||
| Полиизобутилен | < 34 | водный раствор | 20 | стоек |
| 60 | относительно стоек | |||
| 100 | нестоек | |||
| Полиметилметакрилат | < 34 | водный раствор | 20 | стоек |
| Полиэтилен | < 34 | водный раствор | 20—60 | стоек |
| Полипропилен | < 34 | водный раствор | 20—60 | стоек |
| Резина на основе бутилкаучука | 10 | водный раствор | 20—65 | стоек |
| насыщенный | водный раствор | 65 | стоек | |
| Резина на основе натурального каучука | 10—30 | водный раствор | 65 | стоек |
| Резина на основе кремнийорганического каучука | любая | водный раствор | 20—100 | стоек |
| Резина на основе фторкаучука | < 34 | водный раствор | 20—93 | стоек |
| Резина на основе хлоропренового каучука | 20 | водный раствор | 24 | относительно стоек |
| насыщенный | водный раствор | 65 | нестоек | |
| Резина на основе хлорсульфированного полиэтилена | < 34 | водный раствор | 20—60 | стоек |
| Стекло | < 34 | водный раствор | 20—60 | стоек |
| Фторопласт | любая | водный раствор | 20—100 | стоек |
| Эмаль кислотостойкая | любая | водный раствор | < 100 | стоек |
| Т кип. | относительно стоек |
Физиологическое действие и воздействие на окружающую среду
NaOCl одно из лучших известных средств, проявляющих благодаря гипохлорит-иону сильную антибактериальную активность. Он убивает микроорганизмы очень быстро и уже в очень низких концентрациях.
Наивысшая бактерицидная способность гипохлорита проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− приблизительно равны (см. подраздел «Гидролиз и разложение в водных растворах»). Разложение гипохлорита сопровождается образованием ряда активных частиц и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся частицы принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами в их структуре, способными к окислению. Исследованиями установлено, этот процесс аналогичен, тому что происходит естественным образом во всех высших организмах. Некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями[25].
Грибки, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0—0,5%-го раствора NaOCl; при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость спустя 24 часа после воздействия. Более резистентны к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis[К 10] погибает через 30 секунд после обработки 5,25%-м раствором и через 30 минут после обработки 0,5%-м раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia[К 11], погибают в течение 15 секунд после обработки 5,0—0,5%-м раствором NaOCl[26].
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов. В приведённой ниже таблице представлены результаты инактивации токсинов при 30-минутной экспозиции различных концентраций NaOCl («+» — токсин инактивирован; «−» — токсин остался активен)[27]:
На организм человека гипохлорит натрия может оказывать вредное воздействие. Растворы NaOCl могут быть опасны при ингаляционном воздействии из-за возможности выделения токсичного хлора (раздражающий и удушающий эффект). Прямое попадание гипохлорита в глаза, особенно при высоких концентрациях, может вызвать химический ожог и даже привести к частичной или полной потере зрения. Бытовые отбеливатели на основе NaOCl могут вызвать раздражение кожи, а промышленные привести к серьёзным язвам и отмиранию ткани. Приём внутрь разбавленных растворов (3—6 %) гипохлорита натрия приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации разделов желудочно-кишечного тракта[28].
Несмотря на свою высокую химическую активность, безопасность гипохлорита натрия для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы, которые показывают, что вещество в рабочих концентрациях не несёт каких-либо серьёзных последствий для здоровья после непреднамеренного проглатывания или попадания на кожу. Также подтверждено, что гипохлорит натрия не является мутагенным, канцерогенным и тератогенным соединением, а также кожным аллергеном. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку NaOCl, не содержит человеческих канцерогенов[29].
Пероральная токсичность соединения[30]:
- Мыши: ЛД50 (англ. LD50) = 5800 мг/кг;
- Человек (женщины): минимально известная токсическая доза (англ. TDLo) = 1000 мг/кг.
Внутривенная токсичность соединения[30]:
- Человек: минимально известная токсическая доза (англ. TDLo) = 45 мг/кг.
При обычном бытовом использовании гипохлорит натрия распадается в окружающей среде на поваренную соль, воду и кислород. Другие вещества могут образоваться в незначительном количестве. По заключению Шведского института экологических исследований, гипохлорит натрия, скорее всего, не создаёт экологических проблем при его использовании в рекомендованном порядке и количествах[29].
Гипохлорит натрия не представляет угрозы с точки зрения пожароопасности.
Рейтинг NFPA 704 для концентрированных растворов (10—20 %)[31]: [К 12]
Лабораторные методы получения
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия[32]:
Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой[32].
Вместо гидроксида для синтеза можно взять карбонат натрия[33]:
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция[34]:
Промышленное производство
Мировое производство
Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу «in situ», т. е. на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд[2].
Обзор промышленных способов получения
Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.
В современной промышленности существует два основных метода производства гипохлорита натрия:
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:
- основной процесс, где в качестве конечного продукта образуется разбавленный (около 16 % NaOCl) раствор гипохлорита с примесью хлорида и гидроксида натрия;
- низко-солевой или концентрированный процесс — позволяет получить концентрированный (25—40 % NaOCl) с меньшим уровнем загрязнения[36]:[стр. 447—449].
Химический метод
Сущность химического метода получения NaOCl не изменилась с момента его открытия Лабарраком (см. подраздел «История открытия»):
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте[2].
Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке[36]:[стр. 442]:
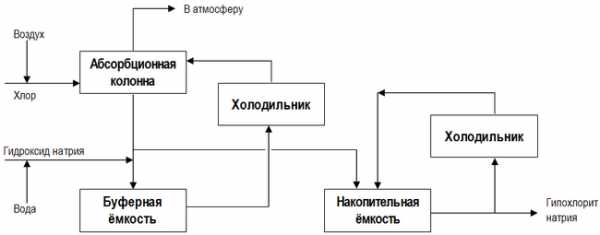
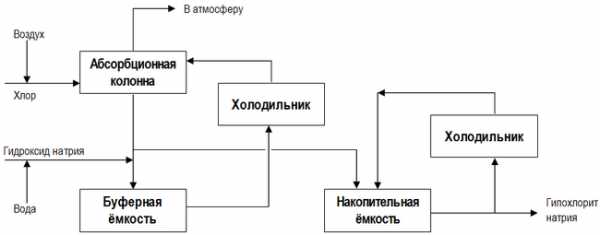
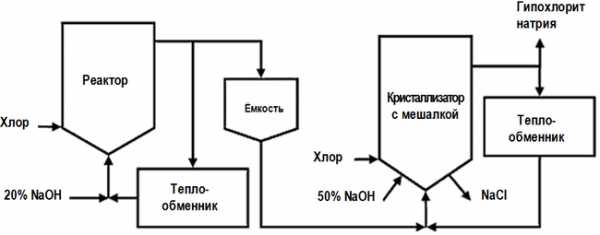
Низкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор (см. на рисунке), где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора[36]:[стр. 450]:
В России товарный гипохлорит натрия производят следующие предприятия:
Электрохимический метод
Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами (бездиафрагменный способ), то есть продукты электролиза свободно смешиваются в электрохимическом процессе[41].
Процесс на аноде:
Процесс на катоде:
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Общая схема процесса:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных[41].
В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec[42].
Система Seaclor® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день[43]. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %[44].
Установки Sanilec® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день[45], концентрация активного хлора составляет 0,05—0,25 %[46].
Характеристика продукции, обращение, хранение и транспортировка
В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 «Гипохлорит натрия. Технические условия». В соответствии с этим документом, по назначению NaOCl делится на две марки, характерист
dic.academic.ru
Гипохлорит натрия — Применение
Химия — Гипохлорит натрия — Применение
01 марта 2011Оглавление:
1. Гипохлорит натрия
2. История открытия
3. Физические свойства
4. Химические свойства
5. Идентификация
6. Коррозионное воздействие
7. Физиологическое действие и воздействие на окружающую среду
8. Лабораторные методы получения
9. Применение
Обзор направлений использования
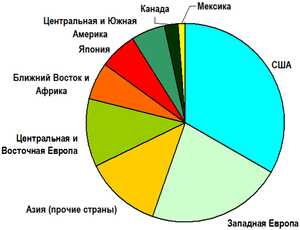
Географическая структура мирового потребления гипохлорита натрия в 2008 году
Среди четырёх неорганических гипохлоритов, имеющих промышленное значение, гипохлорит натрия является безусловным лидером, занимая 91 % мирового рынка; почти 9 % остаётся за гипохлоритом кальция гипохлориты калия и лития имеют незначительные объёмы использования.
Весь широкий спектр использования гипохлорита натрия можно разбить на три условные группы:
- использование для бытовых целей;
- использование для промышленных целей;
- использование в медицине.
Бытовое использование включает в себя:
- использование в качестве средства для дезинфекции и антибактериальной обработки;
- использование для отбеливания тканей;
- химическое растворение санитарно-технических отложений.
Промышленное использование включает в себя:
- промышленное отбеливание ткани, древесной массы и некоторых других продуктов;
- промышленная дезинфекция и санитарно-гигиеническая обработка;
- очистка и дезинфекция питьевой воды для систем коммунального водоснабжения;
- очистка и обеззараживание промышленных стоков;
- химическое производство.
По оценке экспертов SRI Consulting, около 67 % всего гипохлорита натрия используется в качестве отбеливателя и 33 % для нужд дезинфекции и очистки, причём последнее направление имеет тенденцию к росту. Общий глобальный рост объёмов потребления NaOCl оценивается в 1,4 % в год.
Бытовой отбеливатель Clorox
Применение в бытовой химии
Гипохлорит натрия находит широкое применение в бытовой химии и входит в качестве активного ингредиента многочисленных средств, предназначенных для отбеливания, очистки и дезинфекции различных поверхностей и материалов. Обычно, для бытового использования, используется концентрация в диапазоне от 3 до 6 % гипохлорита.
Коммерческая доступность и высокая эффективность действующего вещества определяет его широкое использование различными производственными компаниями, где гипохлорит натрия или средства на его основе выпускаются под различными торговыми марками, некоторые из которых представлены в таблице:
| Торговая марка | Производитель | Назначение | Концентрация NaOCl |
|---|---|---|---|
| Белизна | ОАО «Саянскхимпласт» | Бытовой отбеливатель, пятновыводитель и дезинфицирующее средство | 4 %; 7 % |
| Clorox Regular-Bleach | The Clorox Company | Бытовой отбеливатель, пятновыводитель и дезинфицирующее средство | 6 % |
| Clorox Washing Machine Cleaner | The Clorox Company | Очиститель для стиральных машин | 5—10 % |
| Cascade Complete® with Bleach | Procter & Gamble Company | Средство для автоматических посудомоечных машин | 1—5 % |
| Aquachem Chlorinizor | Sunbelt Chemicals Corp. | Средство для дезинфекции бассейнов | 10 % |
| Brite Bleach | Sunbelt Chemicals Corp. | Бытовой отбеливатель и дезинфицирующее средство | 5,25 % |
| Lysol Bleach Toilet Bowl Cleaner | Reckitt Benckiser | Средство для очистки туалета | 2 % |
| Tiret | Reckitt Benckiser | Средство для устранения засоров труб | нет данных |
| Domestos гель | Unilever | Средство для чистки и дезинфекции | 5 % |
Применение в медицине
Использование гипохлорита натрия для дезинфекции ран впервые было предложено не позднее 1915 года. В современной медицинской практике антисептические растворы гипохлорита натрия используются, в основном, для наружного и местного применения в качестве противовирусного, противогрибкового и бактерицидного средства при обработке кожи, слизистых оболочек и ран. Гипохлорит активен в отношении многих грамположительных и грамотрицательных бактерий, большинства патогенных грибов, вирусов и простейших, хотя его эффективность снижается в присутствии крови или её компонентов.
Низкая стоимость и доступность гипохлорита натрия делает его важным компонентом для поддержания высоких гигиенических стандартов во всём мире. Это особенно ярко проявляется в развивающихся странах, где использование NaOCl стало решающим фактором для остановки холеры, дизентерии, брюшного тифа и других водных биотических заболеваний. Так, при вспышки холеры в странах Латинской Америки и Карибского бассейна в конце XX века благодаря гипохлориту натрия удалось свести к минимуму заболеваемость и смертность, что было сообщено на симпозиуме по тропическим болезням, проводимого под эгидой Института Пастера.
Для медицинских целей в России гипохлорит натрия используется в качестве 0,06%-го раствора для внутриполостного и наружного применения, а также раствора для инъекций. В хирургической практике он применяется для обработки, промывания или дренирования операционных ран и интраоперационной санации плевральной полости при гнойных поражениях; в акушерстве и гинекологии для периоперационной обработки влагалища, лечения бартолинита, кольпита, трихомониаза, хламидиоза, эндометрита, аднексита и т. п.; в оториноларингологии для полосканий носа и горла, закапывания в слуховой проход; в дерматологии для влажных повязок, примочек, компрессов при различных видах инфекций.
В стоматологической практике гипохлорит натрия наиболее широко применяется в качестве антисептического ирригационного раствора в эндодонтии. Популярность NaOCl определяется общедоступностью и дешевизной раствора, а также бактерицидным и противовирусным эффектом в отношении таких опасных вирусов как ВИЧ, ротавирус, вирус герпеса, вирусы гепатита A и B. Имеются данные об использовании гипохлорита натрия для лечения вирусных гепатитов: он обладает широким спектром противовирусных, детоксикационных и антиоксидантных эффектов. Растворы NaOCl можно использовать в целях стерилизации некоторых медицинских изделий, предметов ухода за больными, посуды, белья, игрушек, помещений, твёрдой мебели, сантехнического оборудования. Из-за высокой коррозионной активности, гипохлорит не применяют для металлических приборов и инструментов. Отметим также применение растворов гипохлорита натрия в ветеринарии: они используются для дезинфекции животноводческих помещений.
Промышленное применение
Применение в качестве промышленного отбеливателя
Использования гипохлорита натрия в качестве отбеливателя является одним из приоритетных направлений промышленного использования наряду с дезинфекцией и очисткой питьевой воды. Мировой рынок только в этом сегменте превышает 4 млн тонн.
Обычно, для промышленных нужд в качестве отбеливателя используются водные растворы NaOCl, содержащие 10—12 % действующего вещества.
Гипохлорит натрия широко используется в качестве отбеливателя и пятновыводителя в текстильном производстве и промышленных прачечных и химчистках. Он может быть безопасно использован для многих видов тканей, включая хлопок, полиэстер, нейлон, ацетат, лён, вискозу и другие. Он очень эффективен для удаления следов почвы и широкого спектра пятен в том числе, кровь, кофе, трава, горчица, красное вино и т. д.
Гипохлорит натрия также используется в целлюлозно-бумажной промышленности для отбелки древесной массы. Отбелка с использованием NaOCl обычно следует за этапом хлорирования и является одной из ступеней химической переработки древесины, используемой для достижения высокой степени белизны целлюлозы. Обработку волокнистых полуфабрикатов проводят в специальных башнях гипохлоритной отбелки в щелочной среде, температуре 35—40 °C, в течение 2—3 часов. В течение этого процесса происходит окисление и хлорирование лигнина, а также разрушение хромофорных групп органических молекул.
Применение в качестве промышленного дезинфицирующего средства
Широкое применение гипохлорита натрия в качестве промышленного дезинфицирующего средства связано, прежде всего, со следующими направлениями:
- дезинфекция питьевой воды перед подачей в распределительные системы городского водоснабжения;
- дезинфекция воды плавательных бассейнов и прудов;
- обработка бытовых и промышленных сточных вод, очистка от органических и неорганических примесей;
- в пивоварении, виноделии, молочной промышленности дезинфекция систем, трубопроводов, резервуаров;
- фунгицидная и бактерицидная обработка зерна;
- дезинфекция воды рыбохозяйственных водоёмов;
- дезинфекция технических помещений.
Гипохлорит как дезинфектант входит в состав некоторых средств для поточной автоматизированной мойки посуды и некоторых других жидких синтетических моющих средств.
Промышленные дезинфицирующие и отбеливающие растворы выпускаются многими производителями под различными торговыми марками, некоторые из которых представлены в таблице:
| Торговая марка | Производитель | Назначение | Концентрация NaOCl |
|---|---|---|---|
| Форэкс-Хлор | ДНПК «Альфа» | средство для дезинфекции и санитарной обработки | 4 % |
| Эмовекс | ООО «Макропул Кемиклс» | средство для дезинфекции бассейнов | не менее 130 г/л |
| Bleach Concentratte | Harvard Chemical Company | промышленный отбеливатель | 12,5—15 % |
| Liquid Bleach | Hill Brothers Chemical Co. | промышленный отбеливатель и дезинфектант | 10 %; 12,5 % |
| Clorox Bleach | The Clorox Company | отбеливатель для прачечных | 6,5—7,35 % |
| Poolchlor 1 | Hasa Inc. | жидкость для санитарной обработки бассейнов и спа | 10 % |
Использование для дезинфекции воды
Окислительная дезинфекция с помощью хлора и его производных едва ли не самый распространённый практический метод обеззараживания воды, начало массового использование которого многими странами Западной Европы, США и Россией датируется первой четвертью XX века.
Использование гипохлорита натрия в качестве дезинфицирующего агента в отличие от применения хлора обладает рядом существенных достоинств:
- реагент можно получать электрохимическим методом непосредственно в месте использования;
- достижение необходимых показателей качества питьевой воды достигается за счёт более низкой доли активного хлора;
- концентрация хлорорганических примесей в очищенной воде существенно ниже;
- применение данного вещества позволяет повысить экологическую и гигиеническую безопасность.
Для целей очистки бытовой воды используются разбавленные растворы гипохлорита натрия: типовая концентрация активного хлора в них составляет 0,2—2 мг/л против 1—16 мг/л для газообразного хлора.
Также с технической точки зрения, для условий использования в РФ, эксперты отмечают:
- существенно более высокую безопасность технологии;
- меньшие требования к средствам безопасности;
- данная технология обеззараживания неподведомственна Ростехнадзору РФ.
Использование гипохлорита натрия для дезинфекции воды в России пока не получило широкого применения, но активно внедряется в практику. Так, в конце 2009 года, в Люберцах началось строительство завода по производству NaOCl мощностью 50 тыс. тонн/год для нужд Московского городского хозяйства. Правительством Москвы было принято решение о переводе систем обеззараживания воды московских станции водоподготовки с жидкого хлора на гипохлорит натрия, который завершится ориентировочно в 2012 году.
Среди других российских городов, где применяется или планируется к применению гипохлорит натрия для обеззараживания воды, отметим Санкт-Петербург, Кемерово, Ростов-на-Дону, Иваново, Сыктывкар.
Производство гидразина
Гипохлорит натрия используется в так называемом процесса Рашига основном промышленном способе получения гидразина, открытого немецким химиком Фридрихом Рашигом в 1907 году. Химия процесса выглядит следующим образом: на первой стадии аммиак окисляется до хлорамина, который затем, реагирует с аммиаком, образуя собственно гидразин:
Общая схема:
В качестве побочной реакции наблюдается взаимодействие гидразина с хлорамином:
Процесс Рашига протекает в щелочной среде при избытке аммиака, повышенном давлении и температуре 120—160 °C. Выход гидразина в итоге может достигать 80 %.
Даже незначительные количества катионов некоторых тяжёлых металлов, особенно двухвалентной меди, могут существенно увеличить долю побочной реакции, в связи с чем, в реакционную смесь добавляют небольшое количество желатина или специального клея для связывания ионов в нереакционный комплекс.
Модификацией процесса Рашига стал процесс Хофмана, где вместо аммиака используется мочевина:
В процессе используется 43%-й раствор мочевины с добавками специального реагента для ингибирования побочной реакции и увеличения выхода конечного продукта. Раствор гипохлорита натрия используется в соотношении к раствору мочевины, как 4:1; температура в реакторе не превышает 100 °C.
Применение в промышленном органическом синтезе
Сильные окислительные свойства гипохлорита натрия используются в промышленном органическом синтезе для получения различных соединений, среди которых:
- антраниловая кислота промежуточный продукт в синтезе красителей;
- метансульфоновая кислота промежуточный продукт в синтезе лекарственных препаратов и электролитов для получения покрытий драгоценными металлами:
- хлорпикрин инсектицид;
- аскорбиновая кислота лекарственное средство и консервант в пищевой промышленности;
- дихлоризоциануровая и трихлоризоциануровая кислота инсектициды, дезинфектанты и полупродукты для синтеза пестицидов.
Применение в лабораторном органическом синтезе
Гипохлорит натрия находит широкое применение в лабораторной органической практике прежде всего, из-за своих сильных окислительных свойств и доступности как реактива.
Окислительные возможности NaOCl используются в следующих превращениях:
- метилендиамин → диазометан;
- алкены → эпоксиды;
- первичные спирты → альдегиды или карбоновые кислоты;
- вторичные спирты → кетоны;
- метилкетоны → карбоновые кислоты;
- Эта реакция лежит в основе галоформного расщепления и может служить лабораторным методом получения хлороформа или иодоформа:
- α-аминокислоты → альдегиды;
- первичные амины → нитрилы или карбонильные соединения;
- галогенуглеводороды → карбоновые кислоты;
- органические сульфиды → сульфоксиды;
- органические сульфиды → сульфоны;
- органобораны → первичные амины;
Среди других вариантов использования отметим:
- реагент для качественного или количественного определения аргинина в смеси аминокислот;
- реагент для N-хлорирования аминов;
- реагент для хлорирования ароматических соединений и аллильного хлорирования алкенов;
- реагент для синтеза органических гипохлоритов.
Прочие направления использования
Среди прочих направлений использования гипохлорита натрия отметим:
- в промышленном органическом синтезе или гидрометаллургическом производстве для дегазации токсичных жидких и газообразных отходов, содержащих циановодород или цианиды;
- окислитель для очистки сточных вод промышленных предприятий от примесей сероводорода, неорганических гидросульфидов, сернистых соединений, фенолов и др.;
- в электрохимических производствах в качестве травителя для германия и арсенида галлия;
- в аналитической химии как реагент для фотометрического определения бромид-иона;
- в пищевой и фармацевтической промышленности для получения пищевого модифицированного крахмала;
- в военном деле как средство для дегазации боевых отравляющих веществ, таких как иприт, льюизит, зарин и V-газы.
Просмотров: 18776
4108.ru
Инструкция по применению натрия гипохлорита для целей дезинфекции
Инструкция по применению раствора гипохлорита натрия для целей дезинфекции:
1. Общие положения:
Гипохлорит натрия является солью хлорноватистой кислоты. Раствор получают заводским способом — поглощением хлора раствором едкого натра. В некоторых отраслях промышленности растворы гипохлоритов являются отходами производств. В соответствии с техническими условиями растворы гипохлорита натрия выпускают трех марок А, Б и В, отличающихся друг от друга по содержанию активного хлора, остаточной щелочности и внешнему виду. Марки А и Б — прозрачные зеленовато-желтые жидкости (допускается взвесь) с содержанием активного хлора 17%. Марка В — жидкость от желтого до коричневого цвета, выпускается I и II сортов, содержащих 12 и 9,5% активного хлора соответственно.
На заводах-изготовителях растворы гипохлоритов заливают в стальные гуммированные цистерны или контейнеры, а также в полиэтиленовые канистры или бочки емкостью 20—60 л. Раствор гипохлорита натрия разлагается при хранении, в связи с чем его хранят в закрытом, сухом, прохладном, хорошо проветриваемом нежилом помещении.
В виду слабой стойкости раствора гипохлорита и возможных нарушений правил хранения и приготовления рабочих растворов необходимо проводить проверку препаратов и приготовленных рабочих растворов иодометрическим методом на содержание активного хлора. Гипохлорит обладает бактерицидным и спорицидным действием.
2. Применение растворов гипохлорита натрия и кальция:
Раствор гипохлорита натрия используют взамен хлорной извести и ДТСГК. при текущей, заключительной и профилактической дезинфекции для обеззараживания различных предметов и выделений в очагах инфекционных заболеваний, а также для обеззараживания специальных объектов. Обеззараживание проводят орошением, протиранием, мытьем, замачиванием объектов, не портящихся при таком способе обработки. Белье и прочие ткани, а также металлические предметы, если они не защищены от коррозии, и окрашенные вещи обеззараживанию растворами гипохлоритов не подлежат. При инфекциях, вызванных вегетативными формами микроорганизмов, раствор гипохлорита натрия применяют по следующим режимам:
• Обеззараживание помещений (пол, стены), простой деревянной мебели, надворных установок проводят орошением растворами в концентрации 1% по активному хлору из расчета 300—500 мл/м2 при экспозиции 1 час. По окончании дезинфекции помещения обязательно проветривают.
• Для обеззараживания малоценных мягких вещей, а также ветоши, уборочного материала применяют растворы, содержащие 1 % активного хлора, из расчета 4—5 л на 1 кг сухого веса вещей и выдерживают в течение 1 часа.
• Посуду обеззараживают при полном погружении в 0,25— 1% по активному хлору раствор, в зависимости от наличия остатков пищи, на 1 час из расчета 1,5 л раствора на 1 комплект. По окончании дезинфекции посуду тщательно промывают водой.
• Ванны, унитазы, раковины и другое санитарно-техническое оборудование двукратно обильно орошают растворами 1 % концентрации.
• Жидкие выделения, остатки пищи и другие отбросы заливают неразведенными растворами гипохлоритов в соотношении 1 : 1. Для обеззараживания ночной посуды после удаления обеззараженного содержимого используют 0,25% по активному хлору растворы гипохлоритов, после чего посуду промывают водой.
• Обеззараживание верхних слоев почвы, асфальта и других объектов вне помещения производят растворами гипохлоритов в концентрации 1% по активному хлору из расчета 1,5 мл/м2.
3. Меры личной профилактики
При выполнении дезинфекционных работ раствором гипохлорита натрия каждый работающий обязан строго соблюдать меры личной безопасности, для чего следует пользоваться индивидуальными средствами защиты (респиратор РУ-60 с патроном марки А; защитные очки, резиновые перчатки; защитные передники). При попадании раствора гипохлорита натрия на кожу и слизистую глаз необходимо быстро и обильно промыть струей чистой воды.
4. Приготовление рабочих растворов гипохлорита натрия
Содержание активного хлора в растворе натрия гипохлорита, % | Количество в мл раствора гипохлорита, необходимое для приготовления 10 л рабочего раствора | |
0,25% по активному хлору | 1% по активному хлору | |
17 | 150 | 600 |
12 | 210 | 840 |
10 | 250 | 1000 |
9 | 280 | 1110 |
8 | 315 | 1250 |
5 | 500 | 2000 |
Отходы промышленности, содержащие гипохлориты с нестандартным количеством активного хлора, могут быть также использованы для целей дезинфекции в порядке, предусмотренном данной инструкцией.
Источник: Санитарно-эпидемиологическое управление Минздрава СССР
www.ssintez.ru