Пропионовая кислота. свойства. Вопрос 5 § 55-59 Химия Рудзитис Г.Е., Фельдман Ф.Г. 9 класс – Рамблер/класс
Пропионовая кислота. свойства. Вопрос 5 § 55-59 Химия Рудзитис Г.Е., Фельдман Ф.Г. 9 класс – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Рассмотрите химические свойства карбоновых кислот на примере пропионовой кислоты С Запишите соответствующие уравнения химических реакций.
Запишите соответствующие уравнения химических реакций.
ответы
Химические свойства пропионовой кислоты:
1. Реагирует с металлами, их оксидами или их
основными гидроксидами:
2. Вытесняет более слабую кислоту из ее соли:
3. Вступает в реакцию этерификации:
4. Диссоциируют в водном растворе:
5. Образование хлорангидридов:
6. Реакция с галогенами:
7. Получение ангидридов:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых).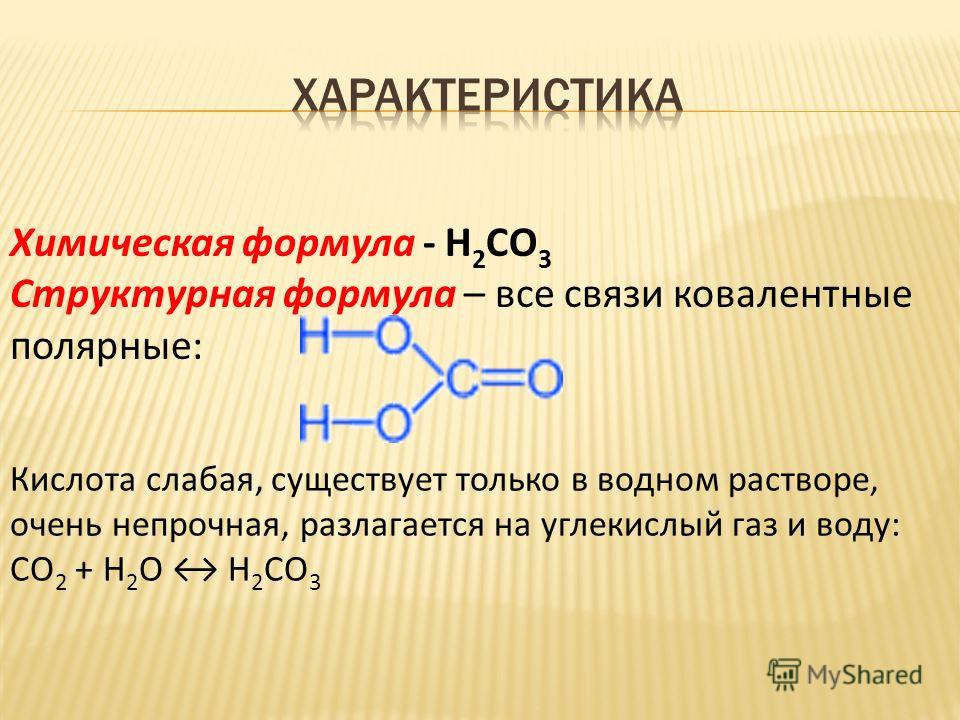 ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Применение пропионовой кислоты и ее взаимодействие с другими химическими соединениями
Для большинства потребителей добавка E280 ни о чем не говорит, но если копнуть глубже, то можно узнать, что за этим обозначением прячется пропионовая кислота. Она представляет собою бесцветную жидкость с резким запахом. Для этого химического соединения характерно универсальное применение, так как его применяют и в кулинарии, и в производстве пластмасс, и в производстве гербицидов, и даже в фармацевтике.
Особенности химических связей
Если рассматривать это вещество с точки зрения химии, то химическая формула пропионовой кислоты будет: C2H5COOH. Ее вывели с помощью нефти и процесса брожения углеводов. Саму кислоту производят бактерии с одноименным названием. Она выступает завершающим продуктом их жизнедеятельности.
Она выступает завершающим продуктом их жизнедеятельности.
Впервые данное вещество получили на производствах, где изготавливают уксус. Уксусная кислота и пропионовая кислота стали неотъемлемым понятием, потому что пропионовые соединения образуются во время изготовления уксуса.
Также ученые доказали тот факт, что пропионовая кислота может встречаться и на кожных покровах человека. Кроме того, ее обнаружили в желудках жвачных животных. В середине 19 века ее первооткрывателем стал ученый Йохан Готлиб. Получение пропионовой кислоты он обнаружил в процессе разложение сахара, но окончательно раскрыть все «секреты» этого вещества смог только француз Жан-Батист-Дюма. Он, к стати, и дал ее такое название.
Стоит отметить, что данная кислота имеет еще несколько названий, а именно:
- • пропановая кислота,
- • метилуксусная кислота,
- • Propionic acid.
В мировой классификации добавок она имеет значение E280.
Чтобы понять – для чего ее добавляют в пищевые продукты, пластмассы или корма для животных, необходимо знать ее свойства. Поэтому ее ключевой характеристикой считается – препятствие размножения и роста различных видов плесени и бактерий.
Такое свойство ценится многими производителями хлебобулочных изделий, растворителей, пластмасс и лекарственных препаратов. Это химическое соединение считается консервантом.
Но, где и в каком количестве можно ее применять? Чтобы ответить на этот вопрос необходимо обращать внимание на законодательную базу той страны, где пропионовая кислота допускается в производственный процесс. Например, в Российской Федерации это вещество считается допустимым в определенном количестве, но в соседней Украине, это вещество запрещено на законодательном уровне.
Взаимодействие с другими химическими соединениями
Реакции пропионовой кислоты получаются в результате ее смешивания с водой или органическими растворителями.
Самыми популярными реакциями взаимодействия пропионовой кислоты считаются:
1. Для получения пропионата кальция производят следующую реакцию:
2Ch4Ch3COOH + CaO → (Ch4Ch3COO)2Ca + h3O
2. Для получения пропионата натрия, необходимо провести реакцию пропионовой кислоты с гидроксидом натрия:
Ch4Ch3COOH + NaOH → Ch4Ch3COONa + h3O
Уравнение пропионовой кислоты с гидроксидом натрия показывает, что в результате этой реакции образовывается новое вещество – пропионат натрия.
Все эти реакции находят практическое применение в производстве, например, гербицида дихлорпрола и пропанола. Пропионовая кислота с гидроксидом натрия пагубно влияют на жизнедеятельность различных паразитарных растений и бурьянов. Они часто используются в сельском хозяйстве и аграрной сфере.
3. Также кроме реакций с калием и натрием, пропионовая кислота взаимодействует со спиртами. Реакция пропионовой кислоты с метиловым спиртом выражается следующим образом:
Ch4Ch3COOH + СН3OH = Ch4Ch3COOСН3 + Н2О
Полученное вещество называют метилпропионатом. Его применяют в качестве ароматизатора в пищевой промышленности, и в качестве растворителя олиф и целлюлозы.
4. Кроме метилового спирта эта кислота входит в реакцию и с этиловым спиртом. В результате получается этиловый эфир пропионовой кислоты: Ch4Ch3COOC2H5. Полученное вещество широко применяют в процессе производства искусственной кожи, а также с его помощью изготавливают растворители для пластмасс, целлюлозы, жира, воска. Этот продукт пропионовой кислоты считается сильнейшим ядом для насекомых.
5. Отдельного внимания требует частое использование муравьиной и пропионовой кислоты в производстве кормов для животных, в частности птиц. Муравьиная кислота помогает снизить уровень кислотности корма, что приводит к длительному хранению.
6. После реакции этанола с пропионовой кислотой получается этилпропионат. Это вещество считается неотъемлемой частью основных видов ароматизаторов, которые добавляют в пищевые продукты питания. Его также могут добавлять в качестве отдушки в парфюмерии.
7. Реакция, в которой участвуют пропанол и пропионовая кислота:
O O
// H(+),t //
\ \
O-C3H7 OH
8. Реакция этанола с пропионовой кислотой:
С2Н5ОН + С2Н5СООН = С2Н5СООС2Н5 + Н2О
Вред от пропионовой кислоты
Если придерживаться всех мер безопасности и дозировки этого вещества, то никакой опасности не может быть. Но бывают случаи, когда из-за человеческого фактора и халатности, концентрация кислоты увеличивается. В таком случае, продукция может принести неисправимый вред организму. При повышенной концентрации в организме могут появляться язвы желудка, ожоги дыхательных и кожных покровов.
В таком случае, продукция может принести неисправимый вред организму. При повышенной концентрации в организме могут появляться язвы желудка, ожоги дыхательных и кожных покровов.
Пропионовая кислота — Sciencemadness Wiki
Пропионовая кислота или пропановая кислота — это природная карбоновая кислота с химической формулой CH 3 CH 2 COOH . Это прозрачная жидкость с резким и неприятным запахом, чем-то напоминающим запах тела.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Пропионовая кислота реагирует с основаниями с образованием солей, известных как пропионаты. Реакция с гидроксидом кальция дает пропионат кальция.
Реакция с гидроксидом кальция дает пропионат кальция.
- 2 CH 3 CH 2 COOH + Ca(OH) 2 → Ca(CH 3 CH 2 COO) 2 + 2 H 2 O
Физический
Пропионовая кислота смешивается с органической водой, бесцветная жидкость растворители. Имеет прогорклый запах, напоминающий пот тела. Его можно высолить из раствора, добавив соль.
Доступность
Пропионовая кислота продается поставщиками химикатов. Его также можно купить на eBay.
Препарат
Пропионовую кислоту промышленно производят несколькими способами.
Один из способов включает гидрокарбоксилирование этилена с использованием карбонила никеля в качестве катализатора.
Другой включает аэробное окисление пропионового альдегида при температуре 40–50 °C.
Ни одно из вышеперечисленных средств не является достаточно дешевым, чтобы делать его дома.
Более доступный способ включает добавление сильной кислоты к пропионату кальция. Конц. серная кислота не может быть хорошим выбором, так как полученный сульфат кальция будет иметь тенденцию улавливать пропионовую кислоту в своих частицах, и его трудно фильтровать. Вместо этого можно использовать соляную кислоту, затем полученный азеотроп пропионовая кислота-вода перегоняют, пропионовую кислоту снова превращают в соль, раствор сушат, получая твердую пропионатную соль, которую затем сушат, затем чистую пропионовую кислоту перегоняют. получают добавлением конц. серную кислоту до соли, а пропионовую кислоту перегоняют. Пропионат кальция доступен во многих местах в качестве пищевого консерванта (E 282), и его можно дешево купить в больших количествах, что делает этот метод привлекательным.
Конц. серная кислота не может быть хорошим выбором, так как полученный сульфат кальция будет иметь тенденцию улавливать пропионовую кислоту в своих частицах, и его трудно фильтровать. Вместо этого можно использовать соляную кислоту, затем полученный азеотроп пропионовая кислота-вода перегоняют, пропионовую кислоту снова превращают в соль, раствор сушат, получая твердую пропионатную соль, которую затем сушат, затем чистую пропионовую кислоту перегоняют. получают добавлением конц. серную кислоту до соли, а пропионовую кислоту перегоняют. Пропионат кальция доступен во многих местах в качестве пищевого консерванта (E 282), и его можно дешево купить в больших количествах, что делает этот метод привлекательным.
Пропионовая кислота является побочным продуктом галоформной реакции метилэтилкетона с отбеливателем. Поскольку отбеливатель разбавлен, вы получите очень разбавленный раствор пропионата натрия. В зависимости от того, сколько жидкости вы хотите перегнать, вы можете либо сконцентрировать раствор, нагревая его при 90 °C в течение многих часов, пока объем жидкости не станет достаточно низким, добавить HCl, а затем перегнать, либо вы можете просто добавить кислоту в разбавленный раствор. раствор и фракционно дистиллировать пропионовую кислоту, как это сделал NurdRage [1] . Пропановая кислота образует азеотроп с водой, состоящей из 17% CH 3 CH 2 COOH, а остальное представляет собой вода, кипящая при 99,96 ° C, что означает, что дистиллят будет очень разбавленной пропановой кислотой. Нейтрализуйте разбавленную пропионовую кислоту пищевой содой, чтобы снова образовался пропионат натрия. Удалите воду, выкипятив воду, и высушите пропаноат. После высыхания добавьте конц. серной кислоты (98%) и фракционно перегоняют полученную кислоту, так как в неочищенной соли пропионата еще могут находиться примеси. Неочищенную пропионовую кислоту сушат безводным раствором. сульфата натрия и снова перегоняют.
раствор и фракционно дистиллировать пропионовую кислоту, как это сделал NurdRage [1] . Пропановая кислота образует азеотроп с водой, состоящей из 17% CH 3 CH 2 COOH, а остальное представляет собой вода, кипящая при 99,96 ° C, что означает, что дистиллят будет очень разбавленной пропановой кислотой. Нейтрализуйте разбавленную пропионовую кислоту пищевой содой, чтобы снова образовался пропионат натрия. Удалите воду, выкипятив воду, и высушите пропаноат. После высыхания добавьте конц. серной кислоты (98%) и фракционно перегоняют полученную кислоту, так как в неочищенной соли пропионата еще могут находиться примеси. Неочищенную пропионовую кислоту сушат безводным раствором. сульфата натрия и снова перегоняют.
Окисление пропанола сильным окислителем, таким как перманганат калия, дает пропионовую кислоту.
Другой метод включает реакцию этилмагнийгалогенида с диоксидом углерода. При этом образуется пропионовая кислота, которую можно извлечь из реакционной массы способом, аналогичным описанному выше (за исключением меньшего количества воды).
Propionibacterium, как известно, производит пропионовую кислоту (она придает поту неприятный запах), хотя ее количество слишком мало, чтобы быть жизнеспособным источником.
Проекты
- Производство этилпропионата
- Сделать пропионат кальция
- Изготовление термопласта из ацетатпропионата целлюлозы
Обращение
Безопасность
Концентрированная пропионовая кислота вызывает коррозию и требует надлежащей защиты при обращении. Он также имеет неприятный запах, и работу следует выполнять на улице или в вытяжном шкафу.
Хранение
Пропановую кислоту следует хранить в герметичных емкостях во избежание распространения ее неприятного запаха на рабочем месте. Подойдет бутылка с тефлоновой крышкой.
Утилизация
Следует нейтрализовать основанием, таким как бикарбонат натрия или гидроксид/карбонат кальция, а затем слить в канализацию.
Ссылки
- ↑ https://www.
 youtube.com/watch?v=iDMuQtglPIw
youtube.com/watch?v=iDMuQtglPIw
Соответствующие темы Sciencemadness
- Приготовление пропионовой кислоты
- Путь к пропионовой кислоте?
- пропионовая кислота из хлорацетона
- Пропионовая кислота через галоформ МЭК?
Ацетон — Sciencemadness Wiki
Ацетон , также известный как пропанон или диметилкетон (химическая формула (CH 3 ) 2 CO — популярный растворитель для многих органических химических веществ) , являясь простейшим кетоном.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 См. также
- 7 Каталожные номера
- 7.1 Соответствующие темы Sciencemadness
Свойства
Химический
Ацетон легко воспламеняется и горит на воздухе с выделением углекислого газа и паров воды.
Реагирует с галогенами с образованием галогенированных органических соединений, т.е. хлорацетона, бромацетона, йодацетона. Ацетон очень экзотермически реагирует с галогенами, растворенными в основных растворах, с образованием галоформа указанного галогена, процесс, известный как галоформная реакция. Одним из примеров является использование бытового отбеливателя и других гипохлоритов с образованием хлороформа.
Ацетон образует непредсказуемую и опасную взрывоопасную перекись ацетона при окислении перекисью водорода при определенных условиях, например, с кислотным катализатором.
Ацетон реагирует с холодной концентрированной азотной кислотой с образованием уксусной и муравьиной кислот. В результате реакции выделяется много тепла, из-за чего продукты испаряются из реакционной колбы.
Физический
Ацетон – это прозрачная жидкость с очень низкой вязкостью, смешивающаяся с водой, кипит при 56 °C и замерзает при –9от 5 до −93 °C. Он имеет резкий, несколько сладкий и цветочный аромат, похожий на другие кетоны. Он также смешивается с большинством органических растворителей, таких как ледяная уксусная кислота, бензол, хлороформ, диэтиловый эфир, этанол, гептан, гексан и метанол. Однако ацетон не смешивается с глицерином.
Он также смешивается с большинством органических растворителей, таких как ледяная уксусная кислота, бензол, хлороформ, диэтиловый эфир, этанол, гептан, гексан и метанол. Однако ацетон не смешивается с глицерином.
Доступность
Ацетон можно найти в хозяйственных магазинах в качестве разбавителя краски или жидкости для снятия лака, в чистом виде или в смеси с другими органическими веществами (обычно сложными эфирами). Для очистки ацетона может потребоваться перегонка.
Большинство технических сортов ацетона, как правило, довольно чистые и содержат очень мало воды, если вообще содержат ее. Если вы хотите, чтобы он был более чистым, вы можете перегнать его снова.
Подготовка
В промышленности ацетон получают кумольным процессом, при котором бензол алкилируется пропиленом с получением кумола, который окисляется воздухом с получением фенола и ацетона.
До этого метода ацетон производился путем сухой перегонки ацетатной соли, обычно ацетата кальция или ацетата натрия.
- 2 Na(CH 3 COO) → Na 2 CO 3 + (CH 3 ) 2 CO
- Ca(CH 3 COO) 2 → CaCO 3 + (CH 3 ) 2 CO
Поскольку эта реакция происходит при температуре около 400-500°C и температуре самовоспламенения, ацетона, это должно быть выполнено в бескислородной камере (достаточно углекислого газа или только атмосферы), и, поскольку ацетон образуется в виде паров, его необходимо конденсировать.
Ацетон можно извлечь из водного раствора высаливанием безводным ацетатом натрия, который обычно получают из уксуса и пищевой соды.
Проекты
- Синтез метилметакрилата
- Синтез пероксида ацетона
- Синтез хлороформа
- Органические экстракты
- Сделать этенон
Обращение
Безопасность
Контакт с кожей с ацетоном не рекомендуется, так как длительное воздействие может привести к обезжириванию кожи. Низкая температура кипения ацетона требует работы в проветриваемом помещении. Хотя ацетон летуч и его пары не особенно токсичны, в больших количествах они могут вызывать раздражение. Однако ацетон является одним из наименее токсичных растворителей, и, как показали многие исследования, в случае многократного воздействия не возникает долгосрочного риска.
Низкая температура кипения ацетона требует работы в проветриваемом помещении. Хотя ацетон летуч и его пары не особенно токсичны, в больших количествах они могут вызывать раздражение. Однако ацетон является одним из наименее токсичных растворителей, и, как показали многие исследования, в случае многократного воздействия не возникает долгосрочного риска.
Основная опасность ацетона связана с его воспламеняемостью. Его пары имеют температуру воспламенения намного ниже комнатной температуры, поэтому смеси воздух/ацетон могут легко взорваться или загореться даже при ударах статическим электричеством.
При температуре выше 486 °C ацетон самовоспламеняется.
Хранение
Ацетон лучше всего хранить в закрытых бутылях, вдали от любых источников тепла.
Утилизация
Ацетон можно безопасно сжигать. Следы ацетона могут выделяться на открытом воздухе. Сильно разбавленные растворы ацетона можно выливать в канализацию, но не выпускать в больших количествах.
