1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t° кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t° кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Пропионат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Пропионат натрия — химическое соединение, соль натрия и пропионовой кислоты с формулой C2H5COONa, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- N a O H + C 2 H 5 C O O H → C 2 H 5 C O O N a + H 2 O {\displaystyle {\mathsf {NaOH+C_{2}H_{5}COOH\ {\xrightarrow {}}\ C_{2}H_{5}COONa+H_{2}O}}}
Физические свойства
Пропионат натрия образует бесцветные гигроскопичные кристаллы моноклинной сингонии, параметры ячейки a = 0,3569 нм, b = 0,5306 нм, c = 1,1188 нм, β = 92,86° [1].
Растворяется в воде.
Образует кристаллогидрат состава C2H5COONa•H2O.
Применение
- Консервирующее вещество в пищевой промышленности и медицине.
Примечания
- ↑ V. Massarotti and G. Spinolo,. Crystal data for sodium propanoate: C2H5COONa // Journal of Applied Crystallography. — 1979. — Т. 12, № 6. — С. 613-614. — DOI:10.1107/S002188987901342X.
Литература
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Пропионат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Пропионат натрия — химическое соединение, соль натрия и пропионовой кислоты с формулой C2H5COONa, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- N a O H + C 2 H 5 C O O H → C 2 H 5 C O O N a + H 2 O {\displaystyle {\mathsf {NaOH+C_{2}H_{5}COOH\ {\xrightarrow {}}\ C_{2}H_{5}COONa+H_{2}O}}}
Физические свойства
Пропионат натрия образует бесцветные гигроскопичные кристаллы моноклинной сингонии, параметры ячейки a = 0,3569 нм, b = 0,5306 нм, c = 1,1188 нм, β = 92,86° [1].
Растворяется в воде.
Образует кристаллогидрат состава C2H5COONa•H2O.
Применение
- Консервирующее вещество в пищевой промышленности и медицине.
Примечания
- ↑ V. Massarotti and G. Spinolo,. Crystal data for sodium propanoate: C2H5COONa // Journal of Applied Crystallography. — 1979. — Т. 12, № 6. — С. 613-614. — DOI:10.1107/S002188987901342X.
Литература
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Материал из Википедии — свободной энциклопедии
Пропионат натрия — химическое соединение, соль натрия и пропионовой кислоты с формулой C2H5COONa, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- N a O H + C 2 H 5 C O O H → C 2 H 5 C O O N a + H 2 O {\displaystyle {\mathsf {NaOH+C_{2}H_{5}COOH\ {\xrightarrow {}}\ C_{2}H_{5}COONa+H_{2}O}}}
Физические свойства
Пропионат натрия образует бесцветные гигроскопичные кристаллы моноклинной сингонии, параметры ячейки a = 0,3569 нм, b = 0,5306 нм, c = 1,1188 нм, β = 92,86° [1].
Растворяется в воде.
Образует кристаллогидрат состава C2H5COONa•H2O.
Применение
- Консервирующее вещество в пищевой промышленности и медицине.
Примечания
- ↑ V. Massarotti and G. Spinolo,. Crystal data for sodium propanoate: C2H5COONa // Journal of Applied Crystallography. — 1979. — Т. 12, № 6. — С. 613-614. — DOI:10.1107/S002188987901342X.
Литература
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Пропионовая кислота и пропионаты
ПРОПИОНОВАЯ КИСЛОТА И ПРОПИОНАТЫ. ПОЛЬЗА ДЛЯ ОРГАНИЗМА И ПРИМЕНЕНИЕ В НАРОДНОМ ХОЗЯЙСТВЕ
ПРОПИОНОВАЯ КИСЛОТА
Пропионовая кислота (англ. propionic acid) — (пропановая или метилуксусная кислота, консервант E280) — одноосновная предельная карбоновая кислота — бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos» — первый, «pion» — жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот. Относится к короткоцепочечным (летучим) жирным кислотам. Соли и анионы пропионовой кислоты называются пропионатами.
Химическая Формула пропионовой кислоты: C3H6O2
Линейная Формула: CH3CH2COOHПРОПИОНАТ
Пропионат (англ. propionate), или ион пропаноата (propanoate ион) — сопряженное основание пропионовой кислоты (пропионовая кислота минус один водородный ион).
Химическая формула пропионата: C3H5O2−
Рациональная формула: CH3CH2COO
Пропионовое соединение представляет собой небольшую соль или сложный эфир пропионовой кислоты. Ниже приведены примеры пропионатов — солей пропионовой кислоты, которые используются в пищевой отрасли:
ПРОПИОНАТ КАЛЬЦИЯСиноним: Кальциевая соль пропионовой кислоты Хим. Формула: Ca(C3H5O2)2 Рациональная: Ca(CH3CH2COO)2 | ПРОПИОНАТ НАТРИЯСиноним: Натриевая соль пропионовой кислоты Хим. Формула: NaC3H5O2 Рациональная:CH3CH2COONa |
ПОЛЕЗНЫЕ ФУНКЦИИ ПРОПИОНОВОЙ КИСЛОТЫ (ПРОПИОНАТОВ) В ОРГАНИЗМЕ
ЭНДОГЕННЫЕ ПРОПИОНАТЫ и ПРОПИОНОВАЯ КИСЛОТА, ПРОДУЦИРУЕМЫЕ КИШЕЧНОЙ МИКРОФЛОРОЙ
Среди постоянно обитающей в кишечнике человека индигенной микробиоты важную роль играют бактерии, продуцирующие пропионовую кислоту (пропионаты) в процессе пропионовокислого брожения. Это представители родов и семейств:
- Propionibacterium (пропионибактерии), включая: Arachnia, которые ранее классифицировались как отдельный род, а в настоящее время включены в род Propionibacterium (в частности, вид Arachnia propionica переименован в Propionibacterium propionicus)
- представители семейства Veillonellaceae (вейлонеллы): Veillonella и Anaerovibrio
Эти кишечные бактерии сбраживают молочную кислоту, глюкозу, лактозу и другие углеводы, а также некоторые спирты с образованием пропионовой и уксусной кислот (пропионата и ацетата) и углекислого газа.
Далее перечислены некоторые физиологические эффекты пропионовой кислоты (пропионатов), как метаболита кишечной микрофлоры (Ардатская М.Д., Минушкин О.Н.):
1) энергообеспечение эпителия; 2) антибактериальный эффект; 3) регуляция пролиферации и дифференцировки эпителия; 4) поставка субстратов глюконеогенеза; 5) блокировка адгезии патогенов к эпителию; 6) поддержание ионного обмена.
Следует отметить, что пропионовая кислота участвует также в синтезе гормонов, нейромедиаторов (серотонина, эндорфинов) и обладает противогрибковым эфектом.
Значительная часть продуцированной бактериями пропионовой кислоты (пропионатов) проникает в локальные кишечные капилляры и по системе воротной вены достигает печени, где подвергается дальнейшей трансформации с образованием глюкозы. Пропионовая кислота в гепатоцитах, преимущественно, участвует в глюконеогенезе, а также является регулятором метаболических процессов и липидного обмена в печени (Ардатская М.Д.).
По имеющимся данным, около 90% количества пропионовой кислоты метаболизируется печенью, а остальная часть транспортируется в периферическую кровь, где еe количество у человека достигает ≈6 мкмоль/л, что значительно превышает таковое у бутирата, но ниже, чем у ацетата.
См. также: Применение пропионовокислых бактерий для образования пропионовой кислоты и/или пропионатов в ободочной кишке
ДРУГИЕ ПОЛЕЗНЫЕ СВОЙСТВА ПРОПИОНОВОЙ КИСЛОТЫ (ПРОПИОНАТОВ) ДЛЯ ЗДОРОВЬЯ
Благотворное влияние пропионовой кислоты и ее производных давно изучается учеными:
Так в работе Jan, G.; et al. «Propionibacteria induce apoptosis of colorectal carcinoma cells via short-chain fatty acids acting on mitochondria». Cell Death & Differentiation. 9, 179-188 (2002). показано как Пропионибактерии индуцируют апоптоз клеток колоректальной карциномы через короткоцепочечные жирные кислоты, в частности, пропионовую кислоту (пропионат), действующие на митохондрии.
В работе Mario M. Zaiss., et al. Short-chain fatty acids regulate systemic bone mass and protect from pathological bone loss. Nature Communications, 9, Article number: 55 (2018). показано, что пропионат защищает костную систему от патологического разрушения (предотвращает остеопороз).
В работе Chambers ES, et al. Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults. Gut 2015; 64: 1744–1754 говорится, как адресная доставка пропионата в толстую кишку нормализует вес у взрослых.
В работе Jonathan Scheiman, Sarah Lessard, Aleksandar D. Kostic, et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nature Medicine, 2019 было показано, что пропионат является причиной повышения физической выносливости (таким образом, он может быть полезен как спорсменам, так и лицам с малоподвижным образом жизни, повышая их работоспособность).
В работе Sa’ad Al-Lahham & Farhad Rezaee. Propionic acid counteracts the inflammation of human subcutaneous adipose tissue: a new avenue for drug development. DARU Journal of Pharmaceutical Sciences (2019) 27:645–652 было показано противовоспалительное действие пропионовой кислоты на воспаление подкожно-жировой клетчатки человека.
В работе Aiden Haghikia et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 2020 Mar 19; 180 (6): 1067-1080. e16. было показано, что пропионовая кислота, изменяя состав кишечной микробиоты и восстанавливая дисбаланс клеток Treg / Th27, может служить мощной иммуномодулирующей добавкой к препаратам от рассеянного склероза
В работе Lars Tönges et al. Propionic Acid and Fasudil as Treatment Against Rotenone Toxicity in an In Vitro Model of Parkinson’s Disease. Molecules 2020, 25, 2502 было показано, что лечение пропионовой кислотой показывает благоприятный потенциал в пораженных ротеноном первичных мезенцефальных клетках (в исследовании использовали модельную систему болезни Паркинсона для культивируемых первичных мезенцефальных клеток и пестицид ротенон использовали для моделирования повреждения дофаминергических клеток). Пропионовая кислота способствовала выживанию дофаминергических клеток против токсичности ротенона и увеличению роста нейритов в умеренной степени. Таким образом, данные по лечению пропионовой кислотой в парадигме ротенона in vitro подчеркивают ее благоприятный потенциал для дофаминергических нейронов при болезни Паркинсона.
В работе Lesley Hoyles, Simon McArthur, et. al. Microbiome–host systems interactions: protective effects of propionate upon the blood–brain barrier. Microbiome, 2018 британские ученые исследовали и показали защитные эффекты пропионата на гематоэнцефалический барьер:
Гемато-энцефалический барьер (ГЭБ) — физиологический барьер между кровеносной системой и центральной нервной системой. Главная функция — поддержание гомеостаза мозга. Он защищает нервную ткань от циркулирующих в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы, которые воспринимают ткань мозга как чужеродную. ГЭБ выполняет функцию высокоселективного фильтра, через который из артериального русла в мозг поступают питательные, биоактивные вещества; в направлении венозного русла с глимфатическим потоком выводятся продукты жизнедеятельности нервной ткани.
- Пропионат, вырабатываемый из пищевых субстратов бактериями толстой кишки, стимулирует глюконеогенез кишечника и связан со сниженным стрессовым поведением, но его потенциальная эндокринная роль не была рассмотрена. В проведенном исследовании, после демонстрации экспрессии рецептора пропионата FFAR3 (Free fatty acid receptor 3) на эндотелии головного мозга человека, ученые изучили влияние физиологически релевантной концентрации пропионата (1 µmol или 10−6 моль) на свойства ГЭБ in vitro. Как оказалось, пропионат ингибировал пути, связанные с неспецифическими микробными инфекциями через CD14-зависимый механизм, подавлял экспрессию LRP-1 (белка 1, подобного рецептору липопротеинов низкой плотности) и защищал ГЭБ от окислительного стресса посредством передачи сигналов фактора транскрипции NRF2 – основного протеина, регулирующего экспрессию антиоксидантных белков.
P.S. В дополнение ко всему следует напомнить об антимикробном (бактерицидном и бактериостатическом) действии пропионовой кислоты (пропионатов), что является эффективной защитой нашего организма в отношении патогенных микроорганизмов (грамотрицательных энтеробактерий, клебсиелл, протеев, псевдоманад и других болезнетворных микробов), в т.ч. благодаря созданию благоприятной pH-среды для развития дружественной симбионтной микрофлоры.
ПРИМЕНЕНИЕ ПРОПИОНОВОЙ КИСЛОТЫ И ПРОПИОНАТОВ В НАРОДНОМ ХОЗЯЙСТВЕ
Пропионовая кислота и её производные применяют в производстве гербицидов (пропанол, дихлорпрол), лекарств (ибупрофен, феноболин), ароматических веществ, растворителей, винилпластификаторов и ПАВ (гликолевые эфиры).
Пропионовая кислота препятствует росту плесени и некоторых бактерий. Поэтому большая часть производимой пропионовой кислоты используется как консервант в продуктах, потребляемых человеком, и в продуктах для животных. В продуктах для животных применяется непосредственно пропионовая кислота, либо её аммониевая соль (пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебе и в других хлебобулочных изделиях, пропионовая кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
Основная опасность пропионовой кислоты — это химические ожоги, которые могут произойти при контакте с концентрированной кислотой.
ПОЛУЧЕНИЕ ПРОПИОНОВОЙ КИСЛОТЫ (ПРОПИОНАТОВ) В НАРОДНОМ ХОЗЯЙСТВЕ
В природе пропионовая кислота найдена в нефти, образуется при брожении углеводов. В промышленности ее получают карбонилированием этилена по реакции Репле; каталитическим окислением пропионового альдегида в присутствии кобальта или ионов марганца; Пропионовую кислоту также получают биологически при метаболическом разложении жирных кислот, содержащих нечётное число атомов углерода, и при разложении некоторых аминокислот. Бактерии рода Propionibacterium производят пропионовую кислоту как конечный продукт своего анаэробного метаболизма. Эти бактерии встречаются в рубце жвачных животных, и отчасти из-за их деятельности швейцарский сыр имеет свой аромат.
пищевая промышленность:
ВЛИЯНИЕ ЭКЗОГЕННОЙ ПРОПИОНОВОЙ КИСЛОТЫ И ПРОПИОНАТОВ НА ЗДОРОВЬЕ
Пропионовая кислота и ее соли (пропионаты) — пищевые Е-добавки, которые часто можно встретить в описании состава пищевых продуктов. Пропионовая кислота и ее производные здесь названы экзогенными, т.к. они химически синтезированы промышленным способом и поступают в организм извне с продукатми питания, в которых они присутствуют.
Пропионовая кислота Е280 (Propionic acid, пропанкарбоновая кислота)
Пропионовую кислоту используют в пищевой промышленности в качестве консерванта. Вещество представляет собой маслянистую жидкость, имеющую характерный резкий едкий запах и кислый вкус.
Природный источник пропионовой кислоты – жизнедеятельность бактерий рода Propionibacterium. Вещество присутствует в некоторых сортах сыра, для изготовления которых используются пропионовые культуры.
Промышленное производство Е280 осуществляется с помощью химического синтеза.
Применение пропионовой кислоты Е-280
Способность вещества оказывать угнетающие действие на многие виды микроорганизмов, вызывающих порчу пищевых продуктов – дрожжей, плесеней, бактерий, позволяет использовать его в качестве консерванта для увеличения срока годности продовольственных товаров.
Однако возможности применения пропионовой кислоты в пищевой промышленности ограниченны из-за изменения под ее воздействием вкусовых качеств готового продукта. Поэтому для производства продуктов питания обычно используются пропионаты – Е281, Е282 и Е283.
В небольших количествах пропионовую кислоту применяют при изготовлении хлебобулочных изделий, а также для консервирования молочной сыворотки и защиты от плесени зерна. Пропионовая кислота может входить в состав лекарственных и фармацевтических средств, кормов для животных, удобрений.
Влияние пропионовой кислоты Е280 на здоровье человека
Пищевая добавка допущена к применению в пищевой промышленности РФ, стран Еврозоны, США, Канады, присутствует в Кодексе Алиментариус.
Нормативные документы не регламентируют допустимое суточное потребление консерванта, так как его применение в производстве продуктов и так очень ограниченно из-за свойств пропионовой кислоты.
Исследования, проведенные с целью выяснить, каково влияние Е280 на здоровье человека, не выявило токсичных, мутагенных, канцерогенных факторов. Согласно официальным источникам, пищевая добавка является безопасной для организма человека.
С точки зрения химии, пропионовая кислота является жирной кислотой, которая полностью усваивается, не накапливается и выводится из организма в виде углекислого газа в цикле Кребса.
Вред пропионовой кислоты проявляется только при контакте кожных покровов и слизистых оболочек с концентрированным веществом, что вызывает химические ожоги. При употреблении в пищу в составе продуктов Е280 не оказывает негативного воздействия.
Предположения о том, что этот консервант может вызывать онкологические заболевания, не подтверждается официальными исследованиями.
Безопасный консервант Е280 — пропионовая кислота (видео)
Пропионат натрия Е281 (Sodium propionate, натриевая соль пропионовой кислоты)
Пропионатом натрия называется пищевая добавка Е-281, используемая в качестве консерванта. Пищевая добавка представляет собой белый порошок, имеющий резкий запах, хорошо растворяющийся в воде.
В форме пропионовой кислоты вещество содержится в нефти, а также образуется в результате воздействия бактерий в желудке жвачных животных и некоторых видах твердых сыров. Консервант производится с помощью химического синтеза при взаимодействии пропионовой кислоты с едким натром.
Применение пропионата натрия Е281
Этот консервант используется в пищевой промышленности реже, чем Е282. Пропионат натрия замедляет рост микроорганизмов, вызывающих порчу продуктов.
Основная сфера применения пищевой добавки – хлебопекарная и кондитерская промышленность. Е 282 используется также для изготовления косметических и лекарственных средств.
Влияние пропионата натрия на здоровье
Консервант имеет разрешение для производства продовольственных товаров в РФ, ЕС, США, Канаде и других странах, присутствует в Международных стандартах на пищевые продукты.
Допустимое суточное потребление пропионата натрия не ограничивается нормативными документами.
В результате проведенных официально исследований не было выявлено негативных последствий употребления в пищу продуктов, в состав которых входит данный консервант. В организме человека пропионат натрия полностью усваивается и выводится из организма.
Существует альтернативная информация о том, что Е281 и другие производные пропионовой кислоты могут вызывать головные боли и провоцировать онкологические заболевания, однако это не подтверждается официальными исследованиями.
Пропионат кальция Е282 (Calcium propionate)
Пропионатом кальция называется пищевая добавка — консервант, кальциевая соль пропионовой кислоты. Вещество представляет собой кристаллический порошок белого цвета с резким запахом пропионовой кислоты, хорошо растворимый в воде.
Применение пропионата кальция Е282
Из всех солей пропионовой кислоты Е282 чаще всего используется в пищевой промышленности для препятствования росту нежелательной микрофлоры.
Консервант применяется для производства хлебобулочных и мучных кондитерских изделий, сыров и сырных продуктов. Е 282 также входит в состав косметических и лекарственных средств.
Влияние пропионата кальция Е-282 на здоровье человека
Пищевая добавка разрешена для производства продуктов питания в РФ, странах Евросоюза, США, Канаде. В Международных стандартах «Кодекс Алиментариус» Е282 разрешено использовать для изготовления плавленых сыров и продуктов на их основе.
Допустимое суточное потребление пропионата кальция не ограничено.
Согласно официальным данным, Е282 не наносит вреда здоровью человека. В результате проведенных исследований было выяснено, что у пропионовой кислоты отсутствуют канцерогенные, токсичные и мутагенные свойства, а также кумулятивный эффект. Пропионат кальция полностью усваивается организмом и выводится в виде углекислого газа.
Вред пропионатов может быть связан с химическими ожогами при контакте с концентрированной кислотой, что исключается при употреблении пищевых продуктов.
сельское хозяйство
ПРОПИОНОВАЯ КИСЛОТА и ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ В СИЛОСОВАНИИ КОРМОВ
Как известно, силос получают путём заквашивания измельчённой зелёной массы травянистых растений, пригодной для корма животных и птиц. Как правило, этот сочный корм получают в результате консервирования молочной кислотой. И, как правило, консервирование без доступа воздуха (в анаэробных условиях) является наиболее распространённым способом заготовки.
А что если основным консервантом выступит пропионовая кислота?
1. ПРОПИОНОВАЯ КИСЛОТА
Пропионовая кислота — естественный метаболит живого организма (продуцируют ее пропионовые бактерии). В рубце жвачных (отдел желудка) ее образуется от З00 до 1100 г. И широкое применение эта кислота нашла для консервирования влажного зерна в аэробных условиях. Биоцидное и биостатическое действие пропионовой кислоты на микроорганизмы заключается в ее воздействии на обмен углеводов и энергообмен некоторых ферментов, вследствие чего подавляется жизнедеятельность микробов. Пропионовая кислота ограничивает процессы брожения (вторичное брожение) в готовом силосе, значительно угнетает развитие плесневых грибов и дрожжей.
В опытах НИИ животноводства России по консервированию травы люцерны пропионовой кислотой (3 кг/т зеленой массы) после 6-месячного хранения силоса потери сухого вещества по сравнению с контролем снизились в 2,5, общего азота – в 2,2, а безазотистых экстрактивных веществ (БЭВ) – в 1,5 раза. Расчеты показали, что использование пропионовой кислоты как консерванта зеленой массы люцерны дает возможность дополнительно получать 1,2 ц сухого вещества с 1 га площади посева культуры.
При внесении пропионовых бактерий (ПКБ) в силосуемые растения, прежде всего с высоким содержанием сахаров (кукуруза), получили корм более высокого качества, чем в контроле (без внесения ПКБ). Он имел низкую кислотность, был обогащен витаминами В2 и В12, пропионовой кислотой и не подвергался плесневению.
В результате скармливания такого силоса в течении 3 месяцев повысилась яйценоскость птиц, выводимость цыплят, сохранность молодняка животных, в крови которых увеличивается содержание каротина и снижается содержание аммиака. Пропионовая кислота, являясь естественным метаболитом, полностью усваивается жвачными животными в качестве источника энергии, не вызывая при этом отрицательных последствий.
Как видите – одни плюсы))) Ну а если пропионовая кислота является продуктом жизнедеятельности пропионовокислых бактерий, то почему бы не использовать сами микроорганизмы?
2. ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ В СИЛОСОВАНИИ
Логично, что уже додумались о силосовании с использованием самих продуцентов органических кислот-консервантов, т.е. об использовании бактериальных заквасок. Закваски пропионовокислых бактерий (ПКБ) входят в ряд бакконцентратов, используемых для заготовки силоса, и основным консервирующим веществом в таком корме является конечно же пропионовая кислота…
Для примера, рассмотрим отличие готового корма, приготовленного с использованием бакконцентрата «Казахсил-М» (один из препаратов для силосования с сухой закваской ПКБ) от силоса, заготовленного по традиционной технологии, где основным консервирующим веществом является молочная кислота.
ОТЛИЧИЯ КОРМА (ПРЕИМУЩЕСТВА):
1. Кислотность силосной массы стабильно утверждается показателем рН 4,1-4,3, значительно выше, чем у корма приготовленного под действием только молочнокислых бактерий. Более высокое значение рН повышает потребление корма на 12-15% и снижает риск заболевания животных ацидозом, кетозом, заболеваний копыт.
2. Повышает активность рубцовой микрофлоры, так как содержит витамины группы В – продукты жизнедеятельности пропионовокислых бактерий. Это способствует активации процессов рубцового пищеварения, а также повышения переваримости органического вещества рациона.
3. В готовом силосе и сенаже при контакте с воздухом не происходит рост и развитие микроскопических грибов, следовательно, корм не содержит микотоксинов и не происходит его разогревание, так как пропионовая кислота микробного синтеза обладает резко выраженным фунгицидным действием. В силосе и сенаже, где основным консервирующим веществом является молочная кислота, этого процесса предотвратить не возможно. Следовательно, при контакте с воздухом идет процесс обсеменения готового корма микотоксинами. Микотоксины резко снижают активность рубцовой микрофлоры, а также способствуют развитию ряда заболеваний, связанных с расстройством пищеварения и общего обмена веществ.
4. Корм, где основным консервирующим веществом является пропионовая кислота, значительно менее подвержен порче в процессе хранения и сохраняет свои питательные свойства в течение 2-3 лет после окончания процесса консервации. Молочная же кислота в процессе хранения оказывает разрушающее действие на питательные компоненты корма, а следовательно снижает его питательность и зачастую на 2 год хранения в корме резко снижается содержание питательных веществ, его поедаемость и качество (отмечаются очаги роста и развития гнилостных процессов и плесени).
P.S. И поверьте, использование такого силосования сокращает применение антибиотиков в животноводстве, что сказывается в итоге и на здоровье людей.
См. дополнительно:
К разделу: Короткоцепочечные жирные кислоты
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ДИСБАКТЕРИОЗ
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Пропионат натрия — химическое соединение, соль натрия и пропионовой кислоты с формулой C2H5COONa, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- N a O H + C 2 H 5 C O O H → C 2 H 5 C O O N a + H 2 O {\displaystyle {\mathsf {NaOH+C_{2}H_{5}COOH\ {\xrightarrow {}}\ C_{2}H_{5}COONa+H_{2}O}}}
Физические свойства
Пропионат натрия образует бесцветные гигроскопичные кристаллы моноклинной сингонии, параметры ячейки a = 0,3569 нм, b = 0,5306 нм, c = 1,1188 нм, β = 92,86° [1].
Растворяется в воде.
Образует кристаллогидрат состава C2H5COONa•H2O.
Применение
- Консервирующее вещество в пищевой промышленности и медицине.
Примечания
- ↑ V. Massarotti and G. Spinolo,. Crystal data for sodium propanoate: C2H5COONa // Journal of Applied Crystallography. — 1979. — Т. 12, № 6. — С. 613-614. — DOI:10.1107/S002188987901342X.
Литература
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
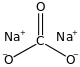
Пропионат натрия Википедия
Пропионат натрия — химическое соединение, соль натрия и пропионовой кислоты с формулой C2H5COONa, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- N a O H + C 2 H 5 C O O H → C 2 H 5 C O O N a + H 2 O {\displaystyle {\mathsf {NaOH+C_{2}H_{5}COOH\ {\xrightarrow {}}\ C_{2}H_{5}COONa+H_{2}O}}}
Физические свойства
Пропионат натрия образует бесцветные гигроскопичные кристаллы моноклинной сингонии, параметры ячейки a = 0,3569 нм, b = 0,5306 нм, c = 1,1188 нм, β = 92,86° [1].
Растворяется в воде.
Образует кристаллогидрат состава C2H5COONa•H2O.
Применение
- Консервирующее вещество в пищевой промышленности и медицине.
Примечания
- ↑ V. Massarotti and G. Spinolo,. Crystal data for sodium propanoate: C2H5COONa // Journal of Applied Crystallography. — 1979. — Т. 12, № 6. — С. 613-614. — doi:10.1107/S002188987901342X.
Литература
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
пропионат натрия
Пропионат натрия Подготовлено на 49-ом JECFA (1997)
Заменяет спецификации, подготовленные на 44-м JECFA (1995),
опубликовано в FNP 52 Addendum 3 (1995)
СИНОНИМЫ | пропаноат натрия, INS № 281 |
ОПРЕДЕЛЕНИЕ | |
Химическое название | пропионат натрия |
с.ТАК КАК. номер | 137-40-6 |
Химическая формула | C 3 H 5 NaO 2 |
Структурная формула | CH 3 CH 2 COO — Na + |
Формула вес | 96,06 |
Assay | Не менее 99.0% в пересчете на сухое вещество |
ОПИСАНИЕ | Белые или бесцветные гигроскопичные кристаллы со слабым характерным запахом |
ФУНКЦИОНАЛЬНЫЕ ИСПОЛЬЗОВАНИЯ | Консервант, противоусадочное и антикоррозийное средство |
ХАРАКТЕРИСТИКИ | |
ИДЕНТИФИКАЦИЯ | |
Растворимость | Свободно растворим в воде, растворим в этаноле |
Положительный тест на натрий | проходит тест |
Положительный тест на пропионат | |
Нагреть образец серной кислотой.Выделенная пропионовая кислота может быть распознана по ее запаху. | |
Положительный тест на щелочную соль органической кислоты | |
Зажечь образец при относительно низкой температуре. Щелочной остаток выделяется кислотой. | |
ЧИСТОТА | |
убытки от высыхания | Не более 4% (105 °, 2ч) |
Нерастворимое в воде вещество | Не более 0.1% |
pH | 7,5 — 10,5 (1 на 10 соль) |
Железо | Не более 50 мг / кг. |
Свинец | Не более 5 мг / кг. Подготовьте раствор образца, как указано для органических соединений в предельном тесте, используя 5 мг иона свинца (Pb) в контроле. |
ИСПЫТАНИЯ | |
ЧИСТЫЕ ИСПЫТАНИЯ | |
Нерастворимое в воде вещество | Взвесить 5 г образца с точностью до мг, перенести в стакан на 100 мл и добавить 50 мл воды. Перемешивайте до тех пор, пока весь образец не окажется полностью растворенным. Фильтруют через тигель Гука, тарированный с точностью до ± 0,2 мг. Ополосните стакан 20 мл воды.Высушите тигель с его содержимым в духовке при 60 ° до постоянного веса. Охладить в эксикаторе, взвесить и рассчитать в процентах. |
МЕТОД АНАЛИЗА | Взвесьте с точностью до мг 3 г образца, предварительно высушенного при 105 ° С в течение 1 ч, в дистилляционную колбу и добавьте 200 мл 50% фосфорной кислоты. Кипятить 2 часа и собирать дистиллят. Во время перегонки поддерживайте объем в колбе примерно 200 мл, добавляя воду с помощью капельной воронки.Титрируют дистиллят IN гидроксидом натрия, используя фенолфталеин TS в качестве индикатора. Каждый мл IN гидроксида натрия соответствует 96,06 мг C 3 H 5 NaO 2 . |
,
Подписи
АнглийскийДобавить однострочное объяснение того, что представляет этот файл
Подписи
Резюме [редактировать]
| ОписаниеСтруктурная формула пропионата натрия.svg | структурная формула пропионата натрия |
| Дата | (исходная дата загрузки) |
| Источник | Машиночитаемый источник не предоставлен.Предположительно собственная работа (основываясь на заявлении об авторском праве). |
| Автор | Машиночитаемый автор не предоставлен. Предположительно Cepheiden (основываясь на заявлении об авторском праве). |
Лицензирование [редактировать]
| Public domainPublic domainfalsefalse |
| | I, владелец авторских прав на это произведение, выпускаю это произведение в общественное достояние . Это относится ко всему миру. В некоторых странах это не может быть возможно юридически; если так: Я даю любому право использовать эту работу для любых целей , без каких-либо условий, если только такие условия не требуются по закону. |
История файла
Нажмите на дату / время, чтобы посмотреть файл, который был загружен в тот момент.
Вы не можете перезаписать этот файл.
Использование файла на Commons
Нет страниц, которые используют этот файл.
,Понимание названий органических соединений
эфиры
Сложные эфиры являются одним из ряда соединений, известных под общим названием кислотных производных . В них кислотная группа модифицирована некоторым образом. В сложном эфире водород в группе -COOH замещен алкильной группой (или, возможно, более сложной углеводородной группой).
Пример 1: Напишите структурную формулу для метилпропаноата .
Название сложного эфира состоит из двух частей — части, которая происходит от кислоты (пропаноат) и части, которая показывает алкильную группу (метил).
Начните с размышлений о пропановой кислоте — 3-углеродной кислоте без углерод-углеродных двойных связей.
Водород в группе -COOH замещен алкильной группой — в данном случае метильной группой.
Имена сложных эфиров сбивают с толку, потому что имя написано в обратном направлении от способа построения структуры.Обойти это невозможно — нужно просто привыкнуть!
В сокращенном варианте эта формула будет иметь вид CH 3 CH 2 COOCH 3 .
Пример 2: Напишите структурную формулу для этилэтаноата .
Это, вероятно, наиболее часто используемый пример сложного эфира. Он основан на этановой кислоте (следовательно, этаноате) — 2-углеродной кислоте. Водород в группе -COOH замещен этильной группой.
Убедитесь, что вы правильно нарисовали этильную группу. Довольно распространенной ошибкой является попытка присоединить группу CH 3 к кислороду. Если вы посчитаете связи, если вы это сделаете, то обнаружите, что углерод CH 3 и углерод CH 2 имеют неправильное число связей.
Ацилхлориды (хлориды кислот)
Ацилхлорид является другим производным кислоты. В этом случае группа -ОН кислоты заменяется на -Cl.Все ацилхлориды содержат группу -COCl:
Пример: Напишите структурную формулу для этаноилхлорида .
Ацилхлориды показаны окончанием oyl хлорид . Таким образом, этаноилхлорид основан на 2-углеродной цепи без углерод-углеродных двойных связей и -COCl-группе. Углерод в этой группе считается частью цепи. В более длинной цепи с присоединенными боковыми группами углероду -COCl присваивается номер 1.
Кислотные ангидриды
Еще одно кислотное производное! Кислотный ангидрид — это то, что вы получаете, если обезвоживаете кислоту, то есть удаляете из нее воду.
Пример: Напишите структурную формулу для пропанового ангидрида .
Их легче всего решить, записав их на клочке бумаги следующим образом:
Нарисуйте две молекулы кислоты, расположенные так, чтобы группы -ОН находились рядом друг с другом.Отрегулируйте молекулу воды — и затем соедините то, что осталось. В этом случае, поскольку вам нужен пропановый ангидрид, вы рисуете две молекулы пропановой кислоты.
Амиды
Еще одно производное кислоты! Амиды содержат группу -CONH 2 , где -ОН кислоты заменен на -NH 2 .
Пример: Напишите структурную формулу для пропанамида .
Это основано на 3 углеродных цепях без углерод-углеродных двойных связей.В конце цепочки находится группа -CONH 2 . Углерод в этой группе считается частью цепи.
Нитрилы
Нитрилы содержат группу -CN и раньше назывались цианидами.
Пример 1: Напишите структурную формулу для этаннитрила .
Название показывает 2-углеродную цепь без углерод-углеродной двойной связи. нитрил показывает группу -CN в конце цепи.Как и в предыдущих примерах, касающихся кислот и производных кислот, не забывайте, что углерод в группе -CN считается частью цепи.
Старое название для этого было бы метилцианид . Вы можете подумать, что это проще, но как только цепочка усложняется, она не работает — как показывает следующий пример.
Пример 2: Напишите структурную формулу для 2-гидроксипропаннитрила .
Здесь у нас есть 3 углеродных цепи, без углерод-углеродных двойных связей и группа -CN на конце цепи.Углерод в группе -CN считается углеродом номер 1. На углероде с числом 2 присутствует группа -ОН (, гидрокси, , ). Обратите внимание, что вы не можете использовать или , потому что у вас уже есть , , нитрил , .
Первичные амины
Первичный амин содержит группу -NH 2 , присоединенную к углеводородной цепи или кольцу. Вы можете думать об аминах как о производных аммиака, NH 3 .В первичном амине один из атомов водорода был заменен углеводородной группой.
Пример 1: Напишите структурную формулу для этиламина .
В этом случае этильная группа присоединена к группе -NH 2 .
Это имя (этиламин) хорошо, если у вас есть только короткая цепь, в которой нет никакой двусмысленности относительно того, где находится группа -NH 2 . Но предположим, что у вас 3-углеродная цепь — в этом случае группа -NH 2 может находиться на конечном углероде или на среднем углероде.Как обойти эту проблему, показано в следующем примере.
Пример 2: Напишите структурную формулу для 2-аминопропана .
Название показывает 3 углеродную цепь с аминогруппой, присоединенной ко второму углероду. амино показывает группу -NH 2 .
Этиламин (пример 1 выше) с таким же успехом можно было бы назвать аминоэтаном.
Вторичные и третичные амины
Вы, скорее всего, найдете только простые примеры из них.Во вторичном амине два атома водорода в молекуле аммиака были заменены углеводородными группами. В третичном амине все три атома водорода заменены.
Пример 1: Напишите структурную формулу для диметиламина .
В этом случае два атома водорода в аммиаке были заменены метильными группами.
Пример 2: Напишите структурную формулу для триметиламина .
Здесь все три водорода в аммиаке были заменены метильными группами.
Аминокислоты
Аминокислота содержит как аминогруппу -NH 2, так и группу карбоновой кислоты -COOH в одной молекуле. Как и во всех кислотах, углеродная цепь пронумерована так, что углерод в группе -COOH считается номером 1.
Пример: Напишите структурную формулу для 2-аминопропановой кислоты .
У этого есть 3 углеродных цепи без углерод-углеродных двойных связей. На втором углероде (считая углерод -COOH как число 1) находится аминогруппа -NH 2 .
,Формула и структура. Химическая структура карбоната натрия — это Na 2 CO 3 , а его молярная масса составляет 106,0 г / моль. Карбонат натрия является ионным соединением — натриевой солью угольной кислоты и состоит из двух катионов натрия (Na + ) и карбонат-аниона (CO 3 — ). Он имеет кристаллическую гептагидратную структуру.
Возникновение: карбонат натрия встречается в природе в минеральной форме в виде его гидратных солей (таких как трона, натрон, натрит и т. Д.).). Есть несколько месторождений полезных ископаемых в сухих регионах по всему миру.
. Приготовление: карбонат натрия получают коммерческим путем двумя различными способами. Первый метод включает в себя разработку месторождений полезных ископаемых карбоната натрия, который является основным методом производства в США. Во втором методе, называемом процессом Сольвея, хлорид натрия взаимодействует с аммиаком с образованием бикарбоната натрия, который затем нагревается с образованием карбоната натрия.
Физические свойства: Карбонат натрия представляет собой белый кристаллический порошок с плотностью 2.54 г / мл и температура плавления 851 ° C.
Химические свойства: карбонат натрия является стабильным, но гигроскопичным твердым веществом (поглощает воду из воздуха) и легко растворяется в воде с образованием слабокислой углекислоты и сильного основания, гидроксида натрия. Таким образом, водный раствор Na 2 CO 3 в целом является сильным основанием. Реагирует бурно со многими кислотами. При нагревании до высоких температур он разлагается, выделяя токсичные пары оксида динатрия (Na 2 O).
Применение: Основное применение карбоната натрия — умягчитель воды, пищевая добавка, модификатор pH, химикат для бассейна и электролит.Он также используется в производстве стекла, бумаги, мыла и моющих средств и многих других полезных химических веществ.
Воздействие на здоровье / опасности для здоровья: растворы карбоната натрия сильно щелочные и едкие. При контакте может вызвать сильное раздражение кожи и глаз. Вдыхание пыли или паров карбоната натрия может вызвать раздражение слизистых оболочек и дыхательных путей и привести к сильному кашлю и одышке. Высокие концентрации могут повредить глаз и вызвать ожоги кожи.
