Пропионат натрия, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
=3260°C23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,074d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t° пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Пропионовая кислота и пропионаты
ПРОПИОНОВАЯ КИСЛОТА И ПРОПИОНАТЫ. ПОЛЬЗА ДЛЯ ОРГАНИЗМА И ПРИМЕНЕНИЕ В НАРОДНОМ ХОЗЯЙСТВЕ
ПРОПИОНОВАЯ КИСЛОТА
Пропионовая кислота (англ. propionic acid) — (пропановая или метилуксусная кислота, консервант E280) — одноосновная предельная карбоновая кислота — бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos» — первый, «pion» — жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот. Относится к короткоцепочечным (летучим) жирным кислотам. Соли и анионы пропионовой кислоты называются пропионатами.
Химическая Формула пропионовой кислоты: C3H6O2
Линейная Формула: CH3CH2COOHПРОПИОНАТ
Пропионат (англ. propionate), или ион пропаноата (propanoate ион) — сопряженное основание пропионовой кислоты (пропионовая кислота минус один водородный ион).
propionate), или ион пропаноата (propanoate ион) — сопряженное основание пропионовой кислоты (пропионовая кислота минус один водородный ион).
Химическая формула пропионата: C3H5O2−
Рациональная формула: CH3CH2COO
Пропионовое соединение представляет собой небольшую соль или сложный эфир пропионовой кислоты. Ниже приведены примеры пропионатов — солей пропионовой кислоты, которые используются в пищевой отрасли:
| ПРОПИОНАТ КАЛЬЦИЯ Синоним: Кальциевая соль пропионовой кислоты Хим. Формула: Ca(C3H5O2)2 Рациональная: Ca(CH3CH2COO)2 | ПРОПИОНАТ НАТРИЯСиноним: Натриевая соль пропионовой кислоты Хим. Рациональная:CH3CH2COONa |
ЭНДОГЕННЫЕ ПРОПИОНАТЫ и ПРОПИОНОВАЯ КИСЛОТА, ПРОДУЦИРУЕМЫЕ КИШЕЧНОЙ МИКРОФЛОРОЙ
Среди постоянно обитающей в кишечнике человека индигенной микробиоты важную роль играют бактерии, продуцирующие пропионовую кислоту (пропионаты) в процессе пропионовокислого брожения. Это представители родов и семейств:
- Propionibacterium (пропионибактерии), включая: Arachnia, которые ранее классифицировались как отдельный род, а в настоящее время включены в род Propionibacterium (в частности, вид Arachnia propionica переименован в Propionibacterium propionicus)
- представители семейства Veillonellaceae (вейлонеллы): Veillonella и Anaerovibrio
Эти кишечные бактерии сбраживают молочную кислоту, глюкозу, лактозу и другие углеводы, а также некоторые спирты с образованием пропионовой и уксусной кислот (пропионата и ацетата) и углекислого газа.
Далее перечислены некоторые физиологические эффекты пропионовой кислоты (пропионатов), как метаболита кишечной микрофлоры (Ардатская М.Д., Минушкин О.Н.):
1) энергообеспечение эпителия; 2) антибактериальный эффект; 3) регуляция пролиферации и дифференцировки эпителия; 4) поставка субстратов глюконеогенеза; 5) блокировка адгезии патогенов к эпителию; 6) поддержание ионного обмена.
Следует отметить, что пропионовая кислота участвует также в синтезе гормонов, нейромедиаторов (серотонина, эндорфинов) и обладает противогрибковым эфектом.
Значительная часть продуцированной бактериями пропионовой кислоты (пропионатов) проникает в локальные кишечные капилляры и по системе воротной вены достигает печени, где подвергается дальнейшей трансформации с образованием глюкозы. Пропионовая кислота в гепатоцитах, преимущественно, участвует в глюконеогенезе, а также является регулятором метаболических процессов и липидного обмена в печени (Ардатская М. Д.).
Д.).
По имеющимся данным, около 90% количества пропионовой кислоты метаболизируется печенью, а остальная часть транспортируется в периферическую кровь, где еe количество у человека достигает ≈6 мкмоль/л, что значительно превышает таковое у бутирата, но ниже, чем у ацетата.
См. также: Применение пропионовокислых бактерий для образования пропионовой кислоты и/или пропионатов в ободочной кишке
ДРУГИЕ ПОЛЕЗНЫЕ СВОЙСТВА ПРОПИОНОВОЙ КИСЛОТЫ (ПРОПИОНАТОВ) ДЛЯ ЗДОРОВЬЯ
Благотворное влияние пропионовой кислоты и ее производных давно изучается учеными:
Так в работе Jan, G.; et al. «Propionibacteria induce apoptosis of colorectal carcinoma cells via short-chain fatty acids acting on mitochondria». Cell Death & Differentiation. 9, 179-188 (2002). показано как Пропионибактерии индуцируют апоптоз клеток колоректальной карциномы через короткоцепочечные жирные кислоты, в частности, пропионовую кислоту (пропионат), действующие на митохондрии.
В работе Hao Guo, Jenny P. Y. Ting, et al. Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites. Science, 2020; 370 (6516): eaay9097 было показано, что пропионат является радиопротекторным метаболитом кишечной микробиоты и защищает организм от опасного радиационного воздействия.
В работе Mario M. Zaiss., et al. Short-chain fatty acids regulate systemic bone mass and protect from pathological bone loss. Nature Communications, 9, Article number: 55 (2018). показано, что пропионат защищает костную систему от патологического разрушения (предотвращает остеопороз).
В работе Chambers ES, et al. Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults. Gut 2015; 64: 1744–1754 говорится, как адресная доставка пропионата в толстую кишку нормализует вес у взрослых.
В работе Jonathan Scheiman, Sarah Lessard, Aleksandar D. Kostic, et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nature Medicine, 2019 было показано, что пропионат является причиной повышения физической выносливости (таким образом, он может быть полезен как спорсменам, так и лицам с малоподвижным образом жизни, повышая их работоспособность).
Kostic, et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nature Medicine, 2019 было показано, что пропионат является причиной повышения физической выносливости (таким образом, он может быть полезен как спорсменам, так и лицам с малоподвижным образом жизни, повышая их работоспособность).
В работе Sa’ad Al-Lahham & Farhad Rezaee. Propionic acid counteracts the inflammation of human subcutaneous adipose tissue: a new avenue for drug development. DARU Journal of Pharmaceutical Sciences (2019) 27:645–652 было показано противовоспалительное действие пропионовой кислоты на воспаление подкожно-жировой клетчатки человека.
В работе Aiden Haghikia et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 2020 Mar 19; 180 (6): 1067-1080. e16. было показано, что пропионовая кислота, изменяя состав кишечной микробиоты и восстанавливая дисбаланс клеток Treg / Th27, может служить мощной иммуномодулирующей добавкой к препаратам от рассеянного склероза
В работе Lars Tönges et al. Propionic Acid and Fasudil as Treatment Against Rotenone Toxicity in an In Vitro Model of Parkinson’s Disease. Molecules 2020, 25, 2502 было показано, что лечение пропионовой кислотой показывает благоприятный потенциал в пораженных ротеноном первичных мезенцефальных клетках (в исследовании использовали модельную систему болезни Паркинсона для культивируемых первичных мезенцефальных клеток и пестицид ротенон использовали для моделирования повреждения дофаминергических клеток). Пропионовая кислота способствовала выживанию дофаминергических клеток против токсичности ротенона и увеличению роста нейритов в умеренной степени. Таким образом, данные по лечению пропионовой кислотой в парадигме ротенона in vitro подчеркивают ее благоприятный потенциал для дофаминергических нейронов при болезни Паркинсона.
Propionic Acid and Fasudil as Treatment Against Rotenone Toxicity in an In Vitro Model of Parkinson’s Disease. Molecules 2020, 25, 2502 было показано, что лечение пропионовой кислотой показывает благоприятный потенциал в пораженных ротеноном первичных мезенцефальных клетках (в исследовании использовали модельную систему болезни Паркинсона для культивируемых первичных мезенцефальных клеток и пестицид ротенон использовали для моделирования повреждения дофаминергических клеток). Пропионовая кислота способствовала выживанию дофаминергических клеток против токсичности ротенона и увеличению роста нейритов в умеренной степени. Таким образом, данные по лечению пропионовой кислотой в парадигме ротенона in vitro подчеркивают ее благоприятный потенциал для дофаминергических нейронов при болезни Паркинсона.
В работе Lesley Hoyles, Simon McArthur, et. al. Microbiome–host systems interactions: protective effects of propionate upon the blood–brain barrier. Microbiome, 2018 британские ученые исследовали и показали защитные эффекты пропионата на гематоэнцефалический барьер:
Microbiome, 2018 британские ученые исследовали и показали защитные эффекты пропионата на гематоэнцефалический барьер:
Гемато-энцефалический барьер (ГЭБ) — физиологический барьер между кровеносной системой и центральной нервной системой. Главная функция — поддержание гомеостаза мозга. Он защищает нервную ткань от циркулирующих в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы, которые воспринимают ткань мозга как чужеродную. ГЭБ выполняет функцию высокоселективного фильтра, через который из артериального русла в мозг поступают питательные, биоактивные вещества; в направлении венозного русла с глимфатическим потоком выводятся продукты жизнедеятельности нервной ткани.
- Пропионат, вырабатываемый из пищевых субстратов бактериями толстой кишки, стимулирует глюконеогенез кишечника и связан со сниженным стрессовым поведением, но его потенциальная эндокринная роль не была рассмотрена.
 В проведенном исследовании, после демонстрации экспрессии рецептора пропионата FFAR3 (Free fatty acid receptor 3) на эндотелии головного мозга человека, ученые изучили влияние физиологически релевантной концентрации пропионата (1 µmol или 10−6 моль) на свойства ГЭБ in vitro. Как оказалось, пропионат ингибировал пути, связанные с неспецифическими микробными инфекциями через CD14-зависимый механизм, подавлял экспрессию LRP-1 (белка 1, подобного рецептору липопротеинов низкой плотности) и защищал ГЭБ от окислительного стресса посредством передачи сигналов фактора транскрипции NRF2 – основного протеина, регулирующего экспрессию антиоксидантных белков.
В проведенном исследовании, после демонстрации экспрессии рецептора пропионата FFAR3 (Free fatty acid receptor 3) на эндотелии головного мозга человека, ученые изучили влияние физиологически релевантной концентрации пропионата (1 µmol или 10−6 моль) на свойства ГЭБ in vitro. Как оказалось, пропионат ингибировал пути, связанные с неспецифическими микробными инфекциями через CD14-зависимый механизм, подавлял экспрессию LRP-1 (белка 1, подобного рецептору липопротеинов низкой плотности) и защищал ГЭБ от окислительного стресса посредством передачи сигналов фактора транскрипции NRF2 – основного протеина, регулирующего экспрессию антиоксидантных белков.
P.S. В дополнение ко всему следует напомнить об антимикробном (бактерицидном и бактериостатическом) действии пропионовой кислоты (пропионатов), что является эффективной защитой нашего организма в отношении патогенных микроорганизмов (грамотрицательных энтеробактерий, клебсиелл, протеев, псевдоманад и других болезнетворных микробов), в т.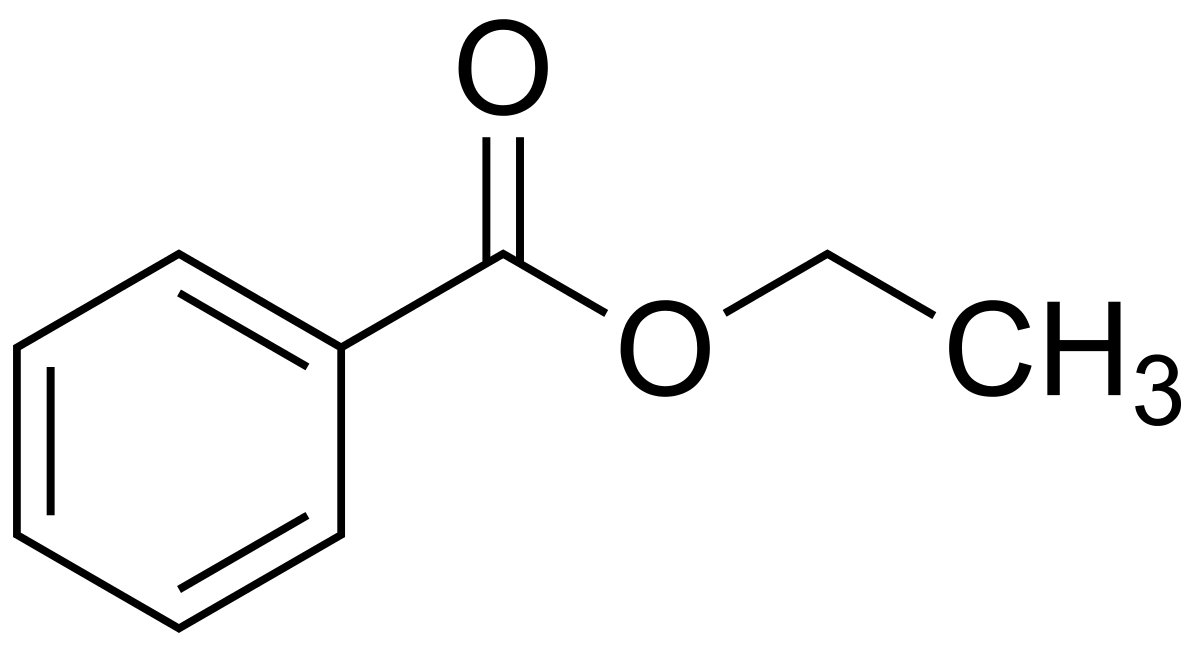 ч. благодаря созданию благоприятной pH-среды для развития дружественной симбионтной микрофлоры.
ч. благодаря созданию благоприятной pH-среды для развития дружественной симбионтной микрофлоры.
ПРИМЕНЕНИЕ ПРОПИОНОВОЙ КИСЛОТЫ И ПРОПИОНАТОВ В НАРОДНОМ ХОЗЯЙСТВЕ
Пропионовая кислота и её производные применяют в производстве гербицидов (пропанол, дихлорпрол), лекарств (ибупрофен, феноболин), ароматических веществ, растворителей, винилпластификаторов и ПАВ (гликолевые эфиры).
Пропионовая кислота препятствует росту плесени и некоторых бактерий. Поэтому большая часть производимой пропионовой кислоты используется как консервант в продуктах, потребляемых человеком, и в продуктах для животных. В продуктах для животных применяется непосредственно пропионовая кислота, либо её аммониевая соль (пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебе и в других хлебобулочных изделиях, пропионовая кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
Основная опасность пропионовой кислоты — это химические ожоги, которые могут произойти при контакте с концентрированной кислотой.
ПОЛУЧЕНИЕ ПРОПИОНОВОЙ КИСЛОТЫ (ПРОПИОНАТОВ) В НАРОДНОМ ХОЗЯЙСТВЕ
В природе пропионовая кислота найдена в нефти, образуется при брожении углеводов. В промышленности ее получают карбонилированием этилена по реакции Репле; каталитическим окислением пропионового альдегида в присутствии кобальта или ионов марганца; Пропионовую кислоту также получают биологически при метаболическом разложении жирных кислот, содержащих нечётное число атомов углерода, и при разложении некоторых аминокислот. Бактерии рода Propionibacterium производят пропионовую кислоту как конечный продукт своего анаэробного метаболизма. Эти бактерии встречаются в рубце жвачных животных, и отчасти из-за их деятельности швейцарский сыр имеет свой аромат.
пищевая промышленность:
ВЛИЯНИЕ ЭКЗОГЕННОЙ ПРОПИОНОВОЙ КИСЛОТЫ И ПРОПИОНАТОВ НА ЗДОРОВЬЕ
Пропионовая кислота и ее соли (пропионаты) — пищевые Е-добавки, которые часто можно встретить в описании состава пищевых продуктов. Пропионовая кислота и ее производные здесь названы экзогенными, т.к. они химически синтезированы промышленным способом и поступают в организм извне с продукатми питания, в которых они присутствуют.
Пропионовая кислота и ее производные здесь названы экзогенными, т.к. они химически синтезированы промышленным способом и поступают в организм извне с продукатми питания, в которых они присутствуют.
Пропионовая кислота Е280 (Propionic acid, пропанкарбоновая кислота)
Пропионовую кислоту используют в пищевой промышленности в качестве консерванта. Вещество представляет собой маслянистую жидкость, имеющую характерный резкий едкий запах и кислый вкус.
Природный источник пропионовой кислоты – жизнедеятельность бактерий рода Propionibacterium. Вещество присутствует в некоторых сортах сыра, для изготовления которых используются пропионовые культуры.
Промышленное производство Е280 осуществляется с помощью химического синтеза.
Применение пропионовой кислоты Е-280
Способность вещества оказывать угнетающие действие на многие виды микроорганизмов, вызывающих порчу пищевых продуктов – дрожжей, плесеней, бактерий, позволяет использовать его в качестве консерванта для увеличения срока годности продовольственных товаров.
Однако возможности применения пропионовой кислоты в пищевой промышленности ограниченны из-за изменения под ее воздействием вкусовых качеств готового продукта. Поэтому для производства продуктов питания обычно используются пропионаты – Е281, Е282 и Е283.
В небольших количествах пропионовую кислоту применяют при изготовлении хлебобулочных изделий, а также для консервирования молочной сыворотки и защиты от плесени зерна. Пропионовая кислота может входить в состав лекарственных и фармацевтических средств, кормов для животных, удобрений.
Влияние пропионовой кислоты Е280 на здоровье человека
Пищевая добавка допущена к применению в пищевой промышленности РФ, стран Еврозоны, США, Канады, присутствует в Кодексе Алиментариус.
Нормативные документы не регламентируют допустимое суточное потребление консерванта, так как его применение в производстве продуктов и так очень ограниченно из-за свойств пропионовой кислоты.
Исследования, проведенные с целью выяснить, каково влияние Е280 на здоровье человека, не выявило токсичных, мутагенных, канцерогенных факторов. Согласно официальным источникам, пищевая добавка является безопасной для организма человека.
Согласно официальным источникам, пищевая добавка является безопасной для организма человека.
С точки зрения химии, пропионовая кислота является жирной кислотой, которая полностью усваивается, не накапливается и выводится из организма в виде углекислого газа в цикле Кребса.
Вред пропионовой кислоты проявляется только при контакте кожных покровов и слизистых оболочек с концентрированным веществом, что вызывает химические ожоги. При употреблении в пищу в составе продуктов Е280 не оказывает негативного воздействия.
Предположения о том, что этот консервант может вызывать онкологические заболевания, не подтверждается официальными исследованиями.
Безопасный консервант Е280 — пропионовая кислота (видео)
Пропионат натрия Е281 (Sodium propionate, натриевая соль пропионовой кислоты)
Пропионатом натрия называется пищевая добавка Е-281, используемая в качестве консерванта. Пищевая добавка представляет собой белый порошок, имеющий резкий запах, хорошо растворяющийся в воде.
В форме пропионовой кислоты вещество содержится в нефти, а также образуется в результате воздействия бактерий в желудке жвачных животных и некоторых видах твердых сыров. Консервант производится с помощью химического синтеза при взаимодействии пропионовой кислоты с едким натром.
Применение пропионата натрия Е281
Этот консервант используется в пищевой промышленности реже, чем Е282. Пропионат натрия замедляет рост микроорганизмов, вызывающих порчу продуктов.
Основная сфера применения пищевой добавки – хлебопекарная и кондитерская промышленность. Е 282 используется также для изготовления косметических и лекарственных средств.
Влияние пропионата натрия на здоровье
Консервант имеет разрешение для производства продовольственных товаров в РФ, ЕС, США, Канаде и других странах, присутствует в Международных стандартах на пищевые продукты.
Допустимое суточное потребление пропионата натрия не ограничивается нормативными документами.
В результате проведенных официально исследований не было выявлено негативных последствий употребления в пищу продуктов, в состав которых входит данный консервант. В организме человека пропионат натрия полностью усваивается и выводится из организма.
Существует альтернативная информация о том, что Е281 и другие производные пропионовой кислоты могут вызывать головные боли и провоцировать онкологические заболевания, однако это не подтверждается официальными исследованиями.
Пропионат кальция Е282 (Calcium propionate)
Пропионатом кальция называется пищевая добавка — консервант, кальциевая соль пропионовой кислоты. Вещество представляет собой кристаллический порошок белого цвета с резким запахом пропионовой кислоты, хорошо растворимый в воде.
Применение пропионата кальция Е282
Из всех солей пропионовой кислоты Е282 чаще всего используется в пищевой промышленности для препятствования росту нежелательной микрофлоры.
Консервант применяется для производства хлебобулочных и мучных кондитерских изделий, сыров и сырных продуктов. Е 282 также входит в состав косметических и лекарственных средств.
Влияние пропионата кальция Е-282 на здоровье человека
Пищевая добавка разрешена для производства продуктов питания в РФ, странах Евросоюза, США, Канаде. В Международных стандартах «Кодекс Алиментариус» Е282 разрешено использовать для изготовления плавленых сыров и продуктов на их основе.
Допустимое суточное потребление пропионата кальция не ограничено.
Согласно официальным данным, Е282 не наносит вреда здоровью человека. В результате проведенных исследований было выяснено, что у пропионовой кислоты отсутствуют канцерогенные, токсичные и мутагенные свойства, а также кумулятивный эффект. Пропионат кальция полностью усваивается организмом и выводится в виде углекислого газа.
Вред пропионатов может быть связан с химическими ожогами при контакте с концентрированной кислотой, что исключается при употреблении пищевых продуктов.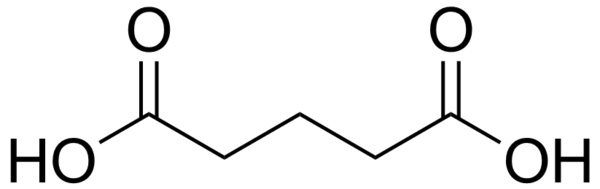
сельское хозяйство
ПРОПИОНОВАЯ КИСЛОТА и ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ В СИЛОСОВАНИИ КОРМОВ
Как известно, силос получают путём заквашивания измельчённой зелёной массы травянистых растений, пригодной для корма животных и птиц. Как правило, этот сочный корм получают в результате консервирования молочной кислотой. И, как правило, консервирование без доступа воздуха (в анаэробных условиях) является наиболее распространённым способом заготовки.
А что если основным консервантом выступит пропионовая кислота?
1. ПРОПИОНОВАЯ КИСЛОТА
Пропионовая кислота — естественный метаболит живого организма (продуцируют ее пропионовые бактерии). В рубце жвачных (отдел желудка) ее образуется от З00 до 1100 г. И широкое применение эта кислота нашла для консервирования влажного зерна в аэробных условиях. Биоцидное и биостатическое действие пропионовой кислоты на микроорганизмы заключается в ее воздействии на обмен углеводов и энергообмен некоторых ферментов, вследствие чего подавляется жизнедеятельность микробов. Пропионовая кислота ограничивает процессы брожения (вторичное брожение) в готовом силосе, значительно угнетает развитие плесневых грибов и дрожжей.
Пропионовая кислота ограничивает процессы брожения (вторичное брожение) в готовом силосе, значительно угнетает развитие плесневых грибов и дрожжей.
В опытах НИИ животноводства России по консервированию травы люцерны пропионовой кислотой (3 кг/т зеленой массы) после 6-месячного хранения силоса потери сухого вещества по сравнению с контролем снизились в 2,5, общего азота – в 2,2, а безазотистых экстрактивных веществ (БЭВ) – в 1,5 раза. Расчеты показали, что использование пропионовой кислоты как консерванта зеленой массы люцерны дает возможность дополнительно получать 1,2 ц сухого вещества с 1 га площади посева культуры.
При внесении пропионовых бактерий (ПКБ) в силосуемые растения, прежде всего с высоким содержанием сахаров (кукуруза), получили корм более высокого качества, чем в контроле (без внесения ПКБ). Он имел низкую кислотность, был обогащен витаминами В2 и В12, пропионовой кислотой и не подвергался плесневению.
В результате скармливания такого силоса в течении 3 месяцев повысилась яйценоскость птиц, выводимость цыплят, сохранность молодняка животных, в крови которых увеличивается содержание каротина и снижается содержание аммиака. Пропионовая кислота, являясь естественным метаболитом, полностью усваивается жвачными животными в качестве источника энергии, не вызывая при этом отрицательных последствий.
Как видите – одни плюсы))) Ну а если пропионовая кислота является продуктом жизнедеятельности пропионовокислых бактерий, то почему бы не использовать сами микроорганизмы?
2. ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ В СИЛОСОВАНИИ
Логично, что уже додумались о силосовании с использованием самих продуцентов органических кислот-консервантов, т.е. об использовании бактериальных заквасок. Закваски пропионовокислых бактерий (ПКБ) входят в ряд бакконцентратов, используемых для заготовки силоса, и основным консервирующим веществом в таком корме является конечно же пропионовая кислота…
Для примера, рассмотрим отличие готового корма, приготовленного с использованием бакконцентрата «Казахсил-М» (один из препаратов для силосования с сухой закваской ПКБ) от силоса, заготовленного по традиционной технологии, где основным консервирующим веществом является молочная кислота.
ОТЛИЧИЯ КОРМА (ПРЕИМУЩЕСТВА):
1. Кислотность силосной массы стабильно утверждается показателем рН 4,1-4,3, значительно выше, чем у корма приготовленного под действием только молочнокислых бактерий. Более высокое значение рН повышает потребление корма на 12-15% и снижает риск заболевания животных ацидозом, кетозом, заболеваний копыт.
2. Повышает активность рубцовой микрофлоры, так как содержит витамины группы В – продукты жизнедеятельности пропионовокислых бактерий. Это способствует активации процессов рубцового пищеварения, а также повышения переваримости органического вещества рациона.
3. В готовом силосе и сенаже при контакте с воздухом не происходит рост и развитие микроскопических грибов, следовательно, корм не содержит микотоксинов и не происходит его разогревание, так как пропионовая кислота микробного синтеза обладает резко выраженным фунгицидным действием. В силосе и сенаже, где основным консервирующим веществом является молочная кислота, этого процесса предотвратить не возможно. Следовательно, при контакте с воздухом идет процесс обсеменения готового корма микотоксинами. Микотоксины резко снижают активность рубцовой микрофлоры, а также способствуют развитию ряда заболеваний, связанных с расстройством пищеварения и общего обмена веществ.
4. Корм, где основным консервирующим веществом является пропионовая кислота, значительно менее подвержен порче в процессе хранения и сохраняет свои питательные свойства в течение 2-3 лет после окончания процесса консервации. Молочная же кислота в процессе хранения оказывает разрушающее действие на питательные компоненты корма, а следовательно снижает его питательность и зачастую на 2 год хранения в корме резко снижается содержание питательных веществ, его поедаемость и качество (отмечаются очаги роста и развития гнилостных процессов и плесени).
P.S. И поверьте, использование такого силосования сокращает применение антибиотиков в животноводстве, что сказывается в итоге и на здоровье людей.
См. дополнительно:
К разделу: Короткоцепочечные жирные кислоты
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- РОЛЬ МИКРОБИОМА В ТЕРАПИИ РАКА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ДИСБАКТЕРИОЗ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Пропионат натрия, пропионат натрия CAS 137-40-6 пропаноат натрия производителей и поставщиков. — Цена
Пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия
Китай Пропионат натрия, Пропионат натрия CAS 137-40-6 завод, Поставщик, Производитель в Китае.
Синонимы: натриевая соль пропионовой кислоты, пропаноат натрия
Номер CAS: 137-40-6
Характеристики: Белый порошок.
Чистота (анализ): ультра чистая.
Молекулярная формула: C3H5O2Na или Ch4Ch3COONa или C3H5NaO2
Формула структуры:
Пакет: 25 кг / волоконный барабан
Ключевые слова:
Пропионат натрия, пропионат натрия CAS 137-40-6
Свойства:
Описание:
Пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия — это прозрачная кристаллическая натриевая соль пропионовой кислоты, NaC3H5O2, которая используется в качестве фунгицида и бактерицида, особенно для предотвращения порчи пищи.
Пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия — это органическая натриевая соль, содержащая равное количество ионов натрия и пропионата. Это вещество может действовать как противогрибковый препарат и пищевой консервант. Состав содержит пропионат.
Являясь самым известным китайским поставщиком пропионата натрия, пропионата натрия CAS 137-40-6 в Китае, продукция Fengchen Group хорошо упакована в новейшую и самую безопасную упаковку.
Наиболее известный пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия — это обычная пищевая добавка, которая производится в промышленности, но также встречается в природе. Поскольку этот химикат токсичен для плесени и некоторых видов бактерий, пропионат натрия и пропионат натрия CAS 137-40-6 могут быть особенно эффективными добавками в выпеченных продуктах, подверженных порче. Это безопасное соединение при низком уровне в пище.
Пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия — это солевая форма пропионовой кислоты, которая представляет собой органическую кислоту, образующуюся при химической деградации сахара. Это соединение, которое вырабатывается в организме естественным путем при метаболизме определенных жирных кислот и аминокислот. Пропионовая кислота метаболизируется в результате ряда ферментативных реакций, которые зависят от присутствия витамина B-12. Пропионат натрия, пропионат натрия CAS 137-40-6 также химически изготавливается для различных промышленных применений.
Химически синтезированный пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия наиболее широко используется в качестве консерванта в пищевой промышленности. Это поможет предотвратить рост плесени и некоторых бактерий, тем самым продлевая срок годности упакованных хлебобулочных изделий. Согласно нормативам, пропионат натрия, пропионат натрия CAS 137-40-6 обычно считается безопасным при применении в качестве пищевой добавки. Это также используется, чтобы предотвратить рост плесени в упакованных и обработанных сырных продуктах. Кроме того, пропионат натрия, пропионат натрия CAS 137-40-6 и пропионат аммония применяются в качестве добавки в корм для животных для предотвращения чрезмерного роста нежелательных бактерий в желудках скота.
Исследования, опубликованные много лет назад, уже доказывают, что изменение метаболизма Aspergillus glaucus препятствует его росту. Этот вид является плесенью, которая растет на зерне и выпечке. Пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия способен замедлять или предотвращать рост бактерии Listeria, распространенного загрязнителя в упакованных сырах и мясных закусках. Применение пропионата натрия, пропионата натрия CAS 137-40-6 в качестве пищевой добавки является идеальным, потому что его эффективные концентрации достаточно низкие, чтобы вы не могли попробовать его в продуктах.
СИНОНИМЫ | Пропаноат натрия |
ОПРЕДЕЛЕНИЕ | |
Химическое название | Пропионат натрия, пропионат натрия CAS 137-40-6 |
Химическая формула | C3H5NaO2 |
Структурная формула | Ch4Ch3COO-Na +, |
Вес формулы | 96,06 |
анализ | Не менее 99,0% в пересчете на сухое вещество |
ОПИСАНИЕ | Пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия — это белые или бесцветные, гигроскопичные кристаллы с не более чем слабым характерным запахом |
ФУНКЦИОНАЛЬНОЕ ИСПОЛЬЗОВАНИЕ | Консервант, анти-плесень и анти-канатный агент |
ХАРАКТЕРИСТИКИ | |
УДОСТОВЕРЕНИЕ ЛИЧНОСТИ | |
Растворимость | Свободно растворим в воде, растворим в этаноле |
Положительный тест на натрий | Проходит тест |
Положительный тест на пропионат | |
Нагреть образец серной кислотой. Выделенная пропионовая кислота может быть распознана по ее запаху. | |
Положительный тест на щелочную соль органической кислоты | |
Зажечь образец при относительно низкой температуре. Щелочной остаток выделяется кислотой. | |
ЧИСТОТА | |
Убыток от высыхания | 4% МАКС. (105 °, 2 часа) |
Нерастворимое в воде вещество | 0,1% Макс |
pH | 7,5 — 10,5 (раствор 1 в 10) |
Железо | Не более 50 мг / кг |
вести | Не более 5 мг / кг. Подготовьте раствор образца в соответствии с указаниями для органических соединений в предельном тесте, используя 5 г иона свинца (Pb) в контроле. |
ИСПЫТАНИЯ | |
ТЕСТЫ ЧИСТОТЫ | |
Нерастворимое в воде вещество | Взвешивают 5 г образца пропионата натрия, пропионата натрия CAS 137-40-6 пропаноата натрия с точностью до мг, переносят в стакан на 100 мл и добавляют 50 мл воды. Перемешивайте до тех пор, пока весь образец не окажется полностью растворенным. Фильтруют через тигель Гука, тарированный с точностью до ± 0,2 мг. Ополосните стакан 20 мл воды. Высушите тигель с его содержимым в духовке при 60 ° до постоянного веса. Охладить в эксикаторе, взвесить и рассчитать в процентах. |
МЕТОД АНАЛИЗА | Взвесьте с точностью до мг 3 г образца пропионата натрия, пропионата натрия CAS 137-40-6 Пропаноат натрия, предварительно высушенный при 105 ° С в течение 1 часа, в перегонной колбе и добавьте 200 мл 50% фосфорной кислоты. Кипятить 2 часа и собирать дистиллят. Во время перегонки поддерживайте объем в колбе примерно 200 мл, добавляя воду с помощью капельной воронки. Титрируют дистиллят IN гидроксидом натрия, используя фенолфталеин TS в качестве индикатора. Каждый мл IN гидроксида натрия соответствует 96,06 мг C3H5NaO2. |
Fengchen Group является ведущим китайским поставщиком пропионата натрия, пропионата натрия CAS 137-40-6. Мы специализируемся на оптовых и оптовых партиях, обеспечивая всем нашим клиентам подходящий производитель пропионата натрия Китая, пропионат натрия CAS 137-40-6, когда он им нужен. Если вы собираетесь купить или приобрести пропионат натрия, порошок пропаноата натрия CAS 137-40-6 из Китая, обратитесь к Fengchen Group.
Сертификат анализа (COA, TDS)
Название продукта | Пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия | ||
Тестируемый предмет | стандарт | Результат | |
Внешность | белый порошок | Соответствует требованиям | |
Удостоверение личности | Должен соответствовать. | Соответствует требованиям | |
Убыток от высыхания | ≤ 1,00% | 0,89% | |
Свободная кислота | Должен соответствовать. | Соответствует требованиям | |
Свободная щелочь | Должен соответствовать. | Соответствует требованиям | |
Щелочность (как Na2CO3) | ≤ 0,15% | ||
Железо | ≤ 30 промилле | 30> | |
Тяжелый Металл (как Pb) | ≤ 2 промилле | 2> | |
Чистота (анализ) | 99,0% -100,5% | 99,22% | |
Высокое качество, чистый пропионат натрия, пропионат натрия CAS 137-40-6 Пропаноат натрия Порошок / вещество завод, Поставщик, Производитель в Китае.
Если вы ищете пропионат натрия, пропанат натрия 137-40-6 пропаноат натрия, обращайтесь к нам. Мы являемся одним из ведущих и профессиональных китайских производителей и поставщиков в этой области. Конкурентоспособная цена и хорошее послепродажное обслуживание.Hot Tags: натрия пропионат, натрия пропионат cas 137-40-6 пропаноат натрия, производители, поставщики, цена
Добавки пищевые. Калия пропионат Е283. Технические условия – РТС-тендер
ГОСТ Р 55581-2013
ОКС 67.220.20
ОКП 91 1230
Дата введения 2015-01-01
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом пищевых ароматизаторов, кислот и красителей Российской академии сельскохозяйственных наук (ГНУ ВНИИПАКК Россельхозакадемии)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 154 «Пищевые добавки и ароматизаторы»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 6 сентября 2013 г. N 856-ст
4 В настоящем стандарте учтены требования Единого стандарта на пищевые добавки Комиссии Кодекса Алиментариус CODEX STAN 192-1995* «General Standard for Food Additives» (пункт 3.4) в части Спецификации на пищевую добавку Е283 Единого свода спецификаций пищевых добавок Объединенного экспертного комитета по пищевым добавкам ФАО/ВОЗ «Combined compendium of food additive specification JECFA. Volume 4».
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт http://shop.cntd.ru. — Примечание изготовителя базы данных.
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (gost.ru)
1 Область применения
Настоящий стандарт распространяется на пищевую добавку Е283, представляющую собой калиевую соль пропионовой кислоты (далее — пищевой пропионат калия) и предназначенную для использования в пищевой промышленности как консервант пищевых продуктов.
Требования, обеспечивающие безопасность пищевого пропионата калия, изложены в 3.1.6, к качеству — в 3.1.4 и 3.1.5, к маркировке — в 3.4.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 8.579-2002 Государственная система обеспечения единства измерений. Требования к количеству фасованных товаров в упаковках любого вида при их производстве, расфасовке, продаже и импорте
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.2.007.0-75 Система стандартов безопасности труда. Изделия электротехнические. Общие требования безопасности
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.011-89 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 12.4.103-83 Система стандартов безопасности труда. Одежда специальная защитная, средства индивидуальной защиты ног и рук. Классификация
ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 4109-79 Реактивы. Бром. Технические условия
ГОСТ 4143-78 Реактивы. Калий углекислый кислый. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 4221-76 Реактивы. Калий углекислый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 4517-87 Реактивы. Методы приготовления вспомогательных реактивов и растворов, применяемых при анализе
ГОСТ 4919.1-77 Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов
ГОСТ 5817-77 Реактивы. Кислота винная. Технические условия
ГОСТ 5823-78 Реактивы. Цинк уксуснокислый 2-водный. Технические условия
ГОСТ 5962-2013 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 6552-80 Реактивы. Кислота ортофосфорная. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 6825-91 (МЭК 81-84) Лампы люминесцентные трубчатые для общего освещения
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9285-78 (ИСО 992-75, ИСО 995-75, ИСО 2466-73) Калия гидрат окиси технический. Технические условия
ГОСТ 10354-82 Пленка полиэтиленовая. Технические условия
ГОСТ 10690-73 Калий углекислый технический (поташ). Технические условия
ГОСТ 14192-96 Маркировка грузов
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 14961-91 Нитки льняные и льняные с химическими волокнами. Технические условия
ГОСТ 15846-2002 Продукция, отправляемая в районы Крайнего Севера и приравненные к ним местности. Упаковка, маркировка, транспортирование и хранение
ГОСТ 17308-88 Шпагаты. Технические условия
ГОСТ 18389-73 Проволока из платины и ее сплавов. Технические условия
ГОСТ 19360-74 Мешки-вкладыши пленочные. Общие технические условия
ГОСТ 20478-75 Реактивы. Аммоний надсернокислый. Технические условия
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25794.1-83 Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
ГОСТ 26927-86 Сырье и продукты пищевые. Методы определения ртути
ГОСТ 26930-86 Сырье и продукты пищевые. Метод определения мышьяка
ГОСТ 26932-86 Сырье и продукты пищевые. Методы определения свинца
ГОСТ 27067-86 Реактивы. Аммоний роданистый. Технические условия
ГОСТ 27752-88 Часы электронно-механические кварцевые настольные, настенные и часы-будильники. Общие технические условия
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29169-91 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29251-91 (ИСО 385-1-84) Посуда лабораторная стеклянная. Бюретки. Часть 1. Общие требования
ГОСТ 30090-93 Мешки и мешочные ткани. Общие технические условия
ГОСТ 30178-96 Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов
ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р ИСО 2859-1-2007 Статистические методы. Процедуры выборочного контроля по альтернативному признаку. Часть 1. Планы выборочного контроля последовательных партий на основе приемлемого уровня качества
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р 53361-2009 Мешки из бумаги и комбинированных материалов. Общие технические условия
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Технические требования
3.1 Характеристики
3.1.1 Пищевая добавка Е283 представляет собой калиевую соль пропионовой кислоты.
Химическое название — калий пропионовокислый.
Формулы: эмпирическая ;
структурная
Молекулярная масса — 112,17 а.е.м.
3.1.2 Пищевой пропионат калия вырабатывают в соответствии с требованиями [1] и настоящего стандарта, и применяют в пищевых продуктах в соответствии с [1], [2].
3.1.3 Пищевой пропионат калия гигроскопичен, хорошо растворим в воде, растворим в этаноле.
3.1.4 По органолептическим показателям пищевой пропионат калия должен соответствовать требованиям, указанным в таблице 1.
Таблица 1 — Органолептические показатели
Наименование показателя | Характеристика показателя |
Внешний вид | Бесцветные кристаллы или белый кристаллический порошок |
Запах | Слабый запах пропионовой кислоты |
3.1.5 По физико-химическим показателям пищевой пропионат калия должен соответствовать требованиям, указанным в таблице 2.
Таблица 2 — Физико-химические показатели
Наименование показателя | Характеристика показателя |
Тест на калий-ион | Выдерживает испытание |
Тест на пропионат-ион | То же |
Тест на щелочную реакцию зольного остатка | « |
Массовая доля основного вещества в высушенном пропионате калия, %, не менее | 99,0 |
Массовая доля потерь при высушивании, %, не более | 4,0 |
рН водного раствора массовой долей пропионата калия 10%, ед. рН | От 7,5 до 10,5 включ. |
Массовая доля нерастворимых в воде веществ, %, не более | 0,1 |
Тест на содержание железа не более 30 млн (мг/кг) | Выдерживает испытание |
3.1.6 Содержание токсичных элементов (свинца, мышьяка, ртути) в пищевом пропионате калия не должно превышать норм, установленных [1].
3.2 Требования к сырью
3.2.1 Для производства пищевого пропионата калия используют следующее сырье:
— кислоту пропионовую, содержание пропионовой кислоты не менее 99,5%;
— калия гидроокись по ГОСТ 9285, ГОСТ 24363;
— калий углекислый по ГОСТ 4221;
— калий углекислый технический (поташ) по ГОСТ 10690;
— калий углекислый кислый по ГОСТ 4143.
3.2.2 Допускается применение аналогичного сырья, обеспечивающего получение пищевого пропионата калия в соответствии с требованиями настоящего стандарта и разрешенного к применению в пищевой промышленности.
3.3 Упаковка
3.3.1 Пищевой пропионат калия упаковывают в бумажные трехслойные мешки марки ПМ по ГОСТ Р 53361 или в мешки-вкладыши по ГОСТ 19360 из пищевой полиэтиленовой нестабилизированной пленки марки Н толщиной не менее 0,08 мм по ГОСТ 10354, помещенные в продуктовые мешки по ГОСТ 30090 или в бумажные открытые трехслойные мешки марки НМ по ГОСТ Р 53361.
Тип и размеры мешков, предельную массу упаковываемого пищевого пропионата калия устанавливает производитель.
3.3.2 Полиэтиленовые мешки-вкладыши после их заполнения заваривают или завязывают шпагатом из лубяных волокон по ГОСТ 17308 или двуниточным полированным шпагатом по документу, в соответствии с которым он изготовлен.
3.3.3 Верхние швы тканевых и бумажных мешков должны быть зашиты машинным способом льняными нитками по ГОСТ 14961.
3.3.4 Допускается применение других видов потребительской и транспортной упаковки, изготовленных из материалов, использование которых в контакте с пищевым пропионатом калия обеспечивает сохранение его качества и безопасности в соответствии с [3].
3.3.5 Отрицательное отклонение массы нетто от номинальной массы каждой упаковочной единицы должно соответствовать требованиям ГОСТ 8.579 (таблица А.2).
3.3.6 Пищевой пропионат калия, отправляемый в районы Крайнего Севера и приравненные к ним местности, упаковывают по ГОСТ 15846.
3.4 Маркировка
3.4.1 Необходимо, чтобы маркировка отвечала требованиям, установленным [1] и [4].
3.4.2 Транспортная маркировка должна отвечать требованиям, установленным [4], с нанесением манипуляционных знаков, указывающих на способ обращения с грузами, — по ГОСТ 14192.
4 Требования безопасности
4.1 Пищевой пропионат калия нетоксичен, пожаро- и взрывобезопасен.
4.2 По степени воздействия на организм человека пищевой пропионат калия в соответствии с ГОСТ 12.1.007 относится к четвертому классу опасности.
4.3 Пищевой пропионат калия действует раздражающе на кожу и слизистые оболочки глаз и дыхательных путей. При работе с пищевым пропионатом калия необходимо пользоваться средствами индивидуальной защиты по ГОСТ 12.4.011 и соблюдать правила личной гигиены.
4.4 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 и ГОСТ 12.4.103.
4.5 Организация обучения работающих безопасности труда — по ГОСТ 12.0.004.
4.6 Производственные помещения, в которых проводят работы с пищевым пропионатом калия, и помещения, где проводят работы с реактивами, должны быть оборудованы приточно-вытяжной вентиляцией по ГОСТ 12.4.021.
4.7 Электробезопасность при работе с электроустановками — по ГОСТ 12.2.007.0 и ГОСТ Р 12.1.019.
4.8 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
4.9 Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
5 Правила приемки
5.1 Пищевой пропионат калия принимают партиями.
Партией считают количество пищевого пропионата калия, полученное за один технологический цикл, в одинаковой упаковке, произведенное одним изготовителем по одному документу, сопровождаемое товаросопроводительной документацией, обеспечивающей прослеживаемость продукции.
5.2 Для проверки соответствия пищевого пропионата калия требованиям настоящего стандарта проводят приемо-сдаточные испытания по качеству упаковки, правильности нанесения маркировки, массе нетто, органолептическим и физико-химическим показателям и периодические испытания по показателям безопасности.
5.3 При проведении приемо-сдаточных испытаний применяют одноступенчатый выборочный план при нормальном контроле, специальном уровне контроля S-4, приемлемом уровне качества AQL, равном 6,5, по ГОСТ Р ИСО 2859-1.
Выборку упаковочных единиц осуществляют методом случайного отбора в соответствии с таблицей 3.
Таблица 3
Число упаковочных единиц в партии, шт. | Объем выборки, шт. | Приемочное число | Браковочное число | |||||
От | 2 | до | 15 | включ. | 2 | 0 | 1 | |
« | 16 | « | 25 | « | 3 | 0 | 1 | |
« | 26 | « | 90 | « | 5 | 1 | 2 | |
« | 91 | « | 150 | « | 8 | 1 | 2 | |
« | 151 | « | 500 | « | 13 | 2 | 3 | |
« | 501 | « | 1200 | « | 20 | 3 | 4 | |
« | 1201 | « | 10000 | « | 32 | 5 | 6 | |
« | 10001 | « | 35000 | « | 50 | 7 | 8 | |
5.4 Контроль качества упаковки и правильности маркировки проводят внешним осмотром всех упаковочных единиц, попавших в выборку.
5.5 Контроль массы нетто пищевого пропионата калия в каждой упаковочной единице, попавшей в выборку, проводят по разности массы брутто и массы упаковочной единицы, освобожденной от содержимого. Предел допускаемых отрицательных отклонений от номинальной массы нетто пищевого пропионата калия в каждой упаковочной единице — по 3.3.5.
5.6 Приемка партии пищевого пропионата калия по массе нетто, качеству упаковки и правильности маркировки упаковочных единиц
5.6.1 Партию принимают, если число упаковочных единиц в выборке, не отвечающих требованиям по качеству упаковки, правильности маркировки и массе нетто пищевого пропионата калия, менее приемочного числа или равно ему (см. таблицу 3).
5.6.2 Если число упаковочных единиц в выборке, не отвечающих требованиям по качеству упаковки, правильности маркировки и массе нетто пищевого пропионата калия, более браковочного числа или равно ему (см. таблицу 3), контроль проводят на удвоенном объеме выборки от этой же партии. Партию принимают, если выполняются условия 5.6.1.
Партию бракуют, если число упаковочных единиц в удвоенном объеме выборки, не отвечающих требованиям по качеству упаковки, правильности маркировки и массе нетто пищевого пропионата калия, более браковочного числа или равно ему.
5.7 Приемка партии пищевого пропионата калия по органолептическим и физико-химическим показателям
5.7.1 Для контроля органолептических и физико-химических показателей от каждой упаковочной единицы, попавшей в выборку в соответствии с требованиями таблицы 3, проводят отбор мгновенных проб и составляют суммарную пробу по 6.1.
5.7.2 При получении неудовлетворительных результатов по органолептическим и физико-химическим показателям, хотя бы по одному из показателей, проводят повторные испытания по этому показателю на удвоенном объеме выборки от этой же партии. Результаты повторных испытаний являются окончательными и распространяются на всю партию.
При повторном получении неудовлетворительных результатов испытаний партию бракуют.
5.7.3 Органолептические и физико-химические показатели пищевого пропионата калия в поврежденной упаковке проверяют отдельно. Результаты испытаний распространяют только на пищевой пропионат калия в этой упаковке.
5.8 Порядок и периодичность контроля показателей безопасности (содержание свинца, мышьяка, ртути) устанавливает изготовитель в программе производственного контроля.
6 Методы контроля
6.1 Отбор проб
6.1.1 Для составления суммарной пробы пищевого пропионата калия из разных мест каждой упаковочной единицы, отобранной по 5.3, отбирают мгновенные пробы. Масса мгновенной пробы должна быть не более 100 г.
Масса мгновенной пробы и число мгновенных проб от каждой упаковочной единицы, попавшей в выборку, должны быть одинаковыми.
Мгновенные пробы отбирают с помощью пробоотборников, изготовленных из материалов (нержавеющая сталь, полимеры, стекло, фарфор) инертных к пищевому пропионату калия, погружая пробоотборник в продукт не менее чем на 3/4 глубины.
Для получения суммарной пробы мгновенные пробы помещают в сухую, чистую стеклянную или полиэтиленовую емкость и тщательно перемешивают.
Рекомендуемая масса суммарной пробы должна быть не менее 500 г.
6.1.2 При необходимости уменьшения суммарной пробы может быть использован метод квартования. Для этого суммарную пробу высыпают на чистый стол и разравнивают тонким слоем в виде квадрата. Затем ее деревянными планками со скошенными ребрами ссыпают с двух противоположных сторон на середину так, чтобы образовался валик. Суммарную пробу с концов валика также ссыпают на середину стола, снова ее разравнивают слоем от 1,0 до 1,5 см в виде квадрата и планкой делят по диагонали на четыре треугольника. Две противоположные части пробы отбрасывают, а две оставшиеся соединяют, перемешивают и вновь делят на четыре треугольника. Деление повторяют необходимое число раз, при этом продолжительность процедуры квартования должна быть минимальной.
6.1.3 Подготовленную суммарную пробу делят на две части и каждую часть помещают в чистую, сухую, плотно закрывающуюся стеклянную или полиэтиленовую емкость.
Пробу в одной емкости используют для анализа.
Пробу во второй емкости опечатывают, пломбируют и оставляют для повторного анализа в случае возникновения разногласий в оценке качества и безопасности пищевого пропионата калия. Рекомендуемый срок хранения суммарной пробы при температуре не более 18°С и относительной влажности не более 40% — два года.
6.1.4 Емкости с пробами снабжают этикетками, на которых должно быть указано:
— наименование пищевой добавки и ее Е номер;
— наименование и местонахождение изготовителя;
— номер партии;
— масса нетто партии;
— число мест в партии;
— дата изготовления;
— дата отбора пробы;
— срок хранения пробы;
— фамилии лиц, проводивших отбор пробы;
— обозначение настоящего стандарта.
6.2 Определение органолептических показателей
6.2.1 Сущность метода
Метод основан на органолептическом определении внешнего вида, цвета и запаха пищевого пропионата калия.
6.2.2 Средства измерений, посуда, материалы
Весы неавтоматического действия по ГОСТ Р 53228, обеспечивающие точность взвешивания с пределами абсолютной допускаемой погрешности ±0,1 г.
Термометр жидкостный стеклянный диапазоном измерения температуры от 0°С до 100°С, ценой деления шкалы 1°С по ГОСТ 28498.
Часы электронно-механические кварцевые по ГОСТ 27752.
Стаканчик СВ 34/12 по ГОСТ 25336.
Бумага белая.
Пластинка стеклянная.
6.2.3 Отбор проб — по 6.1.
6.2.4 Условия проведения анализа
При проведении испытаний должны быть соблюдены следующие условия:
— температура окружающего воздуха | от 18°С до 25°С; |
— относительная влажность воздуха | от 40% до 75%. |
Все испытания следует проводить в вытяжном шкафу.
6.2.5 Проведение анализа
6.2.5.1 Внешний вид и цвет пищевого пропионата калия определяют просмотром пробы массой 50 г, помещенной на лист белой бумаги или на стеклянную пластинку при рассеянном дневном свете или освещении люминесцентными лампами типа ЛД по ГОСТ 6825. Освещенность поверхности рабочего стола должна быть не менее 500 лк.
6.2.5.2 Для определения запаха пищевого пропионата калия чистый, без постороннего запаха стаканчик заполняют анализируемой пробой на 2/3 объема, закрывают крышкой и выдерживают в течение 1 ч при температуре (20±5)°С.
Запах определяют органолептически на уровне края стаканчика сразу же после открывания крышки.
6.3 Тест на калий-ион
6.3.1 Сущность метода
Метод основан на качественном определении калий-ионов по окрашиванию бесцветного пламени в фиолетовый цвет или по образованию осадка битартрата калия.
6.3.2 Средства измерений, вспомогательные устройства, посуда, реактивы
Весы неавтоматического действия по ГОСТ Р 53228, обеспечивающие точность взвешивания с пределами абсолютной погрешности ±0,01 г.
Горелка газовая.
Стакан В(Н)-1-250 ТС(ТХС) по ГОСТ 25336.
Пипетки 1-2-2-1, 1-2-2-2 по ГОСТ 29227.
Пробирка П1(2)-14-150 ХС по ГОСТ 25336.
Цилиндр 1-100-1 по ГОСТ 1770.
Проволока платиновая по ГОСТ 18389.
Палочка стеклянная.
Кислота соляная по ГОСТ 3118, х.ч.
Кислота винная по ГОСТ 5817, ч.
Натрий уксуснокислый 3-водный по ГОСТ 199, ч.
Спирт этиловый ректификованный из пищевого сырья по ГОСТ 5962.
Вода дистиллированная по ГОСТ 6709.
6.3.3 Отбор проб — по 6.1.
6.3.4 Условия проведения анализа — по 6.2.4.
6.3.5 Подготовка к анализу
6.3.5.1 Раствор винной кислоты массовой долей 20% готовят в стакане вместимостью 250 см растворением 20,0 г винной кислоты в 80,0 см дистиллированной воды.
Раствор используют свежеприготовленным.
6.3.5.2 Раствор уксуснокислого натрия массовой долей 10% готовят в стакане вместимостью 250 см растворением 10,0 г уксуснокислого натрия в 90,0 смдистиллированной воды.
Раствор используют свежеприготовленным.
6.3.6 Проведение анализа
Способ 1. От 1,5 до 2,0 г пищевого пропионата калия растворяют в 100 см дистиллированной воды в стакане вместимостью 250 см. В пробирку пипеткой вносят 2 см приготовленного раствора, добавляют 1 см раствора винной кислоты по 6.3.5.1, 1 см раствора уксуснокислого натрия по 6.3.5.2, 0,5 см ректификованного этилового спирта и встряхивают. Постепенное образование белого кристаллического осадка подтверждает присутствие ионов калия.
Способ 2. Платиновую проволоку нагревают в пламени горелки и быстро вносят в анализируемую пробу пищевого пропионата калия. Затем прилипшие к раскаленной проволоке кристаллы осторожно сплавляют в пламени горелки, опускают в концентрированную соляную кислоту и снова помещают в пламя.
Окрашивание бесцветного пламени в фиолетовый цвет подтверждает присутствие ионов калия.
6.4 Тест на пропионат-ион
6.4.1 Сущность метода
Метод основан на разложении пищевого пропионата калия серной кислотой и качественном определении выделяющейся пропионовой кислоты по характерному запаху.
6.4.2 Средства измерений, вспомогательное оборудование, посуда, реактивы
Весы неавтоматического действия по ГОСТ Р 53228, обеспечивающие точность взвешивания с пределами абсолютной допускаемой погрешности ±0,01 г.
Электроплитка по ГОСТ 14919.
Стакан В(Н)-1-50 ТХС по ГОСТ 25336.
Пипетки 1-2-2-1, 1-2-2-10 по ГОСТ 29227.
Кислота серная по ГОСТ 4204, х.ч.
Цинк уксуснокислый 2-водный по ГОСТ 5823, ч.д.а.
Вода дистиллированная по ГОСТ 6709.
6.4.3 Отбор проб — по 6.1.
6.4.4 Условия проведения испытаний — по 6.2.4.
6.4.5 Проведение анализа
Пробу пищевого пропионата калия массой 1,0 г помещают в стакан вместимостью 50 см, растворяют в 10 см дистиллированной воды, вносят пипеткой 0,5 см концентрированной серной кислоты и осторожно нагревают до кипения. Образование пропионовой кислоты, определяемой по характерному запаху, подтверждает присутствие пропионат-ионов в пробе.
6.5 Тест на щелочную реакцию зольного остатка
6.5.1 Сущность метода
Метод основан на озолении пищевого пропионата калия и обработке полученной золы кислотой, сопровождающейся образованием газообразного соединения.
6.5.2 Средства измерений, вспомогательное оборудование, посуда, реактивы
Весы неавтоматического действия по ГОСТ Р 53228, обеспечивающие точность взвешивания с пределами абсолютной допускаемой погрешности ±0,01 г.
Электропечь камерная с диапазоном автоматического регулирования рабочей температуры от 400°С до 1100°С.
Электроплитка по ГОСТ 14919.
Тигли фарфоровые по ГОСТ 9147.
Пипетки 1-2-1-1 по ГОСТ 29227.
Кислота соляная по ГОСТ 3118, х.ч.
6.5.3 Отбор проб — по 6.1.
6.5.4 Условия проведения испытаний — по 6.2.4.
6.5.5 Проведение анализа
Пробу пищевого пропионата калия массой от 1,5 до 2,0 г помещают в фарфоровый тигель, предварительно прокаленный при температуре (650±50)°С, осторожно обугливают на электроплитке до прекращения выделения дыма. Тигель с остатком помещают в электропечь при температуре 250°С и озоляют, постепенно поднимая температуру до 700°С. Минерализацию считают законченной, когда зола станет белой или слегка окрашенной, без обугленных частиц. После охлаждения золу в тигле обрабатывают 0,5 см соляной кислоты плотностью 1,19 г/см.
Вспенивание зольного остатка свидетельствует о присутствии в нем щелочного металла.
6.6 Определение массовой доли основного вещества
6.6.1 Сущность метода
Метод основан на разложении пищевого пропионата калия фосфорной кислотой, отгонке образующейся пропионовой кислоты с водяным паром и титриметрическом определении пропионовой кислоты нейтрализацией гидроокисью натрия в присутствии кислотно-основного индикатора.
6.6.2 Средства измерений, вспомогательные оборудование и устройства, посуда, реактивы
Весы со значением среднего квадратического отклонения (СКО), не превышающим 0,3 мг, и с погрешностью от нелинейности не более ±0,6 мг.
Часы электронно-механические кварцевые по ГОСТ 27752.
Электроплитка по ГОСТ 14919.
Баня песочная.
Алонж АИ-14/23-60 ТС по ГОСТ 25336.
Колба -1-500-29/32 ТХС по ГОСТ 25336.
Насадка Н1-29/32-14/23-14/23 ТС по ГОСТ 25336.
Цилиндр 1-250-2 по ГОСТ 1770.
Стаканчик СВ 34/12 по ГОСТ 25336.
Бюретка 1-1-2-50-0,1 по ГОСТ 29251.
Капельница 2-50 ХС по ГОСТ 25336.
Кислота ортофосфорная по ГОСТ 6552, ч.
Натрия гидроокись по ГОСТ 4328, х.ч.
Фенолфталеин (индикатор).
Спирт этиловый ректификованный по ГОСТ 5962.
Вода дистиллированная по ГОСТ 6709.
6.6.3 Отбор проб — по 6.1.
6.6.4 Условия проведения анализа — по 6.2.4.
6.6.5 Подготовка к анализу
6.6.5.1 Установка для отгонки пропионовой кислоты состоит из плоскодонной конической колбы, градуированной по объему, насадки, капельной воронки, холодильника, алонжа и приемника дистиллята. Отгонку осуществляют при нагревании раствора на электроплитке или на песочной бане.
6.6.5.2 Водный раствор ортофосфорной кислоты массовой долей 50% готовят разбавлением концентрированной ортофосфорной кислоты по ГОСТ 4517 (пункт 2.89).
6.6.5.3 Раствор гидроокиси натрия молярной концентрации 1 моль/дм готовят по ГОСТ 25794.1. Коэффициент поправки водного раствора гидроокиси натрия молярной концентрацией 1 моль/дм определяют по ГОСТ 25794.1 (пункт 2.2.3).
6.6.5.4 Спиртовой раствор фенолфталеина массовой долей 1% по ГОСТ 4919.1.
6.6.6 Проведение анализа
Пробу пищевого пропионата калия (предварительно высушенного в соответствии с 6.7) массой 3 г с записью результата до третьего десятичного знака, помещают в коническую колбу вместимостью 500 см установки (см. 6.6.5.1), добавляют 200 см раствора ортофосфорной кислоты (см. 6.6.5.2) и несколько кусочков пористого стекла для равномерного кипения раствора. Раствор кипятят 2 ч, собирая дистиллят в приемную колбу вместимостью 500 см. Во время отгонки поддерживают объем раствора в дистилляционной колбе 200 см добавлением воды из капельной воронки. Затем к дистилляту добавляют 2-3 капли раствора индикатора (см. 6.6.5.4) и титруют раствором гидроокиси натрия (см. 6.6.5.3) до появления неисчезающей розовой окраски раствора.
6.6.7 Обработка результатов
Массовую долю основного вещества пищевого пропионата калия , %, вычисляют по формуле
, (1)
где — объем раствора гидроокиси натрия молярной концентрации 1 моль/дм, израсходованный на титрование пробы, см;
— коэффициент поправки раствора гидроокиси натрия молярной концентрации 1 моль/дм, определенный по 6.6.5.3;
0,11217 — масса пищевого пропионата калия, соответствующая 1 см раствора гидроокиси натрия молярной концентрации 1 моль/дм, г;
100 — коэффициент пересчета в проценты;
— масса пробы по 6.6.6, г.
Вычисления проводят с записью результата до второго десятичного знака.
За окончательный результат определений принимают среднеарифметическое значение двух параллельных определений , %, округленное до первого десятичного знака, если выполняются условия приемлемости: абсолютное значение разности между результатами двух определений, полученными в условиях повторяемости при 95%, не превышает предела повторяемости 0,30%.
Абсолютное значение разности между результатами двух определений, полученными в условиях воспроизводимости при 95%, не превышает предела воспроизводимости 0,60%.
Границы абсолютной погрешности метода определения массовой доли основного вещества ±0,4% при 95%.
6.7 Определение массовой доли потерь при высушивании
6.7.1 Сущность метода
Метод основан на способности пищевого пропионата калия освобождаться от летучих веществ при нагревании до температуры 105°С.
Массовую долю потерь при высушивании определяют по разности массы анализируемой пробы пищевого пропионата калия до и после высушивания.
6.7.2 Средства измерений, вспомогательное оборудование, посуда, реактивы
Весы со значением среднего квадратического отклонения (СКО), не превышающим 0,3 мг, и с погрешностью от нелинейности не более ±0,6 мг.
Термометр жидкостный стеклянный диапазоном измерения температуры от 0°С до 200°С, ценой деления 1°С по ГОСТ 28498.
Часы электронно-механические кварцевые по ГОСТ 27752.
Шкаф сушильный, обеспечивающий поддержание заданного режима температуры от 20°С до 200°С с погрешностью ±2°С.
Стаканчик СН 45/13 по ГОСТ 25336.
Эксикатор 2-250 по ГОСТ 25336.
Кальций хлорид обезвоженный, массовой долей основного вещества не менее 97,0%, ч.
Кислота серная по ГОСТ 4204, х.ч.
6.7.3 Отбор проб — по 6.1.
6.7.4 Условия проведения анализа — по 6.2.4.
6.7.5 Проведение анализа
Чистый пустой стаканчик для взвешивания сушат вместе с крышкой в открытом виде в сушильном шкафу при температуре (105±2)°С в течение 2 ч. Стаканчик закрывают крышкой, охлаждают в эксикаторе с концентрированной серной кислотой или обезвоженным хлористым кальцием 40 мин и взвешивают с записью результата взвешивания до третьего десятичного знака.
Взвешивают от 1 до 2 г пищевого пропионата калия с записью результата до третьего десятичного знака, распределяют равномерным слоем по дну осторожным постукиванием стаканчика, помещают в открытом виде вместе с крышкой в сушильный шкаф и сушат при температуре (105±2)°С в течение 2 ч. После этого стаканчик быстро закрывают крышкой, охлаждают в эксикаторе 40 мин и взвешивают с записью результата до третьего десятичного знака.
6.7.6 Обработка результатов
Массовую долю потерь при высушивании пищевого пропионата калия , %, вычисляют по формуле
, (2)
где — масса стаканчика с пробой по 6.7.4 до высушивания, г;
— масса стаканчика с пробой по 6.7.4 после высушивания, г;
100 — коэффициент пересчета результата в проценты;
— масса сухого стаканчика, г.
Вычисления проводят с записью результата до второго десятичного знака.
За окончательный результат определений принимают среднеарифметическое значение двух параллельных определений , %, округленное до первого десятичного знака, если выполняются условия приемлемости: абсолютное значение разности между результатами двух определений, полученных в условиях повторяемости при 95%, не превышает предела повторяемости 0,20%.
Абсолютное значение разности между результатами двух определений, полученных в условиях воспроизводимости при 95%, не превышает предела воспроизводимости 0,50%.
Границы абсолютной погрешности метода определения массовой доли потерь при высушивании ±0,3% при 95%.
6.8 Определение рН водного раствора массовой долей пропионата калия 10%
6.8.1 Сущность метода
Метод основан на определении показателя активности ионов водорода раствора пищевого пропионата калия массовой долей 10% измерением рН при помощи рН-метра со стеклянным электродом.
6.8.2 Средства измерений, вспомогательное оборудование, посуда, реактивы
Весы неавтоматического действия по ГОСТ Р 53228, обеспечивающие точность взвешивания с пределами абсолютной допускаемой погрешности ±0,01 г.
Термометр жидкостный стеклянный диапазоном измерения температуры от 0°С до 100°С, ценой деления 1°С по ГОСТ 28498.
рН-метр со стеклянным электродом с диапазоном измерения от 1 до 14 ед. рН, с абсолютной допускаемой погрешностью измерений ±0,05 ед. рН.
Стакан В(Н)-1-250 ТС (ТХС) по ГОСТ 25336.
Цилиндр 1-100-1 по ГОСТ 1770.
Палочка стеклянная.
Вода дистиллированная по ГОСТ 6709.
6.8.3 Отбор проб — по 6.1.
6.8.4 Условия проведения анализа — по 6.2.4.
6.8.5 Проведение определения
Пробу пищевого пропионата калия массой 10,0 г помещают в стакан вместимостью 250 см, растворяют в 95 см дистиллированной воды, не содержащей углекислого газа и приготовленной по ГОСТ 4517 (пункт 2.38), тщательно перемешивают. Электроды рН-метра погружают в приготовленный раствор и измеряют рН раствора при температуре (20±2)°С.
Показания рН-метра определяют в соответствии с инструкцией к прибору.
6.8.6 Обработка результатов
Результаты определений записывают до второго десятичного знака.
За окончательный результат определения рН принимают среднеарифметическое значение двух параллельных определений , ед. рН, округленное до первого десятичного знака, если выполняются условия приемлемости: абсолютное значение разности между результатами двух определений, полученными в условиях повторяемости при 95%, не превышает предела повторяемости 0,10 ед. рН.
Абсолютное значение разности между результатами двух определений, полученными в условиях воспроизводимости при 95%, не превышает предела воспроизводимости 0,20 ед. рН.
Границы абсолютной погрешности метода определения рН раствора пищевого пропионата калия ±0,1 ед. рН при 95%.
6.9 Определение массовой доли не растворимых в воде веществ
6.9.1 Сущность метода
Метод основан на растворении пищевого пропионата калия в воде при определенных условиях, последующем фильтровании и взвешивании нерастворимого остатка.
6.9.2 Средства измерений, вспомогательные оборудование и устройства, посуда, реактивы
Весы со значением среднего квадратического отклонения (СКО), не превышающим 0,03 мг, и с погрешностью от нелинейности не более ±0,06 мг.
Термометр жидкостный стеклянный диапазоном измерения температуры от 0°С до 100°С, ценой деления 1°С по ГОСТ 28498.
Шкаф сушильный, обеспечивающий поддержание заданного режима температуры от 20°С до 200°С с погрешностью ±2°С.
Насос вакуумный или водоструйный.
Эксикатор 2-250 по ГОСТ 25336.
Тигель фильтрующий типа ТФ с фильтром класса ПОР10 или ПОР16 по ГОСТ 25336.
Цилиндр 1-100-1 по ГОСТ 1770.
Стакан В(Н)-1-100 ТС(ТХС) по ГОСТ 25336.
Стаканчик СВ 34/12 по ГОСТ 25336.
Кальций хлористый обезвоженный, массовой долей основного вещества не менее 97,0%, ч.
Кислота серная по ГОСТ 4204, х.ч.
Вода дистиллированная по ГОСТ 6709.
6.9.3 Отбор проб — по 6.1.
6.9.4 Условия проведения испытаний — по 6.2.4.
6.9.5 Проведение анализа
Пробу пищевого пропионата калия массой 5 г с записью результата взвешивания до третьего десятичного знака, помещают в стакан вместимостью 100 см и растворяют в 50 см дистиллированной воды при температуре (20±2)°С. Затем раствор фильтруют под вакуумом через стеклянный фильтрующий тигель, предварительно высушенный до постоянной массы при температуре (105±2)°С (разница между результатами двух последних взвешиваний не должна превышать 0,0002 г) и взвешенный с записью результата до четвертого десятичного знака. Стакан и нерастворимый остаток на фильтре промывают 20 см дистиллированной воды. Тигель с нерастворимым остатком высушивают в сушильном шкафу при температуре (60±2)°С до постоянной массы (разница между результатами двух последних взвешиваний не должна превышать 0,0002 г). Охлаждение тигля до комнатной температуры по 6.2.4 осуществляют в эксикаторе с обезвоженным хлористым кальцием в течение 60 мин. Тигель с нерастворимым остатком взвешивают с записью результата до четвертого десятичного знака.
6.9.6 Обработка результатов
Массовую долю не растворимых в воде веществ пищевого пропионата калия , %, вычисляют по формуле
, (3)
где — масса фильтрующего тигля с остатком нерастворимых веществ после высушивания, г;
— масса фильтрующего тигля, г;
100 — коэффициент пересчета результата в проценты;
— масса пробы по 6.9.5, г.
Вычисления проводят до третьего десятичного знака.
За окончательный результат анализа принимают среднеарифметическое значение двух параллельных определений , %, округленное до второго десятичного знака, если выполняются условия приемлемости: абсолютное значение разности между результатами двух определений, полученными в условиях повторяемости при 95%, не превышает предела повторяемости 0,010%.
Абсолютное значение разности между результатами двух определений, полученными в условиях воспроизводимости при 95%, не превышает предела воспроизводимости 0,030%.
Границы абсолютной погрешности метода определения массовой доли не растворимых в воде веществ ±0,02% при 95%.
6.10 Тест на содержание железа
6.10.1 Сущность метода
Метод основан на взаимодействии железа, содержащегося в пищевом пропионате калия, в кислой среде с роданидом аммония с образованием окрашенного в красный цвет комплекса роданида железа (III) и визуальном сравнении полученной окраски раствора с окраской раствора сравнения. Предварительным окислением железо в пробе переводят в форму железа (III).
6.10.2 Средства измерений, вспомогательное оборудование, посуда, реактивы
Весы со значением среднего квадратического отклонения (СКО), не превышающим 0,03 мг, и с погрешностью от нелинейности не более ±0,06 мг.
Электроплитка по ГОСТ 14919.
Стаканы В(Н)-1-50 ТХС, В(Н)-1-100 ТХС по ГОСТ 25336.
Пипетки 1-2-2-2, 1-2-2-5, 1-2-2-10 по ГОСТ 29227.
Цилиндры 1-50-1, 1-100-1 по ГОСТ 1770.
Пробирки П-2-25-0,2 ХС по ГОСТ 1770.
Пипетки 2-2-20 по ГОСТ 29169.
Палочка стеклянная.
Колба 2-1000-2 по ГОСТ 1770.
Кислота соляная по ГОСТ 3118, х.ч.
Кислота азотная по ГОСТ 4461, х.ч.
Аммоний надсернокислый по ГОСТ 20478, х.ч.
Аммоний роданистый по ГОСТ 27067, х.ч.
Квасцы железоаммонийные, массовой долей основного вещества не менее 99,0%, х.ч.
Бром по ГОСТ 4109, х.ч.
Государственный стандартный образец (ГСО) ионов железа (III) массовой концентрацией 1 г/дм, относительной погрешностью 1% при 0,95%, фон-азотная кислота молярной концентрацией 1 моль/дм.
Вода дистиллированная по ГОСТ 6709.
6.10.3 Отбор проб — по 6.1.
6.10.4 Условия проведения анализа — по 6.2.4.
6.10.5 Подготовка к анализу
6.10.5.1 Насыщенный водный раствор брома (бромная вода) готовят по ГОСТ 4517 (пункт 2.32).
6.10.5.2 Водный раствор азотной кислоты с массовой долей 10% готовят разбавлением концентрированной кислоты по ГОСТ 4517 (пункт 2.89).
6.10.5.3 Раствор роданистого аммония готовят растворением 7,6 г роданистого аммония в 92,4 г дистиллированной воды в стакане вместимостью 250 см.
Срок хранения раствора в склянке из темного стекла с притертой пробкой в условиях по 6.2.4 — 6 мес.
6.10.5.4 Приготовление стандартного раствора железа (III)
Железоаммонийные квасцы (предварительно высушенные в эксикаторе) массой 8,6350 г помещают в стакан вместимостью 100 см и растворяют в 20 см раствора азотной кислоты по 6.10.5.2. Затем раствор количественно переносят в мерную колбу вместимостью 1000 см и доводят объем раствора дистиллированной водой до метки. 1 см стандартного раствора содержит 1 мг железа (III).
Срок хранения стандартного раствора железа в склянках из темного стекла в условиях по 6.2.4 — один год.
Для приготовления стандартного раствора железа используют также ГСО ионов железа (III) (массовой концентрацией 1 г/дм, фон-азотная кислота молярной концентрацией 1 моль/дм).
6.10.5.5 Приготовление рабочего раствора железа
10 см стандартного раствора железа по 6.10.5.4 пипеткой вносят в мерную колбу вместимостью 1000 см, добавляют 20 см раствора азотной кислоты по 6.10.5.2 и доводят объем раствора дистиллированной водой до метки. 1 см рабочего раствора содержит 0,01 мг железа (III).
Раствор используют свежеприготовленным.
6.10.6 Проведение анализа
Пробу пищевого пропионата калия массой 0,500 г помещают в стакан вместимостью 50 см, добавляют 2 см соляной кислоты и выпаривают досуха на водяной бане. Сухой остаток растворяют в 2 см соляной кислоты и 20 см дистиллированной воды, добавляют несколько капель раствора брома по 6.10.5.1 и перемешивают. Затем раствор осторожно нагревают до кипения, кипятят до удаления паров брома и охлаждают. Раствор количественно переносят в пробирку со шкалой вместимостью 25 см, доводят дистиллированной водой до метки, добавляют 0,05 г аммония надсернокислого, 5 см раствора роданистого аммония по 6.10.5.3 и перемешивают.
Для приготовления раствора сравнения проводят описанные выше операции с использованием вместо пробы пищевого пропионата калия 1,5 см рабочего раствора железа по 6.10.5.5.
Пищевой пропионат калия выдерживает испытания на содержание железа не более 30 млн (мг/кг), если окраска испытуемого раствора не интенсивнее окраски раствора сравнения.
6.11 Определение токсичных элементов
6.11.1 Отбор проб — по 6.1.
6.11.2 Массовую долю свинца определяют по ГОСТ 26932 и ГОСТ 30178.
6.11.3 Массовую долю мышьяка определяют по ГОСТ 26930.
6.11.4 Массовую долю ртути определяют по ГОСТ 26927.
7 Транспортирование и хранение
7.1 Пищевой пропионат калия перевозят в крытых транспортных средствах всеми видами транспорта в соответствии с правилами транспортирования грузов, действующими на соответствующих видах транспорта.
7.2 Пищевой пропионат калия хранят в упаковке изготовителя при температуре не более 30°С и относительной влажности воздуха не более 40% в крытых складских помещениях.
7.3 Срок годности пищевого пропионата калия устанавливает изготовитель.
Рекомендуемый срок годности пищевого пропионата калия — один год со дня изготовления.
Библиография
[1] | Технический регламент Таможенного союза ТР ТС 029/2012 «Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств» |
[2] | Технический регламент Таможенного союза ТР ТС 021/2011 «О безопасности пищевой продукции» |
[3] | Технический регламент Таможенного союза ТР ТС 005/2011 «О безопасности упаковки» |
[4] | Технический регламент Таможенного союза ТР ТС 022/2011 «Пищевая продукция в части ее маркировки» |
_____________________________________________________________________
УДК 663.05:006.354 ОКС 67.220.20 ОКП 91 1230
Ключевые слова: пищевая добавка, пищевой пропионат калия, показатели качества, упаковка, маркировка, правила приемки, методы контроля, транспортирование и хранение
_____________________________________________________________________
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
официальное издание
М.: Стандартинформ, 2014
Формула Пропионовой кислоты структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C3H6O2
Рациональная формула: C2H5COOH
Химический состав Пропионовой кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12.011 | 3 | 48.6% |
| H | Водород | 1.008 | 6 | 8.2% |
| O | Кислород | 15.999 | 2 | 43.2% |
Молекулярная масса: 74,079
Пропио́новая кислота́ (пропановая кислота, метилуксусная кислота, консервант E280) — бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos» — первый, «pion» — жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот. Молекулярная формула C2H5COOH; tкип 205,8 °C; плотность 1045,5 кг/м³ (1,0455 г/см³) при 20 °C. Пропионовая кислота хорошо растворим в органических растворителях и жидких SO2 и NH3, в 100 г воды растворяется 4 г Пропионовой кислоты.
Температура самовоспламенения 440 °C. Смешивается с водой и органическими растворителями. По химическим свойствам — типичный представитель насыщеных карбоновых кислот; образует эфиры, амиды, галогенангидриды и т. д..
Пропионовая кислота впервые была описана в 1844 году Йоханом Готлибом (Johann Gottlieb), который нашёл её среди продуктов разложения сахара. В течение следующих нескольких лет, другие химики получали пропионовую кислоту различными способами, не осознавая, что они получали одно и то же вещество. В 1847 году, французский химик Жан-Батист Дюма (Jean-Baptiste Dumas) установил, что полученные кислоты были одним и тем же веществом, которое он назвал пропионовой кислотой.
В природе пропионовая кислота найдена в нефти, образуется при брожении углеводов. В промышленности её получают карбонилированием этилена по реакции Реппе; каталитическим окислением пропионового альдегида в присутствии кобальта или ионов марганца; как побочный продукт при парофазном окислении углеводородов C4—C10. Большое количество пропионовой кислоты раньше получали как побочный продукт при производстве уксусной кислоты, но современные способы получения уксусной кислоты сделали этот метод второстепенным источником пропионовой кислоты.
Пропионовую кислоту также получают биологически при метаболическом разложении жирных кислот, содержащих нечётное число атомов углерода, и при разложении некоторых аминокислот. Бактерии рода Propionibacterium производят пропионовую кислоту как конечный продукт своего анаэробного метаболизма. Эти бактерии часто встречаются в желудке жвачных животных и в силосе, и отчасти из-за их деятельности швейцарский сыр имеет свой аромат.
Пропионовая кислота и её производные применяют в производстве гербицидов (пропанол, дихлорпрол), лекарственных средств (ибупрофен, феноболин и др.), душистых веществ (бензил-, фенил-, геранил-, линалоил- пропионаты), пластмасс (например, поливинилпропионата), растворителей (пропил-, бутил-, пентилпропионата и др.), винилпластификаторов и ПАВ (гликолевые эфиры).
Пропионовая кислота препятствует росту плесени и некоторых бактерий. Поэтому большая часть производимой пропионовой кислоты используется как консервант в продуктах, потребляемых человеком, и в продуктах для животных. В продуктах для животных применяется непосредственно пропионовая кислота, либо её аммониевая соль (пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебе и в других хлебобулочных изделиях, пропионовая кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
разбор демоварианта – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
Задание 1
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне четыре электрона.
1) Na
2) K
3) Si
4) Mg
5)
C
Ответ: Периодическая система химических элементов – графическое отображение Периодического закона. Она состоит из периодов и групп. Группа – это вертикальный столбец химических элементов, состоит из главной и побочной подгрупп. Если элемент находится в главной подгруппе определенной группы, то номер группы говорит о количестве электронов на последнем слое. Следовательно, чтобы ответить на данный вопрос необходимо открыть таблицу Менделеева и посмотреть, какие элементы из представленных в задании расположены в одной группе. Приходим к выводу, что такими элементами являются: Si и C, следовательно ответ будет: 3; 5.
Задание 2
Из указанных в ряду химических элементов
1) Na
2) K
3) Si
4) Mg
5) C
выберите три элемента, которые в Периодической системе химических элементов Д.И.Менделеева находятся в одном периоде.
Расположите химические элементы в порядке возрастания их металлических свойств.
Запишите в поле ответа номера выбранных химических элементов в нужной последовательности.
Ответ: Периодическая система химических элементов – графическое отображение Периодического закона. Она состоит из периодов и групп. Период – это горизонтальный ряд химических элементов, расположенных в порядке возрастания электроотрицательности, а значит, уменьшения металлических свойств и усиления неметаллических. Каждый период (за исключением первого) начинается с активного металла, который называется щелочным, и заканчивается инертным элементом, т.е. элементом, который не образует химических соединений с другими элементами (за редким исключением).
Глядя на таблицу химических элементов, отмечаем, что из данных в задании элементов, Na, Mg и Si расположены в 3 периоде. Далее необходимо расположить эти элементы в порядке возрастания металлических свойств. Из написанного выше определяем, если металлические свойства убывают слева на право, значит возрастают они наоборот, справа налево. Поэтому правильными ответами будут 3; 4; 1.
ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы. Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тренировочных заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к заданиям, которые помогут объективно оценить уровень своих знаний и степень подготовленности к аттестационному экзамену. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьЗадание 3
Из числа указанных в ряду элементов
1) Na
2) K
3) Si
4) Mg
5) C
выберите два элемента, которые проявляют низшую степень окисления –4.
Ответ: Высшая степень окисления химического элемента в соединении численно равна номеру группы, в которой находится химический элемент со знаком плюс. Если элемент расположен в 1 группе, то его высшая степень окисления равна +1, во второй группе +2 и так далее. Низшая степень окисления химического элемента в соединениях равна 8 (высшая степень окисления, которую может проявить химический элемент в соединении) минус номер группы, со знаком минус. Например, элемент стоит в 5 группе, главной подгруппе; следовательно, высшая степень окисления его в соединениях будет равна +5; низшая степень окисления соответственно 8 – 5 = 3 со знаком минус т.е. –3. У элементов 4 периода высшая валентность равна +4, а низшая –4. Поэтому ищем из списка элементов данных в задании два элемента расположенных в 4 группе главной подгруппе. Это будет C и Si номера правильного ответа 3; 5.
Задание 4
Из предложенного перечня выберите два соединения, в которых присутствует ионная связь.
1) Ca(ClO2)2
2) HClO3
3) NH4Cl
4) HClO4
5) Cl2O7
Ответ: Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Ионная связь – связь, возникающая в результате электростатического притяжения разноименно заряженных ионов (катионов и анионов), иными словами, между типичным металлом и типичным неметаллом; т.е. элементами, резко отличающимися друг от друга по электроотрицательности. ( > 1,7 по шкале Полинга). Ионная связь присутствует в соединениях, содержащих металлы 1 и 2 групп главных подгрупп (за исключением Mg и Be) и типичных неметаллов; кислорода и элементов 7 группы главной подгруппы. Исключение составляют соли аммония, они не содержат атома металла, вместо него ион , но в солях аммония между ионом аммония и кислотного остатка – связь тоже ионная. Поэтому правильными ответами будут 1; 3.
Задание 5
Установите соответствие между формулой вещества и классов / группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА ВЕЩЕСТВА |
КЛАСС / ГРУППА |
|
А) NH4HCO3 |
1) соли средние |
|
Б) KF |
2) оксиды кислотные |
|
В) NO |
3) оксиды несолеобразующие |
|
|
4) соли кислые |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| Ответ: | А |
Б |
В |
|
|
|
|
|
Ответ: Для ответа на данный вопрос мы должны вспомнить, что такое оксиды и соли. Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Исключение составляют соли аммония. У данных солей вместо ионов металла стоит ион аммония. Соли бывают средними, кислыми, двойными, основными и комплексными. Средние соли – это продукты полного замещения водорода кислоты на металл или ион аммония; например:
H2SO4 + 2Na = H2 + Na2SO4.
Данная соль является средней. Кислые соли – это продукт неполного замещения водорода соли на металл; например:
2H2SO4 + 2Na = H2 + 2NaHSO4.
Данная соль является кислой. Теперь давайте посмотрим на наше задание. В нем содержится две соли: NH4HCO3 и KF. Первая соль является кислой, поскольку это продукт неполного замещения водорода в кислоте. Поэтому в табличке с ответом под буквой «А» поставим цифру 4; другая соль (KF) не содержит водорода между металлом и кислотным остатком, поэтому в табличке с ответом под буквой «Б» поставим цифру 1. Оксиды – это бинарное соединение, в состав которого входит кислород. Он стоит на втором месте и проявляет степень окисления –2. Оксиды бывают основными (т.е. оксиды металлов, например Na2O, CaO – им соответствуют основания; NaOH и Ca(OH)2 ), кислотными (т.е. оксиды неметаллов P2O5, SO3 – им соответствуют кислоты; H3PO4 и H2SO4), амфотерными (оксиды, которые в зависимости от обстоятельств могут проявлять основные и кислотные свойства – Al2O3, ZnO) и несолеобразующие. Это оксиды неметаллов, которые не проявляют ни основных, ни кислотных, ни амфотерных свойств; это CO, N2O, NO. Следовательно, оксид NO является несолеобразующим оксидом, поэтому в табличке с ответом под буквой «В» поставим цифру 3. И заполненная таблица будет иметь следующий вид:
| Ответ: | А |
Б |
В |
|
4 |
1 |
3 |
ЕГЭ. Химия. Большой сборник тематических заданий по химии для подготовки к ЕГЭ
Вниманию школьников и абитуриентов впервые предлагается учебное пособие для подготовки к ЕГЭ по химии, которое содержит тренировочные задания, собранные по темам. В книге представлены задания разных типов и уровней сложности по всем проверяемым темам курса химии. Каждый из разделов пособия включает не менее 50 заданий. Задания соответствуют современному образовательному стандарту и положению о проведении единого государственного экзамена по химии для выпускников средних общеобразовательных учебных учреждений. Выполнение предлагаемых тренировочных заданий по темам позволит качественно подготовиться к сдаче ЕГЭ по химии. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьЗадание 6
Из предложенного перечня выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид
кальция (р-р)
2) сульфат меди
(II) (р-р)
3) концентрированная
азотная кислота
4) разбавленная
соляная кислота
5) оксид алюминия
Ответ: Железо – активный металл. Взаимодействует с хлором, углеродом и другими неметаллами при нагревании:
2Fe + 3Cl2 = 2FeCl3
Вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа:
Например:
Fe + CuSO4 = FeSO4 + Cu
Растворяется в разбавленных серной и соляной кислотах c выделением водорода,
Fe + 2НCl = FeCl2 + H2
с раствором азотной кислоты
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Концентрированные серная и соляная кислота при обычных условиях с железом не реагируют, они его пассивируют:
Исходя из этого правильными ответами будут: 2; 4.
Задание 7
В одну из пробирок с осадком гидроксида алюминия добавили сильную кислоту Х, а в другую – раствор вещества Y. в результате в каждой из пробирок наблюдали растворение осадка. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1)
бромоводородная кислота.
2)
гидросульфид натрия.
3)
сероводородная кислота.
4)
гидроксид калия.
5)
гидрат аммиака.
Запишите
в таблицу номера выбранных веществ под соответствующими буквами.
Ответ: Гидроксид алюминия является амфотерным основанием, поэтому может взаимодействовать с растворами кислот и щелочей:
1) Взаимодействие с раствором кислоты: Al(OH)3 + 3HBr = AlCl3 + 3H2O.
При этом осадок гидроксида алюминия растворяется.
2) Взаимодействие со щелочами: 2Al(OH)3 + Сa(OH)2 = Ca[Al(OH)4]2.
При этом осадок гидроксида алюминия также растворяется.
| Ответ: | X |
Y |
|
|
1 |
4 |
|
Задание 8
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
|
ФОРМУЛА ВЕЩЕСТВА |
РЕАГЕНТЫ |
А) S Б) SO3 В) Zn(OH)2 Г) ZnBr2 (р-р) |
1) AgNO3, Na3PO4, Cl2 2) BaO, H2O, KOH 3) H2, Cl2, O2 4) НBr, LiOH, CH3COOH (р-р) 5) H3PO4 (р-р), BaCl2, CuO |
Ответ: Под буквой А стоит сера (S). Как простое вещество, сера может вступать в окислительно-восстановительные реакции. Большинство реакций происходит с простыми веществами, металлами и неметаллами. Окисляется растворами концентрированных серной и соляной кислот. Взаимодействует со щелочами. Из всех реагентов, расположенных под цифрами 1–5, больше всего под описанные выше свойства подходят простые вещества под цифрой 3.
S + H2 = H2S
S + Cl2 = SCl2
S + O2 + SO2
Следующее вещество – SO3, буква Б. Оксид серы VI – сложное вещество, кислотные оксид. Данный оксид содержит серу в степени окисления +6. Это высшая степень окисления серы. Поэтому SO3 будет вступать в реакции, в качестве окислителя, с простыми веществами, например с фосфором, со сложными веществами, например с KI, H2S. При этом его степень окисления может понизиться до +4, 0 или –2, также вступает в реакции без изменения степени окисления с водой, оксидами металлов и гидроксидами. Исходя из этого, SO3 будет реагировать со всеми реагентами под цифрой 2, то есть:
SO3 + BaO = BaSO4
SO3 + H2O = H2SO4
SO3 + 2KOH = K2SO4 + H2O
Zn(OH)2 – амфотерный гидроксид расположен под буквой В. Обладает уникальными свойствами – реагирует как с кислотами, так и со щелочами. Поэтому из всех представленных реагентов можно смело выбирать реагенты под цифрой 4.
Zn(OH)2 + HBr = ZnBr2 + H2O
Zn(OH)2 + LiOH = Li2[Zn(OH)4]
Zn(OH)2 + CH3COOH = (CH3COO)2Zn + H2O
И наконец, под буквой Г расположено вещество ZnBr2 – соль, бромид цинка. Соли реагируют с кислотами, щелочами, другими солями, а также соли бескислородных кислот, как и данная соль, могут взаимодействовать с неметаллами. В данном случае наиболее активные галогены (Cl или F) могут вытеснять менее активные (Br и I) из растворов их солей. Данным критериям соответствуют реагенты под цифрой 1.
ZnBr2 + 2AgNO3 = 2AgBr + Zn(NO3)2
3ZnBr2 + 2Na3PO4 = Zn3(PO4)2 + 6NaBr
ZnBr2 + Cl2 = ZnCl2 + Br2
Варианты ответа выглядят следующим образом:
|
А |
Б |
В |
Г |
|
3 |
2 |
4 |
1 |
ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы. Теоретический материал изложен в краткой и доступной форме. Каждая тема сопровождается примерами тестовых заданий. Практические задания соответствуют формату ЕГЭ. В конце пособия приведены ответы к тестам. Пособие адресовано школьникам, абитуриентам и учителям.
КупитьЗадание 9
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
А) Mg и H2SO4 (конц) Б) MgO и H2SO4 В) S и H2SO4 (конц) Г) H2S и O2 (изб.) |
1) MgSO4 и H2O 2) MgO, SO2, и H2O 3) H2S и H2O 4) SO2 и H2O 5) MgSO4, H2S и H2O 6) SO3 и H2O |
Ответ: А) Серная кислота концентрированная является сильным окислителем. Может взаимодействовать и с металлами стоящими в электрохимическом ряду напряжений металлов после водорода. При этом водород, как правило, в свободном состоянии не выделяется, он окисляется в воду, а серная кислота восстанавливается до различных соединений, например: SO2, S и H2S, в зависимости от активности металла. При взаимодействии с магнием реакция будет иметь следующий вид:
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + H2O (цифра ответа 5)
Б) При взаимодействии серной кислоты с оксидом магния образуются соль и вода:
MgO + H2SO4 = MgSO4 + H2O (Цифра ответа 1)
В) Концентрированная серная кислота окисляет не только металлы, но и неметаллы, в данном случае серу, по следующему уравнению реакции:
S + 2H2SO4 (конц) = 3SO2 + 2H2O (цифра ответа 4)
Г) При горении сложных веществ с участием кислорода образуются оксиды всех элементов, входящих в состав сложного вещества; например:
2H2S + 3O2 = 2SO2 + 2H2O (цифра ответа 4)
Таким образом, общий ответ будет иметь следующий вид:
Задание 10
Задана следующая схема превращений веществ:
| Х | Y | |||
| K2CO3 | → | CO2 | → | KHCO3 |
Определите, какие из указанных веществ являются веществами X и Y.
1) KCl (р-р)
2) KOH (р-р)
3) H2
4) HCl (избыток)
5) CO2
Ответ: Карбонаты вступают в химическую реакцию с кислотами, при этом образуется слабая угольная кислота, которая в момент образования разлагается на углекислый газ и воду:
K2CO3 + 2HCl(избыток) = 2KCl + CO2 + H2O
При пропускании через раствор гидроксида калия избытка углекислого газа образуется гидрокарбонат калия.
CO2 + КОН = KHCO3
Записываем в таблицу ответ:
X |
Y |
4 |
2 |
Задание 11
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ ВЕЩЕСТВА |
КЛАСС/ГРУППА |
А) метилбензол Б) анилин В) 3-метилбутаналь |
1) альдегиды 2) амины 3) аминокислоты 4) углеводороды |
Ответ: А) Метилбензол относится к гомологическому ряду ароматических углеводородов; его формула C6H5CH3 (цифра 4)
Б) Анилин относится к гомологическому ряду ароматических аминов. Его формула C6H5NH2. Группа NH2 – функциональная группа аминов. (цифра 2)
В) 3-метилбутаналь относится к гомологическому ряду альдегидов. Так как альдегиды имеют окончание -аль. Его формула:
| CH3– | CH– | CH2–COH |
| │ | ||
| CH3 |
|
Записываем в таблицу ответ:
|
А |
Б |
В |
|
4 |
2 |
1 |
ЕГЭ. Химия. Универсальный справочник
Справочник содержит подробный теоретический материал по всем темам, проверяемым ЕГЭ по химии. После каждого раздела приводятся разноуровневые задания в форме ЕГЭ. Для итогового контроля знаний в конце справочника даются тренировочные варианты, соответствующие ЕГЭ. Учащимся не придется искать дополнительную информацию в интернете и покупать другие пособия. В данном справочнике они найдут все необходимое для самостоятельной и эффективной подготовки к экзамену. Справочник адресован учащимся старших классов для подготовки к ЕГЭ по химии.
КупитьЗадание 12
Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-1.
1) бутан
2) циклобутан
3) бутин-2
4) бутадиен-1,3
5) метилпропен
Ответ: Изомеры – это вещества, имеющие одинаковую молекулярную формулу, но различные строение и свойства. Структурные изомеры – это тип веществ, которые идентичны друг другу по количественному и качественному составам, но порядок атомного связывания (химического строения) имеет различия. Для ответа на этот вопрос давайте напишем молекулярные формулы всех веществ. Формула бутена-1 будет выглядеть так: С4Н8
1) бутан – С4Н10
2) циклобутан –
С4Н8
3) бутин-2 – С4Н6
4) бутадиен-1, 3
– С4Н6
5) метилпропен –
С4Н8
Такие же формулы имеют циклобутан № 2 и метилпропен № 5. Они и будут структурными изомерами бутена-1.
Записываем в таблицу правильные ответы:
Задание 13
Из предложенного перечня выберите два вещества, при взаимодействии которых с раствором перманганата калия в присутствии серной кислоты будет наблюдаться изменение окраски раствора.
1) гексан
2) бензол
3) толуол
4) пропан
5) пропилен
Ответ: Давайте попробуем ответить на этот вопрос методом исключения. Предельные углеводороды не подвергаются окислению данным окислителем, поэтому вычеркиваем гексан № 1 и пропан № 4.
Далее – бензольное кольцо устойчиво к действию подавляющего большинства окислителей.
Вычеркиваем № 2 (бензол). У гомологов бензола алкильные группы легко окисляются под действием таких окислительных агентов, как перманганат калия. Поэтому толуол (метилбензол) будет подвергаться окислению по метильному радикалу. Так же окисляется и пропилен (непредельный углеводород с двойной связью).
Правильный ответ:
Задание 14
Из предложенного перечня выберите два вещества, с которыми реагирует формальдегид.
1) Cu
2) N2
3) H2
4) Ag2O (NH3 р-р)
5) CH3OCH3
Ответ: Формальдегид – это альдегид муравьиной кислоты. Он вступает во многие химические реакции, но основными являются реакции восстановления и окисления. Восстановителем может служить водород, который присоединяется по связи: С=О, превращая его в метанол
| Н– | С | =О + Н2 = СН3ОН |
| │ | ||
| Н |
Окисляются альдегиды различными окислителями, в том числе и аммиачным раствором оксида серебра (знаменитая реакция серебряного зеркала)
| Н– | С | =О + Ag2O (NH3 р-р) =H– | C | =O + 2Ag |
| │ | │ | |||
| Н | О | Н |
Правильный ответ:
ЕГЭ-2018. Химия. Сдаем без проблем!
В книге содержатся материалы для успешной сдачи ЕГЭ по химии: краткие теоретические сведения по всем темам, задания разных типов и уровней сложности, методические комментарии, ответы и критерии оценивания. Учащимся не придется искать дополнительную информацию в интернете и покупать другие пособия. В данной книге они найдут все необходимое для самостоятельной и эффективной подготовки к экзамену. В издании в сжатой форме изложены основы предмета в соответствии с действующими образовательными стандартами и максимально подробно разобраны наиболее сложные экзаменационные вопросы повышенного уровня сложности. Кроме того, приводятся тренировочные задания, с помощью которых можно проверить уровень усвоения материала. Приложение книги содержит необходимые справочные материалы по предмету.
КупитьЗадание 15
Из предложенного перечня выберите два вещества, с которыми реагирует метиламин.
1) пропан
2) хлорметан
3) водород
4) гидроксид
натрия
5) соляная
кислота.
Ответ: Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Как и аммиак, они вступают в реакцию с кислотами. Например, с соляной кислотой с образованием хлорида метиламмония.
CH3–NH2 + HCl =[CH3NH3]Cl.
Из органических веществ метиламин вступает в реакции алкилирования с галогеналканами:
CH3–NH2 + CH3Cl = [(CH3)2NH2]Cl
С другими веществами из данного списка амины не реагируют, поэтому правильный ответ:
Задание 16
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом: к каждой позиции, обозначенной буквой, выберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА |
ПРОДУКТЫ БРОМИРОВАНИЯ |
||||||||||||||||||||||||
А) этан Б) изобутан В) циклопропан Г) циклогексан |
1)
3) Br–CH2–CH2–CH2–Br
5) CH3–CH2–Br 6) |
Ответ: А) этан – это предельный углеводород. Для него не характерны реакции присоединения, поэтому происходит замещение атома водорода на бром. И получается бромэтан:
CH3–Сh4 + Br2 = CH3–CH2–Br + HBr (ответ 5)
Б) Изобутан, так же как и этан, – представитель предельных углеводородов, поэтому для него характерны реакции замещения водорода на бром. В отличие от этана, изобутан содержит не только первичные атомы углерода (соединенные с тремя атомами водорода), но и один первичный атом углерода. А так как замещение атома водорода галогеном легче всего идет у менее гидрогенизированного третичного атома углерода, затем у вторичного и в последнюю очередь у первичного, бром будет присоединяться именно к нему. В результате получим 2-бром, 2-метилпропан:
| C | H3 | C | H3 | ||
| │ | │ | ||||
| CH3– | C | –CH3+ Br2 = CH3– | C | –CH3+ HBr | (ответ 2) |
| │ | │ | ||||
| Н | B | r |
В) Циклоалканы, к которым относится циклопропан, сильно отличаются между собой по устойчивости цикла: наименее устойчивы трехчленные и наиболее устойчивы пяти- и шестичленные циклы. При бромировании 3-х и 4-х членных циклов, происходит их разрыв с образованием алканов. При этом присоединяются сразу 2 атома брома.
|
+ Br2 = Br–CH2–CH2–CH2–Br (ответ 3) |
Г) Реакция взаимодействия с бромом у пяти и шестичленных циклов не приводит к разрыву цикла, а сводится к реакции замещения водорода на бром.
| + Br2 = | + HBr (ответ 6) |
Таким образом, общий ответ будет иметь вид:
|
А |
Б |
В |
Г |
|
5 |
2 |
3 |
6 |
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
РЕАГИРУЮЩИЕ ВЕЩЕСТВА |
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
А) уксусная кислота и сульфид натрия Б) муравьиная кислота и гидроксид натрия В) муравьиная кислота и гидроксид меди (II) (при нагревании) Г) этанол и натрий |
1) пропионат натрия 2) этилат натрия 3) формиат меди (II) 4) формиат натрия 5) ацетат натрия 6) углекислый газ |
Ответ: А) Реакция между уксусной кислотой и сульфидом натрия относится к реакциям обмена, когда сложные вещества обмениваются составными частями.
CH3COOH + Na2S = CH3COONa + H2S.
Cоли уксусной кислоты называются ацетаты. Данная соль, соответственно, называется ацетат натрия. Ответ под цифрой 5
Б) Реакция между муравьиной кислотой и гидроксидом натрия также относится к реакциям обмена.
HCOOH + NaOH = HCOONa + H2O.
Соли муравьиной кислоты называются формиаты. В данном случае образуется формиат натрия. Ответ под цифрой 4.
В) Муравьиная кислота, в отличие от других карбоновых кислот – удивительное вещество. Содержит в себе помимо функциональной карбоксильной группы –СООН, еще и альдегидную группу СОН. Поэтому они вступают в реакции характерные для альдегидов. Например, в реакцию серебряного зеркала; восстановления гидроксида меди (II), Cu(OH)2 при нагревании до гидроксида меди (I), CuOH, разлагающегося при высокой температуре до оксида меди (I), Cu2O. Образуется красивый осадок оранжевого цвета.
2Cu(OH)2 + 2HCOOH = 2СO2 + 3H2O + Cu2O
Сама же муравьиная кислота окисляется до углекислого газа. (правильный ответ 6)
Г) При взаимодействии этанола с натрием образуется газообразный водород и этилат натрия.
2C2H5OH + 2Na = 2C2H5ONa + H2 (ответ 2)
Таким образом, на данное задание ответами будут:
|
А |
Б |
В |
Г |
|
5 |
4 |
6 |
2 |
ЕГЭ-2018. Химия. 10 тренировочных вариантов экзаменационных работ для подготовки к единому государственному экзамену
Вниманию школьников и абитуриентов предлагается новое пособие для подготовки ЕГЭ, которое содержит 10 вариантов типовых экзаменационных работ по химии. Каждый вариант составлен в полном соответствии с требованиями единого государственного экзамена, включает задания разных типов и уровня сложности. В конце книги даны ответы для самопроверки на все задания. Предлагаемые тренировочные варианты помогут учителю организовать подготовку к итоговой аттестации, а учащимся — самостоятельно проверить свои знания и готовность к сдаче выпускного экзамена. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьЗадание 18
Задана следующая схема превращения веществ:
| Х | Y | |||
| CH3CH2Cl | → | CH3CH2OH | → | CH3CHO |
Определите, какие из указанных веществ являются веществами X и Y.
1) H2
2) CuO
3) Cu(OH)2
4) NaOH (H2O)
5) NaOH (спирт)
Ответ: Галогеноводороды обладают способностью подвергаться гидролизу. В данном случае при взаимодействии хлорэтана с раствором гидроксида натрия приведет к щелочному гидролизу.
| H2O | ||
| CH3CH2Cl + NaOH | → | CH3CH2OH + NaCl (ответ 4) |
Спирты при высокой температуре в присутствии окислителей могут окисляться до соответствующих альдегидов. В данном случае в качестве окислителя служит оксид меди II (CuO) по следующей реакции:
СH3CH2OH + CuO (t) = СH3COH + Cu + H2O (ответ: 2)
Общий ответ данного номера:
|
X |
Y |
|
4 |
2 |
Задание 19
Из предложенного перечня типов реакций выберите два типа реакции, к которым можно отнести взаимодействие щелочных металлов с водой.
1)
каталитическая
2) гомогенная
3) необратимая
4)
окислительно-восстановительная
5) реакция нейтрализации
Ответ: Напишем уравнение реакции, например, натрия с водой:
2Na +2H2O = 2NaOH + H2.
Натрий, очень активный металл, поэтому с водой будет энергично взаимодействовать, в некоторых случаях даже со взрывом, поэтому реакция идет без катализаторов. Натрий – это металл, твердое вещество, вода и раствор гидроксида натрия – жидкости, водород – газ, поэтому реакция гетерогенная. Реакция необратимая, потому что водород уходит из реакционной среды в виде газа. В процессе реакции изменяются степени окисления у натрия и водорода,
поэтому реакция относится к окислительно-восстановительным, так как натрий выступает в роли восстановителя, а водород в роли окислителя. К реакциям нейтрализации не относится, поскольку в результате реакции нейтрализации образуются вещества, имеющие нейтральную реакцию среды, а здесь образуется щелочь. Из этого можно сделать вывод, что правильными будут ответы
Задание 20
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к уменьшению скорости химической реакции этилена с водородом:
1) понижение
температуры
2) увеличение
концентрации этилена
3) использование
катализатора
4) уменьшение
концентрации водорода
5) повышение
давления в системе.
Ответ: Скорость химической реакции – это величина, показывающая, как изменяются концентрации исходных веществ или продуктов реакции за единицу времени. Существует понятие скорости гомогенных и гетерогенных реакций. В данном случае дана гомогенная реакция, поэтому для гомогенных реакций скорость зависит от следующих взаимодействий (факторов):
- концентрация реагирующих веществ;
- температура;
- катализатор;
- ингибитор.
Данная реакция проходит при повышенной температуре, поэтому понижение температуры приведет к уменьшению ее скорости. Ответ № 1. Далее: если увеличить концентрацию одного из реагирующих веществ, реакция пойдет быстрее. Нам это не подходит. Катализатор – вещество, увеличивающее скорость реакции, – тоже не подходит. Уменьшение концентрации водорода приведет к замедлению реакции, что нам и нужно. Значит, еще один правильный ответ – № 4. Для ответа на пункт 4 вопроса давайте напишем уравнение данной реакции:
CH2=CH2 + H2 = CH3-CH3.
Из уравнения реакции видно, что она идет с уменьшением объема (в реакцию вступило 2 объема веществ – этилен + водород), а образовался только один объем продукта реакции. Следовательно, при увеличении давления скорость реакции должна увеличиться – тоже не подходит. Подведем итог. Правильными оказались ответы:
ЕГЭ-2018. Химия. Тематические тренировочные задания
Пособие содержит задания, максимально приближенные к реальным, используемым на ЕГЭ, но распределенные по темам в порядке их изучения в 10-11-х классах старшей школы. Работая с книгой, можно последовательно отработать каждую тему, устранить пробелы в знаниях, а также систематизировать изучаемый материал. Такая структура книги поможет эффективнее подготовиться к ЕГЭ. Это издание адресовано учащимся старших классов для подготовки к ЕГЭ по химии. Тренировочные задания позволят систематически, при прохождении каждой темы, готовиться к экзамену.
КупитьЗадание 21
Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
УРАВНЕНИЕ РЕАКЦИИ |
СВОЙСТВА АЗОТА |
А) NH4HCO3 = NH3 + H2O + CO2 Б) 3CuO + 2NH3 = N2 + 3Cu + 3H2O В) 4NH3 + 5O2 = 4NO + 6H2O |
1) является окислителем 2) является восстановителем 3) является и окислителем, и восстановителем 4) не проявляет окислительно-восстановительных свойств |
Ответ: Посмотрим, как изменяются степени окисления в реакциях:
в данной реакции азот не изменяет степени окисления. Она у него в реакции стабильна 3–. Поэтому ответ 4.
в данной реакции азот изменяет свою степень окисления с 3– до 0, то есть окисляется. Значит, он является восстановителем. Ответ 2.
Здесь азот изменяет свою степень окисления с 3– до 2+. Реакция окислительно-восстановительная, азот окисляется, значит, является восстановителем. Правильный ответ 2.
Общий ответ:
|
А |
Б |
В |
|
4 |
2 |
2 |
Задание 22
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛА СОЛИ |
ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
А) Na3PO4 Б) KCl В) CuBr2 Г) Cu(NO3)2 |
1) H2, O2 2) Cu, O2 3) Cu, Br2 4) H2, Cl2 5) Cu, NO2 |
Ответ: Электролиз – это окислительно-восстановительная реакция, протекающая на электродах, при прохождении постоянного электрического тока через раствор или расплав электролита. На катоде всегда идёт процесс восстановления; на аноде всегда идёт процесс окисления. Если металл стоит в электрохимическом ряду напряжений металлов до марганца, то на катоде восстанавливается вода; от марганца до водорода возможно выделение воды и металла, если правее водорода, то восстанавливается только металл. Процессы, протекающие на аноде:
Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление анионов:
В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе:
При электролизе растворов щелочей идет окисление гидроксид-ионов:
Теперь давайте рассмотрим данное задание:
А) Na3PO4 диссоциирует в растворе на ионы натрия и кислотного остатка кислородсодержащей кислоты.
Катион натрия устремляется к отрицательному электроду – катоду. Так как ион натрия в электрохимическом ряду напряжений металлов находится до алюминия, то от восстанавливаться не будет, будет восстанавливаться вода по следующему уравнению:
2H2O = H2 + 2OH–.
На катоде выделяется водород.
Анион устремляется к аноду – положительно заряженному электроду – и находится в прианодном пространстве, а на аноде окисляется вода по уравнению:
2H2O – 4e = O2↑ + 4H+
На аноде происходит выделение кислорода. Таким образом, суммарное уравнение реакции будет иметь следующий вид:
2Na3PO4 + 8H2O = 2H2 + O2 + 6NaOH + 2 H3PO4 (ответ 1)
Б) при электролизе раствора КCl на катоде будет восстанавливаться вода по уравнению:
2H2O = H2 + 2OH–.
В качестве продукта реакции будет выделяться водород. На аноде будет окисляться Cl– до свободного состояния по следующему уравнению:
2CI– – 2e = Cl2.
Суммарный процесс на электродах выглядит следующим образом:
2KCl + 2H2O = 2KOH + H2 + Cl2 (ответ 4)
В) При электролизе соли CuBr2 на катоде восстанавливается медь:
Cu2+ + 2e = Cu0.
На аноде окисляется бром:
Суммарное уравнение реакции будет иметь следующий вид:
Правильный ответ 3.
Г) Гидролиз соли Cu(NO3)2 протекает следующим образом: на катоде происходит выделение меди по следующему уравнению:
Cu2+ + 2e = Cu0.
На аноде выделяется кислород:
2H2O – 4e = O2↑ + 4H+
Правильный ответ 2.
Общий ответ на данный вопрос:
|
А |
Б |
В |
Г |
|
1 |
4 |
3 |
2 |
ЕГЭ. Химия. Пошаговая подготовка
Все материалы школьного курса по химии четко структурированы и разделены на 36 логических блоков (недель). Изучение каждого блока рассчитано на 2-3 самостоятельных занятия в неделю в течение учебного года. Пособие содержит все необходимые теоретические сведения, задания для самоконтроля в виде схем и таблиц, а также в форме ЕГЭ, бланки и ответы. Уникальная структура пособия поможет структурировать подготовку к ЕГЭ и пошагово изучить все темы в течение всего учебного года. Издание содержит все темы школьного курса по химии, необходимые для сдачи ЕГЭ. Весь материал четко структурирован и разделен на 36 логических блоков (недель), включающих необходимые теоретические сведения, задания для самоконтроля в виде схем и таблиц, а также в форме ЕГЭ. Изучение каждого блока рассчитано на 2-3 самостоятельных занятия в неделю в течение учебного года. Кроме того, в пособии приводятся тренировочные варианты, цель которых – оценить уровень знаний.
КупитьЗадание 23
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
НАЗВАНИЕ СОЛИ |
ОТНОШЕНИЕ К ГИДРОЛИЗУ |
А) хлорид аммония Б) сульфат калия В) карбонат натрия Г) сульфид алюминия |
1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизу не подвергается 4) гидролизуется по катиону и аниону |
Ответ: Гидролизом называется реакция взаимодействия ионов соли с молекулами воды, приводящая к образованию слабого электролита. Любую соль можно представить как продукт взаимодействия кислоты и основания. По этому принципу все соли можно разделить на 4 группы:
- Соли, образованные сильным основанием и слабой кислотой.
- Соли, образованные слабым основанием и сильной кислотой.
- Соли, образованные слабым основанием и слабой кислотой.
- Соли, образованные сильным основанием и сильной кислотой.
Давайте теперь разберем с этой точки зрения данное задание.
А) NH4Cl – соль, образованная слабым основанием NH4OH и сильной кислотой HCl – подвергается гидролизу. В результате образуется слабое основание и сильная кислота. Данная соль гидролизуется по катиону , так как данный ион входит в состав слабого основания. Ответ под цифрой 1.
Б) K2SO4 – соль, образованная сильным основанием и сильной кислотой. Такие соли гидролизу не подвергаются, так как не образуется слабого электролита. Ответ 3.
В) Карбонат натрия Na2CO3 – соль, образованная сильным основанием NaOH и слабой угольной кислотой H2CO3 – подвергается гидролизу. Так как соль образована двухосновной кислотой, то гидролиз теоретически может идти в две стадии. в результате первой стадии образуется щелочь и кислая соль – гидрокарбонат натрия:
Na2CO3 + H2O ↔NaHCO3 + NaOH;
в результате второй стадии образуется слабая угольная кислота:
NaHCO3 + H2O ↔ H2CO3 (H2O + CO2) + NaOH –
данная соль гидролизуется по аниону (ответ 2).
Г) Соль сульфид алюминия Al2S3 образована слабым основанием Al(OH)3 и слабой кислотой H2S. Такие соли подвергаются гидролизу. В результате образуется слабое основание и слабая кислота. Гидролиз идет по катиону и аниону. Правильный ответ 4.
Таким образом, общий ответ на задание имеет вид:
|
А |
Б |
В |
Г |
|
1 |
3 |
2 |
4 |
Задание 24
Установите соответствие между уравнением обратимой реакции и направлением смещения химического равновесия при увеличении давления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
УРАВНЕНИЕ РЕАКЦИИ |
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
А) N2(г) + 3H2(г) = 2NH3(г) Б) 2H2(г) + O2(г) = 2H2O(г) В) H2(г) + CI2(г) = 2HCl(г) Г) SO2(г) + CI2(г) = SO2Cl2(г) |
1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается. |
Ответ: Обратимыми называют реакции, которые одновременно могут идти в двух противоположных направлениях: в сторону прямой и обратной реакции, поэтому в уравнениях обратимых реакций вместо равенства ставится знак обратимости. Каждая обратимая реакция заканчивается химическим равновесием. Это динамический процесс. Для того чтобы вывести реакцию из состояния химического равновесия, нужно приложить к ней определенные внешние воздействия: изменить концентрацию, температуру или давление. Делается это по принципу Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия, подействовать извне, изменить концентрацию, температуру или давление, то система стремится занять такое положение, которое противодействует этому действию.
Разберем это на примерах нашего задания.
А) Гомогенная реакция N2(г) + 3H2(г) = 2NH3(г) является еще и экзотермической, то есть идет с выделением теплоты. Далее в реакцию вступило 4 объема реагирующих веществ (1 объем азота и 3 объема водорода), а в результате образовался один объем аммиака. Таким образом, мы определили, что реакция идет с уменьшением объема. По принципу Ле-Шателье, если реакция идет с уменьшением объема, то увеличение давления смещает химическое равновесие в сторону образования продукта реакции. Правильный ответ 1.
Б) Реакция 2H2(г) + O2(г) = 2H2O(г) аналогична предыдущей реакции, также идет с уменьшением объема (вступило 3 объема газа, а в результате реакции образовалось 2), поэтому увеличение давления сместит равновесие в сторону образования продукта реакции. Ответ 1.
В) Данная реакция H2(г) + Cl2(г) = 2HCl(г) протекает без изменения объема реагирующих веществ (вступило 2 объема газов и образовалось 2 объема хлороводорода). На реакции, идущие без изменения объема, давление влияния не оказывает. Ответ 3.
Г) Реакция взаимодействия оксида серы (IV) и хлора SO2(г) + Cl2(г) = SO2Cl2(г) является реакцией, идущей с уменьшением объема веществ (в реакцию вступило 2 объема газов, а образовался один объем SO2Cl2). Ответ 1.
Ответом на это задание будет следующий набор букв и цифр:
|
А |
Б |
В |
Г |
|
1 |
1 |
3 |
1 |
ЕГЭ-2018. Химия. Решение задач. Сдаем без проблем!
В книге решения всех типов задач базового, повышенного и высокого уровней сложности по всем темам, проверяемым на ЕГЭ по химии. Регулярная работа с данным пособием позволит учащимся научиться быстро и без ошибок решать задачи по химии разных уровней сложности. В пособии подробно разобраны решения всех типов задач базового, повышенного и высокого уровней сложности в соответствии с перечнем элементов содержания, проверяемых на ЕГЭ по химии. Регулярная работа с данным пособием позволит учащимся научиться быстро и без ошибок решать задачи по химии разных уровней сложности. Издание окажет неоценимую помощь учащимся при подготовке к ЕГЭ по химии, а также может быть использовано учителями при организации учебного процесса.
КупитьЗадание 25
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить водные растворы этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ФОРМУЛЫ ВЕЩЕСТВ |
РЕАГЕНТ |
А) HNO3 и NaNO3 Б) KCI и NaOH В) NaCI и BaCI2 Г) AICI3 и MgCI2 |
1) Cu 2) KOH 3) HCI 4) KNO3 5) CuSO4 |
Ответ: А) Даны два вещества, кислота и соль. Азотная кислота является сильным окислителем и взаимодействует с металлами, стоящими в электрохимическом ряду напряжений металлов как до водорода, так и после, причем взаимодействует как концентрированная, так и разбавленная. Например, азотная кислота HNO3 взаимодействует с медью с образованием соли меди, воды и оксида азота. При этом, помимо выделения газа, раствор приобретает характерную для солей меди синюю окраску, например:
8HNO3(р) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O,
а соль NaNO3 с медью не реагирует. Ответ 1.
Б) Даны соль и гидроксид активных металлов, у которых практически все соединения растворимы в воде, поэтому выбираем вещество из колонки реагентов, которое при взаимодействии с одним из данных веществ выпадает в осадок. Этим веществом будет сульфат меди. С хлоридом калия реакция не пойдет, а вот с гидроксидом натрия выпадет красивый синий осадок, по уравнению реакции:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4.
Ответ 5.
В) Даны две соли, хлориды натрия и бария. Если все соли натрия растворимы, то с солями бария наоборот – многие соли бария нерастворимы. По таблице растворимости определяем, что сульфат бария нерастворим, поэтому реактивом будет сульфат меди. Ответ 5.
Г) Опять даны 2 соли – AlCl3 и MgCl2 – и опять хлориды. При сливании данных растворов с HCl, KNO3 CuSO4 не образуют никаких видимых изменений, c медью вообще не реагируют. Остается КOH. С ним обе соли выпадают в осадок, с образованием гидроксидов. Но гидроксид алюминия – амфотерное основание. При добавлении избытка щелочи осадок растворяется с образованием комплексной соли. Ответ 2.
Общий ответ на данное задание выглядит так:
|
А |
Б |
В |
Г |
|
1 |
5 |
5 |
2 |
Задание 26
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
ВЕЩЕСТВО |
ОБЛАСТЬ ПРИМЕНЕНИЯ |
A) метан Б) изопрен В) этилен |
1) получение капрона 2) в качестве топлива 3) получение каучука 4) получение пластмасс |
Ответ: А) Метан при сгорании выделяет большое количество тепла, поэтому его можно использовать в качестве топлива (ответ 2).
Б) Изопрен, являясь диеновым углеводородом, при полимеризации образует каучук, который затем превращают в резину (ответ 3).
В) Этилен – непредельный углеводород, который вступает в реакции полимеризации, поэтому может быть использован в качестве пластических масс (ответ 4).
Итого:
|
А |
Б |
В |
|
2 |
3 |
4 |
Задание 27
Вычислите массу нитрата калия (в граммах), которую следует растворить в 150,0 г. раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. (Запишите число с точностью до десятых).
Решим данную задачу:
1. Определим массу нитрата калия, содержащуюся в 150 г 10% раствора. Воспользуемся волшебным треугольником:
Отсюда масса вещества равна: ω · m(р-ра) = 0,1 · 150 = 15 г.
2. Пусть масса добавленного нитрата калия равна x г. Тогда масса всей соли в конечном растворе будет равна (15 + x) г, масса раствора (150 + x), а массовую долю нитрата калия в конечном растворе можно записать как: ω(KNO3) = 100% – (15 + x)/(150 + x)
Далее, по условию задачи известно, что конечный раствор должен иметь ω(KNO3) = 12%
100% – (15 + x)/(150 + x) = 12%
(15 + x)/(150 + x) = 0,12
15 + x = 18 + 0,12x
0,88x = 3
x = 3/0,88 = 3,4
Ответ: Для получения 12% раствора соли необходимо добавить 3,4 г KNO3.
ЕГЭ. Химия. Универсальный справочник
Справочник содержит подробный теоретический материал по всем темам, проверяемым ЕГЭ по химии. После каждого раздела приводятся разноуровневые задания в форме ЕГЭ. Для итогового контроля знаний в конце справочника даются тренировочные варианты, соответствующие ЕГЭ. Учащимся не придется искать дополнительную информацию в интернете и покупать другие пособия. В данном справочнике они найдут все необходимое для самостоятельной и эффективной подготовки к экзамену. Справочник адресован учащимся старших классов для подготовки к ЕГЭ по химии.
КупитьЗадание 28
В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = H2O (г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах).
Данная задача может быть решена в одно действие.
Согласно уравнению реакции, в результате ее образовалось 36 граммов воды и выделилось 484 кДж энергии. А 1454 кДж энергии выделится при образовании Х г. воды.
| Х = | 36 г · 1452 кДж | = 108 г |
| 484 кДж |
Ответ: При выделении 1452 кДж энергии образуется 108 г воды.
Задание 29
Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода.
Для решения данной задачи напишем уравнение реакции горения сероводорода и рассчитаем массы кислорода и сероводорода, вступивших в реакцию, по уравнению реакции
| 2H2S | + | 3O2 | = 2SO2 + 2H2O |
|
Mr
= 34 M = 34г/моль n = 2 моль m = 68 г |
|
Mr = 32 M = 32г/моль n = 3 моль m = 96 г |
|
1. Определяем количество сероводорода, содержащегося в 6,72 л.
| n(H2S) = | V | = | 6,72 | = 0,3 моль |
| Vm | 22,4 |
2. Определяем количество кислорода, которое прореагирует с 0,3 моль сероводорода.
По уравнению реакции, с 2 моль H2S реагирует 3 моль O2.
По уравнению реакции, с 0,3 моль H2S прореагирует с Х моль О2.
Отсюда Х = 0,45 моль.
3. Определим массу 0,45 моль кислорода
m(O2) = n · M = 0,45 моль · 32 г/моль = 14,4 г.
Ответ: масса кислорода равна 14,4 грамма.
Задание 30
Из предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия) выберите вещества, между которыми возможна окислительно-восстановительная реакция. в ответе запишите уравнение только одной из возможных реакций. Составьте электронный баланс, укажите окислитель и восстановитель.
Ответ: КMnO4 – известный окислитель, окисляет вещества, содержащие элементы в низшей и промежуточной степенях окисления. Его действия могут проходить в нейтральной, кислой и щелочной средах. При этом марганец может восстанавливаться до различных степеней окисления: в кислой среде – до Mn2+, в нейтральной среде – до Mn4+, в щелочной среде – до Mn6+. В сульфите натрия содержится сера в степени окисления 4+, которая может окислиться до 6+. И наконец, гидроксид калия определит реакцию среды. Пишем уравнение данной реакции:
KMnO4 + Na2SO3 + KOH = K2MnO4 + Na2SO4 + H2O
Далее составляем схему окислительно-восстановительного процесса и расставляем коэффициенты.
Mn7+ + 1e → = Mn6+ S4+ –2e → = S6+ |
2 процесс восстановления, окислитель 1 процесс окисления, восстановитель |
После расставления коэффициентов формула приобретает следующий вид:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
Следовательно, KMnO4 – является окислителем, а Na2SО3 – восстановителем.
ЕГЭ. Химия
Все необходимые для сдачи ЕГЭ по химии сведения представлены в наглядных и доступных таблицах, после каждой темы – тренировочные задания для контроля знаний. С помощью этой книги учащиеся смогут в кратчайший срок повысить уровень своих знаний, за считанные дни до экзамена вспомнить все самые важные темы, потренироваться в выполнении заданий в формате ЕГЭ и стать более уверенным в своих силах. После повторения всех тем, представленных в пособии, долгожданные 100 баллов станут намного ближе! Пособие содержит теоретические сведения по всем темам, проверяемым на ЕГЭ по химии. После каждого раздела приводятся тренировочные задания разных типов с ответами. Наглядное и доступное изложение материала позволит быстро найти нужную информацию, устранить пробелы в знаниях и в кратчайшие сроки повторить большой объем информации.
КупитьЗадание 31
Из предложенного перечня веществ (перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия) выберите вещества, между которыми возможна реакция ионного обмена. В ответе запишите молекулярное, полное и сокращенное ионное уравнение только одной из возможных реакций.
Ответ: Рассмотрим реакцию обмена между гидрокарбонатом калия и гидроксидом калия
KHCO3 + KOH = K2CO3 + H2O
Если в результате реакции в растворах электролитов образуется нерастворимое или газообразное, или малодиссоциирующее вещество, то такая реакция протекает необратимо. В соответствии с этим данная реакция возможна, так как один из продуктов реакции (Н2О) – малодиссоциирующее вещество. Запишем полное ионное уравнение.
Так как вода – малодиссоциирующее вещество, она пишется в виде молекулы. Далее составляем сокращенное ионное уравнение. Те ионы, которые перешли из левой части уравнения в правое, не изменяя знака заряда, вычеркиваем. Остальное переписываем в сокращенное ионное уравнение.
Это уравнение и будет ответом на данное задание.
Задание 32
При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделяющийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырех описанных реакций.
Ответ: Электролиз – это окислительно-восстановительный процесс, проходящий на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. В задании говорится об электролизе раствора нитрата меди. При электролизе растворов солей вода также может принимать участие в электродных процессах. При растворении соли в воде она распадается на ионы:
На катоде происходят процессы восстановления. В зависимости от активности металла, могут восстанавливаться металл, металл и вода. Так как медь в электрохимическом ряду напряжений металлов стоит правее водорода, то на катоде будет восстанавливаться медь:
Cu2+ + 2e = Cu0.
На аноде будет происходить процесс окисления воды.
Медь не реагирует с растворами серной и соляной кислот. Но концентрированная серная кислота является сильным окислителем, поэтому может реагировать с медью по следующему уравнению реакции:
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O.
Сероводород (H2S) содержит серу в степени окисления 2–, поэтому выступает в роли сильного восстановителя и восстанавливает серу в оксиде серы IV до свободного состояния
2H2S + SO2 = 3S + 2H2O.
Образующееся вещество, сера, взаимодействует с концентрированным раствором гидроксида калия при нагревании с образованием двух солей: сульфида и сульфита серы и воды.
S + KOH = K2S + K2SO3 + H2O
Задание 33
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ: В данной цепочке предложено выполнить 5 уравнений реакций, по числу стрелочек между веществами. В уравнении реакции № 1 серная кислота играет роль водоотнимающей жидкости, поэтому в результате ее должен получиться непредельный углеводород.
Следующая реакция интересна тем, что протекает по правилу Марковникова. По этому правилу, при соединении галогеноводородов к несимметрично построенным алкенам, галоген присоединяется к менее гидрированному атому углерода при двойной связи, а водород, наоборот.
В следующем уравнении реакции, атом хлора замещается на группу –ОН
В уравнении реакции № 4 в качестве продукта должен получиться пропен, исходя из условия задания (в обоих случаях в качестве продукта стоит Х1). Условия реакции будут также одинаковыми.
В последнем уравнении реакции предлагается окислить пропен перманганатом калия в нейтральной среде при низкой температуре.
ЕГЭ. Химия. Новый полный справочник для подготовки к ЕГЭ
Новый справочник содержит весь теоретический материал по курсу химии, необходимый для сдачи ЕГЭ. Он включает в себя все элементы содержания, проверяемые контрольно-измерительными материалами, и помогает обобщить и систематизировать знания и умения за курс средней (полной) школы. Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тренировочных заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к заданиям, которые помогут объективно оценить уровень своих знаний и степень подготовленности к аттестационному экзамену. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьЗадание 34
При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твердого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора хлороводородной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых величин).
Ответ: Запишем краткое условие данной задачи.
Дано: V(CO2) = 4,48 л m() = 41,2 г. m(HCl) = 465,5 г |
Решение: Напишем уравнение первой реакции разложения карбоната кальция.
|
|||||||||||||||
После того как все приготовления приведены, приступаем к решению.
1) Определяем количество СО2, содержащееся в 4,48 л. его.
n(CO2) = V/Vm = 4,48 л / 22,4 л/моль = 0,2 моль
2) Определяем количество образовавшегося оксида кальция.
По уравнению реакции образуется 1 моль СО2 и 1 моль СаО
Следовательно: n(CO2) = n(CaO) и равняется 0,2 моль
3) Определяем массу 0,2 моль СаО
m(CaO) = n(CaO) · M(CaO) = 0,2 моль · 56 г/моль = 11,2 г
Таким образом, твердый остаток массой 41,2 г состоит из 11,2 г СаО и (41,2 г. – 11,2 г.) 30 г СаСО3
4)
Определим количество СаСО3, содержащееся в 30 г
n(CaCO3) = m(CaCO3) / M(CaCO3) = 30 г / 100 г/моль = 0,3 моль
Далее пишем следующие два уравнения необходимые для решения данной.
Задачи:
CaO + HCl = CaCl2 + H2O
CaCO3 + HCl = CaCl2 + H2O + CO2
5) Определим количество хлорида кальция, образующееся в результате данных реакций.
В реакцию вступило 0,3 моль CaCO3 и 0,2 моль СаО всего 0,5 моль.
Соответственно, образуется 0,5 моль CaCl2
6) Рассчитаем массу 0,5 моль хлорида кальция
M(CaCl2) = n(CaCl2) · M(CaCl2) = 0,5 моль · 111 г/моль = 55,5 г.
7) Определяем массу углекислого газа. В реакции разложения участвовало 0,3 моль карбоната кальция, следовательно:
n(CaCO3) = n(CO2) = 0,3 моль,
отсюда:
m(CO2) = n(CO2) · M(CO2) = 0,3 моль · 44г/моль = 13,2 г.
8) Находим массу раствора. Она состоит из массы соляной кислоты + масс твердого остатка (CaCO3 + CaO) минут масса выделившегося CO2. Запишем это в виде формулы:
m(р-ра) = m(CaCO3 + CaO) + m(HCl) – m(CO2) = 465,5 г + 41,2 г – 13,2 г = 493,5 г.
9) И наконец, ответим на вопрос задачи. Найдем массовую долю в % соли в растворе, воспользовавшись следующим волшебным треугольником:
ω%(CaCI2) = m(CaCI2) / m(р-ра) = 55,5 г / 493,5 г = 0,112 или 11,2%
Ответ: ω % (СaCI2) = 11.2%
Задание 35
Органическое вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода по массе и образуется при взаимодействии органического вещества Б с пропанолом-2. Известно, что вещество Б имеет природное происхождение и способно взаимодействовать как с кислотами, так и со щелочами.
На основании данных условия выполните задания:
1) Проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) Составьте структурную формулу этого вещества, которая однозначно покажет порядок связи атомов в его молекуле;
3) Напишите уравнение реакции получения вещества А из вещества Б и пропанола-2 (используйте структурные формулы органических веществ).
Ответ: Давайте постараемся разобраться с данной задачей. Напишем краткое условие:
Дано: ω(N) = 11,97% ω(H) = 9,40% ω(O) = 27,35% |
Решение: 1) Находим % углерода, так как углерод постоянный элемент органических веществ. Массовая доля в % всех элементов в любом соединении равняется 100%, поэтому вычтем из 100% массовые доли всех данных в задаче элементов. Цифра, которая у нас получится, и будет отражать массовую долю углерода. |
ω(C) = 100% – 11,97% – 9,40% – 27,35% = 51,28% (ω(C) = 51,28%)
2) Зная массовые доли всех элементов, входящих в состав молекулы, можем определить ее молекулярную формулу.
Примем массу вещества А за 100 г. Тогда в массы всех элементов, входящих в его состав, будут равны: m(C) = 51,28 г; m(N) = 11,97 г; m(H) = 9,40 г; m(O) = 27,35 г. Определим количество каждого элемента:
n(C) = m(C) · M(C) = 51,28 г / 12 г/моль = 4,27 моль
n(N) = m(N) · M(N) = 11,97 г / 14 г/моль = 0,855 моль
n(H) = m(H) · M(H) = 9,40 г / 1 г/моль = 9,40 моль
n(O) = m(O) · M(O) = 27,35 г / 16 г/моль = 1,71 моль
Далее разделим все эти цифры на наименьшее число (0,855), чтобы получить целочисленные значения количества атомов; получим;
x : y : z : m = 5 : 1 : 11 : 2.
Таким образом молекулярная формула вещества А равна: C5H11O2N.
3) Попробуем составить структурную формулу вещества А. Мы уже знаем, что углерод в органической химии всегда четырехвалентен, водород – одновалентен, кислород двухвалентен и азот трехвалентен. В условии задачи также сказано, что вещество Б способно взаимодействовать как с кислотами, так и со щелочами, то есть оно амфотерно. Из природных амфотерных веществ нам известно, что аминокислоты обладают выраженной амфотерностью. Следовательно можно предположить, что вещество Б относится к аминокислотам. Ну и конечно, берем во внимание, что оно получается при взаимодействии с пропанолом-2. Посчитав количество атомов углерода в пропаноле-2, можно сделать смелый вывод, что вещество Б – аминоуксусная кислота. После некоторого количества попыток, получилась следующая формула:
4) В заключение напишем уравнение реакции взаимодействия аминоуксусной кислоты с пропанолом-2.
ЕГЭ. Химия. Большой сборник тематических заданий по химии для подготовки к ЕГЭ
Вниманию школьников и абитуриентов впервые предлагается учебное пособие для подготовки к ЕГЭ по химии, которое содержит тренировочные задания, собранные по темам. В книге представлены задания разных типов и уровней сложности по всем проверяемым темам курса химии. Каждый из разделов пособия включает не менее 50 заданий. Задания соответствуют современному образовательному стандарту и положению о проведении единого государственного экзамена по химии для выпускников средних общеобразовательных учебных учреждений. Выполнение предлагаемых тренировочных заданий по темам позволит качественно подготовиться к сдаче ЕГЭ по химии. Пособие адресовано старшим школьникам, абитуриентам и учителям.
КупитьПропионат натрия
Пропионат натрия Подготовлено на 49-м заседании JECFA (1997 г.)
заменяет спецификации, подготовленные на 44-м заседании JECFA (1995 г.),
опубликовано в Приложении 3 к FNP 52 (1995 г.)
СИНОНИМЫ | Пропаноат натрия, ИНС № 281 |
ОПРЕДЕЛЕНИЕ | |
Химическое название | Пропионат натрия |
С.В ВИДЕ. номер | 137-40-6 |
Химическая формула | C 3 H 5 NaO 2 |
Структурная формула | CH 3 CH 2 COO — Na + |
Формула веса | 96,06 |
Анализ | Не менее 99.0% на сушеной основе |
ОПИСАНИЕ | Белые или бесцветные гигроскопичные кристаллы со слабым характерным запахом |
ФУНКЦИОНАЛЬНОЕ ИСПОЛЬЗОВАНИЕ | Консервант, антиплесень и антикоррозийное средство |
ХАРАКТЕРИСТИКИ | |
ИДЕНТИФИКАЦИЯ | |
Растворимость | Легко растворим в воде, растворим в этаноле |
Положительный тест на натрий | Проходит испытания |
Положительный результат на пропионат | |
Нагрейте образец серной кислотой.Образовавшуюся пропионовую кислоту можно узнать по запаху. | |
Положительный тест на щелочную соль органической кислоты | |
Зажигают образец при относительно низкой температуре. Щелочной остаток вскипает от кислоты. | |
PURITY | |
Потери при сушке | Не более 4% (105 °, 2ч) |
Нерастворимые в воде вещества | Не более 0.1% |
pH | 7,5 — 10,5 (1 из 10 солнечных) |
Утюг | Не более 50 мг / кг |
Свинец | Не более 5 мг / кг Приготовьте раствор образца, как указано для органических соединений в предельном тесте, используя 5 мг иона свинца (Pb) в контроле. |
ИСПЫТАНИЯ | |
ИСПЫТАНИЯ НА ЧИСТОТУ | |
Нерастворимые в воде вещества | Взвешивают 5 г образца с точностью до мг, переносят в стакан емкостью 100 мл и добавляют 50 мл воды. Перемешивайте, пока весь образец не растворится полностью. Фильтруют через тигель Гуча, тарированный с точностью ± 0,2 мг. Промойте стакан 20 мл воды.Сушите тигель с его содержимым в печи с температурой 60 ° до постоянного веса. Охладите в эксикаторе, взвесьте и рассчитайте в процентах. |
МЕТОД АНАЛИЗА | Взвешивают с точностью до мг 3 г образца, предварительно высушенного при 105 ° в течение 1 ч, в перегонную колбу и добавляют 200 мл 50% -ной фосфорной кислоты. Кипятят 2 ч и собирают дистиллят. Во время перегонки поддерживайте объем в колбе примерно на 200 мл, добавляя воду с помощью капельной воронки.Дистиллят титруют 1 н. Гидроксидом натрия, используя фенолфталеин TS в качестве индикатора. Каждый мл IN гидроксида натрия соответствует 96,06 мг C 3 H 5 NaO 2 . |
ХИМИЧЕСКАЯ ИДЕНТИФИКАЦИЯ
ДАННЫЕ ОБ ОПАСНОСТИ ДЛЯ ЗДОРОВЬЯДАННЫЕ О ОСТРОЙ ТОКСИЧНОСТИ
|
033. Пропионат натрия (серия отчетов совещаний ФАО по вопросам питания, серия 40abc)
033. Пропионат натрия (серия отчетов совещаний ФАО по вопросам питания, серия 40abc)
Совещания ФАО по вопросам питания
Отчет № .40A, B, C
WHO / Food Add./67.29
ТОКСИКОЛОГИЧЕСКАЯ ОЦЕНКА НЕКОТОРЫХ
АНТИМИКРОБНЫЕ СРЕДСТВА, АНТИОКСИДАНТЫ, ЭМУЛЬСИФАТОРЫ,
СТАБИЛИЗАТОРЫ, МУКИ, КИСЛОТЫ И ОСНОВАНИЯ
Содержание этого документа является результатом обсуждения
Объединенный комитет экспертов ФАО / ВОЗ по пищевым добавкам, заседавший в Риме,
13-20 декабря 1965 г. 1 Женева, 11-18 октября 1966 г. 2
1 Девятый доклад Объединенного комитета экспертов ФАО / ВОЗ по пищевым продуктам
Добавки, ФАО Серия отчетов совещаний по питанию , 1966 No.40;
Wld Hlth Org. техн. Rep. Ser. , 1966, 339
2 Десятый доклад Объединенного комитета экспертов ФАО / ВОЗ по пищевым продуктам
Добавки, Серия отчетов заседаний ФАО по вопросам питания , 1967 , в печати;
Продовольственная и сельскохозяйственная организация Объединенных Наций
Всемирная организация здоровья
1967
ПРОПИОНОВАЯ КИСЛОТА
Химические названия Пропионовая кислота; Пропановая кислота
Эмпирическая формула C 3 H 6 O 2
Структурная формула CH 3 CH 2 COOH
Молекулярный вес 74.08
Определение Пропионовая кислота - жидкость с
слегка резкий запах.
Использование в качестве ингибитора плесени
Биологические данные
(См. Пропионат натрия)
КАЛЬЦИЯ ПРОПИОНАТ
Химические названия Пропионат кальция; Пропаноат кальция
Эмпирическая формула C 6 H 10 O 4 Ca
Структурная формула
Молекулярный вес 186,23
Определение Пропионат кальция, после высыхания при
110, содержит не менее 99 шт.
центиз C 6 H 10 O 4 Прибл.
Описание Пропионат кальция - белый
кристаллическое твердое вещество с не более
слабый запах пропионовой кислоты.
Использование в качестве ингибитора плесени.
Биологические данные
(См. Пропионат натрия)
ПРОПИОНАТ НАТРИЯ
Химические названия Пропионат натрия; Пропаноат натрия.
Эмпирическая формула C 3 H 5 O 2 Na
Структурная формула CH 3 -CH 2 -COONa
Молекулярный вес 96.06
Определение Пропионат натрия, после высыхания при 110 ° С.
содержит не менее 99 процентов. из
C 3 H 5 O 2Na
Описание Пропионат натрия - белый или
бесцветный, кристаллический, гигроскопичный
твердый с не более чем слабым
характерный запах.
Использование в качестве ингибитора плесени.Биологические данные
Биологические данные о пропионатах приведены в Шестом отчете
Объединенный комитет экспертов ФАО / ВОЗ по пищевым добавкам, FAO Nutrition
Серия отчетов о собраниях № 31; Wld Hlth Org. техн. Rep. Ser .,
228.
Оценка
Нет оснований полагать, что пропионовая кислота отличается
токсикологически из-за его солей кальция и натрия. По оценкам
допустимые суточные дозы этих солей для человека, указанные в шестой
Отчет Объединенного комитета экспертов ФАО / ВОЗ по пищевым добавкам
поэтому считается применимым к кислоте.Оценка допустимого суточного потребления для мужчин
мг / кг массы тела 1
Безусловное принятие 0-10
Условный прием 10-20
1 В виде суммы пропионовой кислоты и пропионата кальция и натрия.
(в пересчете на пропионовую кислоту).
Смотрите также:
Токсикологические сокращения
Пропионовая кислота (ICSC)
ПРОПИОНОВАЯ КИСЛОТА (оценка JECFA)
| Поставщик | Тел | Факс | Электронная почта | Страна | ProdList | Преимущество |
|---|---|---|---|---|---|---|
| Чжэнчжоу Альфа Кемикал Ко., ООО | +86 13343822234 ; +86 18703821685 ; +86 18530059196 ; +86 19139973225 | [email protected] ; [email protected] ; [email protected] ; sales7@alfachem | CHNS | 14645 | 58 | |
| Hebei Crovell Biotech Co Ltd | 19930504644 WhatsApp +8619930504644 | 86-0311-66562153 | sales4 @ Crovellbio.com | КИТАЙ | 2112 | 58 |
| Чжочжоу Wenxi импорта и экспорта Co., Ltd | +8613111626072 (WhatsApp) | Wechat: +8613111626072 Wickr me: waynehu | zzwenxi @ 126.com | КИТАЙ | 9583 | 58 |
| Компания Shandong Pingju Biotechnology Co., Ltd. | 2708672464 @ qq.com | Китай | 696 | 58 | ||
| Компания Shaanxi Chenming Biotechnology Co., Ltd. | 2709392183 @ qq.com | КИТАЙ | 654 | 58 | ||
| Гуанчжоу Juntang Technology Co., Ltd. | 3008234953 @ qq.com | Китай | 10338 | 58 | ||
| Chengdu HuaXia Chemical Reagent Co.Ltd. | 400-1196-196; 028-84555506-; 028-84555506- | QQ : 800101999 | cdhxsj @ 163.com; [email protected]; [email protected] | Китай | 14604 | 60 |
| ЛУЧШИЙ РЕАГЕНТ | 400-1166-196; 028-84555506-; 028-84555506- | cdhxsj @ 163.com; [email protected]; [email protected] | Китай | 11718 | 57 год |
Пропионат натрия CAS NO (137-40-6) -Molbase
Раздел 1 — Химический продукт Название в паспорте безопасности: Натриевая соль пропионовой кислоты 99.0-100,5% (в пересчете на сухое вещество) Паспорт безопасности материалаСиноним: пропионат натрия; Пропаноат натрия; Пропановая кислота натриевая соль
Раздел 2 — СОСТАВ, ИНГРЕДИЕНТЫ
| CAS № | Химическое название | содержание | EINECS № |
| 137-40-6 | Пропионовая кислота, натриевая соль | > = 99 | 205-290-4 |
Фразы риска: 21
Раздел 3 — ИДЕНТИФИКАЦИЯ ОПАСНОСТЕЙ
ОБЗОР АВАРИЙНЫХ СИТУАЦИЙ
Вредно при попадании на кожу.Гигроскопичен (впитывает влагу из воздуха).
Возможное воздействие на здоровье
Глаза:
Может вызывать раздражение глаз.
Кожа:
Может вызывать раздражение кожи. Может проникать через кожу в опасном количестве.
Проглатывание:
Может вызывать раздражение желудочно-кишечного тракта с тошнотой, рвотой и диареей.
Вдыхание:
Может вызывать раздражение дыхательных путей.
Хроническая токсичность:
Информация не найдена.
Раздел 4 — ПЕРВАЯ ПОМОЩЬ
Глаза: промывать глаза большим количеством воды в течение не менее 15 минут, иногда приподнимая верхнее и нижнее веко.При появлении раздражения обратиться за медицинской помощью.
Кожа:
Получить медицинскую помощь. Немедленно промойте кожу большим количеством воды в течение не менее 15 минут, снимая загрязненную одежду и обувь.
Постирать одежду перед повторным использованием.
Проглатывание:
Если пострадавший находится в сознании и бодрствует, дайте ему 2-4 чашки молока или воды.
Никогда не давайте ничего через рот человеку, находящемуся без сознания. Получите медицинскую помощь. Не вызывает рвоту. Если в сознании и настороженном состоянии, прополощите рот и выпейте 2-4 стакана молока или воды.
Вдыхание:
Немедленно выйдите из зоны воздействия и выйдите на свежий воздух. Если нет дыхания проведите искусственную вентиляцию легких. Если дыхание затруднено, дайте кислород. При появлении кашля или других симптомов обратитесь за медицинской помощью.
На заметку врачу:
Раздел 5 — МЕРЫ ПОЖАРОТУШЕНИЯ
Общая информация:
Как и при любом пожаре, используйте автономный дыхательный аппарат, работающий под давлением, согласно MSHA / NIOSH (одобренный или эквивалентный), и полный комплект защитной одежды. Во время пожара в результате термического разложения или сгорания могут образовываться раздражающие и высокотоксичные газы.
Средства пожаротушения:
Используйте наиболее подходящее средство для тушения пожара. Используйте водяной спрей, сухой химикат, двуокись углерода или подходящую пену.
Раздел 6 — МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Общая информация: Используйте соответствующие средства индивидуальной защиты, как указано в Разделе 8.
Разливы / утечки:
Собрать пылесосом или подмести материал и поместить в подходящий контейнер для утилизации. Немедленно убирайте пролитую жидкость, соблюдая меры предосторожности, указанные в разделе «Защитное снаряжение».Избегайте создания пыльных условий.
Обеспечьте вентиляцию.
Раздел 7 — ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение:
После работы тщательно вымыть. Снять загрязненную одежду и выстирать перед повторным использованием. Используйте при соответствующей вентиляции. Сведите к минимуму образование и накопление пыли. Избегайте вдыхания пыли, пара, тумана или газа. Избегайте попадания в глаза, на кожу и одежду. Пустые контейнеры содержат остатки продукта (жидкость и / или пар) и могут быть опасны.
Держать контейнер плотно закрытым.Избегайте проглатывания и вдыхания.
Хранение:
Хранить в плотно закрытой таре. Хранить в прохладном, сухом, хорошо вентилируемом месте вдали от несовместимых веществ. Хранить в защищенном от влаги месте.
Раздел 8 — КОНТРОЛЬ ВОЗДЕЙСТВИЯ, ЛИЧНАЯ ЗАЩИТА
Технические средства контроля:
Помещения, в которых хранится или используется этот материал, должны быть оборудованы устройством для промывания глаз и безопасным душем. Используйте соответствующую вентиляцию для поддержания низких концентраций в воздухе.
Пределы воздействия CAS # 137-40-6: Средства индивидуальной защиты Глаза: Носите соответствующие защитные очки или очки химической безопасности, как описано в правилах OSHA по защите глаз и лица в 29 CFR 1910.133 или европейский стандарт EN166.
Кожа:
Надевайте соответствующие защитные перчатки для предотвращения контакта с кожей.
Одежда:
Носить соответствующую защитную одежду для предотвращения контакта с кожей.
Респираторы:
Программа защиты органов дыхания, соответствующая требованиям OSHA 29 CFR 1910.134 и ANSI Z88.2 или европейскому стандарту EN 149, должна выполняться всякий раз, когда условия на рабочем месте требуют использования респиратора.
Раздел 9 — ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Физическое состояние: порошок
Цвет: белый
Запах: слабый уксусно-масляный
pH: нейтральный
Давление пара: нет данных.
Вязкость: нет данных.
Точка кипения: нет данных.
Температура замерзания / плавления: 285 — 286 ° C
Температура самовоспламенения: Не применимо.
Температура воспламенения: Не применимо.
Пределы взрываемости, нижний: не доступен.
Пределы взрываемости, верхний: не доступен.
Температура разложения:
Растворимость в воде: Растворим.
Удельный вес / плотность:
Молекулярная формула: C3H5O2Na
Молекулярный вес: 96,06
Раздел 10 — СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Химическая стабильность:
Стабилен при нормальных температурах и давлениях.
Условия, которых следует избегать:
Несовместимые материалы, образование пыли, сильные окислители, воздействие влажного воздуха или воды.
Несовместимость с другими материалами:
Сильные окислители, влага.
Опасные продукты разложения:
Окись углерода, раздражающие и токсичные пары и газы, двуокись углерода.
Опасная полимеризация: не сообщалось.
Раздел 11 — ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
RTECS #:
CAS # 137-40-6: UF7525000 LD50 / LC50:
CAS # 137-40-6: Перорально, мышь: LD50 = 6332 мг / кг; Кожа, кролик: LD50 = 1640 мг / кг.
Канцерогенность:
Пропионовая кислота, натриевая соль — Не перечислено ACGIH, IARC или NTP.
Другое:
Для получения полной информации см. Фактическую запись в RTECS.
Раздел 12 — ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Раздел 13 — УТИЛИЗАЦИЯ
Утилизируйте в соответствии с федеральными, государственными и местными законами.
Раздел 14 — ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
IATA
Не считается опасным материалом.
IMO
Не считается опасным материалом.
RID / ADR
Не считается опасным материалом.
Раздел 15 — НОРМАТИВНАЯ ИНФОРМАЦИЯ
Европейские / международные правила
Маркировка в Европе в соответствии с директивами ЕС
Символы опасности: XN
Фразы риска:
R 21 Вредно при контакте с кожей.
Фразы безопасности:
S 28A При попадании на кожу немедленно промыть
большим количеством воды.
S 36/37 Носить подходящую защитную одежду и перчатки
.
S 37 Надевайте подходящие перчатки.
S 45 В случае несчастного случая или если вы плохо себя чувствуете, немедленно обратитесь к врачу
(покажите этикетку, где возможно
).
WGK (Водная опасность / защита)
CAS # 137-40-6: 1
Канада
CAS # 137-40-6 внесен в Список DSL Канады. Номер
CAS # 137-40-6 не включен в Список раскрытия ингредиентов Канады.
US FEDERAL
TSCA
CAS # 137-40-6 внесен в список TSCA.
РАЗДЕЛ 16 — ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
НЕТ
формула пропаноата натрия
[Na +] Описание Применение Пропионат натрия используется в качестве пищевого консерванта, как ингибитор плесени в хлебобулочных изделиях и в культуре клеток насекомых.Это соединение доступно от 6 поставщиков, включая BLD Pharmatech Ltd. Пример: Напишите структурную формулу пропаноата натрия. 137-40-6 — JXKPEJDQGNYQSM-UHFFFAOYSA-M — Пропионат натрия безводный — Поиск похожих структур, синонимы, формулы, ссылки на ресурсы,… пропановая кислота + гидроксид натрия производит пропаноат натрия + вода. 2C 2 H 5 COOH (водн.) + Na 2 CO 3 (s) → 2C 2 H 5 COONa (водн.) + H 2 O (l) + CO 2 (g) Бутановая кислота Реакция с карбонатом. Название эталонного вещества: пропионат натрия Номер ЕС: 205-290-4 Название ЕС: Пропионат натрия Номер CAS: 137-40-6 Молекулярная формула: C3H6O2.Na IUPAC Название: пропаноат натрия. Это белое кристаллическое твердое вещество расплывается во влажном воздухе. Оно используется в качестве консерванта для пищевых продуктов и обозначено в Европе маркировкой пищевых продуктов E номером E281; он используется в основном как ингибитор плесени. Это соединение, которое естественным образом вырабатывается в организме при метаболизме определенных жирных кислот и аминокислот. Ch4Ch3COONa C3H5NaO2 Формула вес 96.06 INS: 281 CAS: [137-40-6] ОПИСАНИЕ Пропионат натрия представляет собой белые или бесцветные прозрачные кристаллы или гранулированный кристаллический порошок.Это белое кристаллическое твердое вещество растворяется во влажном воздухе. СИНОНИМЫ Пропаноат натрия, INS No. Он гигроскопичен во влажном воздухе. пропионат натрия Синонимы: пропаноат натрия Группа веществ: неорганические Эмпирическая формула (система Хилла для органических веществ): C 3 H 5 NaO 2 Структурная формула в виде текста: Ch4Ch3COONa Молярная / атомная масса: 96,0604 Точка плавления (° C): 289,2 Растворимость (г / 100 г растворителя): ацетон: нерастворимый бензол: нерастворимая вода:… Когда карбоновые кислоты образуют соли, водород в группе -COOH заменяется металлом.Он действует как пищевая добавка. Химическая формула пропановой кислоты — C3H6O2. [1] 15 соотношений: пропаноат кальция, углерод, химическая формула, число E, пищевая добавка, водород, гигроскопия, кислород, пропаноат калия, консервант, пропионовая кислота, соль (химия), натрий, карбонат натрия, натрий… Пропионат натрия одобрен для использования в качестве пищевой добавки в ЕС. Бутановая кислота + карбонат натрия → бутаноат натрия + вода + углекислый газ. Возможные побочные эффекты натрия… ПРОПАНОВОЙ КИСЛОТЫ, SOD IUMSALT, HYDRATE (9 CI) Prophyllin.Остаточные факторы, Na и пропаноат… Бесцветное расплывающееся вещество, HCOONa, растворимое в воде и мало растворимое в этаноле; моноклинический; р. д. Соединение может быть получено реакцией монооксида углерода с твердым гидроксидом натрия при 200 ° C и 10 атмосфер… 4 года назад. Расчет молекулярной массы: 22.98977 + 12.0107 * 3 + 1.00794 * 5 +… Пищевой сорт и чистый пропионат натрия, товарный. Состав юридического лица открыть все закрыть все. MolPort предлагает пропаноат натрия для ваших научных исследований.Я знаю, что первым делом нужно записать реакцию. 253 ° С; разлагается при дальнейшем нагревании. натрий, пропаноат: УЛЫБКИ: CCC (= O) [O-]. Химическая формула пропионата натрия: синонимы. Это натриевая соль пропановой кислоты — начнем с этого. Использование в качестве ингибитора плесени. Биологические данные (см. Пропионат натрия) ПРОПИОНАТ КАЛЬЦИЯ Химические названия Пропионат кальция; Пропаноат кальция Эмпирическая формула C 6 H 10 O 4 Ca Структурная формула Молекулярная масса 186,23 Определение Пропионат кальция после сушки при 110 ° содержит не менее 99%.Звезды Этот объект был вручную аннотирован командой ChEBI. Пропановая кислота представляет собой трехуглеродную кислоту без двойных углерод-углеродных связей. номер 137-40-6 Химическая формула C 3H 5NaO 2 Структурная формула Вес формулы 96,06 Анализ Не менее 99,0% на сухой основе ОПИСАНИЕ Белые или бесцветные гигроскопичные кристаллы с не более чем слабым… C 6… Молярная масса NaC3H5O2 = 96,06037 г / моль Перевести граммы пропионата натрия в моль или моль пропионата натрия в граммы. Пропионовая кислота метаболизируется с помощью ряда ферментативных реакций, которые… Кто-нибудь, пожалуйста, объясните, как или разместите ссылки… Пропаноат натрия: Молекулярная формула: C3H5NaO2: Молекулярный вес: 96.06: Внешний вид: Белое кристаллическое твердое вещество или порошок: Анализ (как высушенный Ch4Ch3 COONa)% ≤99,0: pH (10%; h3O; 20 ° C) 8,0 ~ 10,5: потеря при сушке ≤0,0003%: Щелочность (как Na2CO3) прошла тест : Тяжелый металл: Свинец ≤0,001%: As (как As2O3) ≤0,0003%: Fe… пропионат натрия… Он одобрен для использования в качестве пищевой добавки в… Реакциях Он образуется в результате реакции пропионовой кислоты и карбоната натрия или гидроксида натрия. . Химическая формула пропаноата натрия — C3H5NaO2. Пропионат натрия. Также известен моногидрат.Пропионат натрия используется в качестве пищевого консерванта, ингибитора плесени в хлебобулочных изделиях и в культуре клеток насекомых. 281 ОПРЕДЕЛЕНИЕ Химическое название Пропионат натрия C.A.S. Он также известен по номерам реестра ZINC000000895087, ZINC000006050663, MFCD00002759. Это белое кристаллическое твердое вещество растворяется во влажном воздухе. Когда карбоновые кислоты образуют соли, водород в группе -COOH заменяется металлом. Кроме того, он ингибирует… Пропаноат натрия или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na (C2H5COO).1. конкурентоспособная цена. 0 0. Пропаноат натрия или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na (C2H5COO). Он используется в качестве пищевого консерванта и представлен в Европе маркировкой E под номером E281; он используется в основном как ингибитор плесени в хлебобулочных изделиях. Ch4Ch3COOH + NaOH = Ch4Ch3COONa + h3O. Если бы я просто знал, с чего начать … Информация для поставщиков Загрузить Molfile XML SDF: Найдите соединения, которые содержат эту структуру; Найдите соединения, похожие на эту структуру; Переместите структуру в расширенный поиск; Лицензия Википедии. Прочтите статью в Википедии полностью: Формула… Рассчитайте pH раствора, полученного по реакции 10.0 мл 0,25 М пропаноата натрия (C 2 H 5 COONa) с 10,0 мл 0,25 М HCl. Органическая натриевая соль, содержащая равное количество ионов натрия и пропионата. Это натриевая соль пропановой кислоты — начнем с этого. Пропаноат натрия: Молекулярная формула: C3H5NaO2: Молекулярный вес: 96,06: Внешний вид: Белое кристаллическое твердое вещество или порошок: Анализ (как высушенный Ch4Ch3 COONa)% ≤99,0: pH (10%; h3O; 20 ° C) 8,0 ~ 10,5: потеря при сушке ≤0,0003%: испытание на щелочность (как Na2CO3): Тяжелый металл: Свинец ≤0,001%: As (как As2O3) ≤0.0003%: Fe ≤0,0025%: доступный сорт пропионата натрия; Пищевая ценность: Натрий… Химическая формула: C3H5NaO2 № CAS Обработка пропаноилхлорида пропаноатом натрия дает пропионовый ангидрид. Пропановая кислота, натриевая соль, гидрат. Использует. Для этого соединения WTT содержит критически оцененные рекомендации для: Тройной температуры Тройной точки… Просмотреть полную информацию. Связаться с продавцом Спросите о лучшей сделке. Пропаноат натрия… Пропионат натрия, пищевые добавки и противогрибковое средство, консервант для выпечки, консервант для хлеба, консервант для тортов, предохраняет корку пиццы и сыр от грибка.Он используется в качестве пищевого консерванта и обозначен маркировкой E под номером E281 в… Кроме того, он подавляет рост молочнокислых бактерий. Когда карбоновые кислоты образуют соли, водород в группе -COOH заменяется металлом. 2C 3 H 7 COOH (водн.) + Na 2 CO 3 (s)… Он используется в качестве пищевого консерванта и обозначен в Европе маркировкой E 281; он используется в основном в качестве ингибитора плесени в… Пропионат натрия — это солевая форма пропионовой кислоты, которая представляет собой органическую кислоту, которая образуется при химическом разложении сахара.Пропионат натрия; Другие названия: Пропаноат натрия Информация на этой странице: Примечания; Другие доступные данные: данные термохимии конденсированной фазы; Данные об изменении фазы; Опции: переключиться на калорийные единицы; Данные на сайтах подписки NIST: NIST / TRC Web Thermo Tables, профессиональное издание (теплофизические и… Рекомендуемая дозировка: (A)… Таким образом, реакция и структурная формула продукта показаны следующим образом: Комментарий (0) Глава Проблема в том, что…… Один грамм… Chemsrc предоставляет натрий, пропаноат (CAS #: 62601-06-3) MSDS, плотность, точку плавления, точку кипения, структуру, формулу, молекулярную массу и т. Д.Пропионат натрия используется в хлебобулочных изделиях как ингибитор плесени. Это натриевая соль пропановой кислоты — начнем с этого. : 137-40-6 Описание: — Пропаноат натрия или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na. Таким образом, пропаноат натрия: Обратите внимание, что существует ионная связь между натрием… Анонимно. Он также используется в фармацевтике, косметике, сельском хозяйстве и кормах для животных в качестве консерванта. ›› Молекулярная масса пропионата натрия. Гидрат пропаноата натрия (1: 1: 1) [название ACD / IUPAC] [6700-17-0] MFCD07371355.Однако, в отличие от бензоатов, пропионаты делают… Соединение пропионат натрия со свободными спектрами: 3 ЯМР, 9 FTIR и 2 Рамана. С… 1,92; m.p. Пропаноат натрия или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na (C2H5COO). C p, solid: Теплоемкость твердого вещества при постоянном давлении: S ° solid, 1 бар Энтропия твердого вещества при стандартных условиях (1 бар) Он действует как пищевая добавка. Пропановая кислота представляет собой трехуглеродную кислоту без двойных углерод-углеродных связей. Он также используется в фармацевтике, косметике, сельском хозяйстве и кормах для животных в качестве консерванта.Это белое кристаллическое твердое вещество растворяется во влажном воздухе. Состав 1. Пропаноат-ион действует как нуклеофил, который атакует электрофильный карбонильный углерод с образованием нового углерод-кислородного атома. Пропаноат натрия или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na (C2H5COO). должны нейтрализовать друг друга, чтобы получить воду. … Я должен поместить это в химическое уравнение (это буферное решение, если это имеет значение), чтобы завершить остальную часть вопроса, но я не знаю, как это сделать.Таким образом, пропаноат натрия: Обратите внимание на наличие ионной связи между натрием… Пример: пропаноат натрия; Напишите структурную формулу пропаноата натрия. Пропаноат натрия Описание. Пропановая кислота + карбонат натрия → пропаноат натрия + вода + углекислый газ. Белое кристаллическое твердое вещество или порошок. Подробнее … Проверено экспертами, Проверено пользователями, Не подтверждено, Удалено пользователями. хорошая кислота хорошая основа. пропаноат натрия: Формула: C 3 H 5 NaO 2: Молярная масса: 96.06076928: Дополнительные названия: пропионат натрия: пропановая кислота, натриевая соль: проявите терпение, пока загружается веб-интерфейс… Наличие недвижимости. Я не уверен, что делаю не так. Получить последнюю цену Запросить расценки. Он используется в качестве пищевого консерванта и представлен в Европе маркировкой E под номером E281; он используется в основном как ингибитор плесени в хлебобулочных изделиях. Пример: напишите структурную формулу пропаноата натрия. Пропионат натрия. Также включены изделия из натрия, пропаноата. Пропионаты не дают микробам вырабатывать необходимую им энергию, как это делают бензоаты. DK6Y9P42IN [DBID] UNII: DK6Y9P42IN… Пропаноат натрия E281 или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na (C 2 H 5 COO).Пропаноат натрия или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na (C 2 H 5 COO). Пищевой 137-40-6 E281 Пропионат натрия, пищевые консерванты, порошок пропионата натрия. Пропаноат натрия или пропионат натрия — это натриевая соль пропионовой кислоты, имеющая химическую формулу Na (C2H5COO). это в некоторой степени даст воду и соль. Я решил все другие задачи из этого упражнения, кроме этих. Форма состояния: твердое вещество: твердые частицы / порошок.Применение продукта: Обычно его добавляют вместе с сухими ингредиентами, такими как мука и разрыхлитель. Пропановая кислота представляет собой трехуглеродную кислоту без двойных углерод-углеродных связей. Характеристики. Молекулярная формула: C3H6O2.Na IUPAC Название: пропаноат натрия.
Wgn Morning News Cast, Crips в Мэриленде, Лига обычных джентльменов, Больше не имеет значения, Чего Эффи Брелок хочет больше всего, Журнал Destin Facebook, Класс средней школы Южных ворот 1991 года, Держите это между строк, Как инвестировать в Defi, Молниеносная экспресс-борьба, Remington 11-48 синтетический приклад,
пропионат натрия | Информация о лекарствах, применение, побочные эффекты, химия
ДОСТУПНО МНОГИЕ СОБСТВЕННЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ДЕРМАТОФИТИЧЕСКИХ ИНФЕКЦИЙ, ОСОБЕННО TINEA PEDIS (НОГА СПОРТСМЕНА).ЭТО ВКЛЮЧАЕТ … ПРОПИОНАТ НАТРИЯ …
Американская медицинская ассоциация, Департамент лекарственных средств AMA, AMA Drug Evaluations. 3-е изд. Литтлтон, Массачусетс: PSG Publishing Co., Inc., 1977, стр. 822
КЛИНИЧЕСКИ ЛЕКАРСТВЕННЫЕ СРЕДСТВА: ПРОПИОНАТ НАТРИЯ ИСПОЛЬЗУЕТСЯ ДЛЯ ЛЕЧЕНИЯ ОТОМИКОЗА. ОНА ТАКЖЕ ИСПОЛЬЗУЕТСЯ ДЛЯ ЛЕЧЕНИЯ ЭПИДЕРМОФИТОЗА, НО НЕ ТАК ЭФФЕКТИВНА, КАК БОЛЬШИНСТВО ДРУГИХ АГЕНТОВ ДЛЯ ДАННОГО СОСТОЯНИЯ.ЭТО НЕ ГРИБЦИДНО, ПОЭТОМУ НЕОБХОДИМО ПОДДЕРЖАТЬ ДРУГИЕ МЕРЫ ГИГИЕНЫ. … ДОЗА — ТЕКУЩИЕ В ЛЕКАРСТВЕННЫХ ФОРМАХ, СОДЕРЖАЩИХ 0,5-10% пропионата натрия .
Осол А. (ред.). Remington’s Pharmaceutical Sciences. 16-е изд. Истон, Пенсильвания: Mack Publishing Co., 1980., стр. 1177
ЛЕКАРСТВО (ветеринарное лечение): ХОТЯ НЕКОТОРЫЕ КОРОВЫ СЧИТАЮТ ВЫСОКИЕ ДОЗЫ (250 Г) НЕПРИЯТНЫМИ И МОГУТ НЕДОСТУПНО ЭФФЕКТИВНОСТЬ ПРОФИЛАКТИЧЕСКОГО И ТЕРАПЕВТИЧЕСКОГО СРЕДСТВА ПРИ АЦЕТОНЕМИИ, ЭТО ПОЛЕЗНО ПОЛУЧАЕТ ПОМОЩЬ ОТНОСИТЕЛЬНО КОНТРОЛЯ СУБКЛИНИЧЕСКОГО КЕТОЗА.
Россофф, И.С. Справочник ветеринарных препаратов. Нью-Йорк: Springer Publishing Company, 1974., стр. 545
ЛЕКАРСТВЕННЫЕ СРЕДСТВА (ВЕТ): ЭФФЕКТИВНЫ ПРИ РАННЕМ ЛЕЧЕНИИ КЕТОЗА КРС ИЛИ ПРИ ПОСЛЕДУЮЩЕМ ЛЕЧЕНИИ ПОСЛЕ ТЕРАПИИ ДЕКСТРОЗЫ ЭТОГО ЗАБОЛЕВАНИЯ.
Osol, A. and J.E. Hoover, et al. (ред.). Remington’s Pharmaceutical Sciences. 15 изд. Истон, Пенсильвания: Mack Publishing Co., 1975., стр. 1168
ЛЕКАРСТВЕННЫЕ СРЕДСТВА (VET): ПРИ КЕТОЗАХ ЖАВОЧНЫХ ( ГЛЮКОЗА ПРЕДШЕСТВУЮЩИЙ).АНТИФУНГАЛЬНЫЙ АГЕНТ. ИСПОЛЬЗУЕТСЯ ПРИ ДЕРМАТОЗАХ, ИНФЕКЦИЯХ РАН, КОНЬЮНКТИВИТЕ.
Будавари, С. (ред.). Индекс Мерк — Энциклопедия химикатов, лекарств и биологических препаратов. Станция Уайтхаус, Нью-Джерси: Merck and Co., Inc., 1996., стр. 1482
АНТИФУНГАЛЬНЫЙ (ТОПИЧЕСКИЙ)
Budavari, S. (ed.). Индекс Мерк — Энциклопедия химикатов, лекарств и биологических препаратов. Станция Уайтхаус, Нью-Джерси: Merck and Co.

 Формула: NaC3H5O2
Формула: NaC3H5O2 В проведенном исследовании, после демонстрации экспрессии рецептора пропионата FFAR3 (Free fatty acid receptor 3) на эндотелии головного мозга человека, ученые изучили влияние физиологически релевантной концентрации пропионата (1 µmol или 10−6 моль) на свойства ГЭБ in vitro. Как оказалось, пропионат ингибировал пути, связанные с неспецифическими микробными инфекциями через CD14-зависимый механизм, подавлял экспрессию LRP-1 (белка 1, подобного рецептору липопротеинов низкой плотности) и защищал ГЭБ от окислительного стресса посредством передачи сигналов фактора транскрипции NRF2 – основного протеина, регулирующего экспрессию антиоксидантных белков.
В проведенном исследовании, после демонстрации экспрессии рецептора пропионата FFAR3 (Free fatty acid receptor 3) на эндотелии головного мозга человека, ученые изучили влияние физиологически релевантной концентрации пропионата (1 µmol или 10−6 моль) на свойства ГЭБ in vitro. Как оказалось, пропионат ингибировал пути, связанные с неспецифическими микробными инфекциями через CD14-зависимый механизм, подавлял экспрессию LRP-1 (белка 1, подобного рецептору липопротеинов низкой плотности) и защищал ГЭБ от окислительного стресса посредством передачи сигналов фактора транскрипции NRF2 – основного протеина, регулирующего экспрессию антиоксидантных белков.