Сложные эфиры
– это соединения, содержащие карбоксильную группу, связанную с двумя алкильными радикалами.
Общая формула сложных эфиров такая же, как у карбоновых кислот: CnH2nO2
НОМЕНКЛАТУРА СЛОЖНЫХ ЭФИРОВ. Названия сложных эфиров определяются названиями кислоты и спирта, из которых они образуются.
Формула эфира | Полное название | Другие названия. |
СН3-С-ОСН3 ║ О | метиловый эфир уксусной кислоты | метилацетат уксуснометиловый эфир |
Н-С –ОС2Н5 ║ О | этиловый эфир муравьиной кислоты | этилформиат |
С2Н5 -С–ОС3Н7 ║ О | пропиловый эфир пропановой (пропионовой) кислоты | пропилпропаноат (пропионат) |
ПОЛУЧЕНИЕ СЛОЖНЫХ ЭФИРОВ.
1)Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
2) Сложные эфиры фенолов нельзя получить с помощью этерификации, для их получения используют реакцию фенолята с галогенангидридом кислоты:
С6Н5-О—Na+ + C2H5–C=O NaCl + C6H5–O—C=O
\ \
Cl C2H5
фениловый эфир пропановой кислоты (фенилпропаноат)
Виды изомерии сложных эфиров.
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутаноату изомерны этилизобутаноат, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия с карбоновыми кислотами.
СВОЙСТВА СЛОЖНЫХ ЭФИРОВ.
1. Гидролиз сложных эфиров.
Реакция этерификации обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Кислотный гидролиз обратим:
Щелочной гидролиз протекает необратимо:
Эта реакция называется омылением сложного эфира.
2. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
studfiles.net
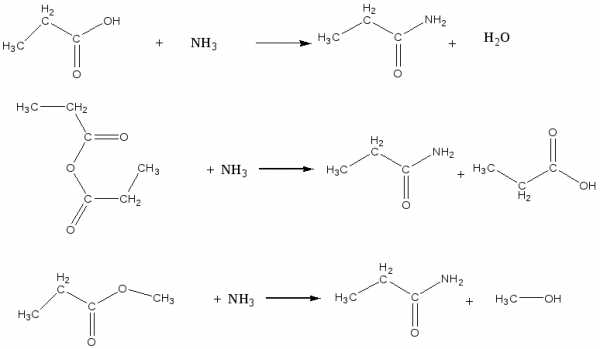
— Полный этиловый эфир бутандиовой кислоты из бутандиовой кислоты
— полный амид бутандиовой кислоты из полного метилового эфира той же кислоты
— метилацетат из соответствующей карбоновой кислоты и ангидрида
— ацетамид из соответствующих функциональных производных: сложного эфира и ангидрида
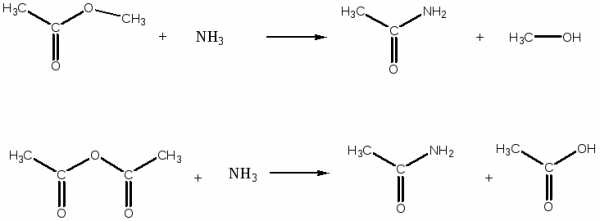
— метилацетат по реакции этерификации
— сложный эфир из бутановой кислоты и этилового спирта
— пропанамид из различных ацилирующих агентов: кислоты, ангидрида, сложного эфира
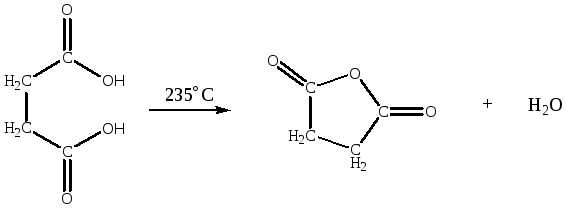
— ангидриды бутановой и бутандиовой кислот из соответствующих кислот
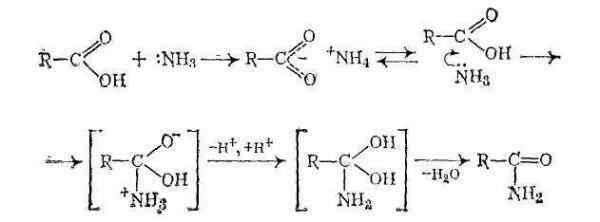
Механизмы реакций:
При нагревании сухих аммониевых солей карбоновых кислот происходит их разложение на исходные вещества, после чего аммиак нуклеофильно атакует атом углерода карбонильной группы:
В отсутствие катализаторов реакция этерификации протекает очень медленно, поскольку на атакуемом атоме углерода карбоксильной группы дефицит электронной плотности невелик из-за +М-эффекта группы ОН. Поэтому реакцию этерификации проводят в присутствии катализаторов — минеральных кислот (H2SO4, газообразныйHCl, фосфорная кислота) Эти вещества протонируют атом кислорода карбонильной группы и тем самым увеличивают частичный положительный заряд на атакуемом атоме углерода.
Реакции свободных карбоновых кислот не могут катализироваться основаниями, так как образуются карбоксилат-анионы, не обладающие карбонильной активностью.
Роль катализаторов в реакции этерификации играют ионы водорода.
Механизм реакции можно представить следующим образом:
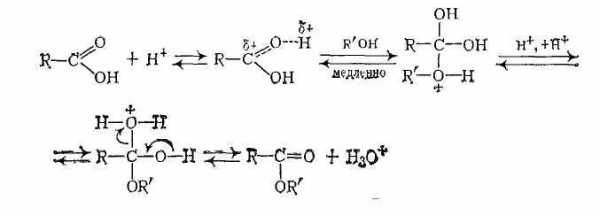
Обычно реализуется тетраэдрический механизм AAC2.
Общие схемы механизмов.
Превращения производных карбоновых кислот могут быть изображены в соответствии с общими схемами следующим образом:
Катализируемые кислотами реакции проходят через аналогичные промежуточные продукты:
Для заместителей с большой основностью (X=Nh3, ОН, OR) сначала происходит протонирование соединения II, а затем отщепление НХ с образованием карбений-оксониевого иона:
9.Напишите уравнения реакций гидролиза:
— метилацетата
— этилового эфира пропановой кислоты
— N-метиламида уксусной кислоты
— метилбутаноата
Опишите механизмы реакций. В какой среде они протекают?
Решение
— Метилацетат
— Этиловый эфир пропановой кислоты
— N-метиламид уксусной кислоты
— Метилбутаноат
Все реакции могут протекать как в кислой, так и в щелочной среде.
Механизм гидролиза сложных эфиров при кислотном катализе:
Механизм гидролиза (омыления) сложных эфиров при основном катализе:
Реакция протекает необратимо, так как образуется соль кислоты.
Механизм гидролиза амидов карбоновых кислот, аналогичен механизмам гидролиза сложных эфиров.
Реакции гидролиза амидов, катализируемые как кислотами, так и основаниями, по существу, необратимы, так как в обоих случаях образуются соли. В случае основного катализа осуществляется механизм ВАС2.
10. Напишите уравнения следующих окислительно-восстановительных реакций:
— окисление пропанола-2
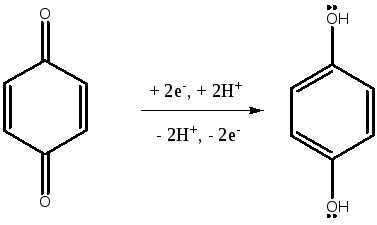
— ОВР в системе гидрохинон — хинон
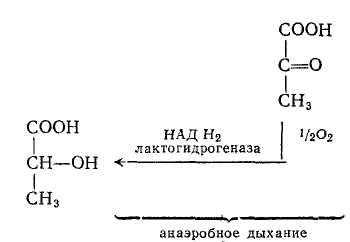
— ОВР в системе молочная кислота — пировиноградная кислота
— окисление этанола
— окисление бутанола
— восстановление бутанола
— ОВР в системе цистеин — цистин
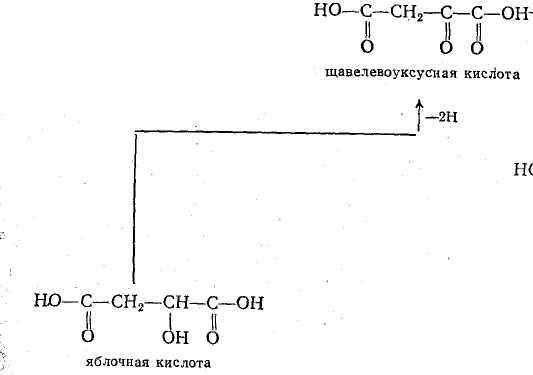
— ОВР в системе яблочная кислота — щавелевая кислота
— восстановление бутендиовой кислоты
— йодоформная проба для ацетона, ацетальдегида, бутанола
какой кофермент принимает участие в ОВР в организме? В чём заключается принцип его действия.
Решение
— окисление пропанола-2
— ОВР в системе гидрохинон — хинон
— ОВР в системе молочная кислота — пировиноградная кислота
При анаэробном дыхании протекает восстановление пировиноградной кислоты в молочную.
— окисление этанола
— восстановление бутанола
— ОВР в системе цистеин — цистин
— ОВР в системе яблочная кислота — щавелевая кислота
Протекает в организмах.
— восстановление бутендиовой кислоты
— йодоформная проба для ацетона, ацетальдегида, бутанола?
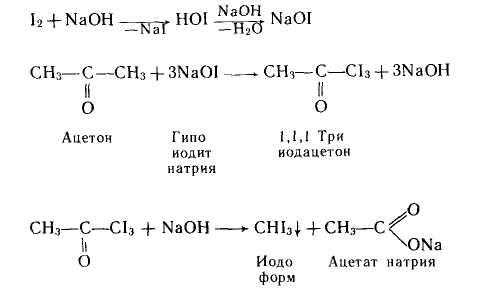
Аналогично реагирует ацетальдегид.
КОФЕРМЕНТЫ орг. прир. соед., необходимые для осуществления каталитич. действия ферментов.
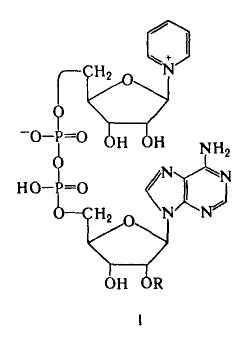
Никотинамидные К. — коферментная форма витамина ниацина. К этой группе К., универсальных по распространению (они найдены буквально во всех живых клетках) и биол. роли, относятся НАД (ф-ла I; R = Н) и никотинамидадениндинуклеотидфосфат, или НАДФ [I; R = РО(ОН)2], а также восстановленные (по пиридиновому кольцу) формы этих соед. (соотв. НАДН и НАДФН). Наиб. важная биохим. ф-ция этих К.-их участие в переносе электронов и водорода от окисляющихся субстратов к кислороду в клеточном дыхании. При участии НАД или НАДФ, связанных прочно или легко диссоциирующих, ферменты дегидрогеназы (напр., алкогольдегидрогеназа, глутаматдегидрогеназа) катализируют обратимое превращ. спиртов, гидроксикислот и нек-рых аминокислот в соответствующие альдегиды, кетоны или кетокислоты.
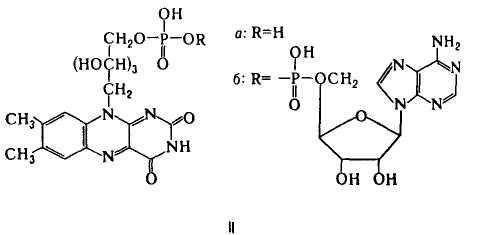
Флавиновые К.-коферментная форма витамина рибофлавина. Среди оксидоредуктаз дыхательной цепи, участвующих в переносе электронов и водорода.
Главная ф-ция флавиновых К. — перенос электронов (водорода) в окислит.-восстановит, цепи от НАДН и янтарной к-ты к цитохромам. Флавопротеиды катализируют также многочисл. р-ции, механизм к-рых включает стадию одноэлектронного переноса; окисление восстановл. формы амида липоевой к-ты, синтез кобамидного кофермента из АТФ и витамина В12, окисление глюкозы и др.
studfiles.net
Пропионовая кислота — Википедия
Материал из Википедии — свободной энциклопедии
Перейти к навигации Перейти к поиску| Пропионовая кислота | |
|---|---|
| Общие | |
| Систематическое наименование | Пропановая кислота |
| Традиционные названия | Пропионовая кислота |
| Хим. формула | C3H6O2 |
| Рац. формула | CH3CH2COOH |
| Физические свойства | |
| Состояние | Бесцветная жидкость |
| Молярная масса | 74,08 г/моль |
| Плотн | |
ru.wikipedia.org
Способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил) пропановой кислоты
Изобретение относится к области синтеза 1,3-дикарбонильных соединений, конкретно к способу получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты формулы:
Способ заключается в ацилировании калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в присутствии безводного растворителя, триэтиламина и хлорида магния с последующей обработкой реакционной массы водным раствором соляной кислоты и выделением целевого продукта, отличающийся тем, что в качестве растворителя используют этилацетат, при этом мольное соотношение 2,6-дихлорникотиноилхлорида: калия 3-оксо-3-этоксипропаноата равно 1:1.4-1.6. Техническим результатом является повышение технологичности синтеза, а также увеличение выхода и чистоты заявляемого соединения.
Изобретение относится к области синтеза 1,3-дикарбонильных соединений, конкретно к способу получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты формулы:
который находит применение как предшественник антибактериальных [Пат. US 3590036, C07D 213/50, C07D 213/61, C07D 213/64, C07D 213/73, C07D 213/74, C07D 213/77, C07D 213/85, C07D 471/04, C07D 213/00, C07D 471/00, (IPC1-7): C07D 39/10. Naphthyridine-3-carboxylic acids, their derivatives and preparation thereof/ Lesher G.Y., Gruett D. — 1971] и противоопухолевых производных 1,8-нафтиридина [Yasunori T. Synthesis and Structure-Activity Relationships of Novel 7-Substituted 1,4-Dihydro-4-oxo-1-(2-thiazolyl)-1,8-naphthyridine-3-carboxylic Acids as Antitumor Agents. Part 2 [Text] / T. Yasunori, T. Kyoji, S. Koh-ichiro et.al. // J. Med. Chem. — 2004. — Vol. 47. — P. 2097-2109].
Известен способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты путем взаимодействия калия 3-оксо-3-этоксипропаноата с 1-(2,6-дихлорникотиноил)-1H-имидазолом [Yasunori Т. Synthesis and Structure-Activity Relationships of Novel 7-Substituted 1,4-Dihydro-4-oxo-1-(2-thiazolyl)-1,8-naphthyridine-3-carboxylic Acids as Antitumor Agents. Part 2 [Text] / T. Yasunori, T. Kyoji, S. Koh-ichiro et.al. // J. Med. Chem. — 2004. — Vol.47. — P.2097-2109].
Этот способ реализуется путем последовательной обработки 2,6-дихлорникотиновой кислоты N,N’-карбонилдиимидазолом в смеси абсолютных ацетонитрила и тетрагидрофурана с образованием 1-(2,6-дихлорникотиноил)-1H-имидазола. Параллельно к суспензии калия 2-оксо-3-этоксипропаноата в абсолютном ацетонитриле при охлаждении льдом прибавляется безводный хлорид магния и триэтиламин и полученная смесь перемешивается 5 часов. После этого к реакционной массе прибавляется приготовленный, как описано выше, раствор 1-(2,6-дихлорникотиноил)-1H-имидазола в смеси абсолютного тетрагидрофурана и ацетонитрила. Реакционная масса перемешивается 15 часов. В ходе подкисления реакционной массы разбавленной соляной кислотой, последующей экстрактивной обработки этилацетатом получают технический продукт с выходом 93%. Дополнительная очистка полученного продукта достигается путем перегонки при пониженном давлении.
Этот способ характеризуется целым рядом существенных недостатков. Во-первых, для его реализации необходимо использование 1-(2,6-дихлорникотиноил)-1H-имидазола — дорогостоящего ацилирующего агента, получаемого in situ из 2,6-дихлорникотиновой кислоты и N,N’-карбонилдиимидазола. Во-вторых, синтез проводится в смеси безводных ацетонитрила и тетрагидрофурана, а экстрактивная обработка выполняется с применением этилацетата. В результате используются три различных органических растворителя, образующие смесь, не подлежащую регенерации. В-третьих, при проведении синтеза происходит побочное образование имидазола, который также не регенерируется.
Наиболее близким является способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты путем обработки калия 3-оксо-3-этоксипропаноата полученным in situ 2,6-дихлорникотиноилхлоридом (из 2,6-дихлорникотиновой кислоты и оксалилхлорида в дихлорметане) в присутствии хлорида магния и триэтиламина в безводном ацетонитриле [WO 2008/060693, 22.05.2008]. После отгонки растворителя реакционная масса разбавляется этилацетатом и обрабатывается соляной кислотой. Органическая фаза отделяется, промывается насыщенным раствором хлорида натрия, осушается сульфатом натрия и фильтруется. После отгонки растворителя в вакууме получается технический продукт с выходом 83%, который дополнительно очищается перекристаллизацией из смеси метанола и воды с образованием целевого вещества. Чистота получаемого вещества составляет 95%, а выход — 74%. Абсолютно идентичный способ описан также в другом литературном источнике [WO 2006/034113, 30.03.2006].
Предложенный метод обладает рядом существенных недостатков, снижающих его препаративную ценность.
Во-первых, для получения хлорангидрида 2,6-дихлорникотиновой кислоты используется дорогостоящий хлорирующий агент — оксалилхлорид. Во-вторых, в синтезе используется технический хлорангидрид без дополнительной очистки, что привносит в реакционную массу дополнительные примеси с предыдущей технологической стадии.
Во-вторых, для проведения синтеза используется ацетонитрил — токсичный растворитель, который неограниченно смешивается с водой. В связи с этим возникает необходимость предварительной отгонки растворителя от реакционной смеси в вакууме перед обработкой соляной кислотой. Это усложняет процесс выделения целевого вещества и делает его менее технологичным.
В-третьих, получаемый технический продукт требует дополнительной очистки, что еще более усложняет процесс его получения и приводит к снижению выхода.
Задачей предлагаемого технического решения является разработка нового технологичного способа получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты, позволяющего проводить синтез в мягких условиях с использованием доступных реагентов и получением целевого продукта с высокими выходом и степенью чистоты.
Техническим результатом является повышение технологичности синтеза, а также увеличение выхода и чистоты заявляемого соединения.
Предлагаемый технический результат достигается в способе получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты общей формулы:
заключающийся в ацилировании калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в присутствии безводного растворителя, триэтиламина и хлорида магния, с последующей обработкой реакционной массы водным раствором соляной кислоты и выделением целевого продукта, при этом в качестве растворителя используют этилацетат, при мольном соотношении 2,6-дихлорникотиноилхлорида:калия 3-оксо-3-этоксипропаноата, равном 1:1.4-1.6.
Сущностью предлагаемого способа является ацилирование калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в среде безводного этилацетата и кислотный гидролиз/декарбоксилирование полученного интермедиата синтеза:
Преимуществом данного способа является возможность получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты с выходом, близким к количественному, не требующего дополнительной очистки. Кроме этого при проведении синтеза используется доступный ацилирующий агент — 2,6-дихлорникотиноилхлорид, а синтез проводится в этилацетате. Таким образом, растворитель после синтеза и экстракции удается практически полностью регенерировать, а также избежать использования дорогостоящего 1-(2,6-дихлорникотиноил)-1H-имидазола и N,N’-карбонилдиимидазола.
Предлагаемый способ осуществляется следующим образом.
Получение этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
К взвеси калия 3-оксо-3-этоксипропаноата в безводном этилацетате прибавляют безводный триэтиламин, охлаждают полученную смесь до 0°С и при перемешивании прибавляют к ней безводный хлорид магния. Реакционную массу перемешивают еще 15 мин при охлаждении и продолжают перемешивание при температуре 35-45°С 6 ч. После этого охлаждают полученную суспензию до -8°С. К охлажденной смеси при перемешивании в течение 15 минут прибавляют раствор свежеперегнанного 2,6-дихлорникотиноилхлорида в безводном этилацетате. Полученную смесь перемешивают еще 1 час при охлаждении, а затем еще сутки при комнатной температуре, после чего вновь охлаждают до -8°С. К охлажденной смеси медленно приливают 12%-ный водный раствор соляной кислоты, перемешивают еще 30 минут, отделяют органическую фазу, а водную извлекают этилацетатом. Объединенные органические вытяжки промывают водой до нейтральной среды, сушат безводным сульфатом магния, фильтруют через тонкий слой силикагеля для ТСХ и удаляют растворитель на водяной бане при пониженном давлении. В остатке получают чистый этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты в виде вязкого масла янтарного цвета.
Изобретение иллюстрируется следующими примерами.
Пример 1. Этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
К взвеси 13.6 г (0.08 моль) калия 3-оксо-3-этоксипропаноата в безводном этилацетате (125 мл) прибавляют безводный триэтиламин (28 мл, 20.3 г, 0.20 моль), охлаждают полученную смесь до 0°С и при перемешивании прибавляют к ней безводный хлорид магния (9.1 г, 0.096 моль). Реакционную массу перемешивают еще 15 мин при охлаждении и продолжают перемешивание при температуре 35-45°С 6 ч. После этого охлаждают полученную суспензию до -8°С. К охлажденной смеси при перемешивании в течение 15 минут прибавляют раствор свежеперегнанного 2,6-дихлорникотиноилхлорида (12 г, 57 ммоль) в безводном этилацетате (50 мл). Полученную смесь перемешивают еще 1 час при охлаждении, а затем еще сутки при комнатной температуре, после чего вновь охлаждают до -8°С. К охлажденной смеси медленно приливают 12%-ный водный раствор соляной кислоты (150 мл), перемешивают еще 30 минут, отделяют органическую фазу, а водную извлекают этилацетатом (3*75 мл). Объединенные органические вытяжки промывают водой до нейтральной среды, сушат безводным сульфатом магния, фильтруют через тонкий слой силикагеля для ТСХ и удаляют растворитель на водяной бане при пониженном давлении. В остатке получают чистый этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты в виде вязкого масла янтарного цвета.
Выход — 14.6 г (98%). Rf=0.79 (пластины NanoSILGUR 20/UV254, элюент — хлороформ — этилацетат (4:1, по объему)). Содержание основного вещества (по ВЭЖХ) — 97.1%.
1H-ЯМР-спектр (300 MГц, СDСl3) δ, м.д, 12.55 — 12.39 (м, 1 Н, ОН (енол)), 7.97-7.81 (м, 1 Н, С4H (ароматический)), 7.38-7.21 (м, 1 Н, С5H (ароматический)), 5.74-5.59 (м, 1 Н, СН (енол)), 4.25-4.09 (м, 2 Н, СН2СН3), 4.05-3.99 (м, 1 Н, СН2 (кето-форма)), 1.32-1.15 (м, 3 Н, CH2СН3).
Соотношения исходных реагентов: 2,6-дихлорникотиноилхлорид: калия 3-оксо-3-этоксипропаноат составляют 1:1.4.
Пример 2. Этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
Выполняют аналогично примеру 1 за исключением соотношения исходных реагентов: 2,6-дихлорникотиноилхлорид: калия 3-оксо-3-этоксипропаноат составляют 1:1.5.
Выход этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты — 96%.
Пример 3. Этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
Выполняют аналогично примеру 1 за исключением соотношения исходных реагентов: 2,6-дихлорникотиноилхлорид: калия 3-оксо-3-этоксипропаноат составляют 1:1.6.
Выход этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты — 94%.
Как следует из представленных примеров, предложенный способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты является технологичным, позволяет получать целевой продукт в мягких условиях с использованием доступных реагентов с высокими выходом и степенью чистоты.
Способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты общей формулы
заключающийся в ацилировании калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в присутствии безводного растворителя, триэтиламина и хлорида магния, с последующей обработкой реакционной массы водным раствором соляной кислоты и выделением целевого продукта, отличающийся тем, что в качестве растворителя используют этилацетат, при этом мольное соотношение 2,6-дихлорникотиноилхлорида:калия 3-оксо-3-этоксипропаноата равно 1:1.4-1.6.
www.findpatent.ru
