Пропановая кислота — это… Что такое Пропановая кислота?
Пропионовая кислота (пропановая кислота, метилуксуcная кислота, консервант E280) — бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos» — первый, «pion» — жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот.
Физические и химические свойства
Температура самовоспламенения 440 °C.
Смешивается с водой и органическими растворителями.
По химическим свойствам — типичный представитель насыщеных карбоновых кислот; образует эфиры, амиды, галогенангидриды и т. д.
История
Пропионовая кислота впервые была описана в 1844 году Йоханом Готлибом (Johann Gottlieb), который нашёл ее среди продуктов разложения сахара. В течение следующих нескольких лет, другие химики получали пропионовую кислоту различными способами, не осознавая, что они получали одно и тоже вещество. В 1847 году, французский химик Жан-Батист Дюма (Jean-Baptiste Dumas) установил, что полученные кислоты были одним и тем же веществом, которое он назвал пропионовой кислотой.
Получение
В природе пропионовая кислота найдена в нефти, образуется при брожении углеводов. В промышленности её получают карбонилированием этилена по реакции Реппе; каталитическим окислением пропионового альдегида в присутствии кобальта или ионов марганца; как побочный продукт при парофазном окислении углеводородов C4 − C10. Большое количество пропионовой кислоты раньше получали как побочный продукт при производстве уксусной кислоты, но современные способы получения уксусной кислоты сделали этот метод второстепенным источником пропионовой кислоты.
Пропионовую кислоту также получают биологически при метаболическом разложении жирных кислот, содержащих нечётное число атомов углерода, и при разложении некоторых аминокислот. Бактерии рода Propionibacterium производят пропионовую кислоту, как конечный продукт своего анаэробного метаболизма. Эти бактерии часто встречаются в желудке жвачных животных, и, отчасти, из-за их деятельности швейцарский сыр имеет свой аромат.
Производные
Пропионаты — соли и эфиры пропионовой кислоты. Щёлочные и щёлочноземельные соли пропионовой кислоты хорошо растворимы в воде и не растворимы в органических растворителях. Эфиры пропионовой кислоты плохо растворимы в воде, смешиваются с органическими растворителями.
Применение
Пропионовая кислота и ее производные применяют в производстве гербицидов (пропанол, дихлорпрол), лекарственных средств (ибупрофен, феноболин и др.), душистых веществ (бензил-, фенил-, геранил-, линалоил- пропионаты), пластмасс (например, поливинилпропионата), растворителей (пропил-, бутил-, пентилпропионата и др.), винилпластификаторов и ПАВ (гликолевые эфиры).
Пропионовая кислота препятствуется росту плесени и некоторых бактерий. Поэтому большая часть производимой пропионовой кислоты используется как консервант в продуктах, потребляемых человеком, и в продуктах для животных. В продуктах для животных применяется непосредственно пропионовая кислота, либо ее аммониевая соль (пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебе и в других хлебобулочных изделиях, пропионовая кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
Безопасность
Основная опасность пропионовой кислоты — это химические ожоги, которые могут произойти при контакте с концетрированной кислотой. В исследованиях на лабораторных животных, единственным неблагоприятным эффектом, связанным с долговременным употреблением небольшого количества пропионовой кислоты, было образование язв в пищеводе и желудке из-за разъедающих свойств вещества. При исследованиях не было обнаружено, что пропионовая кислота токсична, мутагенна, канцерогенна или негативно влияет на репродуктивные органы. В организме пропионовая кислота быстро окисляется, метаболизирует и выводится из организма как углекислый газ в цикле Кребса, не накапливаясь в организме.
Литература
- Н. С. Зефиров, Н. Н. Кулов и др. Химическая энциклопедия. Том 4. — Москва: Научное издательство «Большая российская энциклопедия», 1995. с.107-108, ISBN 5-85270-092-4
Wikimedia Foundation. 2010.
Пропионовая кислота, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2
2p64,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Пропионовая кислота — это… Что такое Пропионовая кислота?
Пропио́новая кислота́ (пропановая кислота, метилуксусная кислота, консервант E280) — бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos» — первый, «pion» — жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот. Химическая формула С2Н5-СООН.
Физические и химические свойства
Температура самовоспламенения 440 °C.
Смешивается с водой и органическими растворителями.
По химическим свойствам — типичный представитель насыщеных карбоновых кислот; образует эфиры, амиды, галогенангидриды и т. д.
История
Пропионовая кислота впервые была описана в 1844 году Йоханом Готлибом (Johann Gottlieb), который нашёл ее среди продуктов разложения сахара. В течение следующих нескольких лет, другие химики получали пропионовую кислоту различными способами, не осознавая, что они получали одно и то же вещество. В 1847 году, французский химик Жан-Батист Дюма (Jean-Baptiste Dumas) установил, что полученные кислоты были одним и тем же веществом, которое он назвал пропионовой кислотой.
Получение
В природе пропионовая кислота найдена в нефти, образуется при брожении углеводов. В промышленности её получают карбонилированием этилена по реакции Реппе; каталитическим окислением пропионового альдегида в присутствии кобальта или ионов марганца; как побочный продукт при парофазном окислении углеводородов C4—C10. Большое количество пропионовой кислоты раньше получали как побочный продукт при производстве уксусной кислоты, но современные способы получения уксусной кислоты сделали этот метод второстепенным источником пропионовой кислоты.
Пропионовую кислоту также получают биологически при метаболическом разложении жирных кислот, содержащих нечётное число атомов углерода, и при разложении некоторых аминокислот. Бактерии рода Propionibacterium производят пропионовую кислоту, как конечный продукт своего анаэробного метаболизма. Эти бактерии часто встречаются в желудке жвачных животных, и, отчасти, из-за их деятельности швейцарский сыр имеет свой аромат.
Производные
Пропионаты — соли и эфиры пропионовой кислоты. Щёлочные и щёлочноземельные соли пропионовой кислоты хорошо растворимы в воде и не растворимы в органических растворителях. Эфиры пропионовой кислоты плохо растворимы в воде, смешиваются с органическими растворителями.
Применение
Пропионовая кислота и ее производные применяют в производстве гербицидов (пропанол, дихлорпрол), лекарственных средств (ибупрофен, феноболин и др.), душистых веществ (бензил-, фенил-, геранил-, линалоил- пропионаты), пластмасс (например, поливинилпропионата), растворителей (пропил-, бутил-, пентилпропионата и др.), винилпластификаторов и ПАВ (гликолевые эфиры).
Пропионовая кислота препятствует росту плесени и некоторых бактерий. Поэтому большая часть производимой пропионовой кислоты используется как консервант в продуктах, потребляемых человеком, и в продуктах для животных. В продуктах для животных применяется непосредственно пропионовая кислота, либо её аммониевая соль (пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебе и в других хлебобулочных изделиях, пропионовая кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
Безопасность
Основная опасность пропионовой кислоты — это химические ожоги, которые могут произойти при контакте с концентрированной кислотой. В исследованиях на лабораторных животных, единственным неблагоприятным эффектом, связанным с долговременным употреблением небольшого количества пропионовой кислоты, было образование язв в пищеводе и желудке из-за разъедающих свойств вещества. При исследованиях не было обнаружено, что пропионовая кислота токсична, мутагенна, канцерогенна и негативно влияет на репродуктивные органы. В организме пропионовая кислота быстро окисляется, метаболизирует и выводится из организма как углекислый газ в цикле Кребса, не накапливаясь в организме.
Литература
- Н. С. Зефиров, Н. Н. Кулов и др. Химическая энциклопедия. Том 4. — Москва: Научное издательство «Большая российская энциклопедия», 1995. — с.107—108. — ISBN 5-85270-092-4
Пропионовая кислота — Циклопедия
Пропионовая кислотаПропионовая кислота (Пропановая кислота, Метилуксусная кислота) — одноосновная карбоновая кислота алифатического ряда, бесцветная едкая жидкость с резким запахом, имеющая формулу CH3CH2COOH.
Пропионовая кислота была открыта в 1844 году Йоханом Готлибом.
[править] Физические свойства
Температура плавления = −20,8 °С, Температура кипения = 140,8 °С, температура самовоспламенения = 440 °C, плотность 0,993 г/см3 (20 °С). Молярная масса = 74,08 г/моль.
[править] Химические свойства
Пропионовая кислота смешивается с водой и органическими растворителями.
Соли и эфиры пропионовой кислоты называются пропионатами. Например, пропионат натрия получают следующим образом:
CH3CH2COOH + NaOH → CH3CH2COONa + H2O
Пропионат кальция получают следующим образом:
2CH3CH2COOH + CaO → (CH3CH2COO)2Ca + H2O
Пропионовая кислота, взаимодействуя со спиртами, образует эфир. Например, при реакции с метанолом CH3OH образуется метиловый эфир пропионовой кислоты:
CH3CH2COOH + CH3OH → CH3CH2COOCH3 + H2O
Пропионовая кислота может взаимодействовать с галогенами, при этом происходит замещение в углеводородном радикале. Так, при реакции с хлором образуется α-хлорпропионовая кислота:
CH3CH2COOH + Cl2 → CH3-CHCl-COOH + HCl
Пропионат аммония получают взаимодействием с NH4OH:
CH3CH2COOH + NH4OH → CH3CH2COONH4 + H2O
[править] Практическое применение
В промышленности пропионовую кислоту получают карбонилированием этилена по реакции Реппе; каталитическим окислением пропионового альдегида; как побочный продукт при парофазном окислении углеводородов С4-С10, например:
H2C=CH2 + H2O + CO → CH3CH2CO2H
Пропионовая кислота и её производные применяются в производстве гербицидов (пропанол, дихлорпрол), лекарственных средств (ибупрофен, феноболин и др.), душистых веществ (бензил-, фенил-, геранил-, линалоил- пропионаты), пластмасс (поливинилпропионата и др.), растворителей (пропил-, бутил-, пентилпропионата и др.), винилпластификаторов и поверхностно-активных веществ (гликолевые эфиры).
Пропионовая кислота применяется в пищевой промышленности, так как препятствует росту плесени и патогенных бактерий. Поэтому эта кислота используется как консервант в продуктах, как потребляемых человеком, так и в кормах для животных (в последнем случае применяется пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебобулочных изделиях, данная кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
При работе с пропионовой кислоты необходимо соблюдать осторожность, так как её попадание на тело человека может вызвать химический ожог. При попадании внутрь данная кислота может теоретически вызвать язву желудка.
Пропановая кислота. Физические и химические свойства. Применение, безопасность при работе.
Пропановая кислота (другие названия — метилуксусная кислота, консервант Е280, пропионовая кислота) — это жидкость без цвета с едким неприятным запахом. Имеет следующую химическую формулу: С2Н5-СООН.
Физические свойства пропионовой кислоты:
1. Температура плавления равна -21°.
2. Температура кипения составляет 141°.
3. Температура вспышки равна 54°.
4. Молярная масса равна 74,08 грамм/моль.
5. При стандартных условиях представляет собой бесцветную жидкость.
6. Температура самовоспламенения равна 440°.
Химические свойства пропионовой кислоты:
1. Смешивается с водой (h3O) и органическими растворителями.
2. Пропановая кислота — это типичный представитель карбоновых насыщенных кислот. Может образовывать эфиры, галогенагидриды, амиды и другие вещества.
История открытия пропановой кислоты
Это вещество впервые было описано в 1844 году Готлибом Йоханом, который нашел его среди продуктов разложения сахара. Затем в течение некоторого времени другие ученые-химики получали эту кислоту разными способами, не осознавая при этом, что добывали одно и то же соединение. А в 1847 году Жан-Батист Дюма установил, что полученные ранее вещества были одной и той же кислотой, которую он впоследствии назвал как пропановая кислота, формула которой — С2Н5-СООН.
Какие существуют способы получения пропановой кислоты?
В природе пропановая кислота найдена в нефти.
В промышленности данное вещество получают посредством карбонилирования этилена по реакции Реппе как побочный продукт при окислении углеродов, каталитическим окислением пропанового альдегида в присутствии ионов марганца или кобальта.
Также большое количество метилуксусной кислоты можно получить при производстве кислоты уксусной, однако современные способы получения сделали этот способ второстепенным источником пропановой кислоты.
Данное вещество можно получить при метаболическом разложении аминокислот и жирных кислот, которые содержат нечетное число атомов углерода.
Также пропановую кислоту производят бактерии рода Propionibacterium (как конечный продукт своего метаболизма). Эти бактерии встречаются в пищеварительной системе жвачных животных, и именно из-за их деятельности у швейцарского сыра есть свой неповторимый аромат.
Производные пропионовой кислоты
Это эфиры и соли.
Щёлочноземельные и щёлочные соли хорошо растворяются в воде (h3O), не растворяются в органических растворителях.
Эфиры этого вещества плохо растворимы в (h3O) воде, но смешиваются с органическими растворителями.
Применение
Эта кислота используется в следующих случаях:
— производство гербецидов (например, дихлорпрол, пропанол), лекарственных препаратов (феноболин, ибупрофен), некоторых душистых веществ (линалоил-, фенил-, геранил-, бензил- пропионаты), растворителей (бутил-, пентил-, пропилпропионата), пластмасс (поливинилпропионат), ПАВ (эфиры гликолевые) и винилпластификаторов;
— так как пропановая кислота препятствует росту некоторых бактерий и плесени, то большая ее часть используется в качестве консерванта в продуктах питания как для человека, так и для животных. В продуктах для животных используется непосредственно пропионовая кислота или ее соль (аммония пропионат), а в продуктах, которые производятся для человека, используется кальциевая (кальция пропионат) или натриевая (пропионат натрия) или соли.
Безопасность при работе
Основная опасность при работе с пропионовой кислотой — это химические ожоги различной степени тяжести.
В исследованиях, которые проводились на лабораторных животных, единственным негативным эффектом, связанным с долговременным потреблением небольших доз пропановой кислоты, было появление язвочек в пищеводе и желудке, что обусловлено разъедающими свойствами вещества. В ходе эксперимента не было обнаружено, что пропановая кислота мутагенна, канцерогенна, токсична и плохо влияет на репродуктивные органы. Попадая в организм, рассматриваемое нами вещество быстро окисляется, метаболизируется и затем выводится в виде углекислого газа.
Карбоновые кислоты, подготовка к ЕГЭ по химии
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .

Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы

Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота

Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.

Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.

При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.

При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции щелочи с угарным газом — образуется формиат (соль муравьиной кислоты). В результате добавления раствора серной кислоты к формиату получается муравьиная кислота.

Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.

Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислот + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
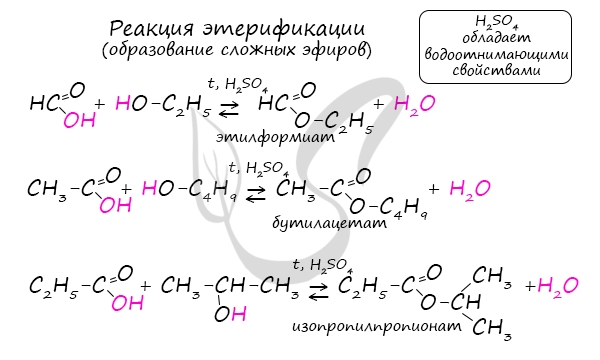
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.

Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.

Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.

Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Карбоновые кислоты | CHEMEGE.RU
| Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН. |
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
По числу карбоксильных групп:
- одноосновные карбоновые кислоты — содержат одну карбоксильную группу -СООН. Общая формула CnH2n+1COOH или CnH2nO2.
| Например, уксусная кислота |

- многоосновные карбоновые кислоты — содержат две и более карбоксильные группы СООН. Например, общая формула двухосновных карбоновых кислот CnH2n(СОOH)2 или CnH2n-2O4.
| Например, щавелевая кислота |

Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.

| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.

Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат | СН3(СН2)7СН=СН(СН2)7СООН
|
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат |  |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат |  |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат |  |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |  |
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота |
| Бутановая (масляная) кислота | Изомасляная (2-метилпропановая) кислота |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и спиртов, и простых эфиров — CnH2nО2.
| Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3 |
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
.
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
| Карбоновые кислоты – кислоты средней силы. В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |

Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |

| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |

| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |

2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |

2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:

При нагревании карбоновые соли аммония разлагаются на амид и воду:

2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

При этом фенол не вступает в реакцию этерификации с карбоновыми кислотами. Сложные эфиры фенола получают косвенными способами.
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |

3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |

4. Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |

4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.

При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):

4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.

4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:

Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:

5.2. Реакции замещения в бензольном кольце
| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |

6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:

6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:

7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:

К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:

7.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:

1. Окисление спиртов, алкенов и алкинов
При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия образуются карбоновые кислоты.
| Например, при окислении этанола в жестких условиях образуется уксусная кислота |

2. Окисление альдегидов
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота. |

| Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты |

3. Щелочной гидролиз тригалогенидов
Тригалогеналканы, в которых три атома галогена расположены у одного атома углерода, с избытком щелочи образуется соль кислоты. При этом сначала происходит замещение галогенов на группы ОН.

Образуется неустойчивое вещество, которое распадается с отщеплением воды:

Так как щелочь в избытке, то образуется не сама кислота, а её соль:

4. Получение карбоновых кислот из солей
Карбоновые кислоты можно получить из солей действием минеральной кислоты на раствор соли:

| Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты: |

5. Гидролиз сложных эфиров
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:

| Например, метилацетат гидролизуется в кислой среде: |

6. Получение муравьиной кислоты из угарного газа
Соль муравьиной кислоты получают нагреванием оксида углерода (II) с твёрдым гидроксидом натрия под давлением:

7. Каталитическое окисление бутана
Уксусную кислоту в промышленности получают каталитическим окислением бутана:

8. Получение бензойной кислоты
Бензойную кислоту получают окислением гомологов бензола раствором перманганата калия в кислой среде.
| Например, при окислении толуола образуется бензойная кислота: |

9. Взаимодействие реактива Гриньяра с углекислым газом
При взаимодействии реактивов Гриньяра (алкилгалогенидов магния) с углекислым газом и последующем гидролизе образовавшегося промежуточного продукта образуется карбоновая кислота.

Кислота пропановая — Википедия
Acidul propanoic (de asemenea cunoscut și ca acid propionic , din cuvintele grecești protos , «primul» și pion te «uncillic chimic es») 3 -CH 2 -COOH. Este un lichid incolor cu un miros înțepător. Anionul, i de asemenea sărurile și esterii acidului propanoic sunt cunoscuți ca propanoați (sau propionați).
в промышленности, кислотный продукт пропановой кислоты, общий принцип гидроксикарбоксилареа этиленей фолозинд, катализатор нихель карбонил: [2]
- ЧАС 2 C знак равно C ЧАС 2 + ЧАС 2 О + C О ⟶ C ЧАС 3 C ЧАС 2 C О 2 ЧАС {\ displaystyle \ mathrm {H_ {2} C = CH_ {2} \ + \ H_ {2} O \ + \ CO \ longrightarrow \ CH_ {3} CH_ {2} CO_ {2} H}}
De asemenea, acidul propionic se poate obține prinoxidarea propanalului.В присутствии ионилор-де-кобальта и кобальта, эти реагенты локализуются при температуре 40–50 ° C:
- C ЧАС 3 C ЧАС 2 C ЧАС О + 1 2 О 2 ⟶ C ЧАС 3 C ЧАС 2 C О О ЧАС {\ displaystyle \ mathrm {CH_ {3} CH_ {2} CHO \ + \ {\ frac {1} {2}} \ O_ {2} \ longrightarrow \ CH_ {3} CH_ {2} COOH}}
Пищевая добавка Пропионовая кислота, пропановая кислота / номер cas: 79-09-4
Гарантия качества
После продажи нет никаких претензий по качеству, как вы это делаете?
1. Все наши сотрудники имеют большой опыт и знания в области химии, они изучат и подтвердят, какой ТОЧНЫЙ ПРОДУКТ ВАМ НУЖЕН!
2. Бесплатные образцы или образцы перед отгрузкой доступны для НОВОГО проекта НОВЫХ клиентов перед коммерческой покупкой.
3. Осмотр третьей стороной, такой как SGS, может быть организован в соответствии с требованиями.
4. Контроль качества на месте на наших УТВЕРЖДЕННЫХ связанных производственных базах с необходимой сертификацией, такой как GMP, ISO и т. Д.
5. Текущий АУДИТ ЗАВОДА с помощью наших методов или наших клиентов.
Как вы можете гарантировать, что качество, которое мы получаем, соответствует образцу или спецификации?
1. Третья сторона, такая как CIQ, проверка SGS перед отправкой по запросу.
2. В случае PSS мы будем держать груз до утверждения со стороны клиента.
3. У нас есть четкое и подробное положение о качестве в контракте с производителем, в случае несоответствия качества / количества они будут нести ответственность.
Профессиональная логистика
Я заказываю и плачу вам, как вы упаковываете и доставляете мне мой груз?
У нас есть строгий процесс обучения по СОП по упаковке и доставке. Подробный профиль СОП доступен для различных режимов, таких как безопасный груз и опасный груз по морю, воздуху, фургону или даже экспресс-доставка.
Как сделать, если мой груз упал в море?
Этого не произойдет. Ха-ха. Если это произошло, вам очень повезло, вы можете потребовать большие деньги в страховой компании, мы всегда страхуем половину вас перед отправкой.
Срочно нужны материалы, поторопитесь! Торопитесь! Ок?
Будем молиться, вы в мгновение ока получите груз. Шутка! Не волнуйтесь, быстрая и своевременная доставка — это наши ключевые проблемы. Мы всегда бронируем доставку через известный лайнер, даже если их стоимость для нас выше.
Гарантия оплаты
Будет ли ваша компания отсутствовать после того, как мы заплатим вам аванс?
Мы занимаемся химией в жизни! Мы никогда не пропадем.
Есть решение? Что наша оплата безопасна, а отгрузка осуществляется вовремя?
Вы можете использовать Trade Assurance Service от Alibaba Group.Пожалуйста, обратитесь к ссылке для получения дополнительной информации.
Мы вас совсем не знаем, как мы можем вам доверять?
Приглашаем Вас посетить нас в любое время. Прежде чем мы начнем B2B, Alibaba проверила нашу компанию на месте и одобрила наш кредит. Обязательства — это главный пункт ценности нашего предприятия.
.

