Производственная площадка
Приняв решение о производстве медицинских изделий, в первую очередь наши клиенты оценивают возможности выпуска медицинского изделия на российский рынок, проводят маркетинговые исследования, оценивают стоимость производства, проводят анализ цепочки закупок компонентов медицинских изделий. Изготовив опытные партии медицинских изделий, собрав обратную связь у врачей, будущих пользователей, вплотную подходят к подготовке Технических условий на производство, изготовлению партий для целей испытаний и регистрации медицинского изделия в Росздравнадзоре.
Если предприятие уже производит медицинские изделия, и это новое изделие в линейке, или новое направление, безусловно самое логичное решение – это размещение производства нового изделия на текущих производственных мощностях. Но это не всегда представляется возможным, например, сказываются ограничения по арендуемым площадям, или нагрузке на перекрытия, или электрической мощности. Может не хватать площадей чистых помещений, или невозможно организовать совмещение нескольких производственных процессов.
В такой ситуации становится целесообразным рассмотреть контрактное производство медицинского изделия, выводя часть производственных операций на субподряд на специализированные производственные площадки для медицинских изделий. Вообще, термин «производственная площадка» очень активно стал применяться в среде производителей мед. Изделий после принятия решения Совета ЕЭК от 10.11.2017 № 106 «Требования к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения».
Производство медицинских изделий предполагает соблюдение определенных норм и требований. Именно в этом документе было закреплено понятие «производственная площадка» – как территориально обособленный комплекс, предназначенный для выполнения всего процесса производства медицинского изделия или его определенных стадий. Согласно данному определению, компания СтериПак Сервис может выступать производственной площадкой как для выполнения определенных стадий (например упаковка, стерилизация), так и для выполнения всего производственного цикла (работа с сырьем, хранение на складе, отмывка, сборка, упаковка, стерилизация, раскладка в потребительскую упаковку, этикетирование, хранение на складе готовой продукции).
При этом очень важно обращать на условия производства медицинских изделий. Что мы понимаем под условиями производства мед. Изделий? «условия производства» — инфраструктура и производственная среда, необходимые для обеспечения соответствия производимых медицинских изделий Общим требованиям эффективности и безопасности, требованиям к их маркировке, технической и эксплуатационной документации на них, утвержденным Решением N 27 Совета Евразийской экономической комиссии от 12 февраля 2016 г. На нашем предприятии, в связи с эксплуатацией комплексов чистых помещений, производственные условия соответствуют нормам для производства изделий классов 2а стерильные, 2b, и изделия класса 3 (имплантируемые). Внедрен регулярный мониторинг условий производства и ведение всей соответствующей документации СМК по нормам ИСО 13485.
Очень важным следствием внедрения решения № 106 также является в том числе активный интерес производителей медицинских изделий к внедрению, поддержанию и приведение в соответствие документации по СМК. Применительно к медицинским изделиям, «система менеджмента качества медицинских изделий» — организационная структура, функции, процедуры, процессы и ресурсы, необходимые для скоординированной деятельности по руководству и управлению организацией — производителем медицинских изделий применительно к качеству.
Применительно к медицинским изделиям, «система менеджмента качества медицинских изделий» — организационная структура, функции, процедуры, процессы и ресурсы, необходимые для скоординированной деятельности по руководству и управлению организацией — производителем медицинских изделий применительно к качеству.
Доверяя производство медицинских изделий компании СтериПак Сервис, Вы можете быть уверены, что производственная площадка соответствует всем необходимым и достаточным требованиям к условиям производства медицинских изделий. При заключении договора на контрактное производство с нашей компанией, Вы можете рассчитывать на предоставление документации о внесении СтериПак Сервис в реестры в качестве площадки производства Вашего медицинского изделия. Мы предоставляем копии сертификатов ГОСТ Р ИСО 13485, договор на пром. Площадку, договор аренды помещений, выписки из Системы Менеджмента Качества, копии сертификатов, подтверждающих квалификацию и непрерывное обучение сотрудников.
Приглашаем Вас познакомиться с возможностями нашего предприятия и обсудить производство медицинских изделий на мощностях нашего предприятия!
Узкие места взаимодействия производственной площадки и отдела регистрации лекарственных препаратов
Я прихожу к директору, я говорю:
— Кто сшил костюм? Кто это сделал? Я ничего не буду делать, не буду кричать, я только хочу в глаза ему посмотреть. Выходит сто человек. Я говорю:
— Ребята, кто сшил костюм?
Они говорят:
— Мы!
Я говорю:
— Кто это «мы»?
Они говорят:
— У нас узкая специализация. Один пришивает карман, один — проймочку, я лично пришиваю пуговицы. К пуговицам претензии есть?
— Нет! Пришиты насмерть, не оторвёшь! Кто сшил костюм? Кто вместо штанов мне рукава пришил? Кто вместо рукавов мне штаны пришпандорил? Кто это сделал?
Они говорят:
— Скажите спасибо, что мы к гульфику рукав не пришили.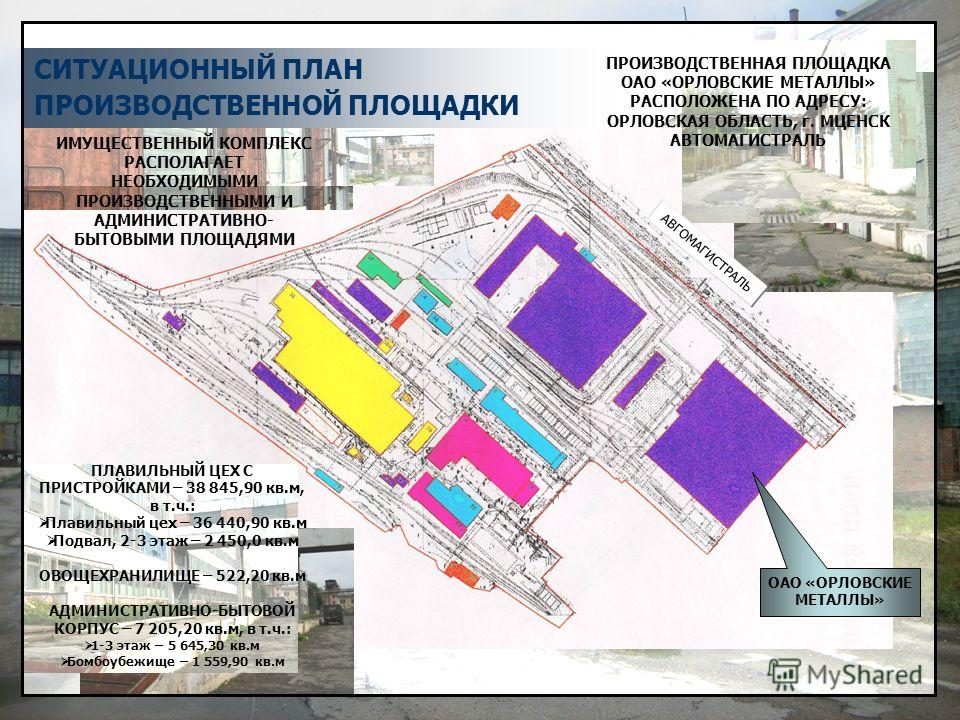 Представляете? Их — сто, а я — один. И все стоят, как пуговицы: насмерть. И я сказал: — Привет, ребята! Вы хорошо устроились!
Представляете? Их — сто, а я — один. И все стоят, как пуговицы: насмерть. И я сказал: — Привет, ребята! Вы хорошо устроились!
Аркадий Райкин, миниатюра «Кто сшил костюм?» из сборника «Люди и манекены».
На мой взгляд, миниатюра, выбранная в качестве эпиграфа к статье, очень точно, хотя и несколько утрировано отражает сложившуюся ситуацию при регистрации ЛП.
По своей сути, регистрация является «посредником» между R&D, производством и регуляторным органом (рисунок 1). В частности, отдел регистрации осуществляет сбор необходимых документов, формирование регистрационного досье и его подачу в регуляторный орган, сопровождает регистрационное мероприятие и после его завершения предоставляет утвержденные документы производственной площадке.
Рисунок 1. Взаимодействие в рамках регистрации лекарственных препаратовДавайте разберем основные причины сложившейся ситуации
На мой взгляд, одна из причин состоит в том, что у участников есть в некотором роде конфликт интересов, обусловленный противоречивыми задачами, стоящими перед ними (рисунок 2).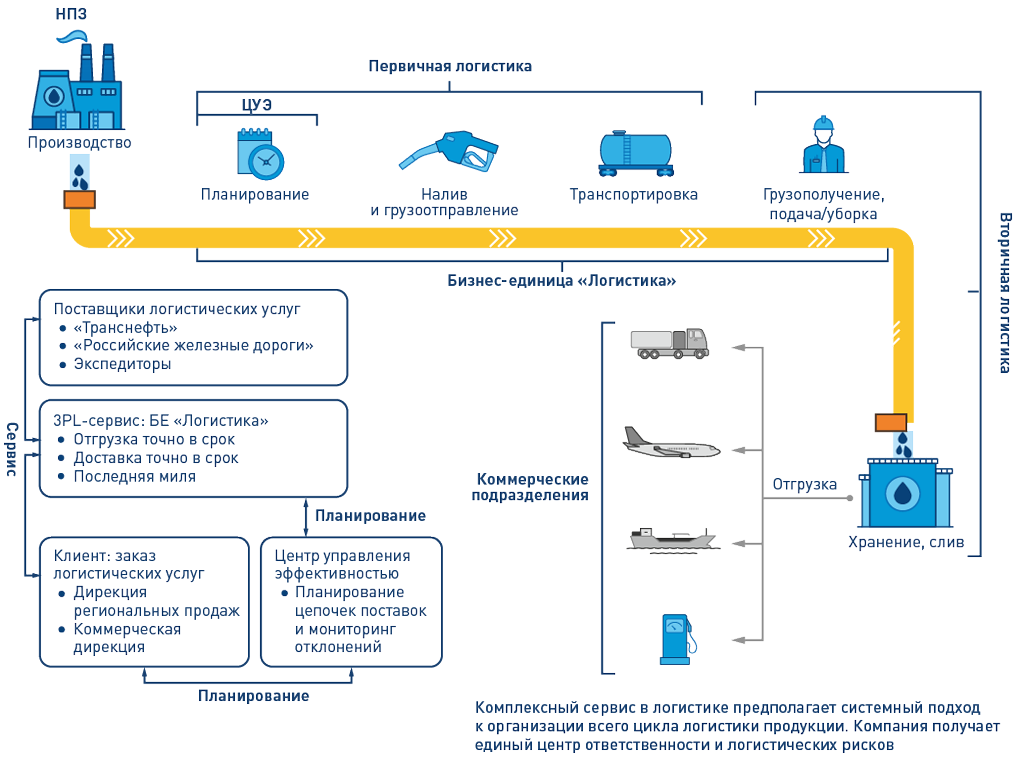
Другая причина – административная «оторванность» участников процесса
На рисунке 3 представлена обобщенная организационная структура фармацевтической организации.
Рисунок 3. Организационная структура фармацевтической компанииЯ намерено не детализировала организационные связи между финансовыми подразделениями, подразделениями маркетинга, продаж и другими подразделениями компании, сделав акцент на участниках процесса регистрации – подразделениями R&D, регистрации и производственной площадке, в составе которой служба качества и производство.
Итак, на что же следует обратить внимание при подготовке регистрационного досье?
Прежде всего, очень важно понимать, что регистрационное досье – это не копия документов производственной площадки.
 Поскольку последняя, с одной стороны, приведет к увеличению трудо-временных и финансовых затрат на поддержание досье в актуальном состоянии, с другой, что менее очевидно, но не менее значимо – предоставляет больший объем информации для экспертизы, что, в свою, очередь увеличивает нагрузку на экспертов и риск ошибок.
Поскольку последняя, с одной стороны, приведет к увеличению трудо-временных и финансовых затрат на поддержание досье в актуальном состоянии, с другой, что менее очевидно, но не менее значимо – предоставляет больший объем информации для экспертизы, что, в свою, очередь увеличивает нагрузку на экспертов и риск ошибок.Это может быть проиллюстрировано следующей образом: если представить документы производственной площадки и регистрационное досье в виде фотографий (как изображено рисунке 4), то целесообразно выбрать такую, условно назовем ее «степень приближения», которая позволит однозначно идентифицировать объект, но при этом не углубляясь до нюансов, которые не имеют критического значения для качества, эффективности и безопасности ЛП и, как следствие, не значимы при проведении экспертизы документов регистрационного досье.
Рисунок 4В этом и заключается виртуозность подготовки регистрационного досье. Для реализации этого необходимо наличие у сотрудников отделов регистрации широкого спектра компетенций, которые не могут ограничиваться только знанием нормативных требований по формированию регистрационного досье и административных регламентов по осуществлению регистрационных мероприятий.
Взаимодействие качества и регистрации осуществляется на следующих этапах:
- Подготовка регистрационного досье
- Выпуск лекарственного препарата в гражданский оборот
- Поддержание регистрационного досье в актуальном состоянии
Ключевые аспекты взаимодействия производственной площадки и регистрации сводятся к следующим:
- Состав (АФС и вспомогательные вещества)
- Производство, в том числе контроль процесса
- Маркировка ЛП
- Контроль качества
- Срок годности (срок хранения)
Разберем их детальнее, структурировав в соответствии с разделами регистрационного досье.
Рисунок 51. Субстанция
1.1. Объем и способ подготовки досье в зависимости от статуса и природы АФС, в частности возможны следующие варианты:
Таблица 1* Мастер-файл на плазму
** Мастер-файл на вакцинный антиген
Выбор наиболее оптимального варианта находиться в зоне ответственности заявителя.
Согласно Правилам регистрации и экспертизы лекарственных средств для медицинского применения, утв. Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78 (в ред. решений Совета Евразийской экономической комиссии от 14.06.2018 № 55, от 30.01.2020 № 9, от 23.12.2020 № 128, от 17.03.21 №36) допускается сокращенный вариант подготовки досье на субстанцию, если она внесена в ГРЛС РФ. К сожалению, не даны четкие инструкции по тому какие документы допускается не предоставлять. В рамках вебинара «Регистрация ЛП по правилам ЕАЭС с учетом новых поправок», организованного Евразийской Академией надлежащих производственных практик 07.04.22 была дана рекомендация предоставлять досье в объеме аналогичном объему при наличии у АФС CEP.
Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78 (в ред. решений Совета Евразийской экономической комиссии от 14.06.2018 № 55, от 30.01.2020 № 9, от 23.12.2020 № 128, от 17.03.21 №36) допускается сокращенный вариант подготовки досье на субстанцию, если она внесена в ГРЛС РФ. К сожалению, не даны четкие инструкции по тому какие документы допускается не предоставлять. В рамках вебинара «Регистрация ЛП по правилам ЕАЭС с учетом новых поправок», организованного Евразийской Академией надлежащих производственных практик 07.04.22 была дана рекомендация предоставлять досье в объеме аналогичном объему при наличии у АФС CEP.
Однако, сокращенные варианты не применимы для ЛП, содержащих в своем составе несколько АФС, а также, если планируется обращение ЛП на территори более одного государства-члена.
1.2. Целесообразно предусмотреть возможность использования АФС от альтернативных поставщиков, что существенно снизит риски возникновения дефектуры препарата на рынке, что может стать особенно критичным в таких фазах жизненного цикла как «рост» и «зрелость».
2. Вспомогательные вещества
Корректно указывать качество, а не производителя. При этом при обосновании требований акцент делать не на конкретной монографии, а критических показателях качества и критериях приемлемости. В этом случае не будет проблем при смене производителей вспомогательных веществ, достаточно будет выполнить требования GMP, проведя надлежащим образом квалификации производителей и поставщиков.
3. Срок годности
3.1. Долгосрочная стабильность должна быть представлена в досье в объеме не менее чем половину желаемого срока годности.
При этом, если в составе досье представлены данные по изучению стабильности. не покрывающие заявленный срок годности, необходимо предоставить в составе досье, соответствующее обязательство по продолжению изучения стабильности.
3.2. Количество серий в ряде случаев может быть менее 3
Более детальную информацию можно найти в Требованиях к исследованию стабильности лекарственных препаратов и фармацевтических субстанций, утв. Решением Коллегии Евразийской экономической комиссии от 10 мая 2018 г. № 69 (в ред. решений Совета Евразийской экономической комиссии от 30.06.2020 N 86).
Решением Коллегии Евразийской экономической комиссии от 10 мая 2018 г. № 69 (в ред. решений Совета Евразийской экономической комиссии от 30.06.2020 N 86).
3.3. Важно, что ускоренная стабильность не предназначена для определения срока годности, необходима для принятия решения в рамках расследования температурных отклонений при хранении и транспортировке
3.4. Стрессовые исследования стабильности, в том числе изучение фотостабильности, исследования стабильности во вскрытом состоянии, в том числе при контакте с пробкой (если применимо) и предоставление результатов в составе регистрационного досье позволит избежать избыточного ужесточения условий хранения. Например, указания «хранить в защищенном от света месте».
Важно продолжать изучение срока годности после регистрации с целью его увеличения, поскольку увеличение срока годности лекарственного препарата принесет значительную экономические выгоды.
МаркировкаРисунок 61. Целесообразно указание номеров Pantone/SMYK на макетах упаковок при идентификации цветовой гаммы.
Хотя не во всех регионах это жестко регламентировано (примерно в 25% стран, в которых мы работаем), но это существенно снижает риск забраковки серии при независимом контроле, формализует входной контроль упаковочных материалов и претензионную работу с поставщиков (при необходимости), а также упрощает процесс смены поставщика упаковочных материалов.
2. Унифицировать способ нанесения и формат переменной информации
Актуально если площадка выпускает ЛП для различных стран. Это позволит отказаться от перенастройки оборудования, что снизить вероятность возможных простоев, а также снизит вероятность ошибок по причине человеческого фактора.
3. Целесообразно отражение мест нанесения внутреннего кода/фарм-кодов и технологических меток (при наличии), поскольку это существенно снижает риск забраковки серии при независимом контроле.
Процесс производства Рисунок 71. Описание процесса и его контроля
Описание процесса и его контроля необходимо проводить в формате достаточно и целесообразно, отражать только суть, не раскрывая «ноу-хау». Важно принять во внимание, что объем контроля в рутинном производственном процессе может превышать таковой, отраженный в регистрационном досье.
Важно принять во внимание, что объем контроля в рутинном производственном процессе может превышать таковой, отраженный в регистрационном досье.
2. Оборудование
Достаточно ограничиться указанием разновидности и рабочих параметров.
3. Производственные площадки и материальный баланс
Необходимо отразить адреса и ответственность всех планируемых участников процесса производства, в том числе выпускающий контроль, а также все объемы серий и фасовок.
Безусловно, это сопряжено с определенными финансовыми и временными затратами на проведение валидационных испытаний и исследование стабильности. Но нужно учитывать, что для определенных объемов серий может проведена валидация процесса производства и изучена стабильность на сериях, часть из которых являются опытно-промышленными сериями. При этом для промышленной серии предоставлен план валидации процесса.
Контроль качестваРисунок 81. Спецификация
Необходимо комплектовать досье спецификацией при выпуске и спецификацией на конец срока годности (хранения) на основании проведенных испытаний стабильности лекарственного препарата с обоснованием выбора показателей качества, методик испытаний и валидации этих методик, что существенно снизит риски замечаний как при экспертизе документов регистрационного досье, так и в рамках инспектировании на соответствие требованиям GMP.
При том важно понимать, что спецификация при выпуске и спецификация на конец срока годности (хранения) могут отличаться по показателям качества, аналитическим методам/методикам и допустимым пределам. Как правило, допустимые пределы при выпуске ЛП являются более строгими по сравнению с допустимыми пределами на конец срока годности (например, испытание на примеси, испытание на растворение, количественное определение и др.)
Спецификация при выпуске может включать альтернативные методы/методики официально утвержденным (например, ТСХ-ВЭЖХ, СФ-ВЭЖХ).
Показатели качества, используемые во внутрипроизводственном контроле (например, истираемость, твердость, размер частиц и т.п.) включаются опционально.
Различия между спецификацией при выпуске и спецификацией на конец срока годности (хранения) обуславливают допустимость отличий между СП в составе нормативного документа, и сертификатом анализа
Как отмечено выше, нормы, указанные в спецификации (в составе НД), регламентируют качество препарата на конец срока годности, что подтверждено результатами стабильности и, могут отличаться от норм, приведенных в сертификате анализа, указанных на момент выпуска препарата, или отсутствовать.
2. Методики
Описание методики должно быть понятным и содержать всю необходимую информацию для ее воспроизведения (формулы расчета, порядок приготовления калибровочных растворов, значения коэффициентов перерасчета и т.д.)
Крайне важно контролировать соответствие методик, приведенных в проекте НД, методикам, приведенным в валидационных отчетах.
Необходимо использовать только установленные буквенные обозначения в формулах расчета и под формульных расшифровках.
По данным ФГБУ НЦЭСМП Минздрава России от 23.03.22, зафиксирован рост количества невоспроизводимых методик при контроле качества с 13 % до 30%, при этом брак при проведении фармацевтической экспертизы составляет 5%. Эти данные свидетельствуют о плохом качестве подготовки досье, подаче большого количества «сырых» досье.
3. Реактивы
Реактивы должны быть описаны с указанием грейда, каталожного номера и производителя, лучше указать, если допускается использование аналогичного реактива.
Целесообразно максимально предусмотреть использование фармакопейных реактивов.
Детали приготовления всех растворов (скорость, оборудование, время, температура), срок годности и условия хранения растворов должны быть указаны. Обязательно указание, если используется только свежеприготовленный раствор (если применимо).
Исключение составляют растворы, включенные в фармакопеи, в этом случае допустима ссылка на соответствующую фармакопею. Например, используется 1 % раствор крахмала – в ГФ РФ отражено приготовление только 0,1 % и 0,5 % растворов крахмала, поэтому приготовление 1 % необходимо описать.
4. Стандартные образцы
Необходимо представить перечень всех используемых стандартных образцов, в том числе стандартов примесей с указанием их квалификации. В отношении квалификации стандартных образцов установлены требования аналогичные требованиям для реактивов. Все стандартные образцы должны быть описаны с указанием грейда, каталожного номера и производителя, лучше указать, если допускается использование аналогичного реактива Целесообразно предусмотреть использование фармакопейных стандартных образцов пригодных для соответствующих методов анализа.
Если нет фармакопейного стандарта, то допустимо использование стандартных образцов квалификации «стандарт фирмы» (in-house), согласно которому данные стандартные образцы используются только для проведения анализов на предприятии и аттестованы по фармакопейному стандартному образцу.
Согласно информации, предоставленной ФГБУ НЦЭСМП Минздрава России от 23.03.22, допускается использование аналогичного оборудования в соответствующих рабочих условиях.
Производить или не производить?Важным аспектом взаимодействия производственной площадки и регистрации является производство и поставка ЛП после завершения регистрационного мероприятия, частности выбор утвержденных документов для выпуска ЛП. Решающим фактором на данном этапе выступает наличие или отсутствие переходных периодов для производства и поставок.
Возможные варианты развития событий могут быть выбраны при использовании матрицы, представленной на рисунке 9.
Рисунок 9. Матрица принятия решений по выбору документов для выпуска лекарственного препаратаОчевидно, что при наличии переходных периодов для производства и поставок возможны как производство, так и ввоз ЛП по ранее утвержденным документам в течение установленного переходного периода. Прямо противоположная ситуация отмечается в случае отсутствия переходных периодов для производства и поставок.
Прямо противоположная ситуация отмечается в случае отсутствия переходных периодов для производства и поставок.
В случае, если установлен переходный период для поставки, но не предусмотрен для производства, соответственно, возможна только поставка ранее произведенных серий в течение переходного периода.
Однако в законодательстве ряда стран предусмотрены опции, использование которых позволит оптимизировать косвенные затраты на регистрационное мероприятие, в частности обусловленные списанием упаковочных материалов, произведенных в соответствии с ранее утвержденными макетами.
Рассмотрим данные опции:
1. В некоторых случаях переходный период для производства действует только при внесении изменений, но не действует при перерегистрации.
Данная ситуация характерна для Азербайджана.
2. Существует возможность производить и ввозить лекарственные препараты по ранее утвержденным документам, даже если срок их действия закончился, но перерегистрация не завершена. Данная опция предусмотрена в Кыргызстане, Молдова.
Данная опция предусмотрена в Кыргызстане, Молдова.
3. Существует возможность «отложить» дату выдачи новых документов, что дает возможность сработать ранее утвержденные компоненты упаковки и/или поставить уже произведенные по ранее утверждённым документам серии.
Такая возможность законодательно закреплена в Азербайджане и Казахстане.
Изменения неизбежны!
В течение жизненного цикла любого лекарственного препарата неизбежны изменения, но их количество должно быть оптимальны, и не становиться бумажным и финансовым бременем для компании.
Я не призываю к нарушению нормативных требований, напротив я ратую за их соблюдение, но не в «прямой» трактовке, а путем грамотной профессиональной интерпретации нормативных требований и заводских изменений.
Оптимизация процессов подготовки регистрационного досье и поддержания его актуальном состояниями, и, как следствие, сопряженных с регистрационными мероприятиями финансовых затрат возможна только в результате интеграции регистрации и качества на каждом из вышеуказанных этапов.
Мне представляется целесообразным с одной стороны, использование для формирования регистрационного досье ПО, которое интегрировано с документооборотом производственной площадки.
С другой, необходимо активное участие регистрации в управлении изменениями на производственной площадке с целью формирования адекватной регистрационной стратегии
Особую актуальность этот подход приобретает в настоящее время, когда остро стоит проблема импортозамещения ЛП.
Возможные преимущества и недостатки предложенного подхода представлены на рисунке 10.
Рисунок 10production%20site — английское определение, грамматика, произношение, синонимы и примеры
Процедура должна быть ограничена оценкой конкретных разделов сводки характеристик продукта , подлежащих изменению.
не установленКогда предполагается использование в целях сострадания, Комитет по лекарственным средствам Продукты для использования человеком после консультации с производителем или заявителем может принять мнение об условиях использования, условиях распространения и целевых пациентах
Продукция CAMS предоставляется бесплатно зарегистрированным пользователям через Интерактивный каталог, доступный на веб-портале CAMS.
Это также требует большей энергоэффективности, что означает сокращение отходов как при производстве энергии, так и при ее потреблении.
Комментарий к новостям— увеличение производства затрат на фрукты и овощи, минус урожайности роста, а
ЕврЛекс-2(а) продукции полностью получен в этой стране по смыслу статьи 68;
EurLex-2Исследовательские услуги в отношении времени и движения, производство линии, складирование, управление запасами и логистика
tmClassS-XIII Изделия из камня, гипса, цемента, асбеста, слюды или аналогичных материалов; керамические изделия ; стекло и стеклянная посуда.
EurLex-2 Потребительский спрос на ткани на основе древесных волокон может подразумевать необходимость более тесного сотрудничества как между производителями экологичных волокон, так и с другими частями ткани 9Цепь 0003 производства для обеспечения четкой маркировки и доверия потребителей.
Этот модуль описывает ту часть процедуры, посредством которой нотифицированный орган устанавливает и подтверждает, что образец, представляющий предусмотренное производство , соответствует положениям Директивы 96/48/ЕС и TSI, которые применяются к нему в отношении пригодности для использования, должно быть продемонстрировано проверкой типа опытом эксплуатации.
EurLex-2(DE) Госпожа Президент, как вы видите, это явно австрийская проблема, и Штирия, одна из наших провинций, которая сильно пострадала, вызывает у нас большую озабоченность, с ее долей выше среднего населения, занятого в автомобильной промышленности с одной стороны и, конечно, непропорционально высокий процент этих продукция экспортируется с другой.
Europarl8 Вино и/или свежее виноградное сусло с брожением, остановленным добавлением спирта, используемые при приготовлении ароматизированного вина, должны присутствовать в готовом продукте в количестве не менее 75 %.
«виноградники для других целей» означает все площади под виноградниками, подлежащие включению в реестр виноградников в соответствии со статьей 3 Регламента Комиссии (ЕС) № 436/2009 от 26 мая 2009 г.устанавливает подробные правила применения Регламента Совета (ЕС) № 479/2008 в отношении реестра виноградников, обязательных деклараций и сбора информации для мониторинга рынка вина, документов, сопровождающих партии вина , продуктов и реестров винодельческого сектора. хранить
не установленОбработка и интерпретация данных по животным, использованным для испытаний на токсичность в отношении вида продуктов , впервые выполнена в Пятом статистическом отчете.
EurLex-2 1. Заявляет, что, не сообщив о законах, постановлениях и административных положениях, которыми он считает, что он выполнил свои обязательства в соответствии с Директивой Совета 85/374/ЕЭС от 25 июля 1985 г. о сближении законов, нормативные акты и административные положения государств-членов, касающиеся ответственности за дефектные продукты (OJ 1985 L 210, стр. 29), или, не приняв меры, необходимые для их соблюдения, Французская Республика не выполнила свои обязательства в соответствии с директивой. и в соответствии с Договором;
29), или, не приняв меры, необходимые для их соблюдения, Французская Республика не выполнила свои обязательства в соответствии с директивой. и в соответствии с Договором;
Так как SAPS является платой за площадь, то из этого следует, что крупные по гектарам хозяйства получают более высокие выплаты, которые не обязательно сопровождаются высокой производительностью .
elitreca-2022Использование ребенка для производства детской порнографии и т. д.
Пункт 1 предназначен для обеспечения того, чтобы обеспечительное право в активах, объединенных в массу или продукт , даже если они более не поддаются идентификации, продолжало действовать в масса или продукт .
Международному сообществу следует также постоянно наращивать инвестиции в наименее развитые страны в области инфраструктуры, производительности и услуг и стремиться помочь им реструктурировать свою экономику, которая слишком зависела от производства товаров.
Завод Производственное оборудование и оставшиеся запасы деталей были проданы с аукциона в конце апреля 2015 года. , которая направлена на укрепление цепочек поставок в этой отрасли и поощрение повышения конкурентоспособности и диверсификации продукт bases
englishtainment-tm-fcX3T6IMОжидаемый рост цен на нержавеющую сталь позволил промышленности Сообщества добиться более высоких цен на аналогичный продукт за счет временного использования в своем производстве запасов сравнительно дешевой нержавеющей стали, закупленных ранее. спекулятивный рост цен.
EurLex-2· 35 знаний и адвокации продуктов разработанных и информационно-просветительских инициатив/инициатив по наращиванию потенциала, поддерживаемых ГМ в области инновационного финансирования и финансирования частного сектора
Недавно Иран объявил о своем намерении начать массовое производство центрифуг нового поколения, для чего потребуются возможности производства из углеродного волокна ВВСКИ.
Данные цены относятся к следующим упакованным продуктам :
EurLex-2Продукция Определение и значение — Merriam-Webster
производство ·производство · prə-ˈdək-shən
прод-
1
а
: нечто произведенное : продукт
б(1)
: литературное или художественное произведение
(2)
: произведение, представленное для всеобщего сведения (как на сцене, так и на экране или в эфире)
с
: что-то преувеличенное непропорционально его важности
2
а
: действие или процесс производства
: создание утилиты
особенно : производство товаров, доступных для использования
3
: общий выпуск, особенно товаров или отраслей
4
часто атрибутивный : нечто, не разработанное специально или не изготовленное по индивидуальному заказу и обычно производимое серийно.
серийный автомобиль
серийный корпуспроизводственный
prə-ˈdək-shnəl
prō-
-shə-nᵊl
прилагательное
Синонимы
- дело
- фрукты
- ручная работа
- труд
- выход
- производить
- товар
- вещь
- работа
- выход
Просмотреть все синонимы и антонимы в тезаурусе
Примеры предложений
производство зернового оружия производство эритроцитов в организме
Я прошел курс кино производство . У него есть работа на телевидении производство .
Мы увидели сцену , постановку романа.
Режиссер хочет, чтобы она появилась в его следующей постановке .
годовой добыча угля
рост добычи нефти Узнать больше
У него есть работа на телевидении производство .
Мы увидели сцену , постановку романа.
Режиссер хочет, чтобы она появилась в его следующей постановке .
годовой добыча угля
рост добычи нефти Узнать больше
Недавние примеры в Интернете
Подчеркивая свой статус новой силы на испанской киносцене, компания Sideral подтвердила 22 производство , распространение или продажа титулов. — Джон Хоупвелл,
— Джон Хоупвелл,  — Harper’s BAZAAR , 15 февраля 2023 г.
Движимая страстью к кино на протяжении всей жизни, карьера Ладди затронула многие аспекты кинобизнеса, включая производство, реставрацию, распространение и выставки.
— Джош Роттенбергстафф, писатель, 9 лет.0217 Los Angeles Times , 14 февраля 2023 г.
Не сдерживаемый таким надзором за производством, продажей, использованием и экспортом, который применяется к типичному стрелковому оружию, индустрия менее смертоносного оружия была предоставлена самой себе.
— Сейворд Дарби, Longreads , 14 февраля 2023 г.
Пышный производства Лануа — не такое уж и секретное оружие Со.
— Брэд Сандерс, 9 лет.0217 SPIN , 13 февраля 2023 г.
Узнать больше
— Harper’s BAZAAR , 15 февраля 2023 г.
Движимая страстью к кино на протяжении всей жизни, карьера Ладди затронула многие аспекты кинобизнеса, включая производство, реставрацию, распространение и выставки.
— Джош Роттенбергстафф, писатель, 9 лет.0217 Los Angeles Times , 14 февраля 2023 г.
Не сдерживаемый таким надзором за производством, продажей, использованием и экспортом, который применяется к типичному стрелковому оружию, индустрия менее смертоносного оружия была предоставлена самой себе.
— Сейворд Дарби, Longreads , 14 февраля 2023 г.
Пышный производства Лануа — не такое уж и секретное оружие Со.
— Брэд Сандерс, 9 лет.0217 SPIN , 13 февраля 2023 г.
Узнать больше
Эти примеры предложений автоматически выбираются из различных онлайн-источников новостей, чтобы отразить текущее использование слова «производство». Мнения, выраженные в примерах, не отражают точку зрения Merriam-Webster или ее редакторов. Отправьте нам отзыв.
Мнения, выраженные в примерах, не отражают точку зрения Merriam-Webster или ее редакторов. Отправьте нам отзыв.
История слов
Первое известное использование
15 век, в значении, определенном в смысле 1a
Путешественник во времени
Первое известное использование производства было в 15 веке
Посмотреть другие слова из того же века продуктивный
производство
контроль производства
Посмотреть другие записи поблизости
Процитировать эту запись «Производство.»
Словарь Merriam-Webster.com , Merriam-Webster, https://www. merriam-webster.com/dictionary/production. По состоянию на 24 марта 2023 г.
merriam-webster.com/dictionary/production. По состоянию на 24 марта 2023 г.Copy Citation
Kids Definition
производство
сущ.
производство ·производство · prə-ˈdək-shən
1
: нечто произведенное
2
: действие или процесс производства
3
: 0 произведенное количество 304004
годовая добыча угля
4
: нечто преувеличенное несоразмерно своей важности
Сделал большую Производство Out Of Off Ording Lunch
Подробнее от Merriam-Webster на
ПроизводствоNGLISH: Перевод Производство для испанских носителей
Britannica English: Translation .
