Щелочные металлы
Щелочные металлы – франций, цезий, рубидий, калий, натрий, литий – называются так из-за того, что образуют щелочи при взаимодействии с водой. Из-за высокой способности вступать в реакцию эти элементы следует хранить под слоем минерального масла или керосина. Самым активным из всех указанных веществ считается франций (обладает радиоактивностью).
Щелочные металлы – вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском. Щелочные металлы кипят и плавятся при низких температурах, обладают высокой тепло- и электропроводимостью. Они имеют также небольшую плотность.
Химические свойства щелочных металлов
Вещества являются сильными восстановителями, проявляют в соединениях степень окисления (единственную) +1. С увеличением атомной массы щелочных металлов увеличивается и восстановительная способность. Практически все соединения растворимы в воде, все они носят ионный характер.
При умеренном нагревании щелочные металлы воспламеняются на воздухе. В соединении с водородом вещества формируют солеобразные гидриды. Продуктами сгорания, как правило, являются пероксиды.
Оксидами металлов щелочных являются твердые вещества желтого (оксиды рубидия и калия), белого (оксиды натрия и лития), и оранжевого (цезия оксид) цветов. Указанные оксиды способны реагировать с водой, кислотами, кислородом, кислотными и амфотерными оксидами. Эти основные свойства присущи им всем и носят ярко выраженный характер.
Пероксиды металлов щелочных – порошки желтовато-белого цвета. Они способны вступать в реакцию с углекислыми и угарными газами, кислотами, неметаллами, водой.
Гидроксиды металлов щелочных представляют собой растворимые в воде твердые вещества белого цвета. В этих соединениях проявляются (достаточно ярко) основные свойства щелочей. От лития к францию сила оснований и степень растворимости в воде увеличиваются. Гидроксиды считаются достаточно сильными электролитами. Они вступают в реакцию с солями, амфотерными гидроксидами и оксидами, отдельными неметаллами, кислотными оксидами. За исключением соединения с литием все остальные проявляют термическую устойчивость. При прокаливании гидроксида лития происходит его разложение на воду и оксид. Получаются указанные соединения при помощи электролиза хлоридных водных растворов, ряда обменных реакций. Гидроксиды получают также при взаимодействии элементов (или оксидов) с водой.
Практически все соли описываемых металлов (за исключением отдельных солей лития) в воде растворимы хорошо. Образованные слабыми кислотами, растворы солей имеют реакцию среды (щелочную) в связи с гидролизом, образованные же сильными кислотами соли не гидролизуются. Распространенными солями являются каменная (поваренная) соль, силикатный клей (растворимое стекло), калийная селитра, бертолетова соль, марганцовка, сода питьевая, кальцинированная сода и прочие.
Все соединения щелочных металлов обладают способностью изменять цвет пламени. Это применяют в химическом анализе. Так, пламя в карминово-красный цвет окрашивается ионами лития, в фиолетовый – ионами калия, в желтый – натрия, беловато-розовый – рубидия, фиолетово-красный – цезия.
В связи с тем, что все щелочные элементы являются самыми сильными восстановителями, получить их можно путем электролиза расплавов солей.
Применение щелочных металлов
Элементы используются в разных сферах деятельности человека. Например, цезий используется в фотоэлементах. В подшипниковых сплавах в качестве катализатора применяется литий. Натрий присутствует в газоразрядных лампах, ядерных реакторах как теплоноситель. В научно-исследовательской деятельности применяется рубидий.
fb.ru
Применение щелочных металлов и их соединений — урок. Химия, 8–9 класс.
Щелочные металлы (за исключением радиоактивного франция) и их соединения широко применяются в различных отраслях.

Из щелочных металлов наибольшее применение находит натрий.
Основными областями его использования является производство металлов и сплавов.
Пример:
натрий служит восстановителем при получении калия, титана и циркония.
Натрий используется также для получения неорганических и органических соединений. Он служит восстановителем органических соединений, катализатором.
Натрий в сплаве с калием является теплоносителем (переносчиком теплоты) в ядерных реакторах.
Литий применяется для производства сплавов на основе меди, магния и алюминия (придаёт сплавам лёгкость), в металлургии — для удаления из металлов примесей кислорода, водорода, азота, серы, с которыми литий образует соединения, переходящие в шлак.
Калий, рубидий и цезий используют для создания фотоэлементов, которые преобразуют энергию света в электрическую.
Сульфат натрия применяют в производстве серной кислоты, соды и стекла.
Хлорид натрия используется для производства важных химических веществ, таких как: натрий, гидроксид натрия, хлор, хлороводородная кислота и сода. Растворы хлорида натрия используют в медицине (физраствор), кулинарии (засолка овощей) и т. д.
Соли калия применяют главным образом в виде минеральных удобрений. При недостатке калия в почве замедляется рост растений, на них желтеют листья, растения легче поражаются вредителями. В качестве удобрений обычно используют хлорид, нитрат и сульфат калия.
Соединения калия (в основном K2CO3) содержит зола, образующаяся при сгорании древесины и растений, поэтому ее также используют как удобрение.
Гидроксиды натрия, калия и лития входят в состав электролитов щелочных аккумуляторов.
Соединения натрия и калия применяют в производстве мыла и синтетических моющих средств.
Соединения лития, рубидия и цезия служат добавками в производстве специальных стекол.Источники:
Иллюстрации: https://ds04.infourok.ru/uploads/ex/108c/0001f8d3-6deece85/640/img18.jpg
www.yaklass.ru
Применение щелочных металлов и их соединений
Применение щелочных металлов
Металлический натрий, с тех пор как его изготовление стало дешевым, находит широкое техническое применение. Его используют в качестве исходного продукта при производстве перекиси натрия (моющее средство), а также амида натрия и натрийцианамида. Его используют также в больших количествах в органических синтезах (например, в красильном производстве). В осветительной технике его применяют в натриевых газоразрядных лампах. В лабораториях натрий используют в качестве восстановителя. Для этого обычно вместо чистого металла употребляют мягко действующую амальгаму. Металлический калий также иногда употребляют в лаборатории. Кроме того, калий и прежде всего цезий применяют в фотоэлементах. Помимо этого, рубидий и цезий в свободном состоянии мало применяются. Металлический литий, напротив, приобрел большое техническое значение. Его используют во все возрастающих количествах в сплавах, так как небольшие добавки этого металла существенно улучшают свойства многих сплавов. Преимущественно литий (и наряду с натрием и кальцием) применяют для свинцово-подшипниковых сплавов и при производстве склерона. Кроме того, он служит в качестве раскисляющего средства для меди и при рафинировании содержащего никеля.
Перекись натрия в больших количествах используется при производстве моющих средств. В лаборатории ее применяют как энергичный окислитель в водном растворе и в расплаве. Гидроксиды калия и натрия в технике и в лаборатории часто применяют в качестве сильных оснований.
Вследствие небольшой гигроскопичности оксида и гидроксида лития, их используют для приготовления фотографических проявителей в виде порошков.
Соли щелочных металлов натрия и калия также имеют широкое применение. Если требуется ввести в реакцию какой-либо кислотный остаток, то его применяют большей частью в виде соответствующей соли щелочного металла (натрия или калия). Такое предпочтение для реакций щелочных солей объясняется их легкой плавкостью и растворимостью, а также и тем, что они не вызывают нежелательных побочных реакций. Однако, для технических целей, могут использовать и другие соединения, если они являются дешевле. Некоторые соли лития, например салицилат, карбонат и цитрат принимают как лечебное средство от подагры. Минеральные воды, употребляемые для борьбы с этой болезнью, в качестве действующей составной части содержат соли лития.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
Щелочные металлы. Строение, физические и химические свойства, применение :: SYL.ru
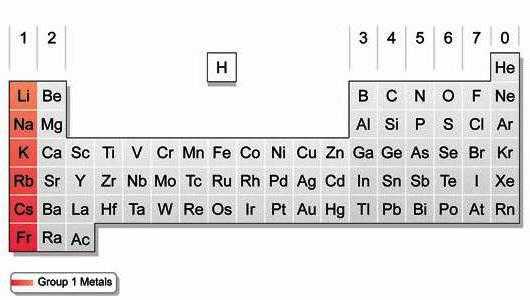
Щелочные металлы — общее название элементов 1-й группы периодической системы химических элементов. Ее состав: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr), и гипотетический элемент — унуненний (Uue). Наименование группы произошло от названия растворимых гидроксидов натрия и калия, обладающих реакцией и вкусом щелочи. Рассмотрим общие черты строения атомов элементов, свойства, получение и применение простых веществ.
Устаревшая и новая нумерация группы
По устаревшей системе нумерации щелочные металлы, занимающие крайний слева вертикальный столбец таблицы Менделеева, относятся к I-А группе. В 1989 году в качестве основного Международный химический союз (IUPAC) предложил иной вариант (длиннопериодный). Щелочные металлы в соответствии с новой классификацией и сплошной нумерацией относятся к 1-й группе. Открывает эту совокупность представитель 2-го периода — литий, завершает ее радиоактивный элемент 7-го периода — франций. У всех металлов 1-й группы во внешней оболочке атомов содержится один s-электрон, который они легко отдают (восстанавливаются).
Строение атомов щелочных металлов
Для элементов 1-й группы характерно наличие второго энергетического уровня, повторяющего строение предшествующего инертного газа. У лития на предпоследнем слое — 2, у остальных — по 8 электронов. В химических реакциях атомы легко отдают внешний s-электрон, приобретая энергетически выгодную конфигурацию благородного газа. Элементы 1-й группы обладают малыми величинами энергии ионизации и электроотрицательности (ЭО). Они легко образуют однозарядные положительные ионы. При переходе от лития к францию возрастает количество протонов и электронов, радиус атома. Рубидий, цезий и франций легче отдают внешний электрон, чем предшествующие им в группе элементы. Следовательно, в группе сверху вниз увеличивается восстановительная способность.
Содержание в земной коре
Легкая окисляемость щелочных металлов приводит к тому, что элементы 1-й группы существуют в природе в виде соединений своих однозарядных катионов. Содержание в земной коре натрия — 2,0%, калия — 1,1%. Другие элементы в ней находятся в малых количествах, например, запасы франция — 340 г. Хлорид натрия растворен в морской воде, рапе соленых озер и лиманов, образует залежи каменной или поваренной соли. Вместе с галитом встречаются сильвинит NaCl • KCl и сильвин KCl. Полевой шпат образован алюмосиликатом калия K2[Al2Si6O16]. В воде ряда озер растворен карбонат натрия, а запасы сульфата элемента сосредоточены в акватории Каспийского моря (Кара-Богаз-Гол). Встречаются залежи нитрата натрия в Чили (чилийская селитра). Существует ограниченное число природных соединений лития. В качестве примесей к соединениям элементов 1-й группы встречаются рубидий и цезий, а франций находят в составе урановых руд.
Последовательность открытия щелочных металлов
Британский химик и физик Г. Дэви в 1807 году провел электролиз расплавов щелочей, впервые получив натрий и калий в свободном виде. В 1817 году шведский ученый Иоганн Арфведсон открыл элемент литий в минералах, а в 1825-м Г. Дэви выделил чистый металл. Рубидий был впервые обнаружен в 1861 году Р. Бунзеном и Г. Кирхгофом. Немецкие исследователи анализировали состав алюмосиликатов и получили в спектре красную линию, соответствующую новому элементу. В 1939 году сотрудница Парижского института радиоактивности Маргарита Пере установила существование изотопа франция. Она же дала название элементу в честь своей родины. Унуненний (эка-франций) — предварительное название нового вида атомов с порядковым номером 119. Временно используется химический символ Uue. Исследователи с 1985 года предпринимают попытки синтеза нового элемента, который станет первым в 8-м периоде, седьмым в 1-й группе.
Физические свойства щелочных металлов
 Почти все щелочные металлы обладают серебристо-белым цветом и металлическим блеском на свежем срезе (цезий имеет золотисто-желтую окраску). На воздухе блеск тускнеет, появляется серая пленка, на литии — зеленовато-черная. Этот металл обладает наибольшей твердостью среди соседей по группе, но уступает тальку — самому мягкому минералу, открывающему шкалу Мооса. Натрий и калий легко сгибаются, их можно разрезать. Рубидий, цезий и франций в чистом виде представляют тестообразную массу. Плавление щелочных металлов происходит при относительно низкой температуре. Для лития она достигает 180,54 °С. Натрий плавится при температуре 97,86 °С, калий — при 63,51 °С, рубидий — при 39,32 °С, цезий — при 28,44 °С. Плотность щелочных металлов меньше, чем родственных им веществ. Литий плавает в керосине, поднимается на поверхность воды, калий и натрий также всплывают в нем.
Почти все щелочные металлы обладают серебристо-белым цветом и металлическим блеском на свежем срезе (цезий имеет золотисто-желтую окраску). На воздухе блеск тускнеет, появляется серая пленка, на литии — зеленовато-черная. Этот металл обладает наибольшей твердостью среди соседей по группе, но уступает тальку — самому мягкому минералу, открывающему шкалу Мооса. Натрий и калий легко сгибаются, их можно разрезать. Рубидий, цезий и франций в чистом виде представляют тестообразную массу. Плавление щелочных металлов происходит при относительно низкой температуре. Для лития она достигает 180,54 °С. Натрий плавится при температуре 97,86 °С, калий — при 63,51 °С, рубидий — при 39,32 °С, цезий — при 28,44 °С. Плотность щелочных металлов меньше, чем родственных им веществ. Литий плавает в керосине, поднимается на поверхность воды, калий и натрий также всплывают в нем.
Кристаллическое состояние
Кристаллизация щелочных металлов происходит в кубической сингонии (объемно-центрированной). Атомы в ее составе обладают зоной проводимости, на свободные уровни которой могут переходить электроны. Именно эти активные частицы осуществляет особую химическую связь — металлическую. Общность строения энергетических уровней и природа кристаллических решеток объясняют сходство элементов 1-й группы. При переходе от лития к цезию возрастают массы атомов элементов, что приводит к закономерному увеличению плотности, а также к изменению других свойств.
Химические свойства щелочных металлов
Единственный внешний электрон в атомах щелочных металлов слабо притягивается к ядру, поэтому им свойственна низкая энергия ионизации, отрицательное или близкое к нулю сродство к электрону. Элементы 1-й группы, обладая восстановительной активностью, практически не способны окислять. В группе сверху вниз возрастает активность в химических реакциях:
- Натрий, калий и литий при небольшом нагревании загораются на воздухе. Для первых двух металлов характерно образование в этой реакции пероксидов и надпероксидов, а для лития — оксида Li2O. Рубидий и цезий на воздухе самовоспламеняются.
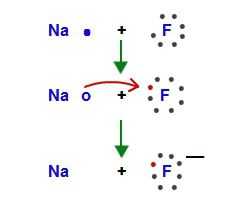
 Щелочные металлы способны восстанавливать даже водород. При нагревании взаимодействуют с атомами самого легкого элемента и восстанавливают его до отрицательно заряженного иона H—. В реакции получаются гидриды, например, NaH, KH.
Щелочные металлы способны восстанавливать даже водород. При нагревании взаимодействуют с атомами самого легкого элемента и восстанавливают его до отрицательно заряженного иона H—. В реакции получаются гидриды, например, NaH, KH.- Простые вещества, соответствующие элементам 1-й группы, взаимодействуют с водой и образуют щелочи, например, LiOH, NaOH, KOH. Процесс сопровождается выделением газообразного водорода, который самовоспламеняется или взрывается. 2Na + 2H2O = 2NaOH + H2↑. Рубидий и цезий вступают в реакцию даже со льдом. Хранение щелочных металлов допускается под слоем минерального масла, в керосине, в запаянных стеклянных сосудах.
- Активно взаимодействуют металлы 1-й группы с галогенами, особенно энергично происходит реакция с фтором и хлором, при нагревании — с серой и фосфором. Большинство получившихся солей обладает хорошей растворимостью.
- Качественная реакция — разложение солей щелочных металлов в огне газовой горелки. Пары окрашивают пламя в определенный цвет.
- При взаимодействии щелочных металлов со спиртами получаются алкоголяты, с карбоновыми кислотами они дают соответствующие соли, например, формиат натрия.
Получение и применение щелочных металлов
Металлы, относящиеся к 1-й группе, в промышленности получают электролизом расплавов их галогенидов и других природных соединений. При разложении под действием электрического тока положительные ионы на катоде присоединяют электроны и восстанавливаются до свободного металла. На противоположном электроде происходит окисление аниона.

При электролизе расплавов гидроксидов на аноде окисляются частицы OH—, выделяется кислород и получается вода. Еще один метод заключается в термическом восстановлении щелочных металлов из расплавов их солей кальцием. Простые вещества и соединения элементов 1-й группы имеют практическое значение. Литий служит сырьем в атомной энергетике, используется в ракетной технике. В металлургии применяется для удаления остатков водорода, азота, кислорода, серы. Гидроксидом дополняют электролит в щелочных аккумуляторах.

Натрий необходим для атомной энергетики, металлургии, органического синтеза. Цезий и рубидий используются при изготовлении фотоэлементов. Широкое применение находят гидроксиды и соли, особенно хлориды, нитраты, сульфаты, карбонаты щелочных металлов. Катионы обладают биологической активностью, особенно важны для организма человека ионы натрия и калия.
www.syl.ru
Соединения щелочных металлов в природе, их применение
Соединения щелочных металлов в природе, их применение [c.130] Щелочные металлы в природе. Получение и применение. Высокая химическая активность щелочных металлов исключает возможность нахождения их в природе в свободном состоянии. Они встречаются в природе только в виде соединений. Содержание щелочных металлов в земной коре в вес.% составляет
Взаимодействие калия и натрия с водородом было впервые описано еще в начале XIX в., но состав и природа образующихся соединений выяснены значительно позже. Химические свойства гидридов щелочных металлов были впервые подробно изучены Муассаном в конце XIX —начале XX вв. Дальнейшее изучение гидридов натрия и, в меньшей степени лития, шло главным образом в направлении использования их в органическом синтезе. Начиная с 40-х годов XX в. значительный размах получили исследования по применению гидридов щелочных металлов для получения простых и комплексных гидридов других элементов. [c.49]
Кобальто-молибденовый катализатор применяется для гидроочистки газойлей [142]. Если исходные нефтепродукты содержат олефины, то катализатор предварительно обрабатывают солями щелочных металлов, при этом он теряет способность гидрировать олефины, сохраняя активность в отношении гидрогенолиза сераорганических соединений [220]. Катализатор такого типа был применен для установления природы сернистых соединений, содержащихся во фракциях 250—300° С нефтей Среднего Востока [69, 221 ]. Предварительно был проведен гидрогенолиз индивидуальных сераорганических соединений для выяснения направления превращения их при температуре 375° С и давлении 50 кг см (табл. 83). [c.386]
Щелочные металлы в природе. Получение, свойства и применение щелочных металлов. Щелочные металлы находятся в природе только в виде соединений. Натрий и калий относятся к наиболее распространенным элементам. Содержание их в земной коре составляет соответственно 2,4 и 2,35%. Они входят в состав различных минералов. Хлористый натрий Na l образует большие залежи каменной соли огромные количества хлористого натрия находятся в морской воде. Богатые запасы сульфата натрия NaaSOj lOHjO содержатся в заливе Кара-Богаз-Гол. [c.210]
Основное достоинство издания Паскаля заключается в том, что каждая монография, посвященная тому или иному элементу, составлялась выдающимся специалистом в данной области. Поэтому краткость изложения отчасти компенсируется разумным отбором материала, критическим освещением сообщаемых сведений и, как правило, их достоверностью. Систематизация материала подчинена единому (в основных чертах) плану. Вначале излагаются исторические сведения об открытии элемента и первых работах с его соединениями, о его минералах, распространенности его в природе и размерах производства приводятся различные методы извлечения элемента из руд, физические и химические свойства, аналитические данные и области применения. Затем следует обзор различных соединений данного элемента с другими элементами периодической системы. При этом сплавы всех металлов выделены особо и сведения о них приведены все вместе в ХП томе. В отличие от издания Гмелина, в справочнике Паскаля общие свойства родственных элементов (например, щелочных металлов, радиоактивных, редкоземельных и некоторых других) обсуждаются параллельно.
Современная органическая химия может с гордостью заявить о своей способности синтезировать неизвестные Природе соединения огромной сложности и об обладании набором разнообразнейших методов, позволяющих выполнять почти любые химические трансформации. Такое заявление надежно подкрепляется множеством вьщающихся достижений органического синтеза последних десятилетий. Тем не менее, впечатление от таких мажорных аккордов немедленно тускнеет при сопоставлении с работой химических механизмов даже простейшей живой клетки. Тысячи соединений (и просп,1Х, и исключительно сложных) синтезируются ферментами в любой момент жизни клетки при обычных (физиологических) условиях в воде, в узком интервале значений pH, без применения высоких температур и давлений и без помоши наших суперактивных реагентов типа сверхкислот, сверхсилькых оснований, щелочных металлов, галогенов, литийорганических соединений и т. п.. В любой клетке непрерывно осуществляются многостадийные синтезы огромного разнообразия органических соединений, необходимых для поддержания ее жизни. Все эти синтезы выполняются за считанные минуты с количественными выходами и строго регао- и стереоспецифично Это означает, что все наиболее трудные проблемы стратегии и тактики органического синтеза уже давно решены на химических комбинатах , оперирующих в любой живой системе. Такое высочайшее совершенство биосинтеза невольно вызывает у химиков смеш анные чувства и восхищения, и подавленности от сравнения своих скромных возможностей с достижениями Природы,
Значительно возросло число известных катализаторов димеризации олефинов к настоящему времени описано применение кислот, окислов и солей металлов, щелочных металлов и их гидридов, комплексов металлов, металлоорганических соединений (индивидуальных и в сочетании с различными сокатализаторами). Появление обширных экспериментальных данных создало предпосылки для научно обоснованной классификации катализаторов димеризации олефинов, основанной на природе их активности и механизме каталитического действия [6]. [c.7]
Особое место занимают работы В. А. Каргина, посвященные электросинтезу минералов, осуществляемому в электродиализаторе. Одна из них, выполненная совместно с О. И. Дмитренко, посвящена изучению процессов выветривания алюмосиликатов [12]. Цель работы заключалась в синтезе некоторых продуктов стадийного выветривания глинистых материалов, получающихся в нормальных условиях в результате щелочного и кислого гидролиза естественных алюмосиликатов. Основная экспериментальная трудность заключалась в воспроизведении природных условий синтеза, протекающего при чрезвычайно низких концентрациях реагирующих веществ кремне-кислоты и окислов металлов, значительно меньших чем 1 мг л. Синтез потребовал бы использования громадных количеств воды, причем неизбежные загрязнения воды и трудности, связанные с улавливанием продуктов реакции, могли совершенно исказить результаты. Для решения этих задач был предложен иной путь, состоящий в ускорении процессов диффузии растворенной части малорастворимых электролитов, применения ускоряющего электрического поля. Использование этого принципа позволило изучить гидролиз некоторых природных минералов в специально сконструированном пятикамерном электродиализаторе. При электродиализе большинства минералов происходит их постепенный распад, связанный с растворением или гидролизом и последовательным переносом катионов и анионов в боковые камеры. Такой процесс соответствует тем явлениям растворения и гидролиза, которые происходили бы при пропускании громадных количеств воды в соответственно длительные промежутки времени. Путем изменения условий синтеза этим методом были получены новые, а также весьма редко встречающиеся в природе кристаллические разновидности, что особенно важно для соединений, обладающих большой энергией кристаллизации. Безусловно, этот метод представляет большой интерес и в смежных областях знания — биологии, медицине, кристаллографии, кристаллохимии, почвоведении и т. д.
Положение водорода в периодической системе. Водород в природе 86. Получение, свойства и применение водорода (202). 87. Вода (206). 88 топы водорода. Тяжелая вода (207). 89. Перекись водорода (208). 90. ные металлы в природе. Получение, свойства и применение щелочных лов (210). 91. Медь (213). 92, Комплексные соединения (217). 93. [c.392]
Более подробно, чем в школьных учебниках, изложен материал о распространенности щелочных и щелочноземельных металлов в природе, об истории их открытия, физических и химических свойствах, химических соединениях, получении 1И применении этих металлов. [c.22]
Полимеризацию ненасыщенных соединений под влиянием металлического натрия наблюдал Кракау [1 ] на примере стирола еще в 1878 г. Возможность полимеризации диеновых углеводородов с щелочными металлами впервые установил Кондаков [2]. В дальнейшем Метьюс и Гаррис [3, 4] предложили метод полимеризации диеновых углеводородов с металлическим натрием. Лебедевым [7 ] был создан метод получения синтетического каучука из бутадиена с применением металлического натрия в качестве катализатора. Возможность полимеризации ненасыщенных углеводородов под влиянием натрийорганических соединений была установлена Остромысленским [5]. Дальнейшее развитие работ по исследованию закономерностей этих реакций дало возможность выяснить природу этих процессов.
Соотношение соединений 81 и 82 зависит от используемого фторида щелочного металла. Так, в случае применения фторида цезия получается только соединение 81, тогда как для фторида калия имеет место образование двух соединений 81 и 82, соотношение которых зависит от природы заместителя в бензольном кольце СбНзХ при КР (в скобках выход соединений 81 и 82), 20 °С, [c.83]
Алкоголяты могут быть амфотерными, сильно кислыми и сильно щелочными. Алкоголяты щелочных металлов, например алкоголят натрия, являются основаниями благодаря этоксид-иону [1—3]. Алкоголят алюминия [4] А1 (ОК)д проявляет прежде всего кислотные свойства благодаря сильной тенденции электрофильного, т. е. кислотного, атома алюминия приобрести пару электронов у электродотного соединения, т. е. основания. По отношению к другой, более сильной кислоте алкоголят алюминия может вести себя как основание, подобно гидроокиси алюминия. В литературе находим некоторые очень интересные исследования в области каталитической конденсации альдегидов с применением кислотных, основных и амфотерных катализаторов. Кульпин-ский и Норд [5] описали применение комплексного алко-голята Mg [А1 (ОК)4]2, который, согласно их экспериментальным результатам, проявляет, повидимохму, амфотерную природу. [c.188]
Четырехвалентность аниона [Ре(СК)81 позволяет осуществить огромное множество вариаций состава смешанных ферроцианидов с изменением в широких пределах как числа внешнесферных катионов (с учетом сказанного выше), так и соотношения между ними. Здесь можно оставить в стороне вопрос о разного рода нестехиометрических соединениях смешанных ферроцианидов (относимых обычно к адсорбционньш по этому вопросу еще не накопилось достаточного количества точного экспериментального материала, который позволил бы однозначно говорить об истинной природе явлений, обобщаемых термином адсорбция ). Однако, говоря о смешанных ферроцианидах, число которых огромно, нельзя не отметить возможность их многочисленных применений, основанных на факте дифференцированности катионов внешней сферы. Наиболее типичны в этом отношении смешанные ферроцианиды, в состав которых входят помимо других катионы щелочных металлов. В принципе все они могут рассматриваться как катиониты со значительной (практически теоретической) ионообменной емкостью. В некоторых случаях этот факт не остался в стороне от практического использования (извлечение радиоактивного цезия, а в сущности говоря, и радиоактивных лантанидов из сбросных радиоактивных растворов, выделения рубидия из карналлита и отходов электролитического получения магния и т. д.), однако нет никакого сомнения, что это только начало, и можно утверждать, что смешанные ферроцианиды являют собою тип неорганического ионита, наиболее подходящего для широкого использования. К этому можно добавить, что отмеченная выше дифференцирован-ность внешнесферных металлов позволяет надеяться на использование соответствующих соединений для выделения и разделения многих цветных и редких металлов. Введение предварительного замораживания смешанных ферроцианидов (В. В. Вольхин и др.) устраняет довольно серьезную помеху, обусловленную коллоидной природой смешанных ферроцианидов, вследствие чего их трудно использовать в колоночном варианте ионного обмена. С устранением указанного препятствия ионный обмен с использованием смешанных ферроцианидов может быть осуществлен в промышленном масштабе, что весьма актуально для цветной металлургии. Попутно отметим здесь, что, как оказалось, многие черты, свойственные химии ферроцианидов, характерны также для химии пирофосфатов. [c.283]
Изучение внедрения щелочных металлов проводилось Кабановым, в первую очередь, путем исследования влияния этого процесса на перенапряжение водорода на металлах. Было установлено [191 —193], что перенапряжение водорода на свинцовом, цинковом, серебряном, кадмиевом и алюминиевом катодах в щелочных растворах изменяется во времени и при высоких плотностях тока сильно зависит от природы катиона щелочи, а тафелевские катодные кривые характеризуются повышенным коэффициентом наклона. Такие результаты принципиально могли быть объяснены на основе теории внедрения щелочного металла. Подтверждение этой точки зрения оказалось возможным в результате применения специальных методов исследования. Один из них был основан на появлении задержек [194] на катодных и последующих анодных кривых заряжения на серебре, кадмии, свинце, цинке в шелочах при потенциале вблизи —1,3 в, что связывалось с катодным образованием и анодным разложением соответствующих ин-терметаллических соединений. Снятие анодных хронопотенцио-грамм после катодной поляризации явилось поэтому методом оценки количества образовавшегося сплава [195—198]. [c.39]
Параллельно с работами, имеюн ими практическое значение, в стране проводились теоретические исследования, которые в дальнейшем обеспечили технический прогресс в области синтеза каучука. Это работы С. С. Медведева с сотрудниками по полимеризации щелочными металлами и их органическими соединениями, работы А. И. Якубчик по установлению зависимости между условиями полимеризации и структурой получаемых полимеров. В этих исследованиях была установлена возможность регулирования структуры при каталитической полимеризации диенов за счет изменения природы катализатора. Одновременно была показана высокая регулярность каучука, получаемого при применении в качестве катализатора лития и его органических соединений. Эти работы были проведены почти на 20 лет раньше работ К. Циглера и Дж. Натта по стереоспецифической полимеризации. [c.257]
KoH TaiHTa равновесия реакции достигает большого значения (/(=10 000), т. е. практически реакция идет в сторону образования смолы. Выделяющаяся в ходе процесса вода на равновесие и скорость процесса оказывает небольшое влияние и основными факторами, определяющими направление реакции и ее кинетику, являются температура, время реакции, природа и концентрация применяемого катализатора. Чем меньше молярнре отношение фенола к формальдегиду, тем больше молекулярная масса полученной смолы. Увеличение времени поликонденсации способствует более полному связыванию фенола с формальдегидом и повышению средней молекулярной массы конечных продуктов. При избытке альдегида (на 6 молей фенола 7 и больше молей формальдегида) и применении в качестве катализатора какой-либо щелочи или соли щелочного металла получаются термореактивные или резольные смолы. Причем с 1 молем прореагировавшего фенола связывается до 1,5 моля формальдегида. В результате реакций конденсации в конечном итоге образуются трехмерные молекулы. Однако взаимодействие между фенолом и формальдегидом протекает ступенчато с образованием различных соединений на отдельных стадиях процесса и при этом в ходе процесса образуется сложная смесь изомеров и полимергомологов, способных к дальнейшему взаимодействию, с образованием более сложных продуктов конденсации. Это разнообразие объясняется тем, что в ядре фенола имеется три подвижных атома водорода, способных к реакциям замещения. [c.173]
Первое сообщение о соединениях, содержащих группу SF5O—, в котором было приведено детальное описание эксперимента, опубликовано Кеди с сотрудниками [22]. Каталитическим фторированием, описанным в разд. П1.А, тионилфторид можно превратить в гипофторит пентафторида серы. Применение избытка фтора позволяет получить 50%-ный выход. При фторировании получают также тионилтетрафторид с низким выходом. Действительная природа катализатора и его влияние на реакцию неясна. Более позднее исследование показало, что фториды щелочных металлов, и фторид цезия особенно, также катализируют реакцию фторирования тионилфторида [23]. Реакции в этом более позднем исследовании проводили в статической системе при комнатной температуре. В отсутствие фторида металла образуется только тионилтетрафторид, даже при избытке фтора. Фторирование в присутствии фторида цезия при тех же экспериментальных условиях позволяет выделить гипофторит пентафторида серы с выходом более 95% при небольшом избытке фтора. Подобным образом в присутствии катализатора тионилтетрафторид можно превратить в гипофторит пентафторида серы с таким же высоким выходом. Фторирование тионилфторида, таким образом, состоит из двух стадий, и катализатор требуется только на последней стадии [c.77]
chem21.info
Щелочные металлы
Структура внешних электронных слоев в атомах элементов I группы позволяет прежде всего предполагать отсутствие у них тенденции к присоединению электронов. С другой стороны, отдача единственного внешнего электрона, казалось бы, должна происходить весьма легко и вести к образованию устойчивых одновалентных катионов рассматриваемых элементов.
Как показывает опыт, предположения эти в полной мере оправдываются только применительно к элементам левого столбца (Li, Na, К и аналогам). Для меди и ее аналогов они верны лишь, наполовину: в смысле отсутствия у них тенденции к присоединению электронов. Вместе с тем их наиболее удаленный от ядра 18-электронный слой оказывается еще не вполне закрепленным и при определённых условиях способен к частичной потере электронов. Последнее обусловливает возможность существования на ряду с одновалентными Сu, Agи Аu также и соединений рассматриваемых элементов, отвечающих их более высокой валентности.
Подобное расхождение выведенных из атомных моделей предположений н результатов опыта показывает, что рассмотрение свойств элементов на основе только электронных структур атомов и без учета остальных особенностей не всегда достаточно для химической характеристики этих элементов даже в самых грубых чертах.
Щелочные металлы.
Применяемое к элементам ряда Li—Cs название щелочные металлы связано с тем, что их гидроокиси являются сильными щелочами. Натрий и калий относятся к наиболее распространенным элементам, составляя соответственно 2,0 и 1,1% от общего числа атомов земной коры. Содержание в ней лития(0,02%), рубидия (0,004%) и цезия(0,00009%) уже значительно меньше, а франция — ничтожно мало. Элементарные Na и К выделены только в 1807 г. Литий открыт в 1817 г., цезий и рубидий — соответственно в 1860 и 1861 г. Элемент № 87 — франций — был открыт в 1939 г., а название свое получил в 1946 г. Природные натрий и цезий являются «чистыми» элементами (23Na и 133Cs), литий слагается из изотопов 6Li (7,4%) и 7Li (92,6%), калий—из изотопов 39К (93,22%).
40К (0,01%) и 41К (6,77%), рубидий— из изотопов 85Rb (72,2%) и 87Rb (27,8%). Из изотопов франция основное значение имеет встречающийся в природе 223Fr (средняя продолжительность жизни атома 32 мин).
Распространённость:
В природе встречаются только соединения щелочных металлов. Натрий и калий являются постоянными составными частями многих силикатов. Из отдельных минералов натрия важнейший — поваренная соль (NaCl) входит в состав морской воды и на отдельных участках земной поверхности образует под слоем наносных пород громадные залежи каменной соли. Верхние слои подобных залежей иногда содержат скопления солей калия в виде пластов сильвинита (mKCl∙nNaCl), карналлита (КСl • MgCl2 • 6Н2О) и др., служащие основным источником получения соединений этого элемента. Имеющих промышленное значение природных скоплений калийных солей известно лишь немного. Для лития известен ряд минералов, но скопления их редки. Рубидий и цезий встречаются почти исключительно в виде примесей к калию. Следы франция всегда содержатся в урановых рудах. Минералами лития являются, например, сподумен [LiAl(SiO3)2] и лепидолит {Li2KAl [Si4O10(F, OH)2]}. Часть калия в последнем из них иногда бывает замещена на рубидий. То же относится к карналлиту, который может служить хорошим источником получения рубидия. Для технологии цезия наиболее важен сравнительно редкий минерал поллуцит — CsAI(SiO3)2.
Получение:
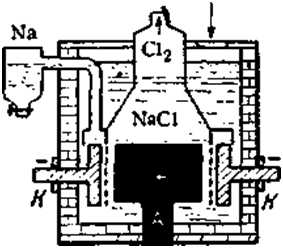
В свободном состоянии щелочные металлы могут быть выделены электролизом их расплавленных хлористых солей. Основное практическое значение имеет натрий, ежегодная мировая выработка которого составляет более 200 тыс. т.Схема установки для его получения электролизом расплавленного NaCl показана ниже. Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом (А) и кольцевым железным катодом (К), между которыми расположена сетчатая диафрагма. Электролитом обычно служит не чистый NaCl (т. пл. 800 ℃), а более легкоплавкая смесь из приблизительно 40% NaCl и 60% СаСl2, что дает возможность работать при температурах около 580 °С. Собирающийся в верхней части кольцевого катодного пространства и переходящий в сборник металлический натрий содержит небольшую (до 5%) примесь кальция, который затем почти полностью выделяется (растворимость Са в жидком натрии при температуре его плавления равна лишь 0,01%). По мере хода электролиза в ванну добавляют NaCl. Расход электроэнергии составляет около 15 кВт • ч на 1 кг Na.
2NaCl→ 2Na+Cl2
Это интересно:
До введения в практику электролитического метода металлический натрий получали накаливанием соды с углем по реакции:
Na2CO3+2C+244ккал→2Na+3CO
Выработка металлических К и Li несравненно меньше, чем натрия. Литий получают электролизом расплава LiCl + КСl, а калий—действием паров натрия на расплав КСl, поступающий противотоком к ним в специальных дистилляционных колоннах (из верхней части которых выходят пары калия). Рубидий и цезий в больших масштабах почти не добываются. Дли получении небольших количеств этих металлов удобно пользоваться нагреванием в вакууме их хлоридов с металлическим кальцием.
KCl+Na→NaCl+K
2LiCl→2Li+Cl2
Физический свойства:
При отсутствии воздуха литий и его аналоги представляют собой серебристо-белые (за исключением желтоватого цезия) вещества с более или менее сильным металлическим блеском. Все щелочные металлы характеризуются небольшими плотностями, малой твердостью, низкими температурами плавления и кипения и хорошей электропроводностью. Их важнейшие константы сопоставлены ниже:
|
|
Li |
Na |
К |
Rb |
Cs |
|
Плотность, г/см3. |
0,53 |
0,97 |
0,86 |
1.53 |
1,87 |
|
Температура плавления, °С |
180 |
98 |
63 |
39 |
29 |
|
Температура кипения, °С |
1350 |
900 |
776 |
686 |
670 |
Благодаря малой плотности Li, Na и К всплывают на воде (Li — даже на керосине). Щелочные металлы легко режутся ножом, а твердость наиболее мягкого из них — цезия — не превышает твердость воска. Несветящееся пламя газовой горелки щелочные металлы и их летучие соединения окрашивают в характерные цвета, из которых наиболее интенсивен присущий натрию ярко-желтый.
Это интересно:
Внешне проявляющееся в виде окрашивания пламени испускания нагретыми атомами щелочных металлов световых лучей обусловлено перескоком электронов с более высоких на более низкие энергетические уровни. Например, характерная желтая линия спектра натрия возникает при перескоке электрона с уровня 3р на уровень 3s. Очевидно, что для возможности такого перескока необходимо предварительное возбуждение атома, т. е. перевод одного или нескольких его электронов на более высокий энергетический уровень. В рассматриваемом случае возбуждение достигается за счет теплоты пламени (и требует затраты 48 ккал/г-атом), вообще же оно может последовать в результате сообщения атому энергии различных видов. Другие щелочные металлы вызывают появление следующих окрасок пламени: Li — карминово-красной, К—фиолетовый, Rb — синевато-красной, Cs — синей.
Спектр люминесценции ночного неба показывает постоянное наличие в ней желтого излучения натрия. Высота места его возникновения оценивается в 200—300 км.Т. е. атмосфера на этих высотах содержит атомы натрия (конечно, в ничтожных количествах). Возникновение излучения описывается рядом элементарных процессов (звездочкой показано возбужденное состояние; М —любая третья частица — О2, О0, N2 и др.): Na + О0 + М = NaO + М*, затем NaO + О=О2+ Na* и, наконец, Na*= Na +λν.
Хранить натрий и калий следует в плотно закрытых сосудах под слоем сухого и нейтрального керосина. Недопустим их контакт с кислотами, водой, хлорированными органическими соединениями и твердой двуокисью углерода. Нельзя накапливать мелкие обрезки калия, которые окисляются особенно легко (из-за своей относительно большой поверхности). Неиспользованные остатки калия и натрия при малых количествах уничтожают взаимодействием с избытком спирта, при больших — сжиганием на углях костра. Загоревшиеся в помещении щелочные металлы лучше всего тушить, засыпая сухим порошком кальцинированной соды.
Химические свойства:
С химической стороны литий и его аналоги являются исключительно реакционноспособными металлами (причем активность их по направлению от Li к Cs обычно возрастает). Во всех соединениях щелочные металлы одновалентны. Располагаясь в крайней левой части ряда напряжений, они энергично взаимодействуют с водой по схеме:
2Э + 2H2O = 2ЭОН +H2↑
При реакции с Li и Na выделение водорода не сопровождается его воспламенением, у К оно уже происходит, а у Rb и Cs взаимодействие протекает со взрывом.
· В соприкосновении с воздухом свежие разрезы Na и К (в меньшей степени и Li) тотчас покрываются рыхлой пленкой продуктов окисления. Ввиду этого Na и К хранят обычно под керосином. Нагретые на воздухе Na и К легко загораются, а рубидий и цезий самовоспламеняются уже при обычной температуре.
4Э+O2→2Э2O (для лития)
2Э+O2 →Э2O2(для натрия)
Э+O2→ЭO2(для калия, рубидия и цезия)
|
Li20 |
Na202 |
К02 |
Rb02 |
Cs02 |
|
белый |
белый
|
желтый
|
желтый
|
желтый
|
Практическое применение находит главным образом перекись натрия (Na202). Технически ее получают окислением при 350°С распыленного металлического натрия:
2Na+O2→Na2O2+122ккал
· Расплавы простых веществ способны соединяться с аммиаком, с образованием амидов и имидов, сольватов:
2Naрасплав+2NH3→2NaNH2+H2↑ (амид натрия)
2Naрасплав+NH3→Na2 NH+H2↑ (имид натрия)
Naрасплав+6NH3 →[Na(NH3)6 ] (сольват натрия)
При взаимодействии пероксидов с водой происходит реакция:
2Э2O2+2H2O=4ЭOH+O2↑
Взаимодействие Na2O2 с водой сопровождается гидролизом:
Na2O2+2H2O→2NaOH + H2O2+34 ккал
Это интересно:
Взаимодействие Na2O2с двуокисью углерода по схеме
2Na2O2+ 2CO2=2Na2CO3+O2↑+111 ккал
служит основой применения перекиси натрия как источника кислорода в изолирующих противогазах и на подводных лодках. Чистая или содержащая различные добавки (например, хлорной извести с примесью солей Ni или Сu) перекись натрия носит техническое название «оксилит». Смешанные препараты оксилита особенно удобны для получения кислорода, который выделяется ими под действием воды. Спрессованный в кубики оксилит может быть использован для получения равномерного тока кислорода в обычном аппарате для получения газов.
Na2O2+H2O=2NaOH+O0(выделяется атомарный кислород, вследствие распада перекиси водорода).
Надперекись калия (КО2) нередко вводится в состав оксилита. Его взаимодействие с двуокисью углерода идет в этом случае по суммарномууравнению:
Na2O2 + 2KO2 + 2СO2 = Na2 CO3 +K2CO3+ 2O2+ 100 ккал, т. е. двуокись углерода заменяется равным объемом кислорода.
· Способны образовывать озониды. Образование озонида калия-KO3 идёт по уравнению:
4КОН+3O3= 4КO3+ O2+2H2O
Он представляет собой красное кристаллическое вещество и является сильнейшим окислителем. При хранении KO3 медленно распадается по уравнению 2NaO3→2NaO2+O2+11 ккал уже в обычных условиях. Водой он мгновенно разлагается по суммарной схеме 4KO3+2H2O=4KOH+5O2
· Способны реагировать с водородом, с образованием ионных гидридов, по общей схеме:
2Na+H2→2NaH
Взаимодействие водорода с нагретыми щелочными металлами идет медленнее, чем с щелочноземельными. В случае Li требуется нагревание до 700—800 °С, тогда как его аналоги взаимодействуют уже при 350—400 °С. Гидриды щелочных металлов являются очень сильными восстановителями. Окисление их кислородом воздуха в сухом состоянии идет сравнительно медленно, но в присутствии влаги процесс настолько ускоряется, что может привести к самовоспламенению гидрида. Особенно это относится к гидридам К, Rb и Cs. С водой происходит бурная реакция по схеме:
ЭН+ H2O= H2+ЭОН
ЭH+O2→2ЭOH
При взаимодействии NaH или КН с двуокисью углерода образуется соответствующая соль муравьиной кислоты:
NaH+CO2→HCOONa
Способны образовывать комплексы:
NaH+AlCl3→NaAlH4+3NaCl (алланат натрия)
NaAlH4 → NaH+AlH3
NaH+CuO=NaOH+Cu
Нормальные оксиды щелочных металлов (за исключением Li20) могут быть получены только косвенным путем. Они представляют собой твердые вещества следующих цветов:
|
Li20 |
Na20 |
К20 |
Rb20 |
Cs20 |
|
белый |
белый |
белый |
желтый |
оранжевый |
Na2O+2HCl=2NaCl+H2O
Гидроокиси (ЭОН) щелочных металлов представляют собой бесцветные, очень гигроскопичные вещества, разъедающие большинство соприкасающихся с ними материалов. Отсюда их иногда употребляемое в практике название — едкие щелочи. При действии щелочей кожа человеческого тела сильно разбухает и становится скользкой; при более продолжительном действии образуется очень болезненный глубокий ожог. Особенно опасны едкие щелочи для глаз (работать рекомендуется в защитных очках). Попавшую на руки или платье щелочь следует тотчас же смыть водой, затем смочить пораженное место очень разбавленным раствором какой- либо кислоты и вновь промыть водой.
Все они сравнительно легкоплавки и летучи без разложения (кроме отщепляющей воду LiOH).Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизомконцентрированного водного раствора поваренной соли:
2NaCl+2H2O→2NaOH+Cl2↑ +H2↑
Ø Являются типичными основаниями:
NaOH+HCl=NaCl+H2O
2NaOH+CO2=Na2 CO3+H2O
2NaOH+2NO2=NaNO3+NaNO2+H2O
Ø Способны образовывать комплексы:
NaOH+ZnCl2= (ZnOH)Cl+NaCl
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
Al2O3+ 6NaOH= 2Na3 AlO3+3H2O
Al(OH)3+NaOH=Na[Al(OH)4]
Ø Способны реагировать с неметаллами:
Cl2+2KOH=KCl+KClO+H2O(реакция идёт без нагреванием)
Cl2+6KOH=5KCl+KClO3+3H2O (реакция идёт с нагреванием)
3S+6NaOH=2Na2 S+Na2SO3+3H2O
Ø Применяются в органическом синтезе (в частности гидроксид калия и натрия, в примерах указан гидроксид натрия):
NaOH+C2H5Cl=NaCl+C2H4 (метод получения алкенов, этилена (этена) в данном случае), использовался спиртовой раствор гидроксида натрия.
NaOH+C2H5Cl=NaCl+C2H5OH (метод получения спиртов, этанола в данном случае), использовался водный раствор гидроксида натрия.
2NaOH+C2H5Cl=2NaCl+C2H2+H2O (метод получения алкинов, ацетилена (этина) в данном случае), использовался спиртовой раствор гидроксида натрия.
C6H5OH (фенол) +NaOH= C6 H5ONa+H2O
NaOH(+CaO)+CH3COONa→Na2CO3CH4(один из способов получения метана)
Ø Надо знать разложение нескольких солей:
2KNO3→2KNO2+O2
4KClO3→KCl+3KClO4
2KClO3→KCl+3O2
4Na2SO3→Na2S+3Na2SO4
Примечательно то, что разложение нитратов идет примерно в диапазоне 450-600 ℃, далее они плавятся без разложения, но при достижении примерно 1000- 1500 ℃ идет разложение по схеме:
4LiNO2→2Li2O+4NO+O2↑
Это интересно:
K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]+3KCl(качественная реакция на Fe3+)
3K4[Fe(CN)6]+4FeCl3=Fe4[Fe(CN)6]3+12KCl
Na2O2+2H2O=2NaOH+H2O2
4NaO2+2H2O=4NaOH+ 3O2
4NaO3+2H2O=4NaOH+5O2 (реакцияозониданатриясводой)
2NaO3→2NaO2+O2(Распад происходит при различных температурах, например: распад озонида натрия при -10°C, озонида цезия при +100°C)
NaNH2+H2O→ NaOH+NH3↑
Na2NH+2H2O→ 2NaOH+NH3↑
Na3N+3H2O→3NaOH+NH3
KNO2+2Al+KOH+5H2O→2K[Al(OH)4 ]+NH3↑
2NaI + Na2O2 + 2H2SO4→I2↓+ 2Na2SO4 + 2H2O
Fe3O4+4NaH=4NaOH+3Fe
5NaN3+NaNO3→8N2↑+3Na2O
Применение:
Натрием широко пользуются при синтезах органических соединений и отчасти для получения некоторых его производных. В ядерной технике он используется как теплоноситель.
Литий имеет совершенно исключительное значение для термоядерной техники. В резиновой промышленности он используется при выработке искусственного каучука (как катализатор полимеризации), в металлургии — как ценная присадка к некоторым другим металлам и сплавам. Например, присадка лишь сотых долей процента лития сильно повышает твердость алюминия и его сплавов, а присадка 0,4% лития к свинцу почти в три раза повышает его твердость, не ухудшая сопротивления на изгиб. Имеются указания на то, что подобная же присадка цезия сильно улучшает механические свойства магния и предохраняет его от коррозии, однако такое его использование. Гидрид натрия используется иногда в металлургии для выделения редких металлов из их соединений. Его 2%-ный раствор в расплавленном NaOH находит применение для снятия окалины со стальных изделий (после минутного выдерживания в нем горячее изделие погружают в воду, причем восстановившаяся по уравнению
Fe3O4+4NaH = 4NaOH + 3Fe (окалина отпадает).
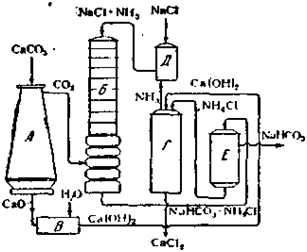
Принципиальная схема заводской установки для получения соды по аммиачному методу (Сольвэ, 1863 г.).
В печи (Л) идет обжиг известняка, причем образующаяся СO2 поступает в карбонизационную башню (Б), а СаО гасится водой (В), после чего Ca(OH)2 перекачивают в смеситель (Г), где она встречается с NH4Cl, при этом выделяется аммиак. Последний поступает в абсорбер (Д)и насыщает там крепкий раствор NaCl, который затем перекачивают в карбонизационную башню, где при взаимодействии с СО2 образуются NaHCO3 и NH4Cl. Первая соль почти полностью осаждается и задерживается на вакуум-фильтре (Е), а вторую вновь перекачивают в смеситель (Г). Таким образом все время расходуются NaCl и известняк, а получаются NaHCO3 и CaCl2(последний — в виде отброса производства). Бикарбонат натрия переводят затем нагреванием в соду.
Автор статьи: Каштанов Артём Денисович
Редактор: Харламова Галина Николаевна
www.teslalab.ru
Использование — щелочной металл — Большая Энциклопедия Нефти и Газа, статья, страница 1
Использование — щелочной металл
Cтраница 1
Использование щелочных металлов как катализаторов в случае гетероароматических соединений вызывает серьезные конкурентные реакции. [1]
Использование щелочных металлов в качестве теплоносителей или рабочих тел в ядерной энергетике началось с конца 50 — х годов. [2]
При использовании щелочных металлов в качестве инициаторов полимеризации углеводородных мономеров было найдено, что скорость инициирования ниже скорости роста цепи. [3]
При использовании щелочных металлов в свободной форме в качестве носителей можно использовать диатомитовую землю ( предварительная обработка которой, осуществляемая при температуре 20 — 120, давлении 1 — Ю мм рт.ст. в течение 2 — 24 часов, значительно улучшает выход), окись кальция, окись алюминия / 118 119 /, В последнем случае процесс приготовления катализатора. [4]
Весьма интересным направлением использования щелочных металлов в качестве возбудителей полимеризации является так называаемая алфиновая полимеризация. Название алфиновые катализаторы происходит от слов алкоголь и олефин. Эти катализаторы содержат два натриевых производных-вторичного алкоголята и олефина. [5]
По той же причине использование щелочных металлов в свободном виде очень ограничено. Наибольшее использование щелочные металлы ( особенно рубидий и цезий) находят для изготовления фотоэлементов, так как под действием света они способны терять свои электроны. [6]
Как уже отмечалось, применение методик, основанных на использовании щелочных металлов, не может быть рекомендовано для получения каталитических растворов для винилирования лактамов в промышленном масштабе. [7]
Инициирование путем переноса электрона от инициатора на мономер происходит при использовании щелочных металлов в слабополярных средах. Например, при полимеризации натрий-бутадиенового каучука полимеризация идет в среде жидкого или газообразного бутадиена. [8]
Помимо диффузии иона щелочного металла в решетку элемента возможна также реакция с поверхности, которая должна была бы привести к увеличению содержания в реакционной смеси продуктов максимальной степени замещения и непрореагировавшего элемента при увеличении степени дисперсности элемента или использовании щелочных металлов в количествах, меньших стехиометрических. [9]
Однако в водных растворах использование щелочных металлов связано с чрезвычайно большими трудностями. В современных вариантах источников тока со щелочными металлами применяют расплавы солей, органические растворители ( апротонные растворители) или твердые электролиты. Наиболее перспективны последние две группы источников тока. [10]
Однако возможность использовать в качестве такового графит, а также успехи, достигнутые в получении высокоплотных графитов и защиты их от окисления и механическою смывания нанесением покрытий из различных материалов, позволяет считать, что для работы в контакте с жидким алюминием в достаточно широком диапазоне изменения температуры имеется хороший конструкционный материал. Следует также иметь в виду, что использование щелочных металлов при температурах выше 1000 С также связано с большими трудностями в выборе конструкционных материалов, так как наиболее часто используемые материалы в этих условиях не применимы. [11]
Подобное воздействие незаменимо, по-видимому, только при подготовке к взаимодействию с адгезивами низкополярных полимеров типа фторопластов. Однако и в этих случаях намечается тенденция к отказу от использования чистых щелочных металлов. Оксиды железа и марганца включаются прежде всего в аморфные области субстрата, приводя к существенному изменению краевых углов смачивания. Модифицированная фаза толщиной до 40 мкм обладает достаточной адгезионной способностью, что позволяет использовать обычные адгезивы для склеивания такого субстрата. [12]
Наиболее активными катализаторами винилирования амино-спиртов при давлении, близком к атмосферному, являются их калиевые алкоголяты. Однако известный метод приготовления каталитического раствора для винилирования растворением металлического калия в аминоспирте, разумеется, не мог быть рекомендован для промышленного применения главным образом из-за высокой взрыво — и пожароопасное операций, связанных с использованием щелочных металлов в больших масштабах. [13]
Хорошая электропроводность щелочных металлов дает возможность использовать для их перекачки и электромагнитные насосы. Поскольку гидравлическое сопротивление пропорционально плотности перекачиваемой жидкости, затраты на перекачку щелочных металлов при прочих равных условиях в 10 — 15 раз меньше, чем на перекачку тяжелых металлов. При равных затратах мощности на перекачку использование щелочных металлов позволяет достичь более высоких скоростей теплоносителя. [14]
Источники тока со щелочными металлами на основе органических растворителей были предложены в результате естественного развития батарей с магниевым отрицательным электродом. С 1962 года внимание исследователей было привлечено к использованию щелочных металлов и, прежде всего, лития в источниках тока с органическими растворителями и с этого времени начинается довольно интенсивная разработка такого рода систем. [15]
Страницы: 1 2
www.ngpedia.ru

 Щелочные металлы способны восстанавливать даже водород. При нагревании взаимодействуют с атомами самого легкого элемента и восстанавливают его до отрицательно заряженного иона H—. В реакции получаются гидриды, например, NaH, KH.
Щелочные металлы способны восстанавливать даже водород. При нагревании взаимодействуют с атомами самого легкого элемента и восстанавливают его до отрицательно заряженного иона H—. В реакции получаются гидриды, например, NaH, KH.